熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷
 一剑起萧郎2022-10-04 11:39:541条回答
一剑起萧郎2022-10-04 11:39:541条回答(1)该燃料电池的化学反应方程式为______;
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______,它来自______.

已提交,审核后显示!提交回复
共1条回复
 renwei321 共回答了19个问题
renwei321 共回答了19个问题 |采纳率89.5%- 解题思路:(1)燃料电池的化学反应方程式为丁烷和氧气反应生成二氧化碳和水的反应;
(2)燃料电池中正极上是氧气得电子发生还原反应;
(3)根据碳守恒和两极上的变化考虑所加入的物质.(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知A必为CO2,负极反应式可表示为CH4+4CO32--8e-=5CO2+2H2O,来自负极反应产物,故答案为:CO2;负极反应产物.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,明确正负极上得失电子的物质是解本题关键,难点是计算丁烷的体积,注意丁烷中碳的平均化合价,为易错点. - 1年前
相关推荐
- 熔融盐燃料电池具有较高的发电效率,因而受到重视。可用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物作电解质,C
熔融盐燃料电池具有较高的发电效率,因而受到重视。可用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物作电解质,CO为阳极燃气,空气与CO 2 的混合气为阴极助燃气,制得650℃下工作的燃料电池。完成有关的电池反应式:
(1)阳极:2CO+2CO 3 2- = 4CO 2 +4e - 。
(2)阴极:__________________。
(3)总的电池反应:___________________。 fjyfl1年前1
fjyfl1年前1 -
 bjboy 共回答了17个问题
bjboy 共回答了17个问题 |采纳率94.1%(2)O 2 +2CO 2 +4e - = 2CO 3 2-
(3)2CO+O 2 = 2CO 21年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另
一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2.则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.正极电极反应是:O2+2CO2+4e-=2CO32-
C.熔融盐中CO32-的物质的量在工作时变小
D.电池工作时,CO32-向正极移动 罗马鲨鱼1年前1
罗马鲨鱼1年前1 -
 一笑而过233 共回答了22个问题
一笑而过233 共回答了22个问题 |采纳率90.9%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.A、该燃料电池中通入CO的一极是负极,通O2和CO2的混合气体的一极是正极,故A错误;
B、该燃料电池中通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,故B正确;
C、正极上的电极反应式为O2+4e-+2CO2═2CO32-,负极上的电极反应式为2CO-4e-+2CO32-═4CO2,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,故C错误;
D、在原电池中,电解质中的阴离子移向负极,故D错误;
故选:B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意电极反应式的正确书写,为易错点.1年前查看全部
- A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
A、B、C、D分别为固体氧化物燃料电池、碱性燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是
( )
A.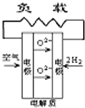
B.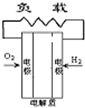
C.
D.
 xjdhappy11年前1
xjdhappy11年前1 -
 wananwa 共回答了23个问题
wananwa 共回答了23个问题 |采纳率91.3%解题思路:原电池中,阳离子向正极移动,正极上得到电子,结合正极的反应产物为水来解答.A.在固体氧化物燃料电池中,正极上O2+4e-=2O2-,故A不选;
B.碱性燃料电池中,正极上发生O2+2H20+4e-=4OH-,故B不选;
C.质子交换膜燃料电池,正极上发生4H++O2+4e-=2H20,故C选;
D.熔融盐燃料电池中,2CO2+O2+4e-=2CO32-,故D不选;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查燃料电池,明确原电池的工作原理是解答本题的关键,注意电解质及电极反应,题目难度不大.1年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2
一种新型熔融盐燃料电池具有高发电效率.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2=2CO2.则下列说法中正确的是( )
A.通CO的一极是正极
B.负极发生的电极反应是:CO+CO32--2e-=2CO2
C.正极发生氧化反应
D.CO32-向正极定向移动 dapao3081年前1
dapao3081年前1 -
 羊皮地图 共回答了18个问题
羊皮地图 共回答了18个问题 |采纳率100%解题思路:该原电池中,负极上CO失电子发生氧化反应,电极反应式为CO+CO32--2e-=2CO2,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-,放电时,阴离子向负极移动,据此分析解答.A.CO失电子发生氧化反应,所以通入CO的电极为负极,故A错误;
B.负极上CO失电子发生氧化反应,电极反应式为CO+CO32--2e-=2CO2,故B正确;
C.正极上得电子发生还原反应,故C错误;
D.放电时,阴离子向负极移动,所以CO32-向负极定向移动,故D错误;
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了化学电源新型电池,该电池使用燃料电池,明确原电池原理即可解答,难点是电极反应式的书写,要结合电解质书写.1年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另
一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2═2CO2.则下列说法中正确的是( )
A.正极电极反应是:O2+2CO2+4e-═2CO32-
B.电池工作时,CO32-向正极移动
C.熔融盐中CO32-的物质的量浓度在工作时增大
D.通CO的一极是电池的正极 草儿101年前1
草儿101年前1 -
 xiaoqu888 共回答了18个问题
xiaoqu888 共回答了18个问题 |采纳率105.6%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.A.该燃料电池中通入CO的一极是负极,通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,故A正确;
B.在原电池中,电解质中的阴离子移向负极,故B错误;
C、正极上的电极反应式为O2+4e-+2CO2═2CO32-,负极上的电极反应式为2CO-4e-+2CO32-═4CO2,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,故C错误;
D、该燃料电池中通入CO的一极是负极,故D错误.
故选:A.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意电极反应式的正确书写,为易错点.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极染气,空气
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极染气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池.
阴极反应式:
阳极反应式:
总反应式: popmili1年前2
popmili1年前2 -
 qq圣 共回答了14个问题
qq圣 共回答了14个问题 |采纳率92.9%阳极反应式:2CO+2CO32--4e-=4CO2
阴极反应式:O2+CO2+4e-=2CO32-
电池总反应式:2CO+O2=2CO21年前查看全部
- 一种新型的熔融盐燃料电池具有高发电效率而备受重视.现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体
一种新型的熔融盐燃料电池具有高发电效率而备受重视.现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气与CO2的混合气体,制得燃料电池.该电池工作时的负极反应式为:______;熔融盐中CO32-的物质的量在工作时______(填“增大“、“减少“、“不变“).
 用户061年前1
用户061年前1 -
 ricskchen 共回答了22个问题
ricskchen 共回答了22个问题 |采纳率100%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-,以此解答该题.通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,正极上的电极反应式为O2+4e-+2CO2═2CO32-,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,
故答案为:2CO-4e-+2CO32-═4CO2;不变.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查燃料电池知识,为高频考点,注意把握电极方程式的书写,为解答该题的关键,学习中注意相关知识的积累,难度不大.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气
熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在6500℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:______.阴极反应式:O2+2CO2+4e-=2CO32-总电池反应式:______. Mangydog1年前1
Mangydog1年前1 -
 心栓 共回答了21个问题
心栓 共回答了21个问题 |采纳率90.5%解题思路:燃料电池中,负极上燃料失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相等条件下,将正负极电极反应式相加即得电池反应式.阳极上CO失电子发生氧化反应,反应式:2CO+2CO32--4e-=4CO2,阴极上氧气失电子和二氧化碳反应生成O2+2CO2+4e-=2CO32-,在得失电子相等条件下,两极反应相加得到总反应:2CO+O2=2CO2,
故答案为:2CO+2CO32--4e-=4CO2;2CO+O2=2CO2.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题以燃料电池为载体考查原电池原理,侧重考查学生书写电极反应式,注意结合电解质书写电极反应式,为学习难点.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷
 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池正极电极反应式为:O2+2CO2+4e-═2CO32-.试回答下列问题:
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池正极电极反应式为:O2+2CO2+4e-═2CO32-.试回答下列问题:
(1)该燃料电池的化学反应方程式为______;
(2)负极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______.
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水.
①写出该电解反应的离子方程式2Cl-+2H2O
Cl2↑+H2↑+2OH-通电 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-通电 .
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.已知参加反应的Cl2和I2的物质的量之比为5:1,且生成两种酸.该反应的化学方程式为______.
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10的体积在标准状况下为______mL. 人追1年前1
人追1年前1 -
 quickshot 共回答了22个问题
quickshot 共回答了22个问题 |采纳率95.5%解题思路:(1)燃料电池的化学反应方程式为丁烷和氧气反应生成二氧化碳和水的反应;
(2)燃料电池中正极上是燃料失电子的氧化反应;
(3)根据碳守恒和两极上的变化考虑所加入的物质;
(4)①电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
②在水溶液里,氯气能将碘氧化生成盐酸和碘酸;
③根据氢氧化钠计算转移电子数,根据串联电池中转移电子数相等计算丁烷的体积.(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)燃料电池中正极上是燃料失电子的氧化反应子,电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O;故答案为:2C4H10+26CO32--52e-=34CO2+10H2O;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知必需通入CO2,故答案为:CO2;
(4))①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-;
②氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=
0.65mol
2×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=
0.65mol
6.5×4×22.4L/mol=560mL,
故答案为:560.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池、电解池的工作原理,明确正负极上得失电子的物质是解本题关键,难点是电子守恒的计算,为易错点.1年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2
一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2=2CO2.则下列说法正确的是( )
A.通CO的一极是电池的正极
B.熔融盐燃料电池中Na+移向电源负极
C.负极发生的电极反应是:CO+CO32--2e-=2CO2
D.正极发生氧化反应 wgs2191年前1
wgs2191年前1 -
 tk70 共回答了13个问题
tk70 共回答了13个问题 |采纳率92.3%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.A、该燃料电池中通入CO的一极是负极,通O2和CO2的混合气体的一极是正极,故A错误;
B、在原电池中,电解质中的阳离子移向正极,即Na+移向电源正极,故B错误;
C、通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,故C正确;
D、通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,故D错误;
故选:C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意电极反应式的正确书写,为易错点.1年前查看全部
- 8.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳
8.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳
8.熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池.请完成有关的 hzhzyhu1年前1
hzhzyhu1年前1 -
 Lyra_2002 共回答了13个问题
Lyra_2002 共回答了13个问题 |采纳率100%阳极反应阳极应该是这样:2CO+2O^2--4e-=4CO2阴极:O2+4e-=2O^2-根据得失电子平衡,又因为是以熔融盐做电解质,所以氧离子可以直接存在,阳极失电子,阴极应该是得到电子.x0d总反应式为:2CO+O2=2CO2,反应条件是Li2CO3和Na2CO3的熔融盐混合物1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极
熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2═2CO2.则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.该电池工作过程中需不断补充CO和O2,CO2可循环利用
C.负极反应式:O2+2CO2+4e-═2CO32-
D.该电池工作过程中有蓝色火焰产生 zbysjds1年前1
zbysjds1年前1 -
 天尽烟 共回答了11个问题
天尽烟 共回答了11个问题 |采纳率90.9%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-.A.该燃料电池中通入CO的一极是负极,负极上失电子发生氧化反应,故A错误;B.燃料电池中需要补充的是燃料和氧化剂,所以该电池工作过程中需不断补充CO和O2,而CO2可循环利用,故B正确;C.负极上的电极反应式为2CO-...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据氢氧燃料电池发生的反应采用知识迁移的方法分析解答,难点是电极反应式的书写,题目难度不大.1年前查看全部
- 工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极
工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质.负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为______.
 等我爱的人1年前1
等我爱的人1年前1 -
 rr独醉48 共回答了13个问题
rr独醉48 共回答了13个问题 |采纳率84.6%解题思路:该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应.该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电极反应式的书写,根据正负极上得失电子结合电解质书写电极反应式,注意该燃料电池中电解质为熔融态的碳酸盐,熔融态电解池中含有碳酸根离子,则正极上生成碳酸根离子,难度中等.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K 2 CO 3 (其中不含O 2- 和
熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K 2 CO 3 (其中不含O 2- 和
HCO 3 - )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C 4 H 10 +26CO 3 2- -52e - → 34CO 2 +10H 2 O。
试回答下列问题
(1)该燃料电池的化学反应方程式为_____________________;
(2)正极电极反应式为___________________________。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是____________,它来自____________________。 烟儿不ii1年前1
烟儿不ii1年前1 -
 小破兜 共回答了16个问题
小破兜 共回答了16个问题 |采纳率93.8%(1)2C 4 H 10 +13O 2 =8CO 2 +10H 2 O
(2)O 2 +2CO 2 +4e - ==2CO 3 2-
(3)CO 2 ;负极反应产物1年前查看全部
- 熔融盐燃料电池甲烷空气熔融盐作电解质的燃料电池,为什么电极反应的书写时碳酸根要参加反映?而总的方程式又没有碳酸根?怎么判
熔融盐燃料电池
甲烷空气熔融盐作电解质的燃料电池,为什么电极反应的书写时碳酸根要参加反映?而总的方程式又没有碳酸根?怎么判断碳酸根参不参加反映? 不安分的年代1年前2
不安分的年代1年前2 -
 huangdawang 共回答了25个问题
huangdawang 共回答了25个问题 |采纳率88%碳酸根参与的是半反应啦.你如果光写一个阳极或阴极反应,你会发现如果没有碳酸根的话,你的氧是没法配平的.在水溶液为介质的电化学里面,一般用水,氢氧根作为携氧的介质,但熔融盐的话,就是碳酸根啦~当你把两个半反应和在一起的时候,碳酸根是可以抵消的,因此,你可以把碳酸根作为催化剂看待.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K 2 CO 3 (其中不含O 2- 和HCO 3 -
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K 2 CO 3 (其中不含O 2- 和HCO 3 - )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C 4 H 10 +26CO 3 2- -52e - ═34CO 2 +10H 2 O.试回答下列问题:
(1)该燃料电池的化学反应方程式为______.
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______.
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水.
①写出该反应的离子方程式______.
②若电解后得到200mL3.25mol/LNaOH溶液,则消耗C 4 H 10 的体积在标准状况下为______mL.
 楚儿11年前1
楚儿11年前1 -
 xinshi66 共回答了23个问题
xinshi66 共回答了23个问题 |采纳率82.6%(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C 4 H 10 +13O 2 =8CO 2 +10H 2 O,故答案为:2C 4 H 10 +13O 2 =8CO 2 +10H 2 O;(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根...1年前查看全部
- 熔融盐燃料的电极反应式熔融盐燃料电池具有高的发电效率,可用Li2CO3H和Na2CO3的熔融盐混合物作电解质,CO为负极
熔融盐燃料的电极反应式
熔融盐燃料电池具有高的发电效率,可用Li2CO3H和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得在650摄氏度下工作的燃料电池.
负极反应式2CO+2CO3^2- -4e-==4CO2
正极反应式________________________总电池反应___________
刚创的号,对不起哈 在一个1年前1
在一个1年前1 -
 黄信 共回答了22个问题
黄信 共回答了22个问题 |采纳率77.3%正极:O2+2CO2+4e-═ 2CO32-
总反应式为:2CO+O2═ 2CO21年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率而备受重视.现有LiCO3和NaCO3的熔融盐混合物作电解质,一极通CO气体,另一极
一种新型熔融盐燃料电池具有高发电效率而备受重视.现有LiCO3和NaCO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650度时工作的燃料电池,其电池总反应是2CO+O2=2CO2,则下列说法正确的是
A.通CO的一极是电池的正极 B.负极电极反应是:O2+2CO2+4e-==2CO3离子
C.熔融盐中CO3离子的物质的量在工作时保持不变
D.正极发生氧化反应 buttypan1年前1
buttypan1年前1 -
 wdbb123 共回答了14个问题
wdbb123 共回答了14个问题 |采纳率85.7%确实问题分类有问题啊,不过题目应该不是很难的说.对于氧化还原反应应该记住“负氧”一词,即负极发生的是氧化反应,那么D就错了,而对于A,可以从反应式中看到C化学价从+2升到了+4,是氧化,因此,通CO的一极是负极,同样可...1年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另
一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2.则下列说法中正确的是( )
A. 通CO的一极是电池的正极
B. 正极电极反应是:O2+2CO2+4e-=2CO32-
C. 熔融盐中CO32-的物质的量在工作时变小
D. 电池工作时,CO32-向正极移动 蓝月弯刀独孤剑1年前1
蓝月弯刀独孤剑1年前1 -
 噬魂听雨楼主 共回答了26个问题
噬魂听雨楼主 共回答了26个问题 |采纳率88.5%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2═2CO32-.A、该燃料电池中通入CO的一极是负极,通O2和CO2的混合气体的一极是正极,故A错误;
B、该燃料电池中通O2和CO2的混合气体的一极是正极,发生的电极反应是:O2+2CO2+4e-═2CO32-,故B正确;
C、正极上的电极反应式为O2+4e-+2CO2═2CO32-,负极上的电极反应式为2CO-4e-+2CO32-═4CO2,总反应式为:2CO+O2═2CO2,熔融盐中CO32-的物质的量浓度不变,故C错误;
D、在原电池中,电解质中的阴离子移向负极,故D错误;
故选:B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,根据燃料电池的工作原理规律来分析解答即可,注意电极反应式的正确书写,为易错点.1年前查看全部
- 熔融盐燃料电池具有较高的发电效率,因而受到重视.
熔融盐燃料电池具有较高的发电效率,因而受到重视.
接上:可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得650度下工作的燃料电池.完成有关的电池反应式:
1.阳极:2CO+2CO3 2-=4CO2+4e-
2.阴极:
3.总的电池反应式: 222233331年前1
222233331年前1 -
 burn一瞬间 共回答了14个问题
burn一瞬间 共回答了14个问题 |采纳率92.9%先考虑总反应方程式:应该为2CO+O2=2CO2;
总反应方程式减阳极得到阴极:O2+2CO2=2CO32--4e-1年前查看全部
- )熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是.
)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.已知负极的电极反应是.
①正极的电极反应是 . 湖南的十三1年前2
湖南的十三1年前2 -
 aoefrank 共回答了9个问题
aoefrank 共回答了9个问题 |采纳率88.9%这个要注意用CO32-代替原来的水、氢氧根离子去配氧原子的个数.
负极:CH4 - 8e- + 4CO32- = 5CO2 + 2H2O
正极:2O2 +4CO2+ 8e- = 4CO32-1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阳极燃气,空气
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:______;
正极反应式:______. liyaling1年前1
liyaling1年前1 -
 quba 共回答了15个问题
quba 共回答了15个问题 |采纳率80%解题思路:该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子,据此分析解答.该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2 CO32-,负极上燃料CO失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO+2CO32--4e-═4CO2,
故答案为:2CO+2CO32--4e-═4CO2;2CO2+O2+4e-=2CO32-.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查化学电源新型电池,侧重考查电极反应式的书写,燃料电池电极反应式的书写是学习难点,燃料电池中,负极上燃料失电子、正极上氧化剂得电子,题目难度中等.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-→34CO2+10H2O.试回答下列问题:
(1)该燃料电池的化学反应方程式为______;
(2)正极电极反应式为______. gg动力1年前1
gg动力1年前1 -
 踪行千里 共回答了22个问题
踪行千里 共回答了22个问题 |采纳率86.4%解题思路:(1)燃料电池的总反应是丁烷和氧气反应生成二氧化碳和水的反应;
(2)燃料电池的正极上是氧气得电子发生还原反应.(1)该电池中,总反应是丁烷和氧气反应生成二氧化碳和水的反应,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-,
故答案为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池中燃料电池的工作原理,明确正负极上得失电子的物质是解本题关键,难度不大.1年前查看全部
- 求老师解答:熔融盐燃料电池具有高
求老师解答:熔融盐燃料电池具有高
熔融盐燃料电池具有高的发电效率,因而受到重视.某燃料电池以熔融的K 2 CO 3 (其中不含O 2- 和
HCO 3 - )为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C 4 H 10 +26CO 3 2- -52e - → 34CO 2 +10H 2 O.
试回答下列问题
(1)该燃料电池的化学反应方程式为_____________________;
(2)正极电极反应式为___________________________.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是____________,它来自____________________. yangzm11年前1
yangzm11年前1 -
 天都华彩 共回答了11个问题
天都华彩 共回答了11个问题 |采纳率90.9%(1)2C 4 H 10 +13O 2 =8CO 2 +10H 2 O
(2)O 2 +2CO 2 +4e - ==2CO 3 2-
(3)CO 2 ;负极反应产物1年前查看全部
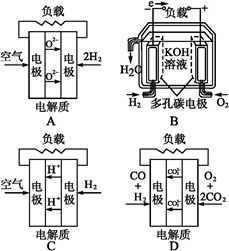
- 有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意
有四种燃料电池:A固体氧化物燃料电池;B碱性氢氧化物燃料电池;C质子交换膜燃料电池;D熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是( )
 我就不信收1年前1
我就不信收1年前1 -
 小猪莎拉 共回答了17个问题
小猪莎拉 共回答了17个问题 |采纳率94.1%C
A项,正极反应生成O 2- ;B项,正极反应生成OH - ;C项,正极反应生成H 2 O;D项,正极反应生成C。1年前查看全部
- 一种新型熔融盐燃料电 一种新型熔融盐燃料电池具有高发电效率.现用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物
一种新型熔融盐燃料电
一种新型熔融盐燃料电池具有高发电效率.现用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物作电解质,一极通CO气体,另一极通O 2 和CO 2 混合气体,其总反应为:2CO+O 2 ==2CO 2 .则下列说法中正确的是 [ ] A.通CO的一极是电池的正极
B.负极发生的电极反应是:O 2 +2CO 2 +4e - ===2CO 3 2-
C.负极发生的电极反应是:CO+CO 3 2- -2e - ===2CO 2
D.正极发生氧化反应 wanzhenglian1年前1
wanzhenglian1年前1 -
 赌坊288号 共回答了10个问题
赌坊288号 共回答了10个问题 |采纳率100%C1年前查看全部
- 一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另
一种新型熔融盐燃料电池具有高发电效率而倍受重视.现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650℃时工作的燃料电池,其电池总反应是2CO+O2=2CO2.则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.负极电极反应是:O2+2CO2+4e-=2CO32-
C.熔融盐中CO32-的物质的量在工作时保持不变
D.电池工作时,CO32-向正极移动 沧原狼1年前1
沧原狼1年前1 -
 jhafda 共回答了25个问题
jhafda 共回答了25个问题 |采纳率96%解题思路:该燃料电池中,负极上CO失电子发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,正极上氧气得电子发生还原反应,电极反应式为O2+2CO2+4e-=2CO32-,放电时,电解质中阳离子向正极移动、阴离子向负极移动,据此分析解答.A.该燃料电池中,通入CO的电极上失电子发生氧化反应,为原电池负极,故A错误;
B.负极上CO失电子发生氧化反应,电极反应式为2CO-4e-+2CO32-═4CO2,故B错误;
C.电池总反应是2CO+O2=2CO2,实际上熔融盐中CO32-不参加反应,则其物质的量在工作时保持不变,故C正确;
D.放电时,CO32-向负极移动,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查原电池原理,燃料电池中负极上燃料失电子发生氧化反应、正极上氧化剂得电子发生还原反应,知道电解质中阴阳离子移动方向,难点是电极反应式的书写.1年前查看全部
- 有关燃料电池熔融盐燃料电池具有高发电效率,可用Li2CO3和Na2CO3的熔融混合物做电解质,CO做燃料,空气和CO2做
有关燃料电池
熔融盐燃料电池具有高发电效率,可用Li2CO3和Na2CO3的熔融混合物做电解质,CO做燃料,空气和CO2做助燃剂,制得在650度下工作的燃料电池.求其电极反应式,电池总反应式. yuanqinghistory1年前2
yuanqinghistory1年前2 -
 ZD爱0 共回答了17个问题
ZD爱0 共回答了17个问题 |采纳率88.2%晕,我打了半天弄丢了,再打一次.楼上貌似错了,熔融CO32-弄丢了.电池为:Pt|CO|Na2CO3,Li2CO3|O2|Pt,负极CO+CO32-=2CO2+2e-,正极1/2O2+CO2+2e-=CO32-,总反应自己加一下.终于打完了,用手机打的…1年前查看全部
- 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁
 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O.试回答下列问题:
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO32--52e-=34CO2+10H2O.试回答下列问题:
(1)该燃料电池的化学反应方程式为______;
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______,它来自______.
(4)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
①写出反应的离子方程式2Cl-+2H2O
Cl2↑+H2↑+2OH-通电 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-通电 .
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化.若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸.该反应的化学方程式为______.
③若电解后得到200mL 3.25mol•L-1 NaOH溶液,则消耗C4H10的体积在标准状况下为______. 变形虫alpha1年前1
变形虫alpha1年前1 -
 年华似铁 共回答了24个问题
年华似铁 共回答了24个问题 |采纳率91.7%解题思路:(1)丁烷和氧气反应生成二氧化碳和水;
(2)正极上氧气得电子发生还原反应;
(3)根据碳守恒和两极上的变化考虑;
(4)①电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
②在水溶液里,氯气能将碘氧化生成盐酸和碘酸;
③根据氢氧化钠计算转移电子数,根据串联电池中转移电子数相等计算丁烷的体积.(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2=8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-或13O2+26CO2+52e-=26CO32-,
故答案为:O2+2CO2+4e-=2CO32-;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知A必为CO2,负极反应式可表示为CH4+4CO32--8e-=5CO2+2H2O,它来源于负极上生成的二氧化碳即可
故答案为:CO2;负极反应产物;
(4)①电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为:2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-;
②阳极附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O═2HIO3+10HCl;
③氢氧化钠的物质的量=3.25mol/L×0.2L=0.65mol,根据2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-知,生成0.65mol氢氧化钠时转移电子的物质的量=[0.65mol/2]×2=0.65mol,串联电池中转移电子数相等,所以丁烷的体积=[0.65mol/6.5×4]×22.4L/mol=0.56L,
故答案为:0.56L.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查氧化还原反应及电解原理的应用,明确电解原理及离子的放电顺序、氧化还原反应的原理,结合元素的化合价变化即可解答,题目难度中等.1年前查看全部
- 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为
 熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
熔融盐燃料电池具有较高的发电效率,因而受到重视.某燃料电池以熔融的K2CO3(其中不含O2-和HCO)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.该燃料电池负极电极反应式为:2C4H10+26CO-52e-═34CO2+10H2O.
试回答下列问题:
(1)该燃料电池的化学反应方程式为______;
(2)正极电极反应式为______.
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此,必须在通入的空气中加入一种物质,加入的物质是______.
(4)某学生想用该燃料电池和如图所示装置电解饱和食盐水:写出反应的离子方程式2Cl-+2H2O
Cl2↑+H2↑+2OH-电解 .2Cl-+2H2O.
Cl2↑+H2↑+2OH-电解 . sword_19851年前1
sword_19851年前1 -
 天使小默 共回答了16个问题
天使小默 共回答了16个问题 |采纳率87.5%解题思路:(1)丁烷和氧气反应生成二氧化碳和水;
(2)正极上氧气得电子发生还原反应;
(3)根据碳守恒和两极上的变化考虑;
(4)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,生成氢气、氯气和氢氧化钠.(1)该电池中,丁烷和氧气反应生成二氧化碳和水,反应方程式为:2C4H10+13O2=8CO2+10H2O,
故答案为:2C4H10+13O2═8CO2+10H2O;
(2)正极上氧气得电子发生还原反应和二氧化碳反应生成碳酸根离子,电极反应式为:O2+2CO2+4e-=2CO32-
故答案为:O2+2CO2+4e-═2CO32-;
(3)由于原电池的负极产物有水生成,所以负极必有CO32-参加反应,同时根据碳守恒可知A必为CO2,负极反应式可表示为CH4+4CO32--8e-=5CO2+2H2O,故答案为:CO2;
(4)电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时还生成氢氧化钠,离子方程式为2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
电解
.
Cl2↑+H2↑+2OH-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,为高频考点,侧重于学生的分析能力的考查,明确正负极上得失电子的物质是解本题关键,注意把握电极方程式的书写,难度中等.1年前查看全部
- 熔融盐燃料电池,可用Li2CO3和NaCl的熔融盐混合物做电解质,
熔融盐燃料电池,可用Li2CO3和NaCl的熔融盐混合物做电解质,
CO为正极燃气,空气与CO2得混合气为负极燃气,制得燃料电池,
完成有关的电池反应时:
正极反应:________________
负极反应:________________
总反应:2CO + O2 ====2CO2
为何答案给的是:
正极2CO + CO32- ==== 4CO2 + 4e-
负极O2 +2CO2 +4e- ====2CO32-
正负极是否搞反了, 野蛮de小魔女1年前2
野蛮de小魔女1年前2 -
 gaoliyang 共回答了9个问题
gaoliyang 共回答了9个问题 |采纳率88.9%正负极搞反了,改正过来即可
燃料电池的一般结构为燃料(负极)|电解质(液态或固态)|氧化剂(正极).1年前查看全部
- 熔融盐燃料电池,正极通入氧气与二氧化碳,负极通入氢气与一氧化碳,负极反应式与总反应式怎么写?
 sanders1年前1
sanders1年前1 -
 谷怀风 共回答了16个问题
谷怀风 共回答了16个问题 |采纳率93.8%燃料电池的总反应为燃烧或者燃烧加上后续变化.
本燃料电池总反应式为2CO + O2 =2CO2
其负极反应为:2CO -4e- + 2CO32- = 4CO2
其正极反应式:O2 + 4e- +2CO2 = 2CO32-
其中第一个式子单独书写时可以化简为:CO-2e- + CO32- = 2CO21年前查看全部
- A,B,C,D分别为固体氧化物燃料电池,碱性燃料电池,质子交换膜燃料电池,熔融盐燃料电池,其中正极的反应产物为水的是
 顽皮少爷1年前1
顽皮少爷1年前1 -
 345059405 共回答了20个问题
345059405 共回答了20个问题 |采纳率70%选C
A中正极为O2+4e==2O2-
B中正极为O2+4e+2H2O==4OH-
C中为O2+4e+4H+==2H2O
D为O2+4e+2CO2==2CO3 2-
高二这一块内容其实并不难,你要把最简单的原电池和电解池原理掌握好,然后遇到提用这些知识来解决即可,一开始可能不太熟悉,多练一练就好了,对了,还要注意电解质,写完基本的以后若能与电解质反应把电解质也加进去,写出最后的产物就好了.不太熟的话可以一步一步写,然后叠加,也可以得到.试试吧1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为负极燃气,空气
熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物做电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池.完成上述有关的电池反应式:
正极反应式:______;
负极反应式:______;
总电池反应式:______. zzliupeng1年前1
zzliupeng1年前1 -
 lihuixing921 共回答了18个问题
lihuixing921 共回答了18个问题 |采纳率100%解题思路:该燃料电池中,负极上CO失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子,在得失电子相同条件下将正负极电极反应式相加即可得电池反应式,据此分析解答.该熔融盐燃料电池中,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2 CO32-,负极上燃料CO失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO+2 CO32--4e-═4CO2,在得失电子相同条件下将正负极电极反应式相加得电池反应式2CO+O2═2CO2,
故答案为:O2+2CO2+4e-═2CO32-;2CO+2 CO32--4e-═4CO2;2CO+O2═2CO2.点评:
本题考点: 化学电源新型电池;电极反应和电池反应方程式.
考点点评: 本题考查化学电源新型电池,侧重考查电极反应式的书写,燃料电池电极反应式的书写是学习难点,燃料电池中,负极上燃料失电子、正极上氧化剂得电子,题目难度中等.1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视。用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物作电解质,一极通
熔融盐燃料电池具有高的发电效率,因而受到重视。用Li 2 CO 3 和Na 2 CO 3 的熔融盐混合物作电解质,一极通CO气体,另一极通O 2 和CO 2 混合气体,可制得在650℃下工作的燃料电池。已知该电池总反应为:2CO+O 2 =2CO 2 。则下列说法中正确的是( )
A.通CO的一极是电池的正极 B.该电池工作过程中需不断补充CO和O 2 ,CO 2 可循环利用 C.负极反应式为:O 2 +2CO 2 +4e - →2CO 3 2 - D.正极反应式为:2CO+2CO 3 2 - →4CO 2 +4e -  universe71年前1
universe71年前1 -
 。。。。。 共回答了20个问题
。。。。。 共回答了20个问题 |采纳率90%B
1年前查看全部
- 熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极
熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2=2CO2.则下列说法中正确的是( )
A.通CO的一极是电池的正极
B.正极反应式为:2CO+2CO32--4e-=4CO2
C.负极反应式为:O2+2CO2+4e-=2CO32-
D.该电池工作过程中需不断补充CO和O2,而CO2可循环利用 原来_爱情那么伤1年前1
原来_爱情那么伤1年前1 -
 babyfat330 共回答了15个问题
babyfat330 共回答了15个问题 |采纳率86.7%解题思路:该燃料电池中,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为2CO-4e-+2CO32-=4CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-.A.该燃料电池中通入CO的一极是负极,负极上失电子发生氧化反应,故A错误;
B.正极上的电极反应式为O2+4e-+2CO2=2CO32-,故B错误;
C.负极上的电极反应式为2CO-4e-+2CO32-=4CO2,故C错误;
D.燃料电池中需要补充的是燃料和氧化剂,所以该电池工作过程中需不断补充CO和O2,而CO2可循环利用,故D正确;
故选D.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池原理,根据氢氧燃料电池来分析解答即可,注意电极反应式的正确书写,为易错点.1年前查看全部
大家在问
- 11、今年、祖父的年龄是小明的年龄6倍;几年后,祖父的年龄将是小明年龄的5倍;又过了几年后,祖父的年龄是小明年龄的4倍;求
- 2I had a pleasant day last month
- 3先化简,再求值 (2ab)(-2ab)+(3ab)(3ab+2),期中a-3,b=2
- 4用几个词来概括尼罗河的特点.
- 5whatever和however在表示“无论怎样”,“无论如何”时有区别吗?
- 6填空:Helen does't feel well today,so I am talking
- 7把6千克苹果平均分成4份,每份是6千克苹果的六分之一,每份苹果重几千克?
- 86点4乘125加36乘12点5等于多少,简便方法
- 9夏,梁衡 ,“轻飞曼舞的蜂蝶不见了,却换来烦人的蝉儿,潜在树叶间一声声地长鸣.”该句中的“潜”如换
- 10甲、乙两人分别从A、B两地同时出发相向而行,两人相遇在距离A地10千米处.相遇后,两人继续前进,分别到达B、A后,立即返
- 11等腰三角形 顶角45度 底边长2米 求腰长 要结果
- 12what makes me a good friends,什么意思
- 13用一根31.4分米的铁丝,围成一个正方形,正方形的边长是多少,如果围成一个圆,圆的直径是多少.
- 14如何在做题时认真自信(我是一个很粗心的人!)
- 15大学文科数学题 求极限
