溴化亚铁&氯气的反应好像有两种可能,最好有化学方程式和解析.
 kampfbinde2022-10-04 11:39:541条回答
kampfbinde2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 graceyang 共回答了15个问题
graceyang 共回答了15个问题 |采纳率93.3%- 氯气有强氧化性,溴化亚铁中,溴离子与亚铁离子均会被氧化.不过,Fe2+的还原性强,先被氧化.
所以,当氯气少量时,只氧化亚铁离子:
6FeBr2 + 3Cl2 = 2FeCl3 + 4FeBr3
当氯气过量时,两者都被氧化:
2FeBr2 + 3Cl2 = 2Br2 + 2FeCl3 - 1年前
相关推荐
- 2,摩尔溴化亚铁溶液加入2.5摩尔氯气 离子方程式
 linyon1年前4
linyon1年前4 -
 fudee1230 共回答了17个问题
fudee1230 共回答了17个问题 |采纳率88.2%4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-1年前查看全部
- 溴化亚铁与氯气1:1反应的化学方程式
 3w331年前2
3w331年前2 -
 eliclee 共回答了26个问题
eliclee 共回答了26个问题 |采纳率80.8%6FeBr2 + 6Cl2 = 2FeBr3 + 4FeCl3 + 3Br21年前查看全部
- 为了得到较纯物质方法正确的是?B.溴化亚铁溶液中加入过量氨水,加热得到氯化铁晶体C,加热蒸发得到了氯化铜饱和溶液纯净的氯
为了得到较纯物质方法正确的是?
B.溴化亚铁溶液中加入过量氨水,加热得到氯化铁晶体
C,加热蒸发得到了氯化铜饱和溶液纯净的氯化铜晶体
这俩都不对,但我不知道原因。
谢谢您了
 玉狐52571年前1
玉狐52571年前1 -
 hsy01 共回答了14个问题
hsy01 共回答了14个问题 |采纳率78.6%B.溴化亚铁溶液中加入过量氨水,加热得到氯化铁晶体得不到氯化铁
C,加热蒸发得到了氯化铜饱和溶液纯净的氯化铜晶体 不是纯的氯化铜1年前查看全部
- 溴化亚铁与氯气反应化学方程式
 乙肝1年前2
乙肝1年前2 -
 cnzhg 共回答了11个问题
cnzhg 共回答了11个问题 |采纳率90.9%Cl2不足时 还原性:(Fe2+)>Br-
3Cl2+6FeBr2=4FeBr3+2FeCl3
Cl2过量 FeBr2 完全反应
2FeBr2 + 3Cl2=2FeCl3 + 2Br2
2Fe2+ + 4Br- + 3Cl2=2Fe3+ +6Cl- + 2Br21年前查看全部
- 向0.005摩尔溴化亚铁中不断通入0.112升氯气反应
 zahh01191年前1
zahh01191年前1 -
 不为人知的米罗 共回答了21个问题
不为人知的米罗 共回答了21个问题 |采纳率95.2%因为亚铁离子还原性比溴离子强(还原性顺序:硫离子,亚硫酸根离子,碘离子,亚铁离子,溴离子,氯离子,锰离子)所以氯气先与亚铁离子反应(0.112L氯气标况下0.005mol)2Fe2+ +Cl2 =2Fe3+ +2Cl-0.005 0.00252Br- +Cl2=Br2 ...1年前查看全部
- (18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(18分)某化学研究小组探究溴化亚铁水溶液与氯气反应。
(1)该小组同学用下图所示装置制取干燥纯净的氯气。
仪器A的名称是________,装置C中的试剂是________,装置F的作用是________;写出制备氯气的离子方程式________。
(2)该小组同学对Cl 2 与FeBr 2 溶液的反应进行实验探究。
【实验过程】
向l00mL0. 1mol 的溶液缓缓通入100 mLCl 2 (标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2 ,溶液黄色加深,变为棕黄色。
的溶液缓缓通入100 mLCl 2 (标准状况),溶液由浅绿色逐渐变黄色;继续通人Cl 2 ,溶液黄色加深,变为棕黄色。
【提出假设】上述现象发生的原因可能是:
假设1:Cl 2 先将Fe 2 + 氧化生成Fe 3 + ,溶液逐渐变黄色,Cl 2 再把Br - 氧化成Br 2 ,溶液变为棕黄色。
假设2:Cl 2 先将Br - 氧化生成Br 2 ,溶液逐渐变黄色,Cl 2 再把Fe 2 + 氧化成Fe 3 + ,溶液变为棕黄色。
【实验方案】
方案甲:设计实验验证由浅绿色逐渐变黄色的原因________(说明实验操作、现象和结论)。
方案乙:设计对比实验验证氧化性顺序
根据实验得出Cl 2 、Fe 3 + 、Br 2 氧化性由强到弱的顺序为________,上述假设合理的是________。
(3)若向含有0.1 molFeBr 2 的溶液中通人0.1molCl 2 充分反应,写出反应的离子方程式:________ 。 心理平衡1年前1
心理平衡1年前1 -
 老芈 共回答了19个问题
老芈 共回答了19个问题 |采纳率89.5%(18分)
(1)分液漏斗(1分) 饱和食盐水(2分)除去尾气中的氯气防止污染空气(2分)
MnO 2 +4H + +2Cl‾ Mn 2+ +Cl 2 ↑+2H 2 O(2分)
Mn 2+ +Cl 2 ↑+2H 2 O(2分)
(2)①取少量上述黄色溶液于试管中,向其中滴加少量KSCN溶液,震荡,若溶液变红色,说明假设1对;否则不成立。(3分)或取少量上述黄色溶液于试管中,向其中滴加少量CCl 4 ,震荡,若CCl 4 层呈现橙红色,说明假设2对,否则不成立。(3分)
②取少量溴化钠溶液于试管中,向其中滴加少量氯水和少量CCl 4 ,震荡静置(2分) Cl 2 > Br 2 >Fe 3+ (2分)
假设1(1分)
(3)2Fe 2+ +2Br‾+2Cl 2 = 2Fe 3+ +Br 2 +4Cl‾(3分)
<>1年前查看全部
- 离子反应式 将1mol氯气通入溶有1mol溴化亚铁的溶液中:⑵向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,
离子反应式 将1mol氯气通入溶有1mol溴化亚铁的溶液中:⑵向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,
在以上中性溶液中,继续滴加Ba(OH)2溶液,
⑶向Ba(OH)2 溶液中逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,
在以上溶液中,继续滴加NaHSO4溶液,
20、⑴在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液呈蓝色,这是因为 (用离子方程式表示).
⑵在⑴所得蓝色溶液中滴加亚硫酸钠(Na2SO3)溶液,发现蓝色逐渐消失,这是因为 (用离子方程式表示)
⑶对比⑴和⑵实验所得的结果,可知 I2、ClO—、SO2-4 的氧化性由强到弱的顺序是:(用离子方程式表示)
21、配平下列化学方程式,并回答下列有关问题.
① Fe3P + HNO3 ——— Fe(NO3)3 + H3PO4+ NO↑+
②上述反应中,若有 21 mol 电子转移时,生成 H3PO4 为 mol,被还原的HNO3 为 g.
③上述反应中,当生成 1.8 mol Fe3+ 时,放出NO的体积(标准状况)为 L,消耗的HNO3 为 mol.
22、Na2SO3中+4价的硫元素既有氧化性又有还原性.现有试剂:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水、稀硝酸.
⑴要证明Na2SO3具有还原性,应选用的试剂是 ,反应的离子方程式为:
⑵要证明Na2SO3具有氧化性,应选用的试剂是 ,反应的离子方程式为
23、NaBH4作为还原剂,在有机化学中有极为广泛的用途:
⑴NaBH4极易溶于水并与水反应产生H2,反应后B元素以BO 的形式存在于溶液中,此反应的离子方程式为:;
⑵该反应与溶液酸碱度有关.pH越小,反应速率越 ,理由是
⑶NaBH4可使许多金属离子还原为金属单质.例如它可以使含有金离子(Au3+)的废液中Au3+还原为Au单质(碱性环境,反应后B仍以BO 存于溶液中).此反应的离子方程式为 .
24、有一包固体粉末,可能含有的离子有K+、 、Fe3+、Na+、Cl-、NO 、S2-、HCO .取试样加蒸馏水全部溶解,溶液呈无色透明,用硝酸酸化,无明显现象.取上述酸化后的溶液分别做以下两个实验:
①先加入Ba(NO3)2溶液,无明显现象,然后加入AgNO3溶液,有白色沉淀产生.
②浓缩后加入铜片、浓硫酸共热,有红棕色气体产生.对试样进行焰色反应,隔着蓝色钴玻璃观察,火焰呈浅紫色
试回答下列问题:
⑴这包粉末中肯定不存在的离子是 ,肯定存在的离子是
⑵写出实验①中有关的离子方程式
实验②中的反应离子方程式
26、强碱性溶液中含有的是 K+、NH 、Al3+、 、 、SiO 、CO 、Cl- 中的某几种,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2 溶液无淀生成.
②另取少量溶液加入盐酸,其现象是:开始一段时间保持原样(无明显现象),然后开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀量逐渐减少至消失.则原溶液中肯定存在的离子是 ,肯定不存在的离子是 .已知原溶液中加入 5mL 0.2mol•L—1盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀 0.187克,则原溶液中是否含有Cl-?请通过计算说明理由.
A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种 A C C D E F G
A - - - - - -↓
B - - - - ↓ ↓ ↓
C - - - ↓ - ↓ ↓
D - - ↓ - ↓ ↓ ↓
E - ↓ - ↓ - ↓ -
F - ↓ ↓ ↓ ↓ - ↓
G ↓ ↓ ↓ ↓ - ↓ -
⑴A的化学式是 G的化学式是.判断理由是
⑵写出下列反应的离子方程式:
C+D C+F→: 深海石斑鱼1年前2
深海石斑鱼1年前2 -
 玉米-MAGGIE 共回答了19个问题
玉米-MAGGIE 共回答了19个问题 |采纳率100%1.向1mol/L的AlCl3溶液10mL中,加入1mol/L的NaOH溶液,得到沉淀0.26g,则加
入的NaOH的体积可能是多少?
A10ml B20ml C30ml D36.7ml
2.向NaCl、NaI的混合溶液通入足量氯气,加热将溶液蒸干,并再灼热片刻得到固体6.46g,球原混合物中NaCl的质量.
3.将一定质量的Mg Zn AL混合物与足量H2SO4反应 生成2.8L(标况) 原混合物质量可能是
A2g
B4g
C8g
D10g
4.测石灰石纯度,取6g样品粉碎后放入烧杯中,加入120g溶质的质量分数为3.65%的盐酸,生成的气体全部放出后,发现尚需20g溶质的质量分数为4%的氢氧化钠溶液去中和多余的盐酸.秋石灰石中碳酸钙的质量分数.
5.测定ABC三种金属的活动性顺序,把这三种金属放到相同浓度的盐酸中,反应速率都较慢,不易分辨三者的反应速率.现在只有盐酸一种化学试剂,应该用什么方法才能迅速测出这三种金属的活动性顺序?
6.向120ml某浓度的硫酸中加入铜片,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500ml,再加入足量的锌粉,使之充分反应收集到标准状况下气体2.24L,过滤残留固体,干燥后称量,质量减轻了7.5g,求原硫酸的物质的量浓度.
7.14克铁粉完全溶于某稀硝酸溶液中恰好完全反应,放出一氧化氮气体,得滤液1升,称得所得溶液比反应前稀硝酸增重8克.求
(1)所得溶液中金属离子的物质的量浓度
(2)某稀硝酸的物质的量浓度(假设反应过程中液体的体积变化忽略不计)
8.(不定项选择)把镁粉中混入的少量的铝粉除去,应选用的试剂是( )
A、盐酸 B、氯水 C、氨水 D、烧碱溶液 E、食盐水
9.有一未知浓度的盐酸25毫升,在加入5摩尔每升硝酸银,还有剩余盐酸,再加入氢氧化钠,用去1摩尔每升,则盐酸的物质量浓度是多少?
10.将质量分数为a%的NaOH溶液蒸发掉mg水后,刚好得到Vml质量分数为2a%的NaOH饱和溶液.求(1)所得NaOH溶液的物质的量的浓度.(2)求该温度下NaOH的溶解度.
11.要将氯化钠的饱和溶液变成不饱和溶液,方法有______、_______.要将氯化钠的不饱和溶液变成饱和溶液,方法有______、______、_______.要将石灰水的饱和溶液变成不饱和溶液,方法有______、______、______.要将石灰水的不饱和溶液变成不饱和溶液,方法有______、______、______.
12.AgI、AgBr为什么可以保存在棕色瓶中?给理由
13.可以吸收大量溴的试剂有哪些?给理由
14.溴水做试剂怎样将下列两组溶液鉴别?
A.汽油、四氯化碳、水 B.汽油、酒精、NaOH溶液
15.向CaCl2、MgBr2、NaI的混合溶液中加Cl2,若溶液中含Br2,则一定不含有的
微粒是
A、I- B、Br- C、Cl- D、Cl2
16.某烧杯中放入12.5g含杂质的石灰石和100g稀盐酸,两者恰好完全反应,称得烧杯中质量减少了4.4g,已知杂质既不与酸反应,也不溶于水.则
(1)石灰石中碳酸钙的质量分数是多少?(2)稀盐酸中溶质的质量分数是多少
(3)生成的氯化钙溶液的溶质质量分数是多少?
17.有一石灰石样品,其中含的杂质不溶于水,不与盐酸发生反应.某学生取2.3g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量如下
(第一次加入5g稀盐酸,剩余物的质量为1.315g .第二次加入5g稀盐酸,剩余物的质量为0.63g.第三次加入5g稀盐酸,剩余物的质量为0.3g.第四次加入5g稀盐酸,剩余物的质量为0.3g.)
求:2.3g石灰石样品中,含碳酸钙的质量为多少克?
18.将14g金属的混合物仍入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是
A.钙和锌 B.镁和铜 C.铝和镁 D.锌和铁
19.把2.1g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量NA2O2固体中,固体质量增加
A2.1g B3.6g C7.2g D无法确定
20.将3.9g镁铝合金,投入到500ml2mol/L中,金属完全溶解,再加入4mol/L的NAOH溶液,若要产生的沉淀最多,加入的这种NAOH溶液的体积是
A125ml B200ml C250ml D560ml
一定要加分!很不容易才找全的.1年前查看全部
- 溴化亚铁与过量氯气反应的化学方程式和离子方程式怎么写?
溴化亚铁与过量氯气反应的化学方程式和离子方程式怎么写?
我手头有一大堆错的了 tangnanxi1年前3
tangnanxi1年前3 -
 超级小菜 共回答了15个问题
超级小菜 共回答了15个问题 |采纳率93.3%化学王子教你
Cl2不足时 还原性:(Fe2+)>Br-
3Cl2+6FeBr2=4FeBr3+2FeCl3
Cl2过量 FeBr2 完全反应
2FeBr2 + 3Cl2=2FeCl3 + 2Br2
2Fe2+ + 4Br- + 3Cl2=2Fe3+ +6Cl- + 2Br2
高一二上课肯定教的1年前查看全部
- 1摩尔氯气和1摩尔溴化亚铁反应的化学方程式
 轻舞M飞扬1年前4
轻舞M飞扬1年前4 -
 浪子爱我 共回答了27个问题
浪子爱我 共回答了27个问题 |采纳率96.3%如果是微量的氯气和溴化亚铁反应就产生溴化亚铁、溴化铁、氯化铁的混合物溶液.
如果是少量的氯气和溴化亚铁反应产生溴化铁和氯化铁的混合物溶液.
如果是大量的氯气和溴化亚铁反应就会产生溴单质溶于水和氯化铁的混合溶液.
看你加入氯气的量了
Cl2不足时 还原性:(Fe2+)>Br-
3Cl2+6FeBr2=4FeBr3+2FeCl3
Cl2过量 FeBr2 完全反应
2FeBr2 + 3Cl2=2FeCl3 + 2Br2
2Fe2+ + 4Br- + 3Cl2=2Fe3+ +6Cl- + 2Br21年前查看全部
- 0.1mol的氯气和50mL,1.5mol/L的溴化亚铁反应,问被氧化的二价铁和溴离子的物质的量之比
 飘岭的枫叶1年前1
飘岭的枫叶1年前1 -
 燕子浪青111 共回答了24个问题
燕子浪青111 共回答了24个问题 |采纳率87.5%二价铁还原性比溴离子强,所以氯气优先与二价铁反应
而依题有氯气与溴化亚铁摩尔比为4比3,所以有
4cl2 + 3Fe2+ + 5Br- = 8cl- + 3Fe3+ + 2.5Br2
被氧化的二价铁和溴离子的物质的量之比为3比5
不好意思我刚高考完,有些知识点生疏了,刚出了错,请见谅,还有哪里不懂?1年前查看全部
- 氯气和溴化亚铁反应生成什么
 ghji01年前0
ghji01年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1mol氯气被溴化亚铁溶液完全吸收,转移的电子总数为多少
 tae812bip0b3b1年前2
tae812bip0b3b1年前2 -
 任天春 共回答了28个问题
任天春 共回答了28个问题 |采纳率85.7%2mol.这只要看氯元素化合价的变化.先是0价最后变为-1价.每个氯原子得到一个电子那么总共有2mol氯原子.转移的电子自然是2mol1年前查看全部
- 溴化亚铁与少量氯气反应的化学方程式是什么,氯气过量呢?
 孤帆江影1年前1
孤帆江影1年前1 -
 52melody 共回答了27个问题
52melody 共回答了27个问题 |采纳率92.6%Cl2少量:
FeBr2+Cl2=FeCl2+Br2
Cl2过量:
2FeBr2+3Cl2=2FeCl3+2Br2
因为Br-的还原性比Fe2+强,所以Cl2会先氧化Br-,再将2价铁氧化为3价.1年前查看全部
- 溴化亚铁溶液中通入少量氯气的化学方程式
 a400137851年前2
a400137851年前2 -
 kevinzwb 共回答了15个问题
kevinzwb 共回答了15个问题 |采纳率93.3%6FeBr2+3Cl2=2FeCl3+4FeBr31年前查看全部
- 当溴化亚铁和氯水反应 氯水足量时,氯水少量时,溴化亚铁与氯水比为1:1时的化学反应方程式(不要离子式)
 KANMENGOU9231年前1
KANMENGOU9231年前1 -
 bw7i4 共回答了9个问题
bw7i4 共回答了9个问题 |采纳率88.9%2FeBr2+3Cl2=2FeCl3+2Br2
6FeBr2+3Cl2=2FeCl3+4FeBr3
6FeBr2+6Cl2=4FeCl3+2FeBr3+3Br21年前查看全部
- 三个高中化学小问题~~谢谢~①AgCl是否溶于硫酸?②溴化亚铁溶液中通入氯气如何反应?是先置换出溴气还是先将亚铁离子氧化
三个高中化学小问题~~谢谢~
①AgCl是否溶于硫酸?
②溴化亚铁溶液中通入氯气如何反应?是先置换出溴气还是先将亚铁离子氧化为三价铁离子?
③酸性最强的酸是否是HF?最稳定的酸是否是HF?
谢谢~~ lszieh861年前5
lszieh861年前5 -
 zhengrui20 共回答了8个问题
zhengrui20 共回答了8个问题 |采纳率100%1,不溶
2,先氧化Fe3+ 、后氧化Br-
3,HF不是最强酸,最强酸是HClO4.
HF在无氧酸中是最稳定的1年前查看全部
- 浅绿色溴化亚铁溶液,通足量氯气,生成黄色液体,加四氯化碳,分层,上层是什么色,加少量碘化钾淀粉溶...
浅绿色溴化亚铁溶液,通足量氯气,生成黄色液体,加四氯化碳,分层,上层是什么色,加少量碘化钾淀粉溶...
浅绿色溴化亚铁溶液,通足量氯气,生成黄色液体,加四氯化碳,分层,上层是什么色,加少量碘化钾淀粉溶液,又变成什么色? 之七1年前1
之七1年前1 -
 八月十六 共回答了15个问题
八月十六 共回答了15个问题 |采纳率86.7%上层为棕红色,Br2,3Cl2+2FeBr2=2Br2+2FeCl3
加碘化钾变为蓝色,2KI+Br2=2KBr+I2,淀粉遇碘变蓝1年前查看全部
- 0.1mol的单质氯气与0.75mol的溴化亚铁溶液反应,则被氧化的亚铁离子和溴离子的物质的量之比为多少?
 寒丝20051年前2
寒丝20051年前2 -
 达一 共回答了15个问题
达一 共回答了15个问题 |采纳率93.3%1、分析:根据还原性强弱:Fe2+ >Br— ,所以将氯气通入溴化亚铁溶液中时,氯气优先与还原性较强的Fe2+ ,只有当Fe2+被全部氧化完之后,才与Br—反应.
2、解析:0.75mol FeBr2中含有0.75mol Fe2+ 、含1.5molBr—
2Fe2+ + Cl2 = 2Fe3+ + 2Cl— 2 Br— + Cl2 = Br2 +2Cl—
2mol 1mol
0.75mol 0.375mol
由于将亚铁全部氧化所需 0.375mol 氯气大于0.1mol ;所以溴离子不可能被氧化.
此题应该将“0.1mol的单质氯气”改为“1mol的单质氯气”:
剩余氯气量为:1mol—0.375mol = 0.625mol
Cl2 + 2 Br— = Br2 +2Cl—
1mol 2mol
0.625mol 1.25mol
所以:被氧化的Fe2+ :被氧化的Br— =0.75:1.25=3:51年前查看全部
- 以下物质是强电解质还是弱电解质硫酸氢钾,碳酸氢钙,亚硫酸氢钠,溴化亚铁,明矾,碳酸氢钾.化学式是什么``
 ztj5161年前4
ztj5161年前4 -
 jssqakfire 共回答了19个问题
jssqakfire 共回答了19个问题 |采纳率100%都是强电解质
Ca(HCO3)2 NaHSO3 FeBr2 KAl(SO4)2*12H2O KHCO31年前查看全部
- 氯水与溴化亚铁反应时过量和不过量离子方程怎么写 是怎么得来的
氯水与溴化亚铁反应时过量和不过量离子方程怎么写 是怎么得来的
老师说少定多变 可我不太理解 教我怎么得来的 思路一步一步来 wizardgbb1年前1
wizardgbb1年前1 -
 grantxiang 共回答了23个问题
grantxiang 共回答了23个问题 |采纳率91.3%高中生不知道要求掌握到什么程度,不过真实的反应应该如下:
1,Fe2+还原性大于Br- 因此氯水先氧化Fe2+,再氧化Br-
2,FeCl3可与Cl-继续反应,形成配合物FeCl4(-)
3,Br2和Cl2 也可以反应生成BrCl
综上,
1,少量Cl2时,
2Fe(2+) + Cl2 + 6Cl(-) = 2FeCl4(-)
2, 当Cl2 完全氧化Fe2+后,继续加入Cl2
2Br(-) +Cl2 = Br2 + 2Cl(-)
3,Br-也被完全氧化后,继续加Cl2
Br2 + Cl2 = 2BrCl
~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~
如果不要求配合物反应的话,可能答案应为
1,少量氯水
2Fe(2+) + Cl2 = 2Fe(3+) + 2Cl(-)
2,所有Fe(2+)被Cl2氧化后,继续加入Cl2
2Br(-)+ Cl2 = Br2 + 2Cl(-)1年前查看全部
- 溴化亚铁溶液与氯气反应的优先问题
溴化亚铁溶液与氯气反应的优先问题
氯气与溴化亚铁反应
A-氯气先和溶液中2价铁离子反应
B-氯气先和溶液中溴离子反应
C-一起反应
请选择 楚林11111年前1
楚林11111年前1 -
 兆东2501 共回答了18个问题
兆东2501 共回答了18个问题 |采纳率94.4%A
如果你不能很好的理解,那么请看:
假设CL2先和BR-反应,生成CL-和BR2
那么溶液中的BR2是否又会和FE2+反应呢?
反应的结果还是CL2和FE2+先反应.这是因为比较氧化性:
CL2>BR2>FE3+>I2
如果这题是CL2和FEI2溶液反应,就先氧化FE2+了1年前查看全部
- 在溴化亚铁和碘化亚铁中通入氯气,可能发生的反应
 不做mm1年前1
不做mm1年前1 -
 修山民 共回答了21个问题
修山民 共回答了21个问题 |采纳率81%向溴化亚铁溶液通入足量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
向溴化亚铁溶液通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
向碘化亚铁溶液通入足量氯气:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
向碘化亚铁溶液通入少量氯气:2I-+Cl2=I2+2Cl-
记着:氧化性由强到弱为:Cl2>Br2>Fe3+>I2
还原性则相反.氧化剂先和还原性强的还原剂反应,在和还原性弱的反应.
所以氯气先和二价铁离子反应再和溴离子反应.
在碘化亚铁中就先和碘离子反应
少量 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
足量2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 6Cl- + 2Br21年前查看全部
- 溴化亚铁溶液与等物质的量的氯气反应的离子方程式 要解析
 xiaotianxia1年前1
xiaotianxia1年前1 -
 quizhige 共回答了21个问题
quizhige 共回答了21个问题 |采纳率85.7%亚铁离子的还原性强于溴离子,故亚铁先被氧化,剩下的氯气再氧化溴离子.故:
2Fe2+ +2Br- +2Cl2 =2Fe3+ +4Cl- +Br21年前查看全部
- 溴化亚铁与足量氯气反应时,是否要完全反应完亚铁离子,在反应溴离子
溴化亚铁与足量氯气反应时,是否要完全反应完亚铁离子,在反应溴离子
如题 深水妖儿1年前3
深水妖儿1年前3 -
 严xx 共回答了19个问题
严xx 共回答了19个问题 |采纳率100%大家都知道 溴会和铁反应生成溴化铁
从这个反应我们可以知道溴可以把亚铁离子变成铁离子
由此 我们假设 氯气是先和溴离子反应 或者是俩离子同时反应 这样的话 就会有溴生成 而溴又会和铁离子反应 生成溴离子和铁离子
所以 不管怎样 得亚铁离子完全反应完后才会有溴的生成1年前查看全部
- 溴化亚铁溶液中加入氯气溴水氯气少量氯气适量氯气过量
 mabocindy1年前1
mabocindy1年前1 -
 yaleikexier 共回答了14个问题
yaleikexier 共回答了14个问题 |采纳率85.7%氯和溴都能氧化亚铁为铁离子,氯氧化能力更强,比溴先反应,后面的自己想,不能全问别人1年前查看全部
- 氯气加溴化亚铁溶液怎么反应?
 Y45111年前5
Y45111年前5 -
 jj爱 共回答了20个问题
jj爱 共回答了20个问题 |采纳率95%2FeBr2+3Cl2=2FeCl3+Br2
因为Fe2+和Br-都能被Cl2氧化失去电子,所以反应就是上面那个样子1年前查看全部
- 往100ml溴化亚铁溶液里缓缓通入2.24L(标况下)氯气,完后有6.4g的溴离子被氧化成溴单质,溴化亚铁溶液的C
 daliucy1年前2
daliucy1年前2 -
 wrnbb 共回答了21个问题
wrnbb 共回答了21个问题 |采纳率85.7%设FeBr2为x mol.
6.4=(0.1*2-x)*80
x=0.12 mol
c=0.12/0.1=1.2 mol/L1年前查看全部
- 往1OOmL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质.原...
往1OOmL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质.原...
往1OOmL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质.原溴化亚铁溶液的物质的量浓度? babygs1年前4
babygs1年前4 -
 水-汪汪 共回答了16个问题
水-汪汪 共回答了16个问题 |采纳率87.5%先知道被氧化的顺序
实现氧化亚铁离子,在氧化溴离子的,设浓度时c mol/l
2.24L,就是0.1 mol的氯气,能得0.2 mol的电子,得失电子数相等
0.1c(1+2*1/3)=0.2
c=1.2mol/l1年前查看全部
- 溴化亚铁与氯水1:1时反应的化学方程式
 一剑走zz1年前1
一剑走zz1年前1 -
 luckyntranslate 共回答了19个问题
luckyntranslate 共回答了19个问题 |采纳率73.7%2FeBr2+3Cl2=2FeCl3 +2Br21年前查看全部
- 溴化亚铁与次氯酸反应的化学方程式?
 wulovefang1年前4
wulovefang1年前4 -
 最后的馒头 共回答了15个问题
最后的馒头 共回答了15个问题 |采纳率93.3%6FeBr2 + 3HClO + 3HCl = 4FeBr3 + 2FeCl3 + 3H2O
需额外加酸进去才能配平.1年前查看全部
- 向含2mol溴化亚铁的溶液中通入标况下33.6l氯气,写出离子方程式
 妖孽真多吖1年前3
妖孽真多吖1年前3 -
 cc西进 共回答了15个问题
cc西进 共回答了15个问题 |采纳率100%先氧化Fe2+,2molFe2+,根据电子守恒需要氯气1mol,然后剩余的0.5mol Cl2氧化1molBr-
所以离子方程式4Fe2+ +2Br- +3Cl2 ==4Fe3+ +Br2 +6Cl-1年前查看全部
- 下列有关离子方程式书写错误的是: A.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:2
下列有关离子方程式书写错误的是:
A.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:2Fe 2 + +4Br - +3Cl 2 =2Fe 3 + +6Cl - +2Br 2 B.向NaOH溶液中滴加同浓度的少量Ca(HCO 3 ) 2 溶液:Ca 2 + + HCO 3 - +OH - =CaCO 3 ↓+H 2 O C.向Ba(OH) 2 溶液中逐滴加入NH 4 HSO 4 溶液至刚好沉淀完全:Ba 2 + +2OH - +H + + SO 4 2 - + NH 4 + =BaSO 4 ↓+ NH 3 ·H 2 O +H 2 O D.向NaHSO 3 溶液中滴入适量NaClO溶液:HSO 3 – + ClO – =SO 4 2– + H + + Cl –  梦想中的净土1年前1
梦想中的净土1年前1 -
 dgfhbtfr 共回答了22个问题
dgfhbtfr 共回答了22个问题 |采纳率100%B
1年前查看全部
- 溴化亚铁与溴反应生成溴化铁的反应方程式
溴化亚铁与溴反应生成溴化铁的反应方程式
如题 奔跑的人19831年前1
奔跑的人19831年前1 -
 shang0104 共回答了15个问题
shang0104 共回答了15个问题 |采纳率100%2FeBr2+Br2=2FeBr31年前查看全部
- 溴化亚铁和氯气反应2FeBr2+3cl2反应的那个,电子怎么转移,就是画一下双线桥
 rockey_du1年前3
rockey_du1年前3 -
 zhaocq2002 共回答了24个问题
zhaocq2002 共回答了24个问题 |采纳率87.5%2FeBr2+3Cl2==2FeCl3+2Br2
只要单线桥,从Cl2到FeBr2,转移电子数:6e-.
假如要双线桥,那么实际上有3个箭头,从溴化亚铁中的铁到氯化铁中的铁,转移2e-;从溴化亚铁中的溴到单质溴,转移电子4e-;从Cl2中的氯到FeCl3中的氯,转移电子6e-.1年前查看全部
- 求离子方程式 溴化亚铁中通入过量cl2 苯酚溶液通入co2 硫酸亚铁铵中加入过量NAOH溶液
 人争4口气1年前2
人争4口气1年前2 -
 grant8028 共回答了17个问题
grant8028 共回答了17个问题 |采纳率88.2%2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
苯酚和CO2不反应,两者溶於水後都是酸.
NH4++Fe2++3OH-=NH3↑+H2O+Fe(OH)2↓1年前查看全部
- 1.溴化亚铁溶液中通入少量氯气/过量氯气/等物质的量的氯气
1.溴化亚铁溶液中通入少量氯气/过量氯气/等物质的量的氯气
2.铁粉与过量稀硝酸反应
3.过量铁粉与稀硝酸反应
4.NH4Cl溶液与稀氢氧化钠溶液反应 199587861年前1
199587861年前1 -
 DELTACHY 共回答了12个问题
DELTACHY 共回答了12个问题 |采纳率83.3%1、
过量 2 Fe2+ + 4 Br- + 3 Cl2 == 2 Fe3+ + 2 Cl-+ 2 Br2
少量 2 Fe2+ + Cl2 == 2 Fe3+ + 2 Cl-
等量 2 Fe2+ +2 Br-+ 2 Cl2 == 2 Fe3+ + Br2 + 4 Cl-
2、Fe + 4 H+ + NO3- = Fe3+ + NO ↑ + 2 H2O
HNO3过量,产物是Fe3+
3、3 Fe + 8 H+ 2 NO3- == 3 Fe2+ + 2 NO↑ + 4 H2O
Fe过量,产物是Fe2+
4、NH4+ + OH- = NH3·H2O(稀溶液不加热只能得到NH3H2O)1年前查看全部
- 现有溴化亚铁溶液,氯水,硫氰化钾溶液,苯等实际,设计试验探究Fe2+和Br-两种离子中哪一种离子还原性更强.
 yrb1121年前1
yrb1121年前1 -
 我也滔滔 共回答了18个问题
我也滔滔 共回答了18个问题 |采纳率88.9%向溴化亚铁溶液中加入1-2滴氯水,震荡.
取少量反应后的溶液,加入KSCN溶液,可以发现溶液变成血红色,说明有Fe3+生成.
向剩余的反应后的溶液中加入苯,充分震荡后静置,可以观察到上层(苯层)颜色仍为无色,说明没有Br2生成.
所以由此可以说明Fe2+的还原性比Br-强.1年前查看全部
- 溴化亚铁与氯气 现象情况是反应装置在制取CL2,然后通入了溴化亚铁,那现象我是按照CL2过量呢还是少量呢?变红棕色还是深
溴化亚铁与氯气 现象
情况是反应装置在制取CL2,然后通入了溴化亚铁,那现象我是按照CL2过量呢还是少量呢?
变红棕色还是深红棕色? st99ygt1年前1
st99ygt1年前1 -
 赵银鞍 共回答了19个问题
赵银鞍 共回答了19个问题 |采纳率94.7%按少量的氯气,先是红棕色,随着反应的进行,氯气逐渐增多,可能会呈深红棕色1年前查看全部
- 为什么溴化亚铁和氯水剂量发生改变它们的离子方程是不同?请从氧化性还原性角度解释,
 大风平地起1年前5
大风平地起1年前5 -
 llbearr12 共回答了20个问题
llbearr12 共回答了20个问题 |采纳率80%解析:还原性大小:Fe2+》Br- 氯水具有氧化性,所以Cl2先与Fe2+反应,反应完后再与Br-作用.
(1)Cl2少量:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
(2)Cl2过量:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ +2Br2+ 6Cl-
(3)Cl2/FeBr2=1:1 :2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ +Br2+ 4Cl-1年前查看全部
- 向溴化亚铁溶液中通入Cl2,直到有一半溴离子被氧化成溴音质
向溴化亚铁溶液中通入Cl2,直到有一半溴离子被氧化成溴音质
向溴化亚铁溶液中通入Cl2,直到有一半溴离子被氧化成溴单质的方程式及离子方程式怎么写?谢 超老的大婶1年前1
超老的大婶1年前1 -
 小猪LING 共回答了22个问题
小猪LING 共回答了22个问题 |采纳率90.9%2CL2+2Fe2+ +2Br-=2Fe3+ +Br2+4cl-
只能写出离子方程式来,因为反应没进行完全
怎么写呀?
首先Cl2+2Fe2+==2Clˉ+2Fe3+
1份CL2消耗2份Fe2+
然后Cl2+2Br-=2CL-+Br2
1份CL2消耗2份Br-
两个方程式加一下,就可以了
且2Br-是2FeBr2中溴离子的一半1年前查看全部
- 下列溶液中,加入溴化亚铁晶体,有两种离子浓度明显减小的是
下列溶液中,加入溴化亚铁晶体,有两种离子浓度明显减小的是
A.k+、OH-、CO3(2-) B.Na+、Ag+、NO3- C.K+、SO4(2-)、S(2-) D.H+、Cu(2+)、NO3- NIECHAO68899891年前4
NIECHAO68899891年前4 -
 想好 共回答了16个问题
想好 共回答了16个问题 |采纳率87.5%A中,
Fe2+与CO3(2-) 双水解,Fe2+ +2OH-==Fe(OH)2(沉淀)
D中H+、NO3-氧化溴离子、亚铁离子,所以浓度减小,
选AD1年前查看全部
- 溴化亚铁溶液与等物质的量的氯气反应的离子方程式
 lbh12011年前3
lbh12011年前3 -
 cra1457 共回答了22个问题
cra1457 共回答了22个问题 |采纳率86.4%关键是先氧化谁、、、 溴与铁反应,生成三价铁,所以,溴 与 二价铁 不共存,不会是先氧化溴离子 ,应该先氧化二价铁,再氧化溴离子
分步反应:
2 Fe2+ + Cl2Br2 + 2Br-
总反应:( 因为是等物质的量的,所以注意铁离子与氯气的物质的量一样,剩下根据电荷守恒,填上相应量的氯离子)
2Fe2+ + 2Br- + 2Cl2 === 2Fe3+ + Br2 + 4Cl-
、、、1年前查看全部
- 将SO2气体通入naclo溶液中;溴化亚铁和少量Cl2 与溴化亚铁和过量Cl2 的离子方程有不同吗?
将SO2气体通入naclo溶液中;溴化亚铁和少量Cl2 与溴化亚铁和过量Cl2 的离子方程有不同吗?
可以说说原理吗,要写离子方程时很多都没见过的 森林骑士1年前2
森林骑士1年前2 -
 momo_skald 共回答了11个问题
momo_skald 共回答了11个问题 |采纳率81.8%SO2+CLO-+H2O==SO4 2- +CL- +2H+(实质是CLO-把SO3 2-氧化了)
2Fe2+ +CL2==2Fe3+ +2Cl-
2Fe2+ +4Br- +3Cl2==2Fe3+ 2Br2 +6Cl-
后面两条要注意两点
1,Fe2+的还原性比Br-的强,所以不足的时候先氧化Fe2+
2.Cl2过量的时候,FeBr2是以这种实行结合的,所以,2份的Fe2+要对应4份的Br-1年前查看全部
- 溴化亚铁溶液滴入少量新制氯水 2Fe2+ + 4Br- + 3Cl2 ==2Fe3+ +2Br2+ 6Cl-为什么不对
 zli_wz1年前6
zli_wz1年前6 -
 帆_雁 共回答了26个问题
帆_雁 共回答了26个问题 |采纳率96.2%因为是少量氯水,只能写亚铁离子被氧化,不能氧化溴离子
你的那个方程式是氯水多的时候的1年前查看全部
- 实验题如图所示,是制取氯气并探究氯气的性质的实验装置.图1中:①氯气发生装置;②溴化亚铁溶液;③15mL 30% KOH
实验题
如图所示,是制取氯气并探究氯气的性质的实验装置.图1中:①氯气发生装置;②溴化亚铁溶液;③15mL 30% KOH溶液,并置于水浴中;④石灰乳;⑤尾气吸收装置.已知:氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:
3Cl2+6OH-
5Cl-+ClO3-+3H2O△ .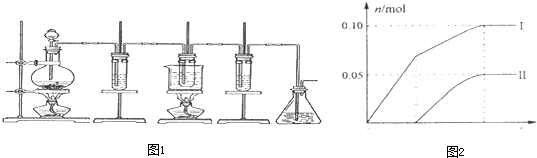
(1)实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有______(填写下列编号字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)通入足量氯气后,②中反应的化学方程式为______,实验结束后,将②中液体与适量CCl4溶液混合,充分静止、振荡,现象为______.
(3)利用③反应后的溶液可制备KClO3晶体,实验过程:溶液→蒸发浓缩→冷却结晶→过滤→洗涤→干燥→氯酸钾晶体.蒸发浓缩时,当______时,应停止加热;洗涤时,如何检验晶体已洗涤干净(请简述操作方法):______.
(4)④的产物中Ca(ClO)2的质量明显小于理论值.为探究产物的组成,另取一定量的石灰乳,缓慢、匀速地通入足量氯气,ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线如图2所示(不考虑氯气和水的反应).则图2中曲线I表示______离子的物质的量随反应时间变化的关系,所取石灰乳中含有Ca(OH)2的物质的量为______mol. qqm_lw1年前1
qqm_lw1年前1 -
 林枫1969 共回答了21个问题
林枫1969 共回答了21个问题 |采纳率90.5%解题思路:(1)除杂试剂的选择方法是:除杂剂和只和杂质反应,且不产生新的杂质,根据氯气和氯化氢的性质选取相应的杂质;
(2)过量氯气和溴化亚铁发生氧化还原反应生成氯化铁和溴;四氯化碳的密度大于水的密度,且不互溶,四氯化碳能萃取溴水中的溴,据此分析解答;
(3)蒸发浓缩时,当出现少量晶体时应该停止加热;检验洗涤干净的方法是:取最后一次洗涤液,加入硝酸酸化的硝酸银,观察是否有沉淀生成判断;
(4)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,根据温度高低来判断属于哪种离子;根据氧化还原反应中得失电子数相等计算氯离子的物质的量,然后根据含氯化合物中钙离子和阴离子的个数比计算氢氧化钙的物质的量.(1)A、氯气和氯化氢都和碱石灰反应,所以不能作除杂剂,故A错误;
B、食盐水中含有氯离子能抑制氯气的溶解,且氯化氢极易溶于水,所以可以使用食盐水除杂,故B正确;
C、浓硫酸和氯化氢不反应,所以不能作除杂剂,故C错误;
D、氯气和氯化氢都能和饱和碳酸氢钠溶液反应,所以不能作除杂剂,故D错误;
故答案为:B;
(2)过量氯气和溴化亚铁发生氧化还原反应生成氯化铁和溴,反应方程式为:3Cl2+2FeBr2=2FeCl3+Br2;四氯化碳的密度大于水的密度,且不互溶,所以混合后能分层,四氯化碳能萃取溴水中的溴,溴在四氯化碳中呈橙红色,所以看到的现象是:分层,上层水层黄色,下层有机层橙红色,
故答案为:3Cl2+2FeBr2=2FeCl3+Br2;分层,上层水层黄色,下层有机层橙红色;
(3)蒸发浓缩时,当出现少量晶体时应该停止加热;检验洗涤干净的方法是:取最后一次洗涤液,加入硝酸酸化的硝酸银,不产生白色沉淀则说明已经洗净,
故答案为:出现少量晶体;取最后一次洗涤液,加入硝酸酸化的硝酸银,不产生白色沉淀则干净;
(4)当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
根据氧化还原反应中得失电子数相等计算氯离子的物质的量,设氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯离子的物质的量=0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol,
故答案为:ClO-;0.25.点评:
本题考点: 探究卤素单质间的置换反应;化学方程式的有关计算;氯气的化学性质.
考点点评: 本题考查了离子的检验、物质的量的有关计算等知识点,难度不大,明确氯气和溴化亚铁反应时溴离子、亚铁离子的先后顺序.1年前查看全部
- 氯气通入溴化亚铁溶液怎么反应有什么现象
 68431141年前2
68431141年前2 -
 nevoi 共回答了12个问题
nevoi 共回答了12个问题 |采纳率91.7%根据还原型亚铁的还原型强于溴离子,那么氯气先与亚铁反应,
CL2+2FE2+=2FE3++2CL-
在与溴反应
CL2+2Br-=Br2+2cl-1年前查看全部
- 氯气通入溴化亚铁溶液先跟什么离子反应?
氯气通入溴化亚铁溶液先跟什么离子反应?
介绍个巧记法,死记我记不住 绿茶壶1年前1
绿茶壶1年前1 -
 stella173173 共回答了13个问题
stella173173 共回答了13个问题 |采纳率84.6%楼上的不胡说行不行?
溴的氧化性比三价铁高,想想如果先和溴离子反应,那溴不还要和二价铁反应吗?
所以先和二价铁反应1年前查看全部
- 下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是__溴化亚铁,氯水__
下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是__溴化亚铁,氯水__
为什么 卓全1年前5
卓全1年前5 -
 patrick1949 共回答了16个问题
patrick1949 共回答了16个问题 |采纳率106.3%当FeBr2与氯水开始反应时,强氧化性的氯水先将亚铁离子氧化成铁离子,
FeBr2+Cl2----->FeCl3+FeBr3
若氯水量较多,则溴离子会被氧化成溴单质.
FeBr3+Cl2----->FeCl3 + Br2
明白了吗?1年前查看全部
- 写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
和食盐水 elaineqian1年前1
elaineqian1年前1 -
 e403 共回答了16个问题
e403 共回答了16个问题 |采纳率81.3%1、 HCO3- + CH3COOH == CH3COO- + H2O + CO2↑
2、 2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 6Cl- + 2Br2
3、 2FeS + 3H2O2 + 6H+ == 2S↓ + 2Fe3+ + 6H2O
4、 2Cl- + 2H2O ==通电== 2OH- + H2↑ + Cl2↑1年前查看全部
大家在问
- 1该从什么角度选择
- 2水发生三态变化,主要是因为由于构成水的( )
- 33+6+7=3+7+6 这道算式运用了什么运算定律? A.加法交换律 B.加法结合律 C.加法交换律
- 4为什么液化气体需要温度降到临界温度以下
- 5She liked the famous painting very much,so she would like to
- 6一扇生门一扇死门,两个门旁边分别站着两个鬼,一个鬼只说真话,另一个鬼只说假话,怎么才能进生门?
- 7盗牛译文急!有盗牛而被拘者,其熟人过而问曰:“汝何事?”答云:“晦气撞出来的.”问:“晦气何能而来?”曰:“适在街上信步
- 81、利用围墙用60米长的篱笆在墙边未出一块长方形场地 若长比宽多15米则长和宽各是多少?面积是多少?
- 9猴子一分钟能摘一个桃子,它去果园五分钟能摘几个桃子?(智力题)
- 10参数方程x=2+sin²θ y=sin^2θ 化为普通方程
- 11数列{an}满足an=p/(pn+1-p)(0
- 12我们物理老师要我们找中考初二物理电学计算题,关于欧姆定律的.
- 13我别无选择只好等待 英文怎么写
- 14我们需要一个健康的饮食习惯(英语翻译)
- 15(2012•昌平区二模)如图,AB是⊙O的直径,CD切⊙O于点D,CA切⊙O于点A,CD交AB的延长线于点E.若AC=3
