求氢氧化镁用碳酸氢铵碳化的反应方程式
 chb5552022-10-04 11:39:543条回答
chb5552022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 qq炮 共回答了19个问题
qq炮 共回答了19个问题 |采纳率89.5%- Mg(OH)2+NH4HCO3=MgCO3+NH3+2H2O
复分解反应原理
再把发生复分解的条件想一下,我想你就明白了 - 1年前
 oO紫Oo之恋 共回答了280个问题
oO紫Oo之恋 共回答了280个问题 |采纳率- Mg(OH)2+NH4HCO3=MgCO3+NH3+2H2O
- 1年前
 caojialing 共回答了1个问题
caojialing 共回答了1个问题 |采纳率- 一种NH↓[4]HCO↓[3]生产碳化工艺,包括浓氨水吸收变换气中二氧化碳产生结晶的NH↓[4]HCO↓[3]悬浮液,再经稠厚器,离心分离而得到成品NH↓[4]HCO↓[3]其特征在于它还包括向浓氨水中通入液氯,通入量为每降低1千克[Fe((CN)↓[6]]↑[4]需3-11千克液氯,控制[Fe(CN)↓[6]]↑[4-]浓度<150毫克/升。
[Fe(CN)↓[6]]↑[4-]*Fe↑... - 1年前
相关推荐
- 氢氧化镁、氢氧化铜是氧化物吗
 hailan12301年前4
hailan12301年前4 -
 十月枯荷 共回答了18个问题
十月枯荷 共回答了18个问题 |采纳率88.9%不是,氧化物是由两种元素组成的化合物,其中一种元素是氧元素的,氢氧化镁、氢氧化铜是由三种元素组成的化合物,所以他们不是氧化物.1年前查看全部
- 氢氧化镁是弱碱,Mg2+水中易水解,但是为什么要到pH=12.4才沉淀?这时OH-也太多了吧.
氢氧化镁是弱碱,Mg2+水中易水解,但是为什么要到pH=12.4才沉淀?这时OH-也太多了吧.
还有就是,如果溶液原pH12.5,氢氧化镁沉淀完全后,溶液呈什么性? 守护北半球1年前1
守护北半球1年前1 -
 亦醉亦痴亦疯 共回答了9个问题
亦醉亦痴亦疯 共回答了9个问题 |采纳率77.8%形成沉淀时与对应离子溶度是根据Mg(OH)2的Ksp 溶度积来确定的
Ksp=1.8×10-11 = cMg2+ x cOH-^2 cOH-=10^-1.6时c Mg2+=2.85x10^-8molL-
说的意思是如果Mg2+的浓度是2.85x10^-8molL-时 ,cOH-的浓度为10^-1.6即PH=12.4
才会出现沉淀.而不是说Mg2+的浓度任意 ,比如Mg的浓度为0.01,那根据溶度积计算PH=9.7就可以形成沉淀
就说的题目溶液依旧碱性而且PH几乎不变
因为Mg2+浓度非常小,即使完全沉淀消耗的OH-也非常少.Mg2+ +2OH-=Mg(OH)2沉淀1年前查看全部
- 氢氧化镁与稀盐酸发生反应是不是离子反应 为什么
 zhangboxiang1年前1
zhangboxiang1年前1 -
 zenz 共回答了26个问题
zenz 共回答了26个问题 |采纳率84.6%是 氢氧化镁与稀盐酸反应可拆成离子式 削去系数为2的一价氯离子 可得:Mg(oH)2+2H离子=Mgcl2+2H2O1年前查看全部
- 人教版高中化学必修2中,氢氧化钠属于强碱,氢氧化镁属于中强碱,氢氧化铝应该怎么填?
 ymsjiayou1年前1
ymsjiayou1年前1 -
 robby_69 共回答了18个问题
robby_69 共回答了18个问题 |采纳率83.3%氢氧化钠属于强碱,氢氧化镁属于中强碱,氢氧化铝是两性氢氧化物,既不是弱酸也不是弱碱,应该填属于两性氢氧化物.1年前查看全部
- 有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠和硝酸钾中的某几种组成
有一包白色粉末,可能由氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠和硝酸钾中的某几种组成
实验如下:
(1)将少量粉末放入足量水中,搅拌、静置、过滤,得白色沉淀和无色滤液.
(2)向所得沉淀中加入足量稀硝酸,沉淀全部溶解,但无气体产生.
(3)向滤液中滴加硝酸银溶液,有白色沉淀生成,加入足量稀硝酸,沉淀不溶解.
试根据以上现象推断该白色粉末中一定含有________;一定没有________;可能含有________(填化学式)
附:请问(1)的化学方程式是什么?
请问(2)的化学方程式又是什么?
请问(3)的化学方程式又是什么?
对于一定没有的物质,理由是什么? 两炮到天亮1年前4
两炮到天亮1年前4 -
 fangfeill 共回答了19个问题
fangfeill 共回答了19个问题 |采纳率100%1、一定含有BaCl2和Mg(OH)2;一定没有Na2CO3、AgCl和Na2SO4;可能含有KNO3.
2、一定没有Na2CO3、AgCl和Na2SO4;
原因:粉末放入水中,有不溶水的沉淀,加入稀硝酸全溶解,说明沉淀中没有BaSO4和AgCl.滤液中加入AgNO3有不溶稀硝酸沉淀生成,说明溶液中有Cl离子,如此说明一定有BaCl2的存在.如果有Na2CO3,水溶时与BaCl2生成BaCO3沉淀,后加稀硝酸时会有气体产生;加入稀硝酸的时候会有气体产生.如果有AgCl,步骤2时加入稀硝酸沉淀不会溶解.如果有Na2SO4会与BaCl2生成BaSO4不溶稀硝酸.1年前查看全部
- 氢氧化镁中混有氢氧化铝,应选用什么试剂除,碳酸钠中混有碳酸氢钠,应选用什么试剂除,并给出离子方程式
 秋风吹过爱1年前3
秋风吹过爱1年前3 -
 一見JQ誤終身 共回答了15个问题
一見JQ誤終身 共回答了15个问题 |采纳率93.3%氢氧化镁中混有氢氧化铝,应选用氢氧化钠来去除;
Al(OH)₃+ OH- ==== AlO₂- + 2H₂O
碳酸钠(固体)中混有碳酸氢钠,应选用加热的方法来去除;
2NaHCO₃==Δ== Na₂CO₃+ CO₂↑+ H₂O1年前查看全部
- 一个简单的离子反应向含偏铝酸钠和氢氧化镁的溶液里滴加盐酸,氢离子先和偏铝酸根反应还是先和氢氧化镁反应?
 yp快乐飘飘1年前1
yp快乐飘飘1年前1 -
 七泉山 共回答了17个问题
七泉山 共回答了17个问题 |采纳率94.1%氢离子先和偏铝酸根反应,因为偏铝酸根是离子,碱性要比氢氧化镁强.1年前查看全部
- 氢氧化镁和氨水的互逆反映Mg(OH)2+2NH4Cl==MgCl2+2NH3•H20 这个反映 反过来怎么解释? 在大学
氢氧化镁和氨水的互逆反映
Mg(OH)2+2NH4Cl==MgCl2+2NH3•H20 这个反映 反过来怎么解释?
在大学里 有把物质按能量等级划分吗? A-wei1年前1
A-wei1年前1 -
 資本gg好 共回答了18个问题
資本gg好 共回答了18个问题 |采纳率88.9%反过来 是中和反应的逆反应 水解 (强酸弱碱盐)
有含能材料的说法 也有高能化合物的说法 但是都没有具体按等级划分1年前查看全部
- 怎么比较碱性强弱?要通法.(比如氢氧化镁和氨水)
 caixiaoyu20041年前2
caixiaoyu20041年前2 -
 五月hh梦 共回答了15个问题
五月hh梦 共回答了15个问题 |采纳率80%一般来说 金属性越强 对应的碱的碱性越强
不过高中阶段 碱性之间的强弱比较要求不高
各种酸的酸性强弱要记住
氨水的碱性大于氢氧化镁1年前查看全部
- 要按顺序.盐酸 硫酸 硝酸 碳酸 氢氧化钠 氢氧化钙 氢氧化钾氢氧化铜 氢氧化铁 氢氧化镁氢氧化钡 氨水氯化钠 氯化钾
要按顺序.
盐酸 硫酸 硝酸 碳酸
氢氧化钠 氢氧化钙 氢氧化钾
氢氧化铜 氢氧化铁 氢氧化镁
氢氧化钡 氨水
氯化钠 氯化钾 氯化钙 氯化镁
氯化亚铁 氯化铁 氯化锌 氯化铜
碳酸钠 碳酸钾 碳酸钙 碳酸镁
硫酸钠 硫酸钾 硫酸钙 硫酸镁
硫酸铝 硫酸锌 硫酸亚铁 硫酸铁 硫酸铜
硝酸钠 硝酸钾 硝酸钙
硝酸镁 硝酸锌 硝酸亚铁 硝酸铁
硝酸铜 硝酸银
氯化铵 碳酸铵 硫酸铵 硝酸铵
碳酸氢铵 sharing1年前3
sharing1年前3 -
 蓝色眼泪1984 共回答了22个问题
蓝色眼泪1984 共回答了22个问题 |采纳率95.5%盐酸 硫酸 硝酸 碳酸 HCl H2SO4 HNO3 H2CO3
氢氧化钠 氢氧化钙 氢氧化钾 NaOH Ca(OH)2 KOH
氢氧化铜 氢氧化铁 氢氧化镁 Cu(OH)2 Fe(OH)3 Mg(OH)2
氢氧化钡 氨水 Ba(OH)2 NH3.H2O
氯化钠 氯化钾 氯化钙 氯化镁 NaCl KCl CaCl2 MgCl2
氯化亚铁 氯化铁 氯化锌 氯化铜 FeCl2 FeCl3 ZnCl2 CuCl2
碳酸钠 碳酸钾 碳酸钙 碳酸镁 Na2CO3 K2CO3 CaCO3 MgCO2
硫酸钠 硫酸钾 硫酸钙 硫酸镁 Na2SO4 K2SO4 CaSO4 MgSO4
硫酸铝 硫酸锌 硫酸亚铁 硫酸铁 硫酸铜 Al2(SO4)3 ZnSO4 FeSO4 Fe2(SO4)3 CuSO4
硝酸钠 硝酸钾 硝酸钙 NaNO3 KNO3 Ca(NO3)2
硝酸镁 硝酸锌 硝酸亚铁 硝酸铁 Mg(NO3)2 Zn(NO3)2 Fe(NO3)2 Fe(NO3)3
硝酸铜 硝酸银 Cu(NO3)2 AgNO3
氯化铵 碳酸铵 硫酸铵 硝酸铵 NH4Cl (NH4)2CO3 (NH4)2SO4 NH4NO3
碳酸氢铵 NH4HCO31年前查看全部
- 氢氧化镁于盐酸反应氢氧化镁与盐酸反应产生的氯化镁是溶液(aq)还是液体(l),
 SPSIC1年前1
SPSIC1年前1 -
 lhgice 共回答了17个问题
lhgice 共回答了17个问题 |采纳率94.1%Mg(OH)2+2HCl=MgCl2+2H2O
是氯化镁是溶液(aq)1年前查看全部
- 碳酸钙、氢氧化镁、氧化镁哪个中和盐酸的能力最强?为什么
 act04391年前1
act04391年前1 -
 晨蓦 共回答了17个问题
晨蓦 共回答了17个问题 |采纳率94.1%相同物质的量的碳酸钙、氢氧化镁、氧化镁中和盐酸的能力一样,但是相同质量的碳酸钙、氢氧化镁、氧化镁中,氧化镁的重和能力越强,因为氧化镁的相对分子质量最小.1年前查看全部
- 现有铁、氧化铁、稀硫酸、氢氧化镁、氢氧化钠溶液、氯化铜溶液六种物质,两两混合能发生的反应有 [ &
现有铁、氧化铁、稀硫酸、氢氧化镁、氢氧化钠溶液、氯化铜溶液六种物质,两两混合能发生的反应有 [ ]A.4个
B.5个
C.6个
D.7个 在线挨砸1年前1
在线挨砸1年前1 -
 lkek 共回答了18个问题
lkek 共回答了18个问题 |采纳率94.4%C1年前查看全部
- NH4Cl饱和溶液时氢氧化镁悬浊液溶解的离子方程式
 jieshiie1年前1
jieshiie1年前1 -
 lucky660 共回答了19个问题
lucky660 共回答了19个问题 |采纳率94.7%2NH4+ + Mg(OH)2==Mg2+ + 2NH3.H2O1年前查看全部
- 直接加热氢氧化镁,得到氧化镁,再电解熔融氧化镁制金属镁,
 静话1年前1
静话1年前1 -
 月亮_深情 共回答了24个问题
月亮_深情 共回答了24个问题 |采纳率91.7%1、第一步,氢氧化镁受热就成氧化镁,正确得不能再正确了.
Mg(OH)2 = MgO + H2O
2、第二步电解熔融的氧化镁就有点强人所难了,只是理论上可以.氧化镁的熔点高得恐怖,达2800度以上,如果真要这样做,那镁的价格可以与黄金比高.
这是理论与现实的差距.1年前查看全部
- 下列六种物质:(1)氢氧化镁、(2)铜、(3)碳酸钡、(4)氧化钠、(5)二氧化硫、(6)硝酸银溶液 其中能跟盐酸反应的
下列六种物质:(1)氢氧化镁、(2)铜、(3)碳酸钡、(4)氧化钠、(5)二氧化硫、(6)硝酸银溶液 其中能跟盐酸反应的是?写出方程式.
其实我想知道为什么1346可以反应 而25 却不可以呢? 大脚妞妞1年前3
大脚妞妞1年前3 -
 bucetk 共回答了18个问题
bucetk 共回答了18个问题 |采纳率94.4%Mg(OH)2 + 2HCl=MgCl2+2H2O
Cu+HCl-----不反应,因为Cu没有H活泼.
BaCO3+2HCl=BaCl2 + CO2(^)+H2O
Na2O+2HCl=2NaCl+H2O
SO2+HCl -----不反应,因为SO2是酸性氧化物,不与酸HCl反应.
AgNO3 + HCl=AgCl(沉淀)+HNO31年前查看全部
- 氯化铁 氢氧化镁 相互反应不反映
氯化铁 氢氧化镁 相互反应不反映
能不能来个有水平的 不要来那么多初中的 绮丽天空1年前5
绮丽天空1年前5 -
 未激活260 共回答了16个问题
未激活260 共回答了16个问题 |采纳率93.8%Mg(oh)2是沉淀不反应!1年前查看全部
- 用化学方程式回答下列问题:(1)胃酸(盐酸)分泌过多的病人服用含氢氧化镁的药物.______;(2)工厂烧煤的烟囱里冒出
用化学方程式回答下列问题:
(1)胃酸(盐酸)分泌过多的病人服用含氢氧化镁的药物.______;
(2)工厂烧煤的烟囱里冒出的烟气中含有SO2,常污染环境,为什么可以用氢氧化钠溶液来吸收该气体?______;
(3)用石灰乳(氢氧化钙的悬浊液)与硫酸铜溶液混合,可以配制防治葡萄等作物病害的波尔多液.请你写出在配制过程中发生的化学反应方程式:______.
(4)用稀盐酸除去铁制品表面的铁锈的原理.______. dnawen1年前1
dnawen1年前1 -
 花所求 共回答了11个问题
花所求 共回答了11个问题 |采纳率90.9%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)氢氧化镁与盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.
(2)二氧化硫能与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O.
(3)氢氧化钙与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钙,反应的化学方程式为:Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4.
(4)铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁和水,反应的化学方程式是为:Fe2O3+6HCl=2FeCl3+3H2O.
故答案为:(1)Mg(OH)2+2HCl=MgCl2+2H2O;(2)SO2+2NaOH═Na2SO3+H2O;(3)Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4;(4)Fe2O3+6HCl=2FeCl3+3H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 氢氧化镁与盐酸反应生成氯化镁的化学方程式
 ggnte1年前3
ggnte1年前3 -
 jadqui 共回答了17个问题
jadqui 共回答了17个问题 |采纳率23.5%1年前查看全部
- 现有镁.氧化镁,氢氧化镁.碳酸镁共6克,与100克百分之7.3的稀盐酸恰好完全反应
现有镁.氧化镁,氢氧化镁.碳酸镁共6克,与100克百分之7.3的稀盐酸恰好完全反应
则生成的氯化镁的质量是 乐安消防1年前2
乐安消防1年前2 -
 帮您的孩子成才 共回答了27个问题
帮您的孩子成才 共回答了27个问题 |采纳率96.3%不管是镁,氯化镁还是碳酸镁,最后都要变为氯化镁,
Mg+2HCl==MgCl2+H2↑
MgO+2HCl==MgCl2+H2O
MgCO3+2HCl==MgCl2+H2O+CO2↑
2HCl----MgCl2
73------95
7.3g----
所以氯化镁的质量为9.5g1年前查看全部
- 由镁制氢氧化镁分两步,原料随便选
 悠悠12345661年前3
悠悠12345661年前3 -
 foxgod 共回答了14个问题
foxgod 共回答了14个问题 |采纳率100%原料:镁,稀盐酸,氢氧化钠.
Mg+2HCl==MgCl2+H2(气体)
MgCl2+2NaOH==Mg(OH)2(沉淀)+2NaCl1年前查看全部
- 铁壶中的水垢成份为碳酸钙和氢氧化镁,用稀盐酸除垢为什么不可以多加?请给出方程式
 BBT_咖啡豆1年前7
BBT_咖啡豆1年前7 -
 xixicheng 共回答了23个问题
xixicheng 共回答了23个问题 |采纳率95.7%CaCO3+2HCl=CaCO3+H2O+CO2↑
Mg(OH)2+2HCl=MgCl2+2H20
2Fe+2HCl=FeCl2+H2↑
盐酸多了会腐蚀铁,肯定不能加多1年前查看全部
- 水垢里面的氢氧化镁不会变成氧化镁吗
水垢里面的氢氧化镁不会变成氧化镁吗
碳酸氢镁分解成碳酸镁、二氧化碳和水,长时间煮沸,碳酸镁水解,部分或全部转化成氢氧化镁,但是,氢氧化镁不会变成氧化镁吗?难溶性碱受热分解啊. 洛杉矶突击者1年前4
洛杉矶突击者1年前4 -
 dellplay 共回答了17个问题
dellplay 共回答了17个问题 |采纳率82.4%氢氧化镁在受热时达到340摄氏度以上时才开始发生分解.
所以此时氢氧化镁不会变成氧化镁.1年前查看全部
- (2006•杨浦区二模) 物质名称 碳酸 氢氧化镁 氯化铜 化学式 SO2 CuSO4•5H2O
(2006•杨浦区二模)
物质名称 碳酸 氢氧化镁 氯化铜 化学式 SO2 CuSO4•5H2O  言吾堂堂主1年前1
言吾堂堂主1年前1 -
 brokenman 共回答了16个问题
brokenman 共回答了16个问题 |采纳率87.5%解题思路:根据化合价原则书写化学式,根据物质命名原则给物质命名.碳酸由氢离子和碳酸根离子组成,氢离子显+1价,碳酸根离子显-2价,根据化合价原则,其化学式可表示为:H2CO3;
由两种元素构成的化合物读作某化某,有时读出元素符号右下角的数字,故SO2读作二氧化硫;
氢氧化镁由显+2价的镁元素和显-1价的氢氧根组成,根据化合价原则,其化学式为:Mg(OH)2;
CuSO4•5H2O是带着5个结晶水的硫酸铜,故读作五水硫酸铜;
氯化铜由显+2价的铜元素和显-1价的氯元素组成,根据化合价原则,其化学式可表示为:CuCl2;
故答案为:
二氧化硫 五水硫酸铜
H2CO3 Mg(OH)2 CuCl2点评:
本题考点: 化学式的书写及意义.
考点点评: 明确化学式的书写方法及物质组成是解答本题关健.1年前查看全部
- 加入铝粉产生氢气的溶液 na+ so42- mg2+ no3-为什么不对 mg2+不是水解成氢氧化镁沉淀溶液显酸性吗?
 艾岛1年前2
艾岛1年前2 -
 lissicat 共回答了20个问题
lissicat 共回答了20个问题 |采纳率75%加入铝粉产生氢气的溶液含有大量的H+或大量的OH-.
如果含有大量的H+,HNO3与Al反应不会生成H2,生成的是氮氧化物,不能共存.
如果有大量的OH-,OH-会与Mg2+生成Mg(OH)2,不能共存.
所以不能共存.1年前查看全部
- 计算样品纯度和反应转化率,取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897m
计算样品纯度和反应转化率,
取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897mol/L.用移液管移取样品溶液25ml于250ml锥形瓶中,加指示剂然后用EDTA滴定,EDTA消耗6.3ml(EDTA于氢氧化镁1:1反应,EDTA浓度为0.01965mol/L)求氢氧化镁样品纯度和反应转化率 yuchenvv1年前1
yuchenvv1年前1 -
 moye2004 共回答了23个问题
moye2004 共回答了23个问题 |采纳率91.3%笨算也算出来了:Mg :EDTA24.31 1X 0.01965*6.3 X=24.31*0.01965*6.3/100025:X = 250:YY=X*250/25=X/(25/250)Mg :Mg(OH)224.31 58.33Y Z Z=58.33/24.31*Y=X/(25/250)*58.33/24.31=10*58.33/24.31*24.31*0.0196...1年前查看全部
- 有一包白色粉末,可能是碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种的混合物,现做如下实验:
有一包白色粉末,可能是碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种的混合物,现做如下实验:
(1)将少量粉末放在烧杯中,加足量水、搅拌、静置、过滤,得无色溶液及白色沉淀;
(2)向过滤所得沉淀中,加足量稀硝酸,沉淀全部溶解,无气体产生.
(3)向滤液中滴加硝酸银溶液,立即有较多的白色沉淀生成,再加稀硝酸,沉淀不溶解.
根据以上实验现象推断,白色粉末中一定存在______;一定不存在______;可能存在______. 1840641年前4
1840641年前4 -
 arque 共回答了19个问题
arque 共回答了19个问题 |采纳率84.2%解题思路:推断题是初中化学试题中常见但却十分重要的一类题型.解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,即重要的现象特征、反应特征及结构特征等,导出结论.本题的突破口:①白色沉淀和无色滤液;②白色沉淀中加入稀硝酸,沉淀全部溶解,无气体产生;③加入硝酸银溶液,生成白色沉淀,加稀硝酸,沉淀不消失.(1)将少量粉末放在烧杯中,加足量水、搅拌、静置、过滤,得白色沉淀和无色滤液,则白色沉淀可能为氢氧化镁、碳酸钡、硫酸钡中的一种或几种.
(2)向过滤所得沉淀中,加足量稀硝酸,沉淀全部溶解,无气体产生.说明沉淀不是硫酸钡和碳酸钡,那么就是氢氧化镁.因为碳酸钡与硝酸反应生成二氧化碳气体,而硫酸钡不与硝酸反应.故溶液中一定含有氢氧化镁;
(3)向滤液中滴加硝酸银溶液,立即有较多的白色沉淀生成,再加稀硝酸,沉淀不溶解.加入硝酸银溶液,生成白色沉淀,加稀硝酸,沉淀不消失:则沉淀为氯化银;而氯离子来自氯化钡,故溶液中一定含有氯化钡,一定不含碳酸钠和硫酸钠,因为碳酸钠和硫酸钠能和氯化钡反应生成碳酸钡沉淀和硫酸钡沉淀,不符合第二步的实验现象.溶液中是否含有硝酸钠对反应现象没有影响.
故答为:氢氧化镁、氯化钡;碳酸钠、硫酸钠;硝酸钠点评:
本题考点: 酸、碱、盐的鉴别;反应现象和本质的联系.
考点点评: 解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口,导出结论,最后把结论代入原题中验证.1年前查看全部
- 某抗酸药每片含碳酸钙0.56g,氢氧化镁0.174g,每片该药可中和多少毫升物质的量浓度为0.1mol/L的盐酸?[式量
某抗酸药每片含碳酸钙0.56g,氢氧化镁0.174g,每片该药可中和多少毫升物质的量浓度为0.1mol/L的盐酸?[式量CaCO3100Mg(OH)2 58].
 啊排1年前1
啊排1年前1 -
 sbnana 共回答了19个问题
sbnana 共回答了19个问题 |采纳率94.7%解题思路:根据碳酸钙、氢氧化钠的质量计算出二者的物质的量,然后根据反应关系式:CaCO3~2HCl、Mg(OH)2~2HCl计算出各自消耗的氯化氢的物质的量,最后根据V=[n/c]计算出需要0.1mol/L的盐酸的体积.抗酸药每片含碳酸钙0.56g,碳酸钙的物质的量为:n(CaCO3)=[0.56g/100g/mol]=0.0056mol,根据反应的关系式:CaCO3~2HCl,碳酸钙消耗的氯化氢的物质的量为:n(HCl)=2n(CaCO3)=0.0056mol×2=0.0112mol,
抗酸药每片含氢氧化镁0.174g,氢氧化镁的物质的量为:n( Mg(OH)2)=[0.174g/58g/mol]=0.003mol,根据反应的关系式:Mg(OH)2~2HCl,消耗的氯化氢的物质的量为:n(HCl)=2n(Mg(OH)2)=0.003mol×2=0.006mol,
每片该抗酸药中含有的碳酸钙、氢氧化镁消耗的氯化氢的总物质的量为:0.0112mol+0.006mol=0.0172mol,
每片该药可中和0.1mol/L的盐酸的体积为:[0.0172mol/0.1mol/L]=0.172L=172mL,
答:每片该药可中和172毫升物质的量浓度为0.1mol/L的盐酸.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了物质的量浓度的计算,题目难度中等,关键是掌握物质的量浓度的计算公式及碳酸钙、碳酸镁与氯化氢的反应关系,试题贴近高考,针对性强,有利于激发学生的学习兴趣和学习积极性.1年前查看全部
- 2.氢氧化镁在水中存在下列平衡:Mg(OH)ot;2(固)≈ Mg2+ + 2OH- ,加入下列物质可使Mg(OH)
2.氢氧化镁在水中存在下列平衡:Mg(OH)¬2(固)≈ Mg2+ + 2OH- ,加入下列物质可使Mg(OH)2固体减少的是(C )
A.碳酸钠 B.硫酸镁
C.硝酸铵 D.氢氧化钠 error951年前1
error951年前1 -
 红衣教 共回答了15个问题
红衣教 共回答了15个问题 |采纳率93.3%因为NH4NO3溶于水后产生(NH4)+,和OH-结合,使平衡右移.增加溶解.1年前查看全部
- 暖水瓶胆的内壁上长有沉积的水垢,主要成分是碳酸钙和氢氧化镁,需要用稀盐酸将他们除掉.写出反应的化学方
 6hso6d11年前3
6hso6d11年前3 -
 孤独-滚开 共回答了19个问题
孤独-滚开 共回答了19个问题 |采纳率94.7%CaCO3+2HCl=CaCl2+H2O+CO2(气体)
Mg(OH)2+2HCl=MgCl2+2H2O1年前查看全部
- 氢氧化镁和稀盐酸反应的离子方程式呢?
 eriuwqefewwe1年前3
eriuwqefewwe1年前3 -
 meng149129 共回答了16个问题
meng149129 共回答了16个问题 |采纳率100%Mg(OH)2+2H+=(Mg2+)+2H2O1年前查看全部
- 用于制肥皂的碱选项有a.烧碱b.氢氧化镁乳剂c.氢氧化铝d.熟石灰e.尼古丁f.氨水
 人力三轮1年前3
人力三轮1年前3 -
 山东大地 共回答了18个问题
山东大地 共回答了18个问题 |采纳率88.9%a.烧碱
肥皂就是用脂肪酸和烧碱(氢氧化钠)共煮,水解为高级脂肪酸钠和甘油,前者经加工成型后就是肥皂.1年前查看全部
- 热水瓶胆的壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁),可以加入适量的盐酸把它除掉.去水垢的原理是什么?有关的化学式是什
热水瓶胆的壁上沉积的水垢(主要成分是碳酸钙和氢氧化镁),可以加入适量的盐酸把它除掉.去水垢的原理是什么?有关的化学式是什么?
 冷鎽1年前2
冷鎽1年前2 -
 本分的狐狸 共回答了28个问题
本分的狐狸 共回答了28个问题 |采纳率85.7%酸与盐反应.CaCO3+2HCL=CaCO3+CO2+H2O Mg(OH)2+2HCL=2H2O+MgCL21年前查看全部
- 有一包白色粉末,可能是氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种的混合物,现做如下实验:
有一包白色粉末,可能是氯化银、碳酸钠、氢氧化镁、氯化钡、硫酸钠、硝酸钠中的一种或几种的混合物,现做如下实验:
①将少量粉末放在烧杯中,加足量水,搅拌、静置、过滤,得无色溶液及白色沉淀;②向过滤所得沉淀中加足量稀硝酸,沉淀全部溶解且无气体产生;③向滤液中滴加硝酸银溶液,有白色沉淀生成再加稀硝酸,沉淀不溶解.根据以上实验现象推断,白色粉末中一定存在______;一定不存在______;可能存在______. parawain1年前1
parawain1年前1 -
 douyacaixu 共回答了19个问题
douyacaixu 共回答了19个问题 |采纳率94.7%解题思路:根据氯化银、硫酸钡不溶于水和酸,氢氧化镁不溶于水,会溶于酸,碳酸钡不溶于水,会溶于酸进行产生气体分析.少量粉末放在烧杯中,加足量水,搅拌、静置、过滤,得无色溶液及白色沉淀,白色沉淀全部溶于硝酸且无气体产生,可以确定一定含有氢氧化镁,可以确定不含氯化银,可以确定氯化钡和硫酸钠、氯化钡和碳酸钠不会同时存在.滤液中滴加硝酸银溶液,有白色沉淀生成再加稀硝酸,沉淀不溶解.可以确定溶液中存在氯化钡,存在氯化钡,根据②知道沉淀全部溶解且无气体产生,就不存在碳酸钠和硫酸钠,存在氢氧化镁,至于硝酸钠的存在与否对实验现象都不会造成影响.
故答案为:一定存在:氢氧化镁、氯化钡,一定不存在:氯化银、碳酸钠、硫酸钠,可能存在:硝酸钠.点评:
本题考点: 常见离子的检验方法及现象;物质的鉴别、推断.
考点点评: 在解此类题时,首先要对混合物中的各种物质有个全面的认识,然后根据题中的现象进行逐一的排除验证,
不溶于酸的沉淀有:氯化银、硫酸钡.1年前查看全部
- 水垢中的氢氧化镁是怎么产生的
 a5206201年前1
a5206201年前1 -
 梦想女孩 共回答了18个问题
梦想女孩 共回答了18个问题 |采纳率100%水垢的主要成分是碳酸钙和氢氧化镁,碳酸钙是由于溶解在水里的碳酸氢钙受热分解产生的,溶解在水里的碳酸氢镁受热分解产生碳酸镁,碳酸镁水解使氢氧根离子的浓度大于氢离子浓度,镁离子与氢氧根结合成的氢氧化镁容度积比碳酸镁的容度积小,故碳酸镁转化成了氢氧化镁.1年前查看全部
- 为什么在水垢中镁主要以氢氧化镁沉淀形式存在,而不是以碳酸镁沉淀的形式存在,用浓度积解释,
 iacquelin1年前2
iacquelin1年前2 -
 po360953146 共回答了19个问题
po360953146 共回答了19个问题 |采纳率94.7%论沉淀,已知碳酸镁是微溶于水的,Mg(OH)2的浓度积远小于MgCO3,所以Mg(OH)2的沉淀形式更稳定,不容易被水分子水合电离1年前查看全部
- 氢氧化镁的离子方程式
 waasm16681年前1
waasm16681年前1 -
 绝世霉女 共回答了17个问题
绝世霉女 共回答了17个问题 |采纳率94.1%你的意思是Mg(OH)2的电子式?1年前查看全部
- 硫酸铜和氧化镁反应吗?氢氧化镁和硫酸铜呢?
 rensilong1年前1
rensilong1年前1 -
 让自己快乐起来 共回答了19个问题
让自己快乐起来 共回答了19个问题 |采纳率84.2%硫酸铜与氧化镁不反应.
氢氧化镁与硫酸铜反应会生成氢氧化铜沉淀,因为氢氧化铜的溶解度比氢氧化镁的溶解度小得多,所以氢氧化镁会转化成更难溶的氢氧化铜.1年前查看全部
- 氢氧化镁悬浊液中加入氯化铵溶液,氢氧化镁怎么能够溶解?
氢氧化镁悬浊液中加入氯化铵溶液,氢氧化镁怎么能够溶解?
水解不是微量的么?怎么还能溶解氢氧化镁?
我记得还有个实验是说,像氯化钡溶液中通入二氧化硫,也不出沉淀,原因就是水解太微弱了.
那同理,这种情况下怎么氢氧化镁就溶了呢? 几句闲话1年前3
几句闲话1年前3 -
 liaolaimin 共回答了17个问题
liaolaimin 共回答了17个问题 |采纳率100%1.BaCl2通入SO2不能反应是因为弱酸不能制取强酸:BaCl2+H2SO3不反应.
2.Mg(OH)2和NH4Cl反应不是因为NH4+水解使得溶液呈酸性,发生酸碱中和,而是Mg(OH)2是中强碱,可以制取弱碱NH3·H2O.你可以理解成NH4+水解的酸性要大於Mg2+水解的酸性,因此强酸NH4+可以制取弱酸Mg2+1年前查看全部
- 碳酸镁受热水解生成氢氧化镁为什么碳酸镁微溶于水受热就能生成更难溶于水的氢氧化镁
 机车女孩1年前2
机车女孩1年前2 -
 为什么那么爱** 共回答了18个问题
为什么那么爱** 共回答了18个问题 |采纳率88.9%碳酸镁的溶解可以看做是可逆反应,镁离子和碳酸根为生成物,碳酸根水解产生氢氧根,氢氧化镁溶度积小,生成物浓度降低平衡右移,碳酸镁不断转化为氢氧化镁1年前查看全部
- 1.在初中阶段的溶解性表里不溶物生成的沉淀分别是什么颜色呢?有氢氧化镁,氢氧化铝,氢氧化锰,氢氧化锌,氢氧化亚铁,氢氧化
1.在初中阶段的溶解性表里不溶物生成的沉淀分别是什么颜色呢?有氢氧化镁,氢氧化铝,氢氧化锰,氢氧化锌,氢氧化亚铁,氢氧化铁,氢氧化铜,氯化银,硫酸钡,碳酸钡,碳酸钙,碳酸锰,碳酸锌,碳酸亚铁,碳酸银.这些帮我分类归纳一下好吗?
2.可溶于水的盐溶于水后一般呈中性吗?有呈酸性和呈碱性的特殊例子吗?
3.在关于提纯的题中常遇到以下几种物质:氢氧化钠溶液,浓硫酸,氯化钙,无水硫酸铜,碱石灰……这些分别有什么作用?常提纯什么物质?还有什么常考用来提纯的物质呢?作用?
问题可能比较多,望指教. 宝宝逍遥1年前4
宝宝逍遥1年前4 -
 未知人物 共回答了17个问题
未知人物 共回答了17个问题 |采纳率94.1%解题技巧和说明:
一、推断题解题技巧:看其颜色,观其状态,察其变化,初代验之,验而得之.
1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色.
2、一些特殊物质的颜色:
黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁)
蓝色:CuSO4•5H2O、Cu(OH)2、CuCO3、含Cu2+ 溶液、
液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)
黄色:硫磺(单质S)、含Fe3+ 的溶液(棕黄色)
绿色:FeSO4•7H2O、含Fe2+ 的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:H2S
3、常见一些变化的判断:
①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
②蓝色沉淀:Cu(OH)2、CuCO3
③红褐色沉淀:Fe(OH)3
Fe(OH)2为白色絮状沉淀,但在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀
④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐
⑤沉淀能溶于酸但没气体放出的:不溶的碱
4、酸和对应的酸性氧化物的联系:
①酸性氧化物和酸都可跟碱反应生成盐和水:
CO2 + 2NaOH == Na2CO3 + H2O(H2CO3 + 2NaOH == Na2CO3 + 2H2O)
SO2 + 2KOH == K2SO3 + H2O
H2SO3 + 2KOH == K2SO3 + 2H2O
SO3 + 2NaOH == Na2SO4 + H2O
H2SO4 + 2NaOH == Na2SO4 + 2H2O
②酸性氧化物跟水反应生成对应的酸:(各元素的化合价不变)
CO2 + H20 == H2CO3 SO2 + H2O == H2SO3
SO3 + H2O == H2SO4 N205 + H2O == 2HNO3
(说明这些酸性氧化物气体都能使湿润pH试纸变红色)
5、碱和对应的碱性氧化物的联系:
①碱性氧化物和碱都可跟酸反应生成盐和水:
CuO + 2HCl == CuCl2 + H2O
Cu(OH)2 + 2HCl == CuCl2 + 2H2O
CaO + 2HCl == CaCl2 + H2O
Ca(OH)2 + 2HCl == CaCl2 + 2H2O
②碱性氧化物跟水反应生成对应的碱:(生成的碱一定是可溶于水,否则不能发生此反应)
K2O + H2O == 2KOH Na2O +H2O == 2NaOH
BaO + H2O == Ba(OH)2 CaO + H2O == Ca(OH)2
③不溶性碱加热会分解出对应的氧化物和水:
Mg(OH)2 == MgO + H2O Cu(OH)2 == CuO + H2O
2Fe(OH)3 == Fe2O3 + 3H2O 2Al(OH)3 == Al2O3 + 3H2O
二、解实验题:看清题目要求是什么,要做的是什么,这样做的目的是什么.
(一)、实验用到的气体要求是比较纯净,除去常见杂质具体方法:
①除水蒸气可用:浓流酸、CaCl2固体、碱石灰、无水CuSO4(并且可以检验杂
质中有无水蒸气,有则颜色由白色→蓝色)、生石灰等
②除CO2可用:澄清石灰水(可检验出杂质中有无CO2)、NaOH溶液、
KOH溶液、碱石灰等
③除HCl气体可用:AgNO3溶液(可检验出杂质中有无HCl)、石灰水、
NaOH溶液、KOH溶液
除气体杂质的原则:用某物质吸收杂质或跟杂质反应,但不能吸收或跟有效成份反应,或者生成新的杂质.
(二)、实验注意的地方:
①防爆炸:点燃可燃性气体(如H2、CO、CH4)或用CO、H2还原CuO、Fe2O3之前,要检验气体纯度.
②防暴沸:稀释浓硫酸时,将浓硫酸倒入水中,不能把水倒入浓硫酸中.
③防中毒:进行有关有毒气体(如:CO、SO2、NO2)的性质实验时,在
通风厨中进行;并要注意尾气的处理:CO点燃烧掉;
SO2、NO2用碱液吸收.
④防倒吸:加热法制取并用排水法收集气体,要注意熄灯顺序.
(三)、常见意外事故的处理:
①酸流到桌上,用NaHCO3冲洗;碱流到桌上,用稀醋酸冲洗.
②沾到皮肤或衣物上:
Ⅰ、酸先用水冲洗,再用3 - 5% NaHCO3冲洗;
Ⅱ、碱用水冲洗,再涂上硼酸;
Ⅲ、浓硫酸应先用抹布擦去,再做第Ⅰ步.
(四)、实验室制取三大气体中常见的要除的杂质:
1、制O2要除的杂质:水蒸气(H2O)
2、用盐酸和锌粒制H2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl,盐酸酸雾)(用稀硫酸没此杂质)
3、制CO2要除的杂质:水蒸气(H2O)、氯化氢气体(HCl)
除水蒸气的试剂:浓流酸、CaCl2固体、碱石灰(主要成份是NaOH和CaO)、生石灰、无水CuSO4(并且可以检验杂质中有无水蒸气,有则颜色由白色→蓝色)等
除HCl气体的试剂:AgNO3溶液(并可检验出杂质中有无HCl)、澄清石灰水、NaOH溶液(或固体)、KOH溶液(或固体)
[生石灰、碱石灰也可以跟HCl气体反应]
(五)、常用实验方法来验证混合气体里含有某种气体
1、有CO的验证方法:(先验证混合气体中是否有CO2,有则先除掉)
将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入澄清石灰水.现象:黑色CuO变成红色,且澄清石灰水要变浑浊.
2、有H2的验证方法:(先验证混合气体中是否有水份,有则先除掉)
将混合气体通入灼热的CuO,再将经过灼热的CuO的混合气体通入盛有无水CuSO4中.现象:黑色CuO变成红色,且无水CuSO4变蓝色.
3、有CO2的验证方法:将混合气体通入澄清石灰水.现象:澄清石灰水变浑浊.1年前查看全部
- 已知氯化镁、氢氧化镁、碳酸镁、硫酸镁四种物质都能和某些物质反应生成化合物,那是什么?
 baccabac1年前3
baccabac1年前3 -
 andy凯 共回答了11个问题
andy凯 共回答了11个问题 |采纳率90.9%硝酸银
速度给分啊!1年前查看全部
- 有ABCDE五种化合物,他们的转化关系如下图,且都含有镁元素,且D是氢氧化镁,推断
有ABCDE五种化合物,他们的转化关系如下图,且都含有镁元素,且D是氢氧化镁,推断
A B C E分别是什麼
写出方程式A-B B-C C-D A-E B-E C-E D-E
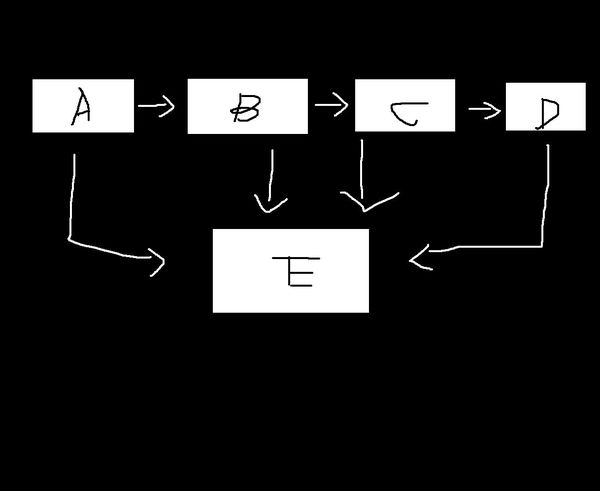
 独夜1年前1
独夜1年前1 -
 faschool 共回答了16个问题
faschool 共回答了16个问题 |采纳率81.3%A:Mg B:MgO C:MgCO3 D:Mg(OH)2 E:MgCL2
A-B:2Mg+O2=2MgO
B-C:MgO+NH4HCO3=MgCO3+H2O+NH3
C-D:MgCO3+2NaOH=Mg(OH)2+Na2CO3
A-E:Mg+2HCL=MgCL2+H2
B-E:MgO+2HCL=MgCL2+H2O
C-E:MgCO3+2HCL=MgCL2+H2O+CO2
D-E:Mg(OH)2+2HCL=MgCL2+2H2O1年前查看全部
- 加入试剂后如何确定海水中的镁离子已全部转化为氢氧化镁沉淀
 wanghongguang1年前1
wanghongguang1年前1 -
 恶男杰特 共回答了15个问题
恶男杰特 共回答了15个问题 |采纳率93.3%加氢氧化钠无沉淀产生.1年前查看全部
- 一块镁、铝合金溶于盐酸中,加入足量的苛性钠溶液.此时溶液存在A氯化镁B氯化铝C偏铝酸钠D氢氧化镁
 sunnylj1年前3
sunnylj1年前3 -
 上海-安然 共回答了17个问题
上海-安然 共回答了17个问题 |采纳率82.4%C偏铝酸钠
注意:氢氧化镁 是沉淀1年前查看全部
- 水垢是由氢氧化镁和碳酸钙为主要成分组成的混合物,要证明水垢中含有碳酸钙,则所需要的化学试剂是( )
水垢是由氢氧化镁和碳酸钙为主要成分组成的混合物,要证明水垢中含有碳酸钙,则所需要的化学试剂是( )
A. 石灰水和氧气
B. 盐酸和石灰水
C. 二氧化碳和水
D. 生石灰和水 flybirdjessie1年前1
flybirdjessie1年前1 -
 潇洒清弈 共回答了19个问题
潇洒清弈 共回答了19个问题 |采纳率89.5%解题思路:碳酸钙属于碳酸盐,可以与酸反应生成能使澄清石灰水变浑浊的二氧化碳气体.碳酸钙可以与盐酸反应生成二氧化碳气体,生成的二氧化碳气体能使澄清石灰水变浑浊,所以要证明水垢中含有碳酸钙,可以使用盐酸和石灰水,分析选项,故选B.
点评:
本题考点: 证明碳酸盐.
考点点评: 本题考查了碳酸盐的检验,检验碳酸盐通常使用酸和澄清石灰水.1年前查看全部
- 判断物质种类一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.1.将少许粉末放入水中,过滤,静置,得
判断物质种类
一包白色粉末,可能有氯化银,碳酸钠,氢氧化镁,氯化钡,硫酸钠,硝酸钾.
1.将少许粉末放入水中,过滤,静置,得白色沉淀.
2.向沉淀中加入硝酸,全部溶解,无气体产生.
3.向其中加入硝酸银溶液,有白色沉淀,加入足量稀硝酸,不溶解.
粉末中一定含---,一定没-----,可能有-----
一定要说为什么啊! situer001年前1
situer001年前1 -
 永远君儿 共回答了15个问题
永远君儿 共回答了15个问题 |采纳率93.3%一定含氯化钡,硫酸钠 ;一定没碳酸钠;可能有硝酸钾,氢氧化镁,氯化银.
条件一:能说明必定有氯化钡——因为氯化银,氢氧化镁不溶于水被过滤后还是有沉淀则是硫酸钡或碳酸钡.再由条件二可知不是碳酸钡因为没有气体.条件三可得白色沉淀是氯化银——氯化钡和硝酸银反应.希望能看懂!1年前查看全部
- 氨水能制氢氧化镁吗
 lydiazlf1年前1
lydiazlf1年前1 -
 安静的黑色 共回答了11个问题
安静的黑色 共回答了11个问题 |采纳率72.7%实验室可以用氯化镁、硫酸镁、硝酸镁溶液加入氨水生成氢氧化镁沉淀.工业上用菱镁矿煅烧生产氧化镁,加水熟化就可以制得氢氧化镁.1年前查看全部
- 光卤石和海水如何制氢氧化镁?
 ningjiafan1年前1
ningjiafan1年前1 -
 零下8的爱 共回答了19个问题
零下8的爱 共回答了19个问题 |采纳率73.7%光卤石 成分为钾、镁的卤化物矿物(KCl·MgCl2·6H2O).
海水-(结晶)-母液-(石灰乳)-Mg(OH)2
海水 光卤石都含有氯化镁
制取的原理都是加入石灰乳或者生石灰把镁离子沉淀.1年前查看全部
大家在问
- 1淹去掉部首是什么字,并组词
- 2军舰在东经160度,南纬59度的海面上,沿着160度经线向南发射导弹,射程为100千米,导弹将落在?
- 3某军舰在(28 0S,160°E)的太平洋上沿经线向南发射导弹,导弹的射程为300千米,则弹着点可能在
- 4某军舰在东经160,南纬59,沿东经160向南发射导弹.射程为90千米.落弹点在哪
- 5某军舰在东经160度,南纬59度的海面上,沿160度E线向南发射导弹,射程为100千米,导弹将落在
- 6单位g/cm立方甲、乙、丙三种溶液密度 甲1、乙1.2、丙0.9取甲种溶液200cm立方、乙种溶液300cm立方、丙种溶
- 7Is the () day of a week
- 8你好,请问"歌"字去掉部首再另加部首组新字并组词,需要两个,谢谢你了!
- 9军舰在东经160度,南纬59度的海面上,沿东经160度经线向南发射导弹,射程为90KM,落点在( )
- 10写一段托物言志的文字仿照下列文段,写一小段托物言志的文字白杨树是不平凡的树,它在西北极普遍,不被人重视,就跟北方的农民相
- 11为“烟花”写一段托物言志的话如:壁灯----位置算什么,重要的是发光.
- 12为了增大英语词汇量,在阅读时,是否看见一个不认识的就应该去查?
- 13浓度40%的糖水加入5千克水,浓度变30%,再加入多少千克糖,能使浓度变为50%
- 14求了,不用初三学的知识点跟我解行不?我真看不懂!
- 15初三不懂的知识点1.等质量的Na2CO3和NaHCO3与过量的稀盐酸分别反应,谁生成CO2速度快?谁生成得多?2.为什么

