某抗酸药每片含碳酸钙0.56g,氢氧化镁0.174g,每片该药可中和多少毫升物质的量浓度为0.1mol/L的盐酸?[式量
 啊排2022-10-04 11:39:541条回答
啊排2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 sbnana 共回答了19个问题
sbnana 共回答了19个问题 |采纳率94.7%- 解题思路:根据碳酸钙、氢氧化钠的质量计算出二者的物质的量,然后根据反应关系式:CaCO3~2HCl、Mg(OH)2~2HCl计算出各自消耗的氯化氢的物质的量,最后根据V=[n/c]计算出需要0.1mol/L的盐酸的体积.
抗酸药每片含碳酸钙0.56g,碳酸钙的物质的量为:n(CaCO3)=[0.56g/100g/mol]=0.0056mol,根据反应的关系式:CaCO3~2HCl,碳酸钙消耗的氯化氢的物质的量为:n(HCl)=2n(CaCO3)=0.0056mol×2=0.0112mol,
抗酸药每片含氢氧化镁0.174g,氢氧化镁的物质的量为:n( Mg(OH)2)=[0.174g/58g/mol]=0.003mol,根据反应的关系式:Mg(OH)2~2HCl,消耗的氯化氢的物质的量为:n(HCl)=2n(Mg(OH)2)=0.003mol×2=0.006mol,
每片该抗酸药中含有的碳酸钙、氢氧化镁消耗的氯化氢的总物质的量为:0.0112mol+0.006mol=0.0172mol,
每片该药可中和0.1mol/L的盐酸的体积为:[0.0172mol/0.1mol/L]=0.172L=172mL,
答:每片该药可中和172毫升物质的量浓度为0.1mol/L的盐酸.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查了物质的量浓度的计算,题目难度中等,关键是掌握物质的量浓度的计算公式及碳酸钙、碳酸镁与氯化氢的反应关系,试题贴近高考,针对性强,有利于激发学生的学习兴趣和学习积极性. - 1年前
相关推荐
- 某抗酸药每片含有碳酸钙534mg,氢氧化镁180mg.
某抗酸药每片含有碳酸钙534mg,氢氧化镁180mg.
(1)写出该抗酸药发挥功效时的反应方程式. zjdx66800081年前2
zjdx66800081年前2 -
 zhouc29 共回答了21个问题
zhouc29 共回答了21个问题 |采纳率85.7%人的胃酸 主要成分就是氯化氢(盐酸)
Mg(OH)2 + 2HCL = MgCL2 + 2H20
CACO3 + 2HCL = CACL2 + H20 + CO2 (这个是实验室制CO2的原理)1年前查看全部
- 铝碳酸镁是一种天然矿物,它最广泛的用途是作为新型抗酸药,用于治疗胃溃疡、胃酸过多症等,其化学式为Al 2 Mg 6 (O
铝碳酸镁是一种天然矿物,它最广泛的用途是作为新型抗酸药,用于治疗胃溃疡、胃酸过多症等,其化学式为Al 2 Mg 6 (OH) x CO 3 •4H 2 O.其中x为( ) A.15 B.16 C.17 D.18  huanashan1年前1
huanashan1年前1 -
 冷钟静_zz 共回答了18个问题
冷钟静_zz 共回答了18个问题 |采纳率77.8%根据在化合物中正负化合价代数和为零,铝显+3、镁显+2、氢氧根显-1、碳酸根显-2,可知Al 2 Mg 6 (OH) x CO 3 •4H 2 O中x的值为:(+3)×2+(+2)×6+(-1)×x+(-2)=0,则x=16.
故选B.1年前查看全部
- (2009•东城区一模)人体胃酸过多会引起胃病.如图为某抗酸药标签上的部分文字,请回答下列问题:
(2009•东城区一模)人体胃酸过多会引起胃病.如图为某抗酸药标签上的部分文字,请回答下列问题:
(1)氢氧化镁中镁元素与氧元素的质量比为3:43:4.[适应症]抗溃疡药,适用于胃溃疡
[主要成分]每片含有氢氧化镁250mg
[注意事项]嚼碎后吞服
(2)每片药片中含镁元素的质量为103.4103.4mg. 布衣3691年前1
布衣3691年前1 -
 冷禅客 共回答了13个问题
冷禅客 共回答了13个问题 |采纳率100%(1)氢氧化镁的化学式Mg(OH)2,则其中镁元素与氧元素的质量比=24:16×2=3:4;
故答案为:3:4;
(2)由标签可得知,每片药片中含氢氧化镁250mg,
每片药片中含镁元素的质量=250mg×
24
58×100%≈103.4mg
枚答案为:103.4mg.1年前查看全部
- 磺胺类药物属于?A抗酸药 B解热镇痛药 C合成抗菌药 D抗生素
 笨笨BuBu1年前1
笨笨BuBu1年前1 -
 suboobus 共回答了17个问题
suboobus 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 某抗酸药每片含CaCO3 534mg,Mg(OH)2 180mg,每片该药可中和多少克溶质质量为6.2%的盐酸?
 maohuo1年前1
maohuo1年前1 -
 anchel23 共回答了20个问题
anchel23 共回答了20个问题 |采纳率80%设中和CaCO3的盐酸是X克,中和Mg(OH)2的盐酸是Y克.
CaCO3+2HCl===CaCl2+H2O+CO2
100.73
0.534.x
0.534/100=x/73
x=0.38982g
Mg(OH)2+2HCl=======MgCl2+2H2O
58.73
0.18.y
0.18/58=y/73
y=0.22655g
所以纯盐酸的总质量是:m=x+y=0.6164g
那么盐酸的总质量是:M=0.6164/6.2%=9.94克1年前查看全部
- 分析计算题 人的胃酸(主要成分是盐酸)过多,会引起胃病.右边方框中是某抗酸药标签上的文字.
分析计算题 人的胃酸(主要成分是盐酸)过多,会引起胃病.右边方框中是某抗酸药标签上的文字.

某同学为了测定该药中氢氧化铝的质量分数,进行如下操作:取一片药片(药片质量为0.5g)研碎后加20毫升蒸馏水,然后加入质量分数为5%的盐酸至完全反应(其他成分不与盐酸反应),测得实验中反应掉的盐酸为6.0克.试通过计算,判断该药片中氢氧化铝的含量是否达到标准,该药片中氢氧化铝的质量分数是多少?
急1
答案上是“氢氧化铝的含量为214毫克,没有达到标准”“它的质量分数为42.8%” momol91年前1
momol91年前1 -
 hcd910 共回答了15个问题
hcd910 共回答了15个问题 |采纳率86.7%Al(OH)3+3HCl=AlCl3+3H2O
78 109.5
x 6g×5%
78×6g×5%=109.6×x
x=213.69mg
213.69/500=42.73
即为42.73%1年前查看全部
- 人胃酸过多会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题:
 人胃酸过多会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题:
人胃酸过多会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题:
(1)该药“嚼碎后吞服”的原因是:______.
(2)某同学为了测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片研碎后用蒸馏水溶解,然后用质量分数为5%的盐酸与其反应(药片中其它成分不与盐酸反应),测得实验中反应掉盐酸的质量为7.3g.计算每片该药中所含氢氧化铝的质量. 晕3591年前1
晕3591年前1 -
 包法利ff1980 共回答了20个问题
包法利ff1980 共回答了20个问题 |采纳率90%解题思路:(1)欲正确解答本题,需从人体消化系统的特点和影响化学反应速率的因素考虑;
(2)欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式计算即可.(1)增大一定量固体的表面积(如粉碎),可增大反应速率.咀嚼后铝碳酸镁片呈小颗粒状,可以增大与胃酸的接触面,因而易于被消化吸收提高药效.故答案为:药物和胃酸充分接触,迅速发挥药效.
(2)设每片该药物含氢氧化铝质量x,
每片药物消耗的盐酸中含HCl的质量为7.3g×5%=0.365g
Al(OH)3+3HCl═AlCl3+3H2O
78 3×36.5
x 0.365g
78:x=(3×36.5):0.365g
解之得:x=0.26g
答:每片含氢氧化铝0.26g.点评:
本题考点: 标签上标示的物质成分及其含量;有关溶质质量分数的简单计算;根据化学反应方程式的计算;家庭常备药品.
考点点评: 本题主要考查学生对影响化学反应速率的因素的知识点的掌握情况和运用化学方程式进行计算的能力.1年前查看全部
- 某抗酸药含有NaHCO3、MgCO3、Mg(OH)2、Al(OH)3中的一中或几种,为了确定其有效成分,进行下列实验:
某抗酸药含有NaHCO3、MgCO3、Mg(OH)2、Al(OH)3中的一中或几种,为了确定其有效成分,进行下列实验:
1.取样品药剂2-3片研碎,向样品中加入适量的水,样品不溶解
2.再向1中加入过量的盐酸,产生大量气泡;
3.静置后,取2中的少量上层溶液,慢慢滴加过量的NaOH溶液,观察到白色沉淀先增多,后建设,但不消失.
回答:
(1)该抗酸药中一定含有( )
(2)写出操作3中有关的离子方程式( )、( )、(
)
第三步里面不消失是为什么?是不是一顶含有氢氧化铝,离子方程式为什么有三个?是哪三个? keaimofashi1年前5
keaimofashi1年前5 -
 万羽视野 共回答了25个问题
万羽视野 共回答了25个问题 |采纳率88%1.一定有 MgCO3 Al(Oh)3
2.Al3+ +oh- =Al(oh)3(沉淀) Al(oh)3+oh-=Alo2- +2H2O
MgCo3是微溶于水的 有可能有 但Mg2+ 有反应 所以 应有Mg2+ +2 Oh- =Mg(oh)2沉淀1年前查看全部
- 下列说法不正确的是( )A.运用电化学原理可以进行金属防护B.氢氧化铝、碳酸钙、醋酸铅都可作抗酸药C.使用太阳能代替化
下列说法不正确的是( )
A.运用电化学原理可以进行金属防护
B.氢氧化铝、碳酸钙、醋酸铅都可作抗酸药
C.使用太阳能代替化石燃料,能减少温室气体的排放
D.“酸雨”主要是由大气中含有较高浓度的硫和氮的氧化物造成的 我要怎样爱你1年前1
我要怎样爱你1年前1 -
 少鸿 共回答了21个问题
少鸿 共回答了21个问题 |采纳率100%解题思路:A、原电池的正极和电解池的阴极金属是被保护的电极;
B、抗酸药的有效成分为:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等;
C、化石燃料的燃烧会产生大量对环境有污染的气体;
D、硫和氮的氧化物是造成酸雨的主要原因.A、运用电化学原理:原电池的正极和电解池的阴极金属是被保护的电极,可以进行金属防护,故A正确;
B、抗酸药的有效成分为:碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等,醋酸铅和盐酸不反应,故B错误;
C、化石燃料的燃烧会产生大量对环境有污染的气体,使用太阳能属于环保型的能源,可以能减少温室气体的排放,故C正确;
D、硫和氮的氧化物二氧化硫、二氧化氮是造成酸雨的主要原因,故D正确.
故选B.点评:
本题考点: 金属的电化学腐蚀与防护;二氧化硫的污染及治理;药物的主要成分和疗效.
考点点评: 本题考查学生对化学基本知识的掌握情况,可以根据教材知识结合化学实际来回答,难度不大.1年前查看全部
- (2007•茂名)胃酸(主要成分是盐酸)过多,会引起很多胃病.某抗酸药的主要成分是氢氧化镁[Mg(OH)2].
(2007•茂名)胃酸(主要成分是盐酸)过多,会引起很多胃病.某抗酸药的主要成分是氢氧化镁[Mg(OH)2].
请回答下列问题:
(1)氢氧化镁由______种元素组成,其组成元素(按化学式中元素的次序)的质量比(最简比)为______;氢氧化镁中镁元素的质量分数为______(保留一位小数).
(2)某同学为测定该药中氢氧化镁的质量分数进行如下几步操作:取一片药片(药片质量均为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸质量为7.3g.则该药片中氢氧化镁的质量分数为多少? 139288420201年前1
139288420201年前1 -
 风吹叶儿 共回答了10个问题
风吹叶儿 共回答了10个问题 |采纳率100%解题思路:(1)根据化学式的意义及化学式的相关计算来完成解答;
(2)根据题意可以知道发生的化学反应为盐酸和氢氧化镁的反应,而已知量为盐酸的质量,可以据此解答.(1)根据氢氧化镁的化学式可以知道氢氧化镁是由3种元素组成的物质,其组成中镁元素、氧元素、氢元素的质量比为24:(16×2):(1×2)=12:16:1而氢氧化镁中镁元素的质量分数为:[24
24+(16+1)×2×100%=41.4%;
(2)根据题给的信息可以知道反应消耗盐酸的质量为7.3g×5%=0.365g,故可以据此求算氢氧化镁的质量,并求算出氢氧化镁的质量分数;
设和盐酸反应的氢氧化镁的质量为x,
2HCl+Mg(OH)2=MgCl2+2H2O
73 58
0.365gx
73/0.365g=
58
x]
解得,x=0.29g;
所以该药片中氢氧化镁的质量分数为:[0.29g/0.5g]×100%=58%;
答:该药片中氢氧化镁的质量分数为58%.
故答案为:
(1)3;12:16:1;41.4%;
(2)58%.点评:
本题考点: 根据化学反应方程式的计算;物质的元素组成;元素质量比的计算;元素的质量分数计算.
考点点评: 在解此类题时,首先分析题中所发生的化学反应并写出化学方程式,然后结合题中所给的数据列出比例关系求出相关的数据进行解答.1年前查看全部
- 胃酸(主要成分是盐酸)过多,会引起很多胃病.某抗酸药的主要成分是氢氧化镁[Mg(OH)2].
胃酸(主要成分是盐酸)过多,会引起很多胃病.某抗酸药的主要成分是氢氧化镁[Mg(OH)2].
请回答下列问题:
(1)氢氧化镁由______种元素组成,其组成元素(按化学式中元素的次序)的质量比(最简比)为______;氢氧化镁中镁元素的质量分数为______(保留一位小数).
(2)某同学为测定该药中氢氧化镁的质量分数进行如下几步操作:取一片药片(药片质量均为0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸质量为7.3g.则该药片中氢氧化镁的质量分数为多少? 1783南海1年前1
1783南海1年前1 -
 专门骂人的 共回答了22个问题
专门骂人的 共回答了22个问题 |采纳率86.4%解题思路:(1)根据化学式的意义及化学式的相关计算来完成解答;
(2)根据题意可以知道发生的化学反应为盐酸和氢氧化镁的反应,而已知量为盐酸的质量,可以据此解答.(1)根据氢氧化镁的化学式可以知道氢氧化镁是由3种元素组成的物质,其组成中镁元素、氧元素、氢元素的质量比为24:(16×2):(1×2)=12:16:1而氢氧化镁中镁元素的质量分数为:[24
24+(16+1)×2×100%=41.4%;
(2)根据题给的信息可以知道反应消耗盐酸的质量为7.3g×5%=0.365g,故可以据此求算氢氧化镁的质量,并求算出氢氧化镁的质量分数;
设和盐酸反应的氢氧化镁的质量为x,
2HCl+Mg(OH)2=MgCl2+2H2O
73 58
0.365gx
73/0.365g=
58
x]
解得,x=0.29g;
所以该药片中氢氧化镁的质量分数为:[0.29g/0.5g]×100%=58%;
答:该药片中氢氧化镁的质量分数为58%.
故答案为:
(1)3;12:16:1;41.4%;
(2)58%.点评:
本题考点: 根据化学反应方程式的计算;物质的元素组成;元素质量比的计算;元素的质量分数计算.
考点点评: 在解此类题时,首先分析题中所发生的化学反应并写出化学方程式,然后结合题中所给的数据列出比例关系求出相关的数据进行解答.1年前查看全部
- (2009•东城区一模)人体胃酸过多会引起胃病.如图为某抗酸药标签上的部分文字,请回答下列问题:
(2009•东城区一模)人体胃酸过多会引起胃病.如图为某抗酸药标签上的部分文字,请回答下列问题:
(1)氢氧化镁中镁元素与氧元素的质量比为______.[适应症]抗溃疡药,适用于胃溃疡
[主要成分]每片含有氢氧化镁250mg
[注意事项]嚼碎后吞服
(2)每片药片中含镁元素的质量为______mg. 古城赤子1年前1
古城赤子1年前1 -
 xiaochuqin 共回答了23个问题
xiaochuqin 共回答了23个问题 |采纳率91.3%解题思路:(1)物质的化学式能表示物质的组成和构成,根据氢氧化镁的化学式Mg(OH)2,可计算出化合物中镁与氧元素的质量比;
(2)利用组成元素的质量=化合物的质量×化合物中元素的质量分数,由每片药片中氢氧化镁的质量可计算出镁元素的质量.(1)氢氧化镁的化学式Mg(OH)2,则其中镁元素与氧元素的质量比=24:16×2=3:4;
故答案为:3:4;
(2)由标签可得知,每片药片中含氢氧化镁250mg,
每片药片中含镁元素的质量=250mg×
24
58×100%≈103.4mg
枚答案为:103.4mg.点评:
本题考点: 元素质量比的计算;化合物中某元素的质量计算.
考点点评: 组成元素的质量=化合物的质量×化合物中元素的质量分数,其中元素的质量分数可由化学式计算得到.1年前查看全部
- 化学与生活密切相关,下列说法不正确的是 A CaCO3,NaHCO3,MgCO3,Al(OH)3都是常见的抗酸药
化学与生活密切相关,下列说法不正确的是 A CaCO3,NaHCO3,MgCO3,Al(OH)3都是常见的抗酸药
B维生素C具有还原性,在人体内起抗氧化作用
C在食品盐中添加适量的碘化钾可以补充人体必需的微量元素碘
D柠檬,柑橘都是碱性食品 ngiel_hall1年前3
ngiel_hall1年前3 -
 天若有崖 共回答了19个问题
天若有崖 共回答了19个问题 |采纳率89.5%D错,因为柠檬和柑橘都含有柠檬酸,所以它们都是酸性物质.1年前查看全部
- (4分)人体胃酸过多会引起胃病。右图为某抗酸药包装标签上的部分文字,请回答下列问题。
(4分)人体胃酸过多会引起胃病。右图为某抗酸药包装标签上的部分文字,请回答下列问题。

(1)Al(OH) 3 的相对分子质量为 。
(2)经测定,每片该抗酸药实含氢氧化铝234mg。
计算一片该抗酸药可消耗7.3%的盐酸多少克(请写出计算过程)? 二维ww1年前1
二维ww1年前1 -
 X-闪电 共回答了13个问题
X-闪电 共回答了13个问题 |采纳率92.3%(1)78 (2)4.5g
1年前查看全部
- 小苏打和氢氧化铝凝胶为什么在医药上可以作为抗酸药?并写出化学方程式
 人似归鸿1年前1
人似归鸿1年前1 -
 米土 共回答了15个问题
米土 共回答了15个问题 |采纳率73.3%胃酸主要成分是HCl,所以用来做药物
NaHCO3 + HCl==NaCl +H2O + CO2
Al(OH)3 + 3HCl==AlCl3 +3H2O1年前查看全部
- 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如右图所示.当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.(写实验操作和实验现象)
【提出问题】抗酸药为什么嚼碎后服用.
【作出猜想】他的猜想是______.
【设计实验】
实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将一片药片______放入试管中,向其中加入5mL5%的稀盐酸.
【现象与结论】实验二比实验一反应快.证明小军的猜想正确.
【拓展探究】
(1)碳酸镁治疗胃酸过多的原理(用化学方程式表示)______
(2)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药.这些物质必须具备两个条件:
一是对身体______;二是______.
(3)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是______. pchf0051年前1
pchf0051年前1 -
 rwil 共回答了30个问题
rwil 共回答了30个问题 |采纳率93.3%解题思路:物质与物质之间的接触面积越大,反应速率越快.人吃的药物必须具备一些条件,例如,对人体的危害程度要小,要起到治疗疾病的效果.利用反应的生成物来分析胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药的原因.【作出猜想】物质与物质之间的接触面积越大,反应速率越快,嚼碎后药物与胃酸的反应快,疗效快故答案为:嚼碎后服用疗效快
【设计实验】为了对比,应该是把药片研碎.故答案为:研碎
【拓展探究】(1)碳酸镁治疗胃酸过多的反应的反应物是碳酸镁和氯化氢,生成物是氯化镁、水和二氧化碳.故答案为:MgCO3+2HCl═MgCl2+H2O+CO2↑
(2)人吃的药物必须具备一些条件,例如,对人体的危害程度要小,要起到治疗疾病的效果.故答案为:对身体无害;能与胃酸作用
(3)因碳酸盐与盐酸作用生成二氧化碳气体,能加重胃溃疡病情,故答案为:碳酸盐与盐酸作用生成二氧化碳气体,加重胃溃疡病情.点评:
本题考点: 酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.利用酸的化学性质,灵活的运用所学的知识,培养学生的解题能力.1年前查看全部
- 人的胃液里含有适量盐酸.服用含MgCO 3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为:
人的胃液里含有适量盐酸.服用含MgCO 3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为: ;该抗酸药说明书上标明的食用方法为”,将药片嚼碎后服用的优点是 .  迷梦者1年前1
迷梦者1年前1 -
 cailinfang 共回答了23个问题
cailinfang 共回答了23个问题 |采纳率78.3%MgCO 3 +2HCl===MgCl 2 +H 2 O+CO 2 ↑;增大接触面积利于吸收1年前查看全部
- 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小明拿来了两种抗酸药(治疗胃酸过多的药物),这
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小明拿来了两种抗酸药(治疗胃酸过多的药物),这两种药物说明书的部分内容如图所示.

(1)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是______.
(2)嚼碎后服用可使药物与胃酸的反应速率加快,疗效快.现提供5%的稀盐酸和试管等仪器,请你设计实验方案,进行证明.______. tomluter1年前1
tomluter1年前1 -
 落日的天空 共回答了15个问题
落日的天空 共回答了15个问题 |采纳率86.7%解题思路:(1)根据碳酸盐能与盐酸反应有二氧化碳气体生成分析;
(2)根据反应物接触面积与反应速率的关系设计实验.(1)由于碳酸盐与盐酸反应后生成二氧化碳气体,增加胃内气压,有可能造成胃穿孔.所以,患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药;
(2)由反应物接触面积与反应速率的关系设计实验:将等质量的碳酸镁一份块状,一份研磨成粉状分别放入试管中,分别滴入5%的稀盐酸,比较气泡生成的快慢.
故答为:(1)碳酸盐与盐酸反应后生成二氧化碳,增加胃内气压,有可能造成胃穿孔;(2)将等质量的碳酸镁一份块状,一份研磨成粉状分别放入试管中,分别滴入5%的稀盐酸,比较气泡生成的快慢.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题的难度不大,解题的关键是利用碳酸盐的性质能做到具体问题具体分析就可以.1年前查看全部
- 下列药物及其类别的对应关系不正确的是( ) A.胃得乐(主要为碳酸镁)--抗酸药 B.复方氢氧化铝--抗生素 C.阿司
下列药物及其类别的对应关系不正确的是( ) A.胃得乐(主要为碳酸镁)--抗酸药 B.复方氢氧化铝--抗生素 C.阿司匹林--解热镇痛药 D.磺胺类药物--合成抗菌药  风泵1年前1
风泵1年前1 -
 无言花 共回答了19个问题
无言花 共回答了19个问题 |采纳率89.5%A.碳酸镁可与盐酸反应,可作中和过多胃酸的药品,故A正确;
B.氢氧化铝是两性氢氧化物,能和胃酸反应生成盐和水而中和胃酸,所以氢氧化铝可用作中和过多胃酸的药品,故B错误;
C.阿司匹林是常用解热镇痛药,不是抗生素,所以不能消炎抗菌,故C正确;
D.磺胺类药物属于合成抗菌药,属于抗生素,故D正确.
故选B.1年前查看全部
- 人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为O.5 g),研碎后加20ml蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验反应掉的盐酸体积为6.O mL.通过计算:①判断该药片中氢氧化铝的含量是否达到标注?②确定该药片中氢氧化铝的质量分数为多少? lihongray1年前1
lihongray1年前1 -
 到底谁不厚道 共回答了15个问题
到底谁不厚道 共回答了15个问题 |采纳率100%答:1mol氢氧化铝能够与3mol盐酸反应0.6克盐酸含有溶质为5%*0.6=0.03g=30mg含有30mg/36.5g/mol=0.82mmol能够与0.27mmol氢氧化铝反应这么多的氢氧化铝的质量是0.27*78mg=21mg没有达到标准 Al(OH)3+3HCl=AlC...1年前查看全部
- 抗酸药中既能与强酸反应,又能与强碱反应得物质是( )
抗酸药中既能与强酸反应,又能与强碱反应得物质是( )
A.CaCO3
B.Al(OH)3
C.Mg(OH)2
D.NaHCO3 feng36781年前1
feng36781年前1 -
 yedan5744 共回答了12个问题
yedan5744 共回答了12个问题 |采纳率75%解题思路:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应.以此解答本题.A.碳酸钙与强酸反应生成盐和水,与强碱不反应,故A错误;
B.Al(OH)3 属于两性氢氧化物,既能与酸反应,生成铝盐(Al3+),又能与碱反应生偏铝酸盐(AlO2-),故B正确;
C.氢氧化镁与强酸反应生成盐和水,与强碱不反应,故C错误;
D.NaHCO3属于弱酸弱碱盐,既能与酸反应,生成CO2气体,又能与碱反应,生成盐,故D正确.
故选BD.点评:
本题考点: 药物的主要成分和疗效;两性氧化物和两性氢氧化物.
考点点评: 本题考查元素化合物的性质,题目难度不大,旨在考查学生对知识的理解识记与知识归纳,注意基础知识的积累.1年前查看全部
- 初3一道科学题,某抗酸药(主要成分)每片含有氢氧化铝250毫克.某同学为测定该药中氢氧化铝的质量分数,进行如下操作:取一
初3一道科学题,
某抗酸药(主要成分)每片含有氢氧化铝250毫克.
某同学为测定该药中氢氧化铝的质量分数,进行如下操作:取一片质量为0.5克的药片研碎后加20毫升蒸馏水,然后加入质量分数为5%的盐酸至完全反应(其他成分不与盐酸反应),测得实验中反应掉的盐酸6.0克.试通过计算判断该药片中氢氧化铝的质量是否达到标准,该药片中氢氧化铝的质量分数是多少? 谁不服气1年前1
谁不服气1年前1 -
 小董1 共回答了29个问题
小董1 共回答了29个问题 |采纳率96.6%设Al(OH)3的质量为x
Al(OH)3+3HCl=AlCl3+3H2O
78 109.5
x 6g*5%=0.3g
78/x=109.5/0.3g
x=0.21g
0.21g1年前查看全部
- 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物).该
 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物).该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究兴趣.
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物).该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究兴趣.
【提出问题】(1)抗酸药为什么要嚼碎后服用?
(2)还有哪些物质可以代替碳酸镁治疗胃酸过多?
(一)关于“抗酸药为什么要嚼碎后服用”的探究?
【设计实验】
实验一:将一片完整的药片放入试管中,加入5ml5%的稀盐酸.
实验二:将药品进行研碎处理后放入试管中,加入5ml5%的稀盐酸.
【现象与结论】(1)实验二比实验一反应______(填“快”或“慢”).
(2)要加快化学反应的速率,可采用______增大与反应物的接触面积的方法.
(二)关于“代替碳酸镁的物质”的探究.
【查阅资料】胃酸过多时,主要是盐酸中的氢离子质量分数过大,刺激胃黏膜引起胃痛.
【设计实验】根据酸的性质,设计如下几种方***疗胃酸过多的方案:
方案1:服用含有铁粉的药物
方案2:服用含有氧化钙的药物
方案3:服用含有氢氧化铝的药物
方案4:服用含有纯碱或小苏打的药物
【讨论与交流】
(1)方案3中发生的反应的化学方程式为______.铁属于人体需要的微量元素,缺铁容易患______,但是如果摄入量超标对人体反而有害,因此在药物中的用量需要严格控制.
(2)其余三个方案中,不合理的是方案______,理由是______.
【拓展与迁移】
氢氧化镁、碳酸钙等也常用于作抗酸药.请你综合分析总结这些抗酸物质必须具备的两个条件:一是能与胃酸作用;二是______. 4xking1年前1
4xking1年前1 -
 sidehua 共回答了9个问题
sidehua 共回答了9个问题 |采纳率100%解题思路:物质与物质之间的接触面积越大,反应速率越快.人吃的药物必须具备一些条件,例如,对人体的危害程度要小,要起到治疗疾病的效果.(一)【现象与结论】(1)药片研碎后增大了与稀盐酸的接触面积,因此实验二比实验一反应快.
(2)要加快化学反应的速率,可采用研磨增大与反应物的接触面积的方法.
(二)【讨论与交流】(1)盐酸与氢氧化铝反应生成氯化铝和水,反应的方程式为3HCl+Al(OH)3═AlCl3+3H2O;铁属于人体需要的微量元素,缺铁容易患缺铁性贫血.
(2)氧化钙与水反应生成氢氧化钙,氢氧化钙有强腐蚀性;少量的铁粉与胃酸反应生成可溶性的氯化亚铁,人体可补充铁元素;纯碱与小苏打对人体无害,并且都能与盐酸反应.
【拓展与迁移】抗酸物质必须具备的两个条件:一是能与胃酸作用;二是无毒无害.
故答案为:【现象与结论】(1)快;(2)研磨;
【讨论与交流】(1)3HCl+Al(OH)3═AlCl3+3H2O;缺铁性贫血;
(2)2;氧化钙与水反应生成氢氧化钙,氢氧化钙有腐蚀性;
【拓展与迁移】无毒无害.点评:
本题考点: 盐的化学性质;中和反应及其应用;书写化学方程式、文字表达式、电离方程式;人体的元素组成与元素对人体健康的重要作用.
考点点评: 实验探究题要求在解题时能根据所给的实验事实进行归纳,推理和判断,得出结论并加以解释说明.1年前查看全部
- 请把第二问的两个计算步骤写下来 人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答
请把第二问的两个计算步骤写下来
人胃酸(主要成分是盐酸)过多,会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
[适应症]抗溃疡药,适用于胃溃痛
[主要成分]每片含有氢氧化铝250 mg
[注意事项]嚼碎后吞服
(1)该药"嚼碎后吞服"的原因是:.
(2)某同学为测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为O.5 g),研碎后加20ml蒸馏水,然后用质量分数为5%,密度为1.02g/mL的盐酸进行反应(假设其他成分不与盐酸反应),测得实验反应掉的盐酸体积为6.O mL.通过计算:
①判断该药片中氢氧化铝的含量是否达到标注
②确定该药片中氢氧化铝的质量分数为多
1)增大反应物的接触面积,加快与胃酸作用.(2分) (2)①药片中的氢氧化铝质量为0.2l 8 g(1分)
因为氢氧化铝的实际质量为218 mg,小于标签所标示的250 mg所以该药品中的氢氧化铝含量没有达标注.(1分) ②药片中氢氧化铝的质量分数为:43.6% younger5541年前1
younger5541年前1 -
 斯文滴人 共回答了23个问题
斯文滴人 共回答了23个问题 |采纳率100%使药物与胃酸接触得更充分,药效出来的快.
Al(OH)3+3HCl=AlCl3+3H2O
78 109.5
X 0.306g(6*1.02*5%)
解得X=0.22g
0.22g/0.5g=43%1年前查看全部
- 人的胃液里含有适量的胃酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该
 人的胃液里含有适量的胃酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.为了验证该药物的主要成分是碳酸盐,他进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,然后______(写实验操作和实验现象).当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
人的胃液里含有适量的胃酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.为了验证该药物的主要成分是碳酸盐,他进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,然后______(写实验操作和实验现象).当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】他的猜想是______.
【设计实验】实验一:将一片完整的药片放入试管中,向其中加入5mL 5%的稀盐酸;
实验二:将______放入试管中,向其中加入5mL 5%的稀盐酸.
【现象与结论】实验二比实验一反应快.证明小军的猜想正确.
【拓展探究】
(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药.这些物质必须具备两个条件:一是能与胃酸作用;二是______.
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是______.
(3)请写出用碳酸镁治疗胃酸过多的化学方程式______. sage_dq1年前1
sage_dq1年前1 -
 tyfx 共回答了15个问题
tyfx 共回答了15个问题 |采纳率93.3%解题思路:物质与物质之间的接触面积越大,反应速率越快.人吃的药物必须具备一些条件,例如,对人体的危害程度要小,要起到治疗疾病的效果.利用反应的生成物来分析胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药的原因.该药物的主要成分是碳酸盐,先将药片放入试管中,向其中加入适量的稀盐酸,然后验证生成的气体是不是二氧化碳就行,
故答案为:将生成的气体通入到澄清的石灰水中,石灰水变浑浊.
【作出猜想】药物说明书上的服用方法是嚼碎后服用,故他猜想的答案为:嚼碎后服用疗效快(或嚼碎后药物与胃酸的反应快;或反应物的接触面积增大,化学反应加快);
【设计实验】可以设计这样的实验来验证一是整片的药片和研碎的药片与盐酸反应,观察反应速度,从而得出小军的猜想正确.
故答案为:一片研碎的药片
【拓展探究】
(1)最后深入探究得出胃药必备的条件:一能中和胃酸,二对身体无害;故[拓展探究]的答案为:对身体无害;
(3)由于这些碳酸盐与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药.故答案为:碳酸盐与盐酸作用生成二氧化碳气体,加重胃溃疡病情.
(3)盐酸与碳酸镁发生的反应方程式为:2HCl+MgCO3=MgCl2+H2O+CO2↑
答案:
将生成的气体通入到澄清的石灰水中,石灰水变浑浊
【作出猜想】嚼碎后服用疗效快
【设计实验】一片研碎的药片
【拓展探究】
(1)【拓展探究】
(2)碳酸盐与盐酸作用生成二氧化碳气体,加重胃溃疡病情
(3)2HCl+MgCO3=MgCl2+H2O+CO2↑点评:
本题考点: 证明碳酸盐;书写化学方程式、文字表达式、电离方程式.
考点点评: 该题最大的特点是通过问题情境,将胃药说明书探究的明明白白,使学生在做题中获得了生活常识,很有意义.1年前查看全部
- (2008•河北)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃
 (2008•河北)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
(2008•河北)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.
为了验证该药物的主要成分是碳酸盐,他进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,然后______(写实验操作和实验现象).当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】他的猜想是______.
【设计实验】实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将______放入试管中,向其中加入5mL5%的稀盐酸.
【现象与结论]实验二比实验一反应快.证明小军的猜想正确.
【拓展探究】
(1)氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药,这些物质必须具备两个条件:一是能与胃酸作用;二是______.
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因______. csdmi1年前1
csdmi1年前1 -
 木矢 共回答了14个问题
木矢 共回答了14个问题 |采纳率85.7%解题思路:该题是典型的实验探究题.以小军吃胃痛药为背景,来探究胃药成分.进而探究抗酸药为什么嚼碎后服用?通过猜想,实验,得出了吃胃药的方法以及胃药的特点和注意事项.该药物的主要成分是碳酸盐,先将药片放入试管中,向其中加入适量的稀盐酸,然后验证生成的气体是不是二氧化碳就行,
故答案为:为将生成的气体通入到澄清的石灰水中,石灰水变浑浊.
药物说明书上的服用方法是嚼碎后服用,故他猜想的答案为:嚼碎后服用疗效快(或嚼碎后药物与胃酸的反应快;或反应物的接触面积增大,化学反应加快);
可以设计这样的实验来验证一是整片的药片和研碎的药片与盐酸反应,观察反应速度,从而得出小军的猜想正确.
故答案为:一片研碎的药片
最后深入探究得出胃药必备的条件:一能中和胃酸,二对身体无害;故[拓展探究]的答案为:对身体无害;
由于这些碳酸盐与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药.故答案为:碳酸盐与盐酸作用生成二氧化碳气体,加重胃溃疡病情.点评:
本题考点: 药品的分类;影响化学反应速率的因素探究;证明碳酸盐.
考点点评: 该题最大的特点是通过问题情境,将胃药说明书探究的明明白白,使学生在做题中获得了生活常识,很有意义.1年前查看全部
- 人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛。小明拿来了两种抗酸药(治疗胃酸过多的药物)。这
人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛。小明拿来了两种抗酸药(治疗胃酸过多的药物)。这两种药物说明书的部分内容如图所示。 
(1)请判断两种药品每片能消耗胃酸多少的关系是①____②。(填“大于”、“等于”或“小于”)
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是___________________________
(3)嚼碎后服用可使药物与胃酸的反应速率加快,疗效快。现提供5%的稀盐酸和试管等仪器,请你设计实验方案,进行证明。 ____________________________ zelldoom1年前1
zelldoom1年前1 -
 雨泪儿 共回答了20个问题
雨泪儿 共回答了20个问题 |采纳率80%(1)大于
(2)碳酸盐与盐酸反应生成二氧化碳气体,可加重胃溃疡病人的病情
(3)取两片相同的药片,其中一片研碎后故入试管1中,另一片直接放入试管2中,并分别向其中加入等质 量5%的稀盐酸,试管l中反应速率比试管2中的快,证明嚼碎后服用可使药物与胃酸的反应速率加快,疗效快。1年前查看全部
- (2009•湛江模拟)如图是湛江××药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
 (2009•湛江模拟)如图是湛江××药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
(2009•湛江模拟)如图是湛江××药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
(1)碳酸镁属于酸、碱、盐、氧化物中的______.
(2)为了验证该药物的主要成分是碳酸盐,小军进行了如下实验:首先将药片放入试管中,向其中加入适量的稀盐酸,观察到有气泡产生,然后将产生的气体通入______(写实验操作),看到的现象是______.
(3)当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣.
【提出问题】抗酸药为什么嚼碎后服用?
【作出猜想】联想到实验室制CO2时粉末状石灰石比块状石灰石产生气体的速率要______(填“快”、“慢”或“不变”),他的猜想是反应物的颗粒大小会影响反应的速率.
【设计对比实验】实验一:将一片完整的药片放入试管中,向其中加入5mL5%的稀盐酸;
实验二:将______放入试管中,向其中加入5mL5%的稀盐酸.
【现象与结论】实验二比实验一反应快.证明小军的猜想正确.
【拓展探究】氢氧化镁、碳酸钙、碳酸氢钠等也常用于制作抗酸药.这些物质必须具备两个条件:一是能与盐酸反应;二是______. 笑看风云lsx1年前1
笑看风云lsx1年前1 -
 anan8256 共回答了14个问题
anan8256 共回答了14个问题 |采纳率92.9%解题思路:碳酸镁是由镁离子和硫酸根离子组成的化合物,属于盐.碳酸盐能和稀盐酸反应生成能使石灰水变浑浊的气体二氧化碳.研碎的药片比完整的药片与盐酸的接触面积大.治疗人类疾病的药物应该对人体无害.(1)碳酸镁是由金属离子和酸根离子组成的化合物,属于盐.故填:盐.
(2)澄清的石灰水是检验二氧化碳的一种常用物质,因为二氧化碳能使石灰水变浑浊.故填:澄清的石灰水中.澄清的石灰水变浑浊.
(3)物质之间的接触面积越大,反应越快.故填:快.一片研碎的药片.
【拓展探究】治疗人类疾病的药物应该对人体无害.故填:对身体无害.点评:
本题考点: 证明碳酸盐;常见的氧化物、酸、碱和盐的判别.
考点点评: 解答本题的关键是要掌握物质的分类方法和物质之间相互作用时的实验现象方面的知识,只有这样才能对问题做出正确的判断.1年前查看全部
- 1某品牌抗酸药的主要成分有糖衣,碳酸镁,氢氧化铝,淀粉.请写出该抗酸药发挥功效时的离子方
1某品牌抗酸药的主要成分有糖衣,碳酸镁,氢氧化铝,淀粉.请写出该抗酸药发挥功效时的离子方
第一题有2个离子方程式
2,已知可用盐酸酸化的碘化钾淀粉溶液检查食盐中含碘酸钾.请写出此检测方法的离子方程式. 忘情另1年前1
忘情另1年前1 -
 hjhgujtyityi 共回答了17个问题
hjhgujtyityi 共回答了17个问题 |采纳率100%1、
Al(OH)3 + 3H+ == Al3+ + 3H2O
MgCO3 + 2H+ == Mg2+ + H2O + CO2↑
2、
IO3- + 5I- + 6H+ ==3I2 + 3H2O1年前查看全部
- 胃酸过多会导致治消化不良等胃病.某种治疗胃酸过多的抗酸药中含有氢氧化铝、碳酸镁、碳酸氢钠和淀粉.
胃酸过多会导致治消化不良等胃病.某种治疗胃酸过多的抗酸药中含有氢氧化铝、碳酸镁、碳酸氢钠和淀粉.
请设计实验见它们一一检验出来 深圳一小妞1年前1
深圳一小妞1年前1 -
 rvnac 共回答了20个问题
rvnac 共回答了20个问题 |采纳率90%只要检验它们是否存在,不需要检验所有的元素
即检验这种物质其中一部分的存在
各取样品:
1.加入碘水,有蓝色物质生成,说明有淀粉
2.通过焰色反应,检验钠元素,就可以检验碳酸氢钠
3.加入水,再加入过量氢氧化钠溶液,发现有部分不溶物溶解
这是氢氧化铝的溶解,和氢氧化钠反应生成偏铝酸钠和水
检验了氢氧化铝的存在
4.检验碳酸镁的话,运用高中的知识比较麻烦,给你点思路:
想办法把氢氧化铝转化为偏铝酸根离子,将沉淀全部溶解
用盐酸去除碳酸根离子,再用氢氧根离子检验镁离子
这里有一个定性的检验方法,了解一下:
加几滴浓氨水,再滴入(NH4)2HPO4溶液
再摩擦试管内壁,会生成白色晶形
即MgNH4PO4·6H2O1年前查看全部
- (2009•河南)人的胃液里含有适量盐酸.服用含MgCO3的抗酸药可治疗胃酸过多症,有关反应的化学方程式为______;
(2009•河南)人的胃液里含有适量盐酸.服用含MgCO3的抗酸药可治疗胃酸过多症,有关反应的化学方程式为______;该抗酸药说明书上标明的食用方法为“嚼食”,将药片嚼碎后服用的优点是______.
 zhangqi3241年前1
zhangqi3241年前1 -
 dd留芳 共回答了15个问题
dd留芳 共回答了15个问题 |采纳率86.7%解题思路:碳酸镁与盐酸的反应类似于碳酸钙与盐酸的反应,嚼服后药品颗粒变小增大了与胃酸的接触面积更有利于反应的进行.碳酸镁与盐酸的反应符合碳酸盐与酸的反应规律,产物回事氯化镁、水、及二氧化碳,嚼服的好处是增大了反应物的接触面积,使反应的速度变快使药效发挥的更好.
故答案为:MgCO3 +2HCl═MgCl2+CO2↑+H2O;药物与胃酸的接触面积大,反应快.点评:
本题考点: 酸的化学性质;影响化学反应速率的因素探究.
考点点评: 此题是一道生活实际考查题,解题的关键是利用所学的化学知识对相关的现象的分析及理解,属基础性知识考查题.1年前查看全部
- 化学与生活密切相关,下列说法正确的是( ) A.氢氧化铝、氢氧化镁可做抗酸药 B.加碘食盐中添加的是碘化钾 C.味觉上
化学与生活密切相关,下列说法正确的是( ) A.氢氧化铝、氢氧化镁可做抗酸药 B.加碘食盐中添加的是碘化钾 C.味觉上具有酸味的食物就是酸性食物 D.凡含有食品添加剂的食物对人体健康均有害  煤气炉子1年前1
煤气炉子1年前1 -
 文儒秀雅 共回答了17个问题
文儒秀雅 共回答了17个问题 |采纳率94.1%A.胃酸的主要成分为盐酸,胃酸与氢氧化铝反应生成氯化铝和水,反应的离子方程式为Al(OH) 3 +3H + =Al 3+ +3H 2 O,胃酸与氢氧化镁反应生成氯化镁和水,反应的离子方程式为Mg(OH) 2 +2H + =Mg 2+ +2H 2 O,氢氧化铝和氢氧化镁都能中和胃里过多的盐酸可做抗酸药,故A正确;
B.“加碘食盐”是根据国家标准将碘酸钾(KIO 3 )与食盐按6:100000的质量比混合配制而成,故B错误;
C.在人体内产生酸性物质的称为酸性食品,如:淀粉类、豆类、动物性食物、油炸食物或奶油类等;在人体内产生碱性物质的称为碱性食品,如:蔬菜、水果,茶叶等,所以葡萄味觉酸性,但含钾、钠、钙、镁等元素,在人体内代谢后生成碱性物质,为碱性食物,故C错误;
D.食品添加剂可以改善食品的色香味、延长食品的保质期,可适量添加使用,不能过量,故D错误;
故选A.1年前查看全部
- 某抗酸药每片含碳酸钙534mg、氢氧化镁180mg.试计算10片该药片理论上可与1.00mol•L-1的盐酸溶液多少毫升
某抗酸药每片含碳酸钙534mg、氢氧化镁180mg.试计算10片该药片理论上可与1.00mol•L-1的盐酸溶液多少毫升恰好反应?
 恋MoMo1年前1
恋MoMo1年前1 -
 圣诞节uu 共回答了17个问题
圣诞节uu 共回答了17个问题 |采纳率94.1%解题思路:根据发生的反应有CaCO3+2HCl=CaCl2+CO2↑+H2O、Mg(OH)2+2HCl=MgCl2+2H2O来计算消耗的盐酸.抗酸药每片含碳酸钙534mg、氢氧化镁180mg,
则10片该药片含碳酸钙5340mg=5.34g、氢氧化镁1800mg=1.8g,
n(CaCO3)=[5.34g/100g/mol]=0.0534mol,
n(Mg(OH)2)=[1.8g/58g/mol]=0.031mol,
由CaCO3+2HCl=CaCl2+CO2↑+H2O
1 2
Mg(OH)2+2HCl=MgCl2+2H2O
1 2
则理论上消耗的HCl为0.0534mol×2+0.031mol×2=0.17mol,
即10片该药片中含有的CaCO3、Mg(OH)2能够反应的盐酸的体积为[0.17mol/1.00mol/L]=0.17L=170mL,
答:10片该药片理论上可与1.00mol•L-1的盐酸溶液170毫升恰好反应.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生利用化学反应方程式进行计算,明确发生的化学反应是解答本题的关键,难度不大.1年前查看全部
- 人的胃液里含有适量盐酸,服用含MgCO 3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为______;该抗酸药说明书
人的胃液里含有适量盐酸,服用含MgCO 3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为______;该抗酸药说明书上标明服用方法为______.钢铁厂利用焦炭与二氧化碳反应生成一种还原性气体______;一氧化碳跟氧化铁在高温下反应生成铁的化学方程式为______.  小龙菲菲1年前1
小龙菲菲1年前1 -
 双飞8翼8 共回答了17个问题
双飞8翼8 共回答了17个问题 |采纳率94.1%碳酸镁与盐酸的反应符合碳酸盐与酸的反应规律,产物回事氯化镁、水、及二氧化碳,嚼服的好处是增大了反应物的接触面积,使反应的速度变快使药效发挥的更好.焦炭与二氧化碳反应生成一氧化碳气体,方程式为:C+CO...1年前查看全部
- 下列实验现象描述正确的是 A.鸡蛋清溶液遇到浓硝酸颜色变蓝 B.葡萄糖遇碘变成蓝色 C.某种抗酸药(有效成分为碳酸氢钠)
下列实验现象描述正确的是
A.鸡蛋清溶液遇到浓硝酸颜色变蓝 B.葡萄糖遇碘变成蓝色 C.某种抗酸药(有效成分为碳酸氢钠)与盐酸反应能放出气体 D.淀粉与新制的银氨溶液混合放入洁净的试管中会发生银镜现象  8812251年前1
8812251年前1 -
 shaoshanshan1985 共回答了22个问题
shaoshanshan1985 共回答了22个问题 |采纳率90.9%C
鸡蛋清溶液中含有蛋白质,蛋白质遇到浓硝酸颜色变黄,A项不正确;淀粉遇碘变蓝,而葡萄糖则不能,B项不正确;碳酸氢钠与盐酸反应能放出CO 2 气体,C项正确;淀粉结构中不含醛基,不能发生银镜反应,D项不正确。故答案为C项。1年前查看全部
- (一)人的胃液里含有适量的盐酸,如图是某种抗酸药(治疗胃酸过多的药物)的说明书的部分内容:
 (一)人的胃液里含有适量的盐酸,如图是某种抗酸药(治疗胃酸过多的药物)的说明书的部分内容:
(一)人的胃液里含有适量的盐酸,如图是某种抗酸药(治疗胃酸过多的药物)的说明书的部分内容:
①药物的用法要求“嚼碎服用”,其原因是______.
②说明书中注明“注意事项:胃溃疡患者慎用”,其原因是______(用化学方程式说明).
(二)盐酸在工业上常用于除绣,将生锈的铁钉放入稀盐酸中,刚开始观察到的现象是______,过一段时间会发现______.写出有关化学方程式______,______. huang_051年前1
huang_051年前1 -
 红尘醉卧烟雨楼 共回答了12个问题
红尘醉卧烟雨楼 共回答了12个问题 |采纳率75%解题思路:(一)①“嚼碎服用”能增大反应物的接触面积,据此进行分析解答.
②该抗酸药的主要成分是NaHCO3,能与盐酸反应生成二氧化碳,据此进行分析解答.
(二)铁锈的主要成分是氧化铁,能与稀盐酸反应生成氯化铁与水,铁锈完全消失后,铁与稀盐酸反应生成氯化亚铁和氢气,据此写出反应的化学方程式即可.(一)①药物的用法要求“嚼碎服用”,能增大反应物的接触面积,反应彻底,吸收效果好.
②NaHCO3能与盐酸反应生成二氧化碳,使胃内气压迅速升高,可能导致胃穿孔,反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑.
(二)铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,溶液由无色变成黄色,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O.
当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,故会观察到有气泡产生,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
故答案为:(一)①能增大反应物的接触面积,反应彻底,吸收效果好;②NaHCO3+HCl═NaCl+H2O+CO2↑.
(二)铁锈逐渐消失,溶液由无色变成黄色;有气泡产生;Fe2O3+6HCl═2FeCl3+3H2O;Fe+2HCl═FeCl2+H2↑.点评:
本题考点: 酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,主要考查酸的化学性质,掌握铁锈的主要成分、酸的化学性质、化学方程式的书写等是正确解答本题的关键.1年前查看全部
- 抗酸药“胃舒平”的主要成分是______,可以用以下方法检验:
抗酸药“胃舒平”的主要成分是______,可以用以下方法检验:
(1)取3-5片“胃舒平”于研钵中研磨至粉末状,置于一试管中.
(2)向试管中加入3-5mL______.
(3)待反应完成后,静置一段时间后进行______.
(4)向滤液中逐滴加入2mol/L的______溶液,发现有白色沉淀生成,再滴加______ 溶液,振荡,白色沉淀消失.所发生的主要反应用离子方程式表示为:
①______
②______
③______. 小小的大头1年前1
小小的大头1年前1 -
 pkrhinoceros 共回答了16个问题
pkrhinoceros 共回答了16个问题 |采纳率100%解题思路:“胃舒平”的主要成分是氢氧化铝,氢氧化铝能与盐酸反应生成氯化铝,氯化铝能与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能与氢氧化钠反应生成偏铝酸钠.“胃舒平”的主要成分是氢氧化铝,故答案为:氢氧化铝;
(2)氢氧化铝能与盐酸反应生成氯化铝,故答案为:HCl;
(3)氢氧化铝能与盐酸反应生成氯化铝,过滤除掉杂质得到氯化铝溶液,故答案为:过滤;
(4)氯化铝能与氢氧化钠反应生成氢氧化铝沉淀,氢氧化铝能与氢氧化钠反应生成偏铝酸钠,反应方程式:Al(OH)3+3H+=Al3++3H2O;3OH-+Al3+=Al(OH)3↓;OH-+Al(OH)3=AlO2-+2H2O,故答案为:氢氧化钠;氢氧化钠;Al(OH)3+3H+=Al3++3H2O;3OH-+Al3+=Al(OH)3↓;OH-+Al(OH)3=AlO2-+2H2O.点评:
本题考点: 药物的主要成分和疗效;探究物质的组成或测量物质的含量.
考点点评: 本题考查铝的化合物的性质,题目难度不大,注意基础知识的积累.1年前查看全部
- 下列药品中,属于抗酸药的是( )
下列药品中,属于抗酸药的是( )
A.阿司匹林
B.胃舒平
C.环丙沙星
D.青霉素 liufengyu0001年前0
liufengyu0001年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列物质中,既可作疏松剂也可用作抗酸药的是( )
下列物质中,既可作疏松剂也可用作抗酸药的是( )
A.NaHCO3
B.Al(OH)3
C.三硅酸镁
D.苯甲酸钠 未清1234561年前1
未清1234561年前1 -
 415305973 共回答了15个问题
415305973 共回答了15个问题 |采纳率86.7%解题思路:疏松剂又名泡打粉、发泡粉、发酵粉和速发粉.主要用于蛋糕、油条、包子、饼干、桃酥类等面制品的快速制作,具有产气多、用量少、蓬松快、色泽好的特点,是理想的复合疏松剂,常见的疏松剂有NaHCO3、碳酸钠,抗酸药是降低胃内酸度从而降低胃蛋白酶的活性和减弱胃液消化作用的药物.A.NaHCO3既可作疏松剂也可用作抗酸药,故A正确;
B.Al(OH)3不能作疏松剂,故B错误;
C.三硅酸镁可做抗酸药,不能作疏松剂,故C错误;
D.苯甲酸钠是防腐剂,不是疏松剂和抗酸药,故D错误.
故选A.点评:
本题考点: 药物的主要成分和疗效.
考点点评: 本题考查疏松剂和抗酸药,题目难度不大,注意常见的疏松剂有NaHCO3、碳酸钠.1年前查看全部
- 由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.
由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.
查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
I.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
(1)I中气全A可使澄清石灰水变浑浊,A的化学式是______.
(2)由I、Ⅱ判断X一定不含有的元素是磷、______.
(3)Ⅲ中生成B的离子方程式是______.
(4)Ⅳ中B溶解的离子方程式是______.
(5)沉淀C的化学式是______.
(6)若上述n(A):n(B):n(C)=1:1:3,则X的化学式是______. wangchunbin211年前1
wangchunbin211年前1 -
 hyl16 共回答了13个问题
hyl16 共回答了13个问题 |采纳率76.9%解题思路:Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
Ⅱ、X中一定不含Na,因为Na的焰色为黄色.
Ⅲ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅳ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅴ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,故答案为:CO2;
(2)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,一定不含Na,因为Na的焰色为黄色,故答案为:钠、硅;
(3)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,故答案为:Al3++3NH3•H20═Al(OH)3↓+3NH4+;
(4)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,故答案为:Mg (OH)2;
(6)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
故答案为:Mg3 Al(OH)7 CO3.点评:
本题考点: 探究物质的组成或测量物质的含量;离子方程式的书写;常见离子的检验方法;复杂化学式的确定.
考点点评: 本题考查抗酸药成分的探究实验,题目较为综合,本题易错点为第(6)题,根据质量守恒定律解答.1年前查看全部
- 铝碳酸镁是一种天然矿物,它最广泛的用途是作为新型抗酸药,用于治疗胃溃疡、胃酸过多症等,其化学式为Al2Mg6(OH)xC
铝碳酸镁是一种天然矿物,它最广泛的用途是作为新型抗酸药,用于治疗胃溃疡、胃酸过多症等,其化学式为Al2Mg6(OH)xCO3•4H2O.其中x为( )
A.15
B.16
C.17
D.18 家庭智1年前1
家庭智1年前1 -
 zlz392 共回答了16个问题
zlz392 共回答了16个问题 |采纳率87.5%解题思路:根据在化合物中正负化合价代数和为零,进行解答本题.根据在化合物中正负化合价代数和为零,铝显+3、镁显+2、氢氧根显-1、碳酸根显-2,可知Al2Mg6(OH)xCO3•4H2O中x的值为:(+3)×2+(+2)×6+(-1)×x+(-2)=0,则x=16.
故选B.点评:
本题考点: 化学式的书写及意义;常见元素与常见原子团的化合价;有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合物中正负化合价代数和为零的原则进行计算的能力.1年前查看全部
- 29.人胃酸过多会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
29.人胃酸过多会引起很多胃病.下图为某抗酸药包装标签上的部分文字,请回答下列问题.
(1)该药“嚼碎后吞服”的原因是:
.
(2)某同学为了测定该药中氢氧化铝的质量分数进行如下几步操作:取一片药片(药片质量为0.5克)研碎后用20ml蒸馏水溶解,然后用质量分数为5%,密度为1.02 g/mL的盐酸与其反应(药片中其它成分不与盐酸反应),测得实验中反应掉的盐酸体积为6.0 mL.通过计算判断该药片中氢氧化铝的含量是否达到标注.(标注为每片含有氢氧化铝250mg )
略- - 那我找你干甚? a56447881年前1
a56447881年前1 -
 寻找母狮 共回答了15个问题
寻找母狮 共回答了15个问题 |采纳率86.7%1、由大颗粒变成小颗粒,增大反应速率
2、Al(OH)3 + 3HCl == AlCl3 + 3H2O
78 109.5
x 6.0*1.02*5%
解得x=0.218g=218mg<250mg
没有达标1年前查看全部
- 生活中常用药品很多,如:①碘酒、②青霉素、③阿司匹林、④葡萄糖注射液、⑤抗酸药(主要成分为碳酸氢钠).
生活中常用药品很多,如:①碘酒、②青霉素、③阿司匹林、④葡萄糖注射液、⑤抗酸药(主要成分为碳酸氢钠).
(1)上述药品中属于抗生素的是______(填写序号)
(2)碘酒是一种常用的外用消***,其消毒原理是氧化细菌,使蛋白质______(填“水解”、“盐析”或“变性”)
(3)碳酸氢钠可以缓解由于胃酸过多所导致的胃部不适.写出其发挥功效时的化学反应方程式:______.
(4)阿司匹林化学名为乙酰水杨酸,结构式为: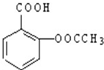 ,难溶于水.为了使疗效更好,它可与______(写化学式)反应制得易溶于水的钠盐,称为可溶性阿司匹林.
,难溶于水.为了使疗效更好,它可与______(写化学式)反应制得易溶于水的钠盐,称为可溶性阿司匹林.  猪再飞1年前1
猪再飞1年前1 -
 redmaple4u 共回答了20个问题
redmaple4u 共回答了20个问题 |采纳率90%解题思路:(1)青霉素是抗生素;
(2)蛋白质遇碘酒发生变性;
(3)碳酸氢钠中有碳酸根离子,能与酸溶液反应;
(4)乙酰水杨酸含有酯基和羧基.(1)青霉素是抗生素,故答案为:②;
(2)蛋白质遇碘酒发生变性,可用于外用消毒,故答案为:变性;
(3)碳酸氢钠中有碳酸根离子,能与酸溶液反应:NaHCO3+HCl═NaCl+H2O+CO2↑,故答案为:NaHCO3+HCl═NaCl+H2O+CO2↑;
(4)乙酰水杨酸含有酯基和羧基,乙酰水杨酸在碱性条件下反应生成水杨酸钠和乙酸钠,故答案为:NaOH.点评:
本题考点: 药物的主要成分和疗效.
考点点评: 本题考查药物的主要成分和疗效,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.1年前查看全部
- (2014•株洲)人体胃酸过多会引起胃病.如图所示为某抗酸药包装标签上的部分文字,请回答下列问题.
 (2014•株洲)人体胃酸过多会引起胃病.如图所示为某抗酸药包装标签上的部分文字,请回答下列问题.
(2014•株洲)人体胃酸过多会引起胃病.如图所示为某抗酸药包装标签上的部分文字,请回答下列问题.
(1)Al(OH)3的相对分子质量为______.
(2)经测定,每片该抗酸药实含氢氧化铝234mg.计算一片该抗酸药可消耗7.3%的盐酸多少克(请写出计算过程)? 希希151年前1
希希151年前1 -
 aigo半导体 共回答了25个问题
aigo半导体 共回答了25个问题 |采纳率84%解题思路:(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式计算即可.(1)氢氧化铝Al(OH)3的相对分子质量是27+(16+1)×3=78;
故答案为:78;
(2)每片该抗酸药实含氢氧化铝的质量=234mg=0.234g.
设可消耗7.3%的盐酸的质量为x.
Al(OH)3+3HCl═AlCl3+3H2O
78 109.5
0.234gx×7.3%
[78/0.234g=
109.5
x×7.3%]
x=4.5g
答:可消耗7.3%的盐酸的质量为4.5g.点评:
本题考点: 根据化学反应方程式的计算;相对分子质量的概念及其计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2014•孟津县一模)人的胃液里含有适量盐酸,服用含MgCO3的抗酸药可治疗胃酸过多症,有关反应的化学方程式为____
(2014•孟津县一模)人的胃液里含有适量盐酸,服用含MgCO3的抗酸药可治疗胃酸过多症,有关反应的化学方程式为______;该抗酸药说明书上标明服用方法为______.钢铁厂利用焦炭与二氧化碳反应生成一种还原性气体C+CO2
2CO高温 .C+CO2;一氧化碳跟氧化铁在高温下反应生成铁的化学方程式为
2CO高温 .Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 . 新用户131年前1
新用户131年前1 -
 WWW13434488 共回答了23个问题
WWW13434488 共回答了23个问题 |采纳率95.7%解题思路:碳酸镁与盐酸的反应类似于碳酸钙与盐酸的反应,嚼服后药品颗粒变小增大了与胃酸的接触面积更有利于反应的进行.根据反应物、生成物以及反应条件,然后根据方程式的书写规则进行书写.碳酸镁与盐酸的反应符合碳酸盐与酸的反应规律,产物回事氯化镁、水、及二氧化碳,嚼服的好处是增大了反应物的接触面积,使反应的速度变快使药效发挥的更好.焦炭与二氧化碳反应生成一氧化碳气体,方程式为:C+CO2
高温
.
2CO;一氧化碳与氧化铁反应会生成铁与二氧化碳,Fe2O3+3CO
高温
.
2Fe+3CO2
故答案为:MgCO3 +2HCl═MgCl2+CO2↑+H2O;嚼食;C+CO2
高温
.
2CO;Fe2O3+3CO
高温
.
2Fe+3CO2点评:
本题考点: 酸的化学性质;铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是一道生活实际考查题,解题的关键是利用所学的化学知识对相关的现象的分析及理解,属基础性知识考查题.1年前查看全部
- 如图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
 如图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
如图是某药厂生产的一种抗酸药(治疗胃酸过多的药物)的说明书的部分内容.阅读后回答下列问题.
现取4片药片碾碎后,加到烧杯中,再往烧杯中加入60g稀盐酸,完全反应后,烧杯中物质的总质量为65.6g,(药品的其它成分不溶于水,也不参加反应),求:
(1)生成二氧化碳的质量.
(2)此药片中碳酸氢钠的质量分数.
实验室开放日,小明与小娜,小佳、小华、小丽等同学来到实验室,看到实验桌上摆放着四瓶无标签的试剂,分别是两瓶固体和两瓶液体,决定对“固体与液体”之间的反应进行一些探究.
(1)小娜同学从一瓶固体和一瓶液体中各取少量试剂于试管中进行混合,立即产生了一种无色气体,对气体是何物质,同学们进行大胆的猜想,小佳同学的猜想可能是:
①______;②______; ③______.
(2)小明想设计一个实验证明小佳同学猜想①是正确的,实验设计如下:
(3)小丽同学从另外两瓶试剂中各取少量试剂于试管中,发现混合后,固体发生了变化,但无气泡放出.同学们对加入试管中的固体和液体从不同的反应类型、物质类别等方面进行了大胆的猜想:实验步骤 现象及结论
猜想一:______
猜想二:______
猜想三:______. selinaella1年前1
selinaella1年前1 -
 怪魔女 共回答了22个问题
怪魔女 共回答了22个问题 |采纳率81.8%解题思路:根据标签可知药物的主要成分为碳酸氢钠,碳酸氢钠可以与盐酸反应生成氯化钠、水和二氧化碳气体;
因此完全反应后,烧杯中物质的总质量会因反应放出二氧化碳气体而减小,减少的质量即为反应放出的气体二氧化碳的质量;利用二氧化碳的质量,根据反应的化学方程式,可计算出4片药物中含碳酸氢钠的质量.
根据实验室制取气体方法的反应原理,发生装置,收集,检验,及反应类型进行分析解答本题.
(1)固体和液体反应生成气体,气体可能是氧气、氢气、二氧化碳等;
(2)根据验证气体的方法考虑回答;
(3)从不同类型的固体和液体反应考虑,条件是生成物中要没有气体.生成二氧化碳的质量:60g+2.5g/片×4片-65.6g═4.4g
设4片药片中碳酸氢钠的质量为x
NaHCO3+HCl═NaCl+H2O+CO2↑
84 44
x 4.4g
[84/44=
x
4.4g]
x=8.4g
碳酸氢钠的质量分数为=[8.4g/4片×2.5g/片]×100%=84%
(1)二氧化碳、氢气、氧气都能通过固体和液体反应制得,故可填二氧化碳,氢气,氧气;
(2)检验二氧化碳用澄清石灰水,看石灰水是否变浑浊;
(3)因为气球是密度比空气小,用如图收集时要从a端进入;
(4)一瓶固体和一瓶液体中各取少量试剂于试管中,发现混合后固体发生了变化,但无气泡放出,可推测:固体是金属,液体盐溶液;固体是金属氧化物,液体是酸溶液;固体是碱,液体是酸溶液,两种发生了中和反应等;
答案:
(1)生成二氧化碳的质量是4.4g;
(2)碳酸氢钠的质量分数为84%;
(1)①二氧化碳,②氢气,③氧气
(2)如①是CO2
实验步骤现象及结论
将气体通入澄清石灰水中石灰水变浑浊,证明是二氧化碳(3)猜想一:金属与盐溶液发生置换反应;
猜想二:金属氧化物与酸溶液反应;
猜想三:碱与酸溶液发生复分解反应;点评:
本题考点: 根据化学反应方程式的计算;缺失标签的药品成分的探究;常见气体的检验与除杂方法.
考点点评: 含碳酸根的盐称为碳酸盐,碳酸盐可与盐酸、硫酸等酸反应放出二氧化碳气体.回答开放性试题时,要结合所学知识,对答案进行大胆猜想,然后利用物质的性质等进行验证,从而得出正确答案.1年前查看全部
- 1.尼龙是天然纤维吗?2.那个是抗酸药?A 青霉素 B阿司匹林 C碳酸镁 D硫酸亚铁3.苯能使KMNO4溶液褪色吗?4.
1.尼龙是天然纤维吗?
2.那个是抗酸药?
A 青霉素 B阿司匹林 C碳酸镁 D硫酸亚铁
3.苯能使KMNO4溶液褪色吗?
4.乙酸含碳氧双键吗? strong1231年前6
strong1231年前6 -
 ww72226 共回答了20个问题
ww72226 共回答了20个问题 |采纳率95%1.不是
聚酰胺俗称尼龙(Nylon),英文名称Polyamide(简称PA),是分子主链上含有重复酰胺基团—[NHCO]—的热塑性树脂总称.包括脂肪族PA,脂肪—芳香族PA和芳香族PA.其中,脂肪族PA品种多,产量大,应用广泛,其命名由合成单体具体的碳原子数而定.
2.C
青霉素是指分子中含有青霉烷,能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用的一类抗生素.
青霉素又被称为青霉素G、peillin G、 盘尼西林、配尼西林、青霉素钠、苄青霉素钠、青霉素钾、苄青霉素钾.
阿司匹林:
镇痛、解热 消炎、抗风湿 抗血栓 关节炎 皮肤粘膜淋巴结综合症
碳酸镁
白色单斜结晶或无定形粉末.无毒、无味,在空气中稳定.相对密度2.16.微溶于水,水溶液呈弱碱性,在水中的溶解度为0.02%(15℃).易溶于酸和铵盐溶液.遇稀酸即分解放出二氧化碳.一般情况下微溶于水
硫酸亚铁
医学上用作补血剂.
3.苯内部是大π键,不是双键,不能使KMNO4溶液褪色
4.含1年前查看全部
- (2010•临川区一模)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小明拿来了两种抗酸药(
(2010•临川区一模)人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小明拿来了两种抗酸药(治疗胃酸过多的药物).这两种药物说明书的部分内容如下图所示.
(1)患者服用药片时应嚼碎后服用的原因是______;说明书
主要成分:氢氧化镁
每片含量:250mg氢氧化镁
适 应 症:用于缓解胃酸过多引起的胃痛
用 法:嚼碎后服用说明书
主要成分:碳酸氢钠
每片含量:250mg碳酸氢钠
适 应 症:用于缓解胃痛
用 法:嚼碎后服用
注意事项:胃溃疡患者慎用
(2)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是______;
(3)两种药品每片能消耗胃酸更多的是______(填化学式).
(4)服用氢氧化镁的患者可能出现“轻泻”的原因是______. vdj126_1br_7_4c21年前1
vdj126_1br_7_4c21年前1 -
 jiyuqin 共回答了18个问题
jiyuqin 共回答了18个问题 |采纳率83.3%解题思路:物质间反应时,接触面积越大,反应的速度越快;碳酸盐与酸反应能生成二氧化碳气体,生成的二氧化碳使胃中气压增大,可能引起胃穿孔,加大病情;根据药品的主要成分与盐酸的反应进行分析;Mg(OH)2与胃酸作用生成氯化镁,溶液中的镁离子刺激肠道蠕动,故具有轻度腹泻作用.(1)物质间反应时,接触面积越大,反应的速度越快,所以嚼碎后的目的是增大与胃酸的接触面积或与胃酸充分反应;
(2)由于这些碳酸盐与胃酸反应能产生二氧化碳气体,加重胃溃疡病情,所以患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药;
(3)比较下面两个反应:
NaHCO3+HCl═NaCl+H2O+CO2↑
84 36.5
168 73
Mg(OH)2+2HCl═MgCl2+2H2O
58 73
从上面的两个反应可以看出,消耗等质量的盐酸需要碳酸氢钠的质量多.
(4)Mg(OH)2与胃酸作用生成氯化镁,溶液中的镁离子刺激肠道蠕动,故具有轻度腹泻作用.
故答案为:(1)增大药物与胃酸反应的接触面;
(2)碳酸盐与胃酸反应产生二氧化碳气体,可能加重胃溃疡病情;
(3)Mg(OH)2;
(4)Mg(OH)2与胃酸作用生成氯化镁,溶液中的镁离子刺激肠道蠕动,故具有轻度腹泻作用.
或Mg(OH)2和HCl反应生成MgCl2和H2O,出现“轻泻”和MgCl2或Mg2+有关点评:
本题考点: 家庭常备药品;酸的化学性质.
考点点评: 本题考查了化学知识在医药方面的应用,完成此题,可以依据酸和碱反应的有关知识进行.1年前查看全部
大家在问
- 1小明再计算25+5的时候,他误将+号看成-号,结果得17,那25+X的正确答案是多少
- 2潜水艇竖直下沉时,向水底发射出持续时间为△t1的某脉冲声波信号,经过一段时间,该潜水艇接受到了反射信号,持续时间为△t2
- 3小林,小红,小丽三个人的年龄正好是三个连续的奇数,他们的年龄和是39岁,他们中最小的是多少岁?最大的是多少岁?
- 41905年至1907年资产阶级革命派与改良派进行论战的意义及革命派的局限性是?
- 5在匀变速直线运动 如果加速度a和初速度V0方向相反,当运动时间 时,瞬时速度V和初速V0同向?反向呢?
- 6双曲线x^2-y^2=1的两焦点为F1,F2,点P在双曲线上,若PF1⊥PF2,则△F1PF2的面积为
- 7我都没办法了~六年三班上学期女生人数是男生人数的十二分之十三,这学期又转来2名女生,这时女生的人数正好是全班人数的50%
- 8天空中飞翔的鸟是靠什么来维持飞行的(A 风能 B太阳能 C 机械能
- 9意识不能算作是物质.可又说世界除了运动着的物质之外什么都没有,困扰啊
- 10仿写 我再也不能理解那些沉迷于虚无世界的网虫,他们.
- 11居然的近义词吩咐的近义词
- 12这儿的河水很清,清得连水底的的鹅卵石都看得清清楚楚.缩句
- 13阅读下面的“哲思小语”,模仿其思路,为“气球”和“卵石”拟两则具有哲思的话.
- 141.已知m-n=-2,则-m+n=多少?4-2m+2n=多少?2.已知a-b=5,a·b=1,求以下代数式的值.(2a+
- 15既能与盐酸反应生成X又能与氢氧化钙反应生成Y,且X Y能反应
