在海水提溴实验中为什么要用空气和水蒸汽吹出溴?为什么氯离子不会被吹出
 wzj00000002022-10-04 11:39:541条回答
wzj00000002022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 拌鬼不用化装 共回答了1个问题
拌鬼不用化装 共回答了1个问题 |采纳率100%- 液溴具有挥发性,氯离子溶于水
- 1年前
相关推荐
- 海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO 2 发生作用以达到富集的目的,化学反应为Br 2 +SO 2 +2
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO 2 发生作用以达到富集的目的,化学反应为Br 2 +SO 2 +2H 2 O═2HBr+H 2 SO 4 ,下列说法正确的是( ) A.Br 2 在反应中表现氧化性 B.SO 2 在反应中被还原 C.Br 2 在反应中失去电子 D.1mol氧化剂在反应中得到1mol电子  rebzhou1年前1
rebzhou1年前1 -
 独剑舞孤影 共回答了19个问题
独剑舞孤影 共回答了19个问题 |采纳率94.7%A.因Br元素的化合价由0降低为-1价,Br 2 在反应中作氧化剂,表现氧化性,故A正确;
B.S元素的化合价由+4价升高到+6价,SO 2 作还原剂,被氧化,故B错误;
C.Br元素的化合价由0降低为-1价,则Br 2 在反应中得到电子,故C错误;
D.1mol氧化剂在反应中得到1mol×2×(1-0)=2mol,故D错误;
故选D.1年前查看全部
- 求海水提溴的简要流程,
 cpa51go1年前0
cpa51go1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一.海水提溴实验方案 1用-----法将海水浓缩,用浓硫酸将浓缩海水酸化.2想算话的海水中通入适量的-----,使溴离子
一.海水提溴
实验方案 1用-----法将海水浓缩,用浓硫酸将浓缩海水酸化.
2想算话的海水中通入适量的-----,使溴离子转化为溴单质.
3向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛-----溶液的吸收塔内.
4向吸收塔内中溶液内通入适量的氯气.
5用四氯化碳【或苯】萃取吸收塔中的溶液里的-----单质.
化学方程式:2NaBr+CI2=
Br2+so2+2H2O=
2HBr+ci2=
二.为了从海水中提取镁的方法的首先是海水中的镁离子转化为氢氧化镁沉淀,从化学知识的角度和经济效应考虑,可在海水中加入的物质是-----.
A.氢氧化钠 B.氢氧化钾 C.氧化钙 D.氧化钠
三.为了从海带中提取碘,某研究兴趣小组设计并进行如下实验.
【海带】1灼烧【海带夹】2侵泡【还带灰悬浊液】3【含碘离子溶液】4二氧化锰+稀硫酸【含碘水溶液】5提取碘【含碘苯溶液】6【单质碘】
1.步骤一灼烧海带时,出三脚架外,还需要用到的实验仪器是-------
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
2.步骤三的实验操作名称是-------,步骤六的目的是从含碘苯溶液中分离出碘单质和回收苯,还步骤的实验操作名称是-------.
3.步骤四反应的离子方程式-----------------.
4.步骤五中某学生选择用苯还提取碘的理由是------------.
5请设计一种检验提取碘后得水溶液中是否含有单质碘的简单方法-----------------------.
四.目前,从海水中提取的溴占世界溴年生产总量的三分之一左右.海水中溴主要以NaBr的形式存在,工业上从海水中提取溴用下列方法:
1.海水中加入氯水使NaBr氧化,反应的离子方程式是--------------------------.
2.向溶液中鼓入空气,将Br2吹出,用纯碱吸收,反应的方程式是----------------------.
3.将2所得的溶液用稀硫酸酸化,使NaBr,NaBrO3转化为溴单质,反应的离子方程式为---------------------.
4.这样制得溴中含有少量的CI2,除去CI2的方法为--------------.
5.若海水中溴含量为百分之零点零七【质量分数】,则海水中溴化钠的质量分数为----------.
如果实行海水淡化来供应居民饮用水,下列方法在原理上完全不可行的是---------.
A加明矾使海水中的盐沉淀出来而淡化
B利用太阳能是海水升温,通过蒸馏而使其淡化
C将海水通过离子交换树脂以除去个离子
D将海水缓慢降温凝固以获得淡水 ssb0081年前1
ssb0081年前1 -
 随便11 共回答了12个问题
随便11 共回答了12个问题 |采纳率91.7%一 1、蒸馏法 2、氯气 3、二氧化硫 5、溴
2NaBr+CI2=2NaCl+Br2
Br2+so2+2H2O=H2SO4+2HBr
2HBr+ci2=2HCl+Br
二 C
三 1、BDE 2、过滤 蒸发 3、2H2O+MnO2+硫酸根离子+2碘离子=碘+锰离子+硫酸根离子+4OH-
4、碘在水中的溶解度比笨中小 5、加淀粉溶液
四 1、2溴离子+CL2=2氯离子+Br2
离子方程式不好打,用文字代替了,你的问题太长了,后面的你多想想1年前查看全部
- 下列叙述中不正确的是( ) A.可以用Si 3 N 4 、Al 2 O 3 制作高温结构陶瓷制品 B.从“海水提溴”,
下列叙述中不正确的是( ) A.可以用Si 3 N 4 、Al 2 O 3 制作高温结构陶瓷制品 B.从“海水提溴”,但得到的液溴中常溶有少量氯气,除去氯气应加入适量的NaBr C.石油、汽油、聚乙烯、甲苯物质中,汽油有固定沸点 D.用乙醇、溴水、NaOH溶液、盐酸中的溴水来鉴别裂化汽油和直馏汽油  倪尘1年前1
倪尘1年前1 -
 苏州小E 共回答了14个问题
苏州小E 共回答了14个问题 |采纳率92.9%A.因氮化硅陶瓷、三氧化二铝陶瓷为常见的新型陶瓷材料,故A正确;
B.氯气有强氧化性,可与NaBr反应生成氯化钠和溴单质,故B正确;
C.汽油主要成分为C4~C12脂肪烃和环烃类,并含少量芳香烃和硫化物,是混合物,没有固定沸点,故C错误;
D.直馏汽油:色层在上,水在下;裂化汽油:能使溴水褪色最终得到分层的2层无色液体,故D正确.
故选C.1年前查看全部
- 关于海水提取溴~海水提溴 每步的作用和方程式~比如 空气吹出的作用是什么~用SO2吸收的作用是什么~
 月亮下的灯塔1年前1
月亮下的灯塔1年前1 -
 wen9992008 共回答了16个问题
wen9992008 共回答了16个问题 |采纳率100%初中化学旧版的《教师教学用》书里面有……
空气和水蒸气是为了把溴吹入吸收塔
二氧化硫是为了生成氢溴酸 这就提纯了
最后再用氯气将氢溴酸氧化成溴
还可以看这里1年前查看全部
- 空气吹出法工艺,是目前海水提溴的最主要方法之一
空气吹出法工艺,是目前海水提溴的最主要方法之一
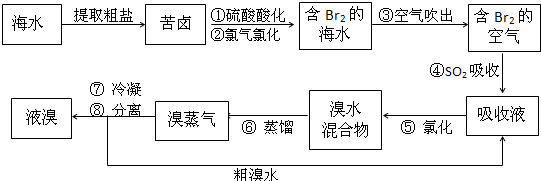
步骤1中用硫酸酸化可提高cl2的利用率,为什么?
答案是:酸化可以防止cl2 br2 h2o反应
但是我查了一下,还是觉得h2so4可以氧化一部分Br-更合适
 gaowangwang1年前1
gaowangwang1年前1 -
 rougeyan 共回答了14个问题
rougeyan 共回答了14个问题 |采纳率100%H2SO4想要氧化Br-必须是浓硫酸,硫酸的氧化性很弱.
5Cl2+Br2+6H2O=2HBrO3+10HCl
增大酸度应该是增加逆反应1年前查看全部
- 海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,
A.Br2在反应中表现氧化性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1 mol 氧化剂在反应中得到1 mol电子
化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是( ) floatsn1年前1
floatsn1年前1 -
 天空的眼泪BJ 共回答了23个问题
天空的眼泪BJ 共回答了23个问题 |采纳率78.3%选A
Br2想都不要想都是氧化性,卤族元素
So2被氧化成So4-
Br2变为Br-,得电子
D只要写出方程式就好啦
Br2+SO2+2H2O=H2SO4+2HBr
自己看看价态变化1年前查看全部
- 海水提溴时氯气的作用是什么?怎样制得粗溴?为什么制得粗溴猴,要鼓入热空气或水蒸气把溴吹出来?
 jjhhn1年前2
jjhhn1年前2 -
 yzhm78 共回答了20个问题
yzhm78 共回答了20个问题 |采纳率90%置换出Br2
2NaBr+Cl2===Br2+2NaCl
溴单质易挥发,鼓入热空气或水蒸气就可以把溴吹出来1年前查看全部
- (2009•黄浦区二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
(2009•黄浦区二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
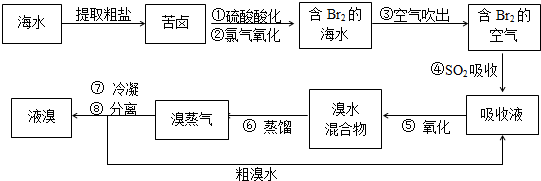
(1)溴在元素周期表中位于______周期,______族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是______.
(3)步骤④的离子方程式:______.
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-900C.温度过高或过低都不利于生产,请解释原因:______.
(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______,分离时液溴从分离器的______(填“上口”或“下口”)排出.
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是______. 之191年前1
之191年前1 -
 伤心的下雨天 共回答了18个问题
伤心的下雨天 共回答了18个问题 |采纳率88.9%解题思路:(1)根据溴在氯的下一周期,与氯在同一主族来解答;
(2)在酸性条件下不利于氯气、溴单质与水之间反应;
(3)根据了SO2的还原性和氯气的氧化性来解答;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(5)根据分液是分离两种不相溶的液体,用分液漏斗分离;
(6)海水中溴离子的浓度较少,在海水提取溴之前,必须进行海水浓缩以节约成本;(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,故答案为:第四,VIIA;
(2)氯气、溴单质与水之间能发生反应,用硫酸酸化,使氯气、溴单质和水的化学平衡左移,可提高Cl2的利用率,也能减少溴单质与水的反应,故答案为:酸化可抑制Cl2、Br2与水反应;
(3)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(5)因液溴与溴水不相溶,用分液漏斗分离,液溴在下层,从下口放出;故答案为:分液漏斗;下口;
(6)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低;
故答案为:氧化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程;点评:
本题考点: 海水资源及其综合利用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.1年前查看全部
- 在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.在有关上述工艺流程的以下化学用语中,正确的是( )
A.用电子式表示溴化氢的形成过程为:
B.海水中Br-的电子式为:
C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2═Br2+2NaCl
D.氯离子的结构示意图为:
 银色的狐狸1年前1
银色的狐狸1年前1 -
 子夜物语 共回答了14个问题
子夜物语 共回答了14个问题 |采纳率100%解题思路:A.溴化氢为共价化合物,分子中不存在阴阳离子;
B.溴离子为阴离子,其电子式中需要标出最外层电子;
C.2NaBr+Cl2═Br2+2NaCl为化学方程式,不是离子方程式;
D.氯离子最外层达到8个电子,题中表示的为氯原子.A.溴化氢分子中不存在阴阳离子,
 ,故A错误;
,故A错误;
B.溴离子最外层达到8个电子稳定结构,电子式需要标出阴离子所带电荷及最外层电子,溴离子的电子式为: ,故B正确;
,故B正确;
C.海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,故C错误;
D.氯离子最外层达到8电子稳定结构,氯离子正确的结构示意图为: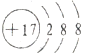 ,故D错误;
,故D错误;
故选B.点评:
本题考点: 电子式、化学式或化学符号及名称的综合.
考点点评: 本题考查了电子式、离子方程式、离子结构示意图等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确表示方法,明确离子结构示意图与原子结构示意图的表示方法及区别.1年前查看全部
- 海水提溴实验方案:(1)用______法将海水浓缩,用硫酸将浓缩的海水酸化.(2)向酸化的海水中通入适量的______,
海水提溴
实验方案:(1)用______法将海水浓缩,用硫酸将浓缩的海水酸化.
(2)向酸化的海水中通入适量的______,使溴离子转化为溴单质.
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛______溶液的吸收塔内.
(4)向吸收塔内中溶液内通入适量的氯气.
(5)用四氯化碳(或苯)萃取吸收塔中溶液里的______单质.
化学方程式:2NaBr+Cl2=______;
Br2+SO2+2H2O=______;
2HBr+Cl2=______. 热血男儿tcy1年前1
热血男儿tcy1年前1 -
 植物美白 共回答了20个问题
植物美白 共回答了20个问题 |采纳率75%解题思路:(1)海水用蒸馏方法浓缩海水,加入硫酸将浓缩的海水酸化;
(2)酸化的海水中通入适量的氯气,和溴离子发生氧化还原反应生成溴单质;
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛二氧化硫的溶液中被还原为溴化氢,向吸收塔内中溶液内通入适量的氯气氧化溴离子为溴单质;
(5)利用萃取分液方法萃取溴单质,氯气和溴化钠反应生成溴单质,溴单质被二氧化硫还原生成溴化氢和硫酸,氯气氧化溴化氢生成溴单质和氯化氢;(1)海水用蒸馏方法浓缩海水,加入硫酸将浓缩的海水酸化;
故答案为:蒸馏;
(2)酸化的海水中通入适量的氯气,和溴离子发生氧化还原反应生成溴单质,2Br-+Cl2=Br2+2Cl-;
故答案为:氯气;
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛二氧化硫的溶液中被还原为溴化氢,Br2+SO2+2H2O=H2SO4+2HBr,向吸收塔内中溶液内通入适量的氯气氧化溴离子为溴单质,2HBr+Cl2=Br2+2HCl;
故答案为:SO2;
(5)利用萃取分液方法萃取溴单质,氯气和溴化钠反应生成溴单质,2NaBr+Cl2=Br2+2NaCl,溴单质被二氧化硫还原生成溴化氢和硫酸,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,氯气氧化溴化氢生成溴单质和氯化氢,2HBr+Cl2=Br2+2HCl;
故答案为:溴,2NaBr+Cl2=Br2+2NaCl,Br2+SO2+2H2O=H2SO4+2HBr,2HBr+Cl2=Br2+2HCl;点评:
本题考点: 海水资源及其综合利用;氯、溴、碘及其化合物的综合应用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了海水提溴的工业生产过程和试剂选择,注意原理的分析判断,化学方程式书写是关键,题目较简单.1年前查看全部
- 高一化学海水提溴实验,详细步骤过程,谢谢
 蛇19781年前2
蛇19781年前2 -
 CARA23 共回答了13个问题
CARA23 共回答了13个问题 |采纳率100%空气吹出法
1.在预先经过酸化的浓缩海水中通入氯气,使溴离子成为溴单质
2.通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽与二氧化硫反应生成氢溴酸.(溴元素的富集) Br2+2H2O+SO2=2HBr+H2SO4
3.再用氯气置换1年前查看全部
- 海水提溴涉及反应:Cl2+2NaBr═Br2+2NaCl.下列说法不正确的是( )
海水提溴涉及反应:Cl2+2NaBr═Br2+2NaCl.下列说法不正确的是( )
A.NaBr是还原剂
B.Cl2是氧化剂
C.Cl2本身被氧化
D.该反应属于置换反应 冰块猫1年前1
冰块猫1年前1 -
 zhuangkezhu 共回答了10个问题
zhuangkezhu 共回答了10个问题 |采纳率90%解题思路:Cl2+2NaBr═Br2+2NaCl中,Cl元素的化合价降低,Br元素的化合价升高,以此来解答.A.Nr元素的化合价升高,则NaBr为还原剂,故A正确;
B.Cl元素的化合价降低,则Cl2为氧化剂,故B正确;
C.Cl2为氧化剂,本身被还原,故C错误;
D.该反应为单质与化合物反应生成单质与化合物,则属于置换反应,故D正确;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重基本概念的考查,题目难度不大.1年前查看全部
- 海水提镁,海水提溴,海水提碘的工艺流程和主要化学方程式
海水提镁,海水提溴,海水提碘的工艺流程和主要化学方程式
紧急 Z978Y271年前1
Z978Y271年前1 -
 glfreddie 共回答了13个问题
glfreddie 共回答了13个问题 |采纳率92.3%镁在海水中的含量仅次于氯和钠,总储量约为1.8×1015吨,主要以氯化镁和硫酸镁的形式存在.从海水中提取镁并不复杂,只要将石灰乳液加入海水中,沉淀出氢氧化镁,注入盐酸,再转换成无水氯化镁就可以了.电解海水也可以得到金属镁.海水-(结晶)-母液-(石灰乳)-Mg(OH)2-(加盐酸,浓缩,结晶)-MgCl2晶体-(脱水)-MgCl2-(电解)-Mg
Mg离子+2OH离子(生石灰+水)=Mg(OH)2沉淀
Mg(OH)2+2HCl=MgCl2+2水
MgCl2(电解)=Mg+Cl2
在海水中,溴总是以溴化镁和溴化钠的形式存在.提取溴的方法常用空气吹出法,即用硫酸将海水酸化,通入氯气氧化,使溴呈气体状态,然后通入空气或水蒸气,将溴吹出来
1.3CO32- +3Br2=5Br- +BrO3- +3CO2↑
2.BrO3- +5Br- +6H+ =3Br2+3H2O
直接从海水中提取碘.利用晒盐后的卤水也可制取碘,所采用的方法有活性炭吸附法、淀粉吸附法、硝酸银或硫酸铜沉淀法、离子交换树脂法等.某些海藻具有吸附碘的能力,如干海带中碘的含量一般为0.3%~0.5%,比海水中碘的浓度高10万倍.因此,利用浸泡液浸泡海带亦可制取碘.1年前查看全部
- 在海水提溴的过程中为什么要先将海水酸化?
 alick19861年前3
alick19861年前3 -
 汪汪110 共回答了15个问题
汪汪110 共回答了15个问题 |采纳率80%在海水提溴的过程中,要先将海水酸化,再通入氯气,将Br-氧化为Br2,离子方程式为:CI2+2Br-=2CI-+Br2 ,由于CI2和生成的Br2都能和水反应,酸化后,就能抑制CI2、Br2和水的反应.X2+H2O=可逆=HX+HXO,增加H+浓度,可使平衡逆向进行,从而抑制了反应的发生,节约了CI2,得到更多的Br2.1年前查看全部
- 空气吹出法是用于工业 空气吹出法是用于工业大规模海水提溴的常用方法.有一种生产工艺流程是:①浓缩; ②氧化,用Cl 2
空气吹出法是用于工业
空气吹出法是用于工业大规模海水提溴的常用方法.有一种生产工艺流程是:①浓缩; ②氧化,用Cl 2 将海水中的NaBr氧化成Br 2 ;③富集,用空气和水蒸气将Br 2 吹入吸收塔与吸收剂SO 2 水溶液反应生成HBr;④提取,再用Cl 2 将HBr氧化成Br 2 得到产品.从氧化还原反应的角度看,上述生产工艺流程中溴元素经历的变化是 [ ] A.①②
B.①②③
C.②④
D.①③④ cleverbabyfly1年前1
cleverbabyfly1年前1 -
 东北伴郎 共回答了17个问题
东北伴郎 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于第______周期第______族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是______.
(3)步骤④利用了SO2的还原性,反应的离子方程式为______.
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因______.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______.
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______.
(7)下图为某饮用水厂从天然水制备纯净水(用离子交换树脂除离子)的工艺流程示意图:
活性炭的作用是______;O3消毒的优点是______. 北都Hokuto1年前0
北都Hokuto1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列有关说法正确的是 A.铁的冶炼过程是通过置换反应得到单质铁 B.利用电解的方法可以从海水中获得淡水 C.海水提溴的过
下列有关说法正确的是
A.铁的冶炼过程是通过置换反应得到单质铁 B.利用电解的方法可以从海水中获得淡水 C.海水提溴的过程中不发生氧化还原反应 D.以贝壳、海水、盐酸为原料提炼金属镁的过程中不涉及置换反应  anoky_然1年前1
anoky_然1年前1 -
 妖妖nn 共回答了17个问题
妖妖nn 共回答了17个问题 |采纳率100%D
1年前查看全部
- 海水提溴的主要离子方程式是什么?
 涿清涟1年前1
涿清涟1年前1 -
 bai20004 共回答了24个问题
bai20004 共回答了24个问题 |采纳率87.5%2Br(-)+Cl2=2Cl(-)+Br21年前查看全部
- 海水提溴时通入氯气之前为什么用硫酸酸化
 ahlxx20001年前3
ahlxx20001年前3 -
 abuyue 共回答了21个问题
abuyue 共回答了21个问题 |采纳率81%置换出得溴会与水反应,如果不在酸性环境中进行反应的话就不能得到单质溴了.而且酸性环境也能先除去海水中碳酸根等类似的离子.对反应有很大帮助的.1年前查看全部
- 海水提溴的三个离子方程式
 五月柳柳1年前1
五月柳柳1年前1 -
 chenxiao 共回答了21个问题
chenxiao 共回答了21个问题 |采纳率81%(1)先将浓缩海水中的Br-用氯气氧化 Cl2+2Br- = Br2+2NaCl
(2)将溴吹入吸收塔,使溴蒸汽和二氧化硫吸收剂发生作用转变成氢溴酸得到富集溴.Br2+SO2+2H2O = 2Br- + SO42- + 4H+
(3)用氯气将富集的溴负离子氧化得到产品溴 Cl2+2Br- = Br2+2C-l1年前查看全部
- (2011•南京模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
(2011•南京模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于______周期,______族.
(2)步骤④的离子方程式:______.
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃.温度过高或过低都不利于生产,请解释原因:______.
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.若在实验室分离上述混合物的分离仪器的名称是______,分离时液溴从分离器的______(填“上口”或“下口”)排出.
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:______. 笨笨的薄荷1年前1
笨笨的薄荷1年前1 -
 虚荣的回忆 共回答了18个问题
虚荣的回忆 共回答了18个问题 |采纳率100%解题思路:空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,
(1)根据溴的原子序数为35,结合原子核外电子排布判断在周期表中的位置;
(2)Br2和SO2发生氧化还原反应生成HBr和H2SO4,以此书写离子方程式;
(3)控制在80-90℃,防止大量的Br2和水蒸气挥发;
(4)可用分液的方法分离液溴与溴水的混合物,液溴密度大于水;
(5)氯化后的海水虽然含有溴单质,但浓度低,产量低.(1)溴的原子序数为35,原子核外有4个电子层,最外层电子数为7,则位于周期表第四周期ⅦA族,
故答案为:第四,ⅦA;
(2)Br2和SO2发生氧化还原反应生成HBr和H2SO4,反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃,应为温度过高,大量水蒸气排出,溴气中水增加; 温度过低,溴不能完全蒸出,吸收率低,温度过高或过低都不利于生产,
故答案为:温度过高,大量水蒸气排出,溴气中水增加; 温度过低,溴不能完全蒸出,吸收率低;
(4)液溴与溴水的混合物分层,可用分液的方法分离液溴与溴水的混合物,液溴密度大于水,从分液漏斗下口流出,
故答案为:分液漏斗;下口;
(5)氯化后的海水虽然含有溴单质,但浓度低,产量低,应经过“空气吹出、SO2吸收、氯化”的过程进行富集,
故答案为:氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;海水资源及其综合利用.
考点点评: 本题考查溴的制取,题目难度中等,注意实验的基本操作,把握实验基本方法和注意事项.1年前查看全部
- 海水提溴中,为什么要先酸化,空气吹入法是虾米?
 左耳左月1年前1
左耳左月1年前1 -
 jackson10224 共回答了19个问题
jackson10224 共回答了19个问题 |采纳率89.5%从海水中提溴用的是氯气氧化法,氯气只有在酸性和中性条件下才有氧化性(酸性条件下氯气的利用率高).氧化出来的单质溴是液体,但很容易气化,只要用空气在底下吹,溴就会跟着空气从水中跑出来,这样就收集到了溴1年前查看全部
- 下列有关说法正确的是( )A.铁的冶炼过程是通过置换反应得到单质铁B.利用电解的方法可以从海水中获得淡水C.海水提溴的
下列有关说法正确的是( )
A.铁的冶炼过程是通过置换反应得到单质铁
B.利用电解的方法可以从海水中获得淡水
C.海水提溴的过程中不发生氧化还原反应
D.以贝壳、海水、盐酸为原料提炼金属镁的过程中不涉及置换反应 疯掉的小白1年前1
疯掉的小白1年前1 -
 牧歌飞扬 共回答了22个问题
牧歌飞扬 共回答了22个问题 |采纳率95.5%解题思路:A、铁的冶炼过程是利用一氧化碳还原氧化铁;
B、电解法得到氢气和氧气;
C、海水提溴是利用加入氧化剂氧化溴离子得到溴单质;
D、贝壳煅烧得到生石灰,生石灰加水得到石灰乳,在海水中加入石灰乳,得到氢氧化镁;氢氧化镁与盐酸反应得到氯化镁,在氯化氢气流中干燥产物得到无水氯化镁.A、铁的冶炼过程是利用一氧化碳还原氧化铁,不是置换反应,故A错误;
B、电解法得到氢气和氧气,不能达到淡水,故B错误;
C、海水提溴是利用加入氧化剂氧化溴离子得到溴单质,过程中需要发生氧化还原反应,故C错误;
D、依据生产过程分析,贝壳煅烧得到生石灰,生石灰加水得到石灰乳,在海水中加入石灰乳,得到氢氧化镁;氢氧化镁与盐酸反应得到氯化镁,在氯化氢气流中干燥产物得到无水氯化镁,反应过程中不涉及置换反应,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用;金属冶炼的一般原理.
考点点评: 本题考查了海水资源的分析应用,主要是金属冶炼,海水提镁、提溴过程分析判断,掌握原理和过程是关键,题目难度中等.1年前查看全部
- 空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在元素周期表中位于______周期,______族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是______.
(3)步骤④的离子方程式:______.
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80-90℃.温度过高或过低都不利于生产,请解释原因______
(5)步骤⑧中溴气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______,分离时液溴从分离器的______(填“上口”或“下口”)排出.
(6)不直接用步骤②后含Br2的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氧化”的原因是______
(7)下列有关溴单质的叙述正确的是______
A.是易挥发的深红棕色液体
B.实验室少量液溴可保存在橡皮塞的棕色瓶中,并且加少量的水液封
C.可用酒精从溴水中萃取溴
D.溴可以与NaI溶液反应,置换出碘单质. ufo51841年前1
ufo51841年前1 -
 清菜虫 共回答了23个问题
清菜虫 共回答了23个问题 |采纳率91.3%解题思路:海水经分离后得到的苦卤中含有溴离子,酸化后通入氯气,发生Cl2+2Br-=Br2+2Cl-,可生成Br2,吹入空气,可将Br2分离出来,用二氧化硫吸收,发生Br2+SO2+2H2O=4H++2Br-+SO42-,起到富集的目的,然后再通入氯气,可得到浓度较大的溴,经蒸馏,可得到液溴,结合溴的性质以及题目要求解答该题.
(1)溴在氯的下一周期,与氯在同一主族;
(2)在酸性条件下不利于氯气、溴单质与水之间反应;
(3)根据了SO2的还原性和氯气的氧化性来解答;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(5)分液是分离两种不相溶的液体,用分液漏斗分离;
(6)海水中溴离子的浓度较少,在海水提取溴之前,必须进行海水浓缩以节约成本;
(7)结合溴具有强氧化性以及萃取的特点判断.海水经分离后得到的苦卤中含有溴离子,酸化后通入氯气,发生Cl2+2Br-=Br2+2Cl-,可生成Br2,吹入空气,可将Br2分离出来,用二氧化硫吸收,发生Br2+SO2+2H2O=4H++2Br-+SO42-,起到富集的目的,然后再通入氯气,可得到浓度较大的溴,经蒸馏,可得到液溴,
(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,故答案为:第四;VIIA;
(2)氯气、溴单质与水之间能发生反应,用硫酸酸化,使氯气、溴单质和水的化学平衡左移,可提高Cl2的利用率,也能减少溴单质与水的反应,故答案为:酸化可抑制Cl2、Br2与水反应;
(3)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(5)因液溴与溴水不相溶,用分液漏斗分离,液溴在下层,从下口放出;故答案为:分液漏斗;下口;
(6)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低;
故答案为:氧化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的浓缩过程;
(7)溴为红棕色液体,具有强氧化性,可置换出碘,在实验保存时,应避免使用橡胶塞,从溶液中分离出溴,应用苯或四氯化碳等与水不溶的有机溶剂,不能用酒精,只有AD符合.
故答案为:AD.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题主要以海水化学资源的利用为背景考查物质的分离和提纯,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和方法,难点中等.1年前查看全部
- 在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.有关上述工艺流程的以下化学用语中,不正确的是( )
A.海水中Br-的电子式为:
B.海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
C.Cl-的结构示意图为:
D.SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2=H2SO3+2HBr Jay_chow1年前1
Jay_chow1年前1 -
 夏天1214 共回答了20个问题
夏天1214 共回答了20个问题 |采纳率90%解题思路:A.阴离子的电子式要用[]把电子和元素符合括起来;
B.氯气和溴离子能发生置换反应;
C.氯离子核外有3个电子层,最外层有8个电子;
D.溴具有强氧化性,能和二氧化硫发生氧化还原反应.A.阴离子的电子式要用[]把电子和元素符合括起来,溴离子最外层有8个电子,其电子式为:
 ,故A正确;
,故A正确;
B.氯气和溴离子能发生置换反应生成溴和氯离子,离子反应方程式为:2Br-+Cl2=Br2+2Cl-,故B正确;
C.氯离子核外有3个电子层,最外层有8个电子,其离子结构示意图为: ,故C正确;
,故C正确;
D.溴具有强氧化性,二氧化硫具有还原性,二氧化硫和溴、水能发生氧化还原反应生成氢溴酸和硫酸,反应方程式为:2H2O+SO2+Br2=H2SO4+2HBr,故D错误;
故选D.点评:
本题考点: 电子式、化学式或化学符号及名称的综合;离子方程式的书写.
考点点评: 本题考查较综合,涉及氧化还原反应、原子结构示意图、电子式的书写等知识点,注意溴、氯气都能氧化二氧化硫.1年前查看全部
- 海水提溴,吹出后烧碱吸收又用硫酸反应,方程:BrO3- +5Br- +6H+ =3Br2+3H2O为什么没气体符号?
 木木三帮1年前1
木木三帮1年前1 -
 ilikehk 共回答了16个问题
ilikehk 共回答了16个问题 |采纳率100%没有气体生成,Br2直接溶于水了.1年前查看全部
- 空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
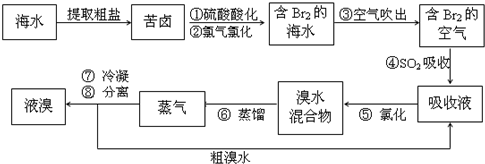
(1)溴在周期表中位于______周期______族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是______.
(3)步骤④利用了SO2的还原性,反应的离子方程式为______.
(4)步骤⑥的蒸馏过程中,温度应控制在80-90℃.温度过高或过低都不利于生产,请解释原因:______.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______.
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. xzhuzhu1年前1
xzhuzhu1年前1 -
 雪海神 共回答了16个问题
雪海神 共回答了16个问题 |采纳率100%解题思路:(1)根据溴在氯的下一周期,与氯在同一主族来解答;
(2)在酸性条件下不利于氯气、溴单质与水之间反应;
(3)根据了SO2的还原性和氯气的氧化性来解答;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(5)根据分液是分离两种不相溶的液体,用分液漏斗分离;
(6)海水中溴离子的浓度较少,在海水提取溴之前,必须进行海水浓缩以节约成本;(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,故答案为:4,VIIA;
(2)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,故答案为:酸化可抑制Cl2、Br2与水反应;
(3)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(5)因液溴与溴水不相溶,用分液漏斗分离,故答案为:分液漏斗;
(6)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.1年前查看全部
- (2014•河北区模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
(2014•河北区模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于______周期______族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是______.
(3)步骤④利用了SO2的还原性,反应的离子方程式为______.
(4)步骤⑥的蒸馏过程中,温度应控制在80-90℃.温度过高或过低都不利于生产,请解释原因:______.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______.
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. 安股1年前1
安股1年前1 -
 浪子2951 共回答了22个问题
浪子2951 共回答了22个问题 |采纳率95.5%解题思路:(1)根据溴在氯的下一周期,与氯在同一主族来解答;
(2)在酸性条件下不利于氯气、溴单质与水之间反应;
(3)根据了SO2的还原性和氯气的氧化性来解答;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(5)根据分液是分离两种不相溶的液体,用分液漏斗分离;
(6)海水中溴离子的浓度较少,在海水提取溴之前,必须进行海水浓缩以节约成本;(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,故答案为:4,VIIA;
(2)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,故答案为:酸化可抑制Cl2、Br2与水反应;
(3)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(5)因液溴与溴水不相溶,用分液漏斗分离,故答案为:分液漏斗;
(6)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;氯、溴、碘及其化合物的综合应用.
考点点评: 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力.1年前查看全部
- (2014•呼伦贝尔二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
(2014•呼伦贝尔二模)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)步骤④的离子反应方程式为______.
(2)溴微溶于水,步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,它们的相对密度相差较大.分离出液溴的实验室方法为______.
(3)步骤⑥如果在实验室中进行,需用到的玻璃仪器有______.
(4)工业生产不直接蒸馏含溴的海水得到液溴,而要经过“空气吹出、SO2吸收、氯化”,原因是______.
(5)苦卤水还可以用于制取金属镁,用化学方程式表示从苦卤水制取金属镁的反应原理MgCl2+Ca(OH)2=Mg(0H)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O;MgCl2(熔融)
Mg+Cl2↑通电 .MgCl2+Ca(OH)2=Mg(0H)2↓+CaCl2;Mg(OH)2+2HCl=MgCl2+2H2O;MgCl2(熔融).
Mg+Cl2↑通电 . dx111年前0
dx111年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1.海水提溴的三个步骤___ ___和___
1.海水提溴的三个步骤___ ___和___
2.海带灰的提取液中含有碘化物,也以用氯水氧化.写出有反应的离子方程式 jintianfalishi1年前2
jintianfalishi1年前2 -
 lilinglili 共回答了20个问题
lilinglili 共回答了20个问题 |采纳率95%1.浓缩,氧化,提取
2.2I- + Cl2=I2+2Cl-
话说我也是高一1年前查看全部
- 下列叙述中不正确的是( )A.可以用Si3N4、Al2O3制作高温结构陶瓷制品B.从“海水提溴”,但得到的液溴中常溶有
下列叙述中不正确的是( )
A.可以用Si3N4、Al2O3制作高温结构陶瓷制品
B.从“海水提溴”,但得到的液溴中常溶有少量氯气,除去氯气应加入适量的NaBr
C.石油、汽油、聚乙烯、甲苯物质中,汽油有固定沸点
D.用乙醇、溴水、NaOH溶液、盐酸中的溴水来鉴别裂化汽油和直馏汽油 unde1年前1
unde1年前1 -
 lui1020 共回答了11个问题
lui1020 共回答了11个问题 |采纳率72.7%解题思路:A.氮化硅陶瓷、三氧化二铝陶瓷为常见的新型陶瓷材料;
B.氯气有强氧化性;
C.纯净物有固定的熔沸点;
D.根据溴水的性质分析,溴水具有氧化性,易溶于有机溶剂,能与不饱和烃发生加成反应.A.因氮化硅陶瓷、三氧化二铝陶瓷为常见的新型陶瓷材料,故A正确;
B.氯气有强氧化性,可与NaBr反应生成氯化钠和溴单质,故B正确;
C.汽油主要成分为C4~C12脂肪烃和环烃类,并含少量芳香烃和硫化物,是混合物,没有固定沸点,故C错误;
D.直馏汽油:色层在上,水在下;裂化汽油:能使溴水褪色最终得到分层的2层无色液体,故D正确.
故选C.点评:
本题考点: 石油的分馏产品和用途;氯、溴、碘及其化合物的综合应用;无机非金属材料;石油的裂化和裂解.
考点点评: 本题考查新型陶瓷材料、氯气的性质、汽油的成分等,难度不大,注意直馏汽油不含双键,裂化汽油含有双键.1年前查看全部
- (2013•绵阳模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下,其中不正确的是( )
(2013•绵阳模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下,其中不正确的是( )

A.步骤①中用硫酸酸化可防止Cl2、Br2与水反应
B.步骤④的离子方程式Br2+SO2+H2O=2H++2Br-+SO42-
C.溴在周期表中位于4周期VIIA族
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗 dxa_0011年前1
dxa_0011年前1 -
 布兰妮二世 共回答了24个问题
布兰妮二世 共回答了24个问题 |采纳率87.5%解题思路:A.步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生;
B.步骤④发生SO2+Br2+2H2O=2HBr+H2SO4;
C.溴的原子序数为35,原子结构中有4个电子层,最外层电子数为7;
D.实现大量液溴和少量溴水分离的方法是分液法.A.步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生,即步骤①中用硫酸酸化可防止Cl2、Br2与水反应,故A正确;
B.步骤④发生SO2+Br2+2H2O=2HBr+H2SO4,离子反应为Br2+SO2+2H2O=4H++2Br-+SO42-,故B错误;
C.溴的原子序数为35,原子结构中有4个电子层,最外层电子数为7,所以溴在周期表中位于4周期VIIA族,故C正确;
D.实现大量液溴和少量溴水分离的方法是分液法,采用的仪器为分液漏斗,操作时下层液体必须从下口流出,上层液体从上口倒出,故D正确;
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查海水提溴,把握流程中发生的化学反应及混合物分离方法为解答的关键,步骤①为解答的难点,注重工业流程和化学反应原理的考查,题目难度中等.1年前查看全部
- 化工生产中用氯气作氧化剂进行海水提溴,离子方程式
 pphail1年前1
pphail1年前1 -
 袂拍ss 共回答了21个问题
袂拍ss 共回答了21个问题 |采纳率100%Cl2 + 2Br-==Br2 + 2Cl-1年前查看全部
- 海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,反应方程式为Br2+SO2+2H2O=2
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,反应方程式为Br2+SO2+2H2O=2HBr+H2SO4.下列说法正确的是( )
A.Br2在反应中被氧化
B.SO2在反应中表现还原性
C.Br2是还原剂
D.1mol氧化剂在反应中失去2mol电子 sam07121年前1
sam07121年前1 -
 无心秋叶 共回答了18个问题
无心秋叶 共回答了18个问题 |采纳率83.3%解题思路:反应Br2+SO2+2H2O=2HBr+H2SO4中,Br元素化合价降低,被还原,Br2为氧化剂,S元素化合价升高,被氧化,SO2为还原剂,结合元素化合价的变化解答该题.A.Br元素化合价降低,被还原,故A错误;
B.S元素化合价升高,被氧化,SO2为还原剂,故B正确;
C.Br2是氧化剂,故C错误;
D.氧化剂在反应中得到电子,故D错误.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.1年前查看全部
- 空气吹出法是用于工业大规模海水提溴的常用方法。有一种生产工艺流程是:①浓缩; ②氧化,用Cl 2 将海水中的NaBr氧化
空气吹出法是用于工业大规模海水提溴的常用方法。有一种生产工艺流程是:①浓缩; ②氧化,用Cl 2 将海水中的NaBr氧化成Br 2 ;③富集,用空气和水蒸气将Br 2 吹入吸收塔与吸收剂SO 2 水溶液反应生成HBr;④提取,再用Cl 2 将HBr氧化成Br 2 得到产品。从氧化还原反应的角度看,上述生产工艺流程中溴元素经历的变化是 [ ]A.①②
B.①②③
C.②④
D.①③④ 在昼为影1年前1
在昼为影1年前1 -
 SCORM 共回答了17个问题
SCORM 共回答了17个问题 |采纳率94.1%B1年前查看全部
- 海水提镁,海水提溴,海水提碘的工艺流程和相关化学方程式
 尼罗河之梦1年前1
尼罗河之梦1年前1 -
 wyybaby 共回答了14个问题
wyybaby 共回答了14个问题 |采纳率85.7%海水提镁,基本的工艺技术是:先把石灰乳注入到盛有海水容器中,使海水中的氯化镁变为氢氧化镁沉淀,从海水中滤出的氢氧化镁再加盐酸,使之生成氯化镁,并将其溶液煮沸、浓缩、烘干成无水氯化镁,经过电解氯化镁,便得到金属镁和氧气.
在海水中,溴总是以溴化镁和溴化钠的形式存在.提取溴的方法常用空气吹出法,即用硫酸将海水酸化,通入氯气氧化,使溴呈气体状态,然后通入空气或水蒸气,将溴吹出来
1.3CO32- +3Br2=5Br- +BrO3- +3CO2↑
2.BrO3- +5Br- +6H+ =3Br2+3H2O
粉碎的海带(含I-)→水浸泡,通入Cl2→溶于水的I2→过滤→碘水(把滤渣分离)→萃取、提纯→I21年前查看全部
- 高一化学方程式练习海水提溴的三个方程式是什么?
 妹妹拉着洋桂桂1年前1
妹妹拉着洋桂桂1年前1 -
 娟子5301 共回答了17个问题
娟子5301 共回答了17个问题 |采纳率94.1%海水提溴用空气吹出法: 2NaBr+Cl2===Br2+2NaCl Br2 + SO2 + 2H2O=2HBr +H2SO4 Cl2 + 2HBr=2HCl +Br21年前查看全部
- 海水提溴中为什么要经过盛有二氧化硫溶液的吸收塔富集后才用氯气置换出溴用四氯化炭萃取而不可以不经过...
海水提溴中为什么要经过盛有二氧化硫溶液的吸收塔富集后才用氯气置换出溴用四氯化炭萃取而不可以不经过...
海水提溴中为什么要经过盛有二氧化硫溶液的吸收塔富集后才用氯气置换出溴用四氯化炭萃取而不可以不经过二氧化硫富集就用四氯化碳萃取,这是什么道理? yue03051年前2
yue03051年前2 -
 祺哥 共回答了18个问题
祺哥 共回答了18个问题 |采纳率88.9%因为刚开始得到的Br2浓度太低了 需要富集1年前查看全部
- 海水提溴中有一部说是用水蒸气和空气将溴吹到吸收塔里达到富集的目的,问一下是怎么吹的?
海水提溴中有一部说是用水蒸气和空气将溴吹到吸收塔里达到富集的目的,问一下是怎么吹的?
海水提溴是我在化学书上看到的,说先同氯气,然后用水蒸气和空气将溴吹到吸收塔里富集,我想问一下是怎么吹的?
能不能说的详细写哦.溴在表面么?然后吹出来?还是怎么回事? 勇敢的dd1年前1
勇敢的dd1年前1 -
 老鹰尾巴 共回答了16个问题
老鹰尾巴 共回答了16个问题 |采纳率81.3%http://zhidao.baidu.com/question/18218621.html?si=21年前查看全部
- 关于用海水提溴的问题为什幺在酸性的条件下,而不是在碱性的条件下氧化Br-,原因是什么?
 hefei191年前1
hefei191年前1 -
 花钱看人 共回答了24个问题
花钱看人 共回答了24个问题 |采纳率91.7%酸性 增加H+浓度 不让Cl2与水反应分解
碱性 Cl2和OH-反应了 不好制1年前查看全部
- 海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O═2H
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,下列说法正确的是( )
A. Br2在反应中表现氧化性
B. SO2在反应中被还原
C. Br2在反应中失去电子
D. 1mol氧化剂在反应中得到1mol电子 lugdy1年前1
lugdy1年前1 -
 派钱送金财爷 共回答了14个问题
派钱送金财爷 共回答了14个问题 |采纳率78.6%解题思路:化学反应为Br2+SO2+2H2O═2HBr+H2SO4,Br元素的化合价由0降低为-1价,S元素的化合价由+4价升高到+6价,以此来解答.A.因Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,故A正确;
B.S元素的化合价由+4价升高到+6价,SO2作还原剂,被氧化,故B错误;
C.Br元素的化合价由0降低为-1价,则Br2在反应中得到电子,故C错误;
D.1mol氧化剂在反应中得到1mol×2×(1-0)=2mol,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确反应中元素的化合价的变化是解答本题的关键,题目难度不大.1年前查看全部
- (2008•龙湖区模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:
(2008•龙湖区模拟)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)步骤①中用硫酸酸化可提高Cl2的利用率,为什么?______.
(2)步骤④的离子方程式:______.
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是______,分离时液溴从分离器的______(填“上口”或“下口”)排出.
(4)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:______. 旧约年年在1年前1
旧约年年在1年前1 -
 jeffreylucy 共回答了15个问题
jeffreylucy 共回答了15个问题 |采纳率93.3%解题思路:(1)在酸性条件下不利于氯气、溴单质与水之间反应;
(2)SO2的具有还原性和氯气具有氧化性;
(3)根据分液是分离两种不相溶的液体,用分液漏斗分离;分离时上层液体从上口倒出,下层液体从下口放出;
(4)氯化后的海水虽然含有溴单质,但浓度低,产量低;(1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应;
故答案为:酸化可抑制Cl2、Br2与水反应;
(2)Br2和SO2发生氧化还原反应生成HBr和H2SO4,反应的离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)因液溴与溴水不相溶,用分液漏斗分离,液溴在下层,从下口放出;
故答案为:分液漏斗;下口;
(4)氯化后的海水虽然含有溴单质,但浓度低,产量低,应经过“空气吹出、SO2吸收、氯化”的过程进行富集;
故答案为:氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程.点评:
本题考点: 海水资源及其综合利用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题主要以海水化学资源的利用为背景,涉及平衡移动原理、氧化还原方程式的书写、物质分离,注意实验的基本操作,把握实验基本方法和注意事项.1年前查看全部
- 目前,工业上从海水中提取的溴,占世界溴年生产量的1/3左右.空气吹出法是用于工业规模海水提溴的常用方法.
目前,工业上从海水中提取的溴,占世界溴年生产量的1/3左右.空气吹出法是用于工业规模海水提溴的常用方法.
1)向预先经过浓缩的海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为——————————.
2)向上述混合液体中吹入热空气,将生成的溴吹出用纯碱溶液吸收,其反应方程式为3Br+3Na2CO3===5NaBr+NaBrO3+CO2
此反应中,Br2的作用是_________,其中被氧化的溴与被还原的溴的物质的量之比是
——————.
3)将(2)所的溶液用H2SO4酸化,是NaBr、NaBrO3中的溴转化为单质溴,且参加反应的NaBr和NaBrO3的物质的量之比为5:1,写出这一过程的化学方程式:_______________.再用——(写出一种有机溶剂的名称)从反应后的溶液中提取溴,这种分离的方法叫______,这样得到耳朵溴中还混有少量的Cl,除去的方法是向其中加_______. 只是妖女1年前1
只是妖女1年前1 -
 葡萄美酒2 共回答了22个问题
葡萄美酒2 共回答了22个问题 |采纳率95.5%(1)Cl2+2Br-=Br2+2Cl-
(2)既是氧化剂也是还原剂 1:5
(3)5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
苯或四氯化碳 萃取 饱和NaBr溶液
希望对你有所帮助,满意请采纳,亲!欢迎追问1年前查看全部
- 海水提溴会不会发生氧化还原反应
 cooldumb1年前1
cooldumb1年前1 -
 cfqtk 共回答了15个问题
cfqtk 共回答了15个问题 |采纳率93.3%首先告诉你 会!
海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,1年前查看全部
大家在问
- 1如何判定用少量的溴和足量乙醇和浓硫酸制1,2,-二溴乙烷反应已经结束
- 22009年12月7日世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中二氧化碳、甲烷和其他造成“温室效应”的气体的排放,
- 3You work hard,so yu can learn English well[改成用if----引导的从句]
- 4翻译成英语“两条鱼”谢谢
- 5(2012•工业园区一模)某燃气热水器将初温14℃、体积3×10-2m3的水加热至80℃的过程中,恰好完全燃烧了0.3m
- 6用仿佛……仿佛……造句,必需有两个仿佛!好的我会加分!
- 7(2013•黄山模拟)某同学要测量一节干电池的电动势和内电阻.他跟据老师所提供的器材画出了如图1所示的原理图;
- 8study一般现在时单词
- 9已知正项数列{An}满足Sn+Sn-1=tAn^2 +2(n>=2,t>0),A1=1,其中Sn是数列{An}的前n项和
- 102009新年随想随想作文 450字左右 不要太多 要随想的
- 11九分之四加八分之三加九分之五等于几
- 12妈妈买了一套衣服,价格是245元,其中裤子价是上衣价的40%,则这套服装中裤子的价格是多少?
- 13拉弓射箭,箭离开弦后能在空中继续飞行,是因为箭具有______,而箭最终落地是因为______的缘故,该力的施力物体是_
- 14对于别人的道歉,应该做出礼貌的哪四种表达?
- 15同义句转换:My son is four years old
