铜离子-EDTA混合液4:1(V/V)的pH值为什么为6?我在做铜离子氧化法测定维生素C,其中铜离子浓度为1mg/ml.
 yy之灰2022-10-04 11:39:541条回答
yy之灰2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xiaoyu66ty 共回答了14个问题
xiaoyu66ty 共回答了14个问题 |采纳率92.9%- Cu和EDTA络合的摩尔比是1:1,不知道EDTA的浓度是多少,铜离子水解是酸性.等于6是因为浓度.
- 1年前
相关推荐
- 往某硫酸铜溶液中加入某浓度的氨水,生成沉淀(已知沉淀中既不含氮元素,也不带结晶水).滤出沉淀之后,滤液经检验没有铜离子,
往某硫酸铜溶液中加入某浓度的氨水,生成沉淀(已知沉淀中既不含氮元素,也不带结晶水).滤出沉淀之后,滤液经检验没有铜离子,硫酸根离子的物质的量只有反应前的1/3,且c(氨根离子)=2c(硫酸根离子)
(1)沉淀物的化学式
(2)整条反应的化学方程式
————分—————————割————————————线——————
本人化学小白,希望尽量完整的解答过程.保证信用
——谢谢合作—— 未雨而绸缪1年前4
未雨而绸缪1年前4 -
 桃阿桃 共回答了10个问题
桃阿桃 共回答了10个问题 |采纳率100%(1)沉淀物的化学式 Cu3(OH)2(SO4)2
(2)3CuSO4 + 2NH3·H2O = (NH4)2SO4 + Cu3(OH)2(SO4)2↓
根据本题所给信息可知:反应物为CuSO4和NH3•H2O,产物存在于沉淀和滤液中,因滤液中c(NH4+)=2c(SO42-),NH4+的水解不予考虑,可知滤液为(NH4)2SO4,至此,本题的解题关键在于对沉淀化学式的确定.根据滤液中SO42-浓度是反应前浓度的1/3,可知有2/3的SO42-进入沉淀,再根据反应前后微粒守恒关系,可分析出沉淀的成分为Cu3(OH)2(SO4)21年前查看全部
- 为什么 在加热条件下氨气可以将氧化铜还原成金属铜但在溶液中氨气不能将铜离子还原成铜单质
 袁袁饰品1年前3
袁袁饰品1年前3 -
 zjp157 共回答了21个问题
zjp157 共回答了21个问题 |采纳率81%氨的还原性能大致与氢气相同,不加热的情况下还原性就是很弱的.常温下只有氯水、次氯酸等才能将其氧化,诸如硝酸、高锰酸钾等强氧化剂,理论上氧化氨没问题,但实际中反应速率过慢,事实上根本观察不到反应的进行.就像氢气一样,加热还原氧化铜无压力,常温下往氯化铜溶液中通却是没反应的.1年前查看全部
- 请问氢氧根离子可以与铜离子共存吗
请问氢氧根离子可以与铜离子共存吗
氢氧根离子与哪些金属不共存?
能不能把溶解性表告诉我 X坏气十足X1年前1
X坏气十足X1年前1 -
 小冰胖 共回答了15个问题
小冰胖 共回答了15个问题 |采纳率73.3%通过以上分析可知离子不能共存的原因一般是:
1.溶液里的离子间能够反应,生成难溶、难电离、易挥发的物质时,不能大量共存.
2.弱碱的金属阳离子不能存在于强碱溶液中.如NH4+、Fe3+、Cu2+、Al3+等不能与OH-大量共存.
3.弱酸根的阴离子不能存于强酸溶液中,如碳酸根、醋酸根、硫离子、偏铝酸根、次
氯酸根不能与氢离子大量共存.
4.弱酸的酸式酸根,既不能存在于强酸溶液中,也不能存在于强碱溶液中.如碳酸氢根、硫氢离子、亚硫酸氢根、磷酸氢根、磷酸二氢根等既不能与氢离子共存,也不能与氢氧根共存.
5.水解显酸性的离子与水解显碱性的离子一般不能大量共存,如三价铁离子、铝离子不能与偏铝酸根、碳酸根、碳酸氢根、硫离子等阴离子大量共存.
6.两种离子间发生氧化还原反应时不能大量共存.如在强酸溶液中二价铁离子、硫离子、碘离子不能与高锰酸根、硝酸根等离子大量共存.
7.两种离子相遇生成稳定的络离子时不能大量共存.如三价铁离子与硫氰根离子大量共存.1年前查看全部
- 2价铜离子和2价铁离子共存吗?
 nnclean1年前1
nnclean1年前1 -
 燕儿飞呀飞 共回答了23个问题
燕儿飞呀飞 共回答了23个问题 |采纳率87%共存,两者不会发生氧化还原.1年前查看全部
- 乙炔黑能否将硝酸铜溶液中的铜离子还原成铜单质
乙炔黑能否将硝酸铜溶液中的铜离子还原成铜单质
采用 什么方法能让反应发生 viviliuliu1年前4
viviliuliu1年前4 -
 海南帅哥 共回答了25个问题
海南帅哥 共回答了25个问题 |采纳率96%不行 虽然乙炔黑表面积大 活性大 但是毕竟是碳啊 在溶液中反应的活性很小
碳在溶液中是不可能还原金属离子的
只要是在溶液中 无论改变条件还是加入催化剂 都不行1年前查看全部
- 钠与硫酸铜溶液的反应根据离子氧化性来判断,氢离子的氧化性要低于铜离子的氧化性,那为什么钠投入到硫酸铜溶液中会先和氢离子反
钠与硫酸铜溶液的反应
根据离子氧化性来判断,氢离子的氧化性要低于铜离子的氧化性,那为什么钠投入到硫酸铜溶液中会先和氢离子反应?而不会置换出铜单质? deifgerres1年前5
deifgerres1年前5 -
 stevenz0908 共回答了14个问题
stevenz0908 共回答了14个问题 |采纳率100%钠要置换出铜要和铜离子接触才能反应但他会和水分子先反应,所以不会置换出铜
反而生成的是氢氧化钠
然后硫酸铜与氢氧化钠反应
钠和水反应 生成 NAOH + H2
硫酸铜与氢氧化钠
生成硫酸钠 和 氢氧化铜沉淀
以下是拓展:
有这特点的还有
K CA NA 还有氧化钠、钾、钙也可以和水反映生成对应的碱1年前查看全部
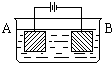
- 按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,
 按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn的物质的量之比为( )
按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn的物质的量之比为( )
A.4:1
B.3:1
C.2:1
D.1:1 niuniu09141年前1
niuniu09141年前1 -
 砍你丫的 共回答了14个问题
砍你丫的 共回答了14个问题 |采纳率92.9%解题思路:该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金中铜的物质的量,从而计算铜和锌的原子个数之比.B极上析出的是铜,B极质量增加7.68g,其物质的量=[7.68g/64g/mol]=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x,则:
Zn+Cu2+═Zn2++Cu 质量增加
1mol 1g
x0.03g
x=0.03mol.
即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:
0.03mol×2+2y=0.12mol×2
y=0.09mol,
所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,
故选:B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于电解的计算,注意把握两极的变化,从差量法与守恒的角度解答该题,题目难度中等.1年前查看全部
- 在水溶液中下列离子不能将铁氧化成亚铁离子的是 A 锌离子 B 铜离子 C 氢离子 D 阴离子
在水溶液中下列离子不能将铁氧化成亚铁离子的是 A 锌离子 B 铜离子 C 氢离子 D 阴离子
D银离子,不好意思打错了 狱卒啊1年前5
狱卒啊1年前5 -
 huizi999 共回答了15个问题
huizi999 共回答了15个问题 |采纳率86.7%选A啊,帮你分析一下啊,A:金属活动性顺序,锌强于铁,所以还原性锌大于铁,锌离子的氧化性小于铁离子.不能把铁氧化成亚铁离子.B:最简单的例子,硫酸铜溶液与铁反应,最后你会发现:铁的表面出现了一层红色的铜.溶液由天蓝色(水合二价铜离子的颜色)变为草绿色(亚铁离子的颜色)铁被氧化成亚铁离子.C:铁能与稀硫酸、稀盐酸反应,氢离子被还原变成氢气,铁被氧化成亚铁离子D:阴离子,好像大部分阴离子都没有氧化性、还原性啊.能不能把铁氧化成亚铁离子就不好说了.综上所述选A.1年前查看全部
- 如果想要在铁上镀铜,用铜做阳极、铁做阴极,电解质溶液用氯化钠为什么不行?铜离子不是比钠离子先放电的吗?
 无理争三分1年前4
无理争三分1年前4 -
 8565865 共回答了22个问题
8565865 共回答了22个问题 |采纳率86.4%电镀的话,电解质溶液要有铜离子,你的理解存在问题,把概念再看看,电镀不是点解.1年前查看全部
- 高中化学题目,帮忙解答!!将铁粉投入到盛有铜离子、银离子、铁离子的溶液中,反应完毕时,若烧杯底部有铁粉剩余,溶液中一定不
高中化学题目,帮忙解答!!
将铁粉投入到盛有铜离子、银离子、铁离子的溶液中,反应完毕时,若烧杯底部有铁粉剩余,溶液中一定不含的金属离子是(银离子、铁离子、铜离子);若烧杯中没有铁粉剩余,则溶液中一定含有的金属离子是(亚铁离子);若溶液中不含有铜离子时,则一定不含有的是(银离子、铁离子)。帮忙分析一下这个题目!
老师讲按氧化性排,银离子大于铁离子大于铜离子,可这个顺序怎么分的?按金属活动顺序表倒着来的?那顺序表中的铁是指的亚铁,铁离子应该放在什么位置?排出顺序来再怎样判断谁先反应谁后反应?
 fishman5321年前3
fishman5321年前3 -
 人马座33266 共回答了25个问题
人马座33266 共回答了25个问题 |采纳率88%同意1楼1年前查看全部
- 250g五水硫酸铜溶解在水中铜离子物质的量是多少
 lwhsky1年前1
lwhsky1年前1 -
 卿卿我我 共回答了15个问题
卿卿我我 共回答了15个问题 |采纳率93.3%铜离子的物质的量=五水硫酸铜的物质的量= 质量/摩尔质量=250/250=1mol1年前查看全部
- 氧化铜为什么是黑色的不是说什么铜离子是蓝色的么
 qq不卖艺11年前3
qq不卖艺11年前3 -
 杨小壮 共回答了18个问题
杨小壮 共回答了18个问题 |采纳率88.9%这个很复杂,可以浅显地理解为铜离子在稀溶液中的颜色为蓝色,在浓溶液中显绿色,在固体中颜色就更深了.1年前查看全部
- PH值是7,是纯水吗高纯度的纯净水,经过空气能加热,热水经过铜管,纯净水的纯度会有变化吗?铜离子会升高吗?热水不超过70
PH值是7,是纯水吗
高纯度的纯净水,经过空气能加热,热水经过铜管,纯净水的纯度会有变化吗?铜离子会升高吗?热水不超过70度,铜管10米左右. 灵欲春宵1年前1
灵欲春宵1年前1 -
 8kxdk 共回答了18个问题
8kxdk 共回答了18个问题 |采纳率100%不一定是啊!PH=7你能显示出这水的酸碱度是中型的啊!并不能显示出水是不含杂质的啊!绝对不溶解的东西是没有啊!铜离子可定会有极少量的溶解到水中啊!79度的温度肯定会加速铜离子溶解到水中啊!1年前查看全部
- 某工厂的废液中含有较多的铜离子,铁离子,锌离子,如何回收铜,并得到氯化亚铁.第一步加金属,再加盐酸.
 uu才子1年前1
uu才子1年前1 -
 zxszxs35849 共回答了17个问题
zxszxs35849 共回答了17个问题 |采纳率100%先加金属锌置换出铁和铜的混合物,然后向混合物中加入稀盐酸溶解铁.因为铜不能被稀盐酸所溶解,所以最终获得的溶液为氯化亚铁溶液,剩余金属为铜.1年前查看全部
- 铜离子和铁哪个活泼比如有下题:在CuO与Fe的混合固体中加入过量稀硫酸并微热,请问是CuO先和稀硫酸反应还是铁先和稀硫酸
铜离子和铁哪个活泼
比如有下题:在CuO与Fe的混合固体中加入过量稀硫酸并微热,请问是CuO先和稀硫酸反应还是铁先和稀硫酸反应?
请问各位是否会有氢气生成? 狼哥1111年前1
狼哥1111年前1 -
 19667249 共回答了16个问题
19667249 共回答了16个问题 |采纳率81.3%只有铁会有氢气产生,Cu没有.我认为是一起反应,只是哪边比较快的问题.我认为,和氧化铜反应比较快,因为氧化铜是偏碱性的氧化物,和酸是较容易反应的.铁虽然也会反应,但是很慢.1年前查看全部
- 能使甲基橙呈红色的溶液指含什么离子.硫化钠溶液中能否使硫酸根离子钾离子氯离子铜离子共存
 冷面兰心1年前2
冷面兰心1年前2 -
 天空永远的灰 共回答了25个问题
天空永远的灰 共回答了25个问题 |采纳率88%甲基橙是酸碱指示剂 ,变红则是酸性溶液,即H+离子使得它变红
Na2S中S2-不和Cu2+共存,因为 S2- +Cu2+===CuS 黑色沉淀1年前查看全部
- 铜离子形成四配位的化合物2个p轨道哪来的
 samuel蓝色冷调1年前1
samuel蓝色冷调1年前1 -
 看着眼熟 共回答了17个问题
看着眼熟 共回答了17个问题 |采纳率88.2%Cu2+的价电子构型3d9,d电子跃迁到高的4p轨道后空出一个3d轨道,还有空的4s,4p轨道,所以3d,4s,4p四个轨道杂化成dsp2轨道1年前查看全部
- 含大量的三价铁溶液与镁离子,铝离子,铜离子,硫酸根离子与之能够共存么?求详解
 horstchou1年前2
horstchou1年前2 -
 可乐加益力多 共回答了18个问题
可乐加益力多 共回答了18个问题 |采纳率94.4%阳离子相互之间基本都不反应,大多数都可以共存,主要看阴离子是不是弱根(弱酸的阴离子),如果是,有可能会发生相互促进水解,而导致不能共存.
刚才你提供的题目里没有出现这种情况,所以可以共存的1年前查看全部
- 被还原的能力是铜离子高还是锌离子高
被还原的能力是铜离子高还是锌离子高
另 被氧化能力是铜高还是锌高 liangyiying71年前6
liangyiying71年前6 -
 mali712 共回答了18个问题
mali712 共回答了18个问题 |采纳率83.3%氧化性等于被还原的能力铜大于锌,还原性等于被氧化的能力锌大于铜1年前查看全部
- 将铜投入一定量的稀硝酸中,铜完全溶解后溶液中的铜离子和硝酸根离子的物质的量之比为3比7,参加反应的硝酸与反应前硝酸总量的
将铜投入一定量的稀硝酸中,铜完全溶解后溶液中的铜离子和硝酸根离子的物质的量之比为3比7,参加反应的硝酸与反应前硝酸总量的物质的量之比是?
 玖壹捌记忆1年前3
玖壹捌记忆1年前3 -
 ranhongming 共回答了13个问题
ranhongming 共回答了13个问题 |采纳率100%表观看是3mol铜和8mol硝酸反应,但实质只和2mol硝酸反应,剩下6mol硝酸根未反应,假设3mol铜那么反应剩下6mol硝酸根,因为是3:7所以里面还有1mol硝酸伟参与任何反应,综合,反应掉硝酸(不包括起酸作用的,如果包括则是8:9)和反应前应是2:9.1年前查看全部
- 锌片与铜离子直接接触发生反应而影响原电池的放电效率,为什么影响,加上盐桥就不影响了?主要求解第一句!
 bobo飘特飘1年前2
bobo飘特飘1年前2 -
 yaqipei758 共回答了19个问题
yaqipei758 共回答了19个问题 |采纳率89.5%主要是电解质也有部分原因,比如你问的cu跟zn,在硝酸中,虽然说zn活泼,失电子,但是cu也会有一小部分跟硝酸反应,就会使放电效率有变化.而用了盐桥,cu所在电解质不是硝酸了,为硝酸铜,所以就避免了这个问题1年前查看全部
- 1价铜离子是什么颜色?2价呢?2价铁离子是什么颜色?3价呢?
 xzj4101年前1
xzj4101年前1 -
 快乐的小爷们 共回答了18个问题
快乐的小爷们 共回答了18个问题 |采纳率94.4%一价铜 离子,红色,二价的铜蓝色,二价亚铁离子,绿色,铁离子黄色
OK,这个要记住,判断溶液中离子共存时很有用的……1年前查看全部
- 1.有一无色未知溶液中有Ba+、Ag+,同时测的酸性很强.某学生还要鉴定此溶液中是否大量存在铜离子,铁离子,氯离子,硝酸
1.
有一无色未知溶液中有Ba+、Ag+,同时测的酸性很强.某学生还要鉴定此溶液中是否大量存在铜离子,铁离子,氯离子,硝酸根离子,硫离子,碳酸根离子,氨根离子,镁离子,铝离子,偏铝酸根离子.其实这些离子中有一部分不必鉴定就能加以否定,你认为不必鉴定的是:
铜离子,铁离子,氯离子,硫离子,碳酸根离子,偏铝酸根离子
我不能理解铜离子,铁离子.为什么呢?
2.
某溶液中由水电离产生的氢离子浓度为1*10^(-13)mol/L
为什么既可以是酸性溶液,又可以是碱性溶液?
PH不是13吗?
那怎样的离子浓度只能是酸性,只能是碱性,那拿些又二者皆可呢? 浅海深处1年前1
浅海深处1年前1 -
 asdzvasada 共回答了14个问题
asdzvasada 共回答了14个问题 |采纳率92.9%1:铜离子呈蓝色,铁离子也有颜色,题设说是无色溶液所以能直接排除.2:Ph值的定义是溶液中氢离子浓度,而不是水电离的氢离子浓度,由题目可知水的电离被抑制,而酸和碱都能抑制水的电离,你可以理解为在水中加了酸或碱使得水的电离程度减小了,所以有可能是酸有可能是碱1年前查看全部
- 铜离子写成cu2+这里的2是怎么来的?
 哈哈老林1年前1
哈哈老林1年前1 -
 dust47714 共回答了20个问题
dust47714 共回答了20个问题 |采纳率80%铜失去两个电子成为铜离子,带2个正电荷.1年前查看全部
- 求:用氨水怎么检测铜离子含量?铜离子里面不含有其他物质
 八爪鱼儿1年前1
八爪鱼儿1年前1 -
 我是阿恐 共回答了19个问题
我是阿恐 共回答了19个问题 |采纳率100%用氨水与铜离子溶液反应生成氢氧化铜沉淀测出质量
通过计算铜占氢氧化铜的质量比计算铜的含量1年前查看全部
- 按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B
按如图所示装置进行实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为( )
 A. 4:1
A. 4:1
B. 3:1
C. 2:1
D. 任意比 龙翔九洲凤相随1年前1
龙翔九洲凤相随1年前1 -
 山丹丹开花红艳艳 共回答了20个问题
山丹丹开花红艳艳 共回答了20个问题 |采纳率90%解题思路:该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金中铜的物质的量,从而计算铜和锌的原子个数之比.B极上析出的是铜,B极质量增加7.68g,其物质的量=[7.68g/64g/mol]=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x,则:
Zn+Cu2+=Zn2++Cu 质量增加
1mol1g
x0.03g
x=0.03mol.
即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设合金中铜的物质的量为y,则:
0.03mol×2+2y=0.12mol×2
y=0.09mol,
所以合金中铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,
故选B.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,侧重于电解的计算,注意把握两极的变化,从差量法与守恒的角度解答该题,题目难度中等.1年前查看全部
- 稀硝酸与铜离子方程式
 侨卡巴柏斯度1年前2
侨卡巴柏斯度1年前2 -
 一把锈菜刀 共回答了16个问题
一把锈菜刀 共回答了16个问题 |采纳率93.8%2HNO3+CU=CU(NO3)2+H2
书上都有的,更全,分类也很好了.不好好学习的孩子1年前查看全部
- 三价铁能置换铜离子吗?
 Shakespare1年前1
Shakespare1年前1 -
 xjhw 共回答了20个问题
xjhw 共回答了20个问题 |采纳率95%三价铁不能置换铜离子.
2Fe3+ +Cu=Cu2+ +2Fe2+1年前查看全部
- 选用1到5等实验操作除去酸性氯化铝溶液中的铜离子,应该是怎样的试验过程
选用1到5等实验操作除去酸性氯化铝溶液中的铜离子,应该是怎样的试验过程
1.同足量二氧化碳 2.加盐酸 3.加过量氢氧化钠溶液 4.加氯化铝溶液 5.过滤 琦小1年前2
琦小1年前2 -
 换上tt 共回答了15个问题
换上tt 共回答了15个问题 |采纳率80%3.加过量氢氧化钠溶液,得到:NaAlO2,Cu(OH)2!.
5.过滤,除去Cu(OH)2!.
1.通足量二氧化碳,得到Al(OH)3!.
5.过滤,取滤渣,得到Al(OH)3!.
2.加盐酸,得到AlCl3溶液.1年前查看全部
- 铜离子的颜色是什么.为什么不同铜盐的溶液的颜色不同呢
 全球ffff1年前4
全球ffff1年前4 -
 burn一瞬间 共回答了14个问题
burn一瞬间 共回答了14个问题 |采纳率92.9%蓝色,在水溶液中
通常,铜离子Cu2+在水溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色.而在氯化铜的溶液中,不仅有水合铜离子[Cu(H2O)4]2+,还有氯离子Cl-与铜离子结合形成的四氯合铜络离子[CuCl4]2-,该离子的颜色为黄色.
根据光学原理我们知道,蓝色和黄色的混合色为绿色,这就是为什么我们常见的一般浓度的氯化铜溶液呈绿色的原因.如果我们向氯化铜溶液中加水,则溶液中氯离子浓度变小,水合铜离子相对增多,溶液主要呈现水合铜离子的颜色(蓝色).所以我们见到的氯化铜稀溶液一般呈蓝色.
同样道理,在硝酸跟铜的反应中,稀硝酸与铜反应所得的溶液呈蓝色,而浓硝酸与铜反应所得溶液呈绿色.这是因为,浓硝酸与铜反应时,产生大量的二氧化氮气体,二氧化氮溶解在溶液中呈黄色,二氧化氮的黄色跟水合铜离子的蓝色混合就出现了我们看到的绿色.1年前查看全部
- 铜离子和氯离子能反应吗
 老式机器人1年前1
老式机器人1年前1 -
 静静79 共回答了19个问题
静静79 共回答了19个问题 |采纳率100%反应的.铜离子是蓝色的,存在大量氯离子时,是绿色的,会发生络合反应.1年前查看全部
- 如何分离铜离子和锡离子实验中需要将铜离子和锡离子分离,目前已知的方法是利用溶度积,通过控制pH分别沉淀出锡、铜,请问各位
如何分离铜离子和锡离子
实验中需要将铜离子和锡离子分离,目前已知的方法是利用溶度积,通过控制pH分别沉淀出锡、铜,请问各位还有没有其它方法可以分离这两种离子的,因为需要提交三种方法, 格子小熊1年前1
格子小熊1年前1 -
 你就是我的天地 共回答了19个问题
你就是我的天地 共回答了19个问题 |采纳率94.7%1、水解法:控制pH沉淀Sn(2+);
2、NaOH酸碱反应法(1年前查看全部
- 电解精炼铜 为什么阳极溶解的铜与阴极析出的铜不等 为什么电解质溶液铜离子浓度减小
 ff否1年前2
ff否1年前2 -
 我想拉巴巴 共回答了22个问题
我想拉巴巴 共回答了22个问题 |采纳率90.9%精炼铜 阳极失电子的有Zn Fe Cu 等,还有Ag Au Pt 等沉淀为阳极泥.
阴极只有Cu2+得电子,一部分来自于阳极生成的Cu2+ ,一部分来自于溶液中.
所以阳极溶解的铜与阴极析出的铜不等 ,电解质溶液铜离子浓度减小1年前查看全部
- 测定铜离子时加入硫氢化钾的作用是什么
 west2031年前1
west2031年前1 -
 bbassy 共回答了12个问题
bbassy 共回答了12个问题 |采纳率91.7%还原铜离子1年前查看全部
- 水合铜离子中水有两对孤电子对为啥只拿出一对形成配位键
水合铜离子中水有两对孤电子对为啥只拿出一对形成配位键
水合铜离子有四个水分子,铜离子有四个空位,但一个水分子有两对孤电子对,为啥每个水分子只拿出了一对啊 忧郁小孩1年前2
忧郁小孩1年前2 -
 Sjsteven 共回答了25个问题
Sjsteven 共回答了25个问题 |采纳率88%空间结构好麼
Cu2+的杂化轨道形状,与O原子杂化轨道不能重叠两个,当然不能用两对电子配位
一种物质的一个原子,一定只能提供一对电子1年前查看全部
- 如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电
如图所示,一束具有各种速率的两种一价铜离子,质量数分别为63和65,水平地经小孔S进入有匀强电场E和匀强磁场D的区域.电场的方向向下,磁场的方向垂直于纸面向里.只有些轨迹不发生偏折的离子才能通过另一小孔S'.为了把从S'射出的两种铜离子分开,再让它们进入另一方向垂直纸面向外的匀强磁场B'中,使两种离子分别沿不同半径的圆形轨道运动.试分别求出两种离子的轨道半径.题中各已知量如下: E=1.00×10^5V/m, B=0.4T, B'=0.5T, 质量数为63的铜离子质量m1=63×1.66×10^-27kg, 质量数为65的铜离子质量m2=65×1.66×10^-27kg

 可乐与茶1年前1
可乐与茶1年前1 -
 fengling722 共回答了24个问题
fengling722 共回答了24个问题 |采纳率91.7%(1)设铜离子的电量为e,以速度v进入小孔S后,受到的力有电场力F1=Ee,方向向下洛仑兹力F2=evB,方向向上重力可忽略不计,只有当F1=F2时,铜离子才能匀速无偏折地穿出小孔S'.因此,从小孔S'穿出的铜离子必须满足的条件是e...1年前查看全部
- 某无色的溶液中可能含有大量的碘离子,亚硫酸根离子,铵根离子,铜离子,亚铁离子,向该溶液中加入少量的溴水
某无色的溶液中可能含有大量的碘离子,亚硫酸根离子,铵根离子,铜离子,亚铁离子,向该溶液中加入少量的溴水
0 - 离问题结束还有 0 小时
,溶液呈无色,则下列关于溶液的组成判断正确的是( )
1.肯定不含碘离子2.肯定不含铜离子、亚铁离子3.肯定含有亚硫酸根离子4.可能含有碘离子5铵根离子可能存在
A 1235 B135 C 2345 D 34 jihaichao1年前1
jihaichao1年前1 -
 jessica--- 共回答了16个问题
jessica--- 共回答了16个问题 |采纳率81.3%肯定不含碘离子
对,如果有I-,有单质碘生成,溶液有颜色.
2.肯定不含铜离子、亚铁离子
对,如果有铜离子、亚铁离子,溶液有颜色.
3.肯定含有亚硫酸根离子
对,只有两种阴离子,没有I-,肯定有SO32-.
4.可能含有碘离子
错,不可能有
5铵根离子可能存在
对,有NH4+
选A1年前查看全部
- (2006•红桥区模拟)如图所示,一束具有各种速率的带一个基本正电荷的两种铜离子,质量数分别为63和65,水平的经小孔&
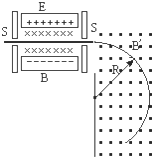 (2006•红桥区模拟)如图所示,一束具有各种速率的带一个基本正电荷的两种铜离子,质量数分别为63和65,水平的经小孔 S 进入有匀强电场和匀强磁场的区域.电场 E 的方向向下,磁场B的方向垂直纸面向里.只有那些路径不发生偏折的离子才能通过另一个小孔S′.为了把从S′射出的两种铜离子分开,再让它们进入另一方向垂直纸面向外的匀强磁场B′中,使两种离子分别沿不同半径的圆形轨道运动.试分别求出两种离子的轨道半径.
(2006•红桥区模拟)如图所示,一束具有各种速率的带一个基本正电荷的两种铜离子,质量数分别为63和65,水平的经小孔 S 进入有匀强电场和匀强磁场的区域.电场 E 的方向向下,磁场B的方向垂直纸面向里.只有那些路径不发生偏折的离子才能通过另一个小孔S′.为了把从S′射出的两种铜离子分开,再让它们进入另一方向垂直纸面向外的匀强磁场B′中,使两种离子分别沿不同半径的圆形轨道运动.试分别求出两种离子的轨道半径.
(已知E=1.00×105V/m,B=0.4T,B′=0.50T,基本电荷e=1.60×10-19C,质量数为63的铜原子的质量m1=63×1.66×10-27kg,质量数为65的铜原子的质量m2=65×1.66×10-27kg) asdgjawrklrtsg1年前1
asdgjawrklrtsg1年前1 -
 一念之间tt 共回答了19个问题
一念之间tt 共回答了19个问题 |采纳率84.2%解题思路:根据电场力与洛伦兹力相平衡,可得速度大小;离子做匀速圆周运动,洛伦兹力提供向心力,由牛顿第二定律,可得质量表达式,从而即可求解.(1)设铜离子的电量为e,以速度v进入小孔S后,
受到的力有电场力F1=Ee,方向向下
洛仑兹力F2=evB,方向向上
重力可忽略不计,只有当F1=F2时,铜离子才能匀速无偏折地穿出小孔S'.因此,从小孔S'穿出的铜离子必须满足的条件是
eE=evB--------------(1)
这就是说,只有速度v=
E
B的铜离子能穿出小孔S'.
(2)铜离子进入磁场B'后,受到洛仑兹力F=evB',重力仍可忽略不计.F跟v垂直并为一恒量,因此铜离子在磁场B'内将作匀速圆周运动,
F就是这种圆周运动的向心力
设铜63离子和铜65离子运动轨迹的半径分别为R1和R2,那么evB′=
m1v2
R1---------(2)
evB′=
m2v2
R2--------(3)
(3)由(1)、(2)两式可得:
R1=
m1E
eBB′------------(4)
由(1)、(3)两式可得:
R2=
m2E
eBB′---------(5)
代入数值进行计算,
R1=
63×1.66×1027×1.00×105
1.60×10−19×0.40×0.50m=0.33m
R2=
65×1.66×1027×1.00×105
1.60×10−19×0.40×0.50m=0.34m
答:两种离子的轨道半径分别是:0.33m和0.34m.点评:
本题考点: 带电粒子在匀强磁场中的运动;牛顿第二定律;向心力;带电粒子在混合场中的运动.
考点点评: 查电场力与磁场力相平衡的匀速直线运动,也学会洛伦兹力使离子做匀速圆周运动,掌握平衡方程与牛顿第二定律方程,本题难度适中.1年前查看全部
- EDTA与铜离子形成的配合物是什么色的啊
 酷杰儿1年前1
酷杰儿1年前1 -
 caoweibj 共回答了21个问题
caoweibj 共回答了21个问题 |采纳率85.7%铜离子一般为蓝色,若是与EDTA配位后,还是蓝色,只是颜色更深一点(有色金属离子与EDT配位后,都会变得更深一点)1年前查看全部
- →用化学符号和数字表示:三个水分子,两个硫原子,两个铜离子,三个硫酸根离子,四个亚铁离子,四个铁原子,铁元素的化合价为+
→用化学符号和数字表示:三个水分子,两个硫原子,两个铜离子,三个硫酸根离子,四个亚铁离子,四个铁原子,铁元素的化合价为+3,3个二氧化硫分子,钙离子,+5价的磷元素.
 西门停电1年前1
西门停电1年前1 -
 sqli1506 共回答了16个问题
sqli1506 共回答了16个问题 |采纳率87.5%3H2O;2S;2Cu2+;3SO4(右上角标2-);4Fe2+;4Fe;Fe(正上方标+3);3SO2;Ca2+;P((正上方标+5)1年前查看全部
- 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中1摩尔铜离子能氧化磷的物质的量是
11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中1摩尔铜离子能氧化磷的物质的量是
(A)2/5(B)11/5(C)1/5(D)1/3 owena1年前1
owena1年前1 -
 艾哥我喜欢你 共回答了25个问题
艾哥我喜欢你 共回答了25个问题 |采纳率92%【解】:C
5P:降3*5=15
6P:升5*6=30
15Cu:降1*15=15
15molCu氧化3mol磷(其他3mol磷被5mol磷氧化)
所以答案为:C1年前查看全部
- 铜离子有强氧化性,为什么氢氧化铜是弱氧化剂
铜离子有强氧化性,为什么氢氧化铜是弱氧化剂
银粒子也有强氧化性,为什么银氨溶液也是弱氧化剂? htyighmdf1年前1
htyighmdf1年前1 -
 幻梦人生 共回答了20个问题
幻梦人生 共回答了20个问题 |采纳率95%离子一旦被络合以后,你上述的情况就是被络合了,离子本身就不再是游离的了,也就是说离子本身已经不存在了,存在的是络合离子,而上述两种络合离子都是结构非常稳定的.
铜离子为例,实际上存在形态为:Cu[(OH)4]2-,每个铜离子外面包裹了氢氧根离子,因而不再容易获得电子,也就是表观的氧化性降低了.1年前查看全部
- 小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马
小刚也查阅了一分资料,了解到氯化铜溶液,硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含硝酸离子.他于是马上到实验室观察氯化钠,硝酸钠,氯化铜,硝酸铜溶液的颜色,基于这些溶液的颜色他可以作一个判断,若 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.
 我是驹1年前1
我是驹1年前1 -
 riot转圈圈 共回答了19个问题
riot转圈圈 共回答了19个问题 |采纳率89.5%若 氯化铜,硝酸铜溶液为蓝色,氯化钠,硝酸钠溶液为无色 ,则可以得出结论——铜离子使硫酸铜溶液呈现蓝色.1年前查看全部
- 有没有方程式比较三价铁离子和二价铜离子的氧化性强弱
 cc中的鱼1年前1
cc中的鱼1年前1 -
 多少爱可以重做 共回答了14个问题
多少爱可以重做 共回答了14个问题 |采纳率85.7%Fe3+>Cu2+
氧化性:氧化剂>氧化产物
2Fe3+ +Cu=2Fe2+ +Cu2+
Fe3+的化合价降低,Fe3+是氧化剂,Cu2+是氧化产物,所以氧化性Fe3+>Cu2+1年前查看全部
- 请问2价锰离子的氧化性与2价铜离子比谁强
 鹏臂升辉1年前1
鹏臂升辉1年前1 -
 aliang11 共回答了15个问题
aliang11 共回答了15个问题 |采纳率86.7%2价Cu2+离子的氧化能力强
容易被还原
可以根据金属的还原性来比较
Mn的还原性比Cu强
Mn易溶于稀酸,并有氢气放出
还原性强于Cu
所以,Mn2+离子的氧化性弱于Cu2+
祝你新年快乐1年前查看全部
- 用K4Fe(CN)6检出铜离子时,为什么要用醋酸酸化溶液
 恋家情结1年前1
恋家情结1年前1 -
 冷风伴着雨 共回答了25个问题
冷风伴着雨 共回答了25个问题 |采纳率96%防止K4Fe(CN)6水解1年前查看全部
- 铜离子与次氯酸根双水解吗?能大量共存吗?铵根离子与碳酸根离子呢?
铜离子与次氯酸根双水解吗?能大量共存吗?铵根离子与碳酸根离子呢?
讲明理由. 风也有ff1年前1
风也有ff1年前1 -
 yetfat 共回答了19个问题
yetfat 共回答了19个问题 |采纳率100%铵根离子与碳酸根离子可以水解 但只是不完全水解 是可以大量共存的 但要注意的是写化学方程式的时候要用可逆符号 不能用沉淀和气体符号 还有像铵根和醋酸根、碳酸氢根这些都是不完全水解 是可以共存的
至于铜离子与次氯酸根 是不可以水解的1年前查看全部
- 用化学符号怎么表示下列内容?钾离子 钠离子 银离子 钙离子 镁离子 钡离子 锌离子 铝离子 铜离子 亚铁离子 铁离子 氢
用化学符号怎么表示下列内容?
钾离子 钠离子 银离子 钙离子 镁离子 钡离子 锌离子 铝离子 铜离子 亚铁离子 铁离子 氢离子 硫离子 氯离子 氧离子 氟离子
铵根离子 氢氧根离子 硫酸根离子 氯酸根离子 碳酸根离子
硫酸根离子
盐酸 硫酸 硝酸 碳酸 氯酸
氢氧化钠 氢氧化钾 氢氧化钙 氢氧化镁 氢氧化钡 氢氧化锌
氢氧化铝 氢氧化铜 氢氧化铁 氢氧化亚铁
氯化钠 氯化镁 氯化铝 氯化铜 氯化钡 氯化钙 氯化亚铁
氯化铁 氯化锌 氯化银
硫酸铜 硫酸钠 硫酸钾 硫酸铝 硫酸钡 硫酸钙 硫酸亚铁
碳酸钠 碳酸钙 碳酸铵 碳酸钡 碳酸铝
硝酸根 硝酸铵 硝酸钠 硝酸镁 硝酸铝
拜托拉…………
帮帮忙!我才刚刚学呀~!…………
帮帮你们的学妹拉 张无忌俺小弟1年前1
张无忌俺小弟1年前1 -
 chenglu2007 共回答了19个问题
chenglu2007 共回答了19个问题 |采纳率94.7%钾离子K+ 钠离子Na+ 银离子Ag+ 钙离子Ca2+ 镁离子Mg2+ 钡离子Ba2+ 锌离子Zn2+ 铝离子Al3+ 铜离子Cn2+ 亚铁离子Fe2+ 铁离子Fe3+ 氢离子H+ 硫离子S2- 氯离子Cl- 氧离子O2- 氟离子F-
铵根离子NH4+ 氢氧根离子OH- 硫酸根离子SO4 2- 氯酸根离子ClO3- 碳酸根离子 CO3 2-
硫酸根离子 SO4 2-
盐酸HCl 硫酸H2SO4 硝酸HNO3 碳酸H2CO3 氯酸HClO3
氢氧化钠NaOH 氢氧化钾KOH 氢氧化钙Ca(OH)2 氢氧化镁Mg(OH)2 氢氧化钡Ba(OH)2 氢氧化锌 Zn(OH)2
氢氧化铝Al(OH)3 氢氧化铜Cu(OH)2 氢氧化铁Fe(OH)3 氢氧化亚铁Fe(OH)2
氯化钠NaCl 氯化镁MgCl2 氯化铝AlCl3 氯化铜CuCl2 氯化钡BaCl2 氯化钙CaCl2 氯化亚铁FeCl2 氯化铁FeCl3 氯化锌ZnCl2 氯化银AgCl
硫酸铜CuSO4 硫酸钠Na2SO4 硫酸钾K2SO4 硫酸铝Al2(S04)3 硫酸钡BaSO4 硫酸钙CaSO4 硫酸亚铁 FeSO4
碳酸钠Na2CO3 碳酸钙CaCO3 碳酸铵(NH4)2CO3 碳酸钡BaCO3 碳酸铝Al2(CO3)3
硝酸根NO3- 硝酸铵NH4NO3 硝酸钠NaNO3 硝酸镁Mg(NO3)2 硝酸铝Al(NO3)31年前查看全部
- 分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子
分别为一价和两价的静止铜离子,经过同一电场加速后,在垂直经过同一偏转电场,然后落到一光屏上.图略,离子重力不计.A 离子经加速电场时,二价铜离子受到电场力的冲量大.B 在偏转电场中电场力对两种离子做功一样多.C 两种铜离子打在屏上速度一样大.D 两种铜离子打在屏上的两个不同点.选择?理由?
 oqbydxm1年前1
oqbydxm1年前1 -
 88212853 共回答了15个问题
88212853 共回答了15个问题 |采纳率93.3%A对 .二价离子受力大,距离相同,FS大,做功大,动能大,速度大,MV大,由冲量定理,冲量大
D要看情况.可以计算(字数限制不能细说)电场中偏转距离相同.所以,如屏紧挨偏转电场边沿,D不对,否则对
楼上想当然1年前查看全部
大家在问
- 1雯媞一诺千金的意思是什么他带有怎样的情感色彩
- 2怎么更好理解现在分词doing.像seeing the cat 和the man sitting there
- 3高速钢的问题 高温回火后得到的应该是回火索氏体,高速钢为什么得到的是回火马氏体
- 4有哪些珍惜生命的名言?
- 5用边长0.6米的方砖铺54平方米的地面,需要多少块这样的方砖?
- 6用边长为0.6米的方砖铺15.12平方米的房间,需要多少块方砖?
- 7用边长0.6米的方砖铺54平方米的地面,需要多少块这样的方砖?
- 8离地球近的星系距离是多少?多写几个星系
- 9there be句型讲解?there be句型有些什么?谁有具体的讲解
- 10友谊是一个永恒的话题,我们每个人对友谊都有不同的感爱.
- 11英语提问,紧急!是work hard ,还是work hardly?
- 12双曲线的数学题已知方程kx的方+3y方+4kx+6ky+3k方+k=0表示焦点与x轴平行的直线上的双曲线,求双曲线做焦点
- 13有什么物体的面积的表面是三角形的?
- 14甲乙两地距离228千米,一列车速度是a千米,另一列车速度是b千米,两车相对同时开出,经过几个小时两车相遇?
- 15电功率:应用题一只灯泡L的电阻为10欧,在6V的电压下才能正常发光,现将该灯泡接在9v的恒压电源上,为了使该灯泡能够正常
