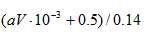将32.64gCu与140ml一定浓度的HNO3反应,Cu完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.
 K成成成K2022-10-04 11:39:541条回答
K成成成K2022-10-04 11:39:541条回答(1)NO的体积为多少?
(2)NO2的体积为多少?

已提交,审核后显示!提交回复
共1条回复
 三叶草上的露珠 共回答了19个问题
三叶草上的露珠 共回答了19个问题 |采纳率100%- NO的体积为5.824L
NO2的体积为5.376L
解题思路:
这道题最简单的解法是用得失电子守恒来计算.
32.64gCu,为0.51mol,不管硝酸被还原成了什么,Cu都被氧化成了Cu2+
那么0.51molCu就失去电子1.02mol(每个铜原子失去两个电子).
我们再看硝酸的还原产物,标况下11.2L,不管是什么气体的混合物,11.2L必定是0.5mol,也就是说NO和NO2的混合气体一共0.5mol.设NO物质的量为x,那么NO2的物质的量为0.5-x,
硝酸HNO3中的N为正五价,NO中N为+2,NO2中N为+4价,那么,当一个正五价的N被还原成+2价的N时必定得到3个电子,被还原成+4价时必定得到1个电子.那么x mol+2价的N必定得到3xmol电子,同理(0.5-x)mol的+4价N必定得到(0.5-x)mol电子,根据得失电子守恒则有:
3x+0.5-x=1.02
解得x=0.26mol,那么体积就是0.26*22.4=5.824L
那么NO2就是5.376L - 1年前
相关推荐
- 关于化学十字交叉法的适用范围比如这种情况能否使用十字交叉法?将32.64g铜与140ml一定浓度的硝酸反应,Cu完全溶解
关于化学十字交叉法的适用范围
比如这种情况能否使用十字交叉法?
将32.64g铜与140ml一定浓度的硝酸反应,Cu完全溶解后生成NO和NO2气体共11.2L,求NO和NO2的体积各是多少?但是这里能不能用十字交叉法,算如果全部是NO或者全部是NO2时的体积,再与中间体积11.2L十字交叉. 谁的泪水谁的脸1年前1
谁的泪水谁的脸1年前1 -
 麦唛丫头 共回答了22个问题
麦唛丫头 共回答了22个问题 |采纳率86.4%我想你这个方法不太科学
你这道题是简单题 我就不做了
十字交叉若两个同类的量值(如相对分子质量 摩尔质量 溶质质量分数等)A B案某种物理量之比(如物质的量之比 气体体积之比 溶液质量之比)a:b组合成的某混合物 这种题就可以用十字交叉法 一般ab是未知量
即十字交叉中间的那个值是个平均值 (不信你照这种题看看 都只这样的)用C表示
A×a/(a+b)+B×b/(a+b)=C 这种情况下可用十字交叉 利用题中给的平均值 算出ab比例1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生NO和NO2的混各气体在标准状况下的体积为11.2L请问N
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生NO和NO2的混各气体在标准状况下的体积为11.2L请问NO
 FFIT1年前2
FFIT1年前2 -
 maycat123 共回答了21个问题
maycat123 共回答了21个问题 |采纳率90.5%NO xmol;NO2 ymol
x+y=11.2/22.4=0.5
3x+y=2*32.64/64=1.02
x=0.26
y=0.241年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO 2 混合气体在标准状况下的体积为
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO 2 混合气体在标准状况下的体积为
11.2L。请回答:
(1)NO的体积为 L,NO 2 的体积为_______________ L。
(2)待产生的气体全部释放后,向溶液加入 的NaOH溶液,恰好使溶液中的全部转化成沉淀,则原硝酸溶液的浓度为_______________ mol/L。
的NaOH溶液,恰好使溶液中的全部转化成沉淀,则原硝酸溶液的浓度为_______________ mol/L。
(3)欲使铜与硝酸反应生成的气体在 溶液中全部转化为
溶液中全部转化为 ,至少需要30%的双氧水____g。
,至少需要30%的双氧水____g。  饼干001年前1
饼干001年前1 -
 任我行任我笑 共回答了24个问题
任我行任我笑 共回答了24个问题 |采纳率100%1年前查看全部
- 将32.64gCu与140ml一定浓度硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L
将32.64gCu与140ml一定浓度硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L
,欲使Cu与HNO3反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需30%的双氧水多少克? christmaseveday21年前1
christmaseveday21年前1 -
 ratso 共回答了23个问题
ratso 共回答了23个问题 |采纳率78.3%先看横线下的一种方法...看不懂再看上面一种
根据电子守恒,反应前为:Cu,HNO3,反应后为,Cu2+(升高2价),NO2(降一价),NO(降三价)
且,n(cu)=0.51mol
设生成NO2 xmol,NOymol
则,x+3y=0.51*2(这条式子就是电子守恒)
x+y=0.5
那么解方程,y=0.26mol,x=0.24mol
4NO+2H2O+3O2=4HNO3
所以需要O2=0.26/4*3=0.195mol
4NO2+2H2O+O2=4HNO3
又需要O2=0.24/4=0.06mol
共需要O2=0.255mol
根据:2H2O2=2H2O+O2
需要H2O2=0.255*2=0.51mol
则需要30%的H2O2 0.51*34/0.3=57.8g
所以,需要57.8g
---------------------------------------------------------------
等我做完发现不用这么烦...
总体的得失电子守恒就行
一开始:CU HNO3 H2O2
最后:HNO3 H2O CU2+
那么,假设使用了xmolH2O2
0.51*2=x*2(因为一个双氧水里面有2个O(-1价),可以变为两个H2O,而每个的变化又是1价)
那么直接解得x=0.51mol
.接下来一样.1年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
1.反应后所得硝酸铜的物质的量是( )mol,被还原的硝酸是()mol?
2.NO和NO2 的体积各为多少?
3.待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为() mol/L.
4.欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少g?我是高一新生,预习阶段,有很多不明白的地方,) 蓝橙子1年前1
蓝橙子1年前1 -
 gxh2004 共回答了16个问题
gxh2004 共回答了16个问题 |采纳率81.3%将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:(1)NO的体积为 L,NO2的体积为 L.(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使...1年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体的体积为11.2L(标准状况),欲使
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体的体积为11.2L(标准状况),欲使铜与硝酸反应产生的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水的质量为( )
A. 54g
B. 57.8g
C. 47.8g
D. 33.6g zhukun7771年前1
zhukun7771年前1 -
 XTenten 共回答了21个问题
XTenten 共回答了21个问题 |采纳率81%解题思路:Cu与硝酸反应得到硝酸铜与NO和NO2混合气体,NO和NO2混合气体再在双氧水、碱性条件下转化为NaNO3,纵观整个过程,根据电子转移守恒,Cu提供的电子等于过氧化氢获得的电子,据此计算过氧化氢的物质的量,再根据m=nM计算过氧化氢的质量,进而计算需要30%的双氧水的质量.Cu与硝酸反应得到硝酸铜与NO和NO2混合气体,NO和NO2混合气体再在双氧水、碱性条件下转化为NaNO3,纵观整个过程,根据电子转移守恒,Cu提供的电子等于过氧化氢获得的电子,
32.64g铜的物质的量=[32.64g/64g/mol]=0.51mol,故Cu提供电子为0.51mol×2=1.02mol,故需要过氧化氢的物质的量=[1.02mol/2]=0.51mol,过氧化氢的质量=0.51mol×34g/mol=17.34g,需要30%的双氧水的质量=[17.34g/30%]=57.8g,故选B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查氧化还原反应有关计算,关键是利用整体法结合守恒思想确定Cu提供的电子等于过氧化氢获得的电子,侧重考查学生分析解决问题的能力,难度中等.1年前查看全部
- 32.64g Cu与浓HNO3反应,铜完全反应,反应后得到标准状况下气体11.2L(NO2和NO)求生成的NO和NO2分
32.64g Cu与浓HNO3反应,铜完全反应,反应后得到标准状况下气体11.2L(NO2和NO)求生成的NO和NO2分别多少L
 漫乐1年前1
漫乐1年前1 -
 三灌帮掌门人 共回答了21个问题
三灌帮掌门人 共回答了21个问题 |采纳率85.7%1年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L
(1)标况下NO,NO2的体积各为多少升?
(2)待产生的气体全部释放后,向溶液中加2mol/L的NaOH溶液450mL,
充分反应,恰好使溶液中的铜离子全部转化成沉淀,则原硝酸溶液中溶质的物质的量浓度. bingxue7951年前6
bingxue7951年前6 -
 jiangyanjun 共回答了22个问题
jiangyanjun 共回答了22个问题 |采纳率86.4%设NO为xmol, NO2为ymol
x+y=11.2/22.4=0.5
3x+y=32.64/64*2=1.02(得失电子守恒)
解得 x=0.26mol 即NO的体积为5.824L
y=0.24mol,即NO2的体积为5.376L
Cu(NO3)2 Cu(OH)2
一个Cu对应两个NO3-,或者OH-
32.64/64=0.51mol,需要的OH-即为1.02mol
2*0.45=0.9mol,所以我觉得你的题目不太对1年前查看全部
- 将32.64g铜与140毫升一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2升.
 17755161年前1
17755161年前1 -
 wensunjun 共回答了18个问题
wensunjun 共回答了18个问题 |采纳率88.9%设为NO为X NO2为YX+Y=11.2/22.4正五价的的N转换来的转移电子数等于铜转换的有:3X+Y=32.64/64解就是了3X+Y=0.51X=0.005Y=0.4951年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的一氧化氮和二氧化氮混合气体在标准状况下的体积
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的一氧化氮和二氧化氮混合气体在标准状况下的体积
待产生的气体全部释放后,向溶液中加入Vmlamol的NaOH溶液,恰好使溶液中铜离子全部转化为沉淀,则原硝酸溶液的浓度为 mol/L
为什么不能用n(CU)的来算? t9999b1年前1
t9999b1年前1 -
 qian1231 共回答了25个问题
qian1231 共回答了25个问题 |采纳率92%你写不出总反应,你怎麼拿Cu去算1年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.(1
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.(1)NO
 莲蓉1年前1
莲蓉1年前1 -
 花来花去 共回答了21个问题
花来花去 共回答了21个问题 |采纳率95.2%题目不全
看看是不是下面的题目 若是 则
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
(1)NO的体积为 L,NO2的体积为 L.
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L.
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g.
(1)设反应中产生NO和NO2的体积分别为x、y(据得失电子守恒有)
x+y=11.2①
(x/22.4)×3+(y/22.4) ×1=(32.64/64)×2
解得x=5.824 L y=5.376 L
(2)根据反应后的溶液中只有一种溶质NaNO3 ,设原硝酸的物质的量浓度为C
(由氮元素守恒)则 0.14×C= 10-3 ×v×a + 11.2/22.4
得原硝酸的浓度为:C= (10-3 va +0.5)/0.14
(3) 从反应的始态和最终状态看,铜在反应中失去电子,双氧水在反应中得到电子,需要30%的双氧水的质量为m 则(据得失电子守恒有):
(32.64/64)×2=〔(30%×m)/34〕×2解得:m=57.8 g1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应
将32.64g铜与140ml一定浓度的硝酸反应
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
1.反应后所得硝酸铜的物质的量是( )mol,被还原的硝酸是()mol?
2.NO和NO2 的体积各为多少?
3.待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为() mol/L.
我对电子守恒的题掌握的很不好,还有第二问如果设NO是x mol,问什么要乘以3. YAYA10101年前1
YAYA10101年前1 -
 chitang99 共回答了16个问题
chitang99 共回答了16个问题 |采纳率87.5%1、(0.51)(0.5)
32.64g铜的物质的量是0.51mol 全部转化为硝酸铜了 所以生成的硝酸铜的物质的量也应该是0.51mol 硝酸中是硝酸根离子被还原了 根据氮原子守恒来看 硝酸根离子的物质的量等于生成的NO和NO2的物质的量之和 两种气体的物质的量为11.2/22.4=0.5mol 所以被还原的硝酸也是0.5mol
2、设NO和NO2的物质的量分别问x和y 根据第一问 二者的物质的量之和为0.5mol 即x+y=0.5 再根据转移电子数列个方程 0.51mol的铜失去了1.02mol电子都转移到氮原子上 原来氮是+5价 得到3个电子的部分氮转化为NO(氮是+2)价得到1个电子的部分氮转化为NO2(氮是+4价) 即1molNO得到了3个电子 1molNO2得到1mol电子 所以有3x+y=1.02 解得x=0.26mol y=0.24mol 转化为体积 NO体积为0.26*22.4=5.824L NO2体积为0.24*22.4=5.376L
3、要求原硝酸溶液的物质的量浓度首先要知道硝酸的物质的量 硝酸在一系列反应中最终都变为一氧化氮、二氧化氮和一部分硝酸根离子 也就是NO和NO2和硝酸根离子的物质的量之和就是硝酸的物质的量 第一问已经知道NO和NO2的物质的量之和是0.5mol 只要求硝酸根离子的物质的量就可以了 反应后的溶液是硝酸铜溶液 只要知道铜离子的物质的量就能知道硝酸根离子的物质的量 而铜离子在加入氢氧化钠溶液之后恰好全部转化为Cu(OH)2沉淀 所以知道氢氧根离子的物质的量就可以了 VmL a mol/L的NaOH溶液中OH-离子浓度为Va*10^-3mol 全部转化为Cu(OH)2沉淀说明铜离子的物质的量为(Va/2)*10^-3mol 那么Cu(NO3)2中硝酸根离子的物质的量为(Va/2)*10^-3*2=Va*10^-3mol 所以原来硝酸的物质的量为(Va*10^-3+0.5)mol 再除以溶液体积140mL就是硝酸原浓度了1年前查看全部
- 化学计算题将32.64gCu与140ml一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积
化学计算题
将32.64gCu与140ml一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L
(1)NO的体积为?
(2)NO2的体积为? elaine_tai1年前3
elaine_tai1年前3 -
 jingyz2006 共回答了20个问题
jingyz2006 共回答了20个问题 |采纳率95%Cu完全溶解转移电子=32.64/64*2=1.02molNO与NO2共计11.2/22.4=0.5mol设NO有xmol那么NO2就有0.5-xmol通过电子守恒列方程3x+1*(0.5-x)=1.02x=0.26mol所以NO体积=0.26*22.4=5.824LVNO2=11.2-5.842=5.376L或者用十字交叉...1年前查看全部
- 将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.
(1)NO和NO2 的体积各为多少 (是不是NO是5.8 ,NO2是5.)
(2)被还原与消耗的硝酸物质的量(这个是重点!) 5lfbgarmi1年前1
5lfbgarmi1年前1 -
 hihpo 共回答了18个问题
hihpo 共回答了18个问题 |采纳率94.4%对问题(1),由于n(Cu)=32.64/64=0.51(mol),n(NO、NO2)=11.2 / 22.4=0.5(mol),若设NO的物质的量为xmol,则NO2为(0.5-x)mol,根据电子守恒得:0.51×2=3x+(0.5-x)×1,则x=0.26,即n(NO)=0.26mol,n(NO2)=0.24mol,所以,V(NO)=0.26×22.4=5.8(L),V(NO2)=0.24×22.4=5.4(L).1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的体积是多少L?NO2的体积为多少L?
 sun_rider1年前2
sun_rider1年前2 -
 山谷里的紫丁香 共回答了25个问题
山谷里的紫丁香 共回答了25个问题 |采纳率80%解题思路:n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,铜失电子、氮原子得电子生成氮氧化物,该反应中得失电子守恒,根据转移电子守恒、氮原子守恒列方程式进行计算.n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,设NO的物质的量为x,NO2的物质的量为y,根据氮原子守恒、电子守恒得
x+y=0.5
(5−2)x+(5−4)y=0.51×2
解得
x=0.26
y=0.24
所以V(NO)=0.26mol×22.4L/mol=5.824L,
V(NO2)=0.24mol×22.4L/mol=5.376L,
答:NO的体积是5.824L;NO2的体积为5.376L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学反应方程式的计算,守恒思想思想的运用为解答的关键,注意对应关系,题目难度不大.1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为11.2L
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的一氧化氮和二氧化氮混合气体在标准状况下的体积为11.2L请回答:
(1)一氧化氮的体积为多少升?
(2)待产生的气体全部释放后,向溶液中加入Vmlamol的NaOH溶液,恰好使溶液中铜离子全部转化为沉淀,则原硝酸溶液的浓度为 mol/L
(3)欲使铜与硝酸反应生成的气体在NaoH溶液中全部转化为NaNO3
,至少需要30%的双氧水几克? 萧寞1年前4
萧寞1年前4 -
 吴味wuwei 共回答了13个问题
吴味wuwei 共回答了13个问题 |采纳率100%这个题用电子守恒加上十字交叉法
11.2L气体就是0.5mol
32.64g铜就是0.51mol,转移电子1.02mol
变成一氧化氮,转移电子3mol.二氧化氮1mol
十字交叉法得一氧化氮二氧化氮的物质的量之比为1:99
所以,一氧化氮的体积是14ml
这个要用物料守恒,铜离子本来和硝酸根,现在和氢氧根,可以看成氢氧根的物质的量和硝酸根的相等,还有一部分硝酸根转化成了氮的氧化物 .总和就是【(aV/1000)+0.5】/0.14mol/L
先是硝酸变成了一氧化氮和二氧化氮的混合物,
再是混合物变成硝酸
这两个过程转移的电子总数相同
就是说铜转移的电子数和过氧化氢的相同,都是1.02mol
1mol过氧化氢可以转移2mol电子,所以需要过氧化氢0.51mol
至少需要30%的双氧水为34*0.51/0.3=57.8g1年前查看全部
- 将32.64g铜与150mL一定浓度的硝酸反应,铜完全溶解后,产生的NO和NO2混合气体在标准状况下的体积为11.2L.
将32.64g铜与150mL一定浓度的硝酸反应,铜完全溶解后,产生的NO和NO2混合气体在标准状况下的体积为11.2L.(假定反应前后溶液体积不变,也不考虑N2O4的存在.)试计算:
(1)反应后,溶液中硝酸铜物质的量浓度为多少?
(2)混合气体中NO的体积为多少?
(3)若将混合气体经水洗后,体积变为多少? legendwx1年前1
legendwx1年前1 -
 ainiling5417 共回答了23个问题
ainiling5417 共回答了23个问题 |采纳率87%解题思路:(1)根据n=[m/M]计算32.64g铜的物质的量,反应生成Cu(NO3)2,根据铜原子守恒计算n[Cu(NO3)2],再根据c=[n/V]计算;
(2)根据n=
计算混合气体的物质的量,令混合气体中NO和NO2物质的量分别为xmol、ymol,利用电子转移守恒、二者物质的量之和列方程,据此计算x、y的值,再根据v=nVm计算NO的体积;V Vm
(3)将混合气体经水洗,发生反应3NO2+H2O=2HNO3+NO,结合(2)计算NO2物质的量,利用差量法计算反应后减少的体积,据此解答.(1)32.64g铜的物质的量为[32.64g/64g/mol]=0.51mol,反应生成Cu(NO3)2,根据铜原子守恒可知n[Cu(NO3)2]=n(Cu)=0.51mol,故反应后,溶液中硝酸铜物质的量浓度为[0.51mol/0.15L]=3.4mol/L,
答:反应后,溶液中硝酸铜物质的量浓度为3.4mol/L;
(2)11.2L混合气体的物质的量为[11.2L/22.4L/mol]=0.5mol,令混合气体中NO和NO2物质的量分别为xmol、ymol,
由电子转移守恒有:3x+y=0.51×2,
由二者物质的量之和:x+y=0.5
联立方程,解得x=0.26,y=0.24,
故NO的体积为0.26mol×22.4L/mol=5.824L,
答:NO的体积为5.824L,
(3)将混合气体经水洗,令混合气体体积减少为VL,则:
3NO2+H2O=2HNO3+NO,体积减少△V
3mol 44.8L
0.24mol VL
所以3mol:0.24mol=44.8L:VL,
解得V=3.584,
故混合气体经水洗后,体积变为11.2L-3.584L=7.616L,
答:混合气体经水洗后,体积变为7.616L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查方程式的有关计算,难度中等,注意利用原子守恒、电子转移守恒进行的计算.1年前查看全部
- 将32.64gCu与140mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L.
将32.64gCu与140mL一定浓度的HNO3反应,Cu完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L.
将32.64gCu与140mL一定浓度的HNO 3 反应,Cu完全溶解产生的NO和NO 2 混合气体在标况下的体积为11.2L..待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu 2+ 全部转化为沉淀,则原HNO3溶液的浓度为---------mol/L vflo265091年前1
vflo265091年前1 -
 n22908 共回答了20个问题
n22908 共回答了20个问题 |采纳率85%涉及到金属与HNO3反应的计算题.用守恒法解 铜的物质的量=0.51mol (1)因为铜完全反应,生成的是Cu2+.所以转移的电子的物质的量=0.51*2=1.02mol (2)设NOxmol NO2 ymol x+y=0.5 (气体量) 3x+y=1.02 (电子得失守恒) x=0.26 y=0.24 所以NO的体积0.26*22.4=5.824 NO2的体积=0.24*22.4=5.376 (3)最终溶液只有NaNO3.根据N守恒.NaNO3的物质的量=aV*10^-3 NO NO2总的N为0.5mol 所以全部的N为(0.5+aV*10^-3) 则HNO3的浓度= (0.5+aV*10^-3)/0.141年前查看全部
- 铜与硝酸反应的题将32.64g铜与100ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为
铜与硝酸反应的题
将32.64g铜与100ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
(1)NO的体积为 L,NO2的体积为 L.
(2)将产生的气体全部释放后,向溶液中加入400ml 3mol/L的NaOH溶液,恰好使溶液中的Cu2+全部反应转化生成沉淀,则原硝酸溶液的浓度为 mol/L.
(3)欲使Cu与HNO3反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g. 浪子小31年前1
浪子小31年前1 -
 灰色晴天 共回答了20个问题
灰色晴天 共回答了20个问题 |采纳率90%(1)设NO的物质的量为x mol,则NO2的物质的量为=(0.5-x)mol.
据电子得失守恒有 1.02=(0.5-x)+3x
解得 x=0.26mol 所以,
NO的体积为0.26×22.4=5.8L,NO2的体积为(0.5-0.26)×22.4=5.4L.
(2)据氮元素守恒可知,原硝酸溶液中含HNO3的物质的量为:
n(HNO3)=n(被还原HNO3)+n(NaNO3)=(0.5+0.4×3)mol,
则原硝酸溶液的浓度为:c(HNO3)=1.7/0.1=17mol/L.
(3)1.02=2*30%y; y=1.02/0.6=1.7g.1年前查看全部
- 32.64g铜与140ml一定浓度的HNO3反应,铜完全溶解产生NO,NO2混合气体在标况下体积11.2g,求NO,NO
32.64g铜与140ml一定浓度的HNO3反应,铜完全溶解产生NO,NO2混合气体在标况下体积11.2g,求NO,NO2的体积
我是想问在这个题中,为什么不能设NO,NO2的物质的量分别为x,y.用列方程组法解决这道题,而偏得设铜在不同反应中的物质的量为x,y liaowenzhao1年前3
liaowenzhao1年前3 -
 风命火命 共回答了24个问题
风命火命 共回答了24个问题 |采纳率95.8%怎么不可以了?都可以!而且设NO,NO2的物质的量分别为x,y更为简单设NO,NO2的物质的量分别为xmol,ymol则NO,NO2混合气体的物质的量为0.5mol32.64g Cu物质的量为0.51mol整个反应失去1.02mol电子每生成1molNO则铜失去3mol...1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下体积为11.2L.
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下体积为11.2L.
1.NO和NO2的体积各为多少?(步骤+点拨) zcbm9991年前2
zcbm9991年前2 -
 蓬莱刘金婷 共回答了13个问题
蓬莱刘金婷 共回答了13个问题 |采纳率76.9%【答】:
3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O
192 .44.8
m1
Cu+4HNO3=Cu(NO3)2+2NO2+2H2O
64 .44.8
m2
m1+m2=32.64
44.8m1/192+44.8m2/64=11.2
m1/192+m2/64=0.25
m1=24.96g
m2=32.64-24.96=7.68g
NO 的体积=24.96*44.8/192=5.824L
NO2 的体积=7.68*44.8/64=5.376L1年前查看全部
- 将32.64gCu与140ml一定浓度的HNO3反应,Cu完全溶解,产生NO5.824 L和NO2 5.376L
将32.64gCu与140ml一定浓度的HNO3反应,Cu完全溶解,产生NO5.824 L和NO2 5.376L
(1)将产生的气体完全释放后,向溶液中加入V ml a mol/L 的NaOH溶液,恰好使溶液中的Cu2+(铜离子)全部转化为沉淀,则原HNO3溶液浓度为多少?
(2)若Cu与HNO3刚好反应完全,则原HNO3的浓度为多少?
相对原子质量:Cu:64 H:1 N:14 O:16 Na:23 NaOH:40 HNO3:63 psg2d1年前2
psg2d1年前2 -
 匣中剑8843 共回答了19个问题
匣中剑8843 共回答了19个问题 |采纳率100%首先要把各个反应弄清楚,先是Cu跟硝酸的反应,因为铜完全溶解,所以硝酸可能过量也可能恰好反应.
(1)因为要将Cu2+恰好沉淀,那么如果硝酸过量的话,NaOH就应该先将其中和,然后再沉淀Cu2+,这样的话也就是说溶液中剩下的硝酸根离子在反应后都生成了NaNO3,根据N元素守恒可以知道原溶液中硝酸的物质的量=NaOH的物质的量+产生的气体的物质的量=a*V/1000+0.5,然后除以原来硝酸的体积就可以了
(2)如果Cu跟HNO3恰好反应的话,反应后的N元素存在于Cu(NO)2和产生的气体中,那么同样根据N元素质量守恒,可以得出硝酸的物质的量=2*硝酸铜的物质的量+气体的物质的量=2*32.64/64+0.5=1.52mol1年前查看全部
- 将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的
将32.64g铜与140ml一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标况下的体积为11.2L,问NO的体积是多少L?NO2的体积为多少L?
 GamBol21年前2
GamBol21年前2 -
 mxl198683 共回答了14个问题
mxl198683 共回答了14个问题 |采纳率92.9%解题思路:n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,铜失电子、氮原子得电子生成氮氧化物,该反应中得失电子守恒,根据转移电子守恒、氮原子守恒列方程式进行计算.n(Cu)=[32.64g/64g/mol]=0.51mol,n(NOx)=[11.2L/22.4L/mol]=0.5mol,设NO的物质的量为x,NO2的物质的量为y,根据氮原子守恒、电子守恒得
x+y=0.5
(5−2)x+(5−4)y=0.51×2
解得
x=0.26
y=0.24
所以V(NO)=0.26mol×22.4L/mol=5.824L,
V(NO2)=0.24mol×22.4L/mol=5.376L,
答:NO的体积是5.824L;NO2的体积为5.376L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学反应方程式的计算,守恒思想思想的运用为解答的关键,注意对应关系,题目难度不大.1年前查看全部
大家在问
- 1a的立方减b的立方公式的推导
- 2把“你曾和朋友们练习过对话吗?”翻译成英语
- 3把函数y=sinx(x∈R)的图象上所有的点向左平行移动 π 3 个单位长度,再把所得图象上所有点的横坐标缩短到原来的
- 4书是我们最好的朋友,它可以提供足够的知识,开阔视野
- 5一根长10之9米的铁丝,第一次剪去它的10分之1第二次剪去一段后还剩下全长的2分之1第二次减去了多少米
- 6五年级有是三个班甲乙两班共91人乙丙两班共89人乙班占全部全班的1/3五年级三个班共多少人
- 7如图四边形ABCD是菱形,PA⊥平面ABCD,Q为PA的中点,求证:(1)PC‖平面QBD(2)BD⊥平面PAC
- 8In how to change love for you still won't change
- 9下列几种情况下,力对物体做功的是( )
- 10经济作物和农作物的区别,分别有哪些?
- 11如图,边长为1的正方形ABCD绕着点A逆时针旋转30°到正方形AB′C′D′,图中阴影部分的面积为( )
- 12A,B 两球的质量之比为5:1 ,当平抛时初速度的比试1:2,落地时水平位移之比为是2:3,则A,B两球抛出点到地面高度
- 13英语翻译以后我们就是好朋友了,我们在一起有聊不完的话题,
- 14五年级数学题一个棱长是3分米的正方体的油桶装满油,如果每升油重4千克,这桶油重多少千克?
- 15默写(8分)①春蚕到死丝方尽,