某天然碱的化学式为xna2CO3·yNaHCO3·zH2O.为了测定该物质的成分,进行如下实验:
 ivy1975092022-10-04 11:39:541条回答
ivy1975092022-10-04 11:39:541条回答1 称取3.32g天然碱样品,加入30mL过量稀盐酸,生成672mLCO2气体(标准状况).
2 另称取3.32g天然碱样品,在300摄氏度下加热至分解完全,生成CO2 112mL(标准状况)和0.45g水.
通过计算,确定天然碱的化学式

已提交,审核后显示!提交回复
共1条回复
 只爱英英 共回答了21个问题
只爱英英 共回答了21个问题 |采纳率90.5%- 1 CO2 量 672mL/22.4L/mol=0.03 mol 得3.32g天然碱样品含C为0.03 mol
2 CO2 量 0.112/22.4 =0.005 mol 水量 0.45/18=0.025 mol
由 2NaHCO3 =Na2CO3+CO2↑+H2O
0.01 mol 0.005 mol 0.005 mol
得3.32g天然碱样品 里NaHCO3 的量 0.005*2=0.01 mol
得3.32g天然碱样品含里NanCO3 为0.03-0.01=0.02 mol
得3.32g天然碱样品水的量为=0.025-0.005=0.02 mol
所以 x:y:z=0.02:001:0.002=2:1:2
天然碱的化学式 2Na2CO3.NaHCO3.2H2O - 1年前
相关推荐
- 天然碱的组成可以用aNa 2 CO 3 •bNaHCO 3 •cH 2 O(a、b、c为整数)表示.现有3种不同的天然碱
天然碱的组成可以用aNa 2 CO 3 •bNaHCO 3 •cH 2 O(a、b、c为整数)表示.现有3种不同的天然碱样品,分别进行如下实验以确定其化学式.
(1)将质量为62.0g的样品A平均分成两份,一份在300℃下充分灼烧(Na 2 CO 3 不分解),固体质量减轻9.8g;另一份溶于水后加入足量的Ba(OH) 2 溶液,得到白色沉淀59.1g.样品A的化学式可以表示为______.
(2)将质量为4.71g的样品B溶于水,逐滴滴加一定浓度的稀盐酸,产生气体的质量与加入盐酸的质量有下表所示关系:
[已知在盐酸不足时会发生反应:Na 2 CO 3 +HCl=NaHCO 3 +NaCl+H 2 O]盐酸的质量分数为______;样品B的化学式可以表示为______.盐酸质量/g 20 40 60 80 气体质量/g 0 0.44 1.32 1.98  海云飘飘1年前1
海云飘飘1年前1 -
 blackmoss 共回答了15个问题
blackmoss 共回答了15个问题 |采纳率93.3%(1)31.0g天然碱中碳元素的就是碳酸钡中碳元素的质量为:59.1g×
12
197 ×100%=3.6g
由于:aNa 2 CO 3 •bNaHCO 3 •cH 2 O~b/2CO 2 +(b/2+c)H 2 O
106a+84b+18c22b+9b+18c
31.0g 9.8g
得出:
106a+84b+18c=31.0
31b+18c=9.8
(a+b)×12
106a+84b+18c ×100%=3.6g
解得:a=0.1 b=0.2 c=0.2所以:a:b:c=1:2:2
样品A的化学式可以表示为:Na 2 CO 3 •2NaHCO 3 •2H 2 O
(2)设盐酸的质量分数是w
NaHCO 3 +HCl=NaCl+H 2 O+CO 2 ↑
36.5 44
(60g-40g)×w(1.32g-0.44g)
36.5
44 =
(60g-40g)×w
(1.32g-0.44g) 解得:w=3.65%
根据反应的方程式以及加入盐酸的质量从40g60g产生气体的质量与可知,每加入20g盐酸与碳酸氢钠产生二氧化碳的质量是0.88g,由此可知,加入的盐酸从0到30g用于碳酸钠转化为碳酸氢钠,从30g到75g用于碳酸氢钠转化为二氧化碳,由此可以得出a:b=2:1,
2Na 2 CO 3 •NaHCO 3 •cH 2 O~3CO 2
2×106+84+18c 3×44
4.71g 1.98g
2×106+84+18c
3×44 =
4.71g
1.98g 解得c=1
样品B的化学式可以表示为 2Na 2 CO 3 •NaHCO 3 •H 2 O
故答为:(1)Na 2 CO 3 •2NaHCO 3 •2H 2 O;(2)3.65%,2Na 2 CO 3 •NaHCO 3 •H 2 O.1年前查看全部
- 某天然碱(纯净物)化学式NaHCO3·2Na2CO3·H2O由CO2和NaOH反应后的产物组成:
某天然碱(纯净物)化学式NaHCO3·2Na2CO3·H2O由CO2和NaOH反应后的产物组成:
加入HCL 30毫升
样品质量7.47克
CO2的体积672ml···
已知Na2CO3与HCL(aq)的反应分下列两步进行:
Na2CO3+HCL= NaCL+ NaHCO3
NaHCO3+HCL= NaCL+CO2+H2O
由上数据可以确定所用HCL(aq)的浓度为 shijing11年前1
shijing11年前1 -
 xsxcpa 共回答了19个问题
xsxcpa 共回答了19个问题 |采纳率84.2%反应物式量=314
所以物质的量=7.47/314=0.024 mol
即n(NaHCO3)=0.024 mol,n(Na2CO3)=0.048 mol
n(C)=0.072 mol
现在只生成0.03 mol CO2,说明所有的Na2CO3都转化为NaHCO3,但尚还有一部分NaHCO3未和HCl反应
Na2CO3转化为NaHCO3需要HCl的物质的量=0.048 mol
之后生成0.03 mol CO2又需要0.03 mol HCl
所以总反应的HCl的物质的量=0.078 mol
浓度=0.078/0.03=2.6 mol/L1年前查看全部
- (5了了8•梅州一模)某天然碱(纯净物)可看作是由CO5和NaOH反应后的产物所组成,其化学式为xNa5CO得•yNaH
(梅州一模)某天然碱(纯净物)可看作是由CO5和NaOH反应后的产物所组成,其化学式为xNa5CO得•yNaHCO得•zH5O.化学兴趣小组为确定x、y、z的值进行如下实验:取得.得5g天然碱样品于装置Ⅰ或装置Ⅱ中加热至得了了℃,恒重后停止加热;过滤沉淀,烘干称重.

(1)按照上述实验过程,该化学兴趣小组至少使用______次天平.
(5)将天然碱样品加热,冷却至室温,称量其质量为i1g,再次加热并冷却至室温称量其质量为i5g,且i1-i5=了.得,接下来的操作应当是______.
(得)你认为选择______(填装置Ⅰ或装置Ⅱ)进行实验为佳.选择的理由是______.
(4)有一学生在加热过程中对剩余固体进行了次称重,(处理数据时已经减去仪器质量)并描出如图5所示曲线:
①写出t1→t5反应的化学方程式:5NaHCO得
Na5CO得+H5O+CO5↑△ .5NaHCO得.
Na5CO得+H5O+CO5↑△ .
②通过上述曲线确定天然碱样品的化学式:______. 宇文拓踢1年前1
宇文拓踢1年前1 -
 恬恬的甜 共回答了23个问题
恬恬的甜 共回答了23个问题 |采纳率78.3%解题思路:(1)根据实验目的、实验装置分析实验步骤,判断在实验过程中至少使用托盘天平的次数;
(2)给固体加热分解的实验中,两次称量的质量差必须小于0.1g,才算充分分解;
(3)装置Ⅰ中的试管中会有残留的二氧化碳气体,导致最后沉淀的二氧化碳的质量减小,影响测定结果;
(4)①根据加热xNa2CO3•yNaHCO3•zH2O时结晶水先失去判断t1→t2的反应,并写出反应的化学方程式;
②根据图象中水的质量、碳酸氢钠分解导致固体减少的质量分别计算出水的物质的量、碳酸氢钠的物质的量,再根据2.96g为碳酸氢钠和碳酸钠的质量,而碳酸氢钠的质量已知,据此可以计算出碳酸钠的物质的量,最后根据三者物质的量之比计算出天然碱样品的化学式.(s)确定xNa2CO得•yNaHCO得•zH2O中x、y、z的值,需要称量的质量有:加热前固体质量、称量大试管的质量、加热后大试管和固体的质量、澄清石灰水吸收二氧化碳之前质量和之后的质量,所以至p需要称量个次,
故答案为:个;
(2)称量其质量为他sg,再次加热并冷却至室温称量其质量为他2g,由于他s-他2=0.得>0.s,必须满足他s-他2<0.s时才可以认为固体完全分解,所以需要继续加热,
故答案为:继续加热;
(得)装置Ⅰ中,由于试管中会有p量的二氧化碳气体,造成测定的误差较大,影响测定结果;而装置Ⅱ使用空气将分解产物驱赶到澄清石灰水中,测定结果较准确,
故答案为:装置Ⅱ;选用装置Ⅰ会有p量CO2仍留在试管中造成误差大;
(4)①xNa2CO得•yNaHCO得•zH2O加热时先失去结晶水,从开始加热到十s的过程为失去结晶水的过程;十s→十2反应的过程为碳酸氢钠分解生成碳酸钠,反应的化学方程式为:2NaHCO得
△
.
Na2CO得+H2O+CO2↑,
故答案为:2NaHCO得
△
.
Na2CO得+H2O+CO2↑或xNa2CO得•yNaHCO得
△
.
(x+y/2)Na2CO得+y/2H2O+y/2CO2↑;
②根据图象可知,结晶水的质量为:得.得2g-2.96g=0.得6g,n(H2O)=[0.得6g/s个g/mo个]=0.02mo个,
十s→十2反应的过程中减p的质量为碳酸氢钠分解生成二氧化碳和水的质量,减p的质量为:2.96g-2.6个g=0.得sg,
根据反应2NaHCO得
△
.
Na2CO得+H2O+CO2↑△m
2mo个62g
n0.得sg
碳酸氢钠的物质的量为:n(NaHCO得)=[2mo个×0.得sg/62g]=0.0smo个,2.96g固体中m(NaHCO得)=个4g/mo个×0.0smo个=0.个4g,所以碳酸钠的质量为:2.96g-0.个4g=2.s2g,所以含有的碳酸钠的物质的量为:n(Na2CO得)=[2.s2g/s06g/mo个]=0.02mo个,故x:y:z=0.02:0.0s:0.02=2:s:2,该天然碱样品的化学式为:2Na2CO得•NaHCO得•2H2O,
故答案为:2Na2CO得•NaHCO得•2H2O.点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了探究确定天然碱样品的化学式的方法,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.1年前查看全部
- (2011•奉贤区一模)自然界存在某天然碱(纯净物)的化学组成可表示为aNa2CO3•bNaHCO3•cH2O(a、b、
(2011•奉贤区一模)自然界存在某天然碱(纯净物)的化学组成可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c 为正整数).现称取不同质量的天然碱样品,溶于水后,分别逐滴加入相同浓度的盐酸溶液30.0ml,产生CO2 的体积(标准状况)如图所示.

(1)若用2.49g样品进行同样的实验时,产生CO2______mL(标准状况).
(2)另取3.32g天然碱样品于3000C加热分解至完全(3000C 时Na2CO3 不分解)产生CO2 112ml(标准状况)和水0.450g,试通过计算确定该天然碱的化学式.
(3)实验所用盐酸的物质的量浓度是多少?
(4)若在上述某次实验中,收集到336ml(标准状况)的气体,该此实验中称取天然碱样品的质量可能是多少? istep1年前1
istep1年前1 -
 178178178 共回答了18个问题
178178178 共回答了18个问题 |采纳率94.4%解题思路:(1)由图象可知,m(样品)≤4.98g时,样品质量与CO2体积成正比;
(2)根据元素守恒计算;
(3)当4.98g≤m(样品)≤12.45g时,30mL盐酸全部参加反应.其中m(样品)=4.98g时,样品中Na2CO3、NaHCO3都恰好生成CO2;m(样品)=12.45g时,样品中Na2CO3恰好生成NaHCO3;
(4)收集到336ml气体时,可能存在两种情况:①盐酸过量,②天然碱过量,结合方程式计算.解析:题中图示表示将30mL盐酸逐滴加入样品溶液中,所加样品质量与生成CO2的体积(标准状况)的关系.
(1)m(样品)≤4.98g时,样品质量与CO2体积成正比.设2.49g样品反应生成CO2的体积为V,则[2.49g/V=
3.32g
672ml],V=504mL,故答案为:504;
(2)3.32g样品中,n(NaHCO3)=2n(CO2)=2×[0.112L/22.4L/mol]=0.01mol,
n(H2O)=[0.45g−0.005mol×18g/mol/18g/mol]=0.02mol.
由碳元素守恒得:
n(Na2CO3)=[0.672L/22.4L/mol]-0.01mol=0.02mol,则n(Na2CO3):n(NaHCO3):n(H2O)=0.02mol:0.01mol:0.02mol=2:1:2.
故该天然碱的组成为:2Na2CO3・NaHCO3・2H2O.
答:该天然碱的组成为:2Na2CO3・NaHCO3・2H2O.
(3)当4.98g≤m(样品)≤12.45g时,30mL盐酸全部参加反应.其中m(样品)=4.98g时,样品中Na2CO3、NaHCO3都恰好生成CO2;m(样品)=12.45g时,样品中Na2CO3恰好生成NaHCO3.任一情形用于计算盐酸浓度都很方便.
样品质量为4.98g时,反应式为:
2Na2CO3・NaHCO3・2H2O+5HCl=5NaCl+3CO2↑+5H2O
由以上可知,消耗n(HCl)=[4.98g/332g/mol]×5=0.075mol,c(HCl)=[0.075mol/0.03L]=2.5mol/L,
答:实验所用盐酸的物质的量浓度是2.5mol/L.
(4)收集到336ml气体时,可能存在两种情况:①盐酸过量,②天然碱过量,
①盐酸过量时,设天然碱的质量为x,
则[x/336ml=
3.32g
672ml],x=1.16g;
②天然碱过量时,设需要ymol天然碱,
则含有2ymolNa2CO3,ymolNaHCO3,发生反应有:
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=CO2↑+NaCl+H2O
则:2y+[0.336L/22.4L/mol]=0.03L×2.5mol/L
y=0.03mol,
则m(2Na2CO3••NaHCO3•2H2O)=0.03mol×332g/mol=9.96g.
答:盐酸过量时1.66克; 天然碱过量时9.96克点评:
本题考点: 化学方程式的有关计算;物质的量的相关计算;复杂化学式的确定.
考点点评: 本题主要考查了图象数据的分析和应用能力,化学实验的结果常以图象的形式表示,看图用图是基本的化学能力之一,题目难度较大,注意根据图象结合反应的化学方程式计算.1年前查看全部
- 某天然碱的组成为2Na2CO3 * NaHCO3 * xH2O,称取1.107g天然碱溶于水,配成100mL溶液,在该溶
某天然碱的组成为2Na2CO3 * NaHCO3 * xH2O,称取1.107g天然碱溶于水,配成100mL溶液,在该溶液中,加入50mL、0.2mol/L Ba(OH)2溶液恰好使CO32-、HCO3-完全沉淀.试计算
(1)生成沉淀的质量
(2)x值 tangming1年前1
tangming1年前1 -
 即将掉落的烟灰 共回答了15个问题
即将掉落的烟灰 共回答了15个问题 |采纳率86.7%Ba(OH)2量为0.2*0.05=0.01mol
所以生成沉淀为BaCO3,质量为0.01*(137+96)=2.33g
产生沉淀实际意义上就Ba离子和CO3离子结合产生
所以碱中产生的CO3离子量也为0.01mol
因为1mol碱能够产生3mol的CO3离子
所以碱的量为0.01/3mol
所以0.01/3*(2*106+84+18x)=1.107
解得x=21年前查看全部
- 我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数比).小红同学为测定其组
我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:

已知:碳酸钠比较稳定,加热时不分解;2NaHCO3
Na2CO3+CO2↑+H2O△ .
图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
(一)实验步骤 ①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量 ④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
(二)问题探究:
(1)E中的药品为______,E的作用是______.C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是______,
F的作用是______,G的作用是______.
(2)实验步骤②与③能否颠倒______(填“能”或“不能”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量______(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是______;
若没有G装置,则碳酸氢钠的质量______(填“偏大”、“偏小”、“无影响”).
(3)据右表回答下列问题:反应前 反应后 E的质量为100.0g E的质量为102.25g F的质量为50.0g F的质量为51.1g
①碳酸氢钠分解生成二氧化碳的质量为______g,
②碳酸氢钠的质量为______g
③结晶水的质量为______g
④Na2CO3的质量为______g,
⑤该天然碱的化学式中a:b:c=______. fqwmjj1年前1
fqwmjj1年前1 -
 我是一只蚂晚蚁 共回答了19个问题
我是一只蚂晚蚁 共回答了19个问题 |采纳率94.7%解题思路:根据整个组合装置及步骤分析每个装置及每步操作的目的,要测定物质组成,通过组合装置需测出加热时产生的二氧化碳及水的质量,空气中含有水蒸气和二氧化碳,在加热前要除去,生成的二氧化碳能残存在装置内,应全部排到F装置内吸收.还应注意不能让空气中的二氧化碳和水进入装置F中影响测量结果.(1)分析整个装置,结合实验步骤,组装好装置,检查气密性之后反复推拉注射器是为了将装置内的二氧化碳和水蒸气全部排出,在气体进入D装置之前需除去空气中的二氧化碳和水蒸气,用除去这二者的剩余空气将D装置以后的整套装置中的空气排出,故C的碱石灰的作用是除去空气中的二氧化碳和水蒸气;固体受热碳酸氢钠分解产生水蒸气和二氧化碳,要先通过浓硫酸吸收水蒸气,然后再通过碱石灰吸收二氧化碳,故E中盛浓硫酸来吸收水分,F中碱石灰是吸收生成的二氧化碳;为防止空气中二氧化碳和水分进入F装置使测量结果偏大,故连接G装置吸收空气中的二氧化碳和水分.
(2)实验步骤②与③不能颠倒,步骤②③是将装置内的空气完全被EF吸收,然后称量EF的质量,这样第一次称重就包含了装置内的二氧化碳和水.当反应结束后再次称重EF,两次的差值就是生成的二氧化碳和水.若②与③颠倒,则第一次称重不包含中装置内的二氧化碳和水,而第二次称重包括了装置内原有的二氧化碳和水,同时还包括新生成的二氧化碳和水,这样的两次差值就大于实际生成的二氧化碳和水,导致计算结果偏大.若不进行步骤⑤,则生成的二氧化碳和水蒸气会残存在装置内,使结果偏小;所以该步操作的目的是使生成的二氧化碳和水蒸气吸收充分;若没有G装置,则空气中的二氧化碳和水蒸气会进入F装置,使结果偏大.
(3)E中增重的质量为水的质量,F中增重的质量为生成的二氧化碳的质量,根据表中数据可知碳酸氢钠分解产生二氧化碳的质量为1.1g,根据二氧化碳的质量可求出碳酸氢钠的质量和碳酸氢钠分解生成的水的质量,用总水量减去生成的水的质量就是原物质中结晶水的质量,用物质的总质量减去碳酸氢钠和结晶水的质量就是碳酸钠的质量,进而可求出系数比.
根据表中数据,二氧化碳的质量为1.1g,原物质中的结晶水和生成的水质量和为2.25g,
设碳酸氢钠的质量为x,生成的水的质量为y,
2NaHCO3
△
.
Na2CO3+CO2↑+H2O
16844 18
x 1.1gy
[168/X]=[44/1.1g]=[18/y] x=4.2g y=0.45g
故结晶水的质量为2.25g-0.45g=1.8g
原物质中碳酸钠的质量为16.6g-4.2g-1.8g=10.6g
所以a:b:c=[10.6g/106]:[4.2g/84]:[1.8g/18]=2:1:2
故答案为:
(1)浓硫酸(浓H2SO4),吸收水蒸气. 除去空气中的二氧化碳、水蒸气等杂质气体,
吸收二氧化碳,防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定.
(2)不能.偏小;使生成的二氧化碳、水蒸气吸收充分;
偏大
(3)①1.1
②4.2
③1.8
④10.6
⑤2:1:2.点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;实验探究物质的组成成分以及含量;实验数据处理或者误差分析的探究.
考点点评: 解答本题关健是分析组合装置中每个装置的作用及每步操作的目的,理清思路才能很好的解答本题.1年前查看全部
- 某天然碱的化学组成为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数),下面是利用天然碱制备小苏打和烧碱的流
某天然碱的化学组成为aNa2CO3•bNaHCO3•cH2O(a、b、c为正整数),下面是利用天然碱制备小苏打和烧碱的流程图.

回答下列问题:
(1)向X的溶液中滴入酚酞试液后溶液显______色,原因是(写离子方程式)______.向上述溶液中滴入过量的CaCl2溶液,观察到的现象是______.
(2)上述由X制备小苏打和烧碱的化学方程式:______.
(3)若取3 32g天然碱样品充分加热收集到0.112L(标况)CO2和0.45g H2O,将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,试推算该天然碱的化学组成______. 2us天将明1年前1
2us天将明1年前1 -
 tianya341 共回答了26个问题
tianya341 共回答了26个问题 |采纳率84.6%解题思路:(1)天然碱的化学组成为aNa2CO3•bNaHCO3•cH2O,加热生成的X为Na2CO3,Na2CO3溶液中CO32-水解,溶液呈碱性.向X的溶液中滴入酚酞试液后溶液显红色,向滴入酚酞Na2CO3溶液中滴入过量的CaCl2溶液,发生反应生成碳酸钙沉淀,碳酸钙是白色沉淀,溶液呈中性,红色褪去.
(2)向Na2CO3溶液中通入CO2,可以制得NaHCO3,试剂1为CO2.向Na2CO3溶液中加入试剂2生成NaOH,故生成难溶性碳酸盐.加热W可得试剂1与试剂2,中学常见W为CaCO3.故试剂2为CaO.
(3)3.32g天然碱样品加热收集到0.112L(标况)CO2和0.45g H2O,利用2NaHCO3
Na2CO3+CO2↑+H2O可知,NaHCO3分解生成0.112L(标况)CO2,物质的量为0.005mol,据此计算3.32g天然碱中NaHCO3的物质的量为0.01mol,以及NaHCO3分解生成的水的物质的量为0.005mol,NaHCO3分解生成的Na2CO3的物质的量为0.005mol;0.45g H2O是NaHCO3分解生成的水与原晶体中含有的结晶水,物质的量为0.025mol,所以3.32g天然碱中含有结晶水为0.025mol-0.005mol=0.02mol;△ .
将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,物质的量为0.025mol,根据碳元素守恒可知,3.32g天然碱中Na2CO3物质的量为0.025mol-0.005mol=0.02mol.据此书写化学式.(1)天然碱的化学组成为aNa2CO3•bNaHCO3•cH2O,加热生成的X为Na2CO3,Na2CO3溶液中CO32-水解CO32-+H2O
 HCO3-+OH-,溶液呈碱性.向滴入酚酞Na2CO3溶液中滴入过量的CaCl2溶液,发生反应生成碳酸钙沉淀,碳酸钙是白色沉淀,溶液呈中性,红色褪去.
HCO3-+OH-,溶液呈碱性.向滴入酚酞Na2CO3溶液中滴入过量的CaCl2溶液,发生反应生成碳酸钙沉淀,碳酸钙是白色沉淀,溶液呈中性,红色褪去.
故答案为:红;CO32-+H2O HCO3-+OH-;产生白色沉淀,且溶液红色褪去.
HCO3-+OH-;产生白色沉淀,且溶液红色褪去.
(2)向Na2CO3溶液中通入CO2,可以制得NaHCO3,试剂1为CO2.向Na2CO3溶液中加入试剂2生成NaOH,故生成难溶性碳酸盐.加热W可得试剂1与试剂2,中学常见W为CaCO3.故试剂2为CaO.
所以由Na2CO3制备小苏打和烧碱的化学方程式为:Na2CO3+CO2+H2O═2NaHCO3;Na2CO3+CaO+H2O═2NaOH+CaCO3↓.
故答案为:Na2CO3+CO2+H2O═2NaHCO3;Na2CO3+CaO+H2O═2NaOH+CaCO3↓.
(3)3.32g天然碱样品加热收集到0.112L(标况)CO2和0.45g H2O,由2NaHCO3
△
.
Na2CO3+CO2↑+H2O可知,NaHCO3分解生成0.112L(标况)CO2,物质的量为[0.112L/22.4L/mol]=0.005mol,所以3.32g天然碱中NaHCO3的物质的量为0.01mol,NaHCO3分解生成的水的物质的量为0.005mol,NaHCO3分解生成的Na2CO3的物质的量为0.005mol;
0.45g H2O是NaHCO3分解生成的水与原晶体中含有的结晶水,0.45g物质的量为[0.45g/18g/mol]=0.025mol,所以3.32g天然碱中含有结晶水为0.025mol-0.005mol=0.02mol;
将所得固体于足量稀盐酸中又收集到0.56L(标况)CO2气体,物质的量为[0.56L/22.4L/mol]=0.025mol,根据碳元素守恒可知,3.32g天然碱中Na2CO3物质的量为0.025mol-0.005mol=0.02mol.
所以天然碱晶体中n(Na2CO3):n(NaHCO3):n(H2O)=0.02 mol:0.01 mol:0.02 mol=1:2:1.
所以该天然碱晶体化学式为2Na2CO3•NaHCO3•2H2O.
故答案为:2Na2CO3•NaHCO3•2H2O.点评:
本题考点: 制备实验方案的设计;钠的重要化合物.
考点点评: 以天然碱制备小苏打和烧碱为载体,考查学生对实验制备原理的理解、盐类水解、元素化合物性质、化学计算等,难度中等,理解制备原理是解题关键.注意制备烧碱的反应不要写出氢氧化钙与碳酸钠反应.1年前查看全部
- 某天然碱可以看作是CO 2 和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:⑴称取3.32g天
某天然碱可以看作是CO 2 和NaOH反应后的产物组成的一种物质。为了测定该物质的成分,进行如下实验:⑴称取3.32g天然碱样品,加入30mL过量稀盐酸,产生672mL CO 2 气体(标准状况);⑵另称取3.32g天然碱样品,在300℃下加热至分解完全,产生CO 2 112mL(标准状况)和0.45g水。试通过计算,确定天然碱的化学式。
 月池赋清风1年前1
月池赋清风1年前1 -
 tiankongsky11 共回答了23个问题
tiankongsky11 共回答了23个问题 |采纳率95.7%2Na 2 CO 3 ·NaHCO 3 ·2H 2 O
略1年前查看全部
- 某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质.为了测定该物质的成分,进行如下实验:
某天然碱可以看作是CO2和NaOH反应后的产物组成的一种物质.为了测定该物质的成分,进行如下实验:
(1)称取3.32 g天然碱样品,加入30 mL过量稀盐酸,产生672 mLCO2气体(标准状况).
(2)另称取3.32 g天然碱样品,在300 ℃下加热至分解完全,产生CO2 112 mL(标准状况)和0.45 g水.
试通过计算,确定天然碱的化学式. 水老虎0011年前2
水老虎0011年前2 -
 2102031003 共回答了13个问题
2102031003 共回答了13个问题 |采纳率84.6%由2NaHCO3=Na2CO3+CO2+H2O
得NaHCO3的物质的量为2×0.112/22.4=0.01(mol)
则Na2CO3的物质的量为0.672/22.4—0.01=0.02(mol)
H2O的物质的量为(3.32—0.02×106—0.01×84)/18=0.02(mol)
所以该天然碱的化学式为2 Na2CO3•NaHCO3•2H2O1年前查看全部
- 一道科学题某校九年级科学探究小组同学为了测定一种天然碱(可用化学式mNa2CO3nNaHCO3kH2O表示)的组成,进行
一道科学题
某校九年级科学探究小组同学为了测定一种天然碱(可用化学式mNa2CO3nNaHCO3kH2O表示)的组成,进行了如下实验:
1.称取3.32g天然碱样品,溶解在足量的稀Hcl中产生1.23gCO2;
2.称取3.32g天然碱样品,在300℃下加热至质量不再减少,产生0.22gCO2和0.45gH2O.
试通过计算确定该天然碱的化学式.(提示:300℃下加热,碳酸钠不分解,而碳酸氢钠分解为碳酸钠,二氧化碳和水) cleston1年前3
cleston1年前3 -
 曲中 共回答了22个问题
曲中 共回答了22个问题 |采纳率81.8%由条件1:CO32-+H+=H2O+CO2,那么碳酸根的质量为1.68g,
由条件2:2NaHCO3=Na2CO3+H2O+CO2,那么有碳酸氢钠的质量为0.84g,生成水的质量为0.09g,原来有水0.36g,原来有碳酸钠3.32-0.36-0.84=2.12g,
所以m=2.12/106=0.02,n=0.84/0.01,k=0.36/18=0.02
取整数比为m=2,n=1,k=2
2Na2CO3.NaHCO3.2H2O,
是我再算碳酸钠式量搞错了.1年前查看全部
- (2013•丹徒区模拟)我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数
(2013•丹徒区模拟)我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:

已知:1.碳酸钠比较稳定,加热时不分解;
2.2NaHCO3
Na2CO3+CO2↑+H2O.△ .
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
(一)实验步骤
(1)实验时,组装好装置,实验前应先______,然后,实验步骤是:①反复推拉注射器②称量E、F的质量③关闭弹簧夹,加热D处试管直到反应不再进行④打开弹簧夹,再次反复缓缓推拉注射器⑤再次称量E、F的质量.
(二)问题探究:
(2)E中的药品为______,E的作用是______.C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是______,F的作用是______.写出 F装置中所发生反应的一个化学方程式______.
(3)实验步骤②与③能否颠倒______(填“能”或“不能”).若不进行步骤④的操作,则所测得的碳酸氢钠质量______(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是______;若没有G装置,则碳酸氢钠的质量______(填“偏大”、“偏小”、“无影响”).
(4)下表是实验记录数据:
则:①碳酸氢钠分解生成二氧化碳的质量为______g反应前 反应后 E的质量为100.0g E的质量为102.25g F的质量为50.0g F的质量为51.1g
②碳酸氢钠的质量为______g
③该天然碱的化学式中a:b:c=______. lsls48885671年前1
lsls48885671年前1 -
 zhaoruijiazhao 共回答了21个问题
zhaoruijiazhao 共回答了21个问题 |采纳率100%解题思路:根据整个组合装置及步骤分析每个装置及每步操作的目的,要测定物质组成,通过组合装置需测出加热时产生的二氧化碳及水的质量,空气中含有水蒸气和二氧化碳,在加热前要除去,生成的二氧化碳能残存在装置内,应全部排到F装置内吸收.还应注意不能让空气中的二氧化碳和水进入装置F中影响测量结果,根据F装置内质量的增加量就是生成二氧化碳的质量,根据二氧化碳的质量通过方程式计算出其它物质的质量.(1)分析整个装置,结合实验步骤,组装好装置,检查气密性之后反复推拉注射器是为了将装置内的二氧化碳和水蒸气全部排出,在气体进入D装置之前需除去空气中的二氧化碳和水蒸气,用除去这二者的剩余空气将D装置以后的整套装置中的空气排出,故C的碱石灰的作用是除去空气中的二氧化碳和水蒸气;固体受热碳酸氢钠分解产生水蒸气和二氧化碳,要先通过浓硫酸吸收水蒸气,然后再通过碱石灰吸收二氧化碳,故E中盛浓硫酸来吸收水分,F中碱石灰是吸收生成的二氧化碳;为防止空气中二氧化碳和水分进入F装置使测量结果偏大,故连接G装置吸收空气中的二氧化碳和水分.
(2)E中的药品为浓硫酸,具有吸水性,为了吸收反应生成的水的质量;在气体进入D装置之前需除去空气中的二氧化碳和水蒸气,用除去这二者的剩余空气将D装置以后的整套装置中的空气排出,故C中放碱石灰的作用是除去空气中的二氧化碳和水蒸气;F中碱石灰是吸收生成的二氧化碳,根据F装置内质量的增加量就是生成的二氧化碳的质量;反应物是二氧化碳和氢氧化钠,生成物是碳酸钠和水,用观察法配平,所以方程式是CO2+2NaOH═Na2CO3+H2O.
(3)实验步骤②与③不能颠倒,步骤②③是将装置内的空气完全被EF吸收,然后称量EF的质量,这样第一次称重就包含了装置内的二氧化碳和水.当反应结束后再次称重EF,两次的差值就是生成的二氧化碳和水.若②与③颠倒,则第一次称重不包含中装置内的二氧化碳和水,而第二次称重包括了装置内原有的二氧化碳和水,同时还包括新生成的二氧化碳和水,这样的两次差值就大于实际生成的二氧化碳和水,导致计算结果偏大.若不进行步骤④,则生成的二氧化碳和水蒸气会残存在装置内,使结果偏小;所以该步操作的目的是使生成的二氧化碳和水蒸气吸收充分;若没有G装置,则空气中的二氧化碳和水蒸气会进入F装置,使结果偏大.
(4)E中增重的质量为水的质量,F中增重的质量为生成的二氧化碳的质量,根据表中数据可知碳酸氢钠分解产生二氧化碳的质量为1.1g,根据二氧化碳的质量可求出碳酸氢钠的质量和碳酸氢钠分解生成的水的质量,用总水量减去生成的水的质量就是原物质中结晶水的质量,用物质的总质量减去碳酸氢钠和结晶水的质量就是碳酸钠的质量,进而可求出系数比.
根据表中数据,二氧化碳的质量为1.1g,原物质中的结晶水和生成的水质量和为2.25g,
设碳酸氢钠的质量为x,生成的水的质量为y,
2NaHCO3
△
.
Na2CO3+CO2↑+H2O
168 44 18
x1.1gy
根据[168/X=
44
1.1g]解得x=4.2g,根据[44/1.1g]=[18/y]解得 y=0.45g
故结晶水的质量为2.25g-0.45g=1.8g
原物质中碳酸钠的质量为16.6g-4.2g-1.8g=10.6g
所以a:b:c=[10.6g/106]:[4.2g/84]:[1.8g/18]=2:1:2
故答案为:(1)检查装置的气密性;(2)浓硫酸;吸收生成的水;除去空气中的二氧化碳和水蒸气;吸收生成的二氧化碳;CO2+2NaOH═Na2CO3+H2O;(3)不能; 偏小;使二氧化碳被充分吸收;偏大;(4)①1.1;②4.2;③2:1:2.点评:
本题考点: 实验探究物质的组成成分以及含量;气体的净化(除杂);盐的化学性质;根据化学反应方程式的计算.
考点点评: 解答本题关健是分析组合装置中每个装置的作用及每步操作的目的,理清思路才能很好的解答本题.1年前查看全部
- 某种天然碱样品的化学式可以用xNaHCO 3 •yNa 2 CO 3 •zH 2 O表示(式中x、y、z是最简整数比).
某种天然碱样品的化学式可以用xNaHCO 3 •yNa 2 CO 3 •zH 2 O表示(式中x、y、z是最简整数比).取50克某一浓度的盐酸与3.32克样品充分反应,能生成1.32克CO 2 气体.
(1)若改用1.66克样品与50克这种盐酸反应,能生成多少克CO 2 ?
(2)另取3.32克样品在300℃下加热至完全分解(已知Na 2 CO 3 在300°C时不会分解),能产生0.22克CO 2 和0.45克H 2 O,试确定该样品的化学式.
(3)写出这种天然碱与盐酸完全反应的化学方程式.若6.64克天然碱样品与50克该盐酸充分反应时放出的CO 2 最多,求该盐酸的溶质质量分数. 剪刀石头布7891年前1
剪刀石头布7891年前1 -
 miss_home 共回答了22个问题
miss_home 共回答了22个问题 |采纳率95.5%(1)1.32g÷3.32g×1.66g=0.66g;
(2)设样品中NaHCO 3 质量为a,生成水的质量为b,
2NaHCO 3
△
.
Na 2 CO 3 +H 2 O+CO 2 ↑
168 1844
a b 0.22g
∴
168
44 =
a
0.22g ,
18
44 =
b
0.22g ,
∴a=
0.22g×168
44 =0.84g,
∴b=
0.22g×18
44 =0.09g,
则样品中H 2 O的质量为:0.45g-0.09g=0.36g;
样品中Na 2 CO 3 的质量为:3.32g-0.84g-0.36g=2.12g;
∴xNaHCO 3 •yNa 2 CO 3 •zH 2 O中xNaHCO 3 :yNa 2 CO 3 :zH 2 O=84x:106y:18z=0.84g:2.12g:0.36g,
∴x:y:z=1:2:2;
故可判断该样品的化学式为:NaHCO 3 •2Na 2 CO 3 •2H 2 O;
(3)①这种天然碱与盐酸完全反应的化学方程式为:NaHCO 3 •2Na 2 CO 3 •2H 2 O+5HCl=5NaCl+3CO 2 ↑+5H 2 O;
②设与6.64克天然碱样品完全反应的HCl的质量为c,
NaHCO 3 •2Na 2 CO 3 •2H 2 O+5HCl=5NaCl+3CO 2 ↑+5H 2 O
332 182.5
6.64g c
∴
332
182.5 =
6.64g
c
∴c=
6.64g×182.5
332 =3.65g;
则该盐酸的溶质质量分数为:
3.65g
50g ×100%=7.3%.
答:(1)若改用1.66克样品与50克这种盐酸反应,能生成0.66克CO 2 ;
(2)该样品的化学式为:NaHCO 3 •2Na 2 CO 3 •2H 2 O;
(3)这种天然碱与盐酸完全反应的化学方程式为NaHCO 3 •2Na 2 CO 3 •2H 2 O+5HCl=5NaCl+3CO 2 ↑+5H 2 O;该盐酸的溶质质量分数为7.3%.1年前查看全部
- 天然碱的组成可以用aNa2CO3•bNaHCO3•cH2O(a、b、c为整数)表示.现有3种不同的天然碱样品,分别进行如
天然碱的组成可以用aNa2CO3•bNaHCO3•cH2O(a、b、c为整数)表示.现有3种不同的天然碱样品,分别进行如下实验以确定其化学式.
(1)将质量为62.0g的样品A平均分成两份,一份在300℃下充分灼烧(Na2CO3不分解),固体质量减轻9.8g;另一份溶于水后加入足量的Ba(OH)2溶液,得到白色沉淀59.1g.样品A的化学式可以表示为______.
(2)将质量为4.71g的样品B溶于水,逐滴滴加一定浓度的稀盐酸,产生气体的质量与加入盐酸的质量有下表所示关系:
[已知在盐酸不足时会发生反应:Na2CO3+HCl=NaHCO3+NaCl+H2O]盐酸的质量分数为______;样品B的化学式可以表示为______.盐酸质量/g 20 40 60 80 气体质量/g 0 0.44 1.32 1.98  我就是这样啊1年前1
我就是这样啊1年前1 -
 cql831215 共回答了16个问题
cql831215 共回答了16个问题 |采纳率87.5%解题思路:(1)根据题意,碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳,减少的质量就是水和二氧化碳的质量,碳酸钡的质量是59.1g,其中碳元素的质量就等于天然碱中碳元素的质量,根据天然碱的质量、减少的质量和碳元素的质量可以列出三元一次方程组,解出未知数,求出整数比,写出化学式;
(2)根据盐酸和生成的气体的数据,分析找出加入盐酸的质量从40g到60g发生的反应是NNaHCO3+HCl=NaCl+H2O+CO2↑生成的二氧化碳的质量是1.32g-0.44g=0.88g,可以求出盐酸的质量分数.根据Na2CO3+HCl=NaHCO3+NaCl+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑根据表中消耗的盐酸的质量的关系,找出Na2CO3与NaHCO3的计量关系.再根据生成的总的二氧化碳的质量和天然碱的质量关系,求出c,写出化学式.(1)31.0g天然碱中碳元素的就是碳酸钡中碳元素的质量为:59.1g×[12/197]×100%=3.6g
由于:aNa2CO3•bNaHCO3•cH2O~b/2CO2+(b/2+c)H2O
106a+84b+18c22b+9b+18c
31.0g 9.8g
得出:
106a+84b+18c=31.0g
31b+18c=9.8g
(a+b)×12
106a+84b+18c×100%×31.0g=3.6g
解得:a=0.1 b=0.2 c=0.2所以:a:b:c=1:2:2
样品A的化学式可以表示为:Na2CO3•2NaHCO3•2H2O
(2)设盐酸的质量分数是w
NaHCO3+HCl=NaCl+H2O+CO2↑
36.5 44
(60g-40g)×w(1.32g-0.44g)
[36.5/44=
(60g−40g)×w
(1.32g−0.44g)]解得:w=3.65%
根据反应的方程式以及加入盐酸的质量从40g60g产生气体的质量与可知,每加入20g盐酸与碳酸氢钠产生二氧化碳的质量是0.88g,由此可知,加入的盐酸从0到30g用于碳酸钠转化为碳酸氢钠,从30g到75g用于碳酸氢钠转化为二氧化碳,由此可以得出a:b=2:1,
2Na2CO3•NaHCO3•cH2O~3CO2
2×106+84+18c 3×44
4.71g 1.98g
[2×106+84+18c/3×44=
4.71g
1.98g] 解得c=1
样品B的化学式可以表示为 2Na2CO3•NaHCO3•H2O
故答为:(1)Na2CO3•2NaHCO3•2H2O;(2)3.65%,2Na2CO3•NaHCO3•H2O.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题属于复杂的化学方程式的计算,在计算时,找出等量关系、有关量的质量关系是解题的关键.1年前查看全部
- 某天然碱的化学式可表示为2Na2CO3•NaHCO3•2H2O,取少量该物质溶于水得稀溶液,下列有关溶液P中微粒的物质的
某天然碱的化学式可表示为2Na2CO3•NaHCO3•2H2O,取少量该物质溶于水得稀溶液,下列有关溶液P中微粒的物质的量浓度关系错误的是( )
A.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B.c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.3c(Na+)>5c(CO32-)+5c(HCO3-)
D.将该溶液与少量NaOH溶液混合后:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) 86701年前1
86701年前1 -
 爱鹰1314 共回答了24个问题
爱鹰1314 共回答了24个问题 |采纳率83.3%解题思路:碳酸钠是强碱弱酸盐,其溶液呈碱性,碳酸氢钠中HCO3-水解程度大于电离程度,导致碳酸氢钠溶液呈碱性,所以该物质溶于水得稀溶液呈碱性,溶液中存在电荷守恒、物料守恒.A.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),存在物料守恒3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),则3c(OH-)=3c(H+)+2c(HCO3-)+5c(H2CO3)+2c(CO32-),故A错误;
B.碳酸根离子水解、碳酸氢根离子水解程度大于电离程度导致溶液中碱性,所以c(OH-)>c(H+),碳酸根离子、碳酸氢根离子水解程度都较小,所以溶液中存在c(CO32-)>c(HCO3-)>c(OH-)>c(H+),故B正确;
C.根据物料守恒得3c(Na+)=5c(CO32-)+5c(HCO3-)+5c(H2CO3),所以3c(Na+)>5c(CO32-)+5c(HCO3-),故C正确;
D.溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选AD.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小比较,根据溶液中溶质的性质结合电荷守恒、物料守恒来分析解答,该溶质为复盐,将复盐分解为碳酸钠、碳酸氢钠的方法进行分析,题目难度中等.1年前查看全部
- 1.我国青海湖采集的天然碱样品可表示为aNa2CO3.bNaHCO3.cH2O(a,b,c为最简整数比).小红同学为测定
1.我国青海湖采集的天然碱样品可表示为aNa2CO3.bNaHCO3.cH2O(a,b,c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6克,进行如下实验.(如图)
已知:1.碳酸钠比较稳定,加热时不分解;
2.2NaHCO3====(加热)Na2CO3+CO2+H2O
3.图中B处为两个单向阀,推注射器时A1关闭,A2打开;拉注射器,A1打开进空气,关闭A2.
1.组装,检查气密性;
2._________
3.称量E,F的质量;
4.关闭弹簧夹.加热
5.打开弹簧夹,再次反复缓缓推拉注射器:
6._________
E中药品为___,作用是___
C,F,G中装有碱石灰(氧化钙和氢氧化钠的混合物),则C,F,G的作用 分别 是_____________________
3能否颠倒_____.
根据下表计算,a:b:c=______
反应前 反应后
E 100g 102.25g
F 50g 51.1g
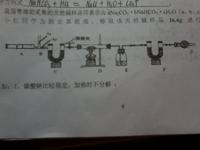
 无用米虫1年前1
无用米虫1年前1 -
 小东12 共回答了14个问题
小东12 共回答了14个问题 |采纳率92.9%29、(1)E中药品:浓硫酸(浓H2SO4).E的作用:吸收水蒸气.
C的作用:除去空气中的二氧化碳、水蒸气等杂质气体.F的作用:吸收二氧化碳.G的作用:防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳 质量的测定.
(答到关键词即可)
(2)不能,偏小,使生成的二氧化碳、水蒸气吸收充分.(防止气流速度过快,二氧化碳、水蒸气未被完全吸收)
(3)1.8g,10.6g,2:1:2.1年前查看全部
- 要解题思路的某天然碱可看做是二氧化碳和氢氧化钠的产物.取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量
要解题思路的
某天然碱可看做是二氧化碳和氢氧化钠的产物.取6.64g天然碱用酒精灯充分加热至恒重,将生成的气体依次通过过量的硫酸,过量的澄清石灰水后,浓硫酸增重0.9g,澄清石灰水生成沉淀1g.
(1)充分加热后,剩余固体重多少g?
(2)该天然碱除了有碳酸钠外,还有
(3)6.64g天然碱中,含碳酸钠的物质的量为多少mol?
(4)该天然碱的化学式为? 易枯荣1年前1
易枯荣1年前1 -
 MiamiCold 共回答了21个问题
MiamiCold 共回答了21个问题 |采纳率95.2%1.澄清石灰水生成沉淀1g,用二氧化碳量是0.44g,同时生成的水应为0.18g.剩余固体重:6.64g-0.18g-0.44g=6.02g
2.还有NaHCO3
3.用二氧化碳量是0.44g,同时生成的水应为0.18g.反应前用NaHCO3由议程式2NaHCO3加热=Na2CO3+CO2+H2O
计算为1.68g.含碳酸钠为6.64g-1.68g=4.96g物质的量为0.047mol
4.该天然碱的化学式为NaHCO3和Na2CO3的混合物.1年前查看全部
- 内蒙古那么便有天然碱产地.冬天捞碱.称为“破冰取碱” 请解释其中的道理
 elwin20071年前1
elwin20071年前1 -
 橘子juzi 共回答了14个问题
橘子juzi 共回答了14个问题 |采纳率85.7%碱就是碳酸钠 它受温度影响较大 冬天溶解度小 就会析出来 就可以破冰取碱了1年前查看全部
- 1.我国青海湖采集的天然碱样品可表示为aNa2CO3.bNaHCO3.cH2O(a,b,c为最简整数比).小红同学为测定
1.我国青海湖采集的天然碱样品可表示为aNa2CO3.bNaHCO3.cH2O(a,b,c为最简整数比).小红同学为测定其组成,称
 小曼991年前1
小曼991年前1 -
 诺诺儿 共回答了16个问题
诺诺儿 共回答了16个问题 |采纳率93.8%浓硫酸(浓H2SO4)
吸收水蒸气
除去空气中的二氧化碳
水蒸气等杂质气体
吸收二氧化碳
防止空气中的二氧化碳和水蒸气等杂质气体进入到F中,影响二氧化碳质量的测定
不能
偏小
使生成的二氧化碳、水蒸气吸收充分
2:1:21年前查看全部
- 某天然碱的化学式为xNa2CO3?NaHCO3?H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之
某天然碱的化学式为xNa2CO3?NaHCO3?H2O,为了测定其组成,取0.3320g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol/L的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL.该天然碱化学式中x=
为什么我的五三上说将酚酞由红色变无色的时候是刚好反应了碳酸钠?碳酸氢钠不是也是碱性吗?怎么不考虑呢? 我披蓑衣任烟雨1年前2
我披蓑衣任烟雨1年前2 -
 kakakakaka 共回答了13个问题
kakakakaka 共回答了13个问题 |采纳率61.5%碳酸氢钠是不与酚酞显色的.小苏打的弱酸性正好在酚酞变色的临界点上.1年前查看全部
大家在问
- 11.某人将人民币2000元按一年定期存入银行,到期后支取1000元用作消费,将剩下的1000元以及所得利息又全部按一年定
- 2在平面直角坐标系中有四个点,它们的坐标分别是A(0,3),B(-2,-1),C(3,-1),D(5,3).
- 3急迫渴望下雨的句子
- 4读图,完成下列问题。(13分) (1)在图中用箭头标出各洋流的运动方向。(2)写出下列洋流的名称。A________,B
- 5网络语言“2”是什么意思?
- 6英语填词I'm going to spend some time _________(stay) with my gra
- 7果胶酶 酵母在哪买?贵阳地区如题 果胶酶 型号LAFASE HE GRAND CRU VR单宁 酵母 1.菌种VL1 2
- 8关于定积分的求值函数∫0.02e^(-0.02t)Dt在区间(0,100)内连续可导,请问∫0.02e^(-0.02t)
- 9映山红花托有什么特别之处
- 10英语作文“my hometown in 20 years”
- 11英语翻译此次也没有再联系过现在每次想起这件事都会很后悔,后悔当初的倔强是从此再也没有再联系过
- 12求一个积分:f根号csc(x)dx
- 13粪尿中的有机物在( ),( )的作用下分解,变成植物可以吸收的溶解在水中的( ).
- 14premise是前提,假设,提出的意思.那in the premise呢?是不是关于此事?
- 15I _____no arms . I _____no legs and no feet ?应该怎么填哪?
