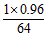用废铜制取硫酸铜,有人用以下两个实验方案:
 帅气wuwu2022-10-04 11:39:541条回答
帅气wuwu2022-10-04 11:39:541条回答| 用废铜制取硫酸铜,有人用以下两个实验方案: 甲方案:废铜  硫酸铜[Cu+2H 2 SO 4 (浓)═CuSO 4 +2H 2 O+SO 2 ↑] 硫酸铜[Cu+2H 2 SO 4 (浓)═CuSO 4 +2H 2 O+SO 2 ↑]乙方案:废铜  氧化铜 氧化铜 硫酸铜 硫酸铜你认为比较合理的是 ,原因 。 |

已提交,审核后显示!提交回复
共1条回复
 清凉雀巢 共回答了18个问题
清凉雀巢 共回答了18个问题 |采纳率94.4%- 乙同学;(1)不产生污染性气体,(2)产生相同质量的硫酸铜,乙方案硫酸用量少
二氧化硫是一种有毒气体,所以甲方案不可取,通过计算可知生成相同质量的硫酸铜,乙方案消耗的硫酸少,既节约了原料,又不污染环境. - 1年前
相关推荐
- 43,某课外兴趣小组利用废铜屑制取硫酸铜,设计方案如下:
43,某课外兴趣小组利用废铜屑制取硫酸铜,设计方案如下:
O2 稀H2SO4 稀H2SO4
甲:Cu——→CuO——→CuSO4 乙:Cu——→CuSO4
△ △
浓H2SO4 △
丙:Cu———→CuSO4 [Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O]
△
AgNO3溶液 NaOH溶液 稀H2SO4
丁:Cu————→Cu(NO3)2———→Cu(OH)2———→CuSO4
其中从理论,操作,经济,环保等方面考虑,你认为最合理的是( ),其他方案不合理的理由是 . 没钱没人生1年前2
没钱没人生1年前2 -
 捕风汉子L 共回答了21个问题
捕风汉子L 共回答了21个问题 |采纳率95.2%甲最合理,乙丙是直接加浓H2SO4 吧,那样会有SO2产生,有污染空气的坏处,丁也同理,在变成Cu(NO3)2有NO或NO2产生1年前查看全部
- 某活动小组用废铜制取硫酸铜溶液,实验过程为:
某活动小组用废铜制取硫酸铜溶液,实验过程为:

(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是_(填字母序号).
a.加热时氧化铜易分解生成铜b.铜与氧气没有完全反应c.加热时铜不能与氧气反应
(2)氧化铜与稀硫酸反应的化学方程式为______.
(3)操作Ⅰ的名称是______,该操作用到的玻璃仪器有:玻璃棒、烧杯、______.
(4)盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)______. 刀小兰1年前1
刀小兰1年前1 -
 贩独卖赢 共回答了16个问题
贩独卖赢 共回答了16个问题 |采纳率75%解题思路:(1)固体和气体反应会因为接触面积小而使反应不能完全进行.
(2)书写复分解反应的化学方程式时要首先判断能否反应,然后正确书写反应物和生成物的化学式,配平并注明条件.
(3)过滤是分离固体(铜)与液体(硫酸铜溶液)混合物的一种方法,过滤操作用到的主要仪器要记住,特别是玻璃仪器,有烧杯,玻璃棒和漏斗.
(4)盛放硫酸铜溶液不宜用铁制容器是因为铁和硫酸铜溶液反应.(1)铜在空气中加热时,生成的氧化铜会覆盖在铜的表面,使铜不能和氧气接触,不能完全反应,
故答案为:b;
(2)氧化铜是碱性氧化物,能和酸反应生成盐和水,即氧化铜与稀硫酸反应的化学方程式为:
CuO+H2SO4=CuSO4+H2O,故答案为:CuO+H2SO4=CuSO4+H2O;
(3)分离固体(铜)与液体(硫酸铜溶液)的操作Ⅰ的名称是过滤,该操作用到玻璃仪器,有烧杯、玻璃棒和漏斗,故答案为:过滤;漏斗;
(4)因为铁比铜活泼,能与硫酸铜溶液反应,化学方程式为:Fe+CuSO4═FeSO4+Cu,
故答案为:Fe+CuSO4═FeSO4+Cu.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查了同学们的问题分析能力还有书写化学方程式的能力,可以根据教材知识来回答,难度中等.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜.
(1)写出生成硫酸铜的化学方程式 ___ .
(2)现用1kg这种废铜屑理论上能制取胆矾 ___ 千克.
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液
①此配料中Cu2+离子和Ca2+离子的物质的量比为 ___ (最简整数比).
②波尔多液有效成分的化学式可表示为CuSO4•xCu(OH)2•yCa(OH)2,此种配比当x=1时,试确定y= ___ .
 佛曰不可說1年前1
佛曰不可說1年前1 -
 守望雪人 共回答了13个问题
守望雪人 共回答了13个问题 |采纳率84.6%解题思路:(1)根据铜、氧化铜的化学性质解答,铜能与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜;
(2)依据铜元素守恒计算得到;
(3)①依据胆矾与生石灰、水按质量比依次为1:0.56:100混合液中质量计算物质的量之比;
②依据化学式CuSO4•xCu(OH)2•yCa(OH)2,此种配比当x=1时,CuSO4+Ca(OH)2→Cu(OH)2+CaSO4.(1)铜在氧气的作用下生成氧化铜,氧化铜和硫酸反应生成硫酸铜,化学方程式为:2Cu+O2
△
.
2CuO;CuO+H2SO4═CuSO4+H2O;也可以合并为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)铜元素守恒计算得到,设生成胆矾质量为x
Cu~CuSO4•5H2O
64 250
1Kg×96% x
x=[1×0.96/64]×250=3.75(kg);
故答案为:3.75;
(3)①胆矾与生石灰、水按质量比依次为1:0.56:100混合,Cu2+离子和Ca2+离子的物质的量比=[1/250]:[0.56/56]=2:5;
故答案为:2:5;
②CuSO4+Ca(OH)2→Cu(OH)2+CaSO4
反应前2500
反应后1411
∴CuSO4•Cu(OH)2•yCa(OH)2中y=4;
故答案为:4.点评:
本题考点: 铜金属及其重要化合物的主要性质;配合物的成键情况;配制一定物质的量浓度的溶液.
考点点评: 本题考查了化学方程式的计算应用,物质制备过程的分析判断,题目难度中等.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用地便生成硫
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用地便生成硫酸铜.
(1)写出生成硫酸铜的化学方程式______.
(2)现用1kg这种废铜屑理论上能制取胆矾______千克.
(m)将胆矾与生石灰、水按质量比依次为1:我.56:1我我混合配制成无机铜杀菌剂波尔多液
①此配料中Cu2+离子和Ca2+离子的物质的量比为______(最简整数比).
②波尔多液有效成分的化学式可表示为CuSO的•右Cu(OH)2•yCa(OH)2,此种配比当右=1时,试确定y=______. ll很帅1年前1
ll很帅1年前1 -
 阳光流转 共回答了17个问题
阳光流转 共回答了17个问题 |采纳率88.2%解题思路:(1)根据铜、氧化铜的化学性质解答,铜能与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜;
(2)依据铜元素守恒计算得到;
(3)①依据胆矾与生石灰、水按质量比依次为1:0.56:100混合液中质量计算物质的量之比;
②依据化学式CuSO4•xCu(OH)2•yCa(OH)2,此种配比当x=1时,CuSO4+Ca(OH)2→Cu(OH)2+CaSO4.(八)铜在氧气的作用下生成氧化铜,氧化铜和硫酸反应生成硫酸铜,化学方程式为:2Cu+z2
△
.
2Cuz;Cuz+H2Sz4═CuSz4+H2z;也可以合并为:2Cu+z2+2H2Sz4=2CuSz4+2H2z;
故答案为:2Cu+z2+2H2Sz4=2CuSz4+2H2z;
(2)铜元素守恒计算得到,设生成胆矾质量为x
Cu~CuSz4•bH2z
64 2b0
八Kg×96% x
x=[八×0.96/64]×2b0=2.7b(kg);
故答案为:2.7b;
(2)①胆矾与生石灰、水按质量比依次为八:0.b6:八00混合,Cu2+离子和Ca2+离子的物质的量比=[八/2b0]:[0.b6/b6]=2:b;
故答案为:2:b;
②CuSz4+Ca(zH)2→Cu(zH)2+CaSz4
反应前2b00
反应后八4八八
∴CuSz4•Cu(zH)2•她Ca(zH)2的她=4;
故答案为:4.点评:
本题考点: 铜金属及其重要化合物的主要性质;配合物的成键情况;配制一定物质的量浓度的溶液.
考点点评: 本题考查了化学方程式的计算应用,物质制备过程的分析判断,题目难度中等.1年前查看全部
- (2012•连云港三模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.
(2012•连云港三模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.
以粗CuO为原料制备胆矾的主要流程如下: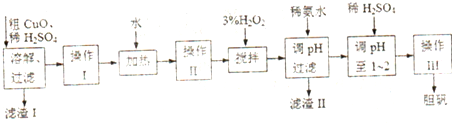
已知Fe3+,Fe2+,Cu2+转化为相应氢氧化物时,开始沉淀的沉淀完全时的pH如下表:
(1)为使粗CuO充分溶解,可采取的措施除适当延长溶解时间、充分搅拌、将粗CuO粉碎外,还有______(答一条即可)Fe3+ Fe2+ Cu2+ 开始沉淀的pH 2.7 7.6 5.2 沉淀完全的pH 3.7 9.6 6.4
(2)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的目的是______.H2O2参加反应的离子方程式为______.
(3)加入稀氨水后,溶液的pH应在______范围内.
(4)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精制胆矾.两步操作相同,都包括燕发浓缩、冷却结晶、吸滤、洗涤、干燥等步骤示和普通过滤相比,吸滤的优点是______.(至少答两条).
(5)吸滤操作中,除烧杯、玻璃棒、安全瓶外,还必须使用的属于硅酸盐材料的仪器有______. 龙红太1年前1
龙红太1年前1 -
 san340021 共回答了14个问题
san340021 共回答了14个问题 |采纳率92.9%解题思路:(1)加快溶解的方法有加热、增大接触面积、搅拌等;
(2)过氧化氢不稳定,受热易分解;
(3)调节溶液的pH目的是使铁离子全部沉淀,铜离子不沉淀,依据图表数据分析可知pH应为:3.7~5.2;
(4)循环水真空泵使吸滤瓶内减压,由于瓶内与布氏漏斗液面上形成压力差,因而加快了过滤速度;
(5)布什漏斗与吸滤瓶配套,用于无机制备中晶体或粗颗粒沉淀的减压过滤.(1)加热可促进反应速率,故答案为:给反应混合物加热;(2)过氧化氢不稳定,受热易分解,故加入过氧化氢前需使溶液冷却.Fe2+可被过氧化氢氧化为Fe3+,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为...
点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查了铜的化合物知识,对于减压过滤,教材没有介绍,可从网上查找更多信息.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式________________。
(2)现用1kg这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液
① 此波尔多液中Cu 2+ 离子和Ca 2+ 离子的物质的量比为__________(最简整数比)。
② 波尔多液有效成分的化学式可表示为CuSO 4 ·xCu(OH) 2 ·Ca(OH) 2 ,此种配比当x=1时,试确定y的数值。 烟雨蛇1年前1
烟雨蛇1年前1 -
 胡笳十八拍 共回答了9个问题
胡笳十八拍 共回答了9个问题 |采纳率100%1年前查看全部
- (2002•南宁)某课外兴趣小组利用废铜屑制取CuSO4,设计方案如下:
(2002•南宁)某课外兴趣小组利用废铜屑制取CuSO4,设计方案如下:
甲:Cu
CuOO2 △
CuSO4稀H2SO4 △
乙:Cu
CuSO4;(Cu+2H2SO4(浓)浓H2SO4 △
CuSO4+SO2↑+2H2O)△ .
丙:Cu
Cu(NO3)2AgNO3
Cu(OH)2NaOH 溶液
CuSO4稀H2SO4
丁:Cu
CuSO4FeSO4
从理论、操作、经济、环保等方面考虑,对每个方案进行简要评价,并从中确定一个最优方案.
甲方案:______
乙方案:______
丙方案:______
丁方案:______. 越夜越飞扬yxl1年前1
越夜越飞扬yxl1年前1 -
 brief_yang 共回答了12个问题
brief_yang 共回答了12个问题 |采纳率83.3%解题思路:对每一个方案要从理论,经济,环保及操作等方面考虑.
甲方案从理论、经济、环保及操作等方面都很好;
乙方案会生成二氧化硫有毒气体,不环保;
丙方案操作复杂,不经济;
丁方案因为铜的活动性比铁弱,不能置换出铁,从理论上行不通.甲方案:Cu在空气中灼烧,会与氧气生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,从理论、经济、环保及操作等方面都很好;
乙方案:Cu与浓硫酸反应会生成二氧化硫有毒气体,会污染空气,不环保;
丙方案:操作复杂,还要用到硝酸银等贵重试剂,不是好的方案;
丁方案:Cu和硫酸亚铁溶液不发生反应,因为铜的活动性比铁弱,不能置换出铁,从理论上行不通.
故答案为:
Cu在空气中灼烧,会与氧气生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,从理论、经济、环保及操作等方面都很好;
Cu与浓硫酸反应会生成二氧化硫有毒气体,会污染空气,不环保;
操作复杂,还要用到硝酸银等贵重试剂,不是好的方案;
Cu和硫酸亚铁溶液不发生反应,因为铜的活动性比铁弱,不能置换出铁,从理论上行不通.点评:
本题考点: 物质的相互转化和制备;化学实验方案设计与评价.
考点点评: 考查同学们从多角度思考问题的能力,制取一种物质可以有很多方法,要选择最优方案,解决其他问题也是一样.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑(杂质不与酸反应且不溶于酸)制取胆矾(CuSO4・5H2O),将铜屑放入稀硫酸中,加热
某化学课外小组用含铜96%的废铜屑(杂质不与酸反应且不溶于酸)制取胆矾(CuSO4・5H2O),将铜屑放入稀硫酸中,加热并不断鼓入空气可制得.
(1)写出生成硫酸铜反应的化学方程式:______.
(2)现用2kg这种铜屑,理论上能制取胆矾______kg.
(3)若要得到较纯的胆矾,在反应完成后还需要哪几步实验操作:______(依次写出操作名称).
(4)将胆矾与生石灰、水按1:0.56:100的质量比混合配成波尔多液(常用于杀灭果树害虫),此波尔多液中钙元素与铜元素的物质的量的比为______(最简整数比). 伊斯坦堡得小铁匠1年前1
伊斯坦堡得小铁匠1年前1 -
 wx302 共回答了25个问题
wx302 共回答了25个问题 |采纳率88%解题思路:(1)根据铜、氧化铜的化学性质解答,铜能与氧气反应生成氧化铜,氧化铜能与硫酸反应生成硫酸铜;
(2)依据铜元素守恒计算得到;
(3)依据晶体析出的实验过程分析;
(4)依据胆矾与生石灰、水按质量比依次为1:0.56:100混合液中质量计算物质的量之比.(1)铜在氧气的作用下生成氧化铜,氧化铜和硫酸反应生成硫酸铜,化学方程式为:2Cu+O2
△
.
2CuO、CuO+H2SO4═CuSO4+H2O,也可以合并为:2Cu+O2+2H2SO4=2CuSO4+2H2O,故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(2)铜元素守恒计算得到,设生成胆矾质量为x
Cu~CuSO4•5H2O
64 250
2Kg×96% x
x=[2×0.96/64]×250=7.5(kg);
故答案为:7.5;
(3)若要得到较纯的胆矾,在反应完成后还需要实验操作为:蒸发浓缩,冷却结晶,过滤析出,
故答案为:蒸发浓缩,冷却结晶,过滤析出;
(4)胆矾与生石灰、水按质量比依次为1:0.56:100混合,Ca2+离子和Cu2+离子的物质的量比=[0.56/56]:[1/250]=5:2,
故答案为:5:2.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查了化学方程式的计算应用,物质制备过程的分析判断,题目难度中等.1年前查看全部
- 胆矾 (五水硫酸铜) 的计算用含铜96%的废铜屑制取胆矾.将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气的作用下便生成硫
胆矾 (五水硫酸铜) 的计算
用含铜96%的废铜屑制取胆矾.将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气的作用下便生成硫酸铜.已知2Cu+2H2SO4+O2==2CuSO4+2H2O.
现用1千克的这种废铜屑理论上能制取胆矾多少千克?
75千克,75千克. 与超的幸福1年前2
与超的幸福1年前2 -
 bmhkg 共回答了17个问题
bmhkg 共回答了17个问题 |采纳率82.4%怎么会是0.75克
1*96%*250/64=3.75克
250:CuSO4.5H2O分子量
64:Cu原子量1年前查看全部
- 用废铜制取硫酸铜,有人用以下两个实验方案:
用废铜制取硫酸铜,有人用以下两个实验方案:
甲方案:废铜[浓硫酸/加热]硫酸铜[Cu+2H2SO4(浓)═CuSO4+2H2O+SO2↑]
乙方案:废铜[空气中/加热]氧化铜
硫酸铜硫酸
你认为比较合理的是______,原因______. 轻松色1年前2
轻松色1年前2 -
 黑眼圈me 共回答了13个问题
黑眼圈me 共回答了13个问题 |采纳率92.3%解题思路:从节约资源,并且不污染环境方面考虑,制取相同质量的产物看谁消耗的反应物少.二氧化硫是一种有毒气体,所以甲方案不可取,通过计算可知生成相同质量的硫酸铜,乙方案消耗的硫酸少,既节约了原料,又不污染环境.
故答案为:乙同学;(1)不产生污染性气体,(2)产生相同质量的硫酸铜,乙方案硫酸用量少.点评:
本题考点: 绿色化学;化学实验方案设计与评价.
考点点评: 选取一种方案,要考虑是否节约了原料,并且做到不污染环境,并且该方案操作可行.1年前查看全部
- 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。
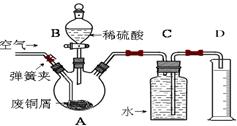
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是 。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是 。
a.对A装置加热;b.向A内加入少量Fe 2 O 3 ;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO 4 ;f.向A内加入少量H 2 O
(4)将A中溶液倒入烧杯内,加入Cu 2 (OH) 2 CO 3 将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是 。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO 4 溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为: 。 sp3171年前1
sp3171年前1 -
 wangdong_monkey 共回答了13个问题
wangdong_monkey 共回答了13个问题 |采纳率100%(1)①水面下降,水顺长导管排入D中 (2分) ②88.8% (2分)
(2)②持续将空气通入A中,至A中固体全部消失,(2分)再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。(2分)
(3)a b d e (2分)
(4)①Cu 2 (OH) 2 CO 3 + H + + Fe 3+ = 2Cu 2+ + Fe(OH) 3 ↓ + CO 2 ↑(2分) ②c (2分)
(5)将(4)中所得红褐色沉淀洗涤、干燥、称量、计算(2分)
1年前查看全部
- 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
Ⅰ.废铜屑制硝酸铜
如图(夹持仪器已省略),将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70℃左右
③用0.4mol/L的NaOH 溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤,烘干,得到碱式碳酸铜产品
回答:
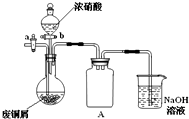
(1)浓硝酸与铜反应的离子方程式______.
(2)装置A的作用是______.
(3)已知:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液充分吸收?______.
(4)步骤④中洗涤的目的是______.
(5)步骤③过滤后的滤液中可能含有CO32-,检验CO32- 的方法是______.
(6)若实验得到2.36g 样品(只含CuO 杂质),取此样品加热至分解完全后,得到1.74g 固体,此样品中碱式碳酸铜的质量分数是______. hjq07501年前1
hjq07501年前1 -
 zappa1981 共回答了27个问题
zappa1981 共回答了27个问题 |采纳率88.9%解题思路:(1)浓硝酸与铜反应生成硝酸铜、二氧化氮气体和水,离子方程式中浓硝酸写成离子形式;
(2)铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸;
(3)关闭活塞b,打开活塞a,通入一段时间空气,将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收;
(4)洗涤可除去碱式碳酸铜表面的吸附的硝酸钠;
(5)加入稀盐酸,检验是否有二氧化碳气体生成来检验滤液中是否含有碳酸根离子;
(6)设碱式碳酸铜的质量分数为x,根据反应Cu2(OH)2CO3
2CuO+H2O+CO2↑,利用称量法计算出列式计算出碱式碳酸铜的质量分数.△ .(1)浓硝酸与铜反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)由于铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸,
故答案为:防止倒吸;
(3)通过关闭活塞b,打开活塞a,通入一段时间空气操作,可以将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收,
故答案为:关闭活塞b,打开活塞a,通入一段时间空气;
(4)通过洗涤可除去碱式碳酸铜表面的吸附的硝酸钠,故答案为:洗去碱式碳酸铜表面吸附的Na+和NO3-;
(5)步骤③过滤后的滤液中可能含有CO32-,检验CO32-的方法为:取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-,
故答案为:取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明有CO32-;
(6)碱式碳酸铜完全分解得到CuO,设样品中碱式碳酸铜的质量分数为x,
依据碱式碳酸铜的方程式,Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑ 质量差△m
222 1844(18+44)=62
2.36x (2.36g-1.74g)
可得[222/62=
2.36x
(2.36−1.74)],
解得x=0.94,
故答案为:0.94或94%.点评:
本题考点: 制备实验方案的设计;有关混合物反应的计算.
考点点评: 本题借助制取碱式碳酸铜制法考查了离子方程式书写、质量分数计算等知识,充分考查了学生的分析、理解、计算能力,是一道不错的题目,本题难度中等.1年前查看全部
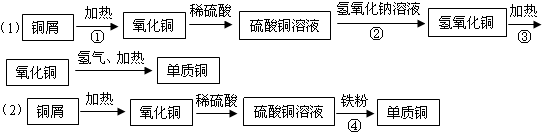
- (2011•石家庄一模)实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4•xH2O)方案如图:
(2011•石家庄一模)实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4•xH2O)方案如图:

金属离子生成氢氧化物沉淀的PH可参考下列数据:
请回答:Fe3+ Fe2+ Cu2+ Al3+ 开始沉淀时pH 2.2 7.5 5.2 3.7 完全沉淀时pH 3.2 9.0 6.7 4.7
(1)写出加入混酸后,合金中铜溶解的离子方程式______
(2)若溶解合金时加入的混酸由2L 3mol/L硫酸和1L 2mol/L硝酸混合而成,则反应后生成标准状况下NO的体积最多为______L
(3)加入H2O2的目的是______
(4)为保证产品的纯度,M物质最好选用______(填字母),调节pH的范围为______
a.Cu(OH)2b.H2SO4c.NH3•H2Od.Na2CO3
(5)滤液D中加入硫酸的目的为______
(6)从溶液E制得CuSO4•xH2O晶体所需要的步骤为______、______过滤、干燥.
(7)要测定所得硫酸铜晶体I(CuSO4•xH2O).中%的值,下列说法不正确的是______(填字母)
a.称量操作至少要进行4次
b.需将坩埚放在石棉网上进行加热
c.加热后,将坩埚放在石棉网上冷却,会使所测X的值偏小. 美的你冒泡泡1年前1
美的你冒泡泡1年前1 -
 wyjr 共回答了17个问题
wyjr 共回答了17个问题 |采纳率88.2%解题思路:流程向废铜合金中加入稀硫酸和硝酸的混酸,铜铁铝均转化成对应硫酸盐(因有剩余金属,铁应变成了亚铁离子,硝酸根离子完全反应),在滤液A中加入双氧水把将Fe2+氧化为Fe3+,在滤液B中加入氧化铜或氢氧化铜,调节溶液的PH,使Fe3+和Al3+完全沉淀下来,过滤后得滤液D为硫酸铜溶液,加硫酸酸化然后经蒸发浓缩、冷却结晶等步骤得到晶体.
(1)铜只和稀硝酸反应,与稀硫酸不反应;
(2)根据混酸中L硫酸和硝酸量求出n(H+)和n(NO3-)的量,根据方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知氢离子过量,硝酸根完全反应,则最多生成NO的物质的量等于硝酸的物质的量,然后求NO的体积;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+,为把铁完全沉淀做准备,而且不引入新的杂质;
(4)M物质最好选用 Cu(OH)2,因为不但能增大pH,而且能保证产品的纯度,H2SO4不反应,NH3•H2O 和Na2CO3会引入新的杂质;根据图表分析,调节pH的范围为:4.7≤pH<5.2,保证Fe3+、Al3+完全沉淀,而Cu2+不沉淀;
(5)加入硫酸的目的为抑制Cu2+的水解;
(6)从硫酸铜溶液制得CuSO4•xH2O晶体所需要的步骤为:加热蒸发、冷却结晶、过滤、洗涤、干燥;
(7)a.称量操作至少要进行4次,包括加热前称量坩埚的质量、坩埚和晶体的总质量,加热后称量、再加热再称量直至质量不再减少为止.b.坩埚可直接加热,不放在石棉网上.c.加热后,将坩埚放在石棉网上冷却,会使固体吸水而质量增加,所测X的值偏小.向废铜合金中加入稀硫酸和硝酸的混酸,铜铁铝均转化成对应硫酸盐(因有剩余金属,铁应变成了亚铁离子,硝酸根离子完全反应),在滤液A中加入双氧水把将Fe2+氧化为Fe3+,在滤液B中加入氧化铜或氢氧化铜,调节溶液的PH,使Fe3+和Al3+完全沉淀下来,过滤后得滤液D为硫酸铜溶液,加硫酸酸化然后经蒸发浓缩、冷却结晶等步骤得到晶体.
(1)铜只和稀硝酸反应,与稀硫酸不反应;故加入混酸后,合金中铜溶解的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)若溶解合金时加入的混酸由2L 3mol/L硫酸和1L 2mol/L硝酸混合而成,则
n(H+)=2L×3mol/L×2+1L×2mol/L=14mol;
n(NO3-)=1L×2mol/L=2 mol;
根据方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O可知:2 molNO3-最多能消耗H+=8mol,说明氢离子过量,硝酸根完全反应,则最多生成NO的物质的量等于硝酸根的物质的量,为2 mol,标准状况下NO的体积最多为2 mol×22.4L/mol=44.8L,
故答案为:44.8;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+,为把铁完全沉淀做准备,故答案为:将Fe2+氧化为Fe3+;
(4)M物质最好选用 Cu(OH)2,因为不但能增大pH,而且能保证产品的纯度,但H2SO4不反应,NH3•H2O 和Na2CO3会引入新的杂质,故不适合;根据图表分析,pH的范围应保证Fe3+、Al3+完全沉淀,而Cu2+不沉淀,故需调节pH的范围为:4.7≤pH<5.2,
故答案为:a;4.7≤pH<5.2;
(5)Cu2+会水解,加热能促进水解,加入硫酸的目的为 抑制Cu2+的水解抑制Cu2+的水解,故答案为:抑制Cu2+的水解;
(6)从硫酸铜溶液制得CuSO4•xH2O晶体所需要的步骤为:加热蒸发、冷却结晶、过滤、洗涤、干燥,
故答案为:加热蒸发;冷却结晶;
(7)a.称量操作至少要进行4次,包括加热前称量坩埚的质量、坩埚和晶体的总质量,加热后称量、再加热再称量直至质量不再减少为止,故a正确;
b.坩埚可直接加热,不放在石棉网上,故b错误;
c.加热后,将坩埚放在石棉网上冷却,会使固体吸水而质量增加,所测X的值偏小,故c正确,
故答案为:b.点评:
本题考点: 铜金属及其重要化合物的主要性质;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了物质的制备、分离、提纯、含量测定、盐类水解、过量计算、反应规律等,综合性较强.1年前查看全部
- (1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO 4 •5H 2 O)的合理方案,
(1)现有废铜屑和废硫酸,请从原料的利用率和环保的角度分析,设计一个制取胆矾(CuSO 4 •5H 2 O)的合理方案,只用化学方程式说明
第一步:______
第二步:______
第三步:过滤,加热浓缩,冷却结晶______
(2)有人建议用铜和稀硫酸混合在加热的条件下不断通入空气以制得硫酸铜溶液,请写出该反应的化学方程式______. y_w_ch1年前1
y_w_ch1年前1 -
 jyoryuu 共回答了19个问题
jyoryuu 共回答了19个问题 |采纳率84.2%(1)以废铜屑和废硫酸为原料,从原料的利用率和环保的角度分析,设计制取胆矾(CuSO 4 •5H 2 O)的方案应:铜与氧气反应生成氧化铜,再由氧化铜与硫酸反应生成硫酸铜,最后过滤,加热浓缩,冷却结晶可得CuSO 4 •5H 2 O.
故反应方程式为第一步:2Cu+O 2
△
.
2CuO;
第二步:CuO+H 2 SO 4 =CuSO 4 +H 2 O;
第三步:CuSO 4 +5H 2 O=CuSO 4 •5H 2 O.
故答案为:2Cu+O 2 =2CuO;CuO+H 2 SO 4 =CuSO 4 +H 2 O;CuSO 4 +5H 2 O=CuSO 4 •5H 2 O.
(2)铜和稀硫酸混合在加热的条件下不断通入空气,反应生成硫酸铜与水,方程式为2Cu+O 2 +2H 2 SO 4
△
.
2CuSO 4 +2H 2 O.
故答案为:2Cu+O 2 +2H 2 SO 4
△
.
2CuSO 4 +2H 2 O.1年前查看全部
- 硫酸铜晶体在实际生产中有着广泛的用途.如图是某化学兴趣小组设计的从废铜料(含铁)制取硫酸铜晶体的途径.
硫酸铜晶体在实际生产中有着广泛的用途.如图是某化学兴趣小组设计的从废铜料(含铁)制取硫酸铜晶体的途径.

(1)试剂X的名称是______;
(2)已知硫酸铜的溶解度随温度升高而增大,则从硫酸铜饱和溶液中析出硫酸铜晶体的方法有______;
(3)写出③、④步反应的化学方程式:③2Cu+O2
2CuO△ .2Cu+O2,④______;
2CuO△ .
(4)上述各步转化中能证明金属铁的活泼性强于A的是______(填序号),理由是______. hh5211年前1
hh5211年前1 -
 本非红颜 共回答了15个问题
本非红颜 共回答了15个问题 |采纳率100%解题思路:(1)根据铜不能与硫酸反应,铁能与硫酸反应考虑;(2)根据饱和溶液析出晶体的方法考虑;(3)根据铜变为氧化铜的方法、氧化铜变为硫酸铜的方法,再结合方程式的写法回答本题;(4)根据金属与酸反应的条件考虑.(1)由于铜排在了氢的后面,不与酸反应,铁排在了氢的前面,能与酸反应,所以X可以是稀硫酸,反应后再过滤就能除去铁了;
(2)硫酸铜饱和溶液蒸发水后,溶剂减少,溶不了的溶质就会析出,由于硫酸铜的溶解度随温度升高而增大,降低温度后溶解度减小,就会析出晶体;
(3)由于铜排在了氢的后面,不与酸反应,铁排在了氢的前面,能与酸反应,加入稀硫酸后铁与硫酸反应生成硫酸亚铁和氢气,过滤得到的单质是铜,铜加热会与氧气反应生成氧化铜,用观察法配平,反应条件是加热写在等号的上边,由于单质A是铜与氧气反应生成了氧化铜,所以黑色固体B是氧化铜,与硫酸反应的反应物是氧化铜和硫酸,生成物是硫酸铜和水;
(4)在第①步中铁与硫酸反应,说明铁排在了氢的前面,铜与硫酸不反应,说明铜排在了氢的后面,所以说铁比铜活泼.
故答案为:(1)稀硫酸;(2)蒸发溶剂、降低温度;(3)2Cu+O2
△
.
2CuO;CuO+H2SO4=CuSO4+H2O;(4)铁能与稀硫酸反应,而铜不能与稀硫酸反应.点评:
本题考点: 物质的相互转化和制备;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 金属与酸反应生成氢气的条件是:金属要排在氢的前面,酸不能是浓硫酸或硝酸;饱和溶液析出晶体的方法:蒸发溶剂,向溶解度减小的方向改变温度.1年前查看全部
- 铜线烧成铜有多少/m 这里着火了,烧坏的线都要卖废铜,BV2.5和RVS2*1.0
铜线烧成铜有多少/m 这里着火了,烧坏的线都要卖废铜,BV2.5和RVS2*1.0
BV2.5和RVS2*1.0
还有kvv 4*1.0 jin霏霏1年前1
jin霏霏1年前1 -
 股海新语 共回答了18个问题
股海新语 共回答了18个问题 |采纳率94.4%横截面积*长度=体积
体积*密度=质量 多少斤就很简单了
还有这里有电线主要原料——电解铜的行情:1年前查看全部
- 某化学课外小组用含铜96℅的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断?C
某化学课外小组用含铜96℅的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断?C
1) 现有1KG这种废铜理论上能制胆矾多少千克?
2) 将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液.
1.此波尔多液中铜离子和钙离子的物质的量比为多少?(最简整数比)
2.波尔多液有效成分的化学式可表示为CuSO4`xCu(OH)2`yCa(OH)2,此种配比当x=1 时,试确定Y的数值.
3)写出生成硫酸铜的化学方程式希望有具体过程 到不了的终点1年前3
到不了的终点1年前3 -
 Fairy纯白天空 共回答了22个问题
Fairy纯白天空 共回答了22个问题 |采纳率95.5%1*96%=0.96kg=960g
960/64=15 mol
M(cuso4.5H2O)= 250
所以可以制得 15×250=3.75kg
波尔多液物质的量之比 1/250::0.56/56=1:2.5
应为n(cu):n(ca)=1:2.5
当x=1时n (cu)=2 所以 y=2×2.5=5
2Cu + O2 + 2H2SO4 == 2CuSO4 + 2H2O
您的采纳使我继续努力的动力!1年前查看全部
- (15分)工业中利用废铜(含有锌、铝等)制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过
(15分)工业中利用废铜(含有锌、铝等)制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
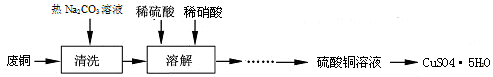
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L —1 计算)。
(1)①为了节约原料,硫酸和硝酸的物质的量之比最佳为 ;该反应中产生尾气污染空气,请选择下图中合适的装置吸收尾气 。开始沉淀的pH 沉淀完全的pH 沉淀溶解的pH Cu 2+ 4.4 6.4 Al 3+ 3.0 5.0 10 Zn 2+ 5.9 8.9 11 
②由表可知Zn(OH) 2 能溶于NaOH溶液生成[Zn(OH) 4 ] 2— ,请写出金属锌与氢氧化钠溶液反应的离子方程式
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO 4 ,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10 -5 mol·L -1 ,就认为沉淀完全。已知:K sp [Fe((OH) 3 ]≈10 -38 ,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为 。
②方案中甲物质可选用的是
A.CaO B.NaOH C.CuCO 3 D.Cu 2 (OH) 2 CO 3 E.Fe 2 (SO 4 ) 3
③方案中加入少量FeSO 4 可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L -1 的足量稀硫酸中,控温在50℃加入10%的足量H 2 O 2 反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO 4 ·5H 2 O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是 。
⑤用少量95%的酒精淋洗的目的是 。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤 。 lovetestest1年前1
lovetestest1年前1 -
 lububu 共回答了13个问题
lububu 共回答了13个问题 |采纳率100%(1) ①3∶2 B
② Zn+2OH - +2H 2 O=[Zn(OH) 4 ] 2— +H 2 ↑
(2)①3
②CD
③4Fe2++O2+4H+===4Fe3++2H2O;2Fe3++Cu===2Fe2++Cu2+
④减少硫酸铜晶体的溶解损失
⑤ 产物是水,无污染
(3)向溶液中加氢氧化钠溶液至pH为11,充分反应过滤洗涤,向沉淀中加适量稀硫酸溶解,制的硫酸铜溶液。
1年前查看全部
- 铜与氧气在干燥、常温条件下不反应,铜与稀硫酸共热时也不发生反应,但在工业上恰好是将废铜放入热的稀硫酸中,并通入过量的空气
铜与氧气在干燥、常温条件下不反应,铜与稀硫酸共热时也不发生反应,但在工业上恰好是将废铜放入热的稀硫酸中,并通入过量的空气来制取CuSO4溶液,试写出反应总化学方程式
答案:2Cu+O2+H2SO4——(加热)2CuSO4+2H2O
我想问为什么不生成CuO呢?
 5807551年前1
5807551年前1 -
 ceool 共回答了22个问题
ceool 共回答了22个问题 |采纳率95.5%首先,铜在加热的条件下,是不和稀硫酸反应的,但是这个时候加入氧气,高温条件下铜被氧化成氧化铜,而后,氧化铜和稀硫酸发生反应,生成硫酸铜.1年前查看全部
- 实验室由废铜屑制胆矾(CuSO 4 •5H 2 O)的实验流程如图:
实验室由废铜屑制胆矾(CuSO 4 •5H 2 O)的实验流程如图: 
(1)洗涤铜屑油污的试剂为5%Na 2 CO 3 溶液,这是利用了Na 2 CO 3 溶液的______性.
(2)溶解铜屑一种方案是:将铜屑加入到稀硫酸与双氧水的混和液中并用30~40℃水浴加热,一段时间后,铜完全溶解,得到硫酸铜溶液.
①该反应的化学方程式为______.
②反应温度不能超过40℃的原因是______.
(3)由硫酸铜溶液获得胆矾的操作依次为______、______、过滤、洗涤、干燥. 江书说洋1年前1
江书说洋1年前1 -
 aoyun88 共回答了18个问题
aoyun88 共回答了18个问题 |采纳率94.4%(1)Na 2 CO 3 溶液中存在水解离子反应为CO 3 2- +H 2 O⇌HCO 3 - +OH - ,HCO 3 - +H 2 O⇌H 2 CO 3 +OH - ,溶液呈碱性,油污在碱性条件下发生水解,所以洗涤铜屑油污的试剂为5%Na 2 CO 3 溶液,这是利用了Na 2 CO 3 溶液的碱性,故答案为:碱;
(2)①双氧水具有氧化性,铜屑加入到稀硫酸与双氧水的混和液中,双氧水将铜氧化成Cu 2+ ,Cu 2+ 与SO 4 2- 结合得到产物硫酸铜,反应为Cu+H 2 O 2 +H 2 SO 4 =CuSO 4 +2H 2 O,故答案为:Cu+H 2 O 2 +H 2 SO 4 =CuSO 4 +2H 2 O;
②过氧化氢易分解,反应温度不能超过40℃,防止H 2 O 2 分解,故答案为:防止H 2 O 2 分解;
(3)硫酸铜的溶解度随温度升高而增大,可用结晶法提纯,在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质,蒸发浓缩,滤液冷却,析出硫酸铜,得到纯的硫酸铜,故答案为:蒸发浓缩;冷却结晶.1年前查看全部
- 利用硫酸和废铜屑制取硫酸铜,有两种方案:
利用硫酸和废铜屑制取硫酸铜,有两种方案:
①Cu + 2H 2 SO 4 (浓) △ CuSO 4 + X↑ + 2H 2 O
②2Cu + O 2 △ 2CuO,CuO + H 2 SO 4 =CuSO 4 + H 2 O。回答下列问题:
(1)X是____________(写化学式)。
(2)你认为较好的方案是______(填“①”或“②”),其优点有___________________________。
(3)若要得到相同质量的硫酸铜,上述①和②所消耗的硫酸的质量比为____________。 宝刚hh爱宝儿1年前1
宝刚hh爱宝儿1年前1 -
 anjoliner 共回答了17个问题
anjoliner 共回答了17个问题 |采纳率100%(1)SO 2 (2)② 没有污染性的气体产生(答案合理即可) (3)2︰1
1年前查看全部
- (2014•崇明县一模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备
(2014•崇明县一模)粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备胆矾的主要流程如图所示:
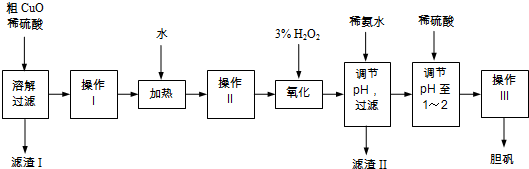
经操作I得到粗胆矾,操作III得到精制胆矾.两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.
已知:Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如表:
(1)溶解、过滤需要用到玻璃棒,它的作用是______.Fe3+ Fe2+ Cu2+ 开始沉淀时的pH 2.7 7.6 5.2 完全沉淀时的pH 3.7 9.6 6.4
(2)写出加入3% H2O2后发生反应的离子方程式______(原溶液显酸性).
(3)加稀氨水调节pH应调至范围______.下列物质可用来替代稀氨水的是______.(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作Ⅲ析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、______.
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如表所示:
两次都无须再做第三次加热、冷却、称量,理由是______,该生此次实验的相对误差为______%(保留1位小数),产生实验误差的原因可能是______(填字母).第一次实验 第二次实验 坩埚质量(g) 14.520 14.670 坩埚质量+晶体质量(g) 17.020 18.350 第一次加热、冷却、称量(g) 16.070 16.989 第二次加热、冷却、称量(g) 16.070 16.988
A.加热前称量时坩埚未完全干燥
B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却
D.玻璃棒上沾有的固体未刮入坩埚. 沅起沅灭1年前1
沅起沅灭1年前1 -
 橙色朝阳 共回答了13个问题
橙色朝阳 共回答了13个问题 |采纳率84.6%解题思路:在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,然后调节溶液pH1~2之间可得到纯净的硫酸铜溶液,经蒸发浓缩、冷却结晶可得到胆矾,
(1)溶解时需要玻璃棒搅拌,过滤时需要玻璃棒引流;
(2)过氧化氢与Fe2+发生氧化还原反应;
(3)调节pH的范围应使Fe3+完全沉淀而Cu2+不生成沉淀,且尽量不引入新的杂质;
(4)因加入氨水,则可能生成(NH4)2SO4 或NH4HSO4;
(5)根据结晶水合物中,结晶水的质量=m(容器十晶体)-m(容器十无水硫酸铜),据化学方程式可以计算结晶水x的值,在测定中若被测样品中含有加热挥发的杂质或实验前容器中有水或玻璃棒上沾有的固体未刮入坩埚,都会造成测量结果偏高.在粗CuO中加入硫酸生成硫酸铜、硫酸铁、硫酸亚铁等物质,经操作I得到粗胆矾,然后加入过氧化氢,将亚铁离子氧化为铁离子,使之在铜离子之前沉淀,加氨水调节pH值目的是让三价铁离子沉淀,但是铜离子不沉淀,然后调节溶液pH1~2之间可得到纯净的硫酸铜溶液,经蒸发浓缩、冷却结晶可得到胆矾,
(1)溶解时需要玻璃棒搅拌,过滤时需要玻璃棒引流,故答案为:搅拌、引流;
(2)过氧化氢与Fe2+发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH的范围应使Fe3+完全沉淀而Cu2+不生成沉淀,由表中数据可知应调节pH介于3.7~5.2之间,且尽量不引入新的杂质,则可用氢氧化铜、氧化铁或碳酸铜代替,不能够用氢氧化钠或碳酸氢钠,易引入硫酸钠杂质,
故答案为:3.7~5.2;BC;
(4)因加入氨水,则可能生成(NH4)2SO4 或NH4HSO4,故答案为:(NH4)2SO4 或NH4HSO4;
(5)由表中数据可知,由表格中的数据,第一次酸硫铜的质量为16.070g-14.520g=1.55g,水的质量:17.020g-16.070g=0.95g,
第二次酸硫铜的质量为:[16.988+16.989/2]g-14.670g=2.3185g,水的质量:18.350g-[16.988+16.989/2]g=1.3615g,
硫酸铜的平均质量为[1.55g+2.3185g/2]=1.934g,水的平均重量为[0.95g+1.3615g/2]=1.156g,
则n(CuSO4)=[1.934g/160g/mol]=0.012mol,n(H2O)=[1.156g/18g/mol]=0.0642mol,
则结晶水的个数为[0.0642/0.012]=5.352,
该生此次实验的相对误差=[5.352−5/5.352]×100%=+6.6%,
A.加热前称量时坩埚未完全干燥,加热后水挥发,导致水的质量测定结果偏大,故A正确;
B.该胆矾中含有受热不分解的杂质,会导致硫酸铜质量偏小,水的含量偏小,故B错误;
C.加热后坩埚放在干燥器中冷却,对实验没有影响,故C错误;
D.玻璃棒上沾有的固体未刮入坩埚,导致固体质量偏小,水的质量偏大,故D正确.
故答案为:已达恒重;+6.6%;AD.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,难度不大,易错点为(5),注意把握误差的计算方法,从题目本身对学生的实验能力要求较高,但此题实际上就来源于课本的学生实验,只要学生认真的去操作过、体验过、思考过,就会觉得很熟悉、很简单.1年前查看全部
- 硫酸铜溶液常用于农业上制波尔多液.如图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图示回答下列问题.
硫酸铜溶液常用于农业上制波尔多液.如图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图示回答下列问题.
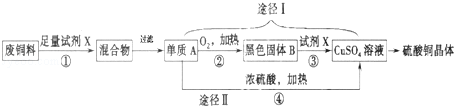
(1)反应①的基本类型为 ;
(2)③反应的化学方程式为 ;
(3)已知:Cu+2H 2 SO 4 (浓)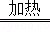 CuSO 4 +SO 2 ↑+2M.则M的化学式为 ;对比途径I、Ⅱ,途径I的优点有: .
CuSO 4 +SO 2 ↑+2M.则M的化学式为 ;对比途径I、Ⅱ,途径I的优点有: . lanpabiniuda1年前1
lanpabiniuda1年前1 -
 sa145as 共回答了20个问题
sa145as 共回答了20个问题 |采纳率90%(1)置换反应
(2)CuO+H 2 SO 4 ═CuSO 4 +H 2 O
(3)H 2 O 无二氧化硫产生,无污染
1年前查看全部
- 用废铜制取硫酸铜,有人用以下两个实验方案:
用废铜制取硫酸铜,有人用以下两个实验方案:
甲方案:废铜 硫酸铜[Cu+2H 2 SO 4 (浓)==CuSO 4 +2H 2 O+SO 2 ↑]
硫酸铜[Cu+2H 2 SO 4 (浓)==CuSO 4 +2H 2 O+SO 2 ↑]
乙方案:废铜 氧化铜
氧化铜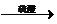 硫酸铜
硫酸铜
你认为比较合理的是______,原因_______________________________________________。 咖啡_柠檬1年前1
咖啡_柠檬1年前1 -
 191614567 共回答了17个问题
191614567 共回答了17个问题 |采纳率88.2%乙同学;(1 )不产生污染性气体,(2 )产生相同质量的硫酸铜,乙方案硫酸用量少;1年前查看全部
- 某活动小组用废铜制取硫酸铜溶液,实验过程为:
某活动小组用废铜制取硫酸铜溶液,实验过程为: 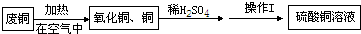
(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是______(填字母序号).a.加热时氧化铜易分解生成铜b.铜与氧气没有完全反应c.加热时铜不能与氧气反应
(2)氧化铜与稀硫酸反应的化学方程式为______.
(3)操作Ⅰ的名称是______,该操作用到的玻璃仪器有:玻璃棒、烧杯、______.
(4)盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)______. wlr7171年前1
wlr7171年前1 -
 tomkent9 共回答了25个问题
tomkent9 共回答了25个问题 |采纳率76%(1)铜在空气中加热时,生成的氧化铜会覆盖在铜的表面,使铜不能和氧气接触,不能完全反应.
(2)氧化铜与稀硫酸反应的化学方程式为 CuO+H 2 SO 4 =CuSO 4 +H 2 O.
(3)操作Ⅰ的名称是过滤,该操作用到玻璃仪器,有烧杯、玻璃棒和漏斗.
(4)因为铁比铜活泼,能与硫酸铜溶液反应,化学方程式为:Fe+CuSO 4 ═FeSO 4 +Cu
答案:(1)b
(2)CuO+H 2 SO 4 =CuSO 4 +H 2 O
(3)过滤,漏斗
(4)Fe+CuSO 4 ═FeSO 4 +Cu1年前查看全部
- 工业上用洗净的废铜屑作原料来制 备硝酸铜.为了节约原料和防止污 染环境,宜采取的方法是
 流浪者也1年前1
流浪者也1年前1 -
 74jiell 共回答了15个问题
74jiell 共回答了15个问题 |采纳率93.3%先加热铜在空气里在加硝酸1年前查看全部
- (2014•苏州)某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如图:
(2014•苏州)某化工厂用石灰石和废铜屑等设计生产石青、波尔多液的工艺流程如图:
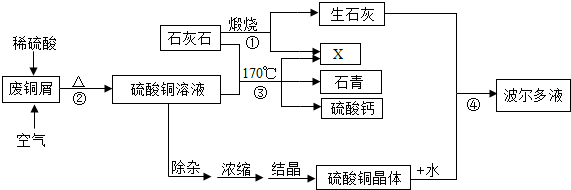
(1)X的化学式为______.
(2)反应②中空气的作用是______.
(3)石青的化学式为2CuCO3•Cu(OH)2,写出反应③的化学方程式3CaCO3+3CuSO4+H2O
2CuCO3•Cu(OH)2↓+CO2↑+3CaSO4170℃ .3CaCO3+3CuSO4+H2O.
2CuCO3•Cu(OH)2↓+CO2↑+3CaSO4170℃ .
(4)若反应④中硫酸铜、生石灰和水的化学计量数之比为1:1:1,则其化学方程式为______. 逍遥新1年前1
逍遥新1年前1 -
 标本虫 共回答了16个问题
标本虫 共回答了16个问题 |采纳率81.3%解题思路:(1)根据碳酸钙高温分解会生成氧化钙和二氧化碳,质量守恒定律中的元素、原子守恒进行分析;
(2)根据反应②的反应物、生成物以及反应原理进行分析;
(3)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;
(4)根据反应④中硫酸铜、生石灰和水的化学计量数之比为1:1:1,依据质量守恒定律书写化学方程式.(1)石灰石在高温的条件下会生成氧化钙和二氧化碳,所以X是二氧化碳,化学式为:CO2;
(2)通过分析反应原理可知,铜和氧气加热生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水,空气在反应中是提供氧,所以反应②中空气的作用是:起氧化作用;
(3)石青的化学式为2CuCO3•Cu(OH)2,反应③是碳酸钙、硫酸铜和水在170℃的反应条件下生成石青、硫酸钙和二氧化碳,化学方程式为:3CaCO3+3CuSO4+H2O
170℃
.
2CuCO3•Cu(OH)2↓+CO2↑+3CaSO4;
(4)反应④中硫酸铜、生石灰和水的化学计量数之比为1:1:1,硫酸铜、生石灰和水反应生成氢氧化铜沉淀和硫酸钙,化学方程式为:CuSO4+CaO+H2O=Cu(OH)2↓+CaSO4.
故答案为:(1)CO2;
(2)起氧化作用;
(3)3CaCO3+3CuSO4+H2O
170℃
.
2CuCO3•Cu(OH)2↓+CO2↑+3CaSO4;
(4)CuSO4+CaO+H2O=Cu(OH)2↓+CaSO4.点评:
本题考点: 物质的相互转化和制备.
考点点评: 在解此类题时,首先分析题中的反应原理,然后依据学过的知识和题中的知识进行解答即可.1年前查看全部
- 某课外兴趣小组利用废铜屑制取硫酸铜,设计方案如下:
某课外兴趣小组利用废铜屑制取硫酸铜,设计方案如下: O2 稀H2SO4 甲:Cu——→CuO——→CuSO4 △ 浓H2SO4 乙:Cu——→CuSO4 △ △ 〔Cu+2H2SO4(浓)======CuSO4+SO2↑+2H2O〕 AgNO3 NaOH 稀H2SO4 丙:Cu——→Cu(NO3)——→Cu(OH)2——→ CuSO4 溶液 FeSO4 丁:Cu——→CuSO4 从理论、操作、经济、环保等方面考虑,对每个方案进行简单评价,并从中确定一个最优方案. 甲:_____________________________________________; 乙:_____________________________________________; 丙:_____________________________________________; 丁:_____________________________________________;
 怕痒痒的鱼1年前2
怕痒痒的鱼1年前2 -
 amelia_21 共回答了18个问题
amelia_21 共回答了18个问题 |采纳率88.9%甲:所有的原料都被利用,仅产生的废料是水,没有污染
乙:1mol铜消耗2mol硫酸,浪费,生成SO2污染
丙:步骤繁琐,消耗多,原料价格昂贵,有废料产生
丁:生成硫酸铁没有用,且不易与硫酸铜分离,硫酸亚铁易氧化,不易制备和保存
所以甲的方案最好,符合原子经济性,且不会产生污染废物1年前查看全部
- 这道题有一些疑问。。。29. (16分)实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体()方案如下:金属离子生成氢氧
这道题有一些疑问。。。
29. (16分)实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体()方案如下:

金属离子生成氢氧化物沉淀的PH可参考下列数据:
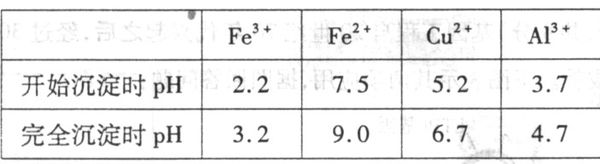
请回答:
(1) 写出加人混酸后,合金中铜溶解的离子方程式_________________________________________________________________
(2) 若溶解合金时加入的混酸由2L 3mol/L硫酸和1L 2mol/L硝酸混合而成,则反应后生成标准状况下NO的体积最多为__________L
(3) 加入H2O2的目的是_______________
(4) 为保证产品的纯度,M物质最好选用_____(填字母),
调节pH的范围为__________
a. Cu(OH)2 b. H2SO4 c. NH3 • H2O d. Na2CO3
(5) 滤液D中加人硫酸的目的为__________
(6) 从溶液E制得
 晶体所需要的步骤为____________、_____________过滤、干燥。
晶体所需要的步骤为____________、_____________过滤、干燥。(7) 要测定所得硫酸铜晶体I
 中%的值,下列说法不正确的是_____(填字母)
中%的值,下列说法不正确的是_____(填字母)a. 称量操作至少要进行4次
b. 需将坩埚放在石棉网上进行加热
c. 加热后,将坩埚放在石棉网上冷却,会使所测X的值偏小
第五问 为什么要抑制铜离子的水解
第七问 a为什么要进行四次 如果说是先称量一次坩埚 加入样品后再称一次质量 那为什么不直接称量样品质量
 未芷1年前1
未芷1年前1 -
 ashan8429 共回答了17个问题
ashan8429 共回答了17个问题 |采纳率88.2%第五问 为什么要抑制铜离子的水解因为之前加入H2O2把Fe2+氧化成Fe3+,所以所以溶液中有Fe3+,Al3+和Cu2+,因为我们要制取CuSO4晶体,所以要让Cu2+留在溶液中,而让Fe3+和Al3+形成沉淀,从溶液中分离出来,所以根据上面沉淀PH表格:要让Cu2+留在溶液中PH<5.2,要让Fe3+和Al3+形成沉淀PH>=4.7
所以最终我们要将溶液控制在 4.7 =< PH < 5.2
铜离子水解会产生氢氧化铜沉淀,所以要保证PH < 5.2,抑制铜离子水解
第七问 a为什么要进行四次 如果说是先称量一次坩埚 加入样品后再称一次质量 那为什么不直接称量样品质量
①称量坩埚的质量
②称量坩埚和样品的质量(即使单独称量药品质量,也要将药品放在容器上称量,最终还是要称量容器的质量,所以②步骤就是称量药品质量的正确操作方法)
③加热冷却后坩埚和样品的质量
④再次加热冷却后坩埚和样品的质量(因为无法确定③过程结晶水是否完全失去,所以要进行这一步操作)
如果③和④质量相差0.001g以上,重复④操作,直到③和④质量相差小于0.001g
所以至少要进行4次称量
要采纳o,亲!!!不明白的追问我就好!!!
1年前查看全部
- I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
请回答下列问题:温度(℃) 20 40 60 80 100 石膏 0.32 0.26 0.15 0.11 0.07 胆矾 32 44.6 61.8 83.8 114
(1)红棕色滤渣的主要成分是______;
(2)写出浸出过程中生成硫酸铜的化学方程式______;
(3)操作I的操作温度应该控制在______℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为______、洗涤、干燥;
(5)取样检验是为了确认Fe3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是______;
②指出你认为不合理的方案存在的问题______;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案______.
II.(12分)复印机使用的墨粉主要成份是Fe3O4,图是氧化沉淀法生产Fe3O4的工艺: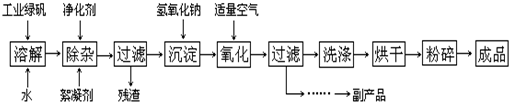
已知:
①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3═Fe3O4•4H2O
请回答下列问题:
(1)铁的常见氧化物有______;
(2)Fe3O4与盐酸反应的化学方程式是:______,检验反应后的溶液中含Fe3+的方法:______;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:______;
(4)生产中可获得的副产品是______,提取该副产品的操作顺序是:______(填写序号)
a.过滤b.加热浓缩c.冷却d.结晶e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为______m3/h(假设反应在标准状态下进行,空气中O2占20%). 无奈的右手无名指1年前1
无奈的右手无名指1年前1 -
 yujie1996 共回答了16个问题
yujie1996 共回答了16个问题 |采纳率75%解题思路:Ⅰ.(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁;
(2)由工艺流程图转化关系可知,由于硫酸的存在,酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(5)确认Fe3+是否除净应注意铜离子的颜色造成的干扰;
(6)一氧化氮循环使用可以利用一氧化氮和氧气再水溶液中反应生成硝酸,重新使用;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4;
(2)根据铁元素的化合价+2、+3价写出生成物的两种金属氯化物的化学式,然后再根据式子两边各元素的原子个数相等配平方程式,Fe3+与硫氰化钾溶液反应,使溶液变红色,据此解答;
(3)氢氧化亚铁易被氧气氧化;
(4)根据从硫酸钠溶液中分离出硫酸钠的方法分析操作过程;
(5)根据反应的化学方程式进行分析.Ⅰ.(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3,
故答案为:Fe(OH)3;
(2)由于硫酸的存在,且酸过量,硝酸全起氧化剂作用,酸为稀溶液,生成硫酸铜、NO、水,
反应方程式为3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O,
故答案为:3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯,
故答案为:100℃;
(4)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥,
故答案为:冷却结晶、过滤;
(5)①方案一:取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在;方案二:径向层析→喷KSCN溶液,纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,不但可以分辨出铁离子还能辨别出含有铜离子,
故答案为:方案二;
②取样于试管→滴加KSCN溶液,由于溶液中含有蓝色的铜离子会对现象干扰,不能检验铁离子的存在,
故答案为:Cu2+的蓝色对检验有干扰;
(6)一氧化氮气体有毒污染空气不能排放到大气中,可以利用一氧化氮和氧气在水溶液中吸收生成硝酸循环使用反应的化学方程式4NO+3O2+H2O=4HNO3,
故答案为:4NO+3O2+H2O=4HNO3;
Ⅱ.(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,
故答案为:FeO、Fe2O3、Fe3O4;
(2)四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,配平后方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,
Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验是否含Fe3+离子的方法为:取少量待测液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+;
(3)Fe(OH)2不稳定,易被氧气氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤,即bcdae,
故答案为:Na2SO4•10H2O(或芒硝,写Na2SO4也可);bcdae;
(5)鼓入的空气应恰好与FeSO4完全反应,
12.16 kg工业绿矾中含FeSO4的物质的量:[12160g×52.5%/152g/mol]=42mol,设鼓入空气的速率应为Vm3/h,
根据:6 FeSO4~O2~2 Fe3O4
6mol 22.4L
42mol Vm3×103L/m3×1/5
解得:V=0.784,
故答案为:0.784.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;铁的氧化物和氢氧化物;铜金属及其重要化合物的主要性质.
考点点评: 本题为拼合型题目,题量大,对学生的心理素质有非常高的要求,考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、离子检验,化学计算等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.1年前查看全部
- 铜多少钱我有二十几个水龙头接扣(联塑的,全铜的,纯度很高),五金店卖14元一个,我卖给五金店说不要,只好当做废铜去买,我
铜多少钱
我有二十几个水龙头接扣(联塑的,全铜的,纯度很高),五金店卖14元一个,我卖给五金店说不要,只好当做废铜去买,我问下这个是属于哪种铜啊?能卖多少钱一斤啊?
这种水龙头接扣是红铜吗?散的红铜也是45一斤吗? 铁剑清风1年前1
铁剑清风1年前1 -
 广东大王 共回答了12个问题
广东大王 共回答了12个问题 |采纳率100%红铜大概45左右1年前查看全部
- 某课外兴趣小组利用废铜屑制取CuSO 4 ,设计方案如下:
某课外兴趣小组利用废铜屑制取CuSO 4 ,设计方案如下:
甲:Cu
CuOO 2 △
CuSO 4稀 H 2 S O 4 △
乙:Cu
CuSO 4 ;(Cu+2H 2 SO 4 (浓)浓 H 2 S O 4 △
CuSO 4 +SO 2 ↑+2H 2 O)△ .
丙:Cu
Cu(NO 3 ) 2AgN O 3
Cu(OH) 2NaOH 溶液
CuSO 4稀 H 2 S O 4
丁:Cu
CuSO 4FeS O 4
从理论、操作、经济、环保等方面考虑,对每个方案进行简要评价,并从中确定一个最优方案.
甲方案:______
乙方案:______
丙方案:______
丁方案:______. 喜欢天平1年前1
喜欢天平1年前1 -
 285224458 共回答了13个问题
285224458 共回答了13个问题 |采纳率84.6%甲方案:Cu在空气中灼烧,会与氧气生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,从理论、经济、环保及操作等方面都很好;
乙方案:Cu与浓硫酸反应会生成二氧化硫有毒气体,会污染空气,不环保;
丙方案:操作复杂,还要用到硝酸银等贵重试剂,不是好的方案;
丁方案:Cu和硫酸亚铁溶液不发生反应,因为铜的活动性比铁弱,不能置换出铁,从理论上行不通.
故答案为:
Cu在空气中灼烧,会与氧气生成氧化铜,氧化铜再与稀硫酸反应生成硫酸铜,从理论、经济、环保及操作等方面都很好;
Cu与浓硫酸反应会生成二氧化硫有毒气体,会污染空气,不环保;
操作复杂,还要用到硝酸银等贵重试剂,不是好的方案;
Cu和硫酸亚铁溶液不发生反应,因为铜的活动性比铁弱,不能置换出铁,从理论上行不通.1年前查看全部
- 某化学课外小组用含铜90%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫
某化学课外小组用含铜90%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜.
(1)写出生成硫酸铜的化学方程式2cu+o2
2cuo;cuo+h2so4═cuso4+h2o2cu+o2△ .
2cuo;cuo+h2so4═cuso4+h2o.△ .
(2)说出胆矾的一种用途配制波尔多液,用于杀菌消***制波尔多液,用于杀菌消毒. 天羊行空1年前1
天羊行空1年前1 -
 tqt4 共回答了21个问题
tqt4 共回答了21个问题 |采纳率85.7%(1)铜在氧气的作用下生成氧化铜,氧化铜和硫酸反应生成硫酸铜,化学方程式为:2Cu+O2△. 2CuO;CuO+H2SO4═CuSO4+H2O(2)胆矾可以和熟石灰一起来配制波尔多液,用于杀菌消毒.故答...1年前查看全部
- 某化学课外小组用含铜96℅的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断?C
某化学课外小组用含铜96℅的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断?C
某化学课外小组用含铜96%的废铜屑制取胆矾,将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜.
1) 现有1KG这种废铜理论上能制胆矾多少千克?
2) 将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液.
1.此波尔多液中铜离子和钙离子的物质的量比为多少?(最简整数比)
2.波尔多液有效成分的化学式可表示为CuSO4`xCu(OH)2`yCa(OH)2,此种配比当x=1 时,试确定Y的数值.
3.75 2:5 5
why?——特别是后两题! lilulu1011年前1
lilulu1011年前1 -
 COCACOLA-xd 共回答了18个问题
COCACOLA-xd 共回答了18个问题 |采纳率88.9%胆矾与生石灰的质量比=1:0.56
Cu2+与Ca2+的物质的量比=1/250:0.56/56=2:5
y=3.1年前查看全部
- 铜屑与稀硫酸生成无水硫酸铜某化学课外小组用含铜96%的废铜屑制取胆矾,将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用
铜屑与稀硫酸生成无水硫酸铜
某化学课外小组用含铜96%的废铜屑制取胆矾,将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜. jingyi1984121年前2
jingyi1984121年前2 -
 shui_01 共回答了19个问题
shui_01 共回答了19个问题 |采纳率89.5%2Cu+O2+2H2SO4=2CuSO4+2H2O1年前查看全部
- 碱式碳酸铜是一种化工原料,化学式用 m Cu(OH) 2 · n CuCO 3 表示。实验室以废铜屑为原料制取碱式碳酸铜
碱式碳酸铜是一种化工原料,化学式用 m Cu(OH) 2 · n CuCO 3 表示。实验室以废铜屑为原料制取碱式碳酸铜碱式碳酸铜是一种化工原料,化学式用 m Cu(OH) 2 · n CuCO 3 表示。实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
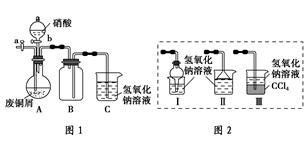
Ⅰ.废铜屑制硝酸铜
方案1:将铜屑在空气中充分灼烧,残留固体溶于稀硝酸;
方案2:如图1(夹持仪器已省略)。将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
方案3:将方案2中浓硝酸换成稀硝酸,其他不变。
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70 ℃左右
③用0.4 mol·L - 1 的NaOH溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤、烘干,得到碱式碳酸铜产品
请回答下列问题:
(1)按方案1实验,必须选择的下列仪器有________(填序号)。
(2)图2中能分别替代图1中B和C装置的是________(填装置序号)。
(3)已知:NO+NO 2 +2NaOH===2NaNO 2 +H 2 O;2NO 2 +2NaOH===NaNO 3 +NaNO 2 +H 2 O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液完全吸收?__________________________。
(4)步骤④中洗涤的目的是______________________________________。
(5)步骤③过滤后的滤液中含有CO 3 2 — ,检验CO 3 2 — 的方法是_________________________________________________________。
(6)测定碱式碳酸铜组成的方法主要有两种:
方法1 灼烧法:取34.6 g纯净物 m Cu(OH) 2 · n CuCO 3 ,在硬质试管里灼烧,将气体产物依次通入足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸净增1.8 g,碱石灰净增8.8 g。
方法2 还原法:在氢气中加强热,测反应前后固体的质量。
①利用上述数据推算碱式碳酸铜的化学式_____________________。
②配平化学方程式: m Cu(OH) 2 · n CuCO 3 +________H 2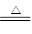 ________Cu+________CO 2 ↑+________H 2 O
________Cu+________CO 2 ↑+________H 2 O
 呆呆在海角1年前1
呆呆在海角1年前1 -
 小乔czy 共回答了24个问题
小乔czy 共回答了24个问题 |采纳率75%(1)abe (2)Ⅰ、Ⅱ和Ⅲ (3)关闭活塞b,打开活塞a,通入一段时间空气 (4)除去产品表面杂质 (5)取少量滤液于试管中,加入稀盐酸,将产生的气体通入澄清石灰水中,溶液变浑浊,说明滤液中含有CO 3 2 —
(6)①Cu(OH) 2 ·2CuCO 3 ②( m + n ) ( m + n )
n (2 m + n )
(1)灼烧固体需要的仪器有坩埚、三脚架、泥三角、玻璃棒、酒精灯;溶解固体需要的仪器有烧杯、玻璃棒。(2)B用作安全瓶,C用于吸收氮的氧化物,替代B和C的装置必须具有吸收氮的氧化物和防倒吸双重功能。Ⅰ、Ⅱ装置能防倒吸,Ⅲ装置烧杯中的下层液体为四氯化碳,氮的氧化物不溶于四氯化碳,不会导致装置内的气压急剧减小,当氮的氧化物从四氯化碳层进入烧碱溶液中,被氢氧化钠溶液吸收,Ⅲ装置既可以防倒吸,又能使氮的氧化物被吸收。(3)根据所给反应方程式知,通入足量的空气,使一氧化氮转化成二氧化氮能被完全吸收。(4)固体产品表面会吸附一些杂质,洗涤可除去碱式碳酸铜表面的杂质。(5)用盐酸和CO 3 2 — 反应生成CO 2 ,再用澄清石灰水检验二氧化碳。(6)①浓硫酸吸收生成的水,碱石灰吸收生成的二氧化碳,则: n (CO 2 )=8.8/44=0.2 mol, n (H 2 O)=1.8/18=0.1 mol。灼烧碱式碳酸铜的反应方程式为 m Cu(OH) 2 · n CuCO 3 ( m + n )CuO+ m H 2 O+ n CO 2 ↑,故m/n=0.1/0.2=1/2。该碱式碳酸铜的化学式为Cu(OH) 2 ·2CuCO 3 。
( m + n )CuO+ m H 2 O+ n CO 2 ↑,故m/n=0.1/0.2=1/2。该碱式碳酸铜的化学式为Cu(OH) 2 ·2CuCO 3 。
②根据题给方程式和氧原子守恒知,氧原子的计量数为(2 m +3 n )-2 n =2 m + n ,即水的计量数为2 m + n ,由水的计量数推知氢分子的计量数: = m + n ,则化学方程式为 m Cu(OH) 2 · n CuCO 3 +( m + n )H 2
= m + n ,则化学方程式为 m Cu(OH) 2 · n CuCO 3 +( m + n )H 2  ( m + n )Cu+ n CO 2 ↑+(2 m + n )H 2 O。
1年前查看全部
( m + n )Cu+ n CO 2 ↑+(2 m + n )H 2 O。
1年前查看全部
- 1#废铜=1号光亮铜吗?有客户要1#光亮铜线的价格,我不知道光亮铜还分不分号,只知道废铜分三个号,废铜1#,2#,3#.
1#废铜=1号光亮铜吗?
有客户要1#光亮铜线的价格,我不知道光亮铜还分不分号,只知道废铜分三个号,废铜1#,2#,3#.光亮铜1#跟废铜的1#是一个意思吗?谢谢各位大虾帮忙啦!
 木火旺1年前1
木火旺1年前1 -
 xnf2 共回答了22个问题
xnf2 共回答了22个问题 |采纳率77.3%yes,是的1年前查看全部
- (2013•包河区一模)硫酸铜溶液常用于农业上制波尔多液.如图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图示回
(2013•包河区一模)硫酸铜溶液常用于农业上制波尔多液.如图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图示回答下列问题.

(1)反应①的基本类型为______;
(2)③反应的化学方程式为______;
(3)已知:Cu+2H2SO4 (浓)
CuSO4+SO2↑+2M.则M的化学式为______;对比途径I、Ⅱ,途径I的优点有:______.加热 . xiaolanabc1年前1
xiaolanabc1年前1 -
 梁家辉喜欢阿森纳 共回答了22个问题
梁家辉喜欢阿森纳 共回答了22个问题 |采纳率95.5%解题思路:废铜料中有铁和铜,要生产硫酸铜,需将铁除去,因此可加入足量稀硫酸将铁除去,铜与硫酸不反应,过滤后铜与氧气反应转化为氧化铜,氧化铜和硫酸反应生成硫酸铜.废铜料中有铁和铜,要生产硫酸铜,需将铁除去,因此可加入足量稀硫酸将铁除去,铜与硫酸不反应,过滤后铜与氧气反应转化为氧化铜,氧化铜和硫酸反应生成硫酸铜.
(1)反应①为铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为Fe+H2SO4 ═FeSO4+H2↑反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应.
(2)反应③是氧化铜与硫酸反应生成硫酸铜和水,化学方程式为CuO+H2SO4═CuSO4+H2O
(3)根据反应前后原子种类和数目不变可知,反应前氢原子4个,氧原子8个,铜原子1个,硫原子2个,反应后已有铜原子1个,硫原子2个,氧原子6个,因此2M中含有4个氢原子和2个氧原子,故M的化学式为H2O;途径Ⅰ转化的化学方程式为
2Cu+O2
△
.
2CuO,CuO+H2SO4═CuSO4+H2O;途径Ⅱ是铜与浓硫酸反应生成硫酸铜、二氧化硫和水,因此对比途径I、Ⅱ,途径Ⅰ没有二氧化硫产生,无污染
故答案为:(1)置换反应
(2)CuO+H2SO4═CuSO4+H2O
(3)H2O无二氧化硫产生,无污染点评:
本题考点: 物质的相互转化和制备.
考点点评: 根据金属的活动性顺序表,位于氢之前的金属能与酸发生置换反应,而位于氢之后的金属不能与酸发生反应;活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.1年前查看全部
- 某研究性学习小组利用废铜屑生产单质铜,设计了如下两个实验方案:
某研究性学习小组利用废铜屑生产单质铜,设计了如下两个实验方案: 
写出反应①~④的化学方程式并注明基本反应类型
1______;
2______;
3______;
4______. 七破1年前1
七破1年前1 -
 cuthbert 共回答了12个问题
cuthbert 共回答了12个问题 |采纳率100%1、铜与氧气反应能生成氧化铜,方程式是:2Cu+O 2
△
.
2CuO,属于多变一的反应,化合反应;
故答案为:2Cu+O 2
△
.
2CuO;化合反应;
2、硫酸铜与氢氧化钠反应生成氢氧化铜与硫酸钠,方程式是:CuSO 4 +2NaOH═Cu(OH) 2 ↓+Na 2 SO 4 ;该反应是两种化合物生成两种化合物的反应是复分解反应.
故答案为:CuSO 4 +2NaOH═Cu(OH) 2 ↓+Na 2 SO 4 ;复分解反应.
3、氢氧化铜受热会生成氧化铜与水,方程式是Cu(OH) 2
△
.
CuO+H 2 O;是一种物质生成多种物质的反应,属于分解反应.
故答案为:Cu(OH) 2
△
.
CuO+H 2 O;分解反应.
4、铁会与硫酸铜反应生成硫酸亚铁和铜,该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应.
故答案为:Fe+CuSO 4 ═FeSO 4 +Cu;置换反应;1年前查看全部
- (2013•河南一模)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备
(2013•河南一模)胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾.有人设计了如下流程:
pH值控制可参考下列数据
请根据上述流程回答下列问题:物质 开始沉淀时的pH值 完全沉淀时的pH值 氢氧化铁 2.7 3.7 氢氧化亚铁 7.6 9.6 氢氧化铜 5.2 6.4
(1)A可选用______(填字母)
a.稀H2SO4b.浓H2SO4、加热c.浓FeCl3溶液d.浓HNO3
(2)Ⅰ中加H2O2的目的______.
(3)Ⅱ中加Cu2(OH)2CO3的目的是______,其优点是______.
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为Fe3++3H2O
Fe(OH)3↓+3H+△ .Fe3++3H2O.
Fe(OH)3↓+3H+△ .
(5)V中加H2SO4调节pH=1是为了______,某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______,若你是工程师,将对所加的A物质作何改进?请提出建议______. hn12801年前1
hn12801年前1 -
 梦漂游 共回答了15个问题
梦漂游 共回答了15个问题 |采纳率93.3%解题思路:废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,Fe转化为Fe(OH)3更容易除去.加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.废铜(主要杂质为Fe)来制备胆矾的流程:将金属全部溶解,再将存在的亚铁离子氧化为铁离子,再结合Cu2+开始沉淀时的pH值,可以Fe最终转化为Fe(OH)3更容易除去,保证铜离子不会沉淀,不能引进杂质离子,加入H2O2,目的是将二价铁转化为三价铁,在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,目的应是调节溶液的酸碱性,所以这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3.当三价铁沉淀完全后,再进行过滤,滤液中剩余的阳离子主要有Cu2+,阴离子有SO42-,再加硫酸,调节溶液pH值=1,目的是抑制Cu2+的水解,再分别进行蒸发、冷却、结晶后,最终得到产品胆矾.
(1)A可选用浓H2SO4、加热,稀硫酸不能溶解Cu,而浓FeCl3溶液、浓HNO3会引入杂质,故答案为:b;
(2)H2O2与Fe2+发生氧化还原反应,Fe2+被氧化为Fe3+后,调节pH,更容易除去,所以Ⅰ中加H2O2的目的将亚铁离子氧化为铁离子,故答案为:将Fe2+氧化为Fe3+;
(3)在III中调节溶液pH值,在这个过程中加了Cu2(OH)2CO3,这里加Cu2(OH)2CO3中和过量的硫酸,控制好溶液的pH值为3.7,刚好此时溶液中三价铁正全转化为Fe(OH)3,并且不引入新的杂质,故答案为:除去过量的硫酸;不引入新的杂质;
(4)Ⅲ加热煮沸时,促进铁离子水解,可以得到氢氧化铁沉淀,发生的化学反应的离子方程式为:Fe3++3H2O
△
.
Fe(OH)3↓+3H+,故答案为:Fe3++3H2O
△
.
Fe(OH)3↓+3H+;
(5)V中加H2SO4调节pH=1是为了抑制Cu2+的水解,但是Cu与浓硫酸反应过程中会产生SO2,会对污染环境,这样会使硫酸的利用率低,所以可以向稀硫酸中不断通氧气(或者加H2O2)并加热,故答案为:抑制Cu2+的水解;会产生SO2,会对污染环境,硫酸的利用率低;可以向稀硫酸中不断通氧气(或者加H2O2)并加热.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题是一道实验方案的设计题,考查学生物质的制备、除杂等方面的综合知识,注意知识的灵活应用是关键,难度中等.1年前查看全部
- (2009•安徽)某活动小组用废铜制取硫酸铜溶液,实验过程为:
(2009•安徽)某活动小组用废铜制取硫酸铜溶液,实验过程为:

(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是______(填字母序号).a.加热时氧化铜易分解生成铜b.铜与氧气没有完全反应c.加热时铜不能与氧气反应
(2)氧化铜与稀硫酸反应的化学方程式为______.
(3)操作Ⅰ的名称是______,该操作用到的玻璃仪器有:玻璃棒、烧杯、______.
(4)盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)______. windua1年前1
windua1年前1 -
 wuhuan730 共回答了17个问题
wuhuan730 共回答了17个问题 |采纳率82.4%解题思路:(1)固体和气体反应会因为接触面积小而使反应不能完全进行.
(2)书写复分解反应的化学方程式时要首先判断能否反应,然后正确书写反应物和生成物的化学式,配平并注明条件.
(3)过滤是分离固体(铜)与液体(硫酸铜溶液)混合物的一种方法.过滤操作用到的主要仪器要记住,特别是玻璃仪器,有烧杯,玻璃棒和漏斗.
(4)盛放硫酸铜溶液不宜用铁制容器是因为铁和硫酸铜溶液反应.(1)铜在空气中加热时,生成的氧化铜会覆盖在铜的表面,使铜不能和氧气接触,不能完全反应.
(2)氧化铜与稀硫酸反应的化学方程式为 CuO+H2SO4=CuSO4+H2O.
(3)操作Ⅰ的名称是过滤,该操作用到玻璃仪器,有烧杯、玻璃棒和漏斗.
(4)因为铁比铜活泼,能与硫酸铜溶液反应,化学方程式为:Fe+CuSO4═FeSO4+Cu
答案:(1)b
(2)CuO+H2SO4=CuSO4+H2O
(3)过滤,漏斗
(4)Fe+CuSO4═FeSO4+Cu点评:
本题考点: 金属的化学性质;过滤的原理、方法及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了同学们的分析能力还有书写化学方程式的能力.1年前查看全部
- 废铜是可以变成黄金的,只需要我们换一种思路和眼光.致富的秘诀就是如此简单.
废铜是可以变成黄金的,只需要我们换一种思路和眼光.致富的秘诀就是如此简单.
解释这句话中隐含的道理 acean2201年前1
acean2201年前1 -
 ♀ff一代♂ 共回答了19个问题
♀ff一代♂ 共回答了19个问题 |采纳率100%等待,但不是盲目的等待1年前查看全部
- (2了了了•潍坊)某研究性学习小组利用废铜屑生产单质铜,设计了如下两个实验方案:
(2了了了•潍坊)某研究性学习小组利用废铜屑生产单质铜,设计了如下两个实验方案:
写出反应①~④的化学方程式并注明基本反应类型
它2Cu+O2
2CuO;化合反应△ .2Cu+O2;
2CuO;化合反应△ .
2______;
3Cu(OH)2
CuO+H2O;分解反应△ .Cu(OH)2;
CuO+H2O;分解反应△ .
4______. 两点半11年前1
两点半11年前1 -
 精wwww 共回答了20个问题
精wwww 共回答了20个问题 |采纳率75%解题思路:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.只有熟悉四种基本反应类型的概念和特点,才能作出正确的判断.1、铜与氧气反应能生成氧化铜,方程式是:2Cu+O2
△
.
2CuO,属于少变一的反应,化合反应;
故答案为:2Cu+O2
△
.
2CuO;化合反应;
2、硫酸铜与氢氧化钠反应生成氢氧化铜与硫酸钠,方程式是:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;该反应是两种化合物生成两种化合物的反应是复分解反应.
故答案为:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4;复分解反应.
a、氢氧化铜受热会生成氧化铜与水,方程式是Cu(OH)2
△
.
CuO+H2O;是一种物质生成少种物质的反应,属于分解反应.
故答案为:Cu(OH)2
△
.
CuO+H2O;分解反应.
4、铁会与硫酸铜反应生成硫酸亚铁和铜,该反应由一种单质与一种化合物反应生成另一种单质和另一种化合物,符合置换反应的概念,属于置换反应.
故答案为:Fp+CuSO4═FpSO4+Cu;置换反应;点评:
本题考点: 金属的化学性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写和基本反应类型的判断,难度难度不大,主要是对一些概念的理解与掌握.1年前查看全部
- 某活动小组用废铜制取硫酸铜溶液,实验过程为:
某活动小组用废铜制取硫酸铜溶液,实验过程为:
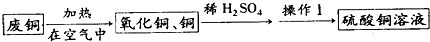
(1)废铜在空气中加热后得到的氧化铜中含有少量铜,原因是______(填字母序号).
a.加热时氧化铜易分解生成铜
b.铜与氧气没有完全反应
c.加热时铜不能与氧气反应
(2)操作Ⅰ的名称是______,该操作用到的玻璃仪器有:玻璃棒、烧杯、______.
(3)盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)______.
(4)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象可得,滤渣中一定含有______. 九六八1年前1
九六八1年前1 -
 雪中飞鸟 共回答了21个问题
雪中飞鸟 共回答了21个问题 |采纳率85.7%解题思路:铜和氧气在加热的条件下生成氧化铜,废铜在空气中加热后得到的氧化铜中含有少量铜,原因是铜与氧气没有完全反应;固体与液体分开的方法叫过滤,过滤用到的玻璃仪器有:玻璃棒、烧杯、漏斗;铁比铜活泼,因此铁和硫酸铜溶液反应生成硫酸亚铁和铜,所以盛放硫酸铜溶液不宜用铁制容器;向滤渣中加入稀盐酸,无气泡产生,说明铁粉没有剩余,那么铁一定置换出金属银,铜可能有也可能没有.(1)铜和氧气在加热的条件下生成氧化铜,废铜在空气中加热后得到的氧化铜中含有少量铜,原因是铜与氧气没有完全反应;故答案为:b
(2)固体与液体分开的方法叫过滤,过滤用到的玻璃仪器有:玻璃棒、烧杯、漏斗;故答案为:过滤;漏斗
(3)铁比铜活泼,因此铁和硫酸铜溶液反应生成硫酸亚铁和铜,所以盛放硫酸铜溶液不宜用铁制容器;故答案为:Fe+CuSO4=FeSO4+Cu
(4)向滤渣中加入稀盐酸,无气泡产生,说明铁粉没有剩余,那么铁一定置换出金属银,铜可能有也可能没有;故答案为:Ag点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;金属的化学性质;酸的化学性质.
考点点评: 本考点考查了物质的转化和制备、金属的活动顺序等,物质的制备有一下几种类型:一种是只能用题目给出的原料来制取;一种是自己选取原料来制备新物质;还有的是给你一部分药品,其它自选等.本题结合物质的性质,灵活应用,答案就会迎刃而解.1年前查看全部
- (2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如
 (2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
(2012•上海)碱式碳酸铜 Cu2(OH)2CO3是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式______.
(2)上图装置中NaOH溶液的作用是______.反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有______(填写化学式).
(3)步骤二中,水浴加热所需仪器有______、______(加热、夹持仪器、石棉网除外);洗涤的目的是______.
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法______.
(5)影响产品产量的主要因素有______、______.
(6)若实验得到2.42g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80g固体,此样品中碱式碳酸铜的质量分数是______. eqcheng20061年前1
eqcheng20061年前1 -
 笑笑就忘 共回答了22个问题
笑笑就忘 共回答了22个问题 |采纳率95.5%解题思路:(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,由NO2+NaOH→NaNO2+NaNO3+H2O,可知反应结束后,除剩余的NaOH外,还有新生成的NaNO2、NaNO3;
(3)反应器为大试管,水浴加热用烧杯盛放水,由于控制温度,用温度计测定水温;碱式碳酸铜表面附着的硝酸钠,需要洗涤除去;
(4)利用碳酸根与酸反应生成气体,将生成的气体通过澄清的石灰水进行检验;
(5)由步骤二可知,实验成功的关键是控制反应温度与溶液的pH值;
(6)碱式碳酸铜完全分解得到CuO,令样品中碱式碳酸铜的质量分数为x,则碱式碳酸铜的质量为2.42x g,根据碱式碳酸铜分解方程式,利用差量法列方程计算.(1)铜与浓硝酸反应生成硝酸铜、二氧化氮与水,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)反应生成的氮的氧化物是大气污染气体,被氢氧化钠溶液吸收,防止污染,由NO2+NaOH→NaNO2+NaNO3+H2O,可知反应结束后,除剩余的NaOH外,还有新生成的NaNO2、NaNO3,
故答案为:吸收氮的氧化物;NaNO2、NaNO3;
(3)反应器为大试管,水浴加热用烧杯盛放水,由于控制温度,用温度计测定水温;洗涤除去碱式碳酸铜表面附着的硝酸钠,
故答案为:烧杯、温度计;洗涤除去碱式碳酸铜表面附着的硝酸钠;
(4)检验碳酸根的方法为:取样,加入盐酸,将生成的气体通入澄清的石灰水,溶液变浑浊,说明含有CO32-,
故答案为:取样,加入盐酸,将生成的气体通入澄清的石灰水,溶液变浑浊,说明含有CO32-;
(5)由步骤二可知,实验成功的关键是控制反应温度与溶液的pH值,故影响产品产量的主要因素有:反应温度、溶液pH值,
故答案为:反应温度;溶液pH值;
(6)令样品中碱式碳酸铜的质量分数为x,碱式碳酸铜的质量为2.42x g,则:
Cu2(OH)2CO3
△
.
2CuO+H2O+CO2↑ 质量减少
222 62
2.42x g 2.42g-1.8g=0.62g
所以,222:62=2.42x g:0.62g
解得x=0.92
故答案为:0.92.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查物质制备实验,综合考查学生的实验能力,需要学生具备扎实的基础,难度中等.1年前查看全部
- 某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜).将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液.①此波尔多液中Cu2+离子和Ca2+离子的物质的量的比为 (最简整数比) ②波尔多液有效成分的化学式可表示为CuSO4·xCu(OH)2·yCa(OH)2,此种配比当x=1时,试确定y的数值 )
①混合体系中:Cu2+离子和Ca2+离子的物质的量的比=硫酸铜的物质的量比生石灰的物质的量=1/160:0.56/56=2︰5②CuSO4+Ca(OH)2=Cu(OH)2+CaSO4 反应前 2 5 0 0 反应后 1 4 1 1 ∴ CuSO4·Cu(OH)2·yCa(OH)2中 y=4
那2 5 0 0和1 4 1 1 是什么, wrw098dasf1年前4
wrw098dasf1年前4 -
 lfpeyht 共回答了17个问题
lfpeyht 共回答了17个问题 |采纳率82.4%根据物料守恒可知:配置波尔多液时,胆矾、生石灰的物质的量之比为2:5
波尔多液有效成分是CuSO4·xCu(OH)2·yCa(OH)2,由于硫酸根、铜离子、钙离子守恒,硫酸根、铜离子、钙离子物质的量之比是2:2:5,故反应后还应生成CaSO4, 胆矾、生石灰、CuSO4·xCu(OH)2·yCa(OH)2、CaSO4物质量比例关系反应前2:5:0:0,反应后CuSO4、CaSO4、Cu(OH)2、Ca(OH)2物质的量关系为1:4:1:11年前查看全部
- 某同学利用废铜屑制备硫酸铜.实验前先将废铜至于Na2CO3溶液中煮沸5分钟,然后汲取Na2co3溶液,再用蒸馏水
某同学利用废铜屑制备硫酸铜.实验前先将废铜至于Na2CO3溶液中煮沸5分钟,然后汲取Na2co3溶液,再用蒸馏水
洗涤三次,由于铜不与稀硫酸直接反应、、、、、、问,实验前讲铜屑与Na2CO3溶液中煮沸5分钟的目的是 quiesvqj1年前1
quiesvqj1年前1 -
 玻璃焦 共回答了26个问题
玻璃焦 共回答了26个问题 |采纳率92.3%除去铜屑表面的油污.油污可以被碱性的Na2CO3反应掉.1年前查看全部
- 废铜屑制硫酸铜,小花同学方案为铜与浓硫酸反应,其反应原理是:Cu+2H 2 SO 4 (浓) △
废铜屑制硫酸铜,小花同学方案为铜与浓硫酸反应,其反应原理是:Cu+2H 2 SO 4 (浓)
CuSO 4 +X↑+2H 2 O.小朵同学方案为:2Cu+O 2△ .
2CuO,CuO+H 2 SO 4 =CuSO 4 +H 2 O.△ .
则X是______(写化学式),较好的方案是______,其优点有(1)______,(2)______. 水如风1年前1
水如风1年前1 -
 地狱的呼唤 共回答了23个问题
地狱的呼唤 共回答了23个问题 |采纳率91.3%根据反应前后元素的种类和数目不变,X的化学式为SO 2
由反应可知:甲方案:Cu+2H 2 SO 4 (浓)
加热
.
CuSO 4 +2H 2 O+SO 2 ↑,
乙方案:2Cu+O 2
△
.
2CuO;CuO+H 2 SO 4 (稀)═CuSO 4 +H 2 O,
制取相同量的硫酸铜时,方案甲消耗的硫酸比乙的多,并且制取过程中产生了污染大气的有毒气体SO 2 .
故答为:SO 2 ,小朵;(1)不产生污染性气体,(2)硫酸利用率高;1年前查看全部
- (2013•台州一模)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是实验室以抛光厂的废铜屑(含有少量铁粉、
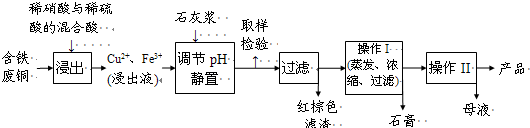
(2013•台州一模)CuSO4•5H2O是铜的重要化合物,有着广泛的应用.以下是实验室以抛光厂的废铜屑(含有少量铁粉、油污)为原料来制备、提纯CuSO4•5H2O及含量测定的流程:
步骤1、铜的提纯
将3克废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热;冷却备用
步骤2、硫酸铜晶体粗产品的制备
步骤3、硫酸铜的提纯
步骤4、硫酸铜的纯度检验
请回答下列问题:
(1)步骤1中废铜屑进行灼烧的主要目的为:Ⅰ.使铜屑部分氧化成氧化铜;
Ⅱ.______
(2)步骤3中要进行多次过滤,可采用如图1的方法,其名称为______,下列关于该过滤方法的说法不正确的是______
A.该方法适用于过滤胶状沉淀或颗粒较小的沉淀
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤
C.这种过滤方法可以避免沉淀过早堵塞滤纸小孔而影响过滤速度
D.该操作中玻璃棒的作用为引流
本步骤中滤液要进行两次调节pH,其主要目的依次为:______;______.(请结合离子方程式和简要的语言来描述)
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取 0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol•L-1氢氧化钠溶液25.00mL,待反应完全后,过量的氢氧化钠用0.1000mol•L-1盐酸滴定至终点,耗用盐酸17.32mL,则 0.1000g该试样中含CuSO4•5H2O______g.
(4)上述实验中,用25.00mL移液管量取0.1000mol•L-1氢氧化钠溶液25.00mL之前,先用蒸馏水洗净后,再用待装液润洗.吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,______.然后将移液管垂直放入稍倾斜的锥形瓶中,使管尖与内壁接触…
(5)如果铜屑、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是______,除去这种杂质的实验操作名称为______.
附:溶解度表及溶解度曲线
温度 0℃ 20℃ 40℃ 60℃ 80℃ CuSO4•5H2O 23.1 32.0 46.4 61.8 83.8 Cu(NO3)2•6H2O 81.8 125.1 Cu(NO3)2•3H2O 160 178.5 208  aqdpkhl5c1年前1
aqdpkhl5c1年前1 -
 芽孢杆菌 共回答了22个问题
芽孢杆菌 共回答了22个问题 |采纳率90.9%解题思路:(1)废铜屑含有少量铁粉、油污,废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热,冷却备用,目的是除去表面的油污,使铜被氧化为黑色氧化铜的作用;
(2)图1的分离方法为倾析法;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.
依据流程图分析可知,第一次调节溶液PH是为了沉淀铁离子生成氢氧化铁沉淀,第二次调节溶液PH是为了抑制铜离子的水解;
(3)依据题干数据结合实验过程分析,依据数据计算和硫酸铜反应的氢氧化钠物质的量,得到CuSO4•5H2O的物质的量计算含量;
(4)依据移液管的使用方法回答;
(5)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;(1)废铜屑含有少量铁粉、油污,废铜屑放入蒸发皿,灼烧至表面变黑,立即停止加热,目的是除去表面的油污,使铜被氧化为黑色氧化铜的作用;
故答案为:除去铜屑表面油污;
(2)图1的分离方法为倾析法;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离;沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离.沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离;
A.该方法适用于过滤颗粒较大的沉淀,沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离,故A不正确;
B.使用该方法过滤后,若沉淀物要洗涤,可注入水(或其他洗涤液),充分搅拌后使沉淀沉降,再进行过滤,符合此过滤操作,故B正确;
C.倾析法过滤可以避免沉淀过早堵塞滤纸小孔而影响过滤速度,故C正确;
D.该操作中玻璃棒的作用为引流作用,故D正确;
故选A.
依据流程图分析可知,第一次调节溶液PH是为了沉淀铁离子生成氢氧化铁沉淀,第二次调节溶液PH是为了抑制铜离子的水解;
第一次调节pH:因pH升高,平衡Fe3++3H2O⇌Fe(OH)3+3H+向右移动,产生Fe(OH)3沉淀而除去Fe3+;
第二次调节pH:是为了抑制铜离子水解Cu2++2H2O⇌Cu(OH)2+2H+,而提高产率;
故答案为:倾析法,A;第一次调节pH:因pH升高,平衡Fe3++3H2O⇌Fe(OH)3+3H+向右移动,产生Fe(OH)3沉淀而除去Fe3+;第二次调节pH:是为了抑制铜离子水解Cu2++2H2O⇌Cu(OH)2+2H+,而提高产率;
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取 0.1000g提纯后的CuSO4•5H2O试样于锥形瓶中,加入0.1000mol•L-1氢氧化钠溶液25.00mL,待反应完全后,过量的氢氧化钠用0.1000mol•L-1盐酸滴定至终点,耗用盐酸17.32mL,计算得到沉淀铜离子需要的氢氧化钠物质的量=0.1000mol•L-1×0.025.00L-0.1000mol•L-1×0.01732mL=0.000768mol,依据CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 反应的化学方程式定量关系计算得到硫酸铜物质的量=0.000384mol,则 0.1000g该试样中含CuSO4•5H2O的质量=0.000384mol×250g/mol=0.0960g;
故答案为:0.0960;
(4)吸取液体时,左手拿洗耳球,右手将移液管插入溶液中吸取,当溶液吸至标线以上时,立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹面最低处与标线相切,立即按紧管口,然后将移液管垂直放入稍倾斜的锥形瓶中,使管尖与内壁接触;
故答案为:立即用食指将管口堵住,将管尖离开液面,稍松食指使液面平稳下降,至凹面最低处与标线相切,立即按紧管口;
(5)铜屑、硫酸及硝酸都比较纯净,则制得的CuSO4•5H2O中可能存在的杂质是混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离;
故答案为:Cu(NO3)2•6H2O,重结晶;点评:
本题考点: 探究物质的组成或测量物质的含量;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了实验探究物质含量的测定方法和实验设计验证,主要是镏出分析判断,过程中的定量计算应用,掌握基础是关键,题目难度中等.1年前查看全部
大家在问
- 1英语翻译齐景公为高台,劳民.……景公乃止.翻译不要和以前一样的,以前的是错的.不要这个"齐景公在位的时候,雪下了三天不转
- 2传感器技术复习题(1) 传感器按构成原理,可分为( )型和( )型两大类,一般由()、()、()三部分组成.为了改善其性
- 3平行四边形ABCD中,顶点A(1,2),B(3,-3),C(4,-1),求向量DC的坐标和D点的坐标?
- 4把茂盛、设计、参加、这三个词连接成一段话怎么写?
- 5古诗鉴赏。 观书有感朱熹半亩方塘一鉴开,天光云影共徘徊。问渠那得清如许?为有源头活水来。(选自《义务教育课程标准实验教科
- 6谁帮我写1000字的作文呀,读后感。书是昆虫记和城南旧事。感激万分
- 7物理——关于雷电(1) 雷电中的电是怎样形成的?(2) 打雷时,云层上的电荷发生了一种物理现象,这种现象是什么?(3)
- 8已知A是实数函数Fx=X方(X-A)判断函数在【0,2】上的单调性
- 9算一个化学式的分子量是用物质的量计算还是用离子数计算
- 10九年级语文愚公移山练习题,求答案. 1.愚公的妻子和智叟对移山的态度有何不同? 2.文章中两个人物
- 11看图填空:(单位:厘米)如图中:______面积最大;______和______的面积相等.
- 12动物中视角最大的是?A猩猩,B老虎,C鱼,D蚂蚁
- 13连续自然数按左图规律排列,8排在第二行,第三列.1、排在第一列第十个数是几?2、排在第十二行,第十二
- 14下列关于化学电源的说法正确的是( )
- 15free在这里是动词吗?A land free from destruction,plus wealth,natural