前20号元素..原子核外电子分层排布
 小小韩韩2022-10-04 11:39:543条回答
小小韩韩2022-10-04 11:39:543条回答如题,我急要前20号元素原子核外电子分层排布
书写规格如下:例如:11号 钠:+11)2)8)1

已提交,审核后显示!提交回复
共3条回复
 vvgirl11 共回答了25个问题
vvgirl11 共回答了25个问题 |采纳率92%- 1号 氢:+1)1
2号 氦:+2)2
3号 锂:+3)2)1
4号 铍:+4)2)2
5号 硼:+5)2)3
6号 碳:+6)2)4
7号 氮:+7)2)5
8号 氧:+8)2)6
9号 氟:+9)2)7
10号 氖:+10)2)8
11号 钠:+11)2)8)1
12号 镁:+12)2)8)2
13号 铝:+13)2)8)3
14号 硅:+14)2)8)4
15号 磷:+15)2)8)5
16号 硫:+16)2)8)6
17号 氯:+17)2)8)7
18号 氩:+18)2)8)8
19号 钾:+19)2)8)8)1
20号 钙:+20)2)8)8)2 - 1年前
 阿乐668 共回答了4个问题
阿乐668 共回答了4个问题 |采纳率- 氢 +1)1
氦 +2)2
锂 +3)2)1
铍 +4)2)2
硼 +5)2)3
碳 +6)2)4
氮 +7)2)5
氧 +8)2)6
氟 +9)2)7
氖 +10)2)8
钠 +11)2)8)1
镁 +12)2)8)2
铝 +13)2)8)3
硅 +14)2)8)4 ... - 1年前
 浪子588 共回答了8个问题
浪子588 共回答了8个问题 |采纳率- 氢 +1)1
氦 +2)2
锂 +3)2)1
铍 +4)2)2
硼 +5)2)3
碳 +6)2)4
氮 +7)2)5
氧 +8)2)6
氟 +9)2)7
氖 +10)2)8
钠 +11)2)8)1
镁 +12)2)8)2
铝 +13)2)8)3
硅 +14)2)8)4
磷 +15)2)8)5
硫 +16)2)8)6
氯 +17)2)8)7
氩 +18)2)8)8
钾 +19)2)8)8)1
钙 +20)2)8)8)2 - 1年前
相关推荐
- 已知四种元素A、B、C、D 为1~20号元素,且原子序数依次增大,A的核外电子数与其电子层数相等;B的原子半径是其所在主
已知四种元素A、B、C、D 为1~20号元素,且原子序数依次增大,A的核外电子数与其电子层数相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO 3 ;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D 2 C。
请回答下列问题:
(1) C在周期表中的位置第 ______周期,第________族;
(2)写出铜与稀HBO 3 溶液反应的离子反应方程式__________________;
(3)A、B形成的化合物的结构式____ ;其中含有的化学键类型为________,用电子式表示该化合物形成过程 ___________;
(4)写出D与C形成化合物的电子式____________________。 fsa101sina1年前0
fsa101sina1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素周期表前20号元素的化合价
 sunytony1年前3
sunytony1年前3 -
 工人介 共回答了22个问题
工人介 共回答了22个问题 |采纳率90.9%都有0价,从左数前三列化合价分别为+1+2+3,氮族-3,0,+1,+2,+3,+4,+5氧族-2,0,+2,+4,+6卤素-1,0,+1,+3,+5,+7,惰性气体01年前查看全部
- w,x,y和z都是元素周期表中前20号元素,已知:1w的阳离子和y的阴离子具有相同的核外电子排布,且能组成wy
w,x,y和z都是元素周期表中前20号元素,已知:1w的阳离子和y的阴离子具有相同的核外电子排布,且能组成wy
的化合物.
2 yz是同族元素,且能形成两种常见化合物.
3 xz属同一周期元素,能形成两种气态化合物.
4 wx能形成wx2的化合物.
5 xy不在同一周期,能形成xy2.
问1 w是 z是
2 wy是 wx2是
3 yz形成的两种常见的化合物的分子式是
4 xz形成的一种气态化合物跟xz反应的方程式
xz和wz反应 小宁子1年前1
小宁子1年前1 -
 julienijun 共回答了21个问题
julienijun 共回答了21个问题 |采纳率90.5%1 w是 Ca z是 O
2 wy是 CaS wx2是 CaC2
3 yz形成的两种常见的化合物的分子式是 SO2 和 SO3
4 题目是不是有问题,xz和xz反应?1年前查看全部
- 元素周期律是学习和研究化学的重要工具.查看元素周期表内前20号元素的部分信息,回答问题:
元素周期律是学习和研究化学的重要工具.查看元素周期表内前20号元素的部分信息,回答问题:
(1)原子序数为9的元素符号是______,名称是______,原子核外电子数是______,相对原子质量是______.
(2)地壳中含量最多的金属元素的符号是______.
(3)表中每一周期元素原子序数的变化规律是______. stage01年前1
stage01年前1 -
 我被小妹uu 共回答了16个问题
我被小妹uu 共回答了16个问题 |采纳率81.3%解题思路:(1)由元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析解答即可.
(2)地壳中含量最多的金属元素是铝元素,写出其元素符号即可.
(3)根据元素周期表中每周期的元素的原子序数变化找到规律即可.(1)原子序数为9的元素符号为:F,名称为氟;根据原子序数=核电荷数=质子数=核外电子数,则该元素的原子核外电子数为9,相对原子质量是19.00.
(2)地壳中含量最多的金属元素是铝元素,其元素符号为:Al.
(3)将每一周期的元素的原子序数对比可知,由左向右原子序数依次增大.
故答案为:(1)F;氟;9;19.00;(2)Al;(3)从左到右依次增大.点评:
本题考点: 元素周期表的特点及其应用;元素的符号及其意义.
考点点评: 本题难度不大,考查学生灵活运用元素周期表中元素的信息进行分析解题的能力.1年前查看全部
- (2011•长宁区模拟)下表为周期表前20号元素中某些元素的有关数据:
(2011•长宁区模拟)下表为周期表前20号元素中某些元素的有关数据:
试回答下列问题:(以下各题回答,可能的话,均用对应的元素符号或物质的化学式表示)元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 原子半径(10-10m) 1.86 1.52 0.66 1.43 0.77 1.10 0.99 2.31 0.70 0.64 最高价态 +1 +1 -- +3 +4 +5 +7 +1 +5 -- 最低价态 -- -- -2 -- -4 -3 -1 -- -3 -1
(1)写出⑦⑨与氢元素形成的常见离子化合物的电子式______
(2)上述⑤、⑥、⑦号元素中某2种元素形成的化合物中,每一个原子都满足最
外层为8电子稳定结构的物质可能是______、______;
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是______
(4)以上10种元素的原子中,失去核外第一个电子所需能量最少的是______
(5)④、⑦、⑧、⑩四种元素形成的离子,其半径由小到大的顺序为______. baby_leslie1年前0
baby_leslie1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三
已知A~J物质是由周期表中1~20号元素组成的10种物质,其中常温常压下C、D、F、G、I均呈气态,H为无色液体,M为三大强酸之一。反应②③④⑥为工业生产中重要的反应。等物质的量的A、B充分混合后加热能恰好完全反应(如下图所示),E的式量为100。图中反应条件(除加热外)均已略去。 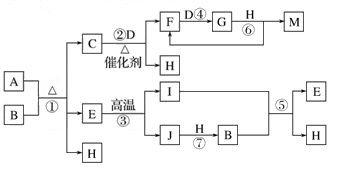
(1)写出A的化学式________。I的结构式________。
(2)写出下列反应的离子方程式:
①向A溶液中加入过量的NaOH溶液,并加热_____________________________;
②气体I通入足量B溶液中_______________________________________。
(3)写出反应②的化学方程式_______________________________________________。
(4)如对盛有气体G的密闭容器(带可移动的活塞)进行压缩操作,产生的现象是______________________;原因是_____________________________________________。 meizi6481年前1
meizi6481年前1 -
 shiguiii 共回答了21个问题
shiguiii 共回答了21个问题 |采纳率95.2%1年前查看全部
- 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子.
(1)该融雪剂的化学式是______;X与氢元素形成的化合物的电子式是______.
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是______;D与E能形成一种非极性分子,该分子的结构式为______;D所在族元素的氢化物中,沸点最低的是______.
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是______.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为______. 非常66071年前1
非常66071年前1 -
 cnecn 共回答了23个问题
cnecn 共回答了23个问题 |采纳率87%解题思路:(1)融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为543=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素;故E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,根据晶体结构与氢键判断氢化物沸点高低;(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素,元素Z的单质分子Z2中由3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4;(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,则R为F元素,F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,反应中O元素化合价不变,故F元素化合价还降低,有NaF生成,根据元素守恒有水生成,据此配平书写.融雪剂主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,含有相同的核外电子数,且1molXY2含有54mol电子,则阴、阳离子核外电子数为[54/3]=18,则为Ca2+、Cl-,故XY2是CaCl2,X为Ca、Y为Cl,
(1)XY2是CaCl2;X与氢元素形成的化合物为CaH2,属于离子化合物,由钙离子与氢负离子构成,其电子式是 ,
,
故答案为:CaCl2; ;
;
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与氯元素相邻,则D为硫元素,D的离子结构示意图是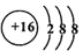 ;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
;E有2个电子层,最外层电子数为4,则E为碳元素,碳元素与硫元素形成的一种对称分子为CS2,与二氧化碳结构类似,其结构式为:S=C=S,氧族元素中氢化物为分子晶体(Po除外),而水分子之间存在氢键,沸点最高,硫化氢相对分子质量小于硒化氢、碲化氢,H2S分子间作用力较小,故H2S的沸点最低,
故答案为: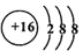 ;S=C=S;H2S;
;S=C=S;H2S;
(3)元素W与Cl元素同周期,其单质是原子晶体,则W为Si元素,元素Z的单质分子Z2中由3个共价键,则Z为氮元素,Si与N形成一种新型无机非金属材料为Si3N4,
故答案为:Si3N4;
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,则R为F元素,F2与NaOH溶液反应的产物之一是OF2,OF2中氧元素为+2,F元素为-1价,反应中O元素化合价不变,故F元素化合价还降低,有NaF生成,根据元素守恒有水生成,反应离子方程式为:2F2+2OH-=2F-+OF2+H2O,
故答案为:2F2+2OH-=2F-+OF2+H2O.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系、常用化学用语、物质结构与性质等,难度中等,氢化钙电子式与氟气与氢氧化钠溶液反应为易错点,注意氢化钙中氢离子电子式中2个电子为成对电子,不要分开书写,注意OF2不是氧化物,其中氧元素表现正化合价.1年前查看全部
- 20号元素中能组成最多化合物的两种元素是什么
20号元素中能组成最多化合物的两种元素是什么
理由 sweetycream1年前4
sweetycream1年前4 -
 xixihehe0340 共回答了21个问题
xixihehe0340 共回答了21个问题 |采纳率90.5%第一位的是C,因为有机物的种类数比无机物加起来还要多,第二位就是H了,因为有机物一般都含H.1年前查看全部
- A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C
A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍.B和D是同周期元素且A和B能形成AB2型化合物.下列说法中正确的是( )
A.D元素处于元素周期表中第二周期Ⅵ族
B.BC2分子一定是极性分子
C.AB2中可能既有离子键又有共价键
D.四种元素的原子半径大小一定是A>C>D>B 岚尧1年前1
岚尧1年前1 -
 若苦哥哥 共回答了13个问题
若苦哥哥 共回答了13个问题 |采纳率100%解题思路:C和D属同主族,其中C的核外电子数是D的核内质子数的2倍,则C为S元素,D为O元素,A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物,则A在周期表第四周期,第ⅡA族,应为Ca元素,B和D是同周期元素且A和B能形成AB2型化合物,则B为C元素或F元素,形成的化合物为CaF2或CaC2,据此解答题中各问.解;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍,则C为S元素,D为O元素,A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物,则A在周期表第四周期,第ⅡA族,应为Ca元素,B和D是同周期元素且A和B能形成AB2型化合物,则B为C元素或F元素,形成的化合物为CaF2或CaC2,
A、D为O元素,处于元素周期表中第二周期ⅥA族,故A错误;
B、若BC2分子为CS2,为直线形分子,结构对称,是非极性分子,故B错误;
C、如AB2是CaC2,则既有离子键又有共价键,故C正确;
D、如B是C元素,则四种元素的原子半径大小顺序是A>C>B>D,故D错误.
故选C.点评:
本题考点: 原子结构与元素周期律的关系;微粒半径大小的比较;化学键;极性分子和非极性分子.
考点点评: 本题考查原子结构和元素周期律的应用,本题难度不大,注意B的两种可能性.1年前查看全部
- X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物。下列说法正确的是 [ ]A.还原性:X的氧化物>Y的氧化物>Z的氢化物
B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.YX、MY都是含有极性键的极性分子
D.Z元素的最高价氧化物的水化物的化学式为HZO 4 逐水月华1年前1
逐水月华1年前1 -
 airxin 共回答了15个问题
airxin 共回答了15个问题 |采纳率93.3%D1年前查看全部
- 20号元素的离子符号呀!请把 20号 元素的 离子符号画出来,并写出 离子 符号...写啊写离子符号有什么规律?怎么有人
20号元素的离子符号呀!
请把 20号 元素的 离子符号画出来,并写出 离子 符号...写啊写
离子符号有什么规律?
怎么有人和你回答的不一样
并不是1~20的元素都能写出例子符号的,要那种容易得电子或失电子的元素才能有离子,也就是活泼的金属或非金属才行。
H-、Li+、N3-、O2-、F-、Na+、Mg2+、Al3+、S2-、Cl-、K+、Ca2+ dujiang1211年前1
dujiang1211年前1 -
 yckfj 共回答了16个问题
yckfj 共回答了16个问题 |采纳率87.5%每个元素都有他的最高正价和最低负价(除F,O,稀有气体)(高一必修1)
常见的有
H-、Li+、N3-、O2-、F-、Na+、Mg2+、Al3+、S2-、Cl-、K+、Ca2+
如果你是初中这些应该够了
希望我的答案对你有用1年前查看全部
- 高一化学问题:W,X,Y和Z都是周期表中前20号元素,已知:
高一化学问题:W,X,Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见的化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能组成为XY2的化合物.
那么这几种元素各是什么呢?
请问,这种答案WX2,XY2可以说的通呢? u2_20011年前3
u2_20011年前3 -
 吃的比猪差 共回答了19个问题
吃的比猪差 共回答了19个问题 |采纳率94.7%W:Ca Y:S Z:O X:C1年前查看全部
- 原子核内质子数等于中子数 的原子 有那些?前20号元素中!
 CMVNB1年前3
CMVNB1年前3 -
 65384403 共回答了19个问题
65384403 共回答了19个问题 |采纳率84.2%He
C
N
O
Ne
Mg
Si
S
Ca1年前查看全部
- 18,A ,B ,C ,D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,
18,A ,B ,C ,D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,
且能形成组成为AC的化合物;C和D属同主族元素,其中C的核外电子数是D的核内质子数的2倍.B和D是同周期元素且B的原子半径小于D,且A和B能形成AB2型化合物.下列说法中不正确的是( )
A.D元素处于元素周期表中第2周期ⅥA族
B.AB2中只含有离子键 C AD2中只含有离子键
D A ,C形成化合物的电子式为
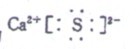
请给出每一项的详细解析, aqwr1年前2
aqwr1年前2 -
 liven1122 共回答了23个问题
liven1122 共回答了23个问题 |采纳率91.3%非常高兴再次看到你的提问.
选C
A、因为D元素为氧元素,所以D位于元素周期表中第2周期ⅥA族,A正确;
B、AB2为CaF2,CaF2是离子化合物,只含有离子键,所以B正确;
C、AD2为过氧化钙CaO2,CaO2中既含非极性共价键又含有离子键,所以C不正确;
D、A、C形成的化合物为硫化钙,硫化钙为离子化合物,每个钙原子失去2个电子达到8个电子的稳定结构,所以1个钙离子带2个单位的正电荷、每硫原子得到2个电子达到8个电子稳定的结构,所以1个硫离子带2个单位的负电荷,阳离子的电子式用离子符号表示,阴离子电子式用中括号括起来,再在右上角标明所带电荷数,如上面的硫离子,所以正确.
分析:C和D属同主族元素,其中C的核外电子数是D的核内质子数的2倍,说明D为氧元素O,C为硫元素S;
A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物,说明A为钙Ca;
B和D是同周期元素且B的原子半径小于D,且A和B能形成AB2型化合物,说明B的核电荷数大,因为同一周期随核电荷的增加,原子半径逐渐减小,则B为氟;
希望我的回答能对你的学习有帮助!1年前查看全部
- (2014•宜春模拟)香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的
(2014•宜春模拟)香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D.XR2、WR2两化合物中R的化合价相同 辽大乱舞1年前1
辽大乱舞1年前1 -
 hunancxdjp 共回答了24个问题
hunancxdjp 共回答了24个问题 |采纳率83.3%解题思路:T无正价,则T为氟元素;Y、Z、R、T位于同周期,则在第二周期,由R最外层电子数为次外层的3倍,则R为氧元素;Z的最外层电子数与次外层相等,则Z为铍元素;Y、Z为金属元素,Y在第二周期,则Y为锂元素;X、Z位于同主族,则X为镁元素或钙元素;若X为镁元素,则由X与R原子序数之和是W的2倍,则[12+8/2]=10,推出W为氖元素不符合题意,若X为钙元素,则由X与R原子序数之和是W的2倍,[20+8/2]=14,推出W为硅元素,即X为钙元素、W为硅元素符合题意;
A、利用电子层越多,原子半径越大,同周期元素的原子半径从左向右半径在减小;
B、非金属性越强,则气态氢化物越稳定;
C、金属性越强,则最高价氧化物对应的水化物碱性越强;
D、根据常见元素的化合价及化合价原则来分析.根据T无正价,则T为氟元素;Y、Z、R、T位于同周期,则在第二周期,由R最外层电子数为次外层的3倍,则R为氧元素;Z的最外层电子数与次外层相等,则Z为铍元素;Y、Z为金属元素,Y在第二周期,则Y为锂元素;X、Z位于同主族,则X为镁元素或钙元素;若X为镁元素,则由X与R原子序数之和是W的2倍,则[12+8/2]=10,推出W为氖元素不符合题意,若X为钙元素,则由X与R原子序数之和是W的2倍,[20+8/2]=14,推出W为硅元素,
即X为钙元素、Y为锂元素、Z为铍元素、R为氧元素、W为硅元素、T为氟元素符合题意;
A、Y为锂元素、Z为铍元素、R为氧元素、T为氟元素,位于同周期,元素的原子半径从左向右半径在减小,故A正确;
B、W为硅元素、R为氧元素、T为氟元素,非金属性F>O>Si,则气态氢化物的稳定性W<R<T,故B正确;
C、X为钙元素、Z为铍元素,钙的金属性强,则最高价氧化物对应的水化物碱性X>Z,故C正确;
D、XR2、WR2两化合物CaO2、SiO2,因钙元素为+2价、硅元素为+4价,则R的化合价分别为-1、-2价,即XR2、WR2两化合物中R的化合价不相同,故D错误;
故选D.点评:
本题考点: 原子结构与元素周期律的关系;位置结构性质的相互关系应用.
考点点评: 本题考查学生利用元素的位置及原子的结构来推断元素,然后利用元素周期律及化合价知识来解答即可.1年前查看全部
- 20号元素中找出满足核外电子数为10的微粒 分子(或原子) 阳离子 阴离子
20号元素中找出满足核外电子数为10的微粒 分子(或原子) 阳离子 阴离子
阴离子中 为什么碳 是不可以的,不是C4- rain鱼儿1年前3
rain鱼儿1年前3 -
 10223022 共回答了15个问题
10223022 共回答了15个问题 |采纳率93.3%分子原子:Ne CH4 NH3 H2O HF
阳离子:Na+ Mg2+ Al3+ NH4+ H3O+
阴离子:F- O2- N3- OH- NH2-
C4-这种物质是没有的.C虽然有-4价,但是没有简单离子,只有在化合物中才体现出-4(或+4)1年前查看全部
- 化学前20号元素符号及原子结构示意图
化学前20号元素符号及原子结构示意图
能一一对应写更好啊! mb2423081年前0
mb2423081年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 根据元素周期表1-20号元素特性和递变规律,回答下列问题
根据元素周期表1-20号元素特性和递变规律,回答下列问题
属于金属元素的有___种,金属性最强的元素与氧化反应生成的化合物___〔填两种化合物的化学式〕
属于稀有气体的是___〔填元素符号,下同〕
形成化合物种类最多的两种元素是_____
第三周期中,原子半径最大的是〔稀有气体除外〕___
推测Si,N最简单氢化物的稳定性___>___〔填化学式〕 wengleiwen1年前1
wengleiwen1年前1 -
 杰客2518 共回答了17个问题
杰客2518 共回答了17个问题 |采纳率82.4%6 Li Na Mg Al K Ca
K2o
He Ne Ar
C 和O
Na
NH3>SiH41年前查看全部
- 最外层有1个电子的元素是什么?(前20号元素)
 rachelfang1年前2
rachelfang1年前2 -
 fghe324 共回答了18个问题
fghe324 共回答了18个问题 |采纳率77.8%分别有:第一号氢元素、第三号锂元素、第十一号钠元素;因为氢元素位于第一周期且位于第一主族,锂元素位于第二周期第一主族,钠元素位于第三周期第一主族.
周期就是元素外面的电子层数,位于第几周期其电子层数就有几层.
主族数目元素的最外层电子数数目一致.1年前查看全部
- 20号元素中10电子和18电子的粒子中有什么规律?
20号元素中10电子和18电子的粒子中有什么规律?
包括它们组成的化合物和离子等 工6851年前1
工6851年前1 -
 雨水那天 共回答了18个问题
雨水那天 共回答了18个问题 |采纳率88.9%最外层电子数8个
一种较稳定的电子排列
10的-2-8
18的2-8-81年前查看全部
- XYZ是周期表中的前20号元素,其原子序数依次增大.X是原子半径最小的元素,Y元素的最高正价与最低负价的代数和为4.其中
XYZ是周期表中的前20号元素,其原子序数依次增大.X是原子半径最小的元素,Y元素的最高正价与最低负价的代数和为4.其中X与Z同主族,X元素与Y元素形成化合物A,Y元素与Z元素形成离子化合物B,且Y元素所形成的离子与Z元素所形成的离子电子层结构相同
(1)X元素为( ),Y元素为( ) Z元素为( ) 最爱山茶花1年前1
最爱山茶花1年前1 -
 hfqsky 共回答了18个问题
hfqsky 共回答了18个问题 |采纳率88.9%X为H
Y为S,最低负价为-2,最高正价为+6
Z为K1年前查看全部
- 前20号元素单质中,在常温下与水反应放氢气的四种元素.
 yiyi5241年前3
yiyi5241年前3 -
 说的已说过 共回答了22个问题
说的已说过 共回答了22个问题 |采纳率95.5%锂,钠,钾,钙1年前查看全部
- 20号元素,请每个都举出一个可以构成的物质的例子,如果可以请写出分子质量.
20号元素,请每个都举出一个可以构成的物质的例子,如果可以请写出分子质量.
20号元素,请每个都举出一个可以构成的物质的例子,如果可以请写出分子质量.列如..6号 C 碳 可以构成CO2 分子质量44
如果实在是烦恼算分子质量也可以不算.急.. happying20081年前4
happying20081年前4 -
 叶倮 共回答了19个问题
叶倮 共回答了19个问题 |采纳率78.9%1 H 氢,H2O,分子量 18
2 He 氦,He(氦气),分子量 4
3 Li 锂,Li2O,分子量 30
4 Be 铍,BeO,分子量25
5 B 硼,BBr3,分子量251
6 C 碳,CO,分子量28
7 N 氮,NO,分子量30
8 O 氧,O2,分子量32
9 F 氟,F2,分子量38
10 Ne 氖,Ne,分子量20
11 Na 钠,NaOH,分子量40
12 Mg 镁,MgO,分子量40
13 Al 铝,Al2O3,分子量102
14 Si 硅,SiC,分子量40
15 P 磷,P2O5,分子量154
16 S 硫,H2S,分子量34
17 Cl 氯,HCl,分子量36.5
18 Ar 氩,Ar,分子量40
19 K 钾,KOH,分子量56
20 Ca 钙,CaO,分子量561年前查看全部
- 化学兴趣小组6名同学要每人在化学元素周期表中的前20号元素中随机选取一种元素了解其化学性质.利用计算器模拟试验的方法估计
化学兴趣小组6名同学要每人在化学元素周期表中的前20号元素中随机选取一种元素了解其化学性质.利用计算器模拟试验的方法估计有两人或两人以上选择同一化学元素的概率时,应随机产生_____到_____之间的随机整数.
讲清楚点. 落雁韵舞1年前1
落雁韵舞1年前1 -
 coralll 共回答了25个问题
coralll 共回答了25个问题 |采纳率96%1 到 20.
这是概率题?1年前查看全部
- 1到20号元素的电子式如何书写
 牛瑟瑟1年前0
牛瑟瑟1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请写出1—20号元素的离子得失电子数目
请写出1—20号元素的离子得失电子数目
如氢离子,氦离子,硼离子等等 macc1年前1
macc1年前1 -
 xuezuhui 共回答了24个问题
xuezuhui 共回答了24个问题 |采纳率91.7%氢,钠,钾失1个电子
镁,钙失去2个电子
铝失3个电子
氟,氯得到1个电子
氧,硫得到2个电子
氮,磷一般是共用3个电子对的1年前查看全部
- 11到20号元素电子式不是元素结构图~是电子式
 小豆丫头1年前1
小豆丫头1年前1 -
 ILZXM 共回答了15个问题
ILZXM 共回答了15个问题 |采纳率80%Na和K一样
.
Na
Mg和Ca一样
.Mg.
.
.Al.
.
.Si .
.
.
:P .
.
.
:S:
.
..
:Cl:
.
..
:Ar:
..1年前查看全部
- D.E.X.Y.Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体,三角锥形,
D.E.X.Y.Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体,三角锥形,正四面体,角形(V形),直线形.回答下列问题.1.Y的最高价氧化物化学式?中心原子杂化为?2.以上元素能形成酸性最强的元素是?写出3种?,最低价含氧酸电子式?,此物关照后发生的反应方程式?3.D和X形成的化合物化学键类型是?中心原子杂化方式?有几个π键?其用途之一?4.价电子构型为3S2的元素的单质可以和E的单质在高温下发生反应,其电子式?次产物雨水反应生成两种碱,该反应的化学方程式?(每个问好一个空,电子式用图片,
 ljz1987561年前1
ljz1987561年前1 -
 雨容 共回答了25个问题
雨容 共回答了25个问题 |采纳率100%D 为C E为N X 为 si Y 为S Z为Cl,下面的应该没有什么难的了吧1年前查看全部
- XY是元素周期表前20号元素,Y的核电荷数比X小4
XY是元素周期表前20号元素,Y的核电荷数比X小4
若Y是最活泼的非金属元素X的单质与强碱溶液反应的离子方程式 有谁不是过客91年前2
有谁不是过客91年前2 -
 香花毒草 共回答了21个问题
香花毒草 共回答了21个问题 |采纳率85.7%Y最活泼的非金属元素是氟(F) 原子序数是9 X是5号元素是硼(委实说这个不常考)2B+NaOH=2Na3BO3+H21年前查看全部
- 如何根据元素周期表判断外层轨道排布式?比如说20号元素是钙,位于第4周期IIA族,如何不用完全写出其轨道排布式即可知道它
如何根据元素周期表判断外层轨道排布式?比如说20号元素是钙,位于第4周期IIA族,如何不用完全写出其轨道排布式即可知道它的最外层的轨道排布式为4S^2?
 春光045511年前1
春光045511年前1 -
 liyuhcd 共回答了16个问题
liyuhcd 共回答了16个问题 |采纳率87.5%知道最外层电子数,知道该层几个能级,注意一下半充满就能写了.1年前查看全部
- 前20号元素,单质硬度最大,溶沸点最高,形成的化合物种类最多的元素是
 许朋飞1年前1
许朋飞1年前1 -
 ghost13 共回答了19个问题
ghost13 共回答了19个问题 |采纳率89.5%碳,元素符号C,元子量12.011,第五号元素,其单体金刚石硬度最大,溶沸点最高,形成的化合物种类最多,地球上所有有机物都是碳的化合物.1年前查看全部
- 元素周期表推断X、Y、Z三种元素位于周期表前20号元素之中.已知:①XY2加水生成Y2Z2和化合物D;②X的氧化物加水也
元素周期表推断
X、Y、Z三种元素位于周期表前20号元素之中.已知:①XY2加水生成Y2Z2和化合物D;②X的氧化物加水也生成D;③Y的氧化物有两种.
请填空:(1)Y的最高价氧化物的电子式为 ,D的电子式为 .
(2)反应①的化学方程式为 .
(3)反应②的化学方程式为 . a12345678121年前1
a12345678121年前1 -
 wangjiashy 共回答了17个问题
wangjiashy 共回答了17个问题 |采纳率88.2%X:Ca Y:C Z:H
(1)Y的最高价氧化物的电子式为 CO2 ,D的电子式为Ca(OH)2 (电子式不便写出) .
(2)反应①的化学方程式为 CaC2+2H2O==Ca(OH)2+C2H2↑ .
(3)反应②的化学方程式为 CaO+H2O=Ca(OH)21年前查看全部
- D.E.X.Y.Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体,三角锥形,
D.E.X.Y.Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体,三角锥形,正四面体,角形(V形),直线形.回答下列问题.:Y的最高价氧化物的化学式为?:上述五种元素中,能形成酸性最强的含氧酸的元素是?写出该元素的任意三种含氧酸的化学式?:D和Y形成的化合物,其分子的空间构型为?:D和X形成的化合物,其化学键类型属?其晶体类型属?
 玲架朝华1年前3
玲架朝华1年前3 -
 一遛小跑 共回答了23个问题
一遛小跑 共回答了23个问题 |采纳率91.3%D.E.X.Y.Z分别是C元素,N元素,Si元素,S元素和Cl元素.
Y的最高价氧化物的化学式为:SO3;
能形成酸性最强的含氧酸的元素是:Cl(高氯酸最强);
D和Y形成的化合物是CS2,其分子的空间构型为直线型;
D和X形成的化合物,其化学键类型属共价键,其晶体类型属原子型晶体1年前查看全部
- 1到20号元素离子电子式怎么写?
 oufangguang1年前0
oufangguang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 前20号元素的简单离子分别是什么?
 文豪_gg1年前4
文豪_gg1年前4 -
 nb1972 共回答了18个问题
nb1972 共回答了18个问题 |采纳率72.2%H+、Li+、N3-、O2-、F-、Na+、Mg2+、Al3+、S2-、Cl-、K+、Ca2+1年前查看全部
- (化学--选修物质结构与性质)A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素.A原子
(化学--选修物质结构与性质)
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素.A原子基态时p能级原子轨道上电子数等于次外层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D有相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ•mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子.G元素的离子形成的硫酸盐结晶水合物呈蓝色.
(1)B形成的单质中有______个Π键,上述元素形成的化合物中和B的单质是等电子体的是______(填化学式)
(2)G元素的基态原子的价层电子排布式为______.
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是______.
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图
①图I所示的FD2晶体中与F离子最近且等距离的F离子数为______,图III中未标号的G原子形成晶体后周围最紧邻的G原子数为______;
②晶体FD2和H3BO3(硼酸)晶体之间的熔点由高到低的排列顺序为______
(填空化学式),H3BO3晶体中存在的作用力除共价键以外还有______. GoodByeMyLover1年前1
GoodByeMyLover1年前1 -
 dhplan 共回答了15个问题
dhplan 共回答了15个问题 |采纳率80%解题思路:除G外均为前20号元素,由
A原子基态时p能级原子轨道上电子数等于次外层电子数,则A的电子排布为1s22s22p2,即A为碳元素;
C元素的原子基态时s能级与p能级上的电子数相等,则C的电子排布为1s22s22p4,则C为氧元素;
A、B、C原子序数依次增大,则B为氮元素;
C、D有相同的能级,且D是同期中电负性最大的元素,则D为氟元素;
E原子的第一至第四电离能(kJ•mol-1)分别为:578、1817、2745、11575,即容易失去3个电子,则E为铝元素;
F元素原子中4s能级有2个电子,F的电子排布为1s22s22p63s22p64s2,则F为钙元素;
G元素的离子形成的硫酸盐结晶水合物呈蓝色,则G为铜元素;
然后依次解答各小问.由除G外均为前20号元素A原子基态时p能级原子轨道上电子数等于次外层电子数,则A的电子排布为1s22s22p2,即A为碳元素;C元素的原子基态时s能级与p能级上的电子数相等,则C的电子排布为1s22s22p4,则C为氧元素;
A、B、C原子序数依次增大,则B为氮元素;C、D有相同的能级,且D是同期中电负性最大的元素,则D为氟元素;
E原子的第一至第四电离能(kJ•mol-1)分别为:578、1817、2745、11575,即容易失去3个电子,则E为铝元素;
F元素原子中4s能级有2个电子,F的电子排布为1s22s22p63s22p64s2,则F为钙元素;G元素的离子形成的硫酸盐结晶水合物呈蓝色,则G为铜元素;
(1)B形成的单质为N2,N≡N中有2个Π键,其原子数为2,价电子数为10,而CO中的原子数为2,价电子数为4+6=10,
则二者互为等电子体,故答案为:2;CO;
(2)G为铜元素,其基态电子排布为1s22s22p63s22p63d104s1,价电子排布为3d104s1,故答案为:3d104s1;
(3)因E为铝,B为氮元素,则常温下铝遇浓硝酸发生钝化,无明显现象,故答案为:无明显现象;
(4)①由图I可以看出晶体中与F离子最近且等距离的F离子数为[3×8/2]=12,由图III中未标号的G原子形成晶体后周围最紧邻的G原子数为3+6+3=12,故答案为:12;12;
②CaF2为离子晶体,H3BO3为分子晶体,离子晶体的熔点高,即熔点由高到低的排列顺序为CaF2>H3BO3,H3BO3晶体中存在的作用力除共价键以外,分子和分子之间存在分子间作用力,有因氧的电负性大,分子之间存在氢键,故答案为:CaF2>H3BO3;分子间作用力、氢键.点评:
本题考点: 原子结构与元素周期律的关系;原子核外电子排布;“等电子原理”的应用;晶体的类型与物质熔点、硬度、导电性等的关系;晶胞的计算.
考点点评: 本题较难,考查物质结构和性质,学生根据信息推断出元素是解答的前提,本题中的(4)是学生解答的难点.1年前查看全部
- 考试化学题,急!A.B.D.E是前20号元素,原子序数依次增大,EA2与水反应产生可燃性有机物气体和白色浆状物,向该浆状
考试化学题,急!
A.B.D.E是前20号元素,原子序数依次增大,EA2与水反应产生可燃性有机物气体和白色浆状物,向该浆状物通AB2气体,可获得另一白色不容物,B.D同主族,D的阴离子与E的阳离子有相同核外电子排布 回答 (1)写出A与B的元素符号 (2) 已知AD2与AB2结构相似写出AD2结构式 (3)D单质放入浓HNO3中加热,生成红棕色气体和强酸,写出该反应式
 滨儿1年前1
滨儿1年前1 -
 ychwjw 共回答了28个问题
ychwjw 共回答了28个问题 |采纳率96.4%1. A:C; B: O; D: S; E: Ca
2. S=C=S
3. S (s)+ 6HNO3 = H2SO4 + 6NO2 (g) + 2H2O (l)1年前查看全部
- A,B,C,D,E都是元素周期表中前20号元素,原子序数依次增大,B,C,D同周期,A,D同主族,E与其他元素
A,B,C,D,E都是元素周期表中前20号元素,原子序数依次增大,B,C,D同周期,A,D同主族,E与其他元素
既不在同周期也不在同主族,BCD的最高价氧化物的水化物两两混合均能发生反应.
(1)A和D的氢化物中,稳定性较弱的是———(选填A或D);A和B的离子中,半径较小的是——(添离子符号) (2)元素C在元素周期表中的位置是——
(3)E元素的名称是—— ss普及工作者011年前3
ss普及工作者011年前3 -
 吹dd不dd 共回答了19个问题
吹dd不dd 共回答了19个问题 |采纳率100%因为A和B、C、D不同周期,而A、D同主族,E又与其他元素既不在同周期也不在同主族,且根据第一问,A有氢化物,则E只能是19或20号元素
BCD的最高价氧化物的水化物两两混合均能发生反应,则必有一个为Al,另外两个分别为非金属和一二主族的金属,根据BCD原子序数依次增大,则C为铝Al,B为碱金属钠Na(因为氢氧化镁为固体,不能跟氢氧化铝反应),D可能为P、S、Cl(D没要求定).因为19号元素是钾K,与B的Na同主族,则E只能是钙Ca
1)D Na+
2)第三周期III A族
3)钙1年前查看全部
- A,B,C,D,E都是元素周期表中前20号元素,原子序数依次增大,
A,B,C,D,E都是元素周期表中前20号元素,原子序数依次增大,
B,C,D,同周期,A,D同主族,E与其他元素不同周期也不同主族,
B,C,D的最高价氧化物的水化物两两混合能发生反应
D的原子半径是周期原子中最小的
(1)A和D的氢化物中,稳定性较弱的是---(选A或D)
A和D的离子中,半径大小是---->----(填离子符号)
(2)元素C在原素周期表中的位置是-----
(3)E元素的名称是----
(4)写出B.C.D.的最高价氧化物的水化物两两间反应的离子方程式
-----------------------,----------------------,D的原子半径是周期原子中最小的 江邊夜影1年前2
江邊夜影1年前2 -
 嘴要干净 共回答了15个问题
嘴要干净 共回答了15个问题 |采纳率93.3%A:F,B:Na,C:Al,D:Cl,E:Ca
(1)D
(2)第三周期IIIA族
(3)钙
(4)OH- +H+=H2O
OH- +Al(OH)3==AlO2- +H2O
3H++Al(OH)3==Al3+ +3H2O1年前查看全部
- 记住标题号,1、 20号元素的名称和符号 2、 金属活动顺行的元素名称和符号 3、 其他三种常见元素的名称和符号 4、
记住标题号,
1、 20号元素的名称和符号
2、 金属活动顺行的元素名称和符号
3、 其他三种常见元素的名称和符号
4、 化学变化的基本特征
5、 物理变化和化学变化的本质区别
6、 物理性质和化学性质的本质区别
7、 常见物理性质包括哪些?
8、 检验纸燃烧后有水、二氧化碳生成的方法
10、探究吸入和呼出气体成分不同的实验步骤
11、证明吸入空气比呼出气体中氧气含量高的实验现象
12、证明吸入空气比呼出气体中二氧化碳含量低的实验现象
13、区别空气和二氧化碳的方法
14、密度大的颗粒状固体取用方法
15、粉末状固体的取用方法
16、倾倒液体的注意事项
17、滴加液体的注意事项
18、用量筒量取液体的读数方法
19、酒精灯使用的注意事项
20、液体加热的注意事项
21、固体加热的注意事项
22、连接仪器的注意事项
23、检查气密性的方法 我爱小豆丁1年前1
我爱小豆丁1年前1 -
 深蓝季风 共回答了23个问题
深蓝季风 共回答了23个问题 |采纳率82.6%1 H氢 He氦 Li锂 Be铍 B硼 C碳 N氮 O氧 F氟 Ne氖 Na钠 Mg镁 Al铝 Si硅 P磷 S硫 Cl氯 Ar氩 K钾 Ca钙
2 钾钙钠镁铝 锌铁锡铅氢 铜汞银铂金
3 锂
4 1、新物质(生成物)的生成,以及量的变化
2、反应物的减少,即量的变化
3、符合质量守恒定律
4、能量守恒定律
5、 能量的释放或者吸收,笼统的来说就是能量的变化
5 化学变化有新物质产生 物理变化没有
6 物理性质是那些不需要通过化学方法就能获得的性质,如颜色、状态、气味、熔沸点、密度、硬度、挥发性等;
化学性质是指物质在发生化学变化时表现出来的性质,如木材燃烧是化学变化,而只有发生这个化学变化,才能知道木材具有可燃性,因此可燃性属于化学性质
7 物质的有些性质如:颜色、气味、味道,是否易升华、挥发等
8 验证水的方法:用一个干燥的烧杯放在点燃纸的上方,发现上面有水珠出现,证明产物之一水
验证二氧化碳的方法:同样也是一个烧杯 不过内壁必须残留上澄清的石灰水,纸燃烧生成的二氧化碳使澄清的石灰水变浑浊,证明二氧化碳的生成.
将两次实验也可放在一起进行.
10 准备工作:收集呼出气体与空气各两瓶
判断二氧化碳含量不同:分别取一瓶呼出气体与空气,向其中各加入少量澄清石灰水,发现呼出气体中的石灰水与空气中的相比明显变浑浊.证明呼出气体中二氧化碳含量增加.
根据:澄清石灰水遇二氧化碳变浑浊
判断氧气含量不同:分别再取一瓶呼出气体与空气,分别向其中插入燃着的木条,发现木条在呼出气体中很快熄灭,而在空气中燃烧时间明显变长.证明呼出气体中氧气含量变少.
根据:木条燃烧需要氧气作为助燃物
判断水含量不同:取一片玻璃,在空气中挥动,无明显变化.再向表面呼气,发现出现一层无色液滴.证明呼出气体中水含量增加
根据:水蒸气遇冷液化成小液滴
11 取俩个相同的集气瓶
一个载空气
一个载呼出气体
用两根等粗等长的木条点燃,分别置于俩个集气瓶中,看燃烧时间,燃烧后木棒长短
在空气燃烧时间长,木条剩余短
证明氧气含量多些
12 用导管将两种气体分别通入澄清的石灰水中,出现沉淀,过滤,晾干,称重
呼出气的沉淀更重些,证明里面CO2更多
13 燃着的木条.
遇到空气继续燃烧,
氧气燃烧变剧烈
二氧化碳直接熄灭.
14 取用块状固体药品一般用(镊子)
15 取用粉末状的固体药品一般用(药匙)
16 瓶口紧密接触,下瓶倾斜与地面呈45度左右.试剂瓶的标签与手掌向贴
17. 用滴管转移液体 转移少量液体或逐滴滴加液体时 注意滴管不可伸进容器中 当然更不可碰到容器口 壁 里面液体 不可滴加过快 以免溅出 滴加后 要放回原瓶 或洗净
18 首先把量筒放在水平桌面上,视线与量筒内凹液面最低处保持水平,
若仰视读数,则读数偏小;若俯视读数,则读数偏大.
19 这个题书里有的 没注意看书吧
1、酒精灯的灯芯要平整.
2、添加酒精时,不超过酒精灯容积的2/3;酒精不少于l/4.
3、绝对禁止向燃着的酒精灯里添加酒精,以免失火.
4、绝对禁止用酒精灯引燃另一只酒精灯.
5、用完酒精灯,必须用灯帽盖灭,不可用嘴去吹.
6、不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,应立即用湿布扑盖
20 1、加热前要擦干试管外壁,防止水滴流下炸裂试管
2、加热时用酒精灯外焰,均匀预热,防止炸裂
3、加热时不要使试管底部与灯芯接触,防止炸裂
4、加热后试管不能马上放在桌上,防止烫坏桌面
5、液体体积不要超过试管容积的三分之一
6、试管口应向上倾斜于桌面约成45度,试管口不要朝向自己或别人
21 给试管里的固体药品加热时,往往有水汽产生(反应过程中生成的水或药品中的湿存水),因此试管口必须微向下倾斜. 加热前需先将试管外壁擦干,以防止加热时试管炸裂.加热时应先使试管均匀受热,使试管在酒精灯上移动. 如果试管已固定在铁架台上,则可用手持酒精灯在试管下移动,以保证试管受热均匀.待试管均匀受热后,将酒精灯火焰固定在试管中放有固体药品的部位,使固体药品充分受热,以利于反应的顺利进行.在整个加热过程中,不要使试管跟灯芯接触,以免试管炸裂.
22 检查气密性的方法是:把反应装置中的导管一端浸入水里,用手掌贴反应器的外壁(或用酒精灯微热),如果装置不漏气,容器里的空气受热膨胀,导管口就有气泡逸出;容器冷却后,又会有水升到导管内形成一段水柱;若装置漏气,则不会有气泡冒出. 当然如果你往后学 还会学到注水法 改变液面法 变色发(利用一氧化氮遇氧气产二氧化氮变红棕)等等 不过初中暂时涉及不到 就不详加介绍啦
加油 初中这知识 还真没想象中那么简单了 O(∩_∩)O哈哈~1年前查看全部
- 化学前20号元素分别是
 yaoaiwei1年前1
yaoaiwei1年前1 -
 丑人儿也要活 共回答了13个问题
丑人儿也要活 共回答了13个问题 |采纳率84.6%H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca1年前查看全部
- 1到20号元素的质子数中子数质子数是多少,中子数是多少。
 oo的蜗牛_791年前3
oo的蜗牛_791年前3 -
 buttygu 共回答了16个问题
buttygu 共回答了16个问题 |采纳率87.5%22每种元素都可以有中子数不同的同位素isotopes
如,中子数分别为1,2,3的氢的同位素氕氘氚.
假定你问的是元素最常见(丰度最高的稳定同位素)的中子数,那么
氢:0 (>99.9%)
氦:2 (>99.9%)
锂:4 (92.5%)
铍:5 100%)
硼:6 (80.1%),5 (19.9%)
碳:6 (99%)
氮:7 (99.6%)
氧:8 (99.8%)
氟:10 100%)
氖:10 (90.5%),12(9.3%)
钠:12 100%)
镁:12 (79%),13(10%),14(11%)
铝:14 100%)
硅:14 (92.2%),15(4.7%),16(3.1%)
磷:16 (100%)
硫:16 (95%),18 (4.2%)
氯:18(75.8%),20(24.2%)
氩:20 (99.6%)
钾:20 (93.3),22(6.7%)
钙:20 (96.9%),24 (2.1%)1年前查看全部
- 关于20号元素的原子结构示意图电子分布为什么是2882而不是2891?
 之栩1年前2
之栩1年前2 -
 zz交通事故网 共回答了19个问题
zz交通事故网 共回答了19个问题 |采纳率89.5%这是根据sp轨道理论来判断的
第3层只有在8电子才能达到稳定结构
9个电子就不稳定了
而且Ca是第二主族
最外层有2个电子
希望帮到你o(∩_∩)o
有问题追问哦1年前查看全部
- 前20号元素的原子最外层电子数等于族序数吗?
 我笑苍生1年前2
我笑苍生1年前2 -
 窗帘上的红花 共回答了12个问题
窗帘上的红花 共回答了12个问题 |采纳率83.3%不等于,稀有气体元素最外层电子数分别是2、8、8,而它们的族序数是0,除了它们外,是的,都是等于主族序数.1年前查看全部
- 一种熔雪剂,主要成分XY2,x,y分别为前20号元素,其阴阳离子电子层结构相同,且1molxy2含有54mol电子.
一种熔雪剂,主要成分XY2,x,y分别为前20号元素,其阴阳离子电子层结构相同,且1molxy2含有54mol电子.
求:1.该熔雪剂的化学式
2.x与氢元素形成化合物的电子式
3.元素d,e原子的最外层电子数是其电子层数的2倍,d与y相邻,d与e能形成一种非急性分子,求d,e,y分别是什么! hh_wxb1年前1
hh_wxb1年前1 -
 iQue 共回答了13个问题
iQue 共回答了13个问题 |采纳率92.3%1.CaCl2
2.H:Ca:H
3.d:c e:s y:Cl1年前查看全部
- 1到20号元素,气态氢化物最稳定的是?形成物质种类最多的元素是?
 kuaileouyang1年前1
kuaileouyang1年前1 -
 浒关 共回答了16个问题
浒关 共回答了16个问题 |采纳率93.8%HF,气态氢化物都是非金属氢化物,非金属氢化物的稳定性与非金属的非金属性有关,非金属性越强,所形成的气态氢化物越稳定.F是非金属性最强的元素,因此HF这个气态氢化物最稳定.
形成物质种类最多的元素是C,有机物中都含有碳元素,而有机物比无机物要多出很多很多.因此形成物质种类最多的元素是C.1年前查看全部
- 20号元素的最高价化合物的水化物哪个酸性最强?
 weng37761年前1
weng37761年前1 -
 谭小小鱼 共回答了20个问题
谭小小鱼 共回答了20个问题 |采纳率70%HClO4 记得是这个1年前查看全部
- 原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数是电子层数的3倍。E和其他元素既不在同周期也不再同主族,D的最高价氧化物对应的水化物为强酸,且BCD的最高价氧化物对应的水化合物两两混合均能发生反应生成盐和水。则ABCDE分别为哪几种元素_________. 脏ル1年前2
脏ル1年前2 -
 cafe5420 共回答了24个问题
cafe5420 共回答了24个问题 |采纳率87.5%首先,你要把原题写清楚吧 这才能解题
等你1年前查看全部
- (2009•南昌二模)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和
(2009•南昌二模)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和相等;A是形成化合物种类最多的元素;C、D、E同周期,它们最高价氧化物对应水化物两两混合均能反应生成盐和水;E的正负化合价代数和为最大.
(1)B原子结构示意图:______;E离子的电子式______;
(2)B与E的离子半径:rB______rE(填“>”,“<”,“=”);
(3)写出D单质与C的最高价氧化物对应水化物溶液反应的离子方程式:______
(4)C与D最高价氧化物的熔沸点______高于______(填“C”或“D”)
(5)B能与A形成B2A3离子化合物,它遇水能发生强烈反应,写出B2A3与水反应的化学方程式:______. dear_baoba1年前0
dear_baoba1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1What about copying them down?____ ____ copying them down?改为同
- 2(2006•济南)下列事例中,能表明分子在不停地做无规则运动的是( )
- 3地下室是属于地基基础部分?还是属于主体结构部分?
- 4某夏令营共8名营员,其中3人来自甲校,3人来自乙校,2人来自丙校.在一项游乐活动中,他们分乘4辆2座位的游乐车.为加强校
- 5Many people enjoy()other people () games.
- 6河北教育出版社一年级上册数学55页的题目只移动一根小棒使下面的式子成立这咋做急求
- 7读等高线图,回答问题.(1)A点的海拔高度是______米;B点与A点的相对高度是______米;山顶D的高度在____
- 8德力西倒顺开关怎么连接电容那头给出四根线,用的是220的两相电,分别是上面:L1 L2 L3 下面是:T1
- 9一空瓶的质量为0.2kg,装满水后总质量是0.6kg.求:
- 10变形虫的外形随着伪足的伸缩而变化,这种现象说明细胞膜具有( )
- 11高速公路上超声波测速仪一般都是怎么算 …1 车速 距离
- 12读《埋在雪下的小屋》有感 作文
- 13ax^3=bx^3=cx^3,且1/x+1/y+1/z=1,那么代数式3^√ax^2+bx^2+cz^2与3^√a+3^
- 14阅读下面的材料,根据要求写一篇不少于800字的文章。(60分)一位棋道高手培训年轻选手的方式十分特别,
- 15She has many good books.改为一般疑问句并做肯定和否定回答.




