0.1mol/L的NH4HSO4溶液与0.1mol/L的NaOH溶液等体积混合,混合后溶液中浓度关系表示正确的是
 月夜路灯2022-10-04 11:39:542条回答
月夜路灯2022-10-04 11:39:542条回答A.c(Na+)=c(SO4 2-)=c(H+)>c(NH4+)
B.c(Na+)>c(NH4+)>c(H+)>c(OH-)
C.c(Na+)+c(H+)+c(NH4+)=c(SO4 2-)+c(OH-)
D.c(H+)=c(OH-)+c(NH3.H2O)
答案是BD为什么啊,如果用到物料守恒或者质子守恒帮忙把守恒式写下吧,

已提交,审核后显示!提交回复
共2条回复
 sophy3456 共回答了17个问题
sophy3456 共回答了17个问题 |采纳率94.1%- 由题意可知发生的化学反应是 2 NH4HSO4+2 NaOH=Na2SO4+(NH4)2SO4 ( 因为HSO4-在水中是完全电离的,见NaHSO4).又NH4-在水中会有~少量~的水解,即NH4-+H2O=NH3.H2O + H+,所以有C(Na+)=C(SO42-)>C(NH4+)>C(H+)>C(OH-)...水中的H+由水电离的部分和NH4+水解产生的那部分组成,由第二个式子可知铵根水解产生的C1(H+)=C(NH3.H2O),水电离产生的C2(H+)=C(OH-),所以C(H+)=C1(H+)+C2(H+)=C(NH3.H2O)+C(OH-)...水中阴阳离子代数和为零,有n(Na+)+n(NH4+)+n(H+)=2 n(SO4 2-)+n(OH) ,体积相同,这个式子左右都削去体积得到C(Na+)+C(NH4+)+C(H+)=2 C(SO4 2-)+C(OH-)
- 1年前
 garyliao2002 共回答了5个问题
garyliao2002 共回答了5个问题 |采纳率- c(Na+)[未损失]>c(NH4+)[部分与水中的0H-结合为NH3.H2O]>c(H+)[溶液呈酸性]>c(OH-)
D.c(H+)=c(OH-)+c(NH3.H2O)
水中c(H+)=c(OH-),因为NH4+与水中的0H-结合为NH3.H2O,NH3.H2O的物质的量=损失的OH-的物质的量
希望我说的对你有帮助,不行咱再交流 - 1年前
相关推荐
- NH4HSO4+NaOH→NH3↑+NaHSO4+H2O
 lb26261年前2
lb26261年前2 -
 wusu089 共回答了19个问题
wusu089 共回答了19个问题 |采纳率89.5%是配平吧
你这样写是不对的
正确的是
NH4HSO4+2NaOH=Na2SO4+NH3+H2O1年前查看全部
- NH4HSO4和NaOH混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是!
 longnet1年前1
longnet1年前1 -
 从来一个人 共回答了19个问题
从来一个人 共回答了19个问题 |采纳率94.7%溶液中的离子有:NH4+,Na+,H+,SO4^2-,OH-
因为溶液显中性,所以c(H+) = c(OH-)
NH4HSO4电离生成NH4+和H+,其中NH4+水解还会生成H+.要使得反应后溶液中性,则NaOH的量要大于NH4HO4的量.
所以c(Na+) > c(SO4^2-)
NH4+部分水解,所以c(Na+) > c(SO4^2-) > c(NH4+)
而溶液中的H+和OH-都是少量的
所以c(Na+) > c(SO4^2-) > c(NH4+) > c(H+) = c(OH-)1年前查看全部
- 离子方程式:NH4HSO4+NaOH→NH3↑+NaHSO4+H2O
离子方程式:NH4HSO4+NaOH→NH3↑+NaHSO4+H2O
怎么写啊?生成NH3要写加热条件吗?
没错呀,这是1:1反应(条件)的式子. huyvgkt1年前1
huyvgkt1年前1 -
 lyy5776 共回答了17个问题
lyy5776 共回答了17个问题 |采纳率82.4%(1)少量氢氧化钠!
H+ + OH- == H2O
(2)过量氢氧化钠! 加热!
NH4+ + H+ + 2OH- == NH3(g) + 2H2O1年前查看全部
- NH4Cl,NH4SO4,NH4HSO4,(NH4)2CO3,NH4+浓度比较
NH4Cl,NH4SO4,NH4HSO4,(NH4)2CO3,NH4+浓度比较
在相同浓度下,以上几种溶液铵根离子浓度比较. 色彩构成1年前3
色彩构成1年前3 -
 秦朝10 共回答了23个问题
秦朝10 共回答了23个问题 |采纳率95.7%(NH4)2CO3<NH4Cl<NH4HSO4<(NH4)2SO4
浓度相同即物质的量相同,(NH4)2SO4一定比NH4Cl大,
HSO4- == H+ + SO42-,NH4+ + OH- ==NH3·H2O,抑制NH4+水解
所以NH4Cl<NH4HSO4,水解毕竟是少量的,所以NH4HSO4<(NH4)2SO4
CO32- + H2O=HCO3- + OH-,NH4+ + OH- ==NH3·H2O,
双水解,互相促进,所以(NH4)2CO3中NH4+最少,
综上:(NH4)2CO3<NH4Cl<NH4HSO4<(NH4)2SO41年前查看全部
- 向Ba(OH)2溶液中加入过量NH4HSO4的溶液的离子方程式
 奇遇奇雨1年前1
奇遇奇雨1年前1 -
 映月荷 共回答了24个问题
映月荷 共回答了24个问题 |采纳率87.5%1.少量NH4HSO4的反应:
Ba2+ + 2OH- + NH4+ + H+ + SO42- = NH3•H2O + H2O + BaSO4↓
2.过量 NH4HSO4的反应:
Ba2+ + 2OH- + 2H+ + SO42- = 2H2O + BaSO4↓
过量的硫酸氢铵电离出的氢离子,把反应1生成的NH3•H2O又中和了.1年前查看全部
- 把下列盐连线归类正盐 NaCl 钠盐酸式盐 NH4Cl 铵盐无氧酸盐 NaHSO4 硫酸盐含氧酸盐 NH4HSO4 盐酸
把下列盐连线归类
正盐 NaCl 钠盐
酸式盐 NH4Cl 铵盐
无氧酸盐 NaHSO4 硫酸盐
含氧酸盐 NH4HSO4 盐酸盐 wrs021年前2
wrs021年前2 -
 zqs200302 共回答了15个问题
zqs200302 共回答了15个问题 |采纳率86.7%正盐 NaCl NH4Cl
酸式盐 NaHSO4 NH4HSO4
无氧酸盐 NaCl NH4Cl
含氧酸盐 NaHSO4 NH4HSO4
钠盐 NaCl NaHSO4
铵盐 NH4Cl NH4HSO4
硫酸盐 NaHSO4 NH4HSO4
盐酸盐 NaCl NH4Cl
.1年前查看全部
- c(NH4+)相同的下列溶液 ①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3
c(NH4+)相同的下列溶液 ①NH4Cl ②(NH4)2SO4 ③NH4HSO4 ④NH4HCO3,其物质的量浓度由大到小的顺序是( )
A. ②③①④
B. ④①③②
C. ①④③②
D. ②④①③ Jinnieez1年前2
Jinnieez1年前2 -
 jhl8200 共回答了20个问题
jhl8200 共回答了20个问题 |采纳率95%解题思路:①铵根离子水解,②铵根离子水解,③电离出氢离子抑制铵根离子水解,④相互促进水解,则相同浓度时c(NH4+)大小顺序为②>③>①>④,而c(NH4+)相同,与之相反,以此来解答.①铵根离子水解,②铵根离子水解,③电离出氢离子抑制铵根离子水解,④相互促进水解,则相同浓度时c(NH4+)大小顺序为②>③>①>④,
则c(NH4+)相同,电离出铵根离子浓度越多的其物质的量浓度越小,
则物质的量浓度由大到小的顺序为④①③②,
故选:B.点评:
本题考点: 离子浓度大小的比较;盐类水解的应用.
考点点评: 本题考查离子浓度大小的比较,侧重盐类水解规律的应用,注意②中等浓度时电离铵根离子浓度最大,明确水解的抑制、水解的相互促进即可解答,题目难度中等.1年前查看全部
- 温度相同,浓度均为0.2mol•L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3C
温度相同,浓度均为0.2mol•L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③ dfxx1年前1
dfxx1年前1 -
 燕子的燕 共回答了17个问题
燕子的燕 共回答了17个问题 |采纳率94.1%解题思路:根据盐类水解的酸碱性和水解程度比较.①(NH4)2SO4、④NH4NO3水解呈酸性,pH<7;③NH4HSO4电离出H+呈酸性,pH<7;②NaNO3不水解,pH=7;⑤CH3COONa水解呈碱性,pH>7,①、④比较,前者c(NH4+)大,水解生成c(H+)大,pH小,①③比较,后者电离出c(H+)比前者水解出c(H+)大,pH小,所以③①④②⑤,故选A.
点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查溶液PH的大小比较,题目难度不大,要考虑盐类的水解程度大小,注意硫酸氢铵中硫酸氢根离子电离出氢离子.1年前查看全部
- A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:①B、
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是______,E是______;
(2)用水稀释0.1mol?L-1B时,溶液中随着水量的增加而减小的是______ (填写序号)
a.
b.c(B) c(OH?)
c.c(H+)?c(OH-)d.n(OH-)c(H+) c(OH?)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中______曲线(填写序号).
(5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为______.
 天使也一样021年前1
天使也一样021年前1 -
 lwxqd 共回答了21个问题
lwxqd 共回答了21个问题 |采纳率100%(1)五种物质中NaOH、NH3?H2O显碱性,CH3COOH、HCl、NH4HSO4均显酸性,前两种五种与后三种物质等物质的量反应,但生成物一种酸性,一种中性的,只有与HCl反应,NaCl溶液显中性,NH4Cl显酸性,则A为HCl、B为NH 3?H2O、D为NaOH;浓度均为0.1mol?L-1C与D溶液等体积混合,溶液呈酸性,所以C为NH4HSO4,则E为CH3COOH.
故答案为:NaOH;CH3COOH;
(2)用水稀释氨水,电离平衡向电离方向移动,n(NH3?H2O)减小,n(OH-)增大,溶液体积不变,浓度之比等于物质的量之比,
c(NH 3?H2O)
c(OH?)减小,a正确、d错误;温度不变,水的离子积常数不变,由kw=c(H+)?c(OH-)知 c(H+)?c(OH-)不变,b错误;稀释时c(OH-)减小,由kw=c(H+)?c(OH-)不变知c(H+)增大.故答案为:a
(3)pH相同的等体积的两份溶液HCl和CH3COOH,开始时c(H+)相同,反应速率相同,B错误;反应开始后,醋酸继续电离,c(H+)增大,反应速率大,反应生成等量氢气时所用时间少,A错误;PH相同等体积则CH3COOH的浓度大,物质的量多,完全反应消耗的锌粉多,所用醋酸中不可能剩余锌粉,d错误;生成等量的氢气,根据方程式知消耗的锌粉相同,c正确;故答案为:c
(4)等体积、等物质的量浓度B和C混合后得到(NH4)2SO4溶液,NH4+水解溶液显酸性,PH<7,①②错误;加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,故答案为:④
(5)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,再滴加少许NaOH呈中性,故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)1年前查看全部
- pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=
pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序①=
pH相等的NH4Cl ,(NH4)2SO4, NH4HSO4三种溶液中铵根离子浓度大小关系 有这样的回答: 三个溶液都是酸性的,阴离子都不会水解,如果只考虑NH4+水解导致溶液的PH降低,效果都是一样的,所以NH4+的数量也应该相等,而NH4HSO4会电离出H+导致溶液酸性增强,所以同PH下,不用那么多的NH4+水解了,所以NH4HSO4中的NH4+最少,NH4Cl ,(NH4)2SO4相等.所以三种溶液中铵根离子浓度大小关系是:NH4Cl =(NH4)2SO4 >NH4HSO4 但是NH4Cl不是会水解,生成NH4OH,会挥发吗?这样的话,溶液中OH-离子就较多啊,显碱性;至于(NH4)2SO4,它不是中性吗?怎么说三种溶液都是酸性? wdtzyz1年前1
wdtzyz1年前1 -
 青青秀秀 共回答了15个问题
青青秀秀 共回答了15个问题 |采纳率73.3%应该是硫酸氢氨最小,氯化氨最大.nh4++h2o=nh3~h2o+h+,就是氨根离子的水解方程式1年前查看全部
- 铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和
铵盐是一类重要的化合物,应用广泛,如NH4Al(SO4)2可用作净水剂、食品添加剂等;NH4HSO4用于定量分析、医药和电子工业中.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是______(用必要的化学用语和相关文字说明).
(2)如图1是0.1mol•L-1的几种电解质溶液的pH随温度变化的曲线.
①其中符合NH4Al(SO4)2的曲线是______(填写序号),导致pH随温度变化的原因是______;
②25℃时,0.1mol•L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(近似值).
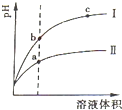
(3)室温时,向100mL0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示: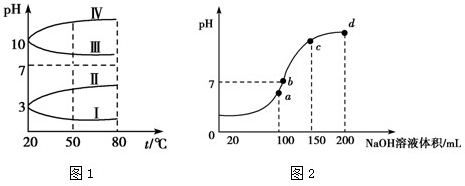
试分析图中a、b、c、d四个点,水的电离程度最大的是______点;在b点,溶液中各离子浓度由大到小的排列顺序是______. jingyuran1年前1
jingyuran1年前1 -
 世界第三包 共回答了23个问题
世界第三包 共回答了23个问题 |采纳率91.3%解题思路:(1)Al3+水解生成的Al(OH)3具有吸附性;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.(1)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O═Al(OH)3+3H+,Al(OH)3,
故答案为:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:1;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②25℃时,0.1mol•L-1 NH4Al(SO4)2中PH=3,根据电荷守恒,阳离子所带的正电荷总数等于阴离子所带的负电荷总数,c(H+)+c(NH4+)+3c(Al3+)=c(OH-)+2c(SO42-),可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1[c(OH-)太小,可忽略],
故答案为:10-3 mol•L-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).点评:
本题考点: 铵盐.
考点点评: 本题考查盐类的水解和离子浓度大小的比较,题目难度中等,(2)②为易错点,注意根据守恒思想解题.1年前查看全部
- 常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
常温下用NaOH、氨水、CH3COOH、HCl、NH4HSO4五种溶液进行下列实验:
(1)浓度均为0.1mol/L的HCl和CH3COOH的pH:HCl______CH3COOH;(填“<”“>”或“=”)
(2)将1L pH=3的HCl溶液分别与0.001mol/L x L氨水、0.001mol/L y L NaOH充分反应至中性,x、y大小关系为:y______ x;(填“<”“>”或“=”)
(3)浓度均为0.1mol/L的 NH4HSO4与NaOH等体积混合,反应的离子方程式为______;此时溶液呈______性(填“酸性”碱性”或“中性”).
(4)用水稀释0.1mol/L 氨水时,溶液中随着水量的增加而减小的是______(填写序号).
①
②c(NH3•H2O) c(OH−)
③c(H+)和c(OH-)的乘积④OH-的物质的量c(OH−) c(H+)
(5)H+浓度相同的等体积的两份溶液HCl和CH3COOH,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______ (填写序号).
①反应所需要的时间CH3COOH>HCl②开始反应时的速率HCl>CH3COOH
③反应过程的平均速率CH3COOH>HCl ④参加反应的锌粉物质的量HCl=CH3COOH. 一心依颖1年前1
一心依颖1年前1 -
 小偷你不要来 共回答了21个问题
小偷你不要来 共回答了21个问题 |采纳率85.7%解题思路:(1)醋酸是弱电解质,部分电离,盐酸是强电解质,完全电离;
(2)氨水是弱电解质,若是氨水和氢氧化钠溶液等体积和盐酸反应,氨水反应后生成了氯化铵溶液,显示酸性,故氨水要多些,才能显中性;
(3)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,氢离子优先与氢氧根离子反应,反应后的溶质为等物质的量的(NH4)2SO4和Na2SO4,铵根离子水解,溶液呈酸性;
(4)加入水,氨水被稀释,电离程度增大,但是溶液中氢氧根浓度减小,氨水浓度减小,氢离子浓度增大;
(5)H+浓度相同,由于醋酸为弱酸、氯化氢为强电解质,说明盐酸的浓度小于CH3COOH的浓度,而体积相等,即醋酸的物质的量比盐酸的物质的量多,由与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的量相同,得到锌与盐酸反应盐酸不足,锌与醋酸反应锌不足,由此分析解题.(1)浓度均为0.1mol/L的HCl和CH3COOH溶液中,醋酸为弱电解质,溶液中只能部分电离出氢离子,而氯化氢为强电解质,溶液中完全电离,所以浓度相同时,盐酸溶液中氢离子浓度大于醋酸,则溶液的pH盐酸溶液小于醋酸,
故答案为:<;
(2)pH=3的HCl溶液,盐酸浓度为0.001mol•L-1,故1L该盐酸消耗0.001mol•L-1 NaOH溶液1L,反应后呈中性,故x=1;氨水是弱电解质,若是取1L0.001mol•L-1 的氨水与盐酸反应,生成了氯化铵,溶液显示酸性,故氨水需要多些,则y大于1L,所以x<y,
故答案为:<;
(3)NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,氢离子结合氢离子能力强于铵根离子,所以氢离子优先与氢氧根离子反应,反应的离子方程式为:H++OH-=H2O;反应后溶质为等物质的量的(NH4)2SO4和Na2SO4,由于铵根离子部分水解,所以反应后的溶液显示酸性,
故答案为:H++OH-=H2O;酸;
(4)①由于加水稀释后,氨水电离程度增大,n(NH3•H2O)减小,n(OH-)增大,故①①
c(NH3•H2O)
c(OH−) 减小,故①正确;
②氨水稀释后,溶液中c(OH-)减小,水的离子积不变,c(H+)增大,故
c(OH−)
c(H+) 减小,故②正确;
③温度不变,c(H+)和c(OH-)的乘积不变,故③错误;
④氨水的电离程度增大,溶液中n(OH-)增大,故④错误;
故答案为:①②;
(5)H+浓度相同的等体积的两份溶液,说明盐酸的浓度小于CH3COOH的浓度,而体积相等,即醋酸的物质的量比盐酸的物质的量多,由与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的量相同,得到锌与盐酸反应盐酸不足,锌与醋酸反应锌不足,
①氢离子浓度越大反应所需要的时间越短,所以CH3COOH<HCl,故①错误;
②开始反应时溶液中氢离子浓度相等,所以反应时的速率相等:HClCH3COOH,故②错误;
③氢离子的浓度越大,反应过程的平均速率越快,由于反应反应过程中醋酸会继续电离出氢离子,所以醋酸中氢离子浓度大于盐酸,则反应速率CH3COOH>HCl,故③正确;
④因生成氢气量相等,所以参加反应的锌粉物质的量:HCl=CH3COOH,故④正确;
故答案为:③④.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查酸碱混合定性判断及溶液pH的计算、弱电解质在水溶液中的电离平衡,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确弱电解质的电离平衡及其影响因素.1年前查看全部
- A,B,C,D,E五种溶液分别是NaOH溶液,NH3•H2O溶液,CH3COOH溶液,HCl溶液,NH4HSO4溶液中的
A,B,C,D,E五种溶液分别是NaOH溶液,NH3•H2O溶液,CH3COOH溶液,HCl溶液,NH4HSO4溶液中的一种,常温下进行下列实验.
①将1LpH=3的A溶液分别与0.001mol•L-1xLB溶液、0.001mol•L-1yLD溶液充分反应后溶液呈中性,x、y大小关系为:y<x;
②浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E);
③浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题
(1)D是______
(2)c(OH-)和体积均相等的两份溶液A和E,分别与锌粒反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是______
①反应所需要的时间:E>A
②开始反应时的速率:A>E
③参加反应的锌粉的物质的量:A=E
④反应过程的平均速率:E>A
⑤A溶液中有锌粉剩余
⑥E溶液中有锌粉剩余
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,得到的溶液中所有粒子的物质的量浓度由大到小的顺序为______
(4)常温下,将0.1mol•L-1的E溶液加水稀释的过程中,下列表达式的数据一定变小的是______
A.c(H+) B.
C.c(H+)•c(OH-) D.c(H+) c(E) c(OH−) c(H+)
(5)25℃时,已知某些物质的电子平衡常数如下表
则:物质的量浓度均为0.1mol.L-1的下列四种溶液:a.Na2CO3溶液,b.NaClO溶液 c.CH3COONa溶液,d.NaHCO3溶液的pH由大到小的顺序是______(用字母表示)化学式 CH3COOH H2CO3 HClO 电离平衡常数 1.8×10-5 K1=4.3×10-7
K2=5.6×10-113.0×10-8  八小戒1年前1
八小戒1年前1 -
 xudhui 共回答了21个问题
xudhui 共回答了21个问题 |采纳率100%解题思路:A溶液是酸性溶液,能和碱反应,所以B、D是NaOH和NH3•H2O,将1LpH=3的A溶液分别和相同浓度的B、D反应使溶液呈中性时,x、y大小关系为:y<x,强碱体积小于弱碱,所以D是NaOH、B是NH3•H2O;
浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,如果C是醋酸或盐酸,其混合溶液呈碱性或中性,要使混合溶液呈酸性,则C是NH4HSO4;
浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E),说明A的电离程度大于E,所以A是盐酸、E是醋酸;
(1)根据以上分析确定D;
(2)c(OH-)和体积均相等的两份溶液A和E,A的浓度小于E,反应速率与氢离子浓度成正比,反应速率越大,反应时间越短,根据转移电子守恒计算消耗锌的质量,如果金属有剩余,应该是强酸中锌有剩余;
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,混合溶液中的溶质是等物质的量浓度的硫酸钠、硫酸铵,铵根离子水解但程度较小,根据物料守恒判断;
(4)E是醋酸,加水稀释促进醋酸电离,但溶液中c(H+)、c(CH3COO-)、c(CH3COOH)都减小,但c(OH-)增大;
(5)酸的电离平衡常数越大,酸根离子水解程度越小,则相同浓度的钠盐pH越小.A溶液是酸性溶液,能和碱反应,所以B、D是NaOH和NH3•H2O,将1LpH=3的A溶液分别和相同浓度的B、D反应使溶液呈中性时,x、y大小关系为:y<x,强碱体积小于弱碱,所以D是NaOH、B是NH3•H2O;
浓度均为0.1mol•L-1C与D溶液等体积混合,溶液呈酸性,如果C是醋酸或盐酸,其混合溶液呈碱性或中性,要使混合溶液呈酸性,则C是NH4HSO4;
浓度均为0.1mol•L-1A和E溶液,pH(A)<PH(E),说明A的电离程度大于E,所以A是盐酸、E是醋酸;
(1)根据以上分析知,D是NaOH,故答案为:NaOH;
(2)A是HCl、E是醋酸,c(OH-)和体积均相等的两份溶液A和E,盐酸的浓度小于醋酸,
①反应过程中醋酸继续电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,则醋酸反应速率大于盐酸,所以反应所需要的时间:E<A,故错误;
②开始反应时两种溶液中氢离子浓度相等,所以其反应速率:A=E,故错误;
③根据转移电子相等知,生成相同量的氢气时消耗相同量的锌,所以参加反应的锌粉的物质的量:A=E,故正确;
④应过程中醋酸继续电离出氢离子,导致反应过程中醋酸中氢离子浓度大于盐酸,所以反应过程的平均速率:E>A,故正确;
⑤盐酸浓度小于醋酸,要使生成氢气的量相等,则消耗酸的量相等,则A溶液中有锌粉剩余,故正确;
⑥如果E溶液中有锌粉剩余,则两种溶液中都应该有锌剩余,与题给信息不符合,故错误;
故选③④⑤;
(3)室温下,向0.01mol•L-1的C溶液中滴加0.01mol•L-1的D溶液至中性,混合溶液中的溶质是等物质的量浓度的硫酸钠、硫酸铵,铵根离子水解但程度较小,根据物料守恒得离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+),故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)>c(H+);
(4)A.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以c(H+)减小,故A正确;
B.加水稀释促进醋酸电离,所以氢离子的物质的量增大、醋酸分子的物质的量减小,则
c(H+)
c(E)增大,故错误;
C.c(H+)•c(OH-)为离子积常数,温度不变,水的离子积常数不变,故错误;
D.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,所以
c(OH−)
c(H+)增大,故错误;
故选A;
(5)根据电离平衡常数知,酸根离子水解程度大小顺序是CO32->ClO->HCO3->CH3COO-,相同浓度的钠盐溶液,酸根离子水解程度越大,其钠盐溶液的pH越大,所以这几种溶液pH大小顺序是a>b>d>c,
故答案为:a>b>d>c.点评:
本题考点: 无机物的推断;弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算;几组未知物的检验.
考点点评: 本题以无机推断为载体考查弱电解质的电离及盐类水解,正确推断物质是解本题关键,再结合物质的性质、盐类水解特点等知识点分析解答,同时考查学生综合应用能力,注意:离子反应中反应速率与离子浓度成正比,与电解质强弱无关,水的离子积常数只与温度有关,这些都是易错点.1年前查看全部
- 向0.01mol/lNH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)>C(SO4 2-)>C(NH4+)>C(O
向0.01mol/lNH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)>C(SO4 2-)>C(NH4+)>C(OH-)=C(H+)
离子浓度怎么比出来的, 池心鱼1年前3
池心鱼1年前3 -
 Resen 共回答了13个问题
Resen 共回答了13个问题 |采纳率92.3%滴加NaOH,发生的离子反应式有两个:
1、HSO4- + OH- = SO42- + H2O
2、NH4+ + OH- ⇋ NH3.H2O
显然,如果NH4HSO4与NaOH完全反应,化学计量比是1:2,但若完全反应溶液中有较多的NH3.H2O,会显碱性,想使溶液为中性,NH4HSO4必须有剩余,那么应该剩余多少呢?若NH4HSO4与NaOH1:1反应,则主要发生反应式1,那么溶液中还有很多NH4+,溶液显示酸性(NH4+水解显酸性),所以若NH4HSO4为nmol,设与之反应的NaOH的用量xmol,则有n1年前查看全部
- 对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
A. 溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①
B. 溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①
C. 溶液的pH相同时,由水电离出的c(H+)大小顺序是③>②>①
D. 若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ highroad61年前3
highroad61年前3 -
 金色的叶子 共回答了21个问题
金色的叶子 共回答了21个问题 |采纳率90.5%解题思路:A.①铵根离子水解显酸性,②电离出氢离子抑制铵根离子水解,③完全电离,显强酸性;
B.加水促进盐的水解,水解生成的氢离子的物质的量增大;
C.酸电离的氢离子抑制水电离,铵根离子水解促进水的电离,铵根离子浓度越大,水的电离程度越大;
D.①铵根离子水解显酸性,②电离出氢离子抑制铵根离子水解,③完全电离,显强酸性;A.①铵根离子水解显酸性,②电离出氢离子抑制铵根离子水解,NH4HSO4中的氢离子完全电离③完全电离,显强酸性,则溶液的pH相同时,3种溶液物质的量浓度大小顺序是①>②>③,故A错误;
B.加水促进盐的水解,水解生成的氢离子的物质的量增大,溶液的pH相同时,将3种溶液稀释相同倍数,H2SO4溶液中氢离子的物质的量几乎不变,所以pH变化最大,故B错误;
C.酸电离的氢离子抑制水电离,铵根离子水解促进水的电离,铵根离子浓度越大,水的电离程度越大,则溶液的pH相同时,由水电离出的c(H+)大小顺序是①>②>③,故C错误;
D.①铵根离子水解显酸性,②电离出氢离子抑制铵根离子水解,③完全电离,显强酸性,所以若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③,故D正确;
故选D.点评:
本题考点: 盐类水解的原理.
考点点评: 本题考查离子浓度大小的比较、水的电离等,侧重盐类水解规律的应用,注意把握影响水的电离平衡的因素,题目难度中等.1年前查看全部
- 请教关于离子方程式的写法~!比如向NH4HSO4溶液中逐滴滴入Ba(OH)2至刚好沉淀完全,或者是刚好ph=7,或者是B
请教关于离子方程式的写法~!
比如
向NH4HSO4溶液中逐滴滴入Ba(OH)2至刚好沉淀完全,或者是刚好ph=7,或者是Ba(OH)2过量之类.这些都该怎么写呢? yubaobaoshizhe1年前1
yubaobaoshizhe1年前1 -
 郭边 共回答了16个问题
郭边 共回答了16个问题 |采纳率93.8%沉淀完全就是说SO42-和Ba2+按1:1反应:NH4HSO4+Ba(OH)2=BaSO4↓+H2O+NH3·H2O
离子方程式为:NH4+ + H+ + SO42- + Ba2+ +2OH-=BaSO4↓+H2O+NH3·H2O
刚好ph=7说明H+和OH-完全反应:2NH4HSO4+Ba(OH)2=BaSO4↓+2H2O+(NH4)2SO4
离子方程式为:2 H+ + SO42- + Ba2+ +2OH-=BaSO4↓+2H2O
如果说Ba(OH)2过量,则少量的按组成拆写:
离子方程式为:NH4+ + H+ + SO42- + Ba2+ +2OH-=BaSO4↓+H2O+NH3·H2O
如果说Ba(OH)2少量,则少量的按组成拆写:
离子方程式为:2 H+ + SO42- + Ba2+ +2OH-=BaSO4↓+2H2O1年前查看全部
- 现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验.实验过程和记录如图所示(无关物质已经略去):

请回答:
(1)A的溶液加热蒸干并灼烧最后所得固体为______(填化学式).
(2)D溶液pH______(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)______.
(3)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者______后者(填“<”、“>”或“=”)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是______. gzyyyyyy1年前1
gzyyyyyy1年前1 -
 伤心的凉白开 共回答了14个问题
伤心的凉白开 共回答了14个问题 |采纳率92.9%解题思路:由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体,Z为CO2,
(1)加热促进盐类的水解,根据盐类水解原理分析;
(2)根据盐的水解条件以及水解规律来回答;
(3)从盐类水解的影响因素以及平衡移动的角度分析;
(4)从溶液电荷守恒的角度分析.由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D为Na2CO3,气体Z为CO2,
(1)A是AlCl3,AlCl3水Al3++3H2O⇌Al(OH)3+3H+,灼烧发生2Al(OH)3
高温
.
Al2O3+3H2O;AlCl3水解产物受热分解得到的是Al2O3和HCl,最后HCl完全逸到空气中,最后所得固体为Al2O3,故答案为:Al2O3;
(2)D是Na2CO3,由于CO32-水CO32-+H2O⇌HCO3-+OH-而呈碱性,故pH>7,
故答案为:大于;CO32-+H2O⇌HCO3-+OH-;
(3)等物质的量浓度的NH4HSO4与NH4Cl溶液,NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+):前者>后者,故答案为:>;
(4)B、C的稀溶液混合后(不加热)溶液呈中性,B、C的物质的量大于1:1,小于2:1,则溶液中存在硫酸钠、硫酸铵以及氨水等溶质,混合溶液呈中性,则c(H+)=c(OH-),由电荷守恒有c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的检验及鉴别,题目难度中等,本题侧重于盐类的水解考查,学习中注意把握相关知识.1年前查看全部
- (2013•崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学
 (2013•崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013•崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
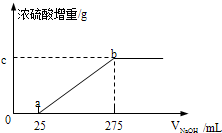
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出.(此温度下,铵盐不分解).该气体干燥后用足量的浓硫酸完全吸收.浓硫酸增重的质量与加入NaOH溶液的体积的关系如右图.分析该图象,并回答下列问题:
(1)写出ab段涉及的离子方程式:NH4++OH-
NH3↑+H2O△ .NH4++OH-.
NH3↑+H2O△ .
(2)c点对应的数值是______;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为______.
乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收.测定结果如下表:
分析该表,并回答下列问题:实验编号 Ⅰ Ⅱ Ⅲ Ⅳ 铵盐的质量(g) 9.88 19.76 29.64 49.40 浓硫酸增加的质量(g) m m 1.36 0
(3)①分析实验数据可知,实验编号为______的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体;m的值为______.
②计算样品B中氮元素的质量分数.(用小数表示,保留两位小数)
(4)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系.假设样品的质量为x(g),浓硫酸增重的质量为y(g).求:当x在不同范围时y与x的函数关系. ysy_881年前1
ysy_881年前1 -
 风吹的 共回答了17个问题
风吹的 共回答了17个问题 |采纳率100%解题思路:(1)向(NH4)2SO4、NH4HSO4的混合溶液中滴加氢氧化钠溶液,氢氧离子先和氢离子反应生成水,后和铵根离子反应生成氨气,所以图象中先没有气体生成后有气体生成,故0-a段是氢离子和氢氧根离子反应,a-b段是铵根离子和氢氧根离子反应;
(2)a-b段是铵根离子和氢氧根离子反应,根据氨气和氢氧化钠之间的关系式计算a-b段生成氨气的量;根据氢离子的量计算硫酸氢铵的量,再根据氨气、硫酸氢铵、硫酸铵之间的关系计算硫酸铵的量,从而得出A中(NH4)2SO4、NH4HSO4的物质的量之比;
(3)①II中铵盐质量是I的2倍,如果氢氧化钠过量,则II中生成的氨气量应该是I中的2倍,实际上相等,则说明II中氢氧化钠的量不足,I中氢氧化钠足量,
根据III中氨气的量计算生成氨气需要氢氧化钠的量,剩余的氢氧化钠和氢离子反应,从而计算得出硫酸氢铵的量,剩余的是硫酸铵的量,I中的硫酸铵和硫酸氢铵是III中的[1/3],根据铵根离子的量计算氨气的量;
②氮原子的质量与总质量的比即为氮元素的质量分数;
(4)分情况讨论:当n(NH4HSO4)≥n(NaOH)时没有氨气生成,当n(NaOH)≥2n(NH4HSO4)+2n((NH4)2SO4)时氨气完全析出,当介于二者之间时,生成部分氨气.(1)0-a段是氢离子和氢氧根离子反应,a-b段是铵根离子和氢氧根离子反应,所以a-b段的离子反应方程式为:NH4++OH-
△
.
NH3↑+H2O,故答案为:NH4++OH-
△
.
NH3↑+H2O;
(2)a-b段是铵根离子和氢氧根离子反应,a-b段的离子反应方程式为:NH4++OH-
△
.
NH3↑+H2O,根据离子方程式知,
m(NH3)=n(NH3)M(NH3)=n(NaOH)M(NH3)=1mol/L×(0.275-0.025)L×17g/mol=4.25g;
0-a段是氢离子和氢氧根离子反应,根据2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O知,n(NH4HSO4)=n(NaOH)
=1mol/L×0.025L=0.025mol,硫酸氢铵中n(NH4+)=n(NH4HSO4)=0.025mol
则n((NH4)2SO4)=
1mol/L×(0.275−0.025)L−0.025mol
2=0.1125mol,
所以n((NH4)2SO4):n(NH4HSO4)=0.1125mol:0.025mol=9:2,
故答案为:4.25;9:2;
(3)①II中铵盐质量是I的2倍,如果氢氧化钠过量,则II中生成的氨气量应该是I中的2倍,实际上相等,则说明II中氢氧化钠的量不足,I中氢氧化钠足量;
III中生成氨气需要n(NaOH)=n(NH3)=[1.36g/17g/mol]=0.08mol,剩余的氢氧化钠和氢离子反应,硫酸氢铵中n(H+)=n(NH4HSO4)=n(NaOH)(剩余)=1mol/L×0.2L-0.08mol=0.12mol,I中的硫酸铵和硫酸氢铵是III中的[1/3],所以I中硫酸氢铵的物质的量是0.04mol,则I中n((NH4)2SO4)=[9.88g−0.04mol×115g/mol/132g/mol]=0.04mol,
所以m(NH3)=[n(NH4HSO4)+2n((NH4)2SO4)]M(NH3)=0.12mol×17g/mol=2.04g,即m=2.04,
故答案为:Ⅰ;2.04;
②氮元素的质量分数=
[n(NH4HSO4)+2n((NH4)2SO4) ]M(N)
m(总)×100%=[0.12mol×14g/mol/9.88g×100%=17%,故答案为:17%;
(4)①当n(NH4HSO4)≥n(NaOH)=1mol/L×0.2L=0.2mol,该化合物中硫酸铵和硫酸氢铵的物质的量相等,所以x≥0.2mol×(115+132)g/mol=49.4g,y=0;
即没有氨气生成,所以当x≥49.4g,y=0;
②当n(NaOH)≥2n(NH4HSO4)+2n((NH4)2SO4)时氨气完全析出,即0.2mol=1mol/L×0.2L=n(NaOH)≥2n(NH4HSO4)+2n((NH4)2SO4),所以x≤0.05mol×(115+132)g/mol=12.35g,y=
xg
247g/mol×3×17g/mol=
51x
247g;
③当介于二者之间时,生成部分氨气,即49.40g>x>12.35g,y=3.4-
17x
247],
答:x在不同范围时y与x的函数关系为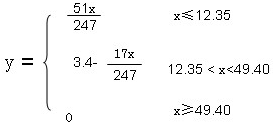 .
.点评:
本题考点: 铵盐;探究物质的组成或测量物质的含量.
考点点评: 本题考查探究物质的组成及其含量的测定,明确各段发生的反应是解本题关键,注意氢氧化钠和硫酸氢铵和硫酸铵的混合溶液反应时离子反应的先后顺序,为易错点.1年前查看全部
- 向NH4HSO4溶液中滴加NaOH溶液至中性时溶液中还有NH4+离子吗?
向NH4HSO4溶液中滴加NaOH溶液至中性时溶液中还有NH4+离子吗?
如果没有,为什么溶液中粒子的物质的量浓度关系为Na+>SO42->NH4+>OH-=H+ 风逝的落叶1年前1
风逝的落叶1年前1 -
 就想买个房 共回答了13个问题
就想买个房 共回答了13个问题 |采纳率92.3%有是肯定有的,只是这个时候,NH4+大量转化为NH3•H2O的形式存在了,但是还有有一些NH4+会溶于溶液中的1年前查看全部
- 离子水解请为以下溶液中NH4+离子浓度大小排序 NH4HSO4 NH4NO3 CH3COONH4
 Theressa1年前1
Theressa1年前1 -
 hing19 共回答了20个问题
hing19 共回答了20个问题 |采纳率90%NH4HSO4> NH4NO3 > CH3COONH4:HSO4-完全电离H+抑制NH4+的电离;NO3-对NH4+水解无影响;CH3COO-结合H+促进NH4+水解.1年前查看全部
- c(NH4+)相同的下列溶液:NH4Cl,(NH4)2SO4,NH4HSO4,NH3H2O
 lsh_82081年前1
lsh_82081年前1 -
 你写我看 共回答了18个问题
你写我看 共回答了18个问题 |采纳率100%那首先看,盐类,因为盐类是电解程度最高的NH4CL和NH4HSO4可单元酸盐,即1 MOL盐包含1 MOLNH4+离子但是NH4+离子存在水解现象(水解后为碱性),由于NH4HSO4同时还能产生H+离子抑制水解所以NH4+的电离要比NH4CL完全,产生...1年前查看全部
- 相同温度下等物质的量浓度的下列溶液中,A.NH4CL B.NH3.H2O C.NH4HSO4 D.(NH4)2SO4(1
相同温度下等物质的量浓度的下列溶液中,A.NH4CL B.NH3.H2O C.NH4HSO4 D.(NH4)2SO4(1)pH值由大到小的顺...
相同温度下等物质的量浓度的下列溶液中,A.NH4CL B.NH3.H2O C.NH4HSO4 D.(NH4)2SO4(1)pH值由大到小的顺序是(2)NH4+离子浓度有大到小的顺序是 ljhyyzj1年前3
ljhyyzj1年前3 -
 cc中的鱼 共回答了20个问题
cc中的鱼 共回答了20个问题 |采纳率90%NH3.H2O碱性,pH最大.HSO4-是强酸,pH最小;(NH4)2SO4有两个NH4+,水解的量多,pH比NH4Cl小.
(NH4)2SO4有两个NH4+,NH4+浓度最大;NH4HSO4中H+抑制NH4+水解,NH4+浓度其次.NH3.H2O部分电离,NH4+浓度最小.1年前查看全部
- 比较等浓度(NH4)2SO4、NH4Cl、NH3*H2O、(NH4HSO4中的铵根浓度大小
 cwq98001年前1
cwq98001年前1 -
 轻风绿茶 共回答了18个问题
轻风绿茶 共回答了18个问题 |采纳率94.4%楼上的错了,(NH4)2SO4>NH4HSO4>NH4Cl>NH3*H20,NH4HSO4是强酸性的,可以抑制铵离子的水解,所以铵离子浓度比氯化铵高1年前查看全部
- 问几个化学方程式:1.C与 浓HCl 2.NH4HSO4与 K2CO3 3.NH4HSO4与 KAlO2 4.(NH4)
问几个化学方程式:1.C与 浓HCl 2.NH4HSO4与 K2CO3 3.NH4HSO4与 KAlO2 4.(NH4)2SO4与 KAlO2
 垃圾的建设厂1年前1
垃圾的建设厂1年前1 -
 菠萝快过期 共回答了19个问题
菠萝快过期 共回答了19个问题 |采纳率89.5%1、不反应
2、2NH4HSO4 + 2K2CO3 = (NH4)2SO4 + K2SO4 + 2KHCO3
3、2NH4HSO4 + 2KAlO2 + 2H2O = (NH4)2SO4 + K2SO4 + 2Al(OH)3
4、(NH4)2SO4 + 2KAlO2 + 4H2O = 2NH3.H2O + K2SO4 + 2Al(OH)31年前查看全部
- 浓度为0.1mol/L的下列几种溶液:NH4HSO4,NH4HCO3,NH4Al(SO4)2,NH4Cl ,请问NH4+
浓度为0.1mol/L的下列几种溶液:NH4HSO4,NH4HCO3,NH4Al(SO4)2,NH4Cl ,请问NH4+浓度大小顺序是什么?
 hata11年前1
hata11年前1 -
 stockcui 共回答了17个问题
stockcui 共回答了17个问题 |采纳率82.4%NH4HSO4 > NH4Al(SO4)2 > NH4Cl > NH4HCO31年前查看全部
- 【新人求指导】相同物质的量浓度的NH4CL溶液和NH4HSO4溶液两者哪个c(nh4+)大?为什么
【新人求指导】相同物质的量浓度的NH4CL溶液和NH4HSO4溶液两者哪个c(nh4+)大?为什么
请说明理由 李俊杰1年前1
李俊杰1年前1 -
 牛儿爱弹琴 共回答了21个问题
牛儿爱弹琴 共回答了21个问题 |采纳率95.2%NH4HSO4溶液中,c(nh4+)大
因为NH4HSO4电离出来的H+抑制了NH4+的水解.1年前查看全部
- 为什么1mol/升的NH4CL溶液中NH4离子浓度比1mol/升的NH4HSO4要大?
 aazjt11年前2
aazjt11年前2 -
 bcywws 共回答了11个问题
bcywws 共回答了11个问题 |采纳率100%你题问错了吧 应该后者大 因为 硫酸氢铵水中完全电离出氨离子 氢离子 同时铵离子存在水解平衡生成氢离子 那么完全电离出的氢离子便抑制其水解 则铵离子浓度大 而前者溶液中并无抑制铵离子水解的离子 所以氨离子较多的变为氨水 铵离子较少1年前查看全部
- 化学;写电离方程式 BaCL2 H2Co3 NH3.H2O AL(OH)3 NH4HSO4 必有重谢
化学;写电离方程式 BaCL2 H2Co3 NH3.H2O AL(OH)3 NH4HSO4 必有重谢
BaCL2 H2Co3 NH3。H2O AL(OH)3 NH4HSO4
坐等啊 cszx801年前3
cszx801年前3 -
 lcsf 共回答了18个问题
lcsf 共回答了18个问题 |采纳率83.3%BaCl2=Ba2+ + 2Cl- (____----代表可逆符号)
H2CO3____---HCO3- + H+ ____-----CO32- + 2H+
NH3.H2O____-----NH4+ + OH-
AL(OH)3=AL3+ + 3OH-
NH4HSO4===NH4+ + H+ + SO42-1年前查看全部
- 请写出:【Ba(OH)2与NH4HSO4反应的离子方程式】
 自己做hh1年前1
自己做hh1年前1 -
 应亦心 共回答了21个问题
应亦心 共回答了21个问题 |采纳率100%NH4++H++SO42-+2OH-+Ba2+=BaSO4↓+NH3·H2O+H2O;1年前查看全部
- 等物质量的Ba(OH)2与NH4HSO4在稀溶液中反应离子方程式
 kirkpeng1年前2
kirkpeng1年前2 -
 小DE木乃伊 共回答了15个问题
小DE木乃伊 共回答了15个问题 |采纳率93.3%Ba2+ SO42- = BaSO4↓
NH4+ 2OH- + H+ =H2O + NH3•H2O
选我啊,1年前查看全部
- 下列离子方程式正确的是( )A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+2
下列离子方程式正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.向100mL 0.1mol/L FeBr2溶液中通入0.01mol的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.AlCl3溶液与过量氨水混合:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
D.向Mg(HCO3)2中加足量的Ca(OH)2溶液:Ca2++2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O langui33441年前1
langui33441年前1 -
 jacktime 共回答了16个问题
jacktime 共回答了16个问题 |采纳率81.3%解题思路:A.刚好沉淀完全,氢氧化钡与硫酸氢铵按照1:1反应,铵根离子和氢离子都与氢氧根离子反应;
B.100mL 0.1mol/L FeBr2溶液中含有溶质溴化亚铁0.01mol,亚铁离子还原性强于溴离子,亚铁离子优先与氯气反应,根据亚铁离子、溴离子与氯气的物质的量关系进行判断;
C.氨水为弱碱,不会溶解氢氧化铝,氯化铝与氨水反应生成氢氧化铝;
D.氢氧化钙足量,反应产物为碳酸钙、氢氧化镁沉淀和碳酸根离子.A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,氢离子不足,铵根离子参与反应,正确的离子方程式为:Ba2++2OH-+H++NH4++SO42-=BaSO4↓+2H2O+NH3•H2O,故A错误;
B.亚铁离子还原性强于溴离子,所以亚铁离子优先参与反应;溴化亚铁的物质的量为0.01mol,含有0.01mol亚铁离子和0.02mol溴离子,0.01mol亚铁离子完全反应消耗0.005mol氯气,剩余的0.005mol氯气消耗0.005mol溴离子,氯气不足,溴离子部分反应,正确的离子方程式为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B错误;
C.AlCl3溶液与过量氨水混合,反应产物为氢氧化铝沉淀,反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C正确;
D.向Mg(HCO3)2中加足量的Ca(OH)2溶液,反应生成氢氧化镁沉淀,正确的离子方程式为:2Ca2++4OH-+2HCO3-+Mg2+=2CaCO3↓+Mg(OH)2↓+2H2O,故D错误;
故选C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式;选项BD为难点和易错点,注意反应物过量情况.1年前查看全部
- NH4HSO4溶液与NaOH溶液的反应离子方程式
NH4HSO4溶液与NaOH溶液的反应离子方程式
NaOH不足 NaOH过量 王波萝宝宝1年前2
王波萝宝宝1年前2 -
 bdflqz135 共回答了11个问题
bdflqz135 共回答了11个问题 |采纳率90.9%NaOH少量时,OH-首先和HSO4-电离出来的H+结合:
2NH4HSO4 + 2NaOH ==== Na2SO4 + (NH4)2SO4 + 2H2O
离子方程:H+ + OH- ==== H2O
NaOH过量时,OH-和H+、NH4+反应:
NH4HSO4 + 2NaOH ==== Na2SO4 + NH3·H2O + H2O
离子方程:NH4+ + H+ + 2OH- ==== NH3·H2O + H2O
如此这般~1年前查看全部
- 在相同条件下NH4Cl、CH3COONH4、(NH4)2SO4、NH4HSO4、(NH4)2CO3中C(NH4+)由大到
在相同条件下NH4Cl、CH3COONH4、(NH4)2SO4、NH4HSO4、(NH4)2CO3中C(NH4+)由大到小的顺序
请并附详解 梅晓菁1年前4
梅晓菁1年前4 -
 还情凤凰羽 共回答了16个问题
还情凤凰羽 共回答了16个问题 |采纳率87.5%在相同条件下NH4Cl、CH3COONH4、(NH4)2SO4、NH4HSO4、(NH4)2CO3中C(NH4+)由大到小的顺序:C[NH4)2SO4]>C[(NH4)2CO3]>C[NH4HSO4]>C(NH4Cl)>C(CH3COONH4)
因为相同条件下,可假设五种物质的物质的量浓度相同,
五种物质都是强电解质,都完全电离,(NH4)2SO4和(NH4)2CO3中铵根离子的物质的量分别是两种物质的物质的量浓度的2倍,所以两种物质的溶液中铵根离子的浓度最大,
硫酸铵正确水解,碳酸铵中铵根离子和碳酸根离子互相促进水解,所以C[NH4)2SO4]>C[(NH4)2CO3];
NH4Cl、CH3COONH4、NH4HSO4三种物质中所含铵根离子的物质的量相同,但NH4HSO4中由于含有氢离子,抑制了铵根离子的水解,NH4Cl中铵根正常水解,CH3COONH4中铵根离子和醋酸根离子互相促进水解,所以C[NH4HSO4]>C(NH4Cl)>C(CH3COONH4)
综上所述可知:C(NH4+)由大到小的顺序:C[NH4)2SO4]>C[(NH4)2CO3]>C[NH4HSO4]>C(NH4Cl)>C(CH3COONH4)1年前查看全部
- ..C(NH4+)1mol/L的NH4HSO4,NH4HCO3,和NH4Cl,哪个NH4+的物质的量浓度最大,我觉得HC
..C(NH4+)1mol/L的NH4HSO4,NH4HCO3,和NH4Cl,哪个NH4+的物质的量浓度最大,我觉得HCO3-,HSO4-应该是促进NH4水解,所以应该NH4CL物质量浓度最大,结果不是,为什么?
 梓榆251年前1
梓榆251年前1 -
 1306xyk 共回答了25个问题
1306xyk 共回答了25个问题 |采纳率92%应该是NH4HSO4,HSO4-会电离成H+和硫酸根离子,再说NH4+的水解也生成H+,这样说来,HSO4-电离成的H+会抑制NH4+水解所以NH4+的浓度较原来没太大改变,而HCO3-水解的程度远远大于电离,所以水解显碱性,这样会促进NH4+的水解,所以综上所述,NH4HSO4中NH4+的物质的量浓度最大.关系是浓度NH4HSO4>NH4Cl>,NH4HCO31年前查看全部
- 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
 常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
常温下有0.1mol•L-1五种溶液NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4.
(1)已知CH3COOH溶液的pH=3,其电离度为______,由水电离的c(H+)=______.
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是______曲线,a、b两点中,导电能力更强的是______.
(3)NH3•H2O溶液和HCl溶液等体积混合后,溶液呈酸性的原因是(离子方程式表示)______.此时,该混合溶液中的微粒浓度关系正确的是______.
A.c(Cl-)>c(H+)>c(NH4+)>c(OH-)B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(NH4+)+c(NH3•H2O)=0.1mol•L-1 D.c(H+)=c(NH3•H2O)+c(OH-)
(4)已知NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中各离子浓度的大小关系是______. 过客5231年前1
过客5231年前1 -
 walter001 共回答了25个问题
walter001 共回答了25个问题 |采纳率100%解题思路:(1)电离度=
×100%;由水电离的c(H+)等于溶液中氢氧根离子浓度;c(H+) c(CH3COOH)
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸;
溶液的导电能力与离子浓度成正比;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解;
根据溶液的酸碱性再结合电荷守恒判断离子浓度大小;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,再结合离子水解、电荷守恒判断.(1)电离度=
c(H+)
c(CH3COOH)×100%=
10−3
0.1×100%=1%;由水电离的c(H+)等于溶液中氢氧根离子浓度=
10−14
10−3mol/L=1×10-11mol.L-1,
故答案为:1%;1×10-11mol.L-1;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:І;a;
(3)等物质的量的氨水和盐酸混合时,二者恰好反应生成氯化铵,铵根离子水解而使溶液中氢离子浓度大于氢氧根离子浓度,则溶液呈酸性,水解离子方程式为NH4++H2O⇌NH3•H2O+H+,
A.氯化铵能水解但水解程度较小,所以c(H+)<c(NH4+),故错误;
B.铵根离子水解而使溶液呈酸性,所以c(OH-)<c(H+),故错误;
C.溶液中存在物料守恒,根据物料守恒得c(NH4+)+c(NH3•H2O)=0.05mol•L-1,故错误;
D.根据质子守恒得c(H+)=c(NH3•H2O)+c(OH-),故正确;
故答案为:NH4++H2O⇌NH3•H2O+H+;D;
(4)NH3•H2O和NH4Cl等浓度混合时溶液呈碱性,说明一水合氨电离程度大于铵根离子水解程度,向NH4HSO4溶液中逐滴滴入NaOH溶液至中性时,溶液中的溶质为硫酸铵、一水合氨和硫酸钠,钠离子不水解、铵根离子水解,溶液中存在电荷守恒c(Na+)+c(NH4+)=2c(SO42-),所以离子浓度大小顺序是c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).点评:
本题考点: 弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了弱电解质的电离,根据弱电解质电离特点结合电荷守恒、物料守恒来分析解答,难点是(4)题,明确溶液中的溶质及其性质,题目难度不大.1年前查看全部
- (2012•闵行区二模)往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,发生的离子反应方程式可能为( )
(2012•闵行区二模)往NH4HSO4溶液中逐滴加入Ba(OH)2溶液,发生的离子反应方程式可能为( )
A.NH4++2H++SO42-+Ba2++3OH-→BaSO4↓+NH3•H2O+2H2O
B.NH4++H++SO42-+Ba2++2OH-→BaSO4↓+NH3•H2O+H2O
C.2NH4++H++2SO42-+2Ba2++3OH-→2BaSO4↓+2NH3•H2O+H2O
D.NH4++3H++2SO42-+2Ba2++4OH-→2BaSO4↓+NH3•H2O+3H2O humy1年前1
humy1年前1 -
 goolge_139 共回答了20个问题
goolge_139 共回答了20个问题 |采纳率85%解题思路:向NH4HSO4溶液中逐滴加入Ba(OH)2溶液,首先同时发生:SO42-+Ba2+=BaSO4↓,OH-+H+=H2O,当H+反应完毕,剩余的OH-再与NH4+发生反应NH4++OH-=NH3•H2O,
①当H+未完全反应或恰好反应时,即n[Ba(OH)2]:n(NH4HSO4)≤1:2,H+部分或完全反应,SO42-部分反应,由Ba(OH)2提供离子可知,H+与SO42-的系数为2:1;
②当NH4+部分反应时,即1:2<n[Ba(OH)2]:n(NH4HSO4)<1:1,NH4+、SO42-部分,H+完全反应,此时H+的系数大于NH4+系数,结合Ba(OH)2提供离子关系判断;
③当NH4+完全反应时,即n[Ba(OH)2]:n(NH4HSO4)≥1:1,H+、NH4+、SO42-都完全反应,三种系数之比为1:1:1,据此根结合选项判断.向NH4HSO4溶液中逐滴加入Ba(OH)2溶液,首先同时发生:SO42-+Ba2+=BaSO4↓,OH-+H+=H2O,当H+反应完毕,剩余的OH-再与NH4+发生反应NH4++OH-=NH3•H2O,
①当H+未完全反应或恰好反应时,即n[Ba(OH)2]:n(NH4HSO4)≤1:2,H+部分或完全反应,SO42-部分反应,由Ba(OH)2提供离子可知,H+与SO42-的系数为2:1,反应离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
②当NH4+部分反应时,即1:2<n[Ba(OH)2]:n(NH4HSO4)<1:1,NH4+、SO42-部分,H+完全反应,此时H+的系数大于NH4+系数,反应离子方程式为:nNH4++mH++[m+n/2]SO42-+[m+n/2]Ba2++(n+m)OH-=[m+n/2]BaSO4↓+nNH3•H2O+mH2O,其中n<m;
③当NH4+完全反应时,即n[Ba(OH)2]:n(NH4HSO4)≥1:1,H+、NH4+、SO42-都完全反应,三种系数之比为1:1:1,反应离子方程式为:H++SO42-+Ba2++2OH-=BaSO4↓+NH3•H2O+H2O;
A、NH4++2H++SO42-+Ba2++3OH-=BaSO4↓+NH3•H2O+2H2O,NH4+参加反应,故H+完全反应,应符合上述分析中情况②,参加反应的SO42-的系数应为1.5,Ba2+的系数为1.5,故A错误;
B、离子反应NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3•H2O+H2O,符合上述分析中情况③,故B正确;
C、离子反应2NH4++H++2SO42-+2Ba2++3OH-=2BaSO4↓+2NH3•H2O+H2O,表示OH-先与NH4+反应,故C错误;
D、离子反应NH4++3H++2SO42-+2Ba2++4OH-=2BaSO4↓+NH3•H2O+3H2O,NH4+参加反应,故H+完全反应,应符合上述分析中情况②,OH-系数等于NH4+、H+系数之和,SO42-、Ba2+系数相等,且为OH-系数的[1/2],符合实际反应,故D正确;
故选:BD.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子方程式的书写与判断,难度较大,理解离子反应发生的先后顺序与物质的量之间的关系是关键.1年前查看全部
- (NH4)2SO4 NH4HSO4 H2SO4稀释前后ph变化大小 怎么比较
(NH4)2SO4 NH4HSO4 H2SO4稀释前后ph变化大小 怎么比较
1、相同物质的量浓度(NH4)2SO4 NH4HSO4 H2SO4
或者 2、相同ph 的(NH4)2SO4 NH4HSO4 H2SO4
稀释前后ph变化大小 怎么比较 天高地厚-1年前1
天高地厚-1年前1 -
 xbl1983623 共回答了16个问题
xbl1983623 共回答了16个问题 |采纳率93.8%PH变化大小以H+浓度变化大小为准.
①c相同,c(H+):硫酸>硫酸氢铵>硫酸铵.若同样稀释一倍,硫酸氢铵和硫酸铵由于先前的不完全电离,加水稀释后可促进电离,使PH变化变小,故C相同稀释前后PH变化大小为:硫酸>硫酸氢铵>硫酸铵.
②PH相同,三溶液n:硫酸铵>硫酸氢铵>硫酸.若同样稀释一倍,稀释后c(H+)为:硫酸铵>硫酸氢铵>硫酸,故PH变化大小为:硫酸>硫酸氢铵>硫酸铵.1年前查看全部
- 一道关于高中电离水解的化学题,体积相同的(NH4)2SO4 NH4HSO4 H2SO4,当它们PH值相同时,溶液中水电离
一道关于高中电离水解的化学题,
体积相同的(NH4)2SO4 NH4HSO4 H2SO4,当它们PH值相同时,溶液中水电离出来的H+的浓度由大到小的排列是?为什么? woshijojo1年前4
woshijojo1年前4 -
 点点1969 共回答了21个问题
点点1969 共回答了21个问题 |采纳率90.5%酸直接电离出H+,故酸溶液中H+浓度大于盐
NH4HSO4也可电离出H+
因此,溶液中,H+浓度由大到小的排列是:H2SO4、NH4HSO4 、(NH4)2SO41年前查看全部
- 哪个大哥说下,NH4HSO4和NH4HCO3怎么电离
哪个大哥说下,NH4HSO4和NH4HCO3怎么电离
如题,还有电荷守恒,物料守恒,质子守恒大哥些也说下,特别是质子守恒.
水解呢... xianlaiyiyu1年前4
xianlaiyiyu1年前4 -
 lfzcq 共回答了25个问题
lfzcq 共回答了25个问题 |采纳率80%NH₄HSO₄电离NH₄+、H+、SO₄2-
NH₄HCO₃电离NH₄+、H+、CO₃2-
NH₄HCO₃有时电离NH₄+、HCO₃-
水解?这些物质比较稳定,不会水解的吧!1年前查看全部
- 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是 A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(N
等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是 A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2CO3
这题答案选c为什么 好不好啊哦1年前3
好不好啊哦1年前3 -
 行痴dashi 共回答了10个问题
行痴dashi 共回答了10个问题 |采纳率100%选D
因为1mol .(NH4)2CO3中含2molNH4+
其余3种1mol 都含1molNH4+
水解的是少数,大概占0.01左右1年前查看全部
- (NH4)2SO4\NH4HSO4\NH4NO3,ph值由小到大怎么排.为什么?
 bettywu011年前2
bettywu011年前2 -
 qbatw 共回答了15个问题
qbatw 共回答了15个问题 |采纳率93.3%NH4HSO4为强酸酸式盐,溶于水可电离出H+,所以其溶液酸性较强,pH最小
NH4NO3和(NH4)2SO4都为强酸弱碱盐,溶于水后电离出的NH4+会水解,
方程式为:H2O+NH4+=可逆=NH3·H2O+H+,所以他们的水溶液都呈酸性,
但是每一摩尔(NH4)2SO4中含有两摩尔NH4+,所以其水解程度强于NH4NO3,所以最终pH顺序为:
NH4HSO4<(NH4)2SO4<NH4NO3<71年前查看全部
- 一道化学计算的反应过程氢氧化钠溶液40mL,样品中有硫酸氢氨.氢氧化钠少量2NH4HSO4 2NaOH=(NH4)2SO
一道化学计算的反应过程
氢氧化钠溶液40mL,样品中有硫酸氢氨.氢氧化钠少量2NH4HSO4 2NaOH=(NH4)2SO4 Na2SO4 2H2O;氢氧化钠足量NH4HSO4 2NaOH=Na2SO4 NH3(气体) 2H2O,第一次样品(g)7.75,生成氨气(g)1.87;二次样品15.00,氨气1.87;三次样品23.25,氨气1.7,给解释一下这三次是谁反应完谁剩余, sissixiang1年前2
sissixiang1年前2 -
 铜子老三 共回答了17个问题
铜子老三 共回答了17个问题 |采纳率94.1%首先比较三组数据:1和2的氨气量是一致的,3的氨气量少,说明第三次氨生成的少,而氢氧化钠过量之后才会发生生成氨的反应,所以3中氢氧化钠量少,反应完,1和2是硫酸氢铵反应完1年前查看全部
- 室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性
室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性
向0.01mol/lNH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)>C(SO4 2-)>C(NH4+)>C(OH-)=C(H+)
为什么, maxvan20081年前1
maxvan20081年前1 -
 阿拉蕾0313 共回答了21个问题
阿拉蕾0313 共回答了21个问题 |采纳率81%先假设都为1mol
1铵根离子水解显酸性小于1mol
2由于它是中性,所以NaOH是过量的大于1mol
3所以最多的是Na+
4SO42-不会水解所以是不变的=1mol
5中性的溶液H+=OH-(由水电离出来微弱所以是最少的)
NH4+ + H+ +2OH-====NH3H2O+H2O1年前查看全部
- 溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 这个NH4HSO4水解成酸性
溶质的物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者 这个NH4HSO4水解成酸性 NH4HSO4里有H离子 抑制水解 所以c(NH4+)前者小于后者 可是NH4HSO4水解生成了一水合氨 它会和溶液的H离子反应 那样就会促进水解了么?我上课开小差来 对不起啊 好不好?
 cocohu1年前3
cocohu1年前3 -
 zr_521 共回答了21个问题
zr_521 共回答了21个问题 |采纳率100%是有一水合氨 但是因为都是微量 而H离子和SO42-离子都是完全电离的 可以认为这个原因造成了水中H离子的增加 从而水呈酸性 水解比起电离是极其微弱的 因而忽略一水合氨只考虑H+ 而这微量的一水合氨受到H+的影响可以认为水解被抑制 要促进NH4HSO4水解 要加碱或水解成碱性的物质1年前查看全部
- 在物质的量相同的下列溶液中,NH4+最多的是A、NH4Cl B、NH4HSO4 C、CH3COONH4 D、NH4HCO
在物质的量相同的下列溶液中,NH4+最多的是A、NH4Cl B、NH4HSO4 C、CH3COONH4 D、NH4HCO3
 面包树blog1年前2
面包树blog1年前2 -
 screlin 共回答了11个问题
screlin 共回答了11个问题 |采纳率100%答案是B H2O水解后形成H+和OH-,而B中均有H+本来存在,抑制水解,A中因为水解NH4+就会变成NH3.H2O挥发掉.而C,D终都为弱酸根,所以亦会加速水解,同理生成氨水.
哎,高中知识都快忘干净了1年前查看全部
- 相同浓度的NH4HSO4溶液与NaOH等体积混合,混合后溶液中浓度关系表示正确的是
相同浓度的NH4HSO4溶液与NaOH等体积混合,混合后溶液中浓度关系表示正确的是
A (Na+)+(NH4+)=2(SO42-) B (H+)=(OH-)+(NH3.H2O) 嗳硪自嘎1101年前1
嗳硪自嘎1101年前1 -
 温dd公公 共回答了21个问题
温dd公公 共回答了21个问题 |采纳率90.5%剩下一个NH4+,一个Na+,一个SO42-
由电荷守恒,(H+)+(Na+)+(NH4+)=2(SO42-)+(OH-)
反应后显酸性,H+与OH-不可能相等.所以A错
由质量守恒(NH4+) + (Na+) + (NH3.H2O)=2(SO42-)
两式相减就可以得到B的答案1年前查看全部
- 高中化学反应有时涉及先后顺序,比如NH4hSO4与NaOH反应,因反应次序不同而和用量有关,又称竞争型.求原理.
 六日-Q1年前2
六日-Q1年前2 -
 jennywcm 共回答了17个问题
jennywcm 共回答了17个问题 |采纳率100%此反应先是
H+ +OH-=H2O,氢氧根再与铵根反应
化学反应中中和反应最快.1年前查看全部
- (NH4)2SO4,(NH4)2CO3, (NH4)2Fe2(SO4),NH4HSO4,NH4Cl溶液中,C(NH4)的
(NH4)2SO4,(NH4)2CO3, (NH4)2Fe2(SO4),NH4HSO4,NH4Cl溶液中,C(NH4)的浓度由大到小的顺序为?理由
 crocodilell1年前1
crocodilell1年前1 -
 wusheng118 共回答了17个问题
wusheng118 共回答了17个问题 |采纳率88.2%你应该丢了一个前提条件,就是这些溶液的浓度是相同的.
这样就考虑其它离子对铵根离子水解的影响
其中,CO32-会促进铵根离子水解,使其浓度减小 Fe2+会抑制铵根离子水解 ,使其浓度增大 H+也会抑制铵根离子水解
所以顺序是:(NH4)2Fe2(SO4)2>(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl1年前查看全部
- 物质的量浓度相等的1.( NH4)2FeSO4 2.NH4HSO4溶液、 .3.(NH4)2CO3 .4.NH4Cl溶液
物质的量浓度相等的1.( NH4)2FeSO4 2.NH4HSO4溶液、 .3.(NH4)2CO3 .4.NH4Cl溶液中 的c(NH4 +) 大小排列顺序是 1432
真心不懂 RRSHU1年前2
RRSHU1年前2 -
 琥珀的痛 共回答了14个问题
琥珀的痛 共回答了14个问题 |采纳率85.7%物质的量浓度相等
所以都设为Cmol/L
1莫尔盐的分子式( NH4)2Fe(SO4)2 LZ写的物质我在网上查证不存在的
本来分子式中含有两个NH4+
但是因为铵根会发生水解NH4+ + H2O → NH3·H2O + H+
Fe2++ 2H2O=Fe(OH)2+2H+
相互抑制
所以c1(NH4+)<2c
2分子式中含一个NH4+
也会发生水解
但是因为HSO4-会电离出H+
抑制NH4+水解
所以c2(NH4+)<c
3分子式中含两个NH4+
溶液中不仅仅存在CH4+的水解
还有CO32-的水解
CO3 2-+2H2O===H2CO3+2OH-
此时生成的NH3·H2O会和H2CO3结合生成NH4+ 和CO3 2-
使得这两个水解反应不断发生
循环往复 NH4+几乎是稳定不变 不发生水解的
所以c3(NH4+)<2c
所以C2<c1<C3
4分子式中含一个NH4+
并且CL-不会水解
CH4+水解
所以c4(NH4+)<c
但是与c2相比 c2中NH4+水解程度小(因为有H+抑制水解)
所以C2>C4
我觉得答案应该由大到小是3124
这道题还是有一定的难度的1年前查看全部
大家在问
- 1饱和时溶液质量分数的计算式? 溶液的稀释和浓缩公式?
- 2一道平行四边形题目,已知平行四边形ABCD的对角线AC与BD相交于点O,这个平行四边形的周长是16,且△AOB的周长比△
- 3心宽体胖,其中的胖有一个还是两个读音?
- 4运动场上有一条为400米的环形跑道.每隔10米插上一面彩旗,一共要插多少面彩旗?
- 5物理题:一个物体由静止开始做匀加速直线运动,第一秒走过的路程是3m,那么
- 6已知f(x)在区间(o,+x)上是减函数,试判断y=f(1/x+1)在(-x,+x)上的单调性
- 7甲车间人数是甲、乙两个车间总人数的五分之二,如果从甲车间调12人到乙车间,则甲、乙两个车间人数的比是3:5,求两个车间共
- 85篇关于暑假的英语日记,80词左右,
- 9有一支温度计,刻度均匀但读数不准.它在冰水混合物中的示数为4℃,在沸水中的示数为94℃.用这支温度计测得烧杯中水的温度是
- 10我长大了300字
- 11三数的比是1:2:4,并且它们的和是84.求这三个数中最大的数.(用方程做)
- 12过点(0,3)得直线与双曲线 x平方/4-Y平方/3=1只有一个公共点,求直线l得方程
- 13机翻勿扰,英翻中:Faculty Mentoring & Advising
- 14对Mg和Mg2+两种微粒的认识不正确的是( )A.这两种微粒都可构成物质B.它们属于同种元素C.它们具有
- 15英语翻译We are committed to providing better solutions to the co
