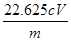亚氯酸钠与硫代硫酸钠反应方程式
 叶孤城12022-10-04 11:39:541条回答
叶孤城12022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 lg7783 共回答了22个问题
lg7783 共回答了22个问题 |采纳率90.9%- 2 NaClO2 + Na2S2O3 + H2O = Na2SO4 + 2 NaCl + H2SO4
亚氯酸钠将S2O32-氧化了 - 1年前
相关推荐
- (2014•中山模拟)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解
(2014•中山模拟)亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解.以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:

(1)提高“反应1”反应速率的措施有______、______等.
(2)“反应2”的氧化剂是______,该反应的化学方程式为:______.
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______.
(4)从“母液”中可回收的主要物质是______.
(5)“冷却结晶”后经______ (填操作名称)即可获得粗产品. hxhjanxa1年前1
hxhjanxa1年前1 -
 众踊跃 共回答了16个问题
众踊跃 共回答了16个问题 |采纳率93.8%解题思路:(1)对于溶液中的化学反应,升高温度或加入催化剂都可增大反应速率;
(2)根据Cl元素化合价的变化判断氧化剂;
(3)减压蒸发在较低温度下可进行,防止温度过高而导致物质分解;
(4)根据物质的性质判断可能发生的反应,以此可判断生成物;
(5)冷却结晶后要分离出固体,应用过滤的方法.(1)对伊气体和液体的反应,为提高反应速率,可适当升高反应温度;增大吸收液浓度,增大SO2与吸收液的接触面积,
故答案为:适当升高反应温度;增大吸收液浓度等;
(2)具有氧化性,根据生成NaClO2目标物的特点可知,反应的方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,反应中Cl元素的化合价降低,则ClO2为氧化剂,
故答案为:ClO2;H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2;
(3)减压蒸发在较低温度下可进行,防止常压蒸发温度过高,亚硫酸钠容易分解,
故答案为:常压蒸发温度过高,亚硫酸钠容易分解;
(4)氯酸钠与二氧化硫在酸性条件下发生氧化还原反应生成ClO2和Na2SO4,则母液中应含有Na2SO4,
故答案为:Na2SO4;
(5)冷却结晶后要分离出固体,应用过滤的方法,故答案为:过滤.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种高效氧化剂、漂白剂。已知:NaClO 2 饱和溶液在温度低于38 o C时析出的晶体是
亚氯酸钠(NaClO 2 )是一种高效氧化剂、漂白剂。已知:NaClO 2 饱和溶液在温度低于38 o C时析出的晶体是NaClO 2 ·3H 2 O,高于38 o C时析出晶体是NaClO 2 ,高于60 o C时NaClO 2 分解成NaClO 3 和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
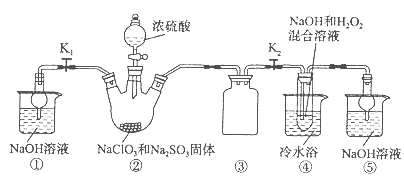
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是: 。
(2)装置②中产生ClO 2 的化学方程式为 。
装置④中发生反应的离子方程式为 。
(3)从装置④反应后的溶液获得NaClO 2 晶体的操作步骤为:
①减压,55 o C蒸发结晶;② ;③ ;④低于60 o C干燥,得到成品。
(4)目前已开发出用电解法制取ClO 2 的新工艺。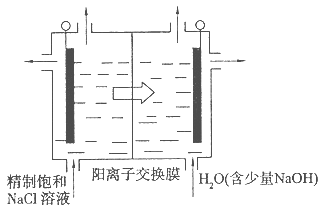
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO 2 的示意图。则阳极产生C1O 2 的电极反应为 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为 mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO 2 - +4I - +4H + =2H 2 O+2I 2 +C1 - )。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是 ;取25.00 mL待测液,用2.0mol·L -1 Na 2 S 2 O 3 标准液滴定(I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2- ),以淀粉溶液做指示剂,达到滴定终点时的现象为 。重复滴定2次,测得Na 2 S 2 O 3 溶液平均值为20.00 mL。该样品中NaClO 2 的质量分数为 。 cctv_19801年前1
cctv_19801年前1 -
 至爱申彗星 共回答了16个问题
至爱申彗星 共回答了16个问题 |采纳率87.5%(1)关闭分液漏斗活塞,打开K 1 、K 2 ,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合...1年前查看全部
- (2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生
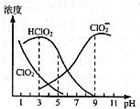 (2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
(2014•浙江模拟)亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
A.含氯消毒剂中的有效氯含量是指含氯消毒剂的氧化能力相当于多少氯的氧化能力,则亚氯酸钠的理论有效氯含量157%
B.使用该漂白剂的最佳pH为3
C.25℃时,HClO2的电离平衡常数的数值Ka=10-6
D.若浓度均为0.1mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)>c(HClO2)-c(ClO2-) loser19861年前1
loser19861年前1 -
 av120 共回答了19个问题
av120 共回答了19个问题 |采纳率73.7%解题思路:A、根据消毒剂中的有效含氯量结合亚氯酸钠的性质、电子守恒知识来计算;
B、根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
C、HClO2的电离平衡常数K=
结合图示数据来计算;c(ClO−)•c(H+) c(HClO)
D、根据溶液中的电荷守恒,质子守恒以及物料守恒等来回答判断.A、消毒剂的消毒是基于物质的氧化性,1mol氯气得电子2mol,1mol亚氯酸钠得电子4mol,当转移电子的量相等时,氯气中氯原子和亚氯酸钠的量之比即为亚氯酸钠的理论有效氯含量,即[0.5×71/0.25×90.5]×100%=157%,故A正确;
B、HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH,应该是小于3,故B错误;
C、HClO2的电离平衡常数K=
c(ClO−)•c(H+)
c(HClO)=10-3×10-3=10-6,故C正确;
D、浓度均为0.1mol•L-1的HClO2溶液和NaClO2溶液等体积混合后所得溶液显酸性,c(H+)+c(Na+)=c(OH-)+c(ClO2-),c(ClO2-)+c(HClO2)=2c(Na+),
c(ClO2-)>c(Na+)>c(H+)>c(OH-),联立得:c(OH-)-c(H+)>c(HClO2)-c(ClO2-),故D正确.
故选B.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.1年前查看全部
- 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:
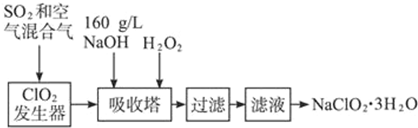
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②160g/L NaOH溶液是指160gNaOH固体溶于水所得溶液的体积为1L.
(1)吸收塔内的反应的化学方程式为
2NaOH+2ClO2+H2O2═2NaClO2+2______+______,
若1mol ClO2参加反应,则转移电子的物质的量是______mol;
(2)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是______(选填序号),
a.蒸馏b.蒸发浓缩c.灼烧d.过滤e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是______(填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是______;
(4)160g/L NaOH溶液的物质的量浓度为______,若要计算该溶液的质量分数,
还需要的一个条件是______(用文字说明). 一刻永远1年前1
一刻永远1年前1 -
 烈火精灵111 共回答了19个问题
烈火精灵111 共回答了19个问题 |采纳率100%解题思路:ClO2在二氧化硫和空气混合气体中不易爆分解炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O;
(1)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生.据此书写方程式,结合化学方程式定量关系计算电子转移总数;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;(3)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故工业生产中主要是用pH计连续测定溶液pH.
(4)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=[n/V]计算氢氧化钠溶液的物质的量浓度.(1)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2,2molClO2反应的转移为2mol,若1mol ClO2参加反应,则转移电子的物质的量是1mol;
故答案为:H2O;O2;1;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为bed.
得到的粗晶体经过重结晶可得到纯度更高的晶体.
故答案为:bed;重结晶;
(3)NaOH过量则溶液呈碱性,但考虑到该溶液有强氧化性,选择指示剂或pH试纸检验会遇到氧化褪色问题,故生产中主要是用pH计连续测定溶液pH;
故答案为:连续测定吸收塔内溶液的pH;
(4)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,则160gNaOH的物质的量为[160g/40g/mol]=4mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=[4mol/1L]=4mol/L,若计算溶质质量分数结合物质的量浓度和溶质质量分数换算分析可知,需要溶液密度;
故答案为:4mol/L;该溶液的密度.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力.题目有一定的难度.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,在碱性溶液中NaClO 2 比较稳定,主要用于水的消毒以及砂糖、油脂
亚氯酸钠(naclo 2 )是一种重要的含氯消毒剂,在碱性溶液中naclo 2 比较稳定,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①naclo 2 的溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 ·3h 2 o。
②纯clo 2 易分解***,一般用稀有气体或空气稀释到10%以下安全。
③160 g/l naoh溶液是指160 g naoh固体溶于水所得溶液的体积为1l。
(1)160 g/l naoh溶液的物质的量浓度为____。若要计算该溶液的质量分数,还需要的一个条件是____(用文字说明)。
(2)发生器中鼓入空气的作用可能是____(选填序号)。
a.将so 2 氧化成so 3 ,增强酸性;
b.稀释clo 2 以防止***;
c.将naclo 3 氧化成clo 2
(3)吸收塔内的反应的化学方程式为____。吸收塔的温度不能超过20℃,其目的是 。
(4)吸收塔中应维持naoh稍过量,理由是____。
(5)吸收塔中能否用fecl 2 代替h 2 o 2 ____(填能.否)?理由是____。
(6)从滤液中得到naclo 2 ·3h 2 o粗晶体的实验操作依次是____(选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的naclo 2 ·3h 2 o晶体必须进行的操作是____(填操作名称)。 木蕊质地1年前1
木蕊质地1年前1 -
 阿宜 共回答了20个问题
阿宜 共回答了20个问题 |采纳率85%(1)4mol/L(1分) 溶液的密度(1分)
(2)b(1分)
(3)2NaOH+2ClO 2 +H 2 O 2 =2NaClO 2 +2H 2 O+O 2 (3分)防止H 2 O 2 的分解(1分)
(4)NaClO 2 在碱性溶液中比较稳定(2分)
(5)否(1分) FeCl 2 可以跟NaClO 2 进一步发生氧化还原反应引进杂质离子(2分)
(6)b、e、d(3分) 重结晶(1分)
1年前查看全部
- 质量分数,物质的量浓度,密度8%的亚氯酸钠溶液(质量分数),求其常温下的密度.求计算,并且有一定解释
 7408281年前1
7408281年前1 -
 弦之音 共回答了24个问题
弦之音 共回答了24个问题 |采纳率95.8%目前还没有一套完整的理论能计算溶液的密度.这个只能实测.你如果经常要知道某种溶液的密度的话可以买组密度计,这个也不贵.1年前查看全部
- 亚氯酸钠(NaClO2)是防疫人员经常使用的一种重要消毒剂,下列说法中不正确的是( )
亚氯酸钠(NaClO2)是防疫人员经常使用的一种重要消毒剂,下列说法中不正确的是( )
A.亚氯酸钠是化合物
B.亚氯酸钠中氯元素的化合价为+3
C.亚氯酸钠由三种元素组成
D.亚氯酸钠中氧元素的质量分数最大 伟强5551年前1
伟强5551年前1 -
 爱神临吻你 共回答了11个问题
爱神临吻你 共回答了11个问题 |采纳率72.7%解题思路:A、由不同种元素组成的纯净物是化合物.
B、根据在化合物中正负化合价代数和为零,结合NaClO2的化学式进行判断.
C、根据亚氯酸钠化学式的含义进行分析判断.
D、根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.A、亚氯酸钠是由钠、氯、氧三种元素组成的纯净物,属于化合物,故选项说法正确.
B、钠元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×2=0,则x=+3价,故选项说法正确.
C、亚氯酸钠是由钠、氯、氧三种元素组成的,故选项说法正确.
D、亚氯酸钠中钠原子的相对原子质量之和为23,氯原子的相对原子质量之和为35.5,氧原子的相对原子质量之和为16×2=32,氯元素的相对原子质量之和最大,则氯元素的质量分数最大,故选项说法错误.
故选:D.点评:
本题考点: 化学式的书写及意义;单质和化合物的判别;有关元素化合价的计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 亚氯酸钠用于牛仔布的褪色漂白时,溶液的PH值应该是多大?
 honlang3201年前1
honlang3201年前1 -
 ljqhl 共回答了18个问题
ljqhl 共回答了18个问题 |采纳率94.4%由于酸性条件下亚氯酸钠会很快失效,所以一般是使用近中性略偏酸性的溶液,即放置在空气中,吸收CO2即可.如果需要加快漂白速率,可以在溶液里加入少量的醋(家庭用法).
希望对你有所帮助!1年前查看全部
- 工业上生产高氯酸.同时生产一种常见含氯消毒剂和漂白剂亚氯酸钠NaClO2.流程:反应器I<NaClO3+浓硫酸>---C
工业上生产高氯酸.
同时生产一种常见含氯消毒剂和漂白剂亚氯酸钠NaClO2.流程:
反应器I<NaClO3+浓硫酸>---ClO2气体并在冷却过滤后有NaHSO4和滤液
ClO2在反应器II中和NaOH,H2O和SO2反应生成NaClO2,滤液则在蒸馏后得到HClO4纯品
请写出上述过程中涉及的有关化学方程式 xindexue1年前1
xindexue1年前1 -
 ceson 共回答了25个问题
ceson 共回答了25个问题 |采纳率84%反应器I:3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O
反应器II:2ClO2+4NaOH+SO2=2NaClO2+Na2SO4+2H2O1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后
亚氯酸钠(NaClO 2 )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO 2 的主要流程如下。
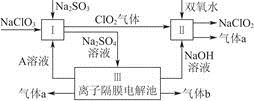
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO 2 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:__________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl 2 。用离子方程式解释产生Cl 2 的原因:__________________________________________。
(5)NaClO 2 变质可分解为NaClO 3 和NaCl。取等质量NaClO 2 ,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO 4 溶液反应时,消耗Fe 2 + 的物质的量________(填“相同”“不相同”或“无法判断”)。 caocao2526271年前1
caocao2526271年前1 -
 罗氏天才 共回答了23个问题
罗氏天才 共回答了23个问题 |采纳率95.7%(1)H—O—O—H Na 2 SO 3
(2)2ClO 2 +H 2 O 2 +2OH - =2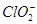 +O 2 ↑+2H 2 O
+O 2 ↑+2H 2 O
(3)H 2 SO 4 阳
(4)5NaClO 2 +4HCl=5NaCl+4ClO 2 ↑+2H 2 O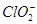 +3Cl - +4H + =2Cl 2 ↑+2H 2 O
+3Cl - +4H + =2Cl 2 ↑+2H 2 O
(5)相同
(1)NaClO 3 中Cl原子化合价为+5价,具有很强的氧化性,而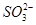 在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO 3 ,还原剂是Na 2 SO 3 ;(2)电解Na 2 SO 4 溶液相当于电解水,由气体a、b是Na 2 SO 4 溶液的电解产物可知为H 2 和O 2 ,由气体a为反应Ⅱ的产物之一可知其为O 2 ,为H 2 O 2 被ClO 2 氧化得到的产物,故反应Ⅱ的反应物为ClO 2 、H 2 O 2 和NaOH,生成物有NaClO 2 和O 2 ,根据电子守恒和原子守恒配平即可;(3)电解Na 2 SO 4 溶液时OH - 在阴极生成,故Na + 通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H + ,
在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO 3 ,还原剂是Na 2 SO 3 ;(2)电解Na 2 SO 4 溶液相当于电解水,由气体a、b是Na 2 SO 4 溶液的电解产物可知为H 2 和O 2 ,由气体a为反应Ⅱ的产物之一可知其为O 2 ,为H 2 O 2 被ClO 2 氧化得到的产物,故反应Ⅱ的反应物为ClO 2 、H 2 O 2 和NaOH,生成物有NaClO 2 和O 2 ,根据电子守恒和原子守恒配平即可;(3)电解Na 2 SO 4 溶液时OH - 在阴极生成,故Na + 通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H + ,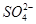 向阳极移动得到产物A(即H 2 SO 4 溶液);(4)①由题意可知反应物为NaClO 2 和HCl,其中NaClO 2 中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO 2 自身的氧化还原反应,根据电子守恒可知氧化产物ClO 2 和还原产物Cl - 的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl 2 则
向阳极移动得到产物A(即H 2 SO 4 溶液);(4)①由题意可知反应物为NaClO 2 和HCl,其中NaClO 2 中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO 2 自身的氧化还原反应,根据电子守恒可知氧化产物ClO 2 和还原产物Cl - 的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl 2 则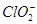 和HCl发生了归中反应,根据电子守恒可知反应的
和HCl发生了归中反应,根据电子守恒可知反应的 和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO 2 自身的氧化还原反应,无论变质与否,与Fe 2 + 反应时氯元素最终都转化为Cl - ,故转移电子数相等。
1年前查看全部
和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO 2 自身的氧化还原反应,无论变质与否,与Fe 2 + 反应时氯元素最终都转化为Cl - ,故转移电子数相等。
1年前查看全部
- (2008•南通)2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒.亚氯酸钠(
(2008•南通)2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.试计算:
(1)亚氯酸钠中Na、Cl、O三种元素的质量之比为______.
(2)现要配制质量分数为16%的亚氯酸钠消毒液1500kg,需要亚氯酸钠______. like05671年前1
like05671年前1 -
 hnqlj 共回答了22个问题
hnqlj 共回答了22个问题 |采纳率90.9%解题思路:(1)任何纯净物都有固定的组成,因此,组成物质的各元素之间必然存在着一定的质量关系.而物质的化学式就反应了组成这种物质的各元素之间的质量关系.根据物质的化学式,我们可以确定物质组成元素的质量比和物质中某元素的质量分数.
(2)溶液在我们的生活、生产和科研中具有广泛的用途,定量表示溶液的方法多,化学上常用溶质的质量分数来表示.溶质质量与溶液质量的比值叫做溶质的质量分数,可用下式表示:
溶质的质量分数=[溶质的质量/溶液的质量]×100%
在实际生活中,很多时候我们必须使用溶质质量分数一定的溶液.本题利用四川汶川大地震,创设情景,理论联系实际.(1)氧原子的相对原子量是16,氯原子的相对原子量是35.5,钠原子的相对原子量是23,由亚氯酸钠的化学式:NaClO2可知Na、Cl、O三种元素的质量之比,1×23:1×35.5:2×16=46:71:64
故答案为:46:71:64
(2)由溶质的质量分数=[溶质的质量/溶液的质量]×100%
得 溶质的质量=溶液的质量×溶质的质量分数
=1500×16%
=240(kg)
故答案为:240kg点评:
本题考点: 有关溶质质量分数的简单计算;元素质量比的计算.
考点点评: 本题分别对元素质量比计算、溶质质量分数的计算进行考查,其问题设置情境可使知变“活”,更加贴近生活和生产,感受“生活处处有化学”.命题的目的是通过对救援工作的应用展开,让同学们尝试解答后,体验重要化学物质在现代社会中的意义和价值,培养同学们通过对溶质质量分数的计算解决现实问题的能力.这类问题具有很强的实用性,因此必将成为今后命题的一个热点.1年前查看全部
- 亚氯酸钠与氯气的反应的化学方程式
 心里有茶1年前1
心里有茶1年前1 -
 topone007 共回答了15个问题
topone007 共回答了15个问题 |采纳率100%2NaClO2+Cl2=2ClO2↑+2NaCl 钠是+1价,第一个氯+3价,第二个铝0价,第三个氯+4价,第四个氯-1价,氧-2价1年前查看全部
- (2014•湖北模拟)某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,已知NaClO2是一种强氧化性漂白剂,
(2014•湖北模拟)某实验A小组设计生产亚氯酸钠(NaClO2)的主要流程如图,已知NaClO2是一种强氧化性漂白剂,广泛用于纺织、印染工业.它在碱性环境中稳定存在.

(1)双氧水的电子式为______,装置Ⅰ中发生反应的还原剂是______(填化学式).
(2)A的化学式是______,装置Ⅲ电解池中A在______极区产生,若装置Ⅲ中生成气体a为11.2L(标准状况),则理论上通过电解池的电量为______(已知法拉第常数F=9.65×l04C•mol-1).
(3)装置Ⅱ中反应的离子方程式是______. fzdhc1年前1
fzdhc1年前1 -
 genius_88888 共回答了19个问题
genius_88888 共回答了19个问题 |采纳率89.5%解题思路:(1)根据电子式的书写方法写出过氧化氢的电子式,装置Ⅰ是NaClO3和Na2SO3反应生成Na2SO4,ClO2,依据元素化合价变化发生反应的还原剂为Na2SO3;
(2)装置Ⅲ是电解硫酸钠溶液,阳极上氢氧根离子失电子生成气体a为氧气,剩余氢离子结合硫酸根离子形成硫酸;阴极上是氢离子得到电子生成气体b为氢气,氢氧根离子浓度增大,形成氢氧化钠,依据电极反应和电子守恒计算电子转移的电量;
(3)装置Ⅱ中反应是2ClO2+NaOH+2H2O2=2NaClO2+O2↑+2H2O;(1)过氧化氢是共价化合物,过氧化氢的电子式为:
 ;装置Ⅰ是NaClO3和Na2SO3反应生成Na2SO4,ClO2,依据元素化合价变化发生反应的还原剂为Na2SO3;
;装置Ⅰ是NaClO3和Na2SO3反应生成Na2SO4,ClO2,依据元素化合价变化发生反应的还原剂为Na2SO3;
故答案为: ;Na2SO3;
;Na2SO3;
(2)装置Ⅲ是电解硫酸钠溶液,阳极上氢氧根离子失电子生成气体a为氧气,剩余氢离子结合硫酸根离子形成硫酸;阴极上是氢离子得到电子生成气体b为氢气,氢氧根离子浓度增大,形成氢氧化钠,装置Ⅲ中生成气体a为11.2L(标准状况)的氧气,物质的量=[11.2L/22.4L/mol]=0.5mol;4OH--4e-=2H2O+O2↑,电极反应计算转移电子物质的量为2mol,理论上通过电解池的电量=2mol×9.65×l04C•mol-1=1.93×l 05C,
故答案为:H2SO4;阳;1.93×l 05C;
(3)装置Ⅱ中反应是2ClO2+NaOH+2H2O2=2NaClO2+O2↑+2H2O,反应的离子方程式为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;点评:
本题考点: 电解原理.
考点点评: 本题考查了过氧化氢的分子式、电子式、化合价,流程分析判断等知识,完成本题,关键是合理分析、理解题中的信息,本题难度不大.1年前查看全部
- (2014•江苏模拟)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
(2014•江苏模拟)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.现利用图所示装置进行实验.
(1)装置③的作用是______.
(2)装置②中产生ClO2的化学方程式为______;装置④中制备NaClO2的化学方程式为______.
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③______;④低于60℃干燥,得到成品.
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:Cl
+4I-+4H+═2H2O+2I2+Cl-);将所得混合液配成250mL待测溶液.O −2
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2
═2I-+S4O −2
.O 2−6
(4)达到滴定终点时的现象为______.
(5)该样品中NaClO2的质量分数为[90.5cV/4m% freegirl1231年前1
freegirl1231年前1 -
 Amyeter 共回答了19个问题
Amyeter 共回答了19个问题 |采纳率84.2%解题思路:(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)根据关系式NaClO2~2I2~4S2O32-进行计算;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.(1)装置③是安全瓶能防止倒吸;
故答案为:防止倒吸;
(2)亚硫酸钠具有还原性,在反应中作还原剂;装置②中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,反应的化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;Na2SO3;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:用38℃~60℃热水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
mag c mol•L-1×V×10-3L×
250ml
25ml],
所以90.5g:mag=4mol:c mol•L-1×V×10-3L×[250ml/25ml],
解得a=[90.5cV/4m%=
22.625cV
m]%,
故答案为:
90.5cV
4m%;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
故答案为:4I-+O2+4H+=2I2+2H2O;点评:
本题考点: 探究物质的组成或测量物质的含量;制备实验方案的设计.
考点点评: 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应滴定中利用关系式进行的计算.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的化工原料,以下是过氧化氢法生产亚氯酸钠的工艺流程图: 已知:
亚氯酸钠(naclo 2 )是一种重要的化工原料,以下是过氧化氢法生产亚氯酸钠的工艺流程图: 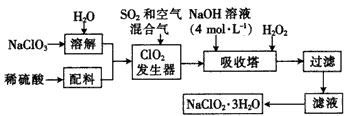
已知:
①naclo 2 的溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 ·3h 2 o;
②纯clo 2 易分解***,一般用稀有气体或空气稀释到10%以下更安全。
试回答下列问题:
(1)clo 2 发生器中发生反应的离子方程式为____。
(2)在clo 2 发生器中通入空气的作用是____(填字母)。
a.将so 2 氧化成so 3 ,增强酸性
b.稀释clo 2 以防止***
c.将naclo 3 氧化成clo 2
(3)吸收塔内的温度不能超过20℃,其主要目的是______,吸收塔内发生反应的化学方程式为____。
(4)在碱性溶液中naclo 3 比较稳定,在酸性溶液中,clo 2 - 和h + 结合为hclo 2 ,hclo 2 是唯一的亚卤酸,不稳定,易分解产生cl 2 、clo 2 和h 2 o,写出hclo 2 分解的化学方程式:____。 chy991年前1
chy991年前1 -
 郁闷的马儿 共回答了22个问题
郁闷的马儿 共回答了22个问题 |采纳率77.3%(1)2ClO 3 - +SO 2 =SO 3 2- +2ClO 2
(2)B
(3)温度升高,H 2 O 2 易分解,且NaClO 2 的溶解度随温度升高而增大,温度高不利于结晶析出
NaClO 2 ·3H 2 O;2ClO 2 +H 2 O 2 +2NaOH==2NaClO 2 +2H 2 O+O 2
(4)8HClO 2 ==Cl 2 ↑+6ClO 2 ↑+4H 2 O1年前查看全部
- 2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒。亚氯酸钠(NaClO 2 )
2008年5月12日四川汶川大地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒。亚氯酸钠(NaClO 2 )是一种重要的消毒剂。试计算:
(1)亚氯酸钠中Na、Cl、O三种元素的质量之比为________。
(2)现要配制质量分数为16%的亚氯酸钠消毒液1500kg,需要亚氯酸钠____ kg。 周文吃水果1年前1
周文吃水果1年前1 -
 yschen1990 共回答了10个问题
yschen1990 共回答了10个问题 |采纳率90%(1)23:35.5:32
(2)2401年前查看全部
- 亚氯酸钠与硫酸氢钠反应的方程式
 padpa1年前1
padpa1年前1 -
 craph 共回答了15个问题
craph 共回答了15个问题 |采纳率100%NaCLO2在酸性介质中生产HCLO2:
NaCLO2+NaHSO4=HClO2+Na2SO4
HClO2部稳定受热分解为ClO2:
5HClO2=4ClO2+HCl+2H2O1年前查看全部
- 印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、 ClO2 ,其中HClO2
印染工业常用亚氯酸钠(NaClO2)漂白织物.亚氯酸钠在溶液中可生成ClO2、HClO2、 ClO2 ,其中HClO2 是漂白
 剂的有效成分,ClO2 是有毒气体,则25C时HClO2溶液的电离平衡常数的数值Ka=.
剂的有效成分,ClO2 是有毒气体,则25C时HClO2溶液的电离平衡常数的数值Ka=.  菲祥1年前1
菲祥1年前1 -
 unnb 共回答了17个问题
unnb 共回答了17个问题 |采纳率82.4%Ka=C(H+)C(ClO-)/C(HClO2),图上看pH=6时,C(ClO-)/C(HClO2)=1,此时C(H+)=10e-6,所以Ka=10e-61年前查看全部
- 亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.如图所示是用过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠(NaClO2)常用于水的消毒和砂糖、油脂的漂白与杀菌.如图所示是用过氧化氢法生产亚氯酸钠的工艺流程图:
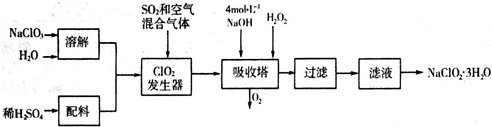
已知:NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
(1)吸收塔内发生反应的化学方程式为______(配平化学方程式).该工艺流程中的NaClO3、ClO2、NaClO2都是强氧化剂,它们都能和浓盐酸反应制取Cl2.若用二氧化氯和浓盐酸制取Cl2,当生成5mol Cl2时,通过还原反应制得氯气的质量为______克.
(2)从滤液中得到的NaClO2•3H2O晶体的操作依次是______(填写序号).a.蒸馏;b.灼烧;c.过滤;d.冷却结晶.
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2 及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为______;体积相等,物质的量浓度相同的NaF、NaCN两溶液中所含阴阳离子总数的大小关系为:______(填“前者大”“相等”或“后者大”).弱酸 HClO2 HF HCN H2S Ka/mol•L-1 1×10-2 6.3×10-4 4.9×10-10 K1=9.1×10−8
K2=1.1×10−12
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ 离子,滴加Na2S溶液后首先析出的沉淀是______;当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时的S2-的浓度为______.
已知Ksp(FeS)=6.3×10−18(mol•L−1)2,Ksp(CuS)=6×10−36(mol•L−1)2Ksp(PbS)=2.4×10−28(mol•L−1)2. yukilee1年前1
yukilee1年前1 -
 风中的荡漾 共回答了12个问题
风中的荡漾 共回答了12个问题 |采纳率100%解题思路:(1)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,Cl元素化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此配平书写方程式;
反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移计算氧化剂与还原剂的物质的量之比,据此确定还原产物与氧化产物物质的量之比,计算还原反应生成的氯气,再根据m=nM计算;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体;
(3)①、弱酸的电离平衡常数越大,酸性越强,反之酸性越弱,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大;
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,故溶液碱性越强,氢离子浓度越小,含有阴阳离子总数的越小;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀;根据溶度积计算S2-的浓度.(1)(3)根据流程信息可知,吸收塔内生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应方程式为:2NaOH+2ClO2+H2O2=2 NaClO2+2H2O+O2↑,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),故n(ClO2):n(HCl)=1:4,故还原产物与氧化产物物质的量之比为1:4,故还原反应生成的氯气为5mol×[1/5]=1mol,通过还原反应制得氯气的质量为1mol×71g/mol=71g,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;71;
(2)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以操作顺序为dc,故答案为:dc;
(3)①根据电离平衡常数可知酸性强弱顺序为:HClO2>HF>HCN>HS-,酸性越弱,对应钠盐中酸根离子水解程度越大,溶液的PH越大,故物质的量浓度相等各溶液pH关系为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2),
NaF、NaCN两溶液中钠离子浓度相同,由于阴离子都是-1价离子,1mol阴离子水解得到1mol氢氧根离子,阴离子的总浓度不变,两溶液中阴离子总浓度相同,溶液为碱性,pH(NaCN)>pH(NaF),故NaCN溶液碱氢离子浓度较小,含有阴阳离子总数较小,即NaF溶液中阴阳离子总数较大,
故答案为:pH(Na2S)>pH(NaCN)>pH(NaF)>pH(NaClO2);前者大;
②物质组成类型相同,溶度积越小,溶解度越小,滴加硫化钠,相应阳离子最先沉淀,故首先析出沉淀是CuS,
Fe2+最后沉淀,沉淀完全时该浓度为10-5mol•L-1,此时的S2-的浓度为
6.3×10−18
10−5mol/L=6.3×10-13mol/L,
故答案为:CuS;6.3×10-13mol/L.点评:
本题考点: 化学方程式的有关计算;难溶电解质的溶解平衡及沉淀转化的本质;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题以学生比较陌生的亚氯酸钠制备为载体,考查学生阅读题目获取信息的能力、氧化还原反应计算、物质分离提纯、盐类水解、溶度积的有关计算与应用等,是在新情境下综合运用知识解决问题的能力的考查,题目有一定的难度.1年前查看全部
- 25%亚氯酸钠溶液有什么作用?80%的亚氯酸钠呢?它们有什么区别!加急!
 shenqin-d1年前1
shenqin-d1年前1 -
 小巫婆Ally 共回答了12个问题
小巫婆Ally 共回答了12个问题 |采纳率100%漂白或消毒
80%的亚氯酸钠一般不直接使用,应该先稀释再用来漂白或消毒 ,否则会有危险1年前查看全部
- 6、亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知: NaClO2饱和溶液在
6、亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:
NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。
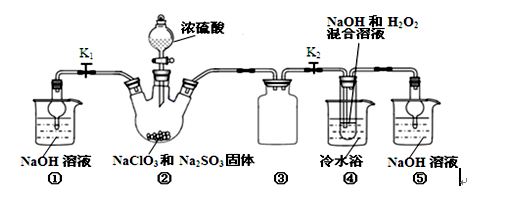
完成下列填空:
(1)组装好仪器后必须进行的操作是 ,装置②产生ClO2,那么分液漏斗中滴入浓硫酸的作用是 。
(2)装置③的仪器名称是 ,装置⑤作用: 。(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(4)①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。
②取25.00mL待测液,用2.0 mol·L-1Na2S2O3标准液滴定(I2 +2S2O32-→2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL,该样品中NaClO2的质量分数为 。
(5)在实验过程中,下列操作会使实验结果偏高的是 ▲
a.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒
b.用滴定管量取液体时,开始时平视读数,结束时俯视读数
c.定容后摇匀,发现液面下降,又补加水,重新达到刻度线
d.滴定前未用标准溶液润洗
e.滴定前有气泡,滴定终点时气泡消失
只需要第五小问的答案及详细解析。
下列操作会使实验结果偏高的是哪些选项,为什么。
谢谢。
 软骨头人1年前1
软骨头人1年前1 -
 xiayanjie 共回答了13个问题
xiayanjie 共回答了13个问题 |采纳率92.3%cde。a:被称量物为10.0g,不需要用游码,故称量中被称量物与砝码位置颠倒称量结果不变;b:将Na2S2O3溶液体积读小了,结果偏小;c:液面下降入补水,使配的NaS2O3溶液浓度偏小,滴定时所用其溶液体积偏大,结果偏大;d:未润洗则标准液被稀释,滴定时所用标准液体积偏大,结果偏大;e:滴定前有气泡,滴定终点时气泡消失,消失的气泡体积相当于使用了标准液体积,使标准液体积偏大,结果偏大。1年前查看全部
- 将干燥空气稀释的氮气填入充有固体亚氯酸钠的柱内制得ClO2,求表示这一反应的化学方程式
 春秋精通1年前1
春秋精通1年前1 -
 tianhuozing 共回答了14个问题
tianhuozing 共回答了14个问题 |采纳率92.9%2NaClO2+Cl2=2ClO2↑+2NaCl(在氮气保护下)1年前查看全部
- 亚氯酸钠是地震灾区常使用的消毒剂之一.以下是用过氧化氢法生产亚氯酸钠的工艺流程图:
亚氯酸钠是地震灾区常使用的消毒剂之一.以下是用过氧化氢法生产亚氯酸钠的工艺流程图:

下列说法正确的是( )
A.亚氯酸钠(NaClO2)中Cl元素的化合价是+3价
B.ClO2发生器里发生的反应:2NaClO3+SO2=2ClO2+Na2SO4属于复分解反应
C.滤液中仅含有的溶质是NaClO2
D.该流程中有三种元素的化合价发生了改变 诺言与谎言1年前1
诺言与谎言1年前1 -
 anthill5123 共回答了21个问题
anthill5123 共回答了21个问题 |采纳率90.5%解题思路:A、根据“在化合物中,正负化合价的代数和为零”的原则,进行解答;B、根据复分解反应的特点考虑;C、由方程式:2NaClO3+SO2=2ClO2+Na2SO4可知滤液中的溶质还含有硫酸钠;D、根据所涉及的化学反应中各元素化合价的计算结果考虑.A、根据“在化合物中,正负化合价的代数和为零”的原则,钠元素的化合价为+1,氧元素的化合价,-2,可得亚氯酸钠(NaClO2)中Cl元素的化合价为:(+1)+x+(-2)×2=0,x=+3;故A正确;
B、复分解反应是两种化合物相互交换成分生成两种新化合物的反应类型,由2NaClO3+SO2=2ClO2+Na2SO4可知并不是两种化合物相互交换成分,不是复分解反应,故B错;
C、滤液中的溶质是NaClO2 和硫酸钠的混合物,故C错;
D、该流程中有三种元素的化合价发生了改变:氯元素由+5价变为+4价,硫元素由+4价变为+6价,氧元素由-1变为-2价,故D正确.
故选AD.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;反应类型的判定.
考点点评: 本题考查学生对计算化合物中元素化合价方法的掌握及书写化学方程式的能力.1年前查看全部
- 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌.如图1是制取亚氯酸钠的工艺流程:
亚氯酸钠(naclo2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌.如图1是制取亚氯酸钠的工艺流程:

已知:①clo2气体只能保持在浓度较低状态下以防止***性分解,且需现合成现用.②clo2气体在中性和碱性溶液中不能稳定存在.
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和naclo3,请写出阳极的电极反应方程式______.
(2)反应生成clo2气体需要x酸酸化,x酸可以为______.
a.盐酸b.稀硫酸c.硝酸d.h2c2o4溶液
(3)吸收塔内的温度不能过高的原因为______.
(4)clo2被s2-还原为clo2-、cl-转化率与ph关系如图2.写出ph≤2时clo2与s2-反应的离子方程式:______.
(5)clo2对污水中fe2+、mn2+、s2-和cn-等有明显的去除效果.某工厂污水中含cn-amg/l,现用clo2将cn-氧化,生成了两种无毒无害的气体,其离子反应方程式为______;处理100m3这种污水,至少需要clo2[100a/26][100a/26]mol. 加强型兔子1年前1
加强型兔子1年前1 -
 心缘娴 共回答了19个问题
心缘娴 共回答了19个问题 |采纳率89.5%解题思路:无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发结晶得到亚氯酸钠晶体,以此解答;
(1)根据电解池中阳极失去电子结合产物书写;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写;根据方程式计算;(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl-+6e-+6OH-=ClO3-+3H2O,故答案为:Cl-+6e-+6OH-=ClO3-+3H2O.
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,故答选:B.
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,故答案为:防止H2O2分解.
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(5)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为
100×103×a×10 −3g
26=[100a/26],故答案为:[100a/26];点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;化学方程式的有关计算;氯、溴、碘及其化合物的综合应用.
考点点评: 该题是高考中的常见题型,属于中等难度的试题.试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力.本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯
亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌,亚氯酸钠受热易分解。以氯酸钠(NaClO 3 )等为原料制备亚氯酸钠的工艺流程如下:
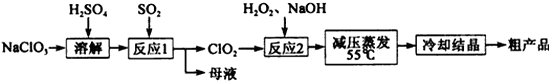
(1)提高“反应1”反应速率的措施有 。(回答一点即可)
(2)“反应1” 的离子方程式是 。
(3)“反应2”的氧化剂是 ,该反应的化学方程式为 。
(4)采取“减压蒸发”而不用“常压蒸发”,原因是 。
(5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下:
a.准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。(已知:ClO 2 - +4I - +4H + =2H 2 O+2I 2 +Cl - )
b.移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L -1 Na 2 S 2 O 3 标准液滴定至终点,重复2次,测得平均值为V mL 。
(已知:I 2 +2S 2 O 3 2- =2I - +S 4 O 6 2- )
①达到滴定终点时的现象为 。
②该样品中NaClO 2 的质量分数为 (用含m、c、V的代数式表示,结果化成最简。) 君临天下-0071年前1
君临天下-0071年前1 -
 vanny13148 共回答了24个问题
vanny13148 共回答了24个问题 |采纳率95.8%1年前查看全部
- 请问配制25%的亚氯酸钠液体是用多少80%的固体亚氯酸钠
请问配制25%的亚氯酸钠液体是用多少80%的固体亚氯酸钠
配制25%的亚氯酸钠液体1000公斤是用多少公斤80%的固体亚氯酸钠,是直接加水就行了吗?计算公式是什么?急用.
配制的时候可以加热吗?加什么可以保持其稳定性? 李青争1年前2
李青争1年前2 -
 肩膀很痛 共回答了11个问题
肩膀很痛 共回答了11个问题 |采纳率72.7%1.计算公式:80%固体亚氯酸钠的实物量==25%*1000公斤/80%==312.5公斤
2.配制方法:先将312.5公斤固体亚氯酸钠用约700公斤水搅拌溶解,然后补加水稀释至1000升.这是重量/体积的百分比浓度.
3.溶解时可稍加热至40-50摄氏度,冷却至室温后再补加水稀释.1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯
亚氯酸钠(naclo 2 )是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
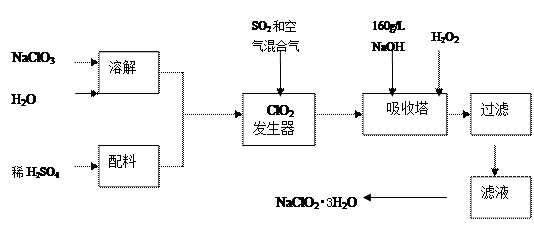

已知:①naclo 2 的溶解度随温度升高而增大,适当条件下可结晶析出naclo 2 •3h 2 o。
②纯clo 2 易分解***,一般用稀有气体或空气稀释到10%以下安全。
③160 g/l naoh溶液是指160 gnaoh固体溶于水所得溶液的体积为1l。
(1)160 g/l naoh溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将so 2 氧化成so 3 ,增强酸性; b.稀释clo 2 以防止***;c.将naclo 3 氧化成clo 2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中naclo 2 比较稳定,所以吸收塔中应维持naoh稍过量,判断naoh是
否过量的简单实验方法是 。
(5)吸收塔中为防止naclo 2 被还原成nacl,所用还原剂的还原性应适中。除h 2 o 2 外,还可以选择的还原剂是 (选填序号)。
a.na 2 o 2 b.na 2 s c.fecl 2
(6)从滤液中得到naclo 2 •3h 2 o粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的naclo 2 •3h 2 o晶体必须进行的操作是 (填操作名称)。 luyohu1年前1
luyohu1年前1 -
 最高用户 共回答了14个问题
最高用户 共回答了14个问题 |采纳率71.4%(1)①4mol/L(1分,未写单位不给分),该溶液的密度(1分);
(2)b(2分);
(3)2NaOH+2ClO 2 +H 2 O 2 →2NaClO 2 +2H 2 O 2 +O 2 (2分);防止H 2 O 2 分解(1分);
(4)连续测定吸收塔内溶液的pH值(2分);(5)a (1分);
(6)b、e、d(2分);重结晶(1分)
略1年前查看全部
- 2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒,亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法不正
2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒,亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法不正确的是( )
A.NaClO2中钠元素质量分数为25.4%
B.NaClO2中氯元素的化合价为+3
C.NaClO2是由NaCl和O2构成的
D.闻到消毒剂气味是因为微粒在不断运动 anan安安anan1年前0
anan安安anan1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 亚氯酸钠(NaClO 2 )是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO 2 4ClO 2 ↑+H + +C
亚氯酸钠(NaClO 2 )是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO 2
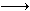 4ClO 2 ↑+H + +Cl - +2H 2 O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……()。
4ClO 2 ↑+H + +Cl - +2H 2 O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……()。A.逸出ClO 2 使生成物浓度降低 B.酸使亚氯酸的氧化性增强 C.溶液中的H + 起催化作用 D.溶液中的Cl - 起催化作用  蓝白蓝白1年前1
蓝白蓝白1年前1 -
 wtuxia 共回答了18个问题
wtuxia 共回答了18个问题 |采纳率94.4%D
1年前查看全部
- 2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法不正
2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法不正确的是( )
A. 闻到消毒剂气味是因为微粒在不断运动
B. NaClO2是由NaCl和O2构成的
C. NaClO2中钠元素的质量分数为25.4%
D. 亚氯酸钠是由钠元素、氯元素、氧元素组成的 董若水20071年前0
董若水20071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (14分) 亚氯酸钠(NaClO 2 )主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易
(14分) 亚氯酸钠(NaClO 2 )主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以
 氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
氯酸钠等为原料制备亚氯酸钠的工艺流程如下: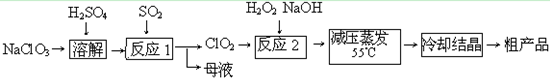
(1)提高“反应1”反应速率的措施有_________________、___________等。
(2)“反应2”的的氧化剂是_________,该反应的化学方程式为_____________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______________________。
(4)从“母液”中可回收的主要物质是_________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。 没有墙的城1年前1
没有墙的城1年前1 -
 玉面玲珑透 共回答了18个问题
玉面玲珑透 共回答了18个问题 |采纳率77.8%1年前查看全部
- 亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+
亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂.下列说法正确的是( )
A.HClO2是有机酸
B.上述反应中,ClO2是还原产物
C.上述反应中,1 mol HClO2分解转移2 mol电子
D.上述反应中,氧化剂与还原剂物质的量之比为1:4 zyk2181年前1
zyk2181年前1 -
 51smzgbbs 共回答了22个问题
51smzgbbs 共回答了22个问题 |采纳率90.9%解题思路:5HClO2=4ClO2↑+HCl+2H2O中,Cl元素的化合价由+3价升高为+4价,Cl元素的化合价由+3价降低为-1价,以此来解答.A.HClO2中没有碳元素,不是有机物,属于无机酸,故A错误;
B.Cl元素的化合价升高被氧化,则ClO2是氧化产物,故B错误;
C.由反应可知,5mol HClO2分解转移4mol电子,则1mol HClO2分解转移[4/5]mol电子,故C错误;
D.由反应可知,5mol HClO2分解时,4mol作还原剂与1mol作氧化剂的得失电子相等,则氧化剂与还原剂物质的量之比为1:4,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素化合价判断,题目难度不大.1年前查看全部
- 2013年4月四川雅安地震后,防疫人员使用各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法
2013年4月四川雅安地震后,防疫人员使用各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.下列说法不正确的是( )
A.闻到消毒剂气味是因为微粒在不断运动
B.NaClO2是由NaCl和O2构成的
C.NaClO2中钠、氯、氧原子个数比为1:1:2
D.NaClO2由三种元素组成 江南一叶飘1年前1
江南一叶飘1年前1 -
 xuzhu2 共回答了17个问题
xuzhu2 共回答了17个问题 |采纳率76.5%解题思路:A、根据分子是在不断的运动的解释闻到气味的原因.
B、根据亚氯酸钠的微观构成进行分析判断.
C、根据亚氯酸钠的微观构成进行分析判断.
D、根据亚氯酸钠化学式的含义进行分析判断.A、闻到消毒剂气味,是因为中消毒剂含有的分子是在不断运动的,向四周扩散,使人们闻到消毒剂气味,故选项说法正确.
B、NaClO2是由钠离子和亚氯酸根离子构成的,故选项说法错误.
C、1个亚氯酸钠分子是由1个钠原子、1个氯原子和2个氧原子构成的,则NaClO2中钠、氯、氧原子个数比为1:1:2,故选项说法正确.
D、亚氯酸钠是由钠元素、氯元素和氧元素组成的,故选项说法正确.
故选:B.点评:
本题考点: 化学式的书写及意义;利用分子与原子的性质分析和解决问题.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义、物质的微观构成等进行分析问题、解决问题的能力.1年前查看全部
- (2013•河东区二模)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
(2013•河东区二模)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置进行实验.
(1)装置③的作用是______;装置①的作用是______.
(2)装置②中产生ClO2的还原剂是______;装置④中制备ClO2的化学方程式为______.
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶:②趁热过滤;③______;④低于60℃干燥,得到成品.
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+═2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液.
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).
(4)达到滴定终点时的现象为______.
(5)该样品中NaClO2的质量分数为[22.625cV/m]%[22.625cV/m]%(用含m、c、V的代数式表示).
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为______. 逆水潇潇1年前1
逆水潇潇1年前1 -
 指北轩谈命 共回答了26个问题
指北轩谈命 共回答了26个问题 |采纳率88.5%解题思路:(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;
装置中有未反应的ClO2,装置①可以吸收ClO2,防止逸出污染空气;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)根据关系式NaClO2~2I2~4S2O32-进行计算;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;装置中有未反应的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;
故答案为:防止倒吸;吸收未反应的ClO2,防止逸出污染空气;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:Na2SO3;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:用38℃~60℃热水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
magc mol•L-1×V×10-3L×[250mL/25mL]
所以90.5g:mag=4mol:c mol•L-1×V×10-3L×[250mL/25mL]
解得a=[22.625cV/m]%,
故答案为:[22.625cV/m]%;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
故答案为:4I-+O2+4H+=2I2+2H2O.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;探究物质的组成或测量物质的含量;制备实验方案的设计.
考点点评: 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应滴定中利用关系式进行的计算.1年前查看全部
- 今年4月20日四川雅安地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的
今年4月20日四川雅安地震后,为了预防疫情,防疫人员使用了各种消毒剂对环境进行消毒.亚氯酸钠(NaClO2)是一种重要的消毒剂.试计算:
(1)亚氯酸钠中Cl元素的化合价是______.
(2)亚氯酸钠的相对分子质量是______.
(3)亚氯酸钠中Na、Cl、O三种元素的质量之比为______. zeaphson1年前1
zeaphson1年前1 -
 阿纳尔汗 共回答了14个问题
阿纳尔汗 共回答了14个问题 |采纳率85.7%解题思路:(1)根据在化合物中正负化合价代数和为零进行解答.
(2)依据相对分子质量等于各元素原子相对原子质量之和分析解答.
(3)依据元素的质量比等于其相对原子质量和的比分析判断.根据在化合物中正负化合价代数和为零,钠元素的化合价为+1,氧元素的化合价为-2,设亚氯酸钠(NaClO2)中氯元素的化合价为x,则:(+1)+x+(-2)×2=0,解答x=+3.
(2)亚氯酸钠的相对分子质量是23+35.5+16×2=90.5;
(3)由于元素的质量比等于其相对原子质量和的比,所以亚氯酸钠中Na、Cl、O三种元素的质量之比为23:35.5:16×2=46:71:64;
故填:(1)+3;(2)90.5;(3)46:71:64.点评:
本题考点: 有关元素化合价的计算;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 此题是有关化学式意义及应用的考查,解题的关键是掌握化学式相关的基本计算和溶液的基本计算,属基础性知识考查题.1年前查看全部
- 氯气氧化亚氯酸钠(氮气保护下)制二氧化氯的化学方程式及其优点是什么?
 土口木二1年前1
土口木二1年前1 -
 萧夜思 共回答了24个问题
萧夜思 共回答了24个问题 |采纳率87.5%2NaClO2+Cl2=2ClO2↑+2NaCl ,此法优点是ClO2产率高、质量好,无氯气杂质.1年前查看全部
- 亚氯酸钠与硫代硫酸钠反应方程式究竟哪个是对的啊
 熨帖1年前3
熨帖1年前3 -
 hlhnxzf 共回答了22个问题
hlhnxzf 共回答了22个问题 |采纳率86.4%亚氯酸钠强氧化性
将Na2S2O3氧化为Na2SO4
2NaClO2 +Na2S2O3+H2O= 2NaCl + Na2SO4 +H2SO41年前查看全部
- 亚氯酸钠与盐酸反应方程式
 salooloo1101年前1
salooloo1101年前1 -
 勇气天秤 共回答了16个问题
勇气天秤 共回答了16个问题 |采纳率93.8%5NaClO2 + 4HCl = 4ClO2 + 5NaCl + 2H2O1年前查看全部
- 亚氯酸钠与水反应的方程式?
 baobao10301年前3
baobao10301年前3 -
 cookise01 共回答了13个问题
cookise01 共回答了13个问题 |采纳率100%好像没有亚氯酸钠
只有次氯酸钠··
如果能够反应 应该是水解
clo- + h+= hclo
因为它是弱酸的盐1年前查看全部
- 硫酸氢钠和亚氯酸钠反映的方程式
 小熊20001年前1
小熊20001年前1 -
 gjj1975 共回答了18个问题
gjj1975 共回答了18个问题 |采纳率66.7%这里我写不出来,生成物是硫酸钠和亚氯酸.
如果亚氯酸像次氯酸一样不稳定,那么也有分解的.1年前查看全部
- CO2通入亚氯酸钠(NaClO2)制取二氧化氯的化学方程式
 观沙漠玫瑰1年前5
观沙漠玫瑰1年前5 -
 夜来香34 共回答了20个问题
夜来香34 共回答了20个问题 |采纳率90%亚氯酸钠(NaClO2)发生了歧化反应,CL由原来+3价变为一个-1,一个+4
2CO2+ 5NaClO2 ==NaCl+4ClO2+2Na2CO31年前查看全部
- 亚氯酸钠和硫酸分步反应方程式
 bofan_1191年前1
bofan_1191年前1 -
 IciIvi 共回答了16个问题
IciIvi 共回答了16个问题 |采纳率87.5%据我推算:
NaClO2+H2SO4===NaHSO4+HClO2
4HClO2===3 ClO2 + 1/2 Cl2 + 2H2O
第二个方程式是绝对正确的(见高等教育出版社 无机化学第四版下P477),第一个方程式是我推出来的,根据酸的解离常数,亚氯酸是1.1*10^-2,硫酸是二级解离常数是1.02*10^-2,也是就是说酸的强弱是硫酸>亚氯酸>硫酸氢根,所以推出的生成硫酸氢钠和亚氯酸.
希望能对你有所帮助.1年前查看全部
- 二氧化氯与双氧水氢氧化钠制亚氯酸钠的方程式
 杀了我去喂猪1年前1
杀了我去喂猪1年前1 -
 blue_spray 共回答了23个问题
blue_spray 共回答了23个问题 |采纳率87%2ClO2+2NaOH+H2O2==2NaClO2+2H2O+O21年前查看全部
- 亚氯酸钠水溶液的酸碱性pH值是多少只需 酸碱性 定性地分析
 ╃北风之神╃1年前1
╃北风之神╃1年前1 -
 anan80 共回答了18个问题
anan80 共回答了18个问题 |采纳率77.8%亚氯酸是弱酸,亚氯酸钠是强碱弱酸盐,其水溶液水解呈碱性1年前查看全部
- 请问,1%亚氯酸钠和1%次氯酸钠水溶液,ph值为6.5-7.5时,哪种更加稳定?
 hóηèУ1年前1
hóηèУ1年前1 -
 liuweiff 共回答了13个问题
liuweiff 共回答了13个问题 |采纳率100%1%亚氯酸钠很稳定1年前查看全部
- 用氯酸钠能制亚氯酸钠吗?如果能怎样制作?
 ccgzxrczr1年前1
ccgzxrczr1年前1 -
 Yang_Orpheus 共回答了19个问题
Yang_Orpheus 共回答了19个问题 |采纳率94.7%应该不可以,因为氯酸钠的氧化性比亚氯酸钠弱,加热只会生成高氯酸钠.不过如果加入强还原剂的话(例如非金属还原剂)应该可以的.1年前查看全部
- 将三氯化氮与亚氯酸钠按物质的量之比1:6混合,在溶液中恰好生成ClO2 写出该反应的离子方程式
 tinyball1年前1
tinyball1年前1 -
 wersdfasdf 共回答了19个问题
wersdfasdf 共回答了19个问题 |采纳率94.7%NCl3+6ClO2-+3H2O═6ClO2+3Cl-+3OH-+NH31年前查看全部
- 过氧化钠与亚氯酸钠反应的离子方程式有吗?
 江西妹子_ff1年前1
江西妹子_ff1年前1 -
 孤空影 共回答了20个问题
孤空影 共回答了20个问题 |采纳率90%2ClO2+Na2O2+2H2O==2NaClO2+2H2O+O2
生成物不会和反应物反应的
错了也有可能,我这是推论,过氧化钠与水反应实际上分两步,第一步生成氢氧化钠与过氧化氢1年前查看全部
- 请问盐酸和亚氯酸钠起反应会生成什么及化学公式
 故事里的人1年前3
故事里的人1年前3 -
 心空如我 共回答了24个问题
心空如我 共回答了24个问题 |采纳率91.7%氯气1年前查看全部
大家在问
- 1关于工程热力学中熵的问题熵的定义式ds=&q\T(微元热量q前那符号打不出来,就是那个小写dert),书上说这个式子必须
- 2焓变和熵变都大于零时 为什么温度越高 反应能自发进行
- 3属于西半球的地区是?A撒哈拉以南的非洲B西欧C东南亚D拉丁美洲
- 4三棱柱的底面积怎样求?拜托了各位 谢谢
- 5人教版八年级下册英语练习册(新目标)的答案啊,
- 6硬脂酸与软脂酸结构简式
- 7软脂酸和硬脂酸的区别
- 8-8开3次方在复数域上共有几个值 8开3次方在复数域上共有几个值
- 9硫化亚铁和硫化铁在水中的沉淀溶解平衡方程式?
- 10硫酸银为什么溶于硝酸呢?
- 11人教版七年级下册英语配套练习册答案及题目
- 12人教版七年级下册英语练习册答案
- 13软脂酸和硬脂酸的区别是什么?
- 14斜面长s=10m,髙h=4m,用沿斜面方向的推力F将一个重为100N的物体由斜面底端A匀速推到顶端B,要快啊!
- 15怎么判断丙烯里面有甲基.知道要构成双键,但是后来就凑吗?