焓变和熵变都大于零时 为什么温度越高 反应能自发进行
 Resen2022-10-04 11:39:541条回答
Resen2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 嘉言懿行 共回答了19个问题
嘉言懿行 共回答了19个问题 |采纳率94.7%- 吉布斯函数变
ΔG=ΔH-TΔS
G<0反应即能自发 - 1年前
相关推荐
- 标准摩尔燃烧焓变都小于等于零,为什么?
 有点呛鼻的金桔1年前1
有点呛鼻的金桔1年前1 -
 faeriesnow 共回答了17个问题
faeriesnow 共回答了17个问题 |采纳率88.2%试问:当物体燃烧事你是感到热还是冷?当然是热,因为燃烧反应体系对外放出热量.同是反应体系自身能量减少,所以焓变是是负值啊1年前查看全部
- MgSO4的水合焓变硫(VI)酸镁的水合焓变
 正牌绝代香蕉1年前2
正牌绝代香蕉1年前2 -
 半坡小文 共回答了20个问题
半坡小文 共回答了20个问题 |采纳率80%硫(VI)酸镁的水合焓变:102.99 kJ/mol1年前查看全部
- 同一反应,无论是以恒压途径还是以恒容途径完成,其反应的焓变不变,热力学能的改变量也不变,
同一反应,无论是以恒压途径还是以恒容途径完成,其反应的焓变不变,热力学能的改变量也不变,
恒压途径的焓变和恒容途径的焓变是不一样的呀? kgjkdf431年前1
kgjkdf431年前1 -
 zirui1 共回答了11个问题
zirui1 共回答了11个问题 |采纳率100%因为H和U均是状态函数,状态函数只与初终态有关,而与过程无关.
例如,温度T是状态函数,
1、将水从20度(初态)降温到10度,再由10度升温到90度(终态),温度的初终态变化是90-20=70度;
2、同样将水从20度(初态)升温到50度,再由50度降温到30度,再由30度升温到90度(终态),这时初终态的温度差仍然是90-20=70度.
焓或者热力学能一样,是体系的状态函数,只要初终态一样,它的改变值是相同的,不管经过了什么过程,同温度一样的道理.1年前查看全部
- 恒容条件下焓变也是等于反应热吧?忽略非体积功.恒容状态不做体积功,此时反应热即为内能变即为焓变.
 tsaito1年前1
tsaito1年前1 -
 zgy998 共回答了32个问题
zgy998 共回答了32个问题 |采纳率84.4%因为dH=dU+d(pV),恒容下,体积不变,但是压强呢?压强是有可能改变的,所以其反应热并不一定是等于焓变的,
所以 恒容条件下,焓变是不等于反应热的1年前查看全部
- 恒温恒容条件下反应热等于什么?焓变等于什么?
 傻傻滴琼1年前1
傻傻滴琼1年前1 -
 旷野里的紫云英 共回答了20个问题
旷野里的紫云英 共回答了20个问题 |采纳率80%有恒压反应热和恒容反应热两种,看你指哪种!封闭体系,非体积功为零时,恒压反应热等于反应焓变,恒容反应热也等于反应焓变! 百科有很多错 ..1年前查看全部
- 热化学方程式后面的焓变应该怎么求?再举个小例子什么的哈
 红嫁衣1年前2
红嫁衣1年前2 -
 墨墨moon 共回答了14个问题
墨墨moon 共回答了14个问题 |采纳率92.9%举个例子啊 H2(g)+CL2(g)=2HCL(g) ΔH=K KJ/mol
有两种求法
(1) 已知反应物能量 生成物能量
就用生成物总能量-反应物总能量
(2) 已知反应物生成物键能
就用反应物键能-生成物键能(注意和上边是反着的)
H-H键 a kj H-CL b kj cl-cl c kj
可知反应物中各有1molH-H CL-CL 生成物中有2molH-CL
则ΔH=a+b-2c1年前查看全部
- 焓变是化学反应开始和结束时表现出来的能量变化值,这句话对么?
 angeltree1年前1
angeltree1年前1 -
 一到天黑就困 共回答了21个问题
一到天黑就困 共回答了21个问题 |采纳率90.5%可以这么说,反应热加上体积功就是能量变化的总值了吧1年前查看全部
- 燃烧热△H与焓变△H有何关系
 石头城下1年前3
石头城下1年前3 -
 云草 共回答了22个问题
云草 共回答了22个问题 |采纳率95.5%燃烧热是指1摩尔反应物生成稳定化合物的反应热 焓变是指反应热 即生成物减反应物 焓变包括燃烧热 焓变范围大 而燃烧热范围小1年前查看全部
- 反应热与焓变、燃烧热、中和热什么关系?
反应热与焓变、燃烧热、中和热什么关系?
高二化学鲁科版第一章第一节讲的反应热Q,可是课本上并没有给出反应热Q的单位,请问Q的单位是焦耳,还是 j/moL?另外,当说反应热为某一数值的时候?这一数值是否和△H一样 包含正负号? qwertyu0021年前2
qwertyu0021年前2 -
 龙华 共回答了23个问题
龙华 共回答了23个问题 |采纳率91.3%焓变就是一个过程(比如化学反应,相变(水蒸发之类的)等)前后放热吸热的多少,单位J/mol,当然单位不一定,但一定是每摩尔.对于气体,反应前后体积变化就会做功的,还要加上pV.所以焓变H=Q+pV
反应热Q就是上面那个Q,只不过特指化学反应里的热变化
燃烧热、中和热都是反应热的一种,前者指物质燃烧放的热,后者指酸碱中和放的热
至于他们的单位,因为只有单位物质的量的反应热能表征,不然东西多自然放热多,所以一般都是每mol.
正负号是要带的,放热为负(自身能量减少)1年前查看全部
- 焓变的单位的理解?、RT
 97821031年前1
97821031年前1 -
 oudox 共回答了16个问题
oudox 共回答了16个问题 |采纳率93.8%每mol反应的反应热.例如:C(s)+O2(g)=CO2(g) △=-AKJ/mol,表明1molC(s)和1molO2(g)完全反应放出的热量是AKJ1年前查看全部
- 判断反应方向是由焓变和熵变共同决定是否正确?
 anyejue1年前2
anyejue1年前2 -
 藤原爱理 共回答了16个问题
藤原爱理 共回答了16个问题 |采纳率93.8%可以.
判断方向可以用熵判据或者Gibbus自由能判据.
而Gibbs自由能判据可以由熵焓关系来表示
G变化=H变化-(TS)变化.
所以也可以说焓变和熵变共同决定了反应方向.1年前查看全部
- 改变体系温度,化学反应焓变会受到影响吗?
 被套19961年前1
被套19961年前1 -
 njboya 共回答了22个问题
njboya 共回答了22个问题 |采纳率77.3%应该会受影响,因为体系的温度改变可能引起反应物和生成物的状态发生变化,而反应物、生成物的状态发生变化就一定伴随着放热或吸热,这些能量的变化就会影响化学反应的焓变.例如2H2(g)+O2(g)=2H2O (l)与2H2(g)+O2(g)=2H2O (g)的焓变就不同,由气态水到液态水的焓变为-44kJ/mol.1年前查看全部
- 下面这句话对吗化学反应中的焓变仅含化学键的断裂和形成的能量变化
 jackcall9121年前3
jackcall9121年前3 -
 wbljsxx 共回答了23个问题
wbljsxx 共回答了23个问题 |采纳率87%不对
焓变是能量变化的表示方法.
还包括状态的变化等1年前查看全部
- 焓变是否与温度有关 (反应热)
 一笑_881年前1
一笑_881年前1 -
 香水百合8301 共回答了17个问题
香水百合8301 共回答了17个问题 |采纳率100%是的,只有温度才能引起焓变的变化.1年前查看全部
- 生成物谁更稳定,顺便也说一下.氯气和溴蒸汽分别与氢气反应.氯气的反应热大于溴蒸汽的反应热,请从活泼性,焓变,断键等角度来
生成物谁更稳定,顺便也说一下.氯气和溴蒸汽分别与氢气反应.氯气的反应热大于溴蒸汽的反应热,请从活泼性,焓变,断键等角度来解说
 跑不mm的人1年前2
跑不mm的人1年前2 -
 344970720 共回答了22个问题
344970720 共回答了22个问题 |采纳率86.4%HCl比HBr稳定 ,前者焓变低于后者(二者的焓变均小于0),前者的键能高于后者断键更不容易因此更稳定1年前查看全部
- 如何判断一个化学反应是吸热还是放热(仅通过化学方程式,不算焓变)
如何判断一个化学反应是吸热还是放热(仅通过化学方程式,不算焓变)
哪一类反应一定吸热放热 shy_dudu1年前1
shy_dudu1年前1 -
 可琳可怜 共回答了14个问题
可琳可怜 共回答了14个问题 |采纳率100%放热:化合反应、燃烧、中和、金属和酸反应、生石灰和水反应、糖类和脂肪在人体内的氧化.
吸热:分解反应、铵盐和碱反应.1年前查看全部
- 是否存在焓变为零的化学反应?化学反应的反应物的总能量一定不等于生成物的总能量吗?为什么?能否从理论上给出解释?
 smallnandy1年前2
smallnandy1年前2 -
 且行且珍惜wf 共回答了17个问题
且行且珍惜wf 共回答了17个问题 |采纳率88.2%化学反应分两种:一种是放热反应,另一种是吸热反应~化学反应一定伴随的有能量变化,就相当于反应的动力;另一种解释更通俗,就是没有每MOL所含能量相等的两种物质~1年前查看全部
- 反应热与焓变有区别吗
 titiben1年前1
titiben1年前1 -
 riverloveyuki 共回答了26个问题
riverloveyuki 共回答了26个问题 |采纳率80.8%焓是一个状态函数也就是说系统的状态一定,焓的植也就一定.焓的定义式是这样的:H=U+PV,U是系统的内能,P是外界的压力,V是系统的体积.
反应热是当PV一定时,U即内能的改变量.1年前查看全部
- 焓变和反应热的区别
 199279471年前2
199279471年前2 -
 hh1225 共回答了23个问题
hh1225 共回答了23个问题 |采纳率95.7%我们研究的反应热通常有两种:等容反应热和等压反应热.等容过程反应的热效应(Qv)等于反应的内能变化(ΔU);等压过程反应的热效应(Qp)等于反应的焓变(Δ1年前查看全部
- 中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是 [ ] A.利用焓变
中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是 [ ] A.利用焓变
中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是
[ ]
A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行
B.利用反应热数据的大小判断不同反应的反应速率的大小
C.利用沸点数据推测将一些液体混合物分离开来的可能性
D.利用溶液的pH与7的大小关系,来判断任何温度下溶液的酸碱性 hao11291年前1
hao11291年前1 -
 ii一小时 共回答了7个问题
ii一小时 共回答了7个问题 |采纳率100%C是正确的,可以用蒸馏分开,沸点要差大约30度以上才可较为准确的分离
A需要焓变和熵增共同判断
B反应热大小反映的是反应过程中吸收还是放出的热量,反应速率取决于浓度,压强,温度,催化剂,和反应热没什么太大关系
D任何温度下,水的解离常数,也就是kw是不一样的,温度越高,kw越大,酸碱性是判断PH和根号下kw值的大小,只不过常温下kw等于10的-7次罢了1年前查看全部
- 焓变和熵变分别是怎么算的,是反应物减生成物,还是生成物减反应物?
 shipuqaz1年前2
shipuqaz1年前2 -
 xiangandfish 共回答了12个问题
xiangandfish 共回答了12个问题 |采纳率91.7%焓变是生成物与反应物的焓值差.作为一个描述系统状态的状态函数,焓变没有明确的物理意义.ΔH(焓变)表示的是系统发生一个过程的焓的增量.ΔH=ΔU+Δ(pV) 在恒压条件下,ΔH(焓变)可以表示过程的热力学能变 焓变是制约化学反应能否发生的重要因素之一,另一个是熵变.熵增焓减,反应自发; 熵减焓增,反应逆向自发; 熵增焓增,高温反应自发; 熵减焓减,低温反应自发
对于化学反应而言,若反应物和产物都处于标准状态下,则反应过程的熵变,即为该反应的标准熵变.当反应进度为单位反应进度时,反应的标准熵变为该反应的标准摩尔熵变,以△rSm表示.与反应的标准焓变的计算相似,化学反应的标准摩尔熵变,可由生成物与反应物的标准熵求得.1年前查看全部
- 为什么理想气体焓变H只与温度有关?
 hnqjzh851年前2
hnqjzh851年前2 -
 最爱扬帆 共回答了23个问题
最爱扬帆 共回答了23个问题 |采纳率95.7%因为H=U+PV,对于理想气体,U只与温度有关,在等温条件下,PV=NRT,所以,H=U(T)+NRT,不难看出,理想气体焓变只与温度有关1年前查看全部
- 弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于焓变,那强酸强碱电离不也吸热,
弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于焓变,那强酸强碱电离不也吸热,
为什么中和热不会小于焓变 NO1杀虫剂1年前1
NO1杀虫剂1年前1 -
 I-AM-CICIYOUNG 共回答了23个问题
I-AM-CICIYOUNG 共回答了23个问题 |采纳率91.3%强酸强堿本身就已经是离子的形态,请问在反应过程中你还要电离什麼?请你搞清楚这里说的电离是什麼时候的电离.背东西不是死记硬背的,你们老师难道叫你们背的时候没教过你们吗?1年前查看全部
- 任何条件下的热效应都是焓变?任何条件下的热效应都是焓变 这句话对吗
 asdfsafdsg1年前1
asdfsafdsg1年前1 -
 丁凡11 共回答了13个问题
丁凡11 共回答了13个问题 |采纳率100%这句话不对.即通常所说的焓变是指等压热效应.
化学反应的热效应即反应热,等于焓变的条件是:
1、等温,等压,只作膨胀功时:
Qp = △H
2、等温,等容,只作膨胀功时:
Qv = △U
此时不等于焓变,等于热力学能(内能).1年前查看全部
- 与化学反应焓变的测定有关的论文?要中英文对照的 那个哥哥姐姐知道赏笑的一篇
 南飞雁1年前1
南飞雁1年前1 -
 哈达姆 共回答了21个问题
哈达姆 共回答了21个问题 |采纳率85.7%化学反应焓变的测定摘要:化学反应过程中,除了发生物质的变化外,常伴有能量的变化,化学反应热在化工生产上有着十分重要的意义,本文中设计了采用热量计,量筒等建议装置测定五水合硫酸铜与锌粉的反应热,结果表明:该实...1年前查看全部
- 反应的热效应与焓变有啥区别?
 雾斯往1年前2
雾斯往1年前2 -
 haifeng1025 共回答了19个问题
haifeng1025 共回答了19个问题 |采纳率94.7%热效应概述
指物质系统在物理的或化学的等温过程中只做膨胀功的时所吸收或放出的热量.根据反应性质的不同,分为燃烧热、生成热、中和热、溶解热等.
在等温度过程中,体系吸的热.因过程不同,有反应热(如生成热、燃烧热、分解热与中和热)、相变热(如蒸发热、升华热、熔化热)、溶解热(积分溶解热、微分溶解热)、稀释热等.等容过程的热效应,称等容热效应[isochoric heat(ing) effect];等压过程的称等压热效应[isobaric heat(ing) effect].化学反应、相变过程等一般是在等压条件下进行的,故手册中列出的有关数据,一般是等压热效应.由于这些过程一般不伴随其他功(只有体积功),等压热效应就等于体系焓的增量,用符号△H表示
焓变是dh
在热力学中,我们直接把(U+pV)定义为焓(H),△H=△U+p△V.U是物质的内能.而焓变不一定是放出能量!它可以小于0也可以大于0.它是体系内能的变化与等压体积功之和.
焓变还有个公式是:∑H(生成物)-∑H(反应物)=△H这个公式就很好理解1年前查看全部
- 求助,原电池能量的焓变和电子转移的关系
求助,原电池能量的焓变和电子转移的关系
Zn + Cu2+ === Cu + Zn2+ H==-216.8KJ/mol 若设计成原电池,则每反应1摩尔有216.8kj化学能转换成电能,但同时转移了2mol电子,二者有何定量关系 石子湖1年前2
石子湖1年前2 -
 jerry412 共回答了12个问题
jerry412 共回答了12个问题 |采纳率91.7%A、1摩尔锌置换出1摩尔Cu2+ 时会放出216.8kj,这能量是化学能,原电池是将化学能转化成电能的工具.
B、根据电极反应,我们知道按照你所写的方程式写电极反应,可知当转移了2mol电子电子,也就是1摩尔锌置换出1摩尔Cu2+ .
C、216.8kj化学能转换成电能,和转移了2mol电子,说的便是一个反应的两种表示方法 .所以216.8kj化学能转换成电能,和转移了2mol电子,是等量关系1年前查看全部
- 请问绝热的刚性容器中,发生2H2(g)+ O2(g) —2H2O(g)反应的焓变小于零么?
请问绝热的刚性容器中,发生2H2(g)+ O2(g) —2H2O(g)反应的焓变小于零么?
一般我们认为放热反应焓变都小于零,但那是对反应本身而言的,而且应该是在恒压条下。对该系统而言,△H=△U+△(PV),由于△U=0,所以△H= △(PV)=V△P,又由于该反应放热,系统的压力会升高,于是△H>0 ? 对于有化学反应发生的体系,可以这样算么?
烦请各位高人指点……谢谢
 电电101年前1
电电101年前1 -
 我是于楠 共回答了14个问题
我是于楠 共回答了14个问题 |采纳率92.9%不行 气体分子数减少压力减小 温度升高压力增大 总的效果无法判断~1年前查看全部
- 焓变小于0一定是放热反应,已知某反应的焓变小于0,下列叙述正确的是A该反应一定是放热反应B该放映一定是吸热反应C该反应反
焓变小于0一定是放热反应,
已知某反应的焓变小于0,下列叙述正确的是
A该反应一定是放热反应
B该放映一定是吸热反应
C该反应反应物的总能量一定大于生成物的总能量
D该反应生成物的总能量一定大于反应物的总能量
单选 不做大多数1年前3
不做大多数1年前3 -
 yh_2006 共回答了21个问题
yh_2006 共回答了21个问题 |采纳率85.7%要是一定要单选的话就选C,说明这题出的比较偏,认为反应后的能量不光是按我们通常说的以热量形式放出,可能以光能或其他能量形式放出1年前查看全部
- 试利用298K时下述反应焓变的实验数据,计算再次温度下
 7093942k1年前1
7093942k1年前1 -
 xianjuzi 共回答了27个问题
xianjuzi 共回答了27个问题 |采纳率92.6%-393.5-(-283.0)=-110.5kJ/mol1年前查看全部
- 我想请问一下说某温度某压力下的焓变为0实际是没有意义的吗?焓变值一样吗?
 纯水布衣1年前1
纯水布衣1年前1 -
 vison511 共回答了16个问题
vison511 共回答了16个问题 |采纳率93.8%因为在变温、变压力过程当中,本身存在焓变,其焓变就不完全是化学反应的了.
某温度某压力下的焓变为0,△H=△U+Pv,即没有能量的流入流出,或者得失相等.1年前查看全部
- 焓变指的是H(反应产物)—H(反应物)可是为什么又会等于反应前物质的总键能减去反应后的物质的总键能?
焓变指的是H(反应产物)—H(反应物)可是为什么又会等于反应前物质的总键能减去反应后的物质的总键能?
ΔH=H(反应产物)—H(反应物)
ΔH=反应物总键能— 生成物总键能
焓和键能是什么关系?
为什么两式的减数被减数不是相同的? longson6681年前4
longson6681年前4 -
 wuquyang 共回答了17个问题
wuquyang 共回答了17个问题 |采纳率88.2%前辈你说你,好好地不问me跑这里来了,这个me真的知道
me不知道的前辈每次都问得死死地不肯放,me知道的前辈又不来问me
前辈让me情何以堪如何是好呐
反应物断键吸收能量即为反应物的键能,生成物成键释放能量即为生成物的键能
不懂前辈再来问me好了,给前辈举个例子就会懂了,这里说太麻烦1年前查看全部
- 熵变与焓变的比较,有什么区别?
 呆萌她二叔1年前1
呆萌她二叔1年前1 -
 zjnbsjl 共回答了21个问题
zjnbsjl 共回答了21个问题 |采纳率95.2%熵变是指体系混乱程度的变化,熵变为正值说明体系的混乱程度增加,熵变为负值说明混乱程度减小.焓变是指体系内能的变化,焓变为正值说明反应放热体系能量减小,焓变为负值说明反应吸热体系能量增加.△G=△H-t△S,△H表示焓变,△S表示熵变,△G表示体系自由能,t表示温度.1年前查看全部
- 反应A(g)+B(g)⇌C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是(
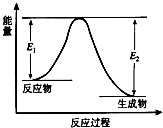 反应A(g)+B(g)⇌C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( )
反应A(g)+B(g)⇌C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( )
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少 zhjingou1年前1
zhjingou1年前1 -
 大QQ泡泡糖 共回答了20个问题
大QQ泡泡糖 共回答了20个问题 |采纳率85%解题思路:由图象可知反应物总能量大于生成物总能量,应为放热反应,加入催化剂可减小反应的活化能,但对反应热无影响,升高温度,平衡向逆反应方向移动.A.反应体系中加入催化剂,反应速率增大,E1、E2都减小,故A错误;
B.应体系中加入催化剂,活化能降低,反应速率增大,△H不变,故B正确;
C.反应物总能量大于生成物总能量,△H<0,反应达到平衡时,升高温度,平衡向逆反应方向移动,A的转化率减小,故C错误;
D.反应物总能量大于生成物总能量,△H<0,故D错误.
故选B.点评:
本题考点: 反应热和焓变;化学平衡的影响因素.
考点点评: 本题考查较为综合,涉及化学反应与能量的变化以及影响化学平衡的因素,注意根据图象判断反应物总能量与生成物总能量的关系,注意催化剂对反应的影响,题目难度不大.1年前查看全部
- 根据焓变=反应产物的焓减去反应物的焓和 焓变=反应中断裂旧化学键的键能减去形成新化学的键能
根据焓变=反应产物的焓减去反应物的焓和 焓变=反应中断裂旧化学键的键能减去形成新化学的键能
一个是生成物减反应物一个是反应物减生成物.怎么用啊 猪有饭1年前2
猪有饭1年前2 -
 yangchengwen 共回答了21个问题
yangchengwen 共回答了21个问题 |采纳率95.2%第一个就是生成物的总能量减去反应物的总能量 (把焓变理解成总能量)
第二个就是反应物的每个原子之间的键能减去生成物之间的键能
这个键能指的是断开这个键需要的能量,就好像把每个原子全拆开再重新组合1年前查看全部
- 化学反应可以讲一摩尔?热化学方程式焓变为什么单位是kj/mol,难道方程式还可以讲1mol反应?
 无花瓶1年前3
无花瓶1年前3 -
 小小虾米123 共回答了25个问题
小小虾米123 共回答了25个问题 |采纳率84%反应是不能用摩尔来度量的,这里的1摩尔是指反应物的量,热化学方程式中的焓变是指1摩尔某反应物发生该反应所产生的热效应,比较热效应需要反应物的物质的量相同,就如同比较密度可以比较一定体积的两种物质的质量1年前查看全部
- 化学反应的热量变化 比较时 是比较焓变大小 带着正负号比
 becauseofyao1年前1
becauseofyao1年前1 -
 maohuatao 共回答了25个问题
maohuatao 共回答了25个问题 |采纳率96%若是比较△H的大小,就带着正负号比,若是说比较其数值则只比绝对值1年前查看全部
- 下列有关说法正确的是( )A.焓变大于零的反应一定不能自发进行B.熵判据可作为判断反应进行方向的唯一判据C.综合考虑焓
下列有关说法正确的是( )
A.焓变大于零的反应一定不能自发进行
B.熵判据可作为判断反应进行方向的唯一判据
C.综合考虑焓判据和熵判据的复合判据,更适用于所有的过程
D.根据过程的自发性,不仅能判断过程的方向,也能确定过程是否一定会发生和过程发生的速率 xueshengbi1年前1
xueshengbi1年前1 -
 070426 共回答了14个问题
070426 共回答了14个问题 |采纳率78.6%解题思路:反应自发进行的判断依据是△H-T△S<0,依据判断依据分析选项.A、△H>0、△S>0,△H-T△S不一定小于0,高温下自发进行,低温下不能自发进行,故A错误;
B、焓变熵变是共同决定反应自发进行的因素,故B错误;
C、综合考虑焓判据和熵判据的复合判据,更适用于所有的过程,故C正确;
D、根据过程的自发性,只能判断过程的方向,不能确定过程是否一定会发生和过程发生的速率,故D错误;
故选C.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的判断方法,注意焓变熵变是共同决定反应自发进行的因素,题目较简单.1年前查看全部
- 温度的变化量为零,焓变等于零 在什么情况下成立?
 唯一52013141年前1
唯一52013141年前1 -
 ababddy8 共回答了16个问题
ababddy8 共回答了16个问题 |采纳率81.3%理想气体,焓只是温度的函数1年前查看全部
- 下列叙述中,正确的是( )A.对于同一物质在不同状态时的熵值是:气态>液态>固态B.焓变小于0的反应肯定是自发的C.熵
下列叙述中,正确的是( )
A.对于同一物质在不同状态时的熵值是:气态>液态>固态
B.焓变小于0的反应肯定是自发的
C.熵变大于0的反应肯定是自发的
D.自发反应的反应速率肯定很快 千棵树21年前1
千棵树21年前1 -
 大大玲玲 共回答了21个问题
大大玲玲 共回答了21个问题 |采纳率100%解题思路:A、熵值是指混乱度,同一物质的不同状态熵值不同;
B、熵变不是决定反应能否自发的唯一条件;
C、焓变不是决定反应能否自发的唯一条件;
D、反应自发与否与反应速率无关.A、同一物质的固态、液态、气态的混乱度依次增大,故A正确;
B、△H-T△S<0的反应能够自发进行,仅仅是△H<0时,不一定自发,故B错误;
C、△H-T△S<0的反应能够自发进行,仅仅是△S>0时,不一定自发,故B错误;
D、反应自发进行只是一种可能,能否发生和反应速率有关,比如氢气与氧气反应生成水是自发过程,常温下几乎不反应,故D错误.
故选:A.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查反应自发进行的条件,△H-T△S<0时反应能够自发进行,题目难度不大.1年前查看全部
- 在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义
在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义
在恒温恒压条件下,ΔH(焓变)可以表示过程的热力学能变 那可逆反应中吸放热不到ΔH 这不是和定义不符了吗? 特种陶瓷1年前2
特种陶瓷1年前2 -
 gdlyj 共回答了16个问题
gdlyj 共回答了16个问题 |采纳率93.8%怎么类?可逆反应都伴有能量的消耗肯定不到△H啊1年前查看全部
- 化学反应焓变的测定
 力气显得1年前1
力气显得1年前1 -
 我只是想找人zz 共回答了22个问题
我只是想找人zz 共回答了22个问题 |采纳率90.9%实验法的话是用量热计,焓变数据一部分是用实验法测的(容易测量的反应)也有很多是靠盖斯定律计算得到.1年前查看全部
- 下列叙述中,不正确的是( )A. 在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行B. 升高温度会加快化学反应
下列叙述中,不正确的是( )
A. 在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行
B. 升高温度会加快化学反应速率,其原因是增加了活化分子的百分数
C. 青石棉的化学式为Na2Fe3Si8O22(OH)2,用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O
D. 红外光谱法可以确定物质相对分子质量 tt没我胡子长1年前1
tt没我胡子长1年前1 -
 xiaocao561 共回答了21个问题
xiaocao561 共回答了21个问题 |采纳率90.5%解题思路:A、依据反应自发进行的判断依据△H-T△S<0分析判断;
B、升高温度,分子能量增大,活化分子百分数增大;
C、依据化学式原子守恒和元素化合价代数和为0分析判断;
D、有机物结构确定的一般步骤是分离,提纯→元素定量分析→测定相对分子质量→波谱分析,用质谱法确定有机物的相对分子质量,红外光谱分析能通过有机物功能基团对红外光谱波长的吸收来判定其基团的类别.A、依据反应自发进行的判断依据△H-T△S<0分析,在相同条件下,焓变小于0△H<0,熵变大于0△S>0,△H-T△S<0,反应肯定能自发进行,故A正确;
B、升高温度,分子能量增大,活化分子百分数增大,故B正确;
C、依据化学式原子守恒和元素化合价代数和为0分析,用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O,青石棉的化学式为Na2Fe5Si8O22(OH)2,故C错误;
D、有机物结构确定的一般步骤是分离,提纯→元素定量分析→测定相对分子质量→波谱分析,用质谱法确定有机物的相对分子质量,红外光谱分析能通过有机物功能基团对红外光谱波长的吸收来判定其基团的类别,故D错误;
故选CD.点评:
本题考点: 焓变和熵变.
考点点评: 本题考查了反应自发进行的分析判断,化学式书写方法的理解化学反应速率影响因素,有机物结构确定的方法判断,题目难度中等.1年前查看全部
- 如何解释焓变熵变与可逆反应的关系
如何解释焓变熵变与可逆反应的关系
对于一个确定的反应(如N2+3H2=2NH3)吉布斯自由能ΔG=ΔH-TΔS中的ΔH和ΔS是确定的,如果反应在恒温恒压、不作非体积功条件下进行,那么ΔG是不变的,试问为什么有可逆反应?不知道哪个地方理解错了…… loveicexjl1年前1
loveicexjl1年前1 -
 roselover00 共回答了18个问题
roselover00 共回答了18个问题 |采纳率77.8%商增的话.会向气体分子少的方向进行,比如2H2+O2=2H2O,商增.就会向右进行,商减就会反之1年前查看全部
- 怎么样测定一个反应的焓变和熵变呢?
 看水库的1年前2
看水库的1年前2 -
 parine 共回答了20个问题
parine 共回答了20个问题 |采纳率85%反应的焓变可以通过测定恒温恒压下的热效应来达到,至于熵变还不太清楚.具体过程楼主可以参考《物理化学》1年前查看全部
- 定压的绝热压缩使气体温度升高是否存在焓变,
 11235831年前2
11235831年前2 -
 欧阳逍遥 共回答了18个问题
欧阳逍遥 共回答了18个问题 |采纳率94.4%在工程热力学理论中,定压过程与绝热过程是不同的两种过程,不是一回事,不能混为一谈.绝热压缩或膨胀过程熵不变,即等熵过程,但工质内的焓有变化.定压过程(等压过程)容积随温度变化,有焓变.1年前查看全部
- 反应焓变是用来描述与什么有关的能量变化的?
 roychen20061年前1
roychen20061年前1 -
 小小苯yy 共回答了18个问题
小小苯yy 共回答了18个问题 |采纳率94.4%当压强一定 焓变在数值上与热量变化一样1年前查看全部
- 容器中,A+3B=C+D,(全部为气体),反应焓变
 雨中散步19721年前1
雨中散步19721年前1 -
 seaboy91 共回答了16个问题
seaboy91 共回答了16个问题 |采纳率81.3%不对;此题很简单,由点类似数学题的做法,取D的物质的量的最大值与最小值,当D的物质的量取最小值d/3时,反应重新达到平衡消耗D的物质的量为d-d/3=2d/3,因为D消耗(生成)的量=A生成(消耗)的量,所以A有最大值a+2d/3~.而当D的物质的量取最大值3d时,D生成的量为3d-d=2d,所以A有最小值a-2d,所以A取值范围为a-2d1年前查看全部
大家在问
- 1属于西半球的地区是?A撒哈拉以南的非洲B西欧C东南亚D拉丁美洲
- 2三棱柱的底面积怎样求?拜托了各位 谢谢
- 3人教版八年级下册英语练习册(新目标)的答案啊,
- 4硬脂酸与软脂酸结构简式
- 5软脂酸和硬脂酸的区别
- 6谁有八年级下册英语配套练习册的答案?人教版
- 7请列举一个常见的化合反应(生成水的反应)
- 8关于工程热力学中熵的问题熵的定义式ds=&q\T(微元热量q前那符号打不出来,就是那个小写dert),书上说这个式子必须
- 9亚氯酸钠与硫代硫酸钠反应方程式
- 10-8开3次方在复数域上共有几个值 8开3次方在复数域上共有几个值
- 11硫化亚铁和硫化铁在水中的沉淀溶解平衡方程式?
- 12硫酸银为什么溶于硝酸呢?
- 13人教版七年级下册英语配套练习册答案及题目
- 14人教版七年级下册英语练习册答案
- 15软脂酸和硬脂酸的区别是什么?
