(2009•肥西县模拟)银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:2Ag+Zn(OH)2[充电/
 解婉婷2022-10-04 11:39:541条回答
解婉婷2022-10-04 11:39:541条回答A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn

已提交,审核后显示!提交回复
共1条回复
 萨达木 共回答了19个问题
萨达木 共回答了19个问题 |采纳率78.9%- 解题思路:在原电池中,负极反应是原子失电子发生氧化反应的过程.
在银锌二次电池中,根据反应:2Ag+Zn(OH)2[充电/放电]Ag2O+Zn+H2O,放电时为原电池,活泼金属做负极,失电子发生氧化反应,根据电极反应应为锌.
故选D.点评:
本题考点: 电极反应和电池反应方程式.
考点点评: 本题主要考查学生电极反应的书写,要抓住电极反应的特点和规律,才能解决此种问题. - 1年前
相关推荐
- (2009•肥西县模拟)在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g);△H=?符合下图(a
(2009•肥西县模拟)在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)⇌xC(g);△H=?符合下图(a)所示的关系,由此推断关于图(b)的说法正确的是( )
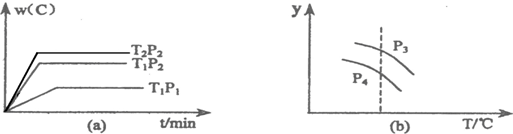
A.P3>P4,y轴表示A的转化率
B.P3<P4,y轴表示B的体积分数
C.P3>P4,y轴表示混合气体的平均相对分子质量
D.P3>P4,y轴表示混合气体的密度 jingjingl1年前1
jingjingl1年前1 -
 我心向往 共回答了11个问题
我心向往 共回答了11个问题 |采纳率100%解题思路:由图a可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,
由图b可知,升高温度,平衡向逆反应方向移动,y值减小,则y可为A、B的转化率、C的体积分数等,结合压强对平衡移动的影响分析.由图a可知,压强为P2时,温度T1先到达平衡,故温度T1>T2,且温度越高,平衡时C的质量分数越低,故升高温度平衡向逆反应移动,正反应为放热反应;
温度为T1时,压强P2先到达平衡,故压强P2>P1,且压强越大,平衡时C的质量分数越高,故增大压强平衡向正反应移动,正反应为体积减小的反应,故x=1,则:
A.P3>P4,在相同温度下增大压强平衡向正反应方向移动,则A的转化率增大,同时升高温度平衡向逆反应方向移动,A的转化率降低,图象与实际符合,故A正确;
B.P3<P4,增大压强,平衡向正反应移动,B的体积分数减小,同时升高温度平衡向逆反应方向移动,B的体积分数应增大,图象与实际不符,故B错误;
C.P3>P4,在相同温度下增大压强平衡向正反应方向移动,则气体的总物质的量减小,混合气体的总质量不变,平均相对分子质量增大,温度升高平衡向逆反应移动,混合气体总的物质的量增大,平均相对分子质量减小,图象与实际符合,故C正确;
D.混合气体的总质量不变,容器的体积不变,混合气体的密度不变,故D错误.
故选AC.点评:
本题考点: 转化率随温度、压强的变化曲线;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查化学平衡移动问题,侧重于学生的分析能力的考查,为高考常见题型,注意根据图a分析反应的特征为解答该题的关键,难度中等.1年前查看全部
- (2009•肥西县模拟)元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表
(2009•肥西县模拟)元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
根据以上信息,回答下列问题:… A B C D
(1)上述五种元素中电负性最大的是______.(填相关元素的元素符号)
(2)请写出E的电子排布式:______.
(3)A和D的氢化物中,沸点较高的是______ (填相关物质的分子式);其原因是______.
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式:______.
(5)D和B形成的化合物的水溶液的pH______7(填“>”、“=”、“<”),其原因是______(用离子方程式表示). wanli011年前1
wanli011年前1 -
 ee市昌厦建筑 共回答了16个问题
ee市昌厦建筑 共回答了16个问题 |采纳率93.8%解题思路:已知A、B、C、D、E五种元素都是元素周期表中前20号元素,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,为氢氧化铝与强碱、强酸的反应,由元素在周期表中的相对位置可知,C为Al元素,故B为Na元素、D为S元素、A为F元素,E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族,则E为Ca元素,据此解答.已知A、B、C、D、E五种元素都是元素周期表中前20号元素,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,为氢氧化铝与强碱、强酸的反应,由元素在周期表中的相对位置可知,C为Al元素,故B为Na元素、D为S元素、A为F元素,E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族,则E为Ca元素,
(1)同周期自左而右电负性呈增大,同主族自上而下电负性减小,故F元素的电负性最大,
故答案为:F;
(2)E为Ca元素,原子核外电子数为20,根据能量最低原理,其核外电子排布式为1s22s22p63s23p64s2,
故答案为:1s22s22p63s23p64s2;
(3)A和D的氢化物分别为HF、H2S,HF分子间存在氢键,HF的沸点较高,
故答案为:HF;HF分子间存在氢键;
(4)B、C的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应的离子方程式为:OH-+Al(OH)3=AlO2-+2 H2O,
故答案为:OH-+Al(OH)3=AlO2-+2 H2O;
(5)D和B形成的化合物为Na2S,其水溶液中S2-离子水S2-+H2O⇌HS-+OH-,破坏水的电离平衡,溶液呈碱性,即溶液pH>7,
故答案为:>;S2-+H2O⇌HS-+OH-.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查物质结构与性质,涉及元素化合物推断、电负性、氢键、盐类水解等,难度不大,推断元素是关键,氢氧化铝的性质是推断突破口.1年前查看全部
大家在问
- 1ab 之间有一条公路,全程需42分钟,车道总站后司机需要休息至少10分钟,接着掉头行驶,假如ab总站每八分钟发一班车(不
- 2随着秦岭终南山隧道的建成,西安至柞水的通行里程由146千米缩短为64.7千米,行车速度由原来的每小时45.5千
- 3ArcGIS中不同属性面之间的融合
- 4求帮写一篇英语作文要求如下4For this part ,you are required to write a let
- 5把一个上底四五厘米,下底是七厘米,高是五厘米的梯形纸板剪去一个最大的正方形,剩下的面积是多少平方厘米?
- 6向氯化铵溶液中投入一块金属铯,生成无色无味的气体 对吗
- 7她们为我准备了许多生日礼物 英语怎么说
- 8表达亲情而且含有亲字的古诗词名句(3句):
- 9这些是你的亲兄弟吗?用英语怎么说
- 10(-1)+2+(-3)+4.+(-99)+100
- 11什么是居里温度?
- 12有关世园会的英语作文
- 13To buy a car is better than renting a car 这个句子的后半句中 renting
- 14猴子为什么会站着走?3Q有缘再相见
- 15在括号里填入真正表达歇后语意思的字
