铀的转化率即铀的核能转化为电能的转化率?
 珍上工2022-10-04 11:39:541条回答
珍上工2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 c5450 共回答了16个问题
c5450 共回答了16个问题 |采纳率93.8%- 核电站和热电站只有一个环节不同,即核电站将核能转化为热能,而热电站是将化学能(煤、石油)转化为热能;其余能量的转化方式都是相同的,因此热电站的能量转化率可以类比到核电站中;一般热电站的能量转化率约为35%,那核电站的能量转化率也应该在35%左右.
- 1年前
相关推荐
- 转化率减小,体积分数为什么增大对于a+b可逆=c+d来说,为什么呢?
 wangxiaokai0211年前1
wangxiaokai0211年前1 -
 嗯猫咪 共回答了12个问题
嗯猫咪 共回答了12个问题 |采纳率100%abcd都是气体吗,还是有非气体.转化率减小意味着平衡向左,即反应物的体积分数增大1年前查看全部
- 化学反应转化率a+b=c,(可逆反应)1 0.2 0.8 a的转化率为20%,怎么求加入1molC,C的转化率为80%
 LZY194571年前1
LZY194571年前1 -
 威严急变 共回答了10个问题
威严急变 共回答了10个问题 |采纳率100%达到的最终平衡时一样的;
所以c加入1mol,生成a0.8mol,转化0.8mol,0.8/1=80%1年前查看全部
- 合成氨中,开始充入1mol氮气和2mol氢气,在一定条件下,反应达平衡,测得氨气占混合气体的25%,则平衡时氮气的转化率
合成氨中,开始充入1mol氮气和2mol氢气,在一定条件下,反应达平衡,测得氨气占混合气体的25%,则平衡时氮气的转化率是?
 泡泡xy1年前0
泡泡xy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 平衡常数k不变是否等同于反应物生成物转化率不变?
 gznongmin1年前1
gznongmin1年前1 -
 meiaokang 共回答了14个问题
meiaokang 共回答了14个问题 |采纳率71.4%不等同于,k只受温度的影响,我举个反例,合成氨加压不改变温度,故k不变,但由于加压反应物转化率提高了!1年前查看全部
- 2NO2(g)=N2O4(g),体积不变时,充入NO2,平衡正移,NO2的转化率增大
2NO2(g)=N2O4(g),体积不变时,充入NO2,平衡正移,NO2的转化率增大
充入N2O4,平衡逆移,NO2的转化率增大 抹不掉的尘1年前1
抹不掉的尘1年前1 -
 pscs28 共回答了20个问题
pscs28 共回答了20个问题 |采纳率100%2NO2(g)=N2O4(g),
举例,假如原来加入2molNO2.
平衡后,再加入2molNO2,则考虑压强增大.
因为新加入的2molNO2可以在另一个同样的容器中达到相同的平衡(等效).然后再把两个容器压到一个容器中,则平衡受压强增大的影响,所以NO2转化率增大.
同样,假如第二次加入1molN2O4,在另一个同样的容器中达到相同的平衡(等效).然后再把两个容器压到一个容器中,则平衡受压强增大的影响,所以NO2转化率增大.1年前查看全部
- 可逆反应A(s)+B(可逆符号)C达到平衡后,B的转化率与压强、温度的关系如图所示.下列说法正确的是
可逆反应A(s)+B(可逆符号)C达到平衡后,B的转化率与压强、温度的关系如图所示.下列说法正确的是
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
 redbeanpig1年前1
redbeanpig1年前1 -
 liujinwen001 共回答了17个问题
liujinwen001 共回答了17个问题 |采纳率88.2%A
B1年前查看全部
- 在体积不变的密闭容器中 ,冲入2mol二氧化氮和1mol 氧气 在一定条件下达到平衡时 一氧化氮的转化率为95%,此时容
在体积不变的密闭容器中 ,冲入2mol二氧化氮和1mol 氧气 在一定条件下达到平衡时 一氧化氮的转化率为95%,此时容器内压强与开始时的压强只比是小于2.05/3为什么是小于?
 hh之心空1年前1
hh之心空1年前1 -
 redapplelj 共回答了16个问题
redapplelj 共回答了16个问题 |采纳率75%2NO + O2 = 2NO2
起始:2 1
转化:2*95% 0.95 1.9
平衡:0.1 0.05 1.9
总物质的量=0.1+0.05+1.9=2.05mol
反应前=2+1=3mol
是否考虑:2NO=N2O4这个平衡,如果考虑的话,就应该是小于.否则应该是等于.1年前查看全部
- 反应mA(g)+nB(s)===pC(g)达到平衡 加入B(体积不变)A的转化率() B的转化率()添增或减
反应mA(g)+nB(s)===pC(g)达到平衡 加入B(体积不变)A的转化率() B的转化率()添增或减
B是气体,打错了 美丽的梦551年前2
美丽的梦551年前2 -
 227193661 共回答了20个问题
227193661 共回答了20个问题 |采纳率90%A的转化率不变,B的转化率减少.因为B是固体又体系已经平衡,B的增加不会使平衡向正反应方向进行,所以A的转化率不变.因为加入了B则B的转化率减少.1年前查看全部
- 一道高2化学平衡题 在线等哦~一定体积 2A=B+XC 温度不变,平衡后,体积增大P%,A的转化率也为P% ,求X
 Six06061年前1
Six06061年前1 -
 孔旦旦 共回答了21个问题
孔旦旦 共回答了21个问题 |采纳率81%设原有体积为a的气体A,则转化的A为P%*a,
(P%*a)/2*(1+X)为B与C总体积,
则有[(1-P%)*a+(P%*a)/2*(1+X)]/a=1+P%
即可解得1年前查看全部
- 可逆反应,转化率变了平衡就移动了,是否欠妥?
 我为绛衣来1年前1
我为绛衣来1年前1 -
 hzzveen6r 共回答了21个问题
hzzveen6r 共回答了21个问题 |采纳率90.5%平衡的特征:逆等动定变.其中定,就是指各组分浓度保持不变,因此剩余量和转化量保持不变,故转化率不变.若转化率发生改变,则证明其转化的浓度和剩余量发生改变,即破坏了定的含义,故平衡发生改变.1年前查看全部
- 如果在一个化学反应中,反应物本身的浓度减小了,则转化率如何变化
 asdffeew71年前2
asdffeew71年前2 -
 花香小镇 共回答了17个问题
花香小镇 共回答了17个问题 |采纳率82.4%具体问题具体分析.如果是有气相的反应并且是在化学平衡时因压力变低而导致反应物本身的浓度减小了,那么1、纯气相反应,转化率不变;2、气液或气固相反应转化率变低.如果反应物本身的浓度减小的原因是因为反应产物的被抽取其余条件不变,那么转化率变大.1年前查看全部
- 对于一个特定的化学反应,反应物按比例投料,是不是化学平衡常数越大,反应物的转化率越大呢?
 紫妱1年前5
紫妱1年前5 -
 titanman 共回答了19个问题
titanman 共回答了19个问题 |采纳率89.5%不是,在温度一定的条件下,一个反应的平衡常数是定值;但随着起始反应物浓度的不同,转化率不同;即转化率还与起始反应物浓度有关.
❤您的问题已经被解答~(>^ω^1年前查看全部
- 如图 第九题 压强不变 加入同比例的反应物不应该是转化率不变么?为什么平衡
如图 第九题 压强不变 加入同比例的反应物不应该是转化率不变么?为什么平衡
如图 高中化学选修4 第九题 求解释 压强不变 加入同比例的反应物不应该是转化率不变么?为什么平衡时C的浓度不变啊?

 凳徒子1年前1
凳徒子1年前1 -
 茶茶AA 共回答了20个问题
茶茶AA 共回答了20个问题 |采纳率70%因为要保证压强不变,那么A选项加入的反应物物质的量是原来的两倍,所以体积会变化呀,再加上等比例的,所以最后c物质的浓度当然不变.1年前查看全部
- 怎么求可逆反应的限度,及一种物质的转化率
怎么求可逆反应的限度,及一种物质的转化率
如题, 花痴kk1年前1
花痴kk1年前1 -
 冬日飘雪xq 共回答了20个问题
冬日飘雪xq 共回答了20个问题 |采纳率95%转化率等于转化的浓度除以初始浓度.
可逆反应不可能完全转化,也不可能不转化,所以剩余的浓度大于0小于初始浓度.1年前查看全部
- 可逆反应平衡时转化率为什么不变
 ss丛林1年前1
ss丛林1年前1 -
 邬艇 共回答了17个问题
邬艇 共回答了17个问题 |采纳率94.1%化学反应平衡是时个物质物质的量达动态平衡,不再变化,而转化率等于反应的物质的物质量比上该物质起始的物质量,索易平衡时转化率不再变化1年前查看全部
- 可逆反应的转化率问题增大一种反应物的浓度,可提高另一种反应物的转化率,但它本身的转化率反而降低.这是为什么?主要是"它本
可逆反应的转化率问题
增大一种反应物的浓度,可提高另一种反应物的转化率,但它本身的转化率反而降低.这是为什么?主要是"它本身的转化率反而降低"我不懂, lhp04131年前2
lhp04131年前2 -
 llxmaggie 共回答了22个问题
llxmaggie 共回答了22个问题 |采纳率95.5%转化率=转化量/初始量
如A+B=C
加入使A平衡向右,B的转化率变大.但是平衡是微弱的,A转化率分母增加的较多,所以降低
这个问题用"有效碰撞"理论来解释最为准确.
设可逆反应为:A(气)+B(气)+C+D
固定A的起始量,增大B的起始量.
显然,B的起始量越大,则每个B分子受到A分子碰撞的机率就越小.(鸟群中的每只鸟,要比独飞的鸟受到鹰攻击的机率更小)
而B的转化率与"单位时间内,单个B分子受到的有效碰撞次数成正比."
故B的起始量越大,B的转化率就越低.
奇妙的是,如果转变看问题的角度,B的起始量越大,则每个A碰撞到B的机率就越大,则A的转化率就越高.(鹰向鸟群冲刺比向单只鸟冲刺更易碰到鸟.当然,前提是鹰不要被鸟群吓倒,嘿嘿.)
这也就是说,提高哪种反应物的起始量,哪种反应物的转化率就会降低,而其他反应物的转化率就会升高.1年前查看全部
- co+H2o气体=H2+CO,773KS时,平衡常数为K,平衡时气体的总压力为P总,CO的转化率为a,则CO的平衡分压为
co+H2o气体=H2+CO,773KS时,平衡常数为K,平衡时气体的总压力为P总,CO的转化率为a,则CO的平衡分压为多少
 铁面游侠1年前1
铁面游侠1年前1 -
 xl121532 共回答了14个问题
xl121532 共回答了14个问题 |采纳率100%由于整个反应是属于等压反应,所以P总不改变
剩下的CO即为1-a(总量为1)
由于之前的压力为CO与H2O共有
所以反应后CO单独的分压应为1-a的一半
即:CO的平衡分压=1/2×(1-a)×P总1年前查看全部
- 初级消费者与次级消费者之间的的能量转化率为百分之多少?
 有壬kk1年前1
有壬kk1年前1 -
 井趴趴的幸福生活 共回答了21个问题
井趴趴的幸福生活 共回答了21个问题 |采纳率85.7%按照高中知识而言,无论哪一营养级,下一营养级与上一营养级的能量转化效率都在10%~20%之间,具体是多少无法确定,需要题目的暗示,如“最少需要的能量”则用的是最大能量转化效率20%,需要结合题目分析.不满意继续追问,1年前查看全部
- 关于转化率的问题.aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反
关于转化率的问题.aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反
aA+bB=cC+dD 恒温恒容中 (全是气体,可逆反应)
加入A,那么由于是恒容,C(A) 变大.反应向正反应移动,即B 的 转化率增大.那么A的转化率呢?
aA=bB+cC 中 若 a>b+c 那么加入A,由于压强增大,本应增大的体积没增大,跟减少体积一个道理.所以,促进正反应所以 转化率会提高.—————这是正确的.
所以,按理来 A的转化率 若 a+b>c+d 应该增加.
然后是我要问的部分
但是 A的转化率却减少,这是为什么? 网络改变了我1年前2
网络改变了我1年前2 -
 maigei1131 共回答了15个问题
maigei1131 共回答了15个问题 |采纳率86.7%大家都这一点不明白,关键是物质B,物质B,已经反应了一大部分,你加入A,哪来的物质B与之反应呢1年前查看全部
- 有关化学平衡与转化率的求助反应物用量的影响(恒温恒容条件下)若反应物不只一种,如:aA(g)+bB(g)可逆号c(C)+
有关化学平衡与转化率的求助
反应物用量的影响(恒温恒容条件下)
若反应物不只一种,如:aA(g)+bB(g)可逆号c(C)+dD(g)
“若只增加A的量,平衡向正反应方向移动,则A的转化率减小,B的转化率增大”为什么?还有 “若只减小A的量,平衡向逆反应方向移动,则B的转化率减小.”那A呢?如何变化? yueqihui1年前1
yueqihui1年前1 -
 宝ル 共回答了17个问题
宝ル 共回答了17个问题 |采纳率94.1%1.A的转化率 = 反应的A的质量 /A的总质量
若只增加A的量,平衡向正反应方向移动,
A虽然也反应了一些,但A的总质量是增大了,
而且A后反应的量没有增加的量多,也就是分母增大的要多.
而B的总质量不变,加入A后B又反应了一些,所以B的转化率增大.
2.只减小A的量,A的转化率变大,
上式分子变小的幅度小于分母变小的幅度.1年前查看全部
- 2SO2+O2=2SO3 恒温恒容 达到平衡 再次加入SO3 SO2的转化率增加
2SO2+O2=2SO3 恒温恒容 达到平衡 再次加入SO3 SO2的转化率增加
平衡正向还是逆向移动?S02的转化率是怎么表示的?起始量按多少算? windies_801年前5
windies_801年前5 -
 浪中浪仙 共回答了17个问题
浪中浪仙 共回答了17个问题 |采纳率76.5%这时平衡一定是逆向移动的,这样的话SO2的转化率当然要减小了,是不需要计算的.1年前查看全部
- 乙烷裂解取乙烯的反应如下:C2H6->C2H4+H2,已知1073K时的速率常数k=3.43 s-1,问当乙烷的转化率为
乙烷裂解取乙烯的反应如下:C2H6->C2H4+H2,已知1073K时的速率常数k=3.43 s-1,问当乙烷的转化率为50%和70%时分别需要多长时间?
 xuzhenghong0001年前1
xuzhenghong0001年前1 -
 恋人未满V 共回答了14个问题
恋人未满V 共回答了14个问题 |采纳率85.7%主要就是通入的H2如果反应不完全或者过量都会引入新的杂质H2,所以不用这个方法除C2H6中的C2H4.1年前查看全部
- 反应物的用量改变时,转化率变化:对于反应物种类不止一种的mA(g)+nB(g)﹤=﹥pC(g)来说,若只
反应物的用量改变时,转化率变化:对于反应物种类不止一种的mA(g)+nB(g)﹤=﹥pC(g)来说,若只
反应物的用量改变时,转化率变化:
对于反应物种类不止一种的mA(g)+nB(g)﹤=﹥pC(g)来说,若只增大A的量,平衡向正反应方向移动,
为什么A的转化率减小,B的转化率增大? chenning08241年前1
chenning08241年前1 -
 caocao193 共回答了26个问题
caocao193 共回答了26个问题 |采纳率88.5%由于a过量,所以b会反应的更多,即b转化率增大
而对于a自身,增加的a由于b的缺乏,转化效率很低,最后总结果是a转化率很低.1年前查看全部
- 化学反应平衡~~ 转化率问题2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生
化学反应平衡~~ 转化率问题
2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生成0.3mol Z 60秒 达平衡 求 以A表示的 平衡反应速率?
解
2X + Y =Z
始 1 1 0
变 2 1 1
平 0.4 0.7 0.3
则 V=0.4/(10*60)
问一下 这样做对么 如果不对 请多多 指教~~~ koni901年前3
koni901年前3 -
 hail11w 共回答了13个问题
hail11w 共回答了13个问题 |采纳率84.6%不对,变 0.6 0.3 0.3 v=0.6/1(10*60)1年前查看全部
- 计算样品纯度和反应转化率,取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897m
计算样品纯度和反应转化率,
取0.1g氢氧化镁样品加适量盐酸加蒸馏水配成250ml溶液则镁离子的的浓度为0.006897mol/L.用移液管移取样品溶液25ml于250ml锥形瓶中,加指示剂然后用EDTA滴定,EDTA消耗6.3ml(EDTA于氢氧化镁1:1反应,EDTA浓度为0.01965mol/L)求氢氧化镁样品纯度和反应转化率 yuchenvv1年前1
yuchenvv1年前1 -
 moye2004 共回答了23个问题
moye2004 共回答了23个问题 |采纳率91.3%笨算也算出来了:Mg :EDTA24.31 1X 0.01965*6.3 X=24.31*0.01965*6.3/100025:X = 250:YY=X*250/25=X/(25/250)Mg :Mg(OH)224.31 58.33Y Z Z=58.33/24.31*Y=X/(25/250)*58.33/24.31=10*58.33/24.31*24.31*0.0196...1年前查看全部
- 合成氨反应转化率计算通入H2,N2混合密度为0.38g/L(S,P,T),出来的混合气密度是氢气的5倍,求氢气转化率.我
合成氨反应转化率计算
通入H2,N2混合密度为0.38g/L(S,P,T),出来的混合气密度是氢气的5倍,求氢气转化率.
我可以求出反应后混合气的平均分子质量是10,有人说通过0.38可以算出反应前两反应物物质的量之比为1: 风行牛仔1年前1
风行牛仔1年前1 -
 gupiao778 共回答了17个问题
gupiao778 共回答了17个问题 |采纳率100%设N2为V1,H2为V2,则p混合密度=(V1*28/22.4g+V2*2/22.4g)/(V1+V2)=0.3819.488*V1=6.512V2V1/V2=1/3 则 应前两反应物物质的量之比为1:3设参加反应的N2为V,H2的密度为pp=2*V2/22.4*V2=1/11.23H2+N2==2NH3根据质量守...1年前查看全部
- 化学平衡的转化率转化率与哪些因素有关?若转化率一定是否代表着各物的含量比值不变
 dd的妈1年前3
dd的妈1年前3 -
 yizo 共回答了21个问题
yizo 共回答了21个问题 |采纳率95.2%转化率与温度有关,
在反应中气体总量反应物与生成物不同情况下,与压强有关.
还与各组分浓度有关,当然固体就没有什么浓度概念了,所以即使增加固体反应物,平衡也不变,转化率不变
注意的是,江月说的催化剂并不影响转化率,催化剂只改变反应速率.
转化率相同,则相当于等效平衡,各组分笔直一定1年前查看全部
- 反应物转化率与浓度的变化关系对于分解反应来说,要视反应前后物质的化学计量数而定,如反应2HI=H2+I2,不论如何改变H
反应物转化率与浓度的变化关系
对于分解反应来说,要视反应前后物质的化学计量数而定,如反应2HI=H2+I2,不论如何改变HI的浓度,HI的转化率都不变. sleepywitch051年前1
sleepywitch051年前1 -
 sikelaure 共回答了16个问题
sikelaure 共回答了16个问题 |采纳率87.5%转化率的问题是比较复杂的.
一般而言,不改变反应物的量而改变其他条件可以有效地改变反应转化率.
但是加反应物的话,比如你的例子,加进去的氢碘酸也会分解达到平衡,反应的HI多了,但是起始总量也变大了,相当于你把一“堆”平衡混合物加到一对平衡混合物中,没有变化的.1年前查看全部
- 在固定体积的容器中充入3g SO2和1g O2,平衡后,测得SO2的转化率为a,再充入6g SO2和2g O2使反应重新
在固定体积的容器中充入3g SO2和1g O2,平衡后,测得SO2的转化率为a,再充入6g SO2和2g O2使反应重新平衡,测得SO2的转化率为b,则a和b的关系下列说法正确的是( )
A. a大于b
B. a小于b
C. a等于b
D. 无法确定 a32359321年前1
a32359321年前1 -
 呜哈 共回答了9个问题
呜哈 共回答了9个问题 |采纳率100%解题思路:容器中充入3gSO2和1gO2和充入6gSO2和2gO2对比,后者中的量是前者的2倍,则后者压强大,增大压强,平衡正移,据此分析.容器中充入3gSO2和1gO2和充入6gSO2和2gO2对比,后者中的量是前者的2倍,则后者压强大,增大压强,平衡正移,SO2的转化率的增大,所以后者中SO2的转化率大于A中SO2的转化率,即a<b,
故选B.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学平衡的影响因素,题目难度中等,注意根据反应方程式的特点把握压强对平衡移动的影响.1年前查看全部
- 现有反应mA+nB=pC,达到平衡后,当升高温度时,B的转化率变大,当减小压强时,混合体系C的质量分数减小
现有反应mA+nB=pC,达到平衡后,当升高温度时,B的转化率变大,当减小压强时,混合体系C的质量分数减小
1 减压时,A的质量分数----(增大、减小还是不变)
2 若容积不变加入B,则B的转化率-----
3若升高温度,则平衡时B、C的浓度之比将------
4若加入催化剂,平衡时气体混合物的总物质的量----------------
 air_nebraska1年前1
air_nebraska1年前1 -
 zl17 共回答了21个问题
zl17 共回答了21个问题 |采纳率95.2%当升高温度时,B的转化率变大,说明正反应是吸热反应.
当减小压强时,混合体系C的质量分数减小,平衡向体积增大的方向移动,所以m+n>p
1 减压时,A的质量分数(增大).因为平衡向左移动.
2 若容积不变加入B,则B的转化率(降低).增加一种反应物,可以降低本物质的转化率,提高其他物质的转化率.
3若升高温度,则平衡时B、C的浓度之比将(变小).平衡右移,C增大,B减小,B/C减小.
4若加入催化剂,平衡时气体混合物的总物质的量(不变).催化剂只能改变反应速率,并不影响化学平衡.1年前查看全部
- 可逆反应的问题,可逆反应中,反应物和生成物的化学计量数之比和平衡时的浓度比是一致的吗?瞬时速率之比呢?转化率怎么求呢?化
可逆反应的问题,
可逆反应中,反应物和生成物的化学计量数之比和平衡时的浓度比是一致的吗?
瞬时速率之比呢?转化率怎么求呢?化学反应是变加速的吗?
想了两个星期了,脑袋昏了,救救我啊 黑白双星1年前1
黑白双星1年前1 -
 智者见仁 共回答了17个问题
智者见仁 共回答了17个问题 |采纳率88.2%可逆反应中,反应物和生成物的化学计量数之比和平衡时的浓度比是不一致的;
瞬时速率之比与计量数不一致;
转换率=消耗反应物的量/原有反应物的量;
化学反应是变加速的,但要是不断改变条件也能强行建立匀加速的状态.1年前查看全部
- 为什么气体体积不变的反应增大压强不影响转化率?
 陪你一路到uu1年前1
陪你一路到uu1年前1 -
 aihaido 共回答了15个问题
aihaido 共回答了15个问题 |采纳率80%(1)平衡不移动,转化率不变!
(2)气体体积不变的反应增大压强,同等增大正逆反应速率!
(3)气体体积不变的反应减小压强,同等减小正逆反应速率!1年前查看全部
- 化学平衡移动时,反应物转化率一定变吗?
 fhbg65h1年前1
fhbg65h1年前1 -
 beebt 共回答了22个问题
beebt 共回答了22个问题 |采纳率95.5%不一定,如向已达反应平衡的气体装置中按反应式系数比加入反应物,同时装置内保持常压,此时反应往正反应的方向移动,但反应装置中各组分的百分含量不变,也就是反应物的转化率不变.1年前查看全部
- 化学反应原理中等效平衡的转化率问题
化学反应原理中等效平衡的转化率问题
一定温度下在一个体积可变的密闭容器中加入2mol氮气和2mol氢气,建立如下平衡:N2+3H2=(可逆)3NH3,全部为气态.相同条件下,若向容器中再通入1mol氮气和1mol氢气,又达到平衡.那么氢气的转化率如何变化? xatsocel1年前1
xatsocel1年前1 -
 永远不再回首 共回答了16个问题
永远不再回首 共回答了16个问题 |采纳率100%我先给你解释一下在恒温恒压下的等效平衡的一个重要定理:如果在一个反应发生后达到平衡时,再往里面通入反应物,通入的各反应物与没反应时通入的反应物成比例时(此题比例为1:2),就会建立等效平衡,则这个等效平衡各组分物质量浓度,各物质的转化率都不变,这是个重要的结论,而此题满足在恒温恒压下的等效平衡,所以氢气的转化率不变1年前查看全部
- 如何通过气相色谱面积归一法测得物质的面积和含量来求物质转化率和选择性.
如何通过气相色谱面积归一法测得物质的面积和含量来求物质转化率和选择性.
例如 A生成了B+C+D+F 目标产物为B 反应后生成的含量A有20% B20% C20% D20% F20% ,需要校正因子什么的么.我是初学者 fang2391年前3
fang2391年前3 -
 奇瑞BOY 共回答了16个问题
奇瑞BOY 共回答了16个问题 |采纳率93.8%最好是直接有各种的纯物质,各物质直接进行进样,物质含量和面积的比值就是各个组分的相对校正因子,随便找本有关仪器分析的书就行,如果要求不是很深的话,南京大学2001科学出版社的《仪器分析》是不错的选择,这部分内容在150页到153页.物质的转化率就是反应掉的A比上总的A,所有的量都用面积乘上相对校正因子就行了,选择性也一样.1年前查看全部
- 化学反应物的转化率,利用率,产率分别怎么计算
化学反应物的转化率,利用率,产率分别怎么计算
最好说明一下区别,还有公式, 111qqqaaa1年前1
111qqqaaa1年前1 -
 美思购物 共回答了19个问题
美思购物 共回答了19个问题 |采纳率94.7%转化率就是利用率,计算方法很简单.任何一个反应都是不能完全进行的.所以反应物肯定有没有被反应掉的.如果你知道未反应的量也就是剩余的量为X,总量为z
公式应该为:
转化率=(z-x)/z
如果你知道反应了的量y,那么公式为:
转化率=y/z
文字表达为反应的量除以总量.
因为是一个百分数,所以单位无所谓.但是x,y,z他们三个得用同一单位啊.mol,ml,kg等等都可以,哪个方便用哪个.
再说下产率.很多有机反应都有副产物.所以你应该先计算出所有反应物全生成你所要的产物时,能生成产物的量,记为X.再测量你实验制得的量Y.
产率=Y/X
文字表达就是实际产量除以理论产量.
同样单位无所谓.1年前查看全部
- 题目中说某物质转化率降低升高,应怎么分析呢,有没有什么一般的规律,最好用一点例子说明一下.
 婧狗狗1年前1
婧狗狗1年前1 -
 卫长萍 共回答了23个问题
卫长萍 共回答了23个问题 |采纳率100%这应该是关于化学反应的平衡吧,转化率提高了应该是此物质的摩尔浓度降低,说白了就是此物质含量减少;转化率降低了应该是此物质的摩尔浓度升高,说白了就是此物质的含量增加.
并不是说消耗多还是少,因为是化学平衡,所以有消耗也有生成.总之就是一句话,“转化率提高了此物质含量减少;转化率降低了此物质的含量增加”.
给你举个例子
A + B = C + D
开始的时候没有生成物C,D,只有A,B各2摩尔,反应结束后,剩余了A,B各自1摩尔,这样的转化率是1/2=50%,A,B转化率都是50%
如果剩余的是1.5摩尔,二者转化率都是(2-1.5)/2 = 25%
[解题过程]
这才是转化率!
转化率=参加反应的物质/开始加入的物质1年前查看全部
- 化学平衡移动原理 微观举几个平衡移动的例子,用微观解释一下移动原理吧..那些影响平衡的因素在微观上是怎样影响速率和转化率
化学平衡移动原理 微观
举几个平衡移动的例子,用微观解释一下移动原理吧..那些影响平衡的因素在微观上是怎样影响速率和转化率的?回答好了加100分.
要回答得满意些才加哦...其实我分不多的. 896165771年前1
896165771年前1 -
 ww芳草绿 共回答了18个问题
ww芳草绿 共回答了18个问题 |采纳率83.3%楼主好,化学平衡移动的例子很多,比如,用氮气加氢气生成氨气,达到反应平衡后加入再氮气或氢气,提高他的浓度,平衡就可以正向移动,理论中升温或加压也可以使平衡正向移动,但要注意加入催化剂不能使平衡移动,勒夏特列原理可以宏观的解释平衡移动:如果改变影响平衡的一个条件,平衡就能够向减弱这种改变的方向移动.影响的因素有三个,温度,压强,和浓度,从微观角度来说浓度增加后是反应物中的活化分子数这多,发生有效碰撞的几率就增加,平衡就会移动,改变压强就是间接地增加了反应物浓度,最后温度升高可以使没有活化的分子活化,发生有效碰撞的几率也会增大,进而平衡移动,可以使物质的转化率增加,在这里化学平衡怎样移动就不再说了.不知能帮你不能,还希望楼主能给些分.1年前查看全部
- 某一元醇A10g,跟足量乙酸反应,生成乙酸酯11.17g,已知醇的转化率为82%,则A的相对分子质量约为
某一元醇A10g,跟足量乙酸反应,生成乙酸酯11.17g,已知醇的转化率为82%,则A的相对分子质量约为
[ ]
A.88 B.102 C.116 D.166 goldenfox_qi1年前1
goldenfox_qi1年前1 -
 班尼鲁 共回答了13个问题
班尼鲁 共回答了13个问题 |采纳率84.6%因为醇的转化率为82%,所以有10*0.82=8.2g的醇反应
设该醇分子式R-OH,R的相对分子质量为X
所以
R-OH+CH3COOH→CH3COOR+H2O
解得X=99g
所以该醇的相对分子质量=99+17=116
答案选C1年前查看全部
- 谁能详细解释一下2no2=n2o4转化率问题啊,增加n2o4为什么no2的转化率会增大?
 东悬1年前1
东悬1年前1 -
 韩大川 共回答了17个问题
韩大川 共回答了17个问题 |采纳率82.4%此问题应该是在N2O4=2NO2反应达到平衡后,再加入N2O4时,N2O4的转化率降低.此问题可以采用过程分解的办法来分析理解,在一个固定容积的容器中加入N2O4,使其分解,当N2O4=2NO2反应达到平衡时,再加入N2O4时平衡向正反应方向移动,但转化率是降低的.为了便于判断我们可以将要加入的N2O4先放在另一个容器中,控制条件与前相同,当它达到平衡时,N2O4的转化率与之相同,然后将此混合物一起加入原容器中,此时相当于压缩体积,平衡向左移动,N2O4的浓度增大,N2O4的转化率降低.也就是说,当我们在原容器中再加入的N2O4时,这部分N2O4的分解率较先前的那部分要小,故整个转化率降低.所以,应该说是N2O4的转化率降低,而不是说NO2的转化率增大.1年前查看全部
- 在其他条件一定时,图中曲线表示2NO(g)+O2(g)==2NO2(g),正反应为吸热反应,达到平衡时NO的转化率与温度
在其他条件一定时,图中曲线表示2NO(g)+O2(g)==2NO2(g),正反应为吸热反应,达到平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且 V正>V逆的点是:
A.A点或E点
B.B.点
C.C点
D.D点
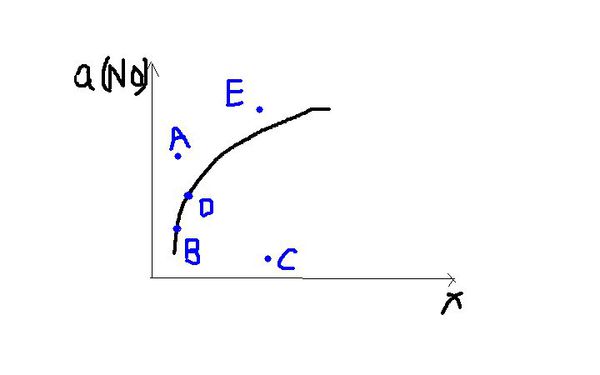
 小可ss莉莉1年前2
小可ss莉莉1年前2 -
 tiantian0211 共回答了13个问题
tiantian0211 共回答了13个问题 |采纳率84.6%在曲线上的点B、D都是对应温度下的平衡点,所以点A、C、E均未达到平衡.
点A、E的转化率比该温度时平衡状态的NO转化率大,平衡向逆反应方向移动才能使得NO的转化率恢复到平衡状态.
点C比该温度时NO的转化率小,要恢复平衡状态,平衡必须向正反应方向移动,所以选择C.1年前查看全部
- 物质的分解率与转化率一样吗?如题.
 玫瑰冰儿1年前1
玫瑰冰儿1年前1 -
 tianfu9803 共回答了18个问题
tianfu9803 共回答了18个问题 |采纳率83.3%分解率应该是相对于分解反应中的反应物而言,而转化率没有对反应的要求1年前查看全部
- 在一真空容器中,冲入10molN2和30molH2 发生反应,N2的转化率是25%,若相同条件下,统一容器,起始时指向其
在一真空容器中,冲入10molN2和30molH2 发生反应,N2的转化率是25%,若相同条件下,统一容器,起始时指向其中加入NH3 于是平衡时,与上述反应等效,则nh3加多少,转化率是多少?
 黑色等待微笑1年前1
黑色等待微笑1年前1 -
 hanh2005 共回答了20个问题
hanh2005 共回答了20个问题 |采纳率75%由于反应N2+3H22NH3中气体体积数发生改变,所以要在同一容器中形成等效平衡,所加的量必须和原平衡完全一致,10molN2和30molH2 代入方程式可得,相当于20mol氨气,所以要加20molNH3,正向转化25%即逆向转化75%,所以NH3转化率是75%1年前查看全部
- 化学平衡向正方应方向移动那么反应物的转化率一定变高吗
化学平衡向正方应方向移动那么反应物的转化率一定变高吗
不是 我是说反应物的转化率一起变高! 馅饼儿1年前3
馅饼儿1年前3 -
 mikazz 共回答了17个问题
mikazz 共回答了17个问题 |采纳率88.2%不是,转化率与转化量和反应物量都有关:反应向正反应进行,说明转化量变大,但如果这种改变是由于反应物物质的量增多,导致反应物浓度增大而导致反应向正反应方向移动的话,那么,由转化率=转化量/反应物量得:1个量增大,另1个量减小,无法判断其比值的大小关系.并且,由勒夏特列原理:反应向着能减小改变的方向进行得:反应物转化量1年前查看全部
- 恒温恒容条件下,加2mol氨气,氨气转化率为x.若加3mol氨气,转化率是增加还是降低呢?
恒温恒容条件下,加2mol氨气,氨气转化率为x.若加3mol氨气,转化率是增加还是降低呢?
详细说说为什么 jerryyan20061年前1
jerryyan20061年前1 -
 20001208 共回答了21个问题
20001208 共回答了21个问题 |采纳率85.7%加入3mol氨气使氨气的总量增加,因为恒温恒容,所以压强增大,转化率也就增加1年前查看全部
- 在一容积、温度不变的密闭容器中,发生可逆反应3A(g)==2C(g),先加入amolA,待反应平衡时A的转化率为X,
在一容积、温度不变的密闭容器中,发生可逆反应3A(g)==2C(g),先加入amolA,待反应平衡时A的转化率为X,
再加入bmolC,问反应再度平衡时,A的转化率大于还是小于X 归心依净1年前1
归心依净1年前1 -
 hawkwisher 共回答了29个问题
hawkwisher 共回答了29个问题 |采纳率82.8%大于X
可以这样考虑,相当于两个容器,一个放amolA,一个放bmolA,容器体积比利与ab比例一致,这样来那个容器压力相等,此时分别达平衡,转化率为X.然后将第二个容器中的气体压入第一个容器,保持体积不变,此时压力升高,平衡向生成C的方向移动,所以转化率将大于X1年前查看全部
- 用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄
用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄铁矿可产生98%硫酸多少吨?
 心跳乱了节奏1年前4
心跳乱了节奏1年前4 -
 skchenglong 共回答了20个问题
skchenglong 共回答了20个问题 |采纳率95%就是计算最后进入硫酸的硫的重量,进而换算成硫酸就可以了,因为硫元素是守恒的.
1t FeS2含有FeS2 720kg,FeS2中硫元素的质量分数是64/(64+56)=0.5333,所以S元素的质量就是384kg ,损失1.5%那么还剩下384×0.985=378.24kg,在转换三氧化硫的时候转化率是97%,所以这时候能转化成SO3的S的重量就是378.24×0.97=367kg,好了,现在知道变成硫酸的硫元素的质量,进而计算三氧化硫转化的纯硫酸质量:(367/32)×98=1123kg,因为硫酸是98%,所以再除以0.98,得到硫酸重量是1146.54kg
实际上运用守恒是很简单的,我写得很复杂,因为要介绍思想,如果你很熟悉,可以一步写齐所有算式,这样其中数字运算的约分等等能让计算更加简单,元素守恒、质量守恒、电荷守恒、能量守恒等等的应用有时候会让人视野更加开阔,看问题更宏观全面,简化思考和计算过程,十分有用.无论是做题还是研究,这都是很重要的思想和思考方法.1年前查看全部
- K2O 有存在吗?化学物质中有这化合物吗?还有 转化率 是指什么?只要定义就行.还有水中有几个H—O键?
 QWind1年前1
QWind1年前1 -
 gdmmlgj 共回答了16个问题
gdmmlgj 共回答了16个问题 |采纳率100%有
可逆反应到达平衡时,某反应物的转化浓度(等于某反应物的起始浓度和平衡浓度的差)与该反应物的起始浓度比值的百分比.可用以表示可逆反应进行的程度.
水中的氢键要额外考虑水分子间的H-O键1年前查看全部
- 为什么化学平衡正向移动,反应物转化率升高
 zhiyong19711年前1
zhiyong19711年前1 -
 今日风采 共回答了11个问题
今日风采 共回答了11个问题 |采纳率100%转化率=(反应前反应物的物质的量-反应后反应物的物质的量)/反应前反应物的物质的量.化学平衡正向移动,就是反应物反应的更多了,反应后反应物的物质的量减少,所以转化率升高1年前查看全部
大家在问
- 1(1)一个两位数,个位上数字是十位上数字的2倍,如果把十位上数字与个位上数字对调,那么所得到的两位数比原两位数大36,求
- 21、下列判断错误的是:a 真分数都比一小 b 假分数都不比一小 c 假分数都可以化为带分数
- 3DELIVERY TERM我们有个客户要求交货方式为a.m.delivery term,是只要送货到目的地吗?a.m.是
- 4一斜坡上有一高尔夫球场 斜坡的坡度为i=1:10一斜坡上有一高尔夫球场 斜坡的坡度为i=1:10 一球从斜坡底部O被击起
- 5右图式一块长方形麦田,长370米,宽254米,有一条水渠和一条马路从田中穿过,若每公顷麦田可产小麦18吨,那么这块麦田共
- 6下面题目用设方程解答.小潘有一些贺卡,分给几个小朋友,如果每人分8张,正好分完,如果每个人分10张,缺8张,问有几个小朋
- 72010年元旦早晨,小雷在家中发现暖水瓶的瓶盖打开不冒“白气”,小雷问自己为什么?想到可能是暖水瓶不保温,倒了一碗尝尝发
- 8在我们身边的外星人 什么特征
- 9多一分不要,少一分不行 换成文言文怎么表达
- 10我的中国梦 大作文 600字
- 11怎么理解太阳直射北半球时,全球各地除了极昼、极夜地区以外,太阳都是从东北方向
- 12北半球极昼,极夜时北极圈里太阳的升起方向和下落方向?南半球呢?
- 13句法挺健,由字法生新也 用来评论白居易一首诗的.我想知道他本身是什么意思?就是把这句话翻译一下.
- 14经过点O(0,0)与P(-根号3,1)的直线的斜率和倾斜角的乘积是
- 15shanghai expo brings me a lot怎么写?
