哈伯的实验表明氨的化学性质是
 baduoduo2022-10-04 11:39:541条回答
baduoduo2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 邻家乌龙二少 共回答了17个问题
邻家乌龙二少 共回答了17个问题 |采纳率82.4%- 氨在水中的反应可表示为:NH3+H2O=NH3·H2O
氨气在高温下分NH3=N2+3H2 可逆反应 - 1年前
相关推荐
- 1909年化学家哈伯在实验室首次合成氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨
1909年化学家哈伯在实验室首次合成氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式为3H2+N2
2NH3催化剂 .高温高压 3H2+N2.
2NH3催化剂 .高温高压
(2)用 分别表示N2、H2、NH3.观察图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序序号排列).
分别表示N2、H2、NH3.观察图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序序号排列).
 lovemouse661年前1
lovemouse661年前1 -
 shuang456789 共回答了11个问题
shuang456789 共回答了11个问题 |采纳率100%解题思路:(1)根据发生的反应,写出反应的化学方程式;
(2)根据化学反应的实质将图示进行排序.(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式为:3H2+N2
催化剂
.
高温高压2NH3.
(2)分析题中五个图是准确解答本题的核心.
图①中的分子仍为氮气分子和氢气分子,且反应物分子还没接触到催化剂,此图应表示反应最初的过程;
图②中分子仍然为原反应物的分子,和图①相比较,可判断是反应物与催化剂相结合的一个过程;
图③图所示为附在催化剂表面的原子,此图应该是变化中分解成原子的一个过程;
图④中形成了氨气分子,应为原子重新组合成新分子的过程;
图⑤表示出新分子与催化剂分离,应为变化过程的最后环节;
由以上分析可知,符合在催化剂表面合成氨反应过程的顺序是:①②③④⑤.
故答为:(1)3H2+N2
催化剂
.
高温高压2NH3;(2)①②③④⑤.点评:
本题考点: 物质的相互转化和制备;化学反应的实质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学方程式的书写和化学反应的实质,同时加强了对化学反应的实质的理解和应用.难度较大.1年前查看全部
- 为什么在太空中不能用照相机来拍摄天体而必须借助哈伯之类的望远镜
为什么在太空中不能用照相机来拍摄天体而必须借助哈伯之类的望远镜
请从光学角度回答, joanleung1年前5
joanleung1年前5 -
 风尘再风尘 共回答了21个问题
风尘再风尘 共回答了21个问题 |采纳率81%相机的镜头焦距能达到500MM已经不错了,很难把更远处的景象拉近来拍.
搞天体摄影,需要把相机的机身直接接到望远镜的目镜上拍摄才能获得更大、更清晰的图像.
这就好比你看星星为什么用望远镜比用肉眼看得清楚一样.1年前查看全部
- 现在普遍应用的工业合成氨的方法是哈伯于 1905 年发明的,但此法反应物的转化率不高.(1)合成氨反应的化学方程式为 1
现在普遍应用的工业合成氨的方法是哈伯于 1905 年发明的,但此法反应物的转化率不高.(1)合成氨反应的化学方程式为 1N2(g)+3H2(g) 2NH3(g),在一定温度下,向容积不
变(始终为 10L)的密闭容器中加入 2 mol N2、8 mol H2 及固体催化剂.10 分钟后反应达到 平衡状态,容器内气体压强变为起始的 80%,此时氨气的体积分数为 反应速率为:.反应的化学平衡常数 K= ,用氮气表示的 若想提高氨气的
产率,根据化学平衡移动原理,请提出合理的建议:(任意写一条).(2)在上述平衡中,若再加入 2 mol NH3、2 mol N2,则此时反应平衡将_________移动.(填 “向正方向”、“向逆方向”或“不”).(3)已知:0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,则溶液中各离子浓度的大 小为:
若再往混合溶液中再加入0.01mol/L氨水溶液
50ml,c(Cl )-c(NH4)=______________;(用溶液中微粒浓度表示等式) (4)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8 kJ/mol N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol 氨催化氧化生成 NO 和水的热化学方程式为 阿基拉1101年前1
阿基拉1101年前1 -
 李和阳 共回答了19个问题
李和阳 共回答了19个问题 |采纳率84.2%(1)我们看一下化学方程式:1N2(g)+3H2(g) =2NH3(g),反应前一共是4份,反应后是2份,前后气体体积减少了2份,这也是压强减小的原因.由PV=nRT知道:V=10L,R、T不变,所以压强只跟摩尔数成正比.所以气体的摩尔数也变为原来的80%,原来有10mol气体(2 mol N2、8 mol H2 ),所以最后容器内只剩下8mol气体.
1N2(g)+3H2(g) =2NH3(g),
1 3 2 体积减少2
2mo
由上式可算出:生成的NH3有2mol,反应掉的N2有1mol(剩余1mol),反应掉得H2有3mol(剩余5mol),因为处于同一容器内,所以摩尔百分数等于体积百分数,氨气的体积分数=2mol/8mol=25%,反应速率=1mol/10min=0.1mol/min.若想提高N2转化率,可以继续加入H2.
反应平衡后H2的浓度=5mol/10L=0.5mol/L,N2的浓度=1mol/10L=0.1mol/L,NH3的浓度=2mol/10L=0.2mol/L,所以K=(0.1*0.5*0.5*0.5)/(0.2*0.2)=0.3125
(2)再加入 2 mol NH3、2 mol N2后,NH3的浓度=4mol/10L=0.4mol/L,N2的浓度=3mol/10L=0.3mol/L,H2浓度不变.此时K=(0.3*0.5*0.5*0.5)/(0.4*0.4)=0.234375,K变小了,所以平衡要向右(逆方向)移动.
(3)反应化学式为: NH3.H20 + HCl = NH4Cl + H20
混合后等于是0.005mol/L的NH4Cl溶液,溶液显弱酸性,所以离子浓度从大到小依次为:
Cl- > NH4+ > H+ > OH-
(4)4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1266.8 kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
所以:氨催化氧化生成 NO 和水的热化学方程式为:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g), △H=-905.8 kJ/mol1年前查看全部
- (2008•梅州一模)氨是最重要的氮肥,是产量最大的化工产品之一.课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905
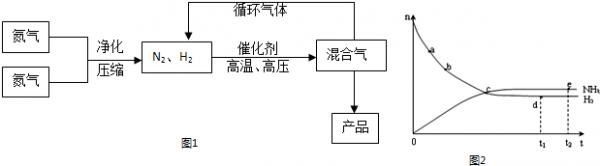
(2008•梅州一模)氨是最重要的氮肥,是产量最大的化工产品之一.课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)⇌2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖.工业上合成氨的部分工艺流程如图1:

反应体系中各组分的部分性质见下表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到______使混合气体分离出来产品;继续循环的气体是______.写出该反应的化学平衡常数表达式:K=气体 氮气 氢气 氨 熔点(℃) -210.01 -252.77 -77.74 沸点(℃) -195.79 -259.23 -33.42 c2(NH3) c(N2)•c3(H2) .c2(NH3) c(N2)•c3(H2)
(2)运用化学反应速率和化学平衡的观点说明工业上采取用上述实际生产措施的理由:______.
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
(4)合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)⇌2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图2所示.下列叙述正确的是______
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d(t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图2中d点的值大
(5)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图3.阴极的电极反应式______. Google测试员58281年前1
Google测试员58281年前1 -
 小饼干booboo 共回答了24个问题
小饼干booboo 共回答了24个问题 |采纳率100%解题思路:(1)根据氨气易液化来解答;
(2)根据浓度对化学平衡的影响以及对原料利用率的影响来分析;
(3)依据化学方程式结合反应热=反应物的总键能-生成物的总键能计算反应热,标注物质聚集状态写出热化学方程式;
(4)在N2(g)+3H2(g)⇌2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.(1)氨气的沸点是-33.42,可以将温度降低到-33.42,氨气液化,转变成液体分离出来,氢气和氮气可以再循环利用,平衡常数表达式为:
c2(NH3)
c(N2)•c3(H2),故答案为:-33.42;N2、H2;
c2(NH3)
c(N2)•c3(H2);
(2)生成物的浓度减少,平衡正向移动,所以及时分离出氨气,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率,
故答案为:及时分离出氨气,平衡正向移动,提高氨气的产率,且循环利用氮气和氢气,提高氮气和氢气的转化率;
(3)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为N2+3H2⇌2NH3,依据化学方程式计算反应热为946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92KJ/mol,反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1;
(4)A、随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;
B、c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C、d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D、该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;
故答案为:AD;
(5)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,故答案为:N2+6e-+6H+=2NH3点评:
本题考点: 工业合成氨;常见化学电源的种类及其工作原理;化学平衡的调控作用;物质的量或浓度随时间的变化曲线.
考点点评: 本题主要考查了浓度对化学平衡的影响、热化学方程式的书写以及化学平衡图象问题,题目难度不大,分析图象中时各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.1年前查看全部
- 哈伯望远镜看到几万光年距离的星系形状是不是距今几万光年前的星系景象
哈伯望远镜看到几万光年距离的星系形状是不是距今几万光年前的星系景象
比如说看到5400万光年距离的星体,那是不是说看到的就是5400万光年前这个星体的形状,而不是我们现在这个时刻的该星体的形状
上面多说了一个“光”字。比如说看到5400万光年距离的星体,那是不是说看到的就是5400万年前这个星体的形状,而不是我们现在这个时刻的该星体的形状 山东济南杜锋1年前5
山东济南杜锋1年前5 -
 寒冰快乐 共回答了18个问题
寒冰快乐 共回答了18个问题 |采纳率88.9%所谓的光年就是光速传播一年所走过的距离.
5400万光年距离的星球,我们现在看到的就是5400万年前的形态.
因为光从那里发出之后经过了5400万年才传播到 地球,因此我们才
能看到1年前查看全部
- (1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表
(1)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式为N2+3H2
2NH3催化剂 .高温、高压 N2+3H2.
2NH3催化剂 .高温、高压
(2)体育课上,剧烈运动后血液中产生了较多乳酸(C3H6O3),使人肌肉酸痛,经过一段时间放松,由于乳酸与吸入的氧气反应,生成二氧化碳和水,酸痛感消失.该反应的化学方程式为______. yaowang8209071年前1
yaowang8209071年前1 -
 owena 共回答了16个问题
owena 共回答了16个问题 |采纳率81.3%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3),反应的化学方程式为:N2+3H2
催化剂
.
高温、高压2NH3.
(2)乳酸与吸入的氧气反应,生成二氧化碳和水,反应的化学方程式为:C3H6O3+3O2═3CO2+3H2O.
故答案为:(1)N2+3H2
催化剂
.
高温、高压2NH3;(2)C3H6O3+3O2═3CO2+3H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
(1)已知 N2(g)与H2(g)反应,生成2mol NH3(g),放出92.2kJ热量,写出反应的热化学方程式:______.
(2)若1mol N2(g)与过量H2(g)充分反应,则放出的热量______92.2kJ(填“>”“=”或“<”).
(3)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”).
(4)有甲、乙两容器,甲体积可变压强不变,乙保持体积不变.向两容器中分别充入1mol N2、3mol H2,此时两容器体积均为500mL,温度为T℃.2min后甲容器中反应达到平衡,测得NH3的浓度为2mol/L,此时容器的体积为______mL,H2的转化率α甲(H2)为______.乙容器中反应达到平衡所需要的时间______2min(填“>”、“<”或“=”,下同),H2的转化率α乙(H2)______α甲(H2) oo傻冒1年前1
oo傻冒1年前1 -
 erfvkuk 共回答了13个问题
erfvkuk 共回答了13个问题 |采纳率84.6%解题思路:(1)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,据此解答;
(2)可逆反应中的反应物不能完全转化为产物;
(3)对于放热反应,温度升高,则K降低,反之增大;
(4)根据三行式结合反应前后的体积之比等于物质的量之比等于浓度之比来计算合成氨的反应是气体体积减小的反应,所以恒压容器相当于在恒容的基础上加压,据此回答.(1)1mol氮气完全反应,能生成2mol氨气,放热92.2KJ,热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2 kJ•mol-1;
(2)氮气和氢气合成氨气的反应是可逆反应,可逆反应中的反应物不能完全转化为产物,即1mol N2(g)与过量H2(g)充分反应,则放出的热量小于92.2kJ,故答案为:<;
(3)氮气和氢气合成氨气的反应是放热反应,对于放热反应,温度升高,则K降低,该反应在298K时的化学平衡常数大于398K时的,故答案为:>;
(4)N2(g)+3H2(g)⇌2NH3(g)
初始浓度:2 6 0
变化浓度:1 3 2
平衡浓度:1 3 2
则反应前后的体积之比等于物质的量之比等于浓度之比,设反应后的体积是V,所以[8/500=
6
V],解得V=375mL,H2的转化率α甲(H2)为[3/6]×100%=50%,合成氨的反应是气体体积减小的反应,所以恒压容器相当于在恒容的基础上加压,所以乙容器相当于在甲容器的基础上减小了压强,反应速率减慢,达平衡时间加长,氢气的转化率减小,故答案为:375;50%;>;<.点评:
本题考点: 热化学方程式;化学平衡的影响因素.
考点点评: 本题涉及热化学方程式的书写、化学平衡的计算和影响化学反应速率的因素的综合考查,注意知识的积累和应用是关键,难度不大.1年前查看全部
- (2009•清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)⇌2NH3(g)
 (2009•清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)⇌2NH3(g)已知298K时:△H=-92.4kJ•mol-1试回答下列问题:
(2009•清远模拟)德国人哈伯在1909年发明的合成氨反应原理为:N2(g)+3H2(g)⇌2NH3(g)已知298K时:△H=-92.4kJ•mol-1试回答下列问题:
(1)在298K时,将10mol N2和30mol H2放入合成塔中,为何放出的热量小于924kJ?______.
(2)如图一在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答:
①N2的转化率αA为______.
②在状态A时,平衡常数KA=0.082 0.06×0.183 (代入数值的表达式,不写出具体数值)当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)0.082 0.06×0.183
(3)图二是实验室模拟工业法合成氨的简易装置.简述检验有氨气生成的方法______.在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨.其实验装置如图.阴极的电极反应式______. 秋阳飞渡1年前1
秋阳飞渡1年前1 -
 缺水的人 共回答了20个问题
缺水的人 共回答了20个问题 |采纳率90%解题思路:(1)可逆反应不能完全反应;
(2)令参加反应的氮气的物质的量为nmol,结合根据三段式用n表示出各组分的物质的量的变化量,平衡时各组分的物质的量,结合混合气体中氨占25%,列方程求出n的值;
①根据转化率的定义计算;
②平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,k=
,c3(NH3) c(N2)•c3(H2)
该反应为放热反应,升高温度平衡向逆反应进行,平衡常数k减小;
(3)氨气是碱性气体,湿润的红色石蕊试纸检验;
阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.(1)该反应为可逆反应,10mol N2和30mol H2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ,
故答案为:该反应为可逆反应,10mol N2和30mol H2不可能完全反应,所以放出的热量小于10×10×92.4kJ=924kJ;
(2)对于反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以[2nmol
(1−n)mol+(3−3n)mol+2nmol×100%=25%,解得n=0.4,
①由上述计算可知,参加反应的氮气的物质的量为0.4mol,所以氮气的转化率为
0.4mol/1mol]×100%=40%,故答案为:40%;
②由上述计算可知,平衡时 N20.6mol、浓度为[0.6mol/10L]=0.06mol/L,H21.8mol、浓度为[1.8mol/10L]=0.18mol/L,NH30.8mol、浓度为[0.8mol/10L]=0.08mol/L,
所以k=
c3(NH3)
c(N2)•c3(H2)=
0.082
0.06×0.183;
该反应为放热反应,升高温度平衡向逆反应进行,平衡常数k减小,即KA>KB,
故答案为:
0.082
0.06×0.183;>;
(3)用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成;
阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3.
故答案为:用湿润的红色石蕊试纸放在导管口处,若试纸变蓝,说明有氨气生成; N2+6e-+6H+=2NH3.点评:
本题考点: 化学平衡的计算;原电池和电解池的工作原理.
考点点评: 本题考查化学平衡计算、电化学等,难度中等,旨在考查学生对知识的掌握与运用,加强基础知识的掌握理解.1年前查看全部
- 1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式为N2+3H2
2NH3催化剂 .高温高压 N2+3H2
2NH3催化剂 .高温高压
(2)用 分别表示N2、H2、NH3.观察图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序用序号排列).
(3)在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在1表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式2CO+2NO
N2+2CO2催化剂 .2CO+2NO.
N2+2CO2催化剂 . 冰凝宝宝1年前1
冰凝宝宝1年前1 -
 成帆 共回答了19个问题
成帆 共回答了19个问题 |采纳率84.2%解题思路:化学变化的实质为:反应物的分子在一定条件下被破坏,分解成原子,然后这些原子重新组合成新的分子.结合微观结构图理解化学变化的过程是本题的一个难点.(1)书写化学方程式,要准确判断反应物、生成物和反应条件.
故答:N2+3H2
催化剂
.
高温高压2NH3
(2)分析题中五个图是准确解答本题的核心.
图①所示为附在催化剂表面的原子,此图应该是变化中分解成原子的一个过程;
图②中形成了氨气分子,应为原子重新组合成新分子的过程;
图③表示出新分子与催化剂分离,应为变化过程的最后环节;
图④中分子仍然为原反应物的分子,和图⑤相比较,可判断是反应物与催化剂相结合的一个过程;
图⑤中的分子仍为氮气分子和氢气分子,且反应物分子还没接触到催化剂,此图应表示反应最初的过程.
故选:⑤④①②③
(3)空气主要成分为氮气和氧气还含有少量二氧化碳气体,结合质量守恒--变化前后元素种类不变,根据化学变化的实质可判断反应生成物为氮气和二氧化碳.
故答:2CO+2NO
催化剂
.
N2+2CO2点评:
本题考点: 实验探究物质的性质或变化规律;微粒观点及模型图的应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 对基本概念进行理解应用时,把握概念的关键用语与题中提示信息进行比对.1年前查看全部
- 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年
氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年
发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
哈伯因此获得了1918年诺贝尔化学奖.试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是『 』填序号
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
(2)保持温度不变,将1 mol N2 和3 mol H2 混合气体充入一容积不变的密闭容器中,
发生如下反应:N2(g)+3 H2 (g) 2NH3 (g);反应达到平衡时,容器中气体压强为起始时
的 ,平衡状态记为P.回答下列问题:
① 平衡时容器中NH3 的体积分数是『 』.
② 若保持温度不变,开始时向容器中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行,且达到平衡后各气体的物质的量与原平衡状态P相同,则起始时,c的取值范围是『 』. 99cij1年前1
99cij1年前1 -
 candyelaine 共回答了24个问题
candyelaine 共回答了24个问题 |采纳率83.3%(1) 可用勒夏特列原理解释 概念就知道了 A D
AD很容易理解 C 勒夏特原理是不包含催化剂的 对于B这儿是错的 很多人会选 因为工厂实际操作的时候发现了 500摄氏度的其实合成氨的转化率并不好 选择500摄氏度的原因是 考虑的 此时的催化剂活性最大 可以价款合成的速度 从而选择500度的 不是因为 勒夏原理
2) 一容积不变的密闭容器
根据 阿伏伽德罗 定律 同温同体积的气体 压强比等于摩尔比
容器中气体压强为起始时的4/5 (可以看成开始时5 平衡就是4)
开始的时候物质的量是 1 mol N2 和3 mol H2 所以n初始=4mol
综上列式
4/5= n终/4
n = 3.2 mol
N2(g)+3 H2 (g) 2NH3 (g);所以直接计算啊 用差量法 或者直接设转化率
就可以得到 不明白就问吧 呵呵 不好写
平衡的时候 氨气可以求得 0.8 molmol 氮气0.6 氢气1.8mol
0.8/3.2=25 %
第二问就是等效平衡
恒温恒体积 是不是要是系数不等的话就是 所有的初始物质的量都要相等
开始时向容器中加入a mol N2 、b mol H2和c mol NH3 ,要使反应向逆反应方向进行
所以必须满足 根据题目将1 mol N2 和3 mol H2 混合气体充入一容积不变的密闭容器中 可以判断出来最大的NH3是不是就是 2mol
根据 1小问 我们可以看见平衡时的氨气是0.8mol
所以就是 小于等于2 大于等于0.8
要是不清楚就HI 呵呵1年前查看全部
- 哈伯望远镜看到宇宙边缘啊?据说哈伯望远镜可以看到宇宙边缘,可是他不是光学望远镜吗?那么遥远的地方不是需要N亿光年的吗?
 dpkv1年前1
dpkv1年前1 -
 sunxin4905 共回答了18个问题
sunxin4905 共回答了18个问题 |采纳率77.8%宇宙是有限无边的.就象地球,你说他是有限的是对的,但你永远无法准确说出他的边在哪里.
哈勃望远镜能够观测到40亿光年以外的天体.现在还无法看到更远的天体.1年前查看全部
- 哈勃太空望远镜的问题哈伯太空望远镜是一架A.r射线望远镜 B.反射望远镜C.射线望远镜 D.射电望远镜
 xmfan991年前2
xmfan991年前2 -
 嫁人以後 共回答了22个问题
嫁人以後 共回答了22个问题 |采纳率86.4%它采用卡塞格林式反射系统,由两个双曲面反射镜组成.
故选B1年前查看全部
- 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
(1)已知某反应为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”).
(2)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2mol N2、8mol H2及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率:______. hail12g1年前1
hail12g1年前1 -
 ph78_78 共回答了13个问题
ph78_78 共回答了13个问题 |采纳率84.6%解题思路:(1)反应是放热反应,温度升高,平衡逆向进行,平衡常数减小;
(2)令参加反应的氮气的物质的量为amol,利用三段式表示出各物质的变化量、平衡时物质的量,利用压强之比等于物质的量之比列方程计算a,氨气的体积分数=[平衡时氨气的物质的量/平衡混合气体总物质的量];根据v=
计算v(N2).△n V △t (1)N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1,若该反应在298K、398K时的化学平衡常数分别为K1、K2,反应是放热反应,温度升高,平衡逆向进行,平衡常数减小,则K1>K2;
故答案为:>;
(2)令参加反应的氮气的物质的量为amol,则:
N2(g)+3H2(g)═2NH3(g)
开始(mol):28 0
转化(mol):a 3a 2a
平衡(mol):2-a 8-3a 2a
故2-a+8-3a+2a=(2+8)×80%,解得a=1
所以,氨气的体积分数=[2×1mol
(2mol+8mol)×80%×100%=25%,
v(N2)=
1mol/10L
10min]=0.01mol/(L•min),
故答案为:25%;0.01mol/(L•min).点评:
本题考点: 化学平衡常数的含义;化学平衡的计算.
考点点评: 本题以合成氨为载体,考查化学平衡计算及影响因素、反应速率计算、平衡常数计算与应用,侧重考查学生对知识的迁移应用,难度中等.1年前查看全部
- 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知:1 mol N 2 (g)与适量H 2 (g)完全反应,生成NH 3 (g),放出92.2 kJ热量,写出反应的热化学方程式:____________________。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1______K2 (填“>” “=” 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N 2 、8 mol H 2 及固体催化剂。
10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:____________。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:__________________(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH 3 、2 mol H 2 及固体催化剂,反应达到平衡时NH 3 的体积分数比(3)中______(填“大”、“小”或“相等”)。
(5)氨被氧化生成一氧化氮的化学方程式为:__________________。
(6)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H + )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。
请回答:在电解法合成氨的电解池中______(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是__________________。钯电极A是电解池的______极(填“阳”或“阴”),该极上的电极反应式是__________________。  摇滚芭比金刚1年前1
摇滚芭比金刚1年前1 -
 vivianshenkendy 共回答了18个问题
vivianshenkendy 共回答了18个问题 |采纳率88.9%1年前查看全部
- 氨是最重要的氮肥,是产量最大的化工产品之一.课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为
氨是最重要的氮肥,是产量最大的化工产品之一.课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)⇌2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖.工业上合成氨的部分工艺流程如图1:
反应体系中各组分的部分性质见下表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程.即反应后通过把混合气体的温度降低到______℃使混合气体分离出来产品;继续循环的气体是______.气体 氮气 氢气 氨 熔点(℃) -210.01 -252.77 -77.74 沸点(℃) -195.79 -259.23 -33.42
(2)工业上采取用上述(1)操作的目的:______.
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
(4)合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)⇌2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图2所示.下列叙述正确的是______
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图2中d点的值大. 沈阳大象1年前1
沈阳大象1年前1 -
 liuchong88 共回答了16个问题
liuchong88 共回答了16个问题 |采纳率100%解题思路:(1)根据氨气易液化来解答;
(2)根据浓度对化学平衡的影响以及对原料利用率的影响来分析;
(3)依据化学方程式结合反应热=反应物的总键能-生成物的总键能计算反应热,标注物质聚集状态写出热化学方程式;
(4)在N2(g)+3H2(g) 2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断.
2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物的生成物的物质的量不再改变,曲线为水平直线,以此判断.
(1)氨气的沸点是-33.42,可以将温度降低到-33.42,氨气液化,转变成液体分离出来,氢气和氮气可以再循环利用,故答案为:-33.42;N2、H2;
(2)生成物的浓度减少,平衡正向移动,所以及时分离出氨气,平衡正向移动,提高氨气的产率;循环利用氮气和氢气,提高氮气和氢气的转化率,
故答案为:及时分离出氨气,平衡正向移动,提高氨气的产率,且循环利用氮气和氢气,提高氮气和氢气的转化率;
(3)拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,化学方程式为N2+3H2⇌2NH3,依据化学方程式计算反应热为946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92KJ/mol,反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92 kJ•mol-1;
(4)A.随着反应的进行,反应物的浓度之间减小,反应速率逐渐减小,则a点的正反应速率比b点大,故A正确;
B.c点反应物和生成物物质的量仍在变化,没有达到平衡状态,故B错误;
C.d点和e点都处于平衡状态,n(N2)不变,d点和e点n(N2)相等,故C错误;
D.该反应是放热反应,升高温度,平衡向逆反应方向移动,所以平衡时氢气的物质的量比d点的值大,故D正确;
故答案为:AD.点评:
本题考点: 工业合成氨;热化学方程式;物质的量或浓度随时间的变化曲线.
考点点评: 本题主要考查了浓度对化学平衡的影响、热化学方程式的书写以及化学平衡图象问题,题目难度不大,分析图象中时各物理量的变化曲线,把握平衡状态的特征为解答该题的关键.1年前查看全部
- 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(
氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,他因此获得了1918年诺贝尔化学奖.在密闭容器中,使2mol N2和6mol H2混合发生上述反应,达到平衡:
(1)此时,N2和H2的浓度比是______;N2和H2的转化率比是______.
(2)若恒容下升高温度,则混合气体的相对分子质量______;密度______.(填“变大”“变小”或“不变”).
(3)若充入氩气,并保持压强不变,平衡将______;(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,达到新平衡后,容器内温度______(填“大于”“小于”或“等于”)原来的2倍. 苗苗19761年前1
苗苗19761年前1 -
 爱情加油100 共回答了26个问题
爱情加油100 共回答了26个问题 |采纳率88.5%解题思路:(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的浓度之比永始终是1:3,转化率之比1:1;
(2)平均相对分子质量=[气体质量总和/气体物质的量总和],ρ=[m/V];
(3)充入氩气并保持压强不变,体积变大;
(4)运用勒夏特列原理解答.(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,
故答案为:1:3;1:1;
(2)升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量=[气体质量总和/气体物质的量总和],所以,混合气体的平均相对分子质量减小;
因容器体积没变,气体质量不变,所以密度不变,
故答案为:变小;不变;
(3)充入氩气并保持压强不变,体积变大,相关气体的分压变小,平衡向体积增大的逆向移动,
故答案为:逆向;
(4)升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:小于.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了反应速率与化学计量数的关系、气体的平均相对分子质量、密度、化学平衡的移动,题目难度不大.1年前查看全部
- 哈伯观测了什么天体,决定了仙女座星云其实是在我们银河之外的星系
 reddog20041年前2
reddog20041年前2 -
 朴爷驾到 共回答了24个问题
朴爷驾到 共回答了24个问题 |采纳率87.5%1924年哈勃把天文望远镜对准仙女座大星云,分辨出构成该星云的单个星体,使河外星系和尘埃云得以区分,并发现仙女座大星云不是银河系中的天体,而是距地球约220万光年之遥的与我们的银河系一样的星系,谓之河外星系1年前查看全部
- (2008•南通)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在
(2008•南通)1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式为N2+3H2
2NH3高温、高压 .催化剂 N2+3H2.
2NH3高温、高压 .催化剂
(2)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序______(将如图五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序______(将如图五张图按反应过程顺序用序号排列).
(3)表面化学对于化学工业很重要,它可以帮助我们了解不同的过程.在潮湿的空气里,铁表面吸附了一层薄薄的水膜,同时由于空气中O2的溶解,水膜呈中性.若空气中CO2溶解,水膜呈酸性,写出该反应的化学方程式______.在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在催化剂表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式2CO+2NO
N2+2CO2催化剂 .2CO+2NO.
N2+2CO2催化剂 . 想说就说哈1年前1
想说就说哈1年前1 -
 uu退散 共回答了17个问题
uu退散 共回答了17个问题 |采纳率94.1%解题思路:书写化学方程式时,必须知道反应物、生成物和反应条件,必须遵守质量守恒定律的两个原则.
(1)该反应是在高温、高压和催化剂三个条件的共同作用下完成的.
(2)可以从化学反应的实质分析、推导,从而得出本题的答案.
(3)第一空答案的得出,必须结合二氧化碳与水的反应和碳酸的酸碱性.
第二空可以根据质量守恒定律得出生成物是氮气和二氧化碳,然后再根据化学方程式的书写方法得出本题的答案.(1)氢气和氮气在高温、高压和催化剂的条件下反应生成氨.
该反应的化学方程式为:N2+3H2
高温、高压
.
催化剂2NH3.
(2)化学反应的实质是分子分成原子,原子重新组合成新的分子.因此应从表示氮气和氢气的图形⑤开始,到分子分成原子的图形④,到原子的重新组合的图形①,到形成新分子的图形②,到新分子脱离催化剂的图形③,从而完成整个反应.
(3)水膜中溶解了二氧化碳后,由于二氧化碳能与水化合生成碳酸,碳酸又具有酸性,因此水膜呈酸性.上述反应的化学方程式为:CO2+H2O=H2CO3.
根据空气的组成成分和质量守恒定律可知:两种生成物是氮气和二氧化碳.
因此一氧化碳和一氧化氮在催化剂的作用下反应生成氮气和二氧化碳.
该反应的化学方程式为:2CO+2NO
催化剂
.
N2+2CO2.
故答案为:
(1)N2+3H2
高温、高压
.
催化剂2NH3.
(2)⑤④①②③.
(3)CO2+H2O=H2CO3;2CO+2NO
催化剂
.
N2+2CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;微粒观点及模型图的应用;质量守恒定律及其应用.
考点点评: 本题主要考查化学方程式的书写和化学反应的实质,同时加强了对化学反应的实质的理解和应用.难度较大.1年前查看全部
- 1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)将氢气和氮气在高温、高压和催化剂的条件下合成氨(NH3).反应的化学方程式N2+3H2
2NH3催化剂 .高温高压 N2+3H2.
2NH3催化剂 .高温高压
(2)用 分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序______(将图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序______(将图按反应过程顺序用序号排列).
(3)表面化学对于化学工业很重要,它可以帮助我们了解不同的过程.在潮湿的空气里,铁表面吸附了一层薄薄的水膜,同时由于空气O2的溶解,水膜呈中性.若空气中CO2溶解,水膜呈酸性,写出该反应的化学方程式______.在汽车排气管上安装尾气净化装置,可使尾气中的CO和NO在催化剂表面发生反应,产生两种空气组成的气体,写出该反应的化学方程式2CO+2NO
N2+2CO2催化剂 .2CO+2NO.
N2+2CO2催化剂 . 新幼卫门1年前1
新幼卫门1年前1 -
 长袜子 共回答了17个问题
长袜子 共回答了17个问题 |采纳率88.2%(1)反应的化学方程式为:N2+3H2
催化剂
.
高温高压2NH3
(2)在催化剂表面合成氨反应过程的顺序为氮气分子和氢气分子向催化剂表面靠近,吸附在催化剂的表面,在催化剂的作用下分解成氢原子和氮原子,重新结合成氨分子,再离开催化剂表面.故填:⑤④①②③
(3)水和二氧化碳反应生成碳酸,反应的化学方程式为:H2O+CO2=H2CO3;
一氧化碳和一氧化氮反应生成氮气和二氧化碳,反应的化学方程式为(由于烟囱是温度较高的,所以可以注明加热,也可以不写):2CO+2NO
催化剂
.
N2+2CO21年前
41年前查看全部
- 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
(1)合成氨反应的化学方程式为N2(g)+3H2(g)⇌2NH3(g),在一定温度下,向容积不变(始终为10L)的密闭容器中加入2mol N2、8mol H2及固体催化剂.10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为______,用氮气表示的反应速率为:______.反应的化学平衡常数K=______ 若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:______(任意写一条).
(2)在上述平衡中,若再加入2mol NH3、2mol N2,则此时反应平衡将______移动.(填“向正方向”、“向逆方向”或“不”).
(3)已知:0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,则溶液中各离子浓度的大小为:______.若再往混合溶液中再加入0.01mol/L氨水溶液50ml,c(Cl-)-c(NH4+)=______;(用溶液中微粒浓度表示等式)
(4)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
氨催化氧化生成NO和水的热化学方程式为______
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)
请回答:在电解法合成氨的电解池中______(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是______.钯电极A是电解池的______极(填“阳”或“阴”),该极上的电应式是______. cherylzhong1年前1
cherylzhong1年前1 -
 pengtt651 共回答了15个问题
pengtt651 共回答了15个问题 |采纳率100%解题思路:(1)令参加反应的氮气的物质的量为amol,利用三段式表示出各物质的变化量、平衡时物质的量,利用压强之比等于物质的量之比列方程计算a,氨气的体积分数=[平衡时氨气的物质的量/平衡时混合气体总物质的量];根据v=
计算v(N2);根据k=△n V △t
计算平衡常数;要提高氨气的产率,应改变条件,使平衡向正反应方向移动;c2(NH3) c(N2)•c3(H2)
(2)再加入2mol NH3、2mol N2,计算此时的浓度商,与平衡常数比较判断;
(3)0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,所得溶液为NH4Cl溶液,溶液中铵根离子水解,溶液呈碱性,据此判断溶液中各离子浓度的大小;根据电荷守恒计算c(Cl-)-c(NH4+);
(4)根据盖斯定律书写目标热化学方程式;
(5)新法合成氨电解池的反应温度是570℃时,水为水蒸气;
由图可知,氮气在钯电极A上获得电子与B电极产生的氢离子生成氨气,发生还原反应,为电解池的阴极.(1)令参加反应的氮气的物质的量为amol,则:
N2(g)+3H2(g)═2NH3(g)
开始(mol):28 0
转化(mol):a 3a 2a
平衡(mol):2-a 8-3a 2a
故2-a+8-3a+2a=(2+8)×80%,解得a=1
所以,氨气的体积分数=[2×1mol
(2mol+8mol)×80%=25%,
v(N2)=
1mol/10L
10min]=0.01mol/(L•min),
平衡时,氮气的浓度为[2mol−1mol/10L]=0.1mol/L、氢气浓度=[8mol−3mol/10L]=0.5mol/L、氨气浓度=[2mol/10L]=0.2mol/L,故平衡常数k=
0.22
0.1×0.53=3.2,
若想提高氨气的产率,化学平衡向右移动,可以是增大氢气浓度或增大氮气浓度或增大反应物浓度或降温或增大压强或及时转移走生成的氨,
故答案为:25%;0.01mol/(L•min);3.2;增大氢气浓度(或增大氮气浓度或增大反应物浓度或降温或增大压强或及时转移走生成的氨);
(2)再加入2mol NH3、2mol N2,此时,氮气的浓度为0.1mol/L+[2mol/10L]=0.3mol/L,氢气浓度不变为0.5mol/L,氨气浓度=[2mol/10L]+0.2mol/L=0.4mol/L,此时的浓度商Qc=
0.42
0.3×0.53=4.27,大于平衡常数,故平衡向逆反应方向移动,
故答案为:向逆方向;
(3)0.01mol/L氨水溶液50ml与同浓度同体积的盐酸混合,所得溶液为NH4Cl溶液,溶液中铵根离子水解,溶液呈碱性,故溶液中各离子浓度的大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),根据电荷守恒可知c(NH4+)+c(H+)=c(Cl-)+c(OH-),故c(Cl-)-c(NH4+)=c(H+)-c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);c(H+)-c(OH-);
(4)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
根据盖斯定律,①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol;
(5)新法合成氨电解池的反应温度是570℃时,水为水蒸气,故在电解法合成氨的电解池中不能用水作电解质溶液的溶剂;
由图可知,氮气在钯电极A上获得电子与B电极产生的氢离子生成氨气,发生还原反应,为电解池的阴极,阴极电极反应式为:N2+6e-+6H+═2NH3,
故答案为:不能;新法合成氨电解池的反应温度是570℃时,水为水蒸气;阴; N2+6e-+6H+═2NH3.点评:
本题考点: 化学平衡的计算;热化学方程式;化学平衡的影响因素;电解原理.
考点点评: 本题以合成氨为载体,考查化学平衡计算及影响因素、反应速率计算、平衡常数计算与应用、离子浓度比较、热化学方程式、电解原理等,题目比较综合,侧重考查学生对知识的迁移应用,难度中等.1年前查看全部
- 氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N 2 (g)+3H 2 (g) 2NH 3 (g) ΔH=-92.4 kJ·mol - 1
2NH 3 (g) ΔH=-92.4 kJ·mol - 1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
中,并补充N 2 和H 2A.采用较高压强 B.采用500 ℃的高温 C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来,剩余N 2 和H 2 循环到合成塔
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
(3)在298 K时,将10 mol N 2 和30 mol H 2 通入合成塔中,放出的热量小于924kJ,原因是______________________________
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H + ),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
 isiah1年前1
isiah1年前1 -
 上海勤思rr中心 共回答了12个问题
上海勤思rr中心 共回答了12个问题 |采纳率100%(1)AD
(2)用湿润的红色石蕊试纸放在管口处,若试纸变蓝则说明有氨气生成
(3)该反应是可逆反应,10 mol N 2 与30 mol H 2 不可能完全反应,所以放出的热量小于10×92.4 kJ=924 kJ
(4)N 2 +6H + +6e - =2NH 3
(1)勒夏特列原理只解释平衡移动问题。(2)根据氨的性质进行检验。(3)合成氨的反应是可逆反应。(4)根据合成氨反应中的氧化剂、电解池中阴极反应特点及电解质成分进行分析。1年前查看全部
- 氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理
氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N 2 (g)+3H 2 (g)  2NH 3 (g);△H=-92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
2NH 3 (g);△H=-92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是_____________(填序号)。
A.向生石灰中滴入浓氨水
B.加热浓氨水
C.直接用氢气和氮气合成
D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是_______________(填序号)。
A.采用较高压强(20 MPa~50 MPa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N 2 和H 2 循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。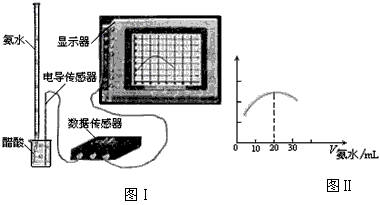
①用滴定管盛氨水前,滴定管要用_____________润洗2~3遍,
②试计算该种氨水的浓度:________________。
③下列情况下,会导致实验结果c(NH 3 ·H 2 O)偏低的是____________。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4)1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H + ),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
正极的电极反应式为:_______________________________。  热带鱼801年前1
热带鱼801年前1 -
 花花的花衬衣 共回答了14个问题
花花的花衬衣 共回答了14个问题 |采纳率92.9%(1)CD
(2)AD
(3)①上述待测氨水;②0.6250 mol/L;③AC
(4)N 2 +6e - =2N 3-1年前查看全部
- 氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(
氨是最重要的氮肥,是产量最大的化工产品之一.德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1,他因此获得了1918年诺贝尔化学奖.
在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)⇌2NH3(g)
(1)当反应达到平衡时,N2和H2的浓度比是______,N2和H2的转化率比是______.
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量______,密度______.(填“变大”“变小”或“不变”).
(3)当达到平衡时,充入氩气并保持压强不变,平衡将______(填“正向”“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将______(填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度______(填“大于”“小于”或“等于”)原来的2倍. 打马吊1年前1
打马吊1年前1 -
 aa05 共回答了19个问题
aa05 共回答了19个问题 |采纳率89.5%解题思路:(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,氮气和氢气的浓度之比永始终是1:3,转化率之比1:1;
(2)平均相对分子质量=[气体质量总和/气体物质的量总和],ρ=[m/V];
(3)充入氩气并保持压强不变,体积变大;
(4)运用勒夏特列原理解答.(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比永始终是1:3,转化率之比1:1,
故答案为:1:3;1:1;
(2)升温,平衡逆向移动,气体物质的量增大,质量不变,气体的平均相对分子质量=[气体质量总和/气体物质的量总和],所以,混合气体的平均相对分子质量减小;
因容器体积没变,气体质量不变,所以密度不变,
故答案为:变小;不变;
(3)充入氩气并保持压强不变,体积变大,相关气体的分压变小,平衡向体积增大的逆向移动,
故答案为:逆向;
(4)升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:向左移动;小于.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查了反应速率与化学计量数的关系、气体的平均相对分子质量、密度、化学平衡的移动,题目难度不大.1年前查看全部
- 1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成
1909年化学家哈伯在实验室首次合成了氨.2007年化学家格哈德•埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
(1)用 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序______(将下面五张图按反应过程顺序用序号排列).
(2)氢气与氮气反应时的化学计量数比是______;该反应属于______反应. 装纯啊1年前1
装纯啊1年前1 -
 烦ll 共回答了17个问题
烦ll 共回答了17个问题 |采纳率94.1%(1)氮气和氢气在催化剂表面合成氨反应过程的顺序为:氮气和氢气向催化剂靠近,氮气和氢气与催化剂混合,在催化剂的作用下氮气和氢气分解成氮原子和氢原子,氮原子和氢原子在催化剂的作用下生成氨分子,氨分子离开催化剂.故填:⑤④①②③.
(2)由图中可知,每3个氢分子和1个氮气分子生成2个氨分子,氢气与氮气反应时的化学计量数比是3:1.
该反应中反应物是两种,生成物是一种,属于化合反应.故填:化合.1年前查看全部
- 介入哈伯太空望远镜发现的蝴蝶星云是
介入哈伯太空望远镜发现的蝴蝶星云是
A:人马座
B:射手座
C:天仙座 gboy20041年前1
gboy20041年前1 -
 swclfy 共回答了14个问题
swclfy 共回答了14个问题 |采纳率100%它距离我们约2100光年远.位于人马座.
A1年前查看全部
- 1909年化学家哈伯在实验室首次合成了氨2007年化学家格哈德·埃特尔在 最后一问急
 唐以洪1年前1
唐以洪1年前1 -
 jxcf 共回答了20个问题
jxcf 共回答了20个问题 |采纳率90%54123 还有楼主前面那反应是可逆反应 要用双箭头1年前查看全部
- 哈伯观测了什么天体,
 暗香花影1年前1
暗香花影1年前1 -
 moguishengcai 共回答了16个问题
moguishengcai 共回答了16个问题 |采纳率93.8%1924年哈勃把天文望远镜对准仙女座大星云,分辨出构成该星云的单个星体,使河外星系和尘埃云得以区分,并发现仙女座大星云不是银河系中的天体,而是距地球约220万光年之遥的与我们的银河系一样的星系,谓之河外星系1年前查看全部
大家在问
- 1如果A是B的充分条件,那么能推出B是A的必要条件吗?
- 2-a²+2ab-b²分解因式
- 3we all sat around the cake怎么翻译
- 4有用尽自己的一切来帮助别人的意思的成语
- 5电路中的小灯泡亮了,小灯泡把电能转化为了内能和光能.为什么说它把电能转化为了内能?
- 6有一批大米.第一天卖出总数的12.5%.第2天卖出总数的6/1.还剩3400千克.一共有多少大米
- 73.14159,根号64,³根号64,π,-根号11,³根号-9,0.334,根号25/36,13/
- 8下列对高等动物通过减数分裂形成生殖细胞以及受精作用的叙述中,不正确的是( )
- 9芳菊开林耀,
- 10I will not think or choose it at this moment!
- 11英语翻译Many years ago ,a very rich woman Judy had three childre
- 12定义新运算:a△b=[ab/a+b],那么2△10△10=______.
- 13九上证明三测试题一、 (每小题3分,共30分)1.如图,在平行四边形ABCD中,对角线AC、BD相交于点O,若BD、AC
- 14物理的基本单位有哪些?
- 15阅读赏析(一)甲文:雨是最寻常的,一下就是三两天。可别恼,像牛毛,像花针,像细丝,密密地斜织着,人家屋顶上全笼着一层薄烟

