以甲醇,乙醇,苯及其他无机试剂为原料,应用丙二酸二乙酯合成(1)2,3-二甲基丁酸 (2)2-卞基
 孤独之旅0022022-10-04 11:39:540条回答
孤独之旅0022022-10-04 11:39:540条回答以甲醇,乙醇,苯及其他无机试剂为原料,应用丙二酸二乙酯合成(1)2,3-二甲基丁酸
(2)2-卞基戊酸.

已提交,审核后显示!提交回复
共0条回复
相关推荐
- (1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为____
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.7kJ,则该反应的热化学方程式应为______.
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,写出该反应的热化学方程式H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/molH2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(g)的△H=______. sqq2581年前1
sqq2581年前1 -
 没落青鸟 共回答了13个问题
没落青鸟 共回答了13个问题 |采纳率84.6%解题思路:(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,并在热化学方程式中标明物质的状态;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),以此来解答.(1)由1gCH3OH燃烧放热22.7kJ,则2molCH3OH燃烧放热22.7×32×2=1452.8kJ,则该燃烧反应的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol;
(2)由氢气和氧气反应生成1mol液态水时放热285.8kJ,则①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,则②H2O(g)=H2O(l)△H=-43.992kJ/mol,
由盖斯定律可知,①×2-②×2得到反应2H2(g)+O2(g)═2H2O(g),
则△H=(-285.8kJ/mol)×2-(-43.992kJ/mol)×2=-483.6kJ/mol,
故答案为:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol;-483.6kJ/mol.点评:
本题考点: 热化学方程式;有关反应热的计算.
考点点评: 本题考查热化学方程式的书写.热化学方程式是表示化学反应与反应热关系的方程式.书写和应用热化学方程式时必须注意以下几点:
①明确写出反应的计量方程式,各物质化学式前的化学计量系数可以是整数,也可以是分数;
②各物质化学式右侧用圆括弧( )表明物质的聚集状态.可以用g、l、s分别代表气态、液态、固态.固体有不同晶态时,还需将晶态注明,例如S(斜方),S(单斜),C(石墨),C(金刚石)等.溶液中的反应物质,则须注明其浓度,以aq代表水溶液,(aq) 代表无限稀释水溶液;
③反应热与反应方程式相互对应.若反应式的书写形式不同,则相应的化学计量系数不同,故反应热亦不同;
④热化学方程式必须标明反应的浓度、温度和压力等条件,若在常温常压时可省略.1年前查看全部
- (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机
 (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式______.
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3-4min之间,化学平衡向______反应方向移动(填“正”或“逆”).时间/min
物质
浓度0 1 2 3 4 CH4 0.2mol•L-1 0.13mol•L-1 0.1mol•L-1 0.1mol•L-1 0.09mol•L-1 H2 0mol•L-1 0.2mol•L-1 0.3mol•L-1 0.3mol•L-1 0.33mol•L-1
②3min时改变的反应条件是______(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示.
①图1中的两条曲线所示投料比的关系X1______X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式______
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为______. qinglaixia1年前1
qinglaixia1年前1 -
 beyond_chu 共回答了13个问题
beyond_chu 共回答了13个问题 |采纳率92.3%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;(2)反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高;②根据压强对平衡移动影响,结合图象分析解答;(4)①甲烷燃料电池工作时,正极发生还原反应,氧气得电子被还原;②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.(1)已知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),由表中数据可知3-4min之间,CH4浓度减小,H2浓度增大,则反应向生产氢气的方向移动,即向正方向进行,故答案为:正;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p1>p2,故答案为:>;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为[8.96L/22.4L/mol]=0.4mol,根据电子转移守恒可知,生成二氧化碳为[0.4mol×4/8]=0.2mol,n(NaOH)=0.1L×3.0mol•L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,发生发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+).点评:
本题考点: 化学平衡的计算;热化学方程式;化学电源新型电池;化学平衡建立的过程;离子浓度大小的比较.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.1年前查看全部
- 以甲醇为原料的一款新型手机电池,其反应原理为:2CH 3 OH+3X+4NaOH═2Na 2 CO 3 +6H 2 O,
以甲醇为原料的一款新型手机电池,其反应原理为:2CH 3 OH+3X+4NaOH═2Na 2 CO 3 +6H 2 O,其中X的化学式为( ) A.CO B.CO 2 C.O 2 D.H 2  langlanmeifu1年前1
langlanmeifu1年前1 -
 听摇滚的土豆 共回答了13个问题
听摇滚的土豆 共回答了13个问题 |采纳率92.3%根据质量守恒定律化学反应前后原子种类不变,原子数目没有增减,在2CH 3 OH+3X+4NaOH═2Na 2 CO 3 +6H 2 O反应前后,碳原子、氢原子、钠原子个数都已相等,而反应后氧原子个数为12个,反应前氧原子个数为6个,故3x个分子中氧原子为6个,故一个X分子中含有2个氧原子,故为氧气
故选C1年前查看全部
- (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
 (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
(2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H2=-192.9KJ•mol-1
下列说法正确的是( )
A.根据②推知:在25℃,101kPa时,1molCH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9kJ
B.反应②中的能量变化如图所示,则△H2=E1-E3
C.H2燃烧能放出大量的热,故CH30H转变成H2的过程必须吸收能量
D.CH30H的燃烧热△H=-192.9kJ•mol-1 梨花压倒菊花1年前1
梨花压倒菊花1年前1 -
 晓之林 共回答了11个问题
晓之林 共回答了11个问题 |采纳率100%解题思路:A、根据物质的能量大小与物质的状态关系来判断;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气能量变化分析;
D、利用盖斯定律分析.A、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故A正确;
B、在反应②中,由图示△H=生成物总能量-反应物总能量=E1-E2,故B错误;
C、由已知可知,反应②为放热反应,故C错误;
D、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.1年前查看全部
- 求甲醇完全燃烧的热化学方程式~~~~~~~~~~~~~~~~
 Iris10181年前2
Iris10181年前2 -
 清y玉 共回答了19个问题
清y玉 共回答了19个问题 |采纳率89.5%2CH3OH(l)+3O2(g)----->2CO2(g)+4H2O(g) ΔH=-137.2KJ/mol1年前查看全部
- 工业酒精究竟是甲醇呢,还是仍是乙醇,只不过作为杂质的甲醇比较多?
 lbtkm1年前1
lbtkm1年前1 -
 weilan__0227 共回答了22个问题
weilan__0227 共回答了22个问题 |采纳率90.9%工业酒精即工业上使用的酒精,含有少量甲醇、96%乙醇.医用酒精一般含有75%的乙醇.工业酒精不能用于人体的消毒,因为甲醇会导致中毒,用于皮肤消毒也会有部分被皮肤吸收,中毒后严重的可导致失明甚至死亡!1年前查看全部
- 甲醇[CH3OH]是一种有毒,有酒的气味的可燃性液体.甲醇在氧气中不完全燃烧可发生如下反应:
甲醇[CH3OH]是一种有毒,有酒的气味的可燃性液体.甲醇在氧气中不完全燃烧可发生如下反应:
可发生如下反应:8CH3OH+nO2=mCO2+2CO+16H2O.若反应生成3.6g的水,请计算:[1]M的值是______ [2]参加反应的氧气质量是多少克?[写出规范计算步骤] keaikeai1年前2
keaikeai1年前2 -
 风解羽 共回答了20个问题
风解羽 共回答了20个问题 |采纳率85%[1]M的值是( 8 )——依据是:方程两边,碳原子的个数相等
经配平后的化学方程式为:
8CH3OH+13O2=8CO2+2CO+16H2O
[2]设参加反应的氧气质量是x克
8CH3OH+13O2=8CO2+2CO+16H2O
416 288
x 3.6g
416/x=288/3.6g
x=5.2g
答:参加反应的氧气质量是5.2克1年前查看全部
- 我没分了下列说法是否正确?为什么?甲烷通常称为沼气,也叫做天然气甲烷.甲醇和酒精的燃烧产物都是CO2和H2O,由此可以推
我没分了
下列说法是否正确?为什么?
甲烷通常称为沼气,也叫做天然气
甲烷.甲醇和酒精的燃烧产物都是CO2和H2O,由此可以推断,甲烷.甲醇.酒精的成分里都只含有碳元素和氢元素 我是夏目漱石的猫1年前5
我是夏目漱石的猫1年前5 -
 okmpl123 共回答了17个问题
okmpl123 共回答了17个问题 |采纳率88.2%1.错
甲烷仅仅是天然气的主要成分.
2.错
CO2和H2O中都含有O,其中O可能是空气中的氧气形成,也可能是甲烷、甲醇、酒精中本身含有的,不能够判断只有C和H,也可能有O.1年前查看全部
- 有关制备甲醇的化学题,有带解析那就更好
有关制备甲醇的化学题,有带解析那就更好
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.①CH4(g)+H2O(g)CO(g)+3H2(g) DH1②CO(g)+2H2(g)CH3OH(g) DH2 将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图.⑴温度不变,缩小体积,①的反应速率(填“增大”、“减小”或“不变”).平衡向方向移动 . ⑵反应①的DH1 0(填“<”“=”或“>”),其平衡常数表达式为K=,100°C时的平衡常数值K= . asansan1年前1
asansan1年前1 -
 寒澹 共回答了23个问题
寒澹 共回答了23个问题 |采纳率91.3%(1)增大(缩小体积就等于增大反应浓度,反应速率自然增大,这一问和平衡没什么关系)
下一问你就得看图了,因为反应①正反应体积增大,而反应②体积减小……总之缩小体积就等于增大压强,你对照图看甲烷的转化率就行了
(2)题目直接问△H1啊……似乎是看图就行了,压强不变时,若温度升高,甲烷转化率也升高,那么就是>,反之是1年前查看全部
- 化学有机选择下列说法错误的是:( )A.酸与醇在强碱催化下加热,生成物一定有酯B.乙酸和甲醇可酯化成甲酸乙酯C.酯化反应
化学有机选择
下列说法错误的是:( )
A.酸与醇在强碱催化下加热,生成物一定有酯
B.乙酸和甲醇可酯化成甲酸乙酯
C.酯化反应的逆反应称为水解反应
D.果类,花类中的香味,是由于含有低级脂类 leier2501年前5
leier2501年前5 -
 命人 共回答了16个问题
命人 共回答了16个问题 |采纳率81.3%A和B都是错误的
A.在强碱作用下不可能发生酯化反应(可以想想强碱催化脂类水解)
B.生成的是乙酸甲酯1年前查看全部
- 植物油与甲醇发生怎样的反应?请说明反应条件和产物
 zswsf6541年前2
zswsf6541年前2 -
 2288387 共回答了22个问题
2288387 共回答了22个问题 |采纳率95.5%脂肪酸甲酯和甘油.
酯交换反应,用超过5-6倍摩尔的甲醇与植物油反应.1年前查看全部
- 甲醇着火为啥不能用水灭火?
 巫格小琴1年前3
巫格小琴1年前3 -
 tjyda 共回答了19个问题
tjyda 共回答了19个问题 |采纳率100%因为加水后,甲醇会扩散开,着火面积扩大,不利于扑救.
一般,液体着火,不用水灭火,原理类似
经常考试的是,酒精灯着火,用沙子灭火,而不用H2O1年前查看全部
- 醋酸甲酯、甲醇、PA三元体系中PA是什么?
醋酸甲酯、甲醇、PA三元体系中PA是什么?
醋酸甲酯、甲醇、PA三元体系中,醋酸甲酯与PA沸点是55.6°C,摩尔分数0.202;甲醇与PA沸点是53.6°C,摩尔分数0.63.PA是一种非极性物质,需要加水从这三元体系中萃取分离.有大侠能推算出是什么物质吗?
邻苯二甲干是什么啊! 玫瑰不慌张1年前1
玫瑰不慌张1年前1 -
 liang8651 共回答了11个问题
liang8651 共回答了11个问题 |采纳率100%邻苯二甲干1年前查看全部
- 工业酒精含水吗?平时说的浓度为97%的工业酒精分别含多少乙醇、甲醇和水?
 杰剑1年前1
杰剑1年前1 -
 py118 共回答了20个问题
py118 共回答了20个问题 |采纳率80%工业酒精的主要成分无疑是酒精——乙醇.由于生产厂家的不同,它的比例也不尽相同.一般都在90%以上,另外还有微量甲醇等杂质以及少量的水.其中的甲醇成分对人来说是属于剧毒的,微量误食即可能导致失明,重则致命.1年前查看全部
- 甲醇是一种优质燃料,可制作燃料电池.
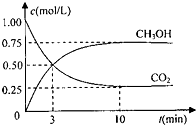 甲醇是一种优质燃料,可制作燃料电池.
甲醇是一种优质燃料,可制作燃料电池.
(1)为探究用 CO2 来生产燃料甲醇的反应原理,现进行如下实验:在体积为 1L 的密 闭容器中,充入 1molCO2 和 3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O (g)△H=-49.0kJ/mol
测得 CO2 和 CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=______
②下列措中能使平衡混合物中 n(CH3OH)/n(CO2) 增大的是
A.加入催化剂 B.充入 He(g),使体系压强增大
C.将 H2O(g)从体系中分离D.降低温度
(2)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为______极,正极反应的电极反应式为______
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H 1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则 1mol 甲醇不完全燃烧生成一氧化碳和液态水时反应的△H=
+2△H3△H1−△H2 2 (用含△H 1、△H2、△H3 的式子表示)
+2△H3△H1−△H2 2  安静jj1年前1
安静jj1年前1 -
 ddxin 共回答了16个问题
ddxin 共回答了16个问题 |采纳率93.8%解题思路:(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,根据浓度变化量之比等于化学计量数之比氢气的浓度变化量,根据v=[△c/△t]计算v(H2);
②使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)根据盖斯定律进行计算.(1)①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)⇌CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=[2.25mol/L/10min]=0.225mol/(L•mon),
故答案为:0.225mol/(L min);
②A.加入催化剂只改变化学反应速率不改变平衡移动,故A错误;
B.充入 He(g),使体系压强增大,反应物和生成物浓度不变,所以平衡不移动,故B错误;
C.将 H2O(g)从体系中分离,平衡向正反应分析移动,则n(CH3OH)/n(CO2)增大,故C正确;
D.D.降低温度向正反应分析移动,则n(CH3OH)/n(CO2)增大,故D正确;
故选C D;
(2)甲醇燃料电池中,燃料失电子发生氧化反应,所以通入甲醇的电极是负极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;
故答案为:负;O2+2H2O+4e-=4OH-;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H 1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H 3
由盖斯定律[①−②/2+2③得CH3OH(l)+O2(g)=CO(g)+2H2O(l),故△H=
△H1−△H2
2]+2△H3,
故答案为:
△H1−△H2
2+2△H3.点评:
本题考点: 化学电源新型电池;用盖斯定律进行有关反应热的计算;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了化学平衡的计算、平衡移动方向的判断、盖斯定律、原电池原理等知识点,这些都是学习重点,难点是化学平衡移动方向的判断,易错选项是(1)②B,改变体系压强不一定使平衡移动,只有改变压强能使反应物或生成物浓度的,平衡才移动,为易错点.1年前查看全部
- 甲烷与甲醇有关系吗二氯乙烷又是怎么回事
 一个教师的自白1年前1
一个教师的自白1年前1 -
 漫画之家net 共回答了21个问题
漫画之家net 共回答了21个问题 |采纳率95.2%甲烷的结构式为CH4
甲醇的结构式为CH3OH
它们之间没有必然的联系,因为甲烷属于烷烃,甲醇属于醇类,他们的物理性质和化学性质均不同.
二氯乙烷分为1,1-二氯乙烷和1,2-二氯乙烷两种,它是乙烷上的两个氢被两个氯所取代生成的产物.1年前查看全部
- 甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
反应Ⅰ:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g) △H1
CO(g)+3H 2 (g) △H1
反应Ⅱ:CO(g)+2H 2 (g) CH 3 OH(g) △H2
CH 3 OH(g) △H2
(1)如图是反应1进行过程中的能量变化示意图。根据图象判断,升高温度,反应I的平衡常数将____________ (填“增大”、“减小”或“不变”)。反应I的逆反应的活化能为___________(用含E1、E2的表达式表示)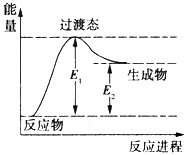
(2)已知在催化剂和一定压强下,反应?能自发进行。若保持容器容积不变,下列措施可增加该反应中CO转化率的是___________(填字母)。
A.适当降低温度
B.将甲醇从反应体系中分离出来
C.充入He,使体系总压强增大
D.按原比例再充入CO和H 2
(3)一种甲醇燃料电池以多孔石墨为电极,一极通入甲醇蒸气,另一极通入氧气,电解质溶液为4L 1 moI/L的KOH溶液。当有3 mol甲醇放电时,电解质溶液中各种离子的浓度由大到小的顺序为_________________
(4)下图甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH 3 OH+3O 2 2CO 2 +4H 2 O。
2CO 2 +4H 2 O。
①M电极的电极反应式为______________________________。
②以上述电池做电源,用乙图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):______________。Al电极应接燃料电池的___________(填“M”或“N”)极。 llc4444441年前1
llc4444441年前1 -
 1000712 共回答了29个问题
1000712 共回答了29个问题 |采纳率86.2%1年前查看全部
- 一瓶色谱用的甲醇,价格多少?一瓶分析纯的甲醇,价格又多少?
 小棉0001年前4
小棉0001年前4 -
 浪漫简史 共回答了14个问题
浪漫简史 共回答了14个问题 |采纳率100%分析甲醇,500ml,国产5块一瓶,色谱的一般在8-12块 一瓶,500ml的;进口4升,好点的在220一瓶,差点的在160一瓶1年前查看全部
- 甲醇 乙腈 在甲醇钠催化剂存在下反应生成什么?
甲醇 乙腈 在甲醇钠催化剂存在下反应生成什么?
反应条件 25摄氏度 保温12H.
具体条件有知道者也可! 誊娆1年前1
誊娆1年前1 -
 十里啷铛被ll了 共回答了24个问题
十里啷铛被ll了 共回答了24个问题 |采纳率83.3%CH3C(OCH3)31年前查看全部
- 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
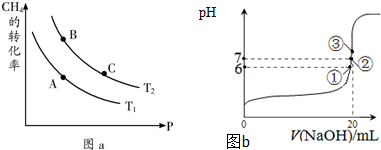 开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ•mol-1
CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ•mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去.工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法.此反应称为一氧化碳变换反应,该反应的热化学方程式是______.
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a.则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为______.(填“<”、“>”、“=”);
②100℃时,将1mol CH4和2mol H2O通入容积为1L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是______.
a.容器内气体密度恒定
b.单位时间内消耗0.1mol CH4同时生成0.3molH2
c.容器的压强恒定
d.3v正(CH4)=v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图b所示,下列说法正确的是______.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,该反应的化学方程式为______. eiowenig1年前1
eiowenig1年前1 -
 美yy大uu卡特 共回答了23个问题
美yy大uu卡特 共回答了23个问题 |采纳率91.3%解题思路:(1)根据盖斯定律书写目标热化学方程式;
(2)①平衡常数只受温度影响,处于等温线上各点平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大;
②达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断;
(3)A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.根据电荷守恒计算;
C.根据电荷守恒计算;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电荷守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半;
(4)电负性F>O,故H-O-F中F元素表现-1价,与水反应生成HF,发生水解反应,可推知A为H-O-O-H.(1)已知:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)△H=+165.0kJ•mol-1
根据盖斯定律,②-①得:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ•mol-1,
故答案为:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2 kJ•mol-1;
(2)①平衡常数只受温度影响,B、C处于等温线上,平衡常数相等,由图可知,压强一定时,温度T2条件下,甲烷的转化率更大,则反应进行的程度更大,比温度T1时的平衡常数大,故平衡常数KC=KB>KA,
故答案为:KC=KB>KA;
②a.100℃时,反应混合物都是气体,混合气体总质量不变,容器的容积不变,容器内气体密度始终不变,不能说明得到平衡,故a错误;
b.单位时间内消耗0.1mol CH4同时生成0.3molH2,反应始终按此比例进行,不能说明到达平衡,故b错误;
c.随反应进行混合气体总物质的量增大,容器容积不变,压强增大,当容器的压强恒定时,说明到达平衡,故c正确;
d.3v正(CH4)=v逆(H2),不能物质的正逆速率之比等于化学计量数之比,反应到达平衡,故d正确,
故答案为:cd;
(3)A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的不相等,故错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)=c(Na+),故正确;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故错误;
故选BC;
(4)电负性F>O,故H-O-F中F元素表现-1价,与水反应生成HF,发生水解反应,可推知A为H-O-O-H,该反应的化学方程式为:H2O+HFO=HF+H2O2,
故答案为:H2O+HFO=HF+H2O2.点评:
本题考点: 转化率随温度、压强的变化曲线;热化学方程式;化学平衡状态的判断.
考点点评: 本题比较综合,涉及热化学方程式、化学平衡图象及影响因素、平衡常数、平衡状态判断、弱电解质的电离、离子浓度比较等,(3)中注意溶液中离子浓度等量关系,经常考虑电荷守恒、物料守恒、质子恒等式等.1年前查看全部
- (2014•合肥三模)二氧化碳和氢气可在一定条件下反应,生成一种重要的化工原料甲醇CO2+3H2 钌−膦鉻合物
(2014•合肥三模)二氧化碳和氢气可在一定条件下反应,生成一种重要的化工原料甲醇CO2+3H2
CH3OH+H2O.下列有关该反应的说法正确的是( )钌−膦鉻合物 .加压
A.为二氧化碳的利用创造一种新途径
B.氢原子数在反应前后发生了改变
C.钌-膦铬合物的质量在反应前后发生了变化
D.属于置换反应 八戒小和尚1年前1
八戒小和尚1年前1 -
 rr飞扬少 共回答了18个问题
rr飞扬少 共回答了18个问题 |采纳率77.8%A、二氧化碳含量多了会造成温室效应,该反应能吸收二氧化碳,且生成甲醇和水,所以为CO2的利用创造了一种新途径,故A正确;
B、由质量守恒定律可知反应前后各种原子的数目和种类不变,故B错;
C、钌-膦铬合物是该反应的催化剂,催化剂反应前后质量不变,故C错;
D、反应物中有单质和化合物,生成物是两种化合物,所以该反应不是置换反应,故D错.
故选A.1年前查看全部
- 哪位朋友给介绍几种含碳的有机化合物含碳的是液体最好还能与甲醇互溶
 卡卡西291年前2
卡卡西291年前2 -
 wjhd2002 共回答了24个问题
wjhd2002 共回答了24个问题 |采纳率95.8%二甲基甲酰胺(DMF)1年前查看全部
- 甲醇与液化气互溶吗液态液化气与甲醇互溶吗?如果在球罐中,甲醇在底部还是均匀分布啊?
 mr20101年前1
mr20101年前1 -
 云水相依 共回答了26个问题
云水相依 共回答了26个问题 |采纳率96.2%互溶,而且甲醇与液化气不能通过沉降的方法分离,球罐中均匀分布,不懂追问,1年前查看全部
- 下列各组物质的名称、俗名、化学式(主要成分)不能表示同一种物质的是( ) A.甲烷、甲醇、CH 4 B.二氧化碳、干冰
下列各组物质的名称、俗名、化学式(主要成分)不能表示同一种物质的是( ) A.甲烷、甲醇、CH 4 B.二氧化碳、干冰、CO 2 C.甲烷、沼气、CH 4 D.一氧化碳、煤气、CO  jilke1年前1
jilke1年前1 -
 实际上32 共回答了28个问题
实际上32 共回答了28个问题 |采纳率89.3%A、甲烷化学式用CH 4 表示,而甲醇的化学式是CH 3 OH,故A符合题意;
B、固态的二氧化碳称为“干冰”,二氧化碳化学式为:CO 2 ,故B不符合题意;
C、沼气的主要成分是甲烷,甲烷化学式用CH 4 表示,故C不符合题意;
D、煤气中含有一氧化碳,一氧化碳化学式用CO表示,故D不符合题意.
故选A.1年前查看全部
- (2014•延边州模拟)甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2014•延边州模拟)甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:co(g)+2h2(g)⇌ch3oh(g)△h1
反应Ⅱ:co2(g)+3h2(g)⇌ch3oh(g)+h2o(g)△h2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(k).
由表中数据判断△h1______0(填“<”、“=”或“>”).温度 250℃ 300℃ 350℃ k 2.041 0.270 0.012
②某温度下,将2mol co和6mol h2充入2l密闭容器中充分反应,4分钟后反应达到平衡,测得co的物质的量为0.4mol,则co的反应速率为______,此时的压强是反应前压强的______倍.
(2)反应Ⅱ的平衡常数表达式为c(h2o)c(ch3oh) c(co2)c3(h2) ,为了加快反应Ⅱ的反应速率,并且提高h2的转化率,采取的措施是______(填写正确选项的字母).c(h2o)c(ch3oh) c(co2)c3(h2)
a.增大co2的浓度 b.增大h2的浓度 c.增大压强 d.加入催化剂
(3)工业上利用co与水蒸气的反应,将***co转化为无毒的co2,书写有关热化学反应方程式______.该反应在830k下进行时,初始浓度到达平衡的时间有如下的关系:
则n为______min.co的初始浓度(mol/l) 2 4 1 3 h2的初始浓度(mol/l) 3 2 3 3 时间(min) 8 6 12 n
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池.该电池中甲醇发生反应的一极为______极、其电极反应式为______.
(5)用该电池作电源,用惰性电极电解饱和nacl溶液时,每消耗0.2mol ch3oh,阴极产生标况下气体的体积为______l. 我要裸聊1年前1
我要裸聊1年前1 -
 燕爱豆21 共回答了22个问题
燕爱豆21 共回答了22个问题 |采纳率95.5%解题思路:(1)①图表分析判断,平衡常数随温度升高减小,平衡逆向进行,正反应是放热反应;
②依据化学平衡三段式列式结合化学反应速率概念计算,压强之比等于气体物质的量之比;
(2)依据反应化学方程式结合平衡常数概念书写平衡常数表达式,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,依据影响化学反应速率和平衡的因素分析判断;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;依据图表数据分析变化规律得到n值;
(4)燃料电池中燃料在原电池负极发生氧化反应,甲醇失电子在碱溶液中生成碳酸钾;
(5)依据原电池和电解池的电极反应中电子守恒计算生成气体体积;(1)①图表分析判断,平衡常数随温度升高减小,平衡逆向进行,正反应是放热反应,△H<0;
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,依据化学平衡三段式列式计算;
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol) 2 6 0
变化量(mol)1.63.2 1.6
平衡量(mol) 0.42.8 1.6
CO的反应速率=
1.6mol
2L
4min=0.2mol/(L•min)
平衡状态气体压强和起始压强之比等于气体物质的量之比P(平衡):P(起始)=(0.4+2.8+1.6):(2+6)=4.8:8=0.6;
故答案为:0.2mol/(L•min),0.6;
(2)CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),反应的平衡常数K=
c(H2O)c(CH3OH)
c(CO2)c3(H2);
为了加快反应Ⅱ的反应速率,并且提高H2的转化率;
a.增大CO2的浓度,增大氢气的转化率,平衡正向进行,反应速率加快,故a符合;
b.增大H2的浓度,平衡正向进行,反应速率增大,氢气的转化率减小,故b不符合;
c.增大压强,反应速率增大,平衡正向进行,氢气转化率增大,故c符合;
d.加入催化剂改变化学反应速率不改变化学平衡,氢气转化率不变,故d不符合;
故答案为:K=
c(H2O)c(CH3OH)
c(CO2)c3(H2),a、c;
(3)反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
依据盖斯定律反应Ⅰ-反应Ⅱ得到CO(g)+H2O(g)=CO2(g)+H2(g)△H=△H1-△H2;
图表中数据保持氢气初始浓度不变,一氧化碳浓度增大一倍,达到平衡所需时间缩短4分钟,所以分析判断n=4min;
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=△H1-△H2 、4;
(4)甲醇和氧气以强碱溶液为电解质溶液的新型手机电池,燃料电池中燃料在原电池负极发生氧化反应,甲醇失电子在碱溶液中生成碳酸钾,该电池中甲醇发生反应的一极为负极,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;
故答案为:负,CH3OH-6e-+8OH-=CO32-+6H2O;
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,CH3OH-6e-+8OH-=CO32-+6H2O,每消耗0.2mol CH3OH,转移电子1.2mol,阴极电极反应为2H++2e-=H2↑,产生标况下气体的体积=0.6mol×22.4L/mol=13.44L;
故答案为:13.44.点评:
本题考点: 化学平衡的影响因素;常见化学电源的种类及其工作原理;化学平衡常数的含义;电解原理.
考点点评: 本题考查了化学平衡影响因素分析,平衡常数计算应用,热化学方程式和原电池原理、电解池原理的计算分析应用,掌握基础是解题关键,题目难度中等.1年前查看全部
- 我怀孕前经常接触化工原料,如:甲缩醛,甲醇,甲烷,丙烷,现在怀孕了对胎儿有影响吗?
 mmx_20061年前1
mmx_20061年前1 -
 浪人师哥 共回答了22个问题
浪人师哥 共回答了22个问题 |采纳率90.9%怀孕前的话关系不大,怀孕后最好不要接触了
记得采纳啊1年前查看全部
- 无水氯化钙与乙醇生成络合物,和甲醇会吗?
无水氯化钙与乙醇生成络合物,和甲醇会吗?
无水氯化钙不能用于干燥乙醇,会生成CaCl2·4C2H5OH,如果是含有甲醇的体系可以用氯化钙来干燥吗? mbmbnn1年前1
mbmbnn1年前1 -
 咳嗽三号 共回答了23个问题
咳嗽三号 共回答了23个问题 |采纳率91.3%不可以
一样会形成配合物1年前查看全部
- 一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)⇌CH3OH(g),在不同温度下甲醇的物质的量随
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)⇌CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示,下列叙述真确的是( )
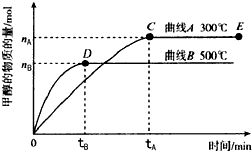
A.平衡常数K(300℃)小于K(500℃)
B.在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大
C.300℃,当容器内气体密度不变时说明反应已经达到平衡
D.500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
mol•L-1•min-1nB 3tB  爱在五月1年前1
爱在五月1年前1 -
 ocys0c 共回答了14个问题
ocys0c 共回答了14个问题 |采纳率85.7%解题思路:A.温度越高,甲醇的物质的量越少,根据K=
判断;c(CH3OH) c(CO)•c3(H2)
B.物质的量不变,体积减小,则浓度增大;
C.根据气体的密度等于气体质量和容器体积的比值来判断;
D.先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比.A.温度越高,甲醇的物质的量越少,则一氧化碳和氢气的物质的量越多,根据K=
c(CH3OH)
c(CO)•c3(H2)判断知,平衡常数越小,所以K(500℃)<K(300℃),故A错误;
B.在其他条件下不变时,压缩处于E点的体系体积,氨气浓度增大,故B正确;
C.容器内气体密度ρ=[m/V],体积V不变,M守恒,密度始终不变,所以密度不变时不能说明反应已经达到平衡,故C错误;
D.500℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
nB
3tBmol/(L•min),同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比,所以v(H2)=
2nB
3tBmol/(L•min),故D错误;
故选B.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题考查了物质的量随时间变化曲线,根据压强和温度对化学平衡的影响、反应速率公式等来分析解答,易错选项是C,注意增大压强时,平衡向正反应方向移动,但氢气、一氧化碳浓度增大,为易错点.1年前查看全部
- 甲酸和甲醇的酯化反应,求~~~~~~~~~~·
 zxcmvjskdfoiasdu1年前4
zxcmvjskdfoiasdu1年前4 -
 乱无知 共回答了17个问题
乱无知 共回答了17个问题 |采纳率82.4%HCOOH+CH3OH=HCOOCH3+H2O
条件浓H2SO4,加热1年前查看全部
- (1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃
(1)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/molCH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol.
(2)已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热△H分别是-285.8kJ•mlo-1、-1411.0kJ•mlo-1和-1366.8kJ,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的热化学方程式______. 八猪猪1年前1
八猪猪1年前1 -
 pinkromeo 共回答了20个问题
pinkromeo 共回答了20个问题 |采纳率95%解题思路:(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态,根据燃烧热的概念结合热化学方程式的书写来回答;
(2)由燃烧热的概念写出各反应的热化学方程式,利用盖斯定律计算.(1)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,64g即2molCH3OH在氧气中燃烧生成CO2和液态水,放出1452.8kJ热量,
则燃烧热的热化学方程式为:CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol,
故答案为:CH3OH(g)+[3/2]O2(g)═CO2(g)+2H2O(l)△H=-726.4KJ/mol;
(3)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,
则有:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+2O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③C2H5OH(l)+2O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol;
故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol;点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 本题考查反应热的计算,热化学方程式书写,燃烧热概念的计算应用,题目难度中等,注意盖斯定律应用于反应热的计算.1年前查看全部
- (1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:________________ 。
(2)已知反应N 2 (g)+3H 2 (g) 2NH 3 (g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________。
2NH 3 (g) △H=a kJ/mol。试根据表中所列键能数据估算a的数值:_________。 
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:
C(s,石墨)+O 2 (g)== CO 2 (g) △H1=-393.5kJ·mol -1 ①
2H 2 (g)+O 2 (g)== 2H 2 O(1) △H2=-571.6kJ·mol -1 ②
2C 2 H 2 (g)+5O 2 (g)== 4CO 2 (g)+2H 2 O(l) △H3 =-2599kJ·mol -1
③ 根据盖斯定律,计算298K时由C(s,石墨)和H 2 (g)生成1mol C 2 H 2 (g)反应的焓变:_________。 迭戈肖1年前1
迭戈肖1年前1 -
 bohei 共回答了12个问题
bohei 共回答了12个问题 |采纳率91.7%(1)2CH 3 OH(1)+3O 2 (g)===2CO 2 (g)+4H 2 O(l) △H=-1452.8 kJ/mol
(2)-93
(3)△H=+226.7 kJ/mol1年前查看全部
- 含甲醇质量分数为80%的甲醇水溶液中,甲醇的分子数与溶液分子总数之比约为?)
含甲醇质量分数为80%的甲醇水溶液中,甲醇的分子数与溶液分子总数之比约为?)
含甲醇质量分数为80%的甲醇水溶液中,甲醇的分子数与溶液分子总数之比约为( )
A.0.7 B.0.6 C.0.5 D.0.4 zfw1101年前1
zfw1101年前1 -
 无忧子 共回答了16个问题
无忧子 共回答了16个问题 |采纳率100%设有100g溶液,则甲醇有80g,水20g
溶液中甲醇的分子数与溶液分子总数之比为:
(80/32):(80/32+20/18)=0.7
正确答案是A1年前查看全部
- 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
(1)写出CO燃烧的热化学方程式______;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);
①温度升高该反应的平衡常数______(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是3nB 2tB mol•L-1•min-13nB 2tB
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,负极的反应式为______. mwemei1年前1
mwemei1年前1 -
 津女 共回答了16个问题
津女 共回答了16个问题 |采纳率100%解题思路:(1)依据热化学方程式书写方法和注意问题标注物质聚集状态和对应焓变;
(2)根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
(3)①依据先拐先平的判断方法可知T1<T2,温度变化判断平衡移动的分析分析平衡常数变化;
②依据图象分析甲醇的平衡物质的量和时间,结合化学方程式计算消耗氢气的物质的量,结合反应速率概念计算得到;
(4)甲醇燃料电池,燃料在负极失电子发生氧化反应.(1)由CO(g)的燃烧热△H分别为-283.0kJ•mol-1,则一氧化碳燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1
故答案为:2CO(g)+O2(g)=2CO2(g)△H=-566KJ•mol-1;
(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)①图象分析先拐先平,温度高,T1<T2,温度越高甲醇物质的量越小,说明平衡逆向进行,平衡常数减小,故答案为:减小;
②B过程依据图象分析,在tB达到平衡时生成甲醇nBmol,依据化学方程式CO2+3H2=CH3OH+H2O,消耗氢气物质的量为3nBmol,用H2表示该反应的化学反应速率=
3nBmol
2L
tBmin=
3nB
2tBmol/L•min,故答案为:
3nB
2tB;
(4)直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-═CO32-+3H2O,甲醇燃料电池,燃料在负极失电子发生氧化反应,负极的反应式为:
CH3OH-6e-+8OH-═CO32-+6H2O,故答案为:CH3OH-6e-+8OH-═CO32-+6H2O.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡的影响因素.
考点点评: 本题考查了热化学方程式的书写和盖斯定律的应用,化学平衡的影响因素分析判断,图象分析应用能力,原电池电极反应书写方法,题目难度中等.1年前查看全部
- 据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH 3 OH+3O 2 +4OH - 2CO 3 2- +6H 2 O,则下列说法错误的是[ ]
2CO 3 2- +6H 2 O,则下列说法错误的是[ ]A.放电时CH 3 OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH 3 OH-6e - +8OH - =CO 3 2- +6H 2 O
D.充电时每生成1mol CH 3 OH转移6mol电子 coangel1年前1
coangel1年前1 -
 poppy05 共回答了10个问题
poppy05 共回答了10个问题 |采纳率90%A1年前查看全部
- 甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
甲醇 乙醇 硝酸 硫酸 双氧水可以用来清洁什么
清洗什么物品 不把斋的和尚被封1年前2
不把斋的和尚被封1年前2 -
 vampire32167 共回答了17个问题
vampire32167 共回答了17个问题 |采纳率70.6%甲醇 乙醇清洗油污及其他有机物
硝酸洗可除去银镜、铜镜等物质
硫酸洗可除去金属、金属氧化物
双氧水可以除去带有还原性的物质,1年前查看全部
- 请问甲醇和水共沸吗?如果共沸,请问共沸点和共沸比例是多少?有方法能破坏这种共沸吗?如何有效分离呢?
请问甲醇和水共沸吗?如果共沸,请问共沸点和共沸比例是多少?有方法能破坏这种共沸吗?如何有效分离呢?
加入生石灰消耗掉水?生石灰遇水大量放热, FIFI61571年前1
FIFI61571年前1 -
 木头鬼童 共回答了17个问题
木头鬼童 共回答了17个问题 |采纳率94.1%共沸的
需要实验
加入生石灰1年前查看全部
- 在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5C
在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;上述反应中B物质的化学式为( )
A. H2
B. O2
C. NO
D. CO 朝晖路打更的1年前1
朝晖路打更的1年前1 -
 半点微笑005 共回答了19个问题
半点微笑005 共回答了19个问题 |采纳率84.2%解题思路:由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则可推测B物质的化学式.由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则反应前的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子5个;而反应后的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子29个,故可知12B中含有24个氧原子.故为:O2.
故选B.点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力,学会利用质量守恒定律的元素守恒处理问题.1年前查看全部
- 乙酸在浓硫酸条件下与甲醇共热反应方程式是什么
乙酸在浓硫酸条件下与甲醇共热反应方程式是什么
同上 rongrong291年前1
rongrong291年前1 -
 ihznay6 共回答了9个问题
ihznay6 共回答了9个问题 |采纳率66.7%CH3COOH+C2H5OH→CH3COOC2H5+H2O
加热条件下浓硫酸做催化剂,酯化反应
有机反应用箭头,不是等号1年前查看全部
- 某废水处理站用甲醇处理含氨34mg/L的废水,其反应原理如下:
某废水处理站用甲醇处理含氨34mg/L的废水,其反应原理如下:

问:在处理过程中,氨转化为氮气可达98%,如果每天处理500立方米的废水,计算每天需要甲醇多少kg?每天有多少kg 氮气放出?
 新好男人20051年前2
新好男人20051年前2 -
 qiaojs 共回答了20个问题
qiaojs 共回答了20个问题 |采纳率90%V(需处理的废水)=500m3×1000(l/m3)=500000L ;
m(氨的总量)=0.034g/L ×500000L =17000g ;
n(氨的总量)=m(氨的总量)/(17g/mol)
=17000g/(17g/mol)=1000mol ;
n(处理氨的总量)=n(氨的总量)×98%=1000mol ×98%=980mol ;
有反应原理得出以下反应关系:
5CH3OH------3N2-------6硝酸根------6NH3
5 3 6
n(CH3OH) n(N2) 980mol
n(CH3OH) = (980mol×5)/ 6 ;
m(CH3OH) =【 (980mol×5)/ 6】×(32g/mol)=26133.3g≈26.1kg ;
n(N2) = (980mol×3)/ 6 =490mol ;
m(N2) =(490mol)×(28g/mol)=13720g≈13.7kg ;
答:每天需甲醇约26.1kg ,放出氮气约13.7kg.1年前查看全部
- 苯加甲醇是生成甲苯加水,还是苯酚加甲烷?反应条件是什么?
 lwx200520061年前1
lwx200520061年前1 -
 犹豫当中 共回答了24个问题
犹豫当中 共回答了24个问题 |采纳率91.7%在AlCl3催化下,苯也可以和醇反应,苯环上的氢原子被烷基取代生成烷基苯1年前查看全部
- 在使用5%甲醇冲洗色谱柱时,压力线每隔20min会有个压力下降,形成一个压力线的倒三角形.
在使用5%甲醇冲洗色谱柱时,压力线每隔20min会有个压力下降,形成一个压力线的倒三角形.
已检查过色谱柱接头,未出现漏液! 风格20001年前1
风格20001年前1 -
 lillian007 共回答了21个问题
lillian007 共回答了21个问题 |采纳率95.2%是新色谱柱吗?如果是新色谱柱,有可能是色谱柱塌陷导致柱压的变化.建议你上“色谱世界”网站看看,这网站在色谱方面非常专业,会对你有很大帮助的.1年前查看全部
- 若有16g的甲醇完全燃烧可生成二氧化碳多少克
 北海漂流瓶1年前2
北海漂流瓶1年前2 -
 玲珑蕊 共回答了14个问题
玲珑蕊 共回答了14个问题 |采纳率100%设16g甲醇完全燃烧生成二氧化碳的质量是x.
2CH3OH+3O2=点燃=2CO2+4H2O
64 88
16g x
64/16=88/x
x=22g
答:16g甲醇完全燃烧生成二氧化碳22g.1年前查看全部
- 如何用市售盐酸配制2.5mol/L盐酸甲醇溶液?
 灯心草星星1年前1
灯心草星星1年前1 -
 lonads 共回答了16个问题
lonads 共回答了16个问题 |采纳率81.3%市售盐酸的浓度为12mol/L,配制1升2.5mol/L盐酸甲醇溶液需用盐酸12/2.5≈0.2083(L),加入甲醇1-0.2083=0.8917(L)即可.1年前查看全部
- 汽车烧甲醇以后为啥会费汽油呢
 淄蔹1年前1
淄蔹1年前1 -
 LULU0505 共回答了17个问题
LULU0505 共回答了17个问题 |采纳率100%甲醇汽油的热值是甲醇的热值加上汽油的热值,汽油加上甲醇后在添加剂的作用下,辛烷值达到了93或者97号标准,但是甲醇的热值毕竟比汽油要低一些,提供的能量也就稍微差一点,在应用的时候人们往往不自觉地更加大力地踩油门以达到以往的或者理想的速度,所以在甲醇汽油的应用时总的用油量是要多一些的,1年前查看全部
- 用含同位素氧18的甲醇与浓硫酸和冰醋酸混合加热,其化学方程式为多少?生成有机物的名称为___,在反应
用含同位素氧18的甲醇与浓硫酸和冰醋酸混合加热,其化学方程式为多少?生成有机物的名称为___,在反应
中甲醇提供___,醋酸提供___,从而生成水 albertxian1年前4
albertxian1年前4 -
 yaotianyue 共回答了19个问题
yaotianyue 共回答了19个问题 |采纳率94.7%浓硫酸,加热
CH3(18)OH+CH3COOH===>CH3CO(18)OCH3+H2O,18指的同位素
乙酸甲酯
甲醇提供H,醋酸提供羟基1年前查看全部
- 金属钠区分甲醇和甲醚
 ChildrenLi1年前1
ChildrenLi1年前1 -
 就是要你的人 共回答了25个问题
就是要你的人 共回答了25个问题 |采纳率88%可以
金属钠和甲醇放出气体,而甲醚没有
2CH3OH+2Na===CH3ONa+H2气体1年前查看全部
- 有一反应,邻苯酚甲醇在醇羟基被氧气氧化之前,加入氢氧化钠,能保护酚羟基不被氧化.Why?
 vivianfree1年前1
vivianfree1年前1 -
 ferly333 共回答了11个问题
ferly333 共回答了11个问题 |采纳率90.9%你把前一个反应的方程式写出来(懒得打出来了)
简单地说加入氢氧化钠减少氢离子数量能让氧化反应平衡像左移动.也就是防止其被氧化了
其实氢离子浓度降低就会令该氧化还原电对的电势降低,再降低氢离子浓度就根本不反应了1年前查看全部
- 293K时,甲醇的蒸气压为11.83KPa,则甲醇气化过程的标准摩尔自由能变为多少
 carmeng1年前1
carmeng1年前1 -
 长城故事 共回答了19个问题
长城故事 共回答了19个问题 |采纳率100%CH3OH ( l ) = CH3OH ( g )
Kθ = P (CH3OH) / Pθ = 11.83 / 100
△rGmθ = - RTln Kθ = - 8.314* 293 *10^-3 ln 0.1183 = 5.2 (kJ/mol)1年前查看全部
- 丙酮和甲醇混合物怎么分离?
 绯雾1年前1
绯雾1年前1 -
 wcsnm 共回答了17个问题
wcsnm 共回答了17个问题 |采纳率100%分离一种混合物,
首先必须了解组分之间的溶解特性!
丙酮与甲醇是互溶的,
但不会形成共沸!
工业生产可以考虑蒸馏的方法.1年前查看全部
大家在问
- 1如图甲所示,伍实同学用示波器、钢锯条和台钳探究声音的响度
- 2十六进制数112转化为八进制数422怎么运算?
- 3在等差数列an中,a3+a7-a10=6,a1-a4=-6,则s13等于?
- 4甲乙丙丁做了370个零件,甲做的+10,乙做的-20,丙做的*2,丁做的/2,丁=甲=乙=丙.乙做了几个?
- 5一个梯形,如果上底增加4㎝,就变成一个平行四边形,上底减少3cm,面积就比原来减少了7.5cm2.原来这个梯形的
- 6一个数(零除外)除以20分之1,这个数就缩小的原来的20分之1,是对的还是错的
- 7角1=78度,角2=102度,角C=角D,试探索角A与角F有怎样的数量关系?说明理由
- 8在“圆、等腰三角形、直角三角形”中,不一定是轴对称图形的是______.
- 9我们是快乐的一家人 翻译
- 10With the money you m____,you will be able to help others
- 11初二数学-1/4x²+1/3xy-1/9y² (x²+1/4)²-2x(x&su
- 12春天的快乐伴我行 作文
- 13如图所示,有一根一端粗一端细的木棒,在如图的位置悬挂起来,恰好处于水平位置,若把木棒从绳子悬挂处锯开,则被据开的木棒(
- 14月亮是否围绕地球转动月亮是围绕着地球转动的吗?
- 15求一道数学题的解法.已知A={x丨x=2n+1,n∈Z} B={y丨y=4k±1,k∈Z} 求证A=B

