1molh2中含有2MOL氢离子和2NA个电子
 chaplin20082022-10-04 11:39:541条回答
chaplin20082022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 娜样幸福 共回答了17个问题
娜样幸福 共回答了17个问题 |采纳率82.4%- H2 是分子,其中没有氢离子,氢离子是 0 mol
应该说有2 mol 氢原子 和2NA个电子 - 1年前
相关推荐
- 某温度下,现在体积为1L的密闭容器中充入1molH2(g)和1molI2(g),发生反应H2(g)+I2(g)=2HI(
某温度下,现在体积为1L的密闭容器中充入1molH2(g)和1molI2(g),发生反应H2(g)+I2(g)=2HI(g)经5分钟后达到平衡时此时H2和I2的量均为0.4 mol,HI的量为0.8mol.(1)此温度下反应的平衡常数K值为_____,I2的转化率为____.(2)若维持温度和体积不变起始加入1.6mol(g)一段时间后反应重新达到平衡,平衡时HI的平衡浓度为,_____mol/L
 纵横七海1年前1
纵横七海1年前1 -
 nuoxi 共回答了11个问题
nuoxi 共回答了11个问题 |采纳率100%“经5分钟后达到平衡时此时H2和I2的量均为0.4 mol,HI的量为0.8mol.”这两个数值中的一个有问题,它们不符合反应变化关系.
(1)判断方法如下:
H2(g)+ I2(g)= 2HI(g)
初始物质的量浓度(mol/L) 1 1
平衡物质的量浓度(mol/L) 0.4 0.4 ( 0.8)1.2
变化物质的量浓度(mol/L) 0.6 0.6 1.2
然后依据平衡常数表达式和转化率公式计算就可以了;
(2)由于该反应为等体反应,压强不会使平衡发生移动,所以可以利用(1)中的结果来计算HI的平衡浓度.1年前查看全部
- 1molN2生成NH3需要多少能量;1molH2生成NH3需要多少能量
1molN2生成NH3需要多少能量;1molH2生成NH3需要多少能量
求详解 彩彩泪1年前1
彩彩泪1年前1 -
 ll农夫 共回答了23个问题
ll农夫 共回答了23个问题 |采纳率95.7%这题不理解你说的意思.N2 + 3H2 === 2NH3
吸收946KJ 吸收3×436 KJ 放出6 ×391 KJ 该化学反应放热生成
2 molNH3时放出的热量为92KJ.1年前查看全部
- 1mol某有机物与1molH2发生加成反应生成 CH3 CH3-C-CH2-CH2-CH3 CH3 ,求他有可能的结构解
1mol某有机物与1molH2发生加成反应生成 CH3 CH3-C-CH2-CH2-CH3 CH3 ,求他有可能的结构解式
 jesss1年前2
jesss1年前2 -
 amy_liyi 共回答了17个问题
amy_liyi 共回答了17个问题 |采纳率88.2%因为有机物与氢气加成的量的关系为1:1,所以从反应原理分析,原来的有机物为含一个碳碳双键.先从加成反应发生的原理来分析,碳碳双键加氢的过程可表示 为C=C+H2→-CH-CH-,可推知,从加成产物反推原来的有机物时,如果产物中相邻两个碳原子上至少各有一个氢原子的时候,就可以还原出一个双键了.据此,可以得出如下结构(注意不要重复,同时氢原子全部省略了):
你写出来的物质有错误,应该是CH3 (CH3)-C-CH2-CH2-CH2CH3或者(CH3)2C-CH2-CH2-CH2 CH3.如果如此,则原来可能结构为( CH3)2C-CH=CH-CH2 CH3;或者( CH3)2C-CH2CH=CHCH3;或者( CH3)2C-CH2CH2-CH=CH2;共三种.希望对你有所帮助.1年前查看全部
- 请假化学热力学:1molH2由始态25℃及P可逆绝热压缩至 5dm-3,求最后温度
请假化学热力学:1molH2由始态25℃及P可逆绝热压缩至 5dm-3,求最后温度

解答的第二步我没看懂…… 噜啦嘭1年前1
噜啦嘭1年前1 -
 芊芊雨桐 共回答了15个问题
芊芊雨桐 共回答了15个问题 |采纳率80%dU=δW+δQ
绝热δQ=0
dU=δW
δW=-pdV
dU=CvdT
p=nRT/V
带入积分(n=1)
大致如此 忘得差不多了~1年前查看全部
- 已知(1).1molH2分子中化学键断裂时需要吸收436kj的能量.(2).1moli2蒸汽中化学键断裂时需要吸收151
已知(1).1molH2分子中化学键断裂时需要吸收436kj的能量.(2).1moli2蒸汽中化学键断裂时需要吸收151kj的能量.(3).由H原子和I原子形成1molHI分子时释放299kj的能量.下列判断不正确的是
A.I2蒸汽比H2分子稳定.
B.2molHI(g)发生反应属于放热反应.
C.HI与NaOH反应属于放热反应.
D.0.5molH2(g)与0.5mol I2(g)完全反应释放出5.5kj热量. 天尊蛋蛋1年前1
天尊蛋蛋1年前1 -
 hqlcqs 共回答了15个问题
hqlcqs 共回答了15个问题 |采纳率93.3%不正确的是A,
化学键的键能越大,越稳定,
.I2蒸汽不如H2分子稳定.1年前查看全部
- 1molH2与1molO2混合的体积
1molH2与1molO2混合的体积
是否为22.4L? shaohuachen1年前2
shaohuachen1年前2 -
 fanxinvv7285 共回答了19个问题
fanxinvv7285 共回答了19个问题 |采纳率89.5%2mol的啊!这有不会反应,你又没有点燃···1年前查看全部
- 若将1molH2和3molI2引入一容积为V,温度为T的烧瓶中,当达到平衡时得到X mol的HI,此后再引2mol H2
若将1molH2和3molI2引入一容积为V,温度为T的烧瓶中,当达到平衡时得到X mol的HI,此后再引2mol H2 ,新达到平衡后得2Xmol HI (1)求Kp ,KX的关系 (2)求该温度下的Kp
 jimmouse1年前1
jimmouse1年前1 -
 雅安青衣江 共回答了20个问题
雅安青衣江 共回答了20个问题 |采纳率95%Kp=Kx
Kp=[HI][HI]/[H2][I2]=XX/[1-X][3-x]=4XX/[3-2X][3-2X]
4[1-X][3-X]=[3-2x][3-2x]
12-16X=9-12X
X=3/4
Kp=11年前查看全部
- 1molH2与0.5mol O2反应放出的热量就是H2的燃烧热 为什么这句话不对
 abcd_001061年前1
abcd_001061年前1 -
 ss纯子 共回答了16个问题
ss纯子 共回答了16个问题 |采纳率93.8%因为根据燃烧热的定义必须是完全燃烧所放出的热量,即燃烧必须生成液态水,所以题目所说定义不严密.1年前查看全部
- 拆开1molH2吸热436kJ,拆开1molCl2吸热243kJ,形成1molHCl放热431kJ.请你算一算“氢气和氯
拆开1molH2吸热436kJ,拆开1molCl2吸热243kJ,形成1molHCl放热431kJ.请你算一算“氢气和氯气反应生成氯化氢”的反应是吸热过程还是放热过程.简单说说你的依据.
 willimasix1年前1
willimasix1年前1 -
 苍山远 共回答了13个问题
苍山远 共回答了13个问题 |采纳率84.6%h2+cl2--2hcl
xi:436+243=679 fang:862
fangre1年前查看全部
- 1.01*10的5次方pa、25°c时,每1molH2完全燃烧生成液态水,放出285.8kj的能量.
1.01*10的5次方pa、25°c时,每1molH2完全燃烧生成液态水,放出285.8kj的能量.
若同温同压下1molH2完全燃烧生成水蒸气,放出的热量大于、等于或小于285.8kj
做题思路 sxfsdjn1年前1
sxfsdjn1年前1 -
 73蜘蛛 共回答了19个问题
73蜘蛛 共回答了19个问题 |采纳率100%小于285.8kJ.
因为液态水生成水蒸气时一定是吸收热量,所以放出的热量小于285.8kj1年前查看全部
- 化学键与化学反应中能量的变化氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1k
化学键与化学反应中能量的变化
氢气在氯气中燃烧时产生苍白色火焰.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molcl2中的化学键消耗的能量为Q2KJ,形成1molHcl中的化学键释放的能量为Q3KJ.下列关系式中,正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2 clong8401年前1
clong8401年前1 -
 demi861023 共回答了15个问题
demi861023 共回答了15个问题 |采纳率80%燃烧为放热反应
所以放热大于吸热
断化学键吸热,生成化学键放热
选D1年前查看全部
- 1molN2的共价键断裂(或生成)吸收(或释放)942kJ能量,1molH2的共价键断裂(或生成)吸
1molN2的共价键断裂(或生成)吸收(或释放)942kJ能量,1molH2的共价键断裂(或生成)吸
(3)若2molN2和4.5molH2在一定条件下化合生成氨时,是释放能量还是吸收能量,能量是多少?(假设反应物完全转化)
1molN2的共价键断裂(或生成)吸收(或释放)942kJ能量,1molH2的共价键断裂(或生成)吸收(或释放)436kJ能量,1molNH3的共价键断裂(或生成)吸收(或释放)1173kJ能量. 随心情而舞1年前1
随心情而舞1年前1 -
 cuckooaa 共回答了16个问题
cuckooaa 共回答了16个问题 |采纳率100%假设反应物完全转化时【太不符合事实了】,2molN2和4.5molH2在一定条件下化合生成氨就是1.5molN2和4.5molH2生成3mol氨,1173kJ×3-942kJ×1.5-436kJ×4.5=144kJ 释放能量.1年前查看全部
- 同一容器,充入1molH2 1molI2,和充入2molH2 2molI2等效平衡吗?为什么?
 aryiwa1年前1
aryiwa1年前1 -
 宝石薇心 共回答了23个问题
宝石薇心 共回答了23个问题 |采纳率91.3%等效,因为反应方程为H2+I2=2HI
前后气体分子数都是2,
也就是说压强对这个反应平衡的移动是没有影响的.
所以,只要是按照比例投料,
充入1molH2 1molI2,和充入2molH2 2molI2
就是等效平衡的1年前查看全部
- 为什么常温常压下,活泼金属从盐酸中置换出1molH2,失去的电子数为2Na
 px55181年前1
px55181年前1 -
 owoss 共回答了14个问题
owoss 共回答了14个问题 |采纳率85.7%1molH2含有2molH原子,每摩尔氢原子在失电子是失去1mol电子,那么也就是失去2mol电子,即2Na个~1年前查看全部
- 1molh2的粒子数为什么比1molh2的原子数少
 wdty1年前1
wdty1年前1 -
 zmyzl 共回答了16个问题
zmyzl 共回答了16个问题 |采纳率93.8%因为H2的粒子是分子,所以1molH2有1NA个氢气分子,而一个氢气分子是由两个氢原子组成的,也就是2NA个氢原子 所以1molh2的粒子数比1molh2的原子数少1年前查看全部
- 1) 1molH2(理想气体)由始态298K、p被绝热可逆的压缩到5L,那么终态温度T2等于(?)K,内能变化△U等于(
1) 1molH2(理想气体)由始态298K、p被绝热可逆的压缩到5L,那么终态温度T2等于(?)K,内能变化△U等于(?)KJ.
2) 2mol理想气体B,在300K时等温膨胀,W=0时体积增加一倍,则其△S等于(?)J.K-1
3) 某理想气体Cv,m=2.5R,有5mol该气体恒压降温50℃,则该过程的△U=(?)KJ,△H=(?)KJ
4) 任意量的NH3(g)和H2S(g)与NH4HS(s)成平衡,则该系统的组分数C为(?),相数P为 ),自由度数F为(?)
5) 60℃时甲醇(A)的饱和蒸汽压是83.4KPa,乙醇(B)的饱和蒸汽压是47.0KPa,二者可形成理想液态混合物,若混合物中二者的质量分数各为0.5,则该状态下混合物的平衡蒸汽压组成(摩尔分数)Ya=(?),Yb(?)
6) 在1L的玻璃容器内放入2.695gPCL5,部分发生解离.在250℃达平衡,容器内的是压力之100KPa,则其解离度为(?),平衡常数Kp为(?)
7) 证明:热力学基本方程(封闭可逆系统、W=0)
8) 5mol单原子理想气体从始态300K、50KPa,先绝热可逆压缩至100KPa,再恒压冷却使体积缩小到85L,求整个过程的Q、W、△U、△H、△S. freewfrwer1年前1
freewfrwer1年前1 -
 hanmengcom 共回答了16个问题
hanmengcom 共回答了16个问题 |采纳率87.5%1)562K,5.49 kJ .
2)5.76
3)5.196kJ
4)C为(2),相数P为 (2),自由度数F为(2)
5)0.718;0.282
6)0.86,36
7)
在可逆循环中,有熵的全微分dS=dQ/T,又由热力学第一定律dQ=dU+dW;
如果只考虑系统体积改变所做的功,则的dW=pdV,带入第一定律,得TdS=dU+pdV,也即dU=TdS-pdV;
又因H=U+pV(做勒让德变换),所以dH=dU+pdV+Vdp,与上式相加,有 dH=TdS+Vdp
赫姆霍兹自由能F(好像也叫自由焓),F=U-TS,所以dF=dU-TdS-SdT,
与一式相加得,dF=-SdT-pdV;
8):Q=-19.892kJ;W=13.935kJ;△U=-5.958kJ; △H=-9.930kJ;△S=-68.66J·K-11年前查看全部
- 如果说“1molH2和O2的混合气体”是各自1mol还是2个加起来是1mol?— —
 wh89381年前2
wh89381年前2 -
 深蓝朵儿 共回答了22个问题
深蓝朵儿 共回答了22个问题 |采纳率86.4%两个加起来是1mol1年前查看全部
- 问几个热化学方程式的问题1.后面的焓变如果是正数 必须要写正号吗?可不可以省略?2.如果题目要求写1molH2和O2反应
问几个热化学方程式的问题
1.后面的焓变如果是正数 必须要写正号吗?可不可以省略?
2.如果题目要求写1molH2和O2反应生成水的方程式 系数必须要H2前是1吗 还是可以改变系数,后面的焓变也对应改变?
3.燃烧热 中和热的系数是唯一的吗? ljie88881年前4
ljie88881年前4 -
 loove 共回答了22个问题
loove 共回答了22个问题 |采纳率86.4%1.必须要写(这个不同的省份有不同.有些省份可以不用+,具体问下你老师.苏教版一定要用+)
2.必须要是1 要按照要求来写
没有要求的时候,系数改变,焓变也要改变,成正比.
3 是.燃烧热中可燃物的系数必须是1.中和热中,生成物H2O的系数必须是1.这样才叫燃烧热或中和热.1年前查看全部
- 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:
H2(g)+I2(g) 2HI(g)+Q(Q>0),并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(I)所示,则改变的条件可能是( )
2HI(g)+Q(Q>0),并达到平衡,HI的体积分数ω(HI)随时间(t)变化如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(I)所示,则改变的条件可能是( )
 A. 恒温恒容条件下,加入适当催化剂
A. 恒温恒容条件下,加入适当催化剂
B. 恒温条件下,缩小反应容器体积
C. 恒容条件下升高温度
D. 恒温条件下,扩大反应容器体积 相楚1年前1
相楚1年前1 -
 nzmzx2 共回答了27个问题
nzmzx2 共回答了27个问题 |采纳率88.9%解题思路:该反应是反应前后气体体积不变的放热反应,根据拐点的横坐标达平衡的时间,判断反应速率的大小;根据拐点的纵坐标HI的体积分数判断化学平衡的移动方向,据此分析该题.该反应是反应前后气体体积不变的放热反应,图(Ⅱ)的拐点横坐标大于图(Ⅰ)的拐点横坐标,所以图(Ⅱ)的反应时间长,图(Ⅰ)的反应时间短,说明图(Ⅰ)的反应速率大于图(Ⅱ)的反应速率;图(Ⅱ)的拐点纵坐标大于图(Ⅰ)的拐点纵坐标,所以由图(Ⅱ)到图(Ⅰ),平衡向逆反应方向移动.
A、恒温恒容条件下,加入适当催化剂,可加快反应速率,但化学平衡不移动,故A错误;
B、恒温条件下,缩小反应容器体积,即增大体系的压强,可加快反应速率,但化学平衡不移动,故B错误;
C、恒容条件下升高温度,温度升高,反应速率增大,平衡向逆反应方向移动,故C正确;
D、恒温条件下,扩大反应容器体积,减小体系的压强,反应速率降低,平衡不移动,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡的影响因素,难度不大,明确图象拐点代表的含义及两曲线的不同点是解本题的关键.1年前查看全部
- 1molH2和O2是这样计算得出它们的质量的吗?
1molH2和O2是这样计算得出它们的质量的吗?
H2的原子质量相对原子质量是1,O2是16,1mol粒子数是6.02×10^23,那么1molH2就是6.02×10^23×1×12(因为一个原子实际质量是12C的12分之一所以乘上12)=7.224×10^24吗?O2就是6.02×10^23×16×12=1.15584×10^26吗?感觉不对,正确的该怎么算? hucx42801年前1
hucx42801年前1 -
 mu37 共回答了20个问题
mu37 共回答了20个问题 |采纳率95%H相对原子质量略大于1,质量数近似取1,H2是2不是1.相对分子质量mr不带单位,但是1mol物质的质量乘以阿伏伽德罗常数得到的摩尔质量M带单位,数值上等于相对分子质量(事实上,为了使这个关系满足,阿伏伽德罗常数的数值部分才确定为一个特定的值).M(H2) = 2g/mol,由此看出1mol的H2的质量就是2g,也就是相对分子质量的数值部分2加上g作单位.LZ的计算方法结果的单位是原子质量单位u(等于1/12倍C-12质量).用g表示1mol物质的质量的话,要在此基础上除以阿伏伽德罗常数NA = 6.02*10^23 mol^-1,然后乘以1mol消掉NA的单位.
总结(M为摩尔质量,m为质量,NA为阿伏伽德罗常数,mr为相对分子质量,u为原子质量单位):
M = m * NA(M的定义式);
mr * 1g/mol = M;
1u = m(C-12原子) / 12 = m(1mol C-12) / 12 / NA = 12.000000g / 12 / NA = 1g / NA.
====
[原创回答团]1年前查看全部
- 常温常压,22.4LSO2和O2混合气体中含的氧原子的数是 铁铝混合物与一定量稀盐酸生成1molH2,转移电子数是
 ff色的男人1年前1
ff色的男人1年前1 -
 冷漠背后 共回答了15个问题
冷漠背后 共回答了15个问题 |采纳率93.3%常温常压,22.4LSO2和O2混合气体中含的氧原子的数是()
无法计算,因为常温常压下,22.4 L不是1 mol,物质的量无法求出,所以无法计算
铁铝混合物与一定量稀盐酸生成1molH2,转移电子数是(2NA)
无论什么金属与H+反应,总是1 mol H+得到1 mol e-,产生0.5 mol H2
所以产生了1 mol H2,转移2 mol电子,个数 = 2 NA1年前查看全部
- 1molH2与足量的O2反应,生成水的质量()、物质的量(),消耗O2的质量()、物质的量()急需!
 5f4b9g1年前1
5f4b9g1年前1 -
 charleslee86 共回答了18个问题
charleslee86 共回答了18个问题 |采纳率83.3%18 1mol 16g 0.5mol1年前查看全部
- 1MOL H和1MOL H+和1MOLH2的含义一样吗?
 hiddendragon221年前1
hiddendragon221年前1 -
 hmyujian 共回答了15个问题
hmyujian 共回答了15个问题 |采纳率80%肯定不一样
1MOL H是1mol氢原子
1MOL H+是1mol氢离子
1MOLH2是1mol氢气1年前查看全部
- 化学题目 大家帮忙~~化合物A的分子式是C10H16,在催化剂作用下氢化时可吸收1molH2得B,A经催化脱氢可得一芳香
化学题目 大家帮忙~~
化合物A的分子式是C10H16,在催化剂作用下氢化时可吸收1molH2得B,A经催化脱氢可得一芳香烃C,C经酸化的KMnO4氧化未见苯甲酸生成.试写出ABC的结构简式,A可能有的同分异构体为?
 撞击你的枪1年前1
撞击你的枪1年前1 -
 kandianying 共回答了18个问题
kandianying 共回答了18个问题 |采纳率94.4%这里打不上结构式,想帮不好帮呀.
我慢慢打上些不知道能不能帮助你理解.
A:是丁基环已烯(丁基中有两个支链,即有三个甲基)
B是丁基环已烷(丁基同上)
C是丁基苯(丁基同上)
A的同分异构体很多,可以是丁基的碳链异构体,也可以是环烯的位置异构体,也可是双烯或炔的官能团异构体.
这里需要说一下:与苯环直接相连的碳原子上有氢时,才能被酸性高锰酸钾氧化为羧基.考查出题者的意图,则C中与苯环直接相连的碳原子上没有氢原子,则应该连着三个甲基.
这里还要说明一点,出题人在提到C的时候有一点不明确,其实他应该说C中无羧基而不是没有生成苯甲酸,不然想象,如果苯环上有多个取代基,当然不会生成苯甲酸,显然出题者没有考虑到这一点.而是理想的认为是一个取代基.1年前查看全部
- 常温常压下,活泼金属与盐酸反应生成1molH2时发生转移的电子数一定为2NA.还有何为歧化反应?
 精灵奶茶1年前2
精灵奶茶1年前2 -
 wq3773 共回答了18个问题
wq3773 共回答了18个问题 |采纳率83.3%对的 .歧 分歧的意思 指在一个化学反应中的一种反应物的一种元素 在反应中化合价一方面升高,另一方面降低.如氯气与水的反应,氯气中的氯元素生成盐酸时化合价降低,生成次氯酸时化合价升高1年前查看全部
- 反应方程式:CaH2+2H2O=Ca(OH)2+2H2↑中水作——剂,反应中每生成1molH2,转移电子数目为————.
 dd归来1年前2
dd归来1年前2 -
 蜜儿的故事 共回答了20个问题
蜜儿的故事 共回答了20个问题 |采纳率90%1mol CaH2中,H为-1价,在H2O中,H为+1价,所以:1mol 氢气生成是一个-1价H和一个+1价H结合所以只有1mol转移电子数目1年前查看全部
- 在一个固定的密闭容器中,保持一定温度进行如下反应:H2+BR2=2HBR(为可逆反应)已知加入1MOLH2和2MOLBR
在一个固定的密闭容器中,保持一定温度进行如下反应:H2+BR2=2HBR(为可逆反应)已知加入1MOLH2和2MOLBR2达到平衡后,生成了AMOLHBR.在相同条件下,若起始时加入的H2,BR2,HBR分别为XMOL,YMOL,ZMOL(均不为0)且达到平衡时,各组分含量都不变.以下推断中一定正确的是:
1 X,Y,Z应满足的关系是:4X+Z=2Y
2 达到平衡时HBR的物质的量为(AY-XA)MOL
3 达到平衡时HBR的物质的量为AMOL
4 X,Y,Z应满足的关系为X+Y=Z
A 1,2 B 2,3 C3,4 D1,2,3 wxj198711021年前4
wxj198711021年前4 -
 jcyou 共回答了16个问题
jcyou 共回答了16个问题 |采纳率93.8%H2 + Br2 == 2HBr
1.2.0(开始)
(1-0.5A)...(2-0.5A).A(平衡时)
H2 + Br2 == 2HBr
X.Y.Z(开始)
(X+0.5Z)...(Y+0.5Z).0(等同于开始)
(X+0.5Z) :(Y+0.5Z) = 1 :2(达到平衡时,各组分含量都不变)
2X + Z = Y + 0.5Z
2X + 0.5Z = Y
4X+Z=2Y -------1正确.
Z=2Y-4X
X+0.5Z= X+ 0.5*(2Y-4X) = Y-X
H2----------2HBr
1.A (1molH2生成AmolHBr)
(Y-X).n(HBr) ((Y-X)mol H2生成的HBr的量)
n(HBr) = A*(Y-X) = (AY-AX) mol-----------2正确.
答案是A.1年前查看全部
- 向等温等容容器中加2molHI与1molH2与1molI2反应,平衡向哪移动
 达玛1年前3
达玛1年前3 -
 yangxl4800 共回答了23个问题
yangxl4800 共回答了23个问题 |采纳率87%平衡不移动,因为反应前后系数之和不变1年前查看全部
- 1mol水中含有1molH2和1molO 这句话错在哪里
 树林1年前1
树林1年前1 -
 奇遇奇缘 共回答了13个问题
奇遇奇缘 共回答了13个问题 |采纳率100%水中没有H2(氢气)
应该是一摩尔水中有两摩尔氢原子和一摩尔氧原子1年前查看全部
- 在一密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下发生反应:
在一密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下发生反应:
H2(g)+I2(g)⇌2HI(g)
①增大体系压强,反应速率______(填增大 减小 不变,下同);
②保持容器容积不变,向其中加入1molN2(N2不参与反应),反应速率______
③保持容器中气体压强不变,向其中加入1molN2(N2不参与反应),反应速率______
理由是______
④保持容器中气体压强不变,向其中加入1molH2和1molI2(g),反应速率______. fang26931年前1
fang26931年前1 -
 kalishen 共回答了17个问题
kalishen 共回答了17个问题 |采纳率88.2%解题思路:①反应是气体体积不变的反应,增大压强平衡不动,反应速率增大;
②容积不变,向其中加入1molN2,总压增大分压不变,平衡不动;
③保持容器中气体压强不变,向其中加入1molN2,为保持恒压,体积增大,反应速率减小;
④保持容器中气体压强不变,向其中加入1molH2和1molI2(g),浓度不变.①反应是气体体积不变的反应,增大压强平衡不动,反应速率增大,故答案为:增大;
②容积不变,向其中加入1molN2,氮气不参与反应,容器中总压增大,气体分压不变,平衡不动,反应速率不变,故答案为:不变;
③保持容器中气体压强不变,向其中加入1molN2,为保持恒压,体积增大,反应速率减小,
故答案为:减小;压强不变,充入N2,容器体积增大,H2和I2的物质的量不变,但浓度会下降,所以速率减小;
④保持容器中气体压强不变,向其中加入1molH2和1molI2(g),浓度不变,反应速率不变,故答案为:不变.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题综合考查反应速率的影响因素,注意浓度、温度以及压强对反应速率的影响,难度不大,注意相关基础知识的积累.1年前查看全部
- Cu2S+2H2O==2H2+Cu+SO2,每生成1molH2时,氧化剂与还原剂之间转移的电子是()mol
 倾心火星人1年前0
倾心火星人1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1molH2SO4中含1molH2 这句话对吗
1molH2SO4中含1molH2 这句话对吗
为什么 80mj9e1年前4
80mj9e1年前4 -
 行走飞 共回答了14个问题
行走飞 共回答了14个问题 |采纳率92.9%不对,硫酸中不可能含有氢气,应该说1mol H2SO4中含2mol H+1年前查看全部
- 1molH2中含有几个H-H单键?
 肖箫1年前3
肖箫1年前3 -
 呵呵4 共回答了15个问题
呵呵4 共回答了15个问题 |采纳率100%每个H2分子中有一个H-H单键,1molH2中含有1mol的H-H单键,即6.02X10*23个H-H单键1年前查看全部
- 1molH2SO4中含有1molH2.是对的吗?
 俏丫头儿1年前1
俏丫头儿1年前1 -
 坐地成佛 共回答了17个问题
坐地成佛 共回答了17个问题 |采纳率82.4%错的1年前查看全部
- 在一密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)===
在一密闭容器中充入1molH2和1molI2,压强为P(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)===2HI(g)
2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率也加快吗?理由是
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率____,理由是这两题的题目不是一样的吗?为什么前一个不变后一个变慢?
还有保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率____,理由是
第三个,同时都加了1mol为什么就不变呢? 風雲3331年前1
風雲3331年前1 -
 bzm01 共回答了26个问题
bzm01 共回答了26个问题 |采纳率84.6%这些你要换成浓度就好理解了:
2、充入N2,总压强增大,但H2和I2所受的压强及浓度均不变,所以速率不变.
3、压强不变,充入N2,容器体积增大,H2和I2的物质的量不变,但浓度会下降,所以速率减小.
压强不变,向其中加入1molH2(g)和1molI2(g),体积增大,物质的量也增大,倍数一样,所以浓度不变,速率不变.1年前查看全部
- 开始时向容器中充入1molCO2、1molH2和1molH2O
开始时向容器中充入1molCO2、1molH2和1molH2O
将1molCO和1molH2O(g)充入某固定容积的反应器中,在某条件下达到平衡:CO+H2O(g)==CO2+H2,此时有1/3的CO转化为CO2.
⑵若在相同条件下,向容器中充入1molCO2、1molH2和1molH2O,此时平衡混合物中CO2的体积分数可能是下列各值中的______(填编号)
A.22.2% 5700601年前1
5700601年前1 -
 八卦也顶 共回答了16个问题
八卦也顶 共回答了16个问题 |采纳率100%2/3的CO转化为CO2 说明有2/3molCO2产生
加入1molCO和1molH2O(g)和加入1molCO2、1molH2时等效的
如果2情况只加入1molCO2、1molH2 会剩余2/3molCO2 因为反应前后总体积不变 所以CO2体积分数为2/3除2=33.3% 现在又加入1molH2O 使反应右移 CO2转化率提高
只有大于33.3%1年前查看全部
- 常温常压下活泼金属从盐酸中置换出1molH2,发生转移的电子数约为2NA
常温常压下活泼金属从盐酸中置换出1molH2,发生转移的电子数约为2NA
生成1molH2 转移的电子数就是2mol
转移的电子数是怎么做出来的? 00沧海一栗1年前1
00沧海一栗1年前1 -
 CAIXUDOG7090 共回答了16个问题
CAIXUDOG7090 共回答了16个问题 |采纳率87.5%被还原的是盐酸中的H+
每个H+转化为H原子需要1个电子,每两个H原子结合成一个H2分子,故每生成一个H2分子需2个电子,即每生成1molH2需转移2mol电子.1年前查看全部
- 化学计算题,算出C2H60,两种可能的结构,但是如果将2mol乙醇与钠反应,产生1molH2,就说明是CH3CH2OH
化学计算题,算出C2H60,两种可能的结构,但是如果将2mol乙醇与钠反应,产生1molH2,就说明是CH3CH2OH
这种结构,为什么呢 yurenzaixian1年前2
yurenzaixian1年前2 -
 canse 共回答了14个问题
canse 共回答了14个问题 |采纳率85.7%两种结构是 CH3OCH3 和CH3CH2OH
第一种结构是甲醚,不与钠反应.
第二种结构是乙醇,乙醇中的羟基可以与钠反应生成—ONa的官能团,也就是乙醇钠.
所以说,
如果将2mol乙醇与钠反应,产生1molH2,就说明是CH3CH2OH.1年前查看全部
- 1molH2中含有2molH+和2mol
1molH2中含有2molH+和2mol
如果不对,哪里错了? 江南混混1年前3
江南混混1年前3 -
 轻灵蝉翼 共回答了21个问题
轻灵蝉翼 共回答了21个问题 |采纳率90.5%不对,没有H+,因为氢气是共价化合物,如果说是2mol质子和2mol e-是对的1年前查看全部
- 任何金属与酸反应生成1molH2一定转移2MOL电子?怎么证明这句话?有例子吗
 1441571年前2
1441571年前2 -
 513026 共回答了20个问题
513026 共回答了20个问题 |采纳率95%2R + 2x H+ ==2Rx+ +x H2 两个氢离子变成氢气需要转移两个电子才能生成一个氢气.也就是说每生成一个氢气要转移2个电子.若要生成1mol电子就要2mol电子了1年前查看全部
- 反应生成1molH2,就是得到2mol电子吗?为什么
 joy_hee1年前3
joy_hee1年前3 -
 200569266 共回答了18个问题
200569266 共回答了18个问题 |采纳率83.3%不一定,如果是金属氢化物和水反应则可能转移的是1 mol电子
比如 NaH+ H2O = NaOH + H21年前查看全部
- 1molH2分子含几摩尔氢原子怎磨算啊急啊
 风飘残雪1年前3
风飘残雪1年前3 -
 jfy99 共回答了18个问题
jfy99 共回答了18个问题 |采纳率94.4%1个氢气分子、2个氢原子 1个氢气分子、2个氢原子.1年前查看全部
- 常温常压下活泼金属从盐酸中置换出1molH2,发生转移的电子数约为2NA,正确吗
 他心中的虫虫1年前1
他心中的虫虫1年前1 -
 蝶化庄生 共回答了21个问题
蝶化庄生 共回答了21个问题 |采纳率95.2%对1年前查看全部
- 1molCO完全燃烧生成CO2放出283KJ,1molH2完全燃烧生成液态水放出286kj,1molCH4完全燃烧生成C
1molCO完全燃烧生成CO2放出283KJ,1molH2完全燃烧生成液态水放出286kj,1molCH4完全燃烧生成CO2和液态水放出890kj,若amolCH4,CO,H2的混合气体完全燃烧生成CO2和液态水,放出热量为Q,则Q的取值范围是?若amolCH4,CO,H2的混合气体完全燃烧生成CO2和液态水,且CO2和水的物质的量相等,则Q的取值范围是
 haoxue01061年前2
haoxue01061年前2 -
 打不赢我就装uu 共回答了17个问题
打不赢我就装uu 共回答了17个问题 |采纳率94.1%第一步
极值法假设都是co或者都是甲烷
所以q范围是(283aKJ,890aKJ],半开半闭区间
第二步二氧化碳和水物质的量相等
仍旧是极值法
当混合气体中只有co,h2时,且两者物质的量相等
可得最小值q
当只有甲烷和co时,且两者物质的量相等
可得最大值q
自己计算1年前查看全部
- 1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
1、相同情况下1molH2与1molO2的任意比例 混合体积不变?
2、标准情况下1molH2与1molO2的任意比例 混合体积不变
谢绝 jrj120501 再次回答!因为我根本不懂 yzjjbhl1年前1
yzjjbhl1年前1 -
 风貌 共回答了21个问题
风貌 共回答了21个问题 |采纳率100%标准情况下1mol氢气体积是22.4L 氧气也是22.4L(一定要是标况)所以任意比例混合体积不变,即等于原来氢气体积加氧气体积.
相同情况下1molH2与1molO2体积不能确定,但是任意比例混合与原来氢气和氧气总体积不变.1年前查看全部
- 燃烧放热问题1molH2燃烧时约放热286kJ,而1kg汽油燃烧时约放热46000kJ.请回答:等质量的氢气和汽油相比,
燃烧放热问题
1molH2燃烧时约放热286kJ,而1kg汽油燃烧时约放热46000kJ.请回答:
等质量的氢气和汽油相比,哪种放出的热量更多?
请通过计算说明 抓住猫的狗1年前2
抓住猫的狗1年前2 -
 陈伦爱ii 共回答了21个问题
陈伦爱ii 共回答了21个问题 |采纳率85.7%1mol氢气2g
lkg氢气有1000g/2g=500mol,共放热500*286KJ=143000KJ,远大于汽油的46000KJ1年前查看全部
- 【化学】1.01*10的5次方pa、25°c时,每1molH2完全燃烧生成液态水,放出285.8kj的能量.
【化学】1.01*10的5次方pa、25°c时,每1molH2完全燃烧生成液态水,放出285.8kj的能量.
1.01*10的5次方pa、25°c时,每1molH2完全燃烧生成液态水,放出285.8kj的能量.若同温同压下1molH2完全燃烧生成水蒸气,放出的热量大于、等于还是小于285.8kj? senquan1年前1
senquan1年前1 -
 不如想象的美 共回答了23个问题
不如想象的美 共回答了23个问题 |采纳率82.6%液态水变成气态水需要吸收热量,可以理解成氢气燃烧后生成液态水,放出285.8千焦的热量,然后液态水再气化,变成气态水,需要吸收一部分热量,所以肯定少于285.8千焦1年前查看全部
- (2007•惠州模拟)将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I
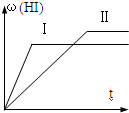 (2007•惠州模拟)将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)⇌2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
(2007•惠州模拟)将1molH2(g)和2molI2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)⇌2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积 路过你世界1年前1
路过你世界1年前1 -
 沙殇冰寒 共回答了22个问题
沙殇冰寒 共回答了22个问题 |采纳率95.5%解题思路:由图可知,由曲线Ⅱ到曲线Ⅰ,到达平衡的时间缩短,故改变条件,反应速率加快,平衡时曲线Ⅰ表示的HI的体积分数ω(HI)减小,说明改变条件,平衡向逆反应移动,据此结合选项进行解答.A、恒温恒容条件下,加入适当催化剂,加快反应速率,但不影响平衡移动,HI的体积分数ω(HI)不变,故A错误;
B、恒温条件下,缩小反应容器体积,容器内压强增大,反应混合物的浓度增大,反应速率加快,平衡不移动,故B错误;
C、恒容条件下,升高温度,速率加快,该反应正反应是放热反应,升高温度,平衡向逆反应移动,HI的体积分数ω(HI)减小,符合题意,故C正确;
D、恒温条件下,扩大反应容器体积,容器内压强减小,反应混合物的浓度减小,反应速率减慢,改变压强平衡不移动,平衡时HI的体积分数ω(HI)不变,故D错误;
故选:C.点评:
本题考点: 产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查了化学平衡图象、化学反应速率与化学平衡的影响因素等,难度中等,根据图象分析条件变化,对反应速率与平衡移动的影响是解题的关键.1年前查看全部
- (1)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子
(1)已知拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则1g氢气燃烧生成气态水时放出的热量为______.
(2)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池的负极反应式为:2H2+4OH--4e-=4H2O,则正极反应式为______. iksusan1年前1
iksusan1年前1 -
 月下人2代 共回答了17个问题
月下人2代 共回答了17个问题 |采纳率88.2%解题思路:(1)由信息可知,H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,2H2(g)+O2(g)=2H2O(g)中,△H=反应物中键能和-生成物中键能和,以此来计算.
(2)根据燃料电池的工作原理:负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应来回答.常温下拆开1mol H2中的化学键要吸收436kJ的能量,拆开1mol O2中的化学键要吸收496kJ的能量,形成水分子中的1mol H-O键要放出463kJ的能量,则H-H键能为436kJ/mol,O=O键能为496kJ/mol,H-O键能为436kJ/mol,由2H2(g)+O2(g)=2H2O(l)中,△H=反应物中键能和-生成物中键能和=2×436kJ/mol+496kJ/mol-4×463kJ/mol=-484kJ/mol,即2mol氢气燃烧放出484kJ的能量,1g氢气的物质的量n=[m/M]=[1g/2g/mol]=0.5mol,燃烧放出的热量为121KJ,故答案为:121KJ;
(2)由于是碱性氢氧燃料电池,正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.点评:
本题考点: 有关反应热的计算;化学电源新型电池.
考点点评: 本题考查血学生有关电化学和热化学的综合知识,注意知识的迁移和应用是解题的关键,难度不大.1年前查看全部
大家在问
- 11molH2SO4中含有1molH2.是对的吗?
- 2一个多边形,除了一个角为132度外,其余各内角和为2748度,求这个多边形的边数,和对
- 3读书的三重境界 阅读答案
- 4在分液漏斗里用一种有机溶剂萃取水溶液里的某物质时如果不知道哪一层是“水层”设计一个简单的实验进行判
- 5在制取干燥纯净的氯气时,先使氯气通过水,后通过浓硫酸
- 6有10把钥匙,只有其中两把钥匙一起使用才能开门,如果丢了1把,还能开门的概率是多少?
- 7某人有5把大小一样的钥匙,其中有2把可以打开房门.随机取钥匙开门不重复取,第3次打开门的概率是多少?
- 81molH2中含有几个H-H单键?
- 9晶体融化时为什么吸收热量而温度不升高
- 101molH2SO4中含1molH2 这句话对吗
- 11一道数学夏令营数学竞赛小张,小李和小王于某日上午分别步行,骑自行车和开汽车从A地出发沿公路向B地匀速前进,已知小李比小张
- 12质量相等的铜块和铅块升高相同的温度,谁吸收的热量多
- 132008年夏令营数学知识习题一(A卷)怎么做
- 14已知a:b:c=2:3:7且a-b+c=12,求2a+b-3c的值.
- 15老头的心被这轻脆的声响砸得很痛,仿佛整个心都被这个中年人给砸碎了.说说你对这句话的理解.
