求析出晶体的质量A,B两名同学在20摄氏度时都取100g某溶液分别做结晶实验,A同学恒温蒸发掉20g水后,析出晶体3.6
 422227223222242022-10-04 11:39:541条回答
422227223222242022-10-04 11:39:541条回答A,B两名同学在20摄氏度时都取100g某溶液分别做结晶实验,A同学恒温蒸发掉20g水后,析出晶体3.6g;B同学恒温蒸发掉30g水后,析出晶体6g.则当他们最初恒温蒸发掉10g水时析出的晶体质量是( )
A.1.2g
B.1.6g
C.2.4g
D.11.8g
[原因原因]

已提交,审核后显示!提交回复
共1条回复
 情盟 共回答了25个问题
情盟 共回答了25个问题 |采纳率96%- 以上过程可以这样看待:
A同学蒸发20g水析出3.6g晶体后,B同学再拿去蒸发了10g水,又析出了6-3.6=2.4g晶体.
由于蒸发20g水后有晶体析出,所以蒸发了20g水的溶液已经是饱和溶液.饱和溶液蒸发时,原来溶解在蒸发掉的水中的溶质会结晶析出.所以B同学蒸发掉10g水后,溶解在这10g水中的2.4g溶质就会结晶析出.由此可以知道,该温度下10g水溶解2.4g溶质就形成饱和溶液.也既12.4g饱和溶液中有溶质2.4g
再回到原来的A同学:
100g溶液----(蒸发10g水)--析出晶体X--再蒸发10g水--析出晶体2.4g
X+2.4==3.6,X==1.2g
答案是A.
以上是不是罗嗦了点. - 1年前
相关推荐
- 关于仪器分析电化学部分的疑问控制电位电解,溶液中被测离子浓度降低,电流下降,被测离子几乎完全析出后,电流趋近于零,我看不
关于仪器分析电化学部分的疑问
控制电位电解,溶液中被测离子浓度降低,电流下降,被测离子几乎完全析出后,电流趋近于零,我看不懂啊 幽-红色幽灵1年前1
幽-红色幽灵1年前1 -
 sunximeng 共回答了21个问题
sunximeng 共回答了21个问题 |采纳率81%电解溶液就是在溶液中通电使其发生化学反应,溶液能导电靠的是溶液中的离子,电解使离子逐步析出,也就是在溶液中的离子逐步减少,导电能力就越来越弱,电流就越来越小,最后被测离子几乎完全析出后,电流趋近于零,电解完成.1年前查看全部
- 用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,
用惰性电极电解1mol/LCuSO4和0.1mol/LCu(NO3)2的混合溶液100ml,当阳极析出896ml气体时,切断电源,使电极仍浸在溶液中.
1)写出开始电解时反应式(两条)
2)电解后电极在溶液经充分反应后,阴极比原来增重多少g?溶液的H+浓度时多少(溶液体积保持不变) 5493381681年前1
5493381681年前1 -
 虚掩的门yoyo 共回答了27个问题
虚掩的门yoyo 共回答了27个问题 |采纳率88.9%cu+ + 2e- =cu
2H2o -- 4e- = O2 + 4H+
2Cu+ 2 H2O2 = 2Cu +O2 + 4H+ 0.896L/22.4L/mol=0.04mol(O2) 可推出阳极一共失去0.04*4=0.16摩尔电子,一摩尔铜有2摩尔电子,所以依照对因关系有0.08摩尔铜生成,即为0.08*64=5.12g铜,即阴极增重5.12g
在阳极增加0.16摩尔H+原子,除以液体体积0.1L得1.6摩尔每升,即H+离子的浓度为1.6摩尔每升
总体是这样了,你在组织下语言,这道题就能得分了1年前查看全部
- 在一定温度下,某未饱和溶液蒸发掉15克水(部分)后,析出2克晶体(不含结晶水);向原溶液投入5克溶质晶体后,溶液中还剩下
在一定温度下,某未饱和溶液蒸发掉15克水(部分)后,析出2克晶体(不含结晶水);向原溶液投入5克溶质晶体后,溶液中还剩下1克固体溶质,则此温度下该溶质的溶解度为( )
A. 13.3克
B. 26.7克
C. 33.3克
D. 40克 chfchfchfchf1年前1
chfchfchfchf1年前1 -
 月若心 共回答了21个问题
月若心 共回答了21个问题 |采纳率95.2%解题思路:固体的溶解度是指在一定的温度下,某固体物质在100g溶剂中达到饱和状态时所溶解的质量.根据题意可知,不饱和溶液
蒸发溶剂
饱和溶液
继续蒸发至15g
析出2g晶体,而根据向原溶液投入5克溶质晶体后,溶液中还剩下1克固体溶质,说明原溶液在溶解4g溶质即达到饱和状态,说明这蒸发掉的15g水若溶解6g溶质也即达到饱和状态,即每克水中最多溶解0.4g溶质,则100g水中最多溶解40g溶质,故选D.点评:
本题考点: 饱和溶液和不饱和溶液;固体溶解度的概念.
考点点评: 本题难度较大,主要考查了对固体溶解度概念的理解及其应用.1年前查看全部
- 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不
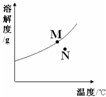 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温再将其升温
D.从M→N:先将M升温再加适量水 wengmj1年前1
wengmj1年前1 -
 付小辛博吕小杨 共回答了17个问题
付小辛博吕小杨 共回答了17个问题 |采纳率88.2%解题思路:溶解度曲线上的点和曲线上方的点表示的是该温度下的饱和溶液,溶解度曲线下方的点表示该温度下的不饱和溶液.M点是这一温度下的饱和溶液,N点是这一温度下的不饱和溶液.A、从N→M:先向N中加入适量固体A再降温,说法正确,故正确;
B、N→M:先将N降温再加入适量固体A,说法正确,故正确;
C、从M→N意思是单位溶剂溶解溶质的量减小,溶液由饱和变为不饱和且溶液温度升高,可采取减小溶质(如降温析出晶体或将溶质变成沉淀或气体反应掉)需将固体滤除和升温的方法,故不可实现;
D、从M→N:先将M升温溶质质量不会变小,再加适量水,溶液就变成了不饱和溶液,故D可实现.
答案;C点评:
本题考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液相互转变的方法.
考点点评: 溶解度曲线上的点和曲线上方的点表示的是该温度下的饱和溶液,溶解度曲线下方的点表示该温度下的不饱和溶液.1年前查看全部
- 玻璃纤维在一定温度下会有二氧化硅析出吗
玻璃纤维在一定温度下会有二氧化硅析出吗
烦请您说的详细一点,我了解到在碱性条件下会有析出, dasongyuan1年前1
dasongyuan1年前1 -
 koo99 共回答了22个问题
koo99 共回答了22个问题 |采纳率86.4%会析出的是氧化钠.
确实如你所知,玻璃在碱性溶液中会析出二氧化硅,生成硅酸盐.但这时的关键不是温度而是湿度——形成碱性水溶液.
我曾做过研究,玻璃纤维在氢氧化钙溶液里(PH 12.5)不到半年就全部被溶解了.1年前查看全部
- 10摄氏度取100克水配成KCl饱和溶液,又取50克水加35.4克硝酸钠配成溶液,再两者混合,析出的晶体是
10摄氏度取100克水配成KCl饱和溶液,又取50克水加35.4克硝酸钠配成溶液,再两者混合,析出的晶体是
10摄氏度,S(NaNO3)=80g,S(NaCl)=35.8g,S(KNO3)=20.9gS(KCl)=3g请将解题过程详细介绍, 播客之播1年前1
播客之播1年前1 -
 summer1001 共回答了19个问题
summer1001 共回答了19个问题 |采纳率89.5%KCl,NaNO3溶于水后,会发生电离,生成K+、Cl-、Na+、NO3-四种离子.也就是有四种物质:KCl、KNO3、NaCl、NaNO3.而KNO3在10摄氏度时的溶解度为20.9g.
故两者混合后,析出的晶体是KNO3.1年前查看全部
- 电解精炼铜 为什么阳极溶解的铜与阴极析出的铜不等 为什么电解质溶液铜离子浓度减小
 ff否1年前2
ff否1年前2 -
 我想拉巴巴 共回答了22个问题
我想拉巴巴 共回答了22个问题 |采纳率90.9%精炼铜 阳极失电子的有Zn Fe Cu 等,还有Ag Au Pt 等沉淀为阳极泥.
阴极只有Cu2+得电子,一部分来自于阳极生成的Cu2+ ,一部分来自于溶液中.
所以阳极溶解的铜与阴极析出的铜不等 ,电解质溶液铜离子浓度减小1年前查看全部
- 用惰性电极电解硫酸铜溶液,若阴极上析出的铜的质量为3.2g.则阳极上产生的气体在标准状况下的体积?
 wjh20081年前1
wjh20081年前1 -
 zhglen 共回答了24个问题
zhglen 共回答了24个问题 |采纳率91.7%根据电荷守恒原理,阴极消耗0.1mol电荷,所以阳极消耗0.05,阳极电解oh根,产生氧气,所以最后产生0.025氧气,再乘以22.4即可得0.561年前查看全部
- 侯氏制碱法中NaHCO3为什么会析出
 zhixiao4761年前3
zhixiao4761年前3 -
 jlle_liu 共回答了18个问题
jlle_liu 共回答了18个问题 |采纳率83.3%因为常温下NaHCO3的溶解度非常小.
而原来使用的是NaCl饱和溶液,所以NaHCO3就过饱和而析出了.1年前查看全部
- (2005•福州)下列各图所表示的实验操作,可以使食盐水中的食盐结晶析出的是( )
(2005•福州)下列各图所表示的实验操作,可以使食盐水中的食盐结晶析出的是( )
A.
B.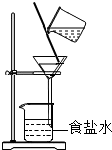
C.
D.
 村上佳裕1年前1
村上佳裕1年前1 -
 aa混混 共回答了26个问题
aa混混 共回答了26个问题 |采纳率92.3%解题思路:结晶的方法主要有①降温②蒸发溶剂的方法,不同物质结晶的方法不同,食盐的溶解度随温度变化不明显,故只能采用蒸发溶剂的方法A、是加水稀释的过程与析出晶体无关,故A错误
B、过滤是分离固体与液体的方法,与晶体析出无关,故B错误
C、蒸发是减少溶剂的过程,能使溶液析出溶质,故C正确
D、增加溶液的量与析出溶质无关,故D错误
故选C点评:
本题考点: 结晶的原理、方法及其应用;蒸发与蒸馏操作.
考点点评: 此题是对溶液溶质析出的考查,对晶体析出的知识训练有一定帮助.1年前查看全部
- 关于溶液结冰的问题溶液在缓慢降低温度的时候要结冰,开始结冰后形成的固体是水还是混合物(在理想状态下)随着冰的析出下边的溶
关于溶液结冰的问题
溶液在缓慢降低温度的时候要结冰,开始结冰后形成的固体是水还是混合物(在理想状态下)随着冰的析出下边的溶液浓度越来越大最后在底部与冰完全分离对吗?如果是冰那么冰糕是因为温度降低过快导致溶液用的溶质分子还没来的及挤出就被包到了冰中吗 sanduoer1年前2
sanduoer1年前2 -
 非帅即酷 共回答了11个问题
非帅即酷 共回答了11个问题 |采纳率81.8%快慢没有道理,盐和水可以形成混晶,是一相,就像合金一样.如果溶液浓度大于混晶的最大浓度,就会形成混晶和盐的混合物,是两相,就像拌匀的糖和盐.具体参考相图.1年前查看全部
- 将质量分数为a%的NaOH溶液蒸发掉mg水以后,变成VmL3a%的NaOH溶液(蒸发过程中无晶体析出)
将质量分数为a%的NaOH溶液蒸发掉mg水以后,变成VmL3a%的NaOH溶液(蒸发过程中无晶体析出)
蒸发后所得溶液的物质的量浓度是(mol/L),各位朋友们,给个详解吧
 欧莱雅的百褶裙1年前1
欧莱雅的百褶裙1年前1 -
 patac 共回答了19个问题
patac 共回答了19个问题 |采纳率89.5%哦,我来试试吧
设NaOH的质量为M,剩下水的质量为m1,那么M/(m1+m+M)=a%,M/(m1+M)=3a%,可以解得m=2(M+m1).
物质的量浓度是可以有质量分数转化来的,先求溶液体积V,题上已给出VmL,再求NaOH的质量是M,物质的量是M/40,根据M/(m1+M)=3a%,则M=3a%m/2,物质的量为3a%m/80,最后是(3a%m/80V)mol/L
不知道对不对,思路应该不错.
希望能帮到你!1年前查看全部
- t℃时,某物质溶液200克,蒸发掉10克水,析出晶体4克,又蒸发掉10克水,
t℃时,某物质溶液200克,蒸发掉10克水,析出晶体4克,又蒸发掉10克水,
出晶体6克,在蒸发掉10克水,析出晶体()
A 4g
B 5g
C 6g
D 10g
哪个为什么 nanlei1年前1
nanlei1年前1 -
 耶不稣 共回答了20个问题
耶不稣 共回答了20个问题 |采纳率95%t℃时,某物质溶液200克,蒸发掉10克水,析出晶体4克,这时溶液是饱和溶液,又蒸发掉10克水,
出晶体6克,再蒸发掉10克水,析出晶体还是6克,因为饱和溶液,蒸发掉相同的溶剂,析出的晶体也相同,选C1年前查看全部
- 在t℃时,把20%某溶液恒温蒸发20g水后,析出4g晶体(不含水),得到25%的该溶液.1.求原溶液中含溶质多少克
在t℃时,把20%某溶液恒温蒸发20g水后,析出4g晶体(不含水),得到25%的该溶液.1.求原溶液中含溶质多少克
2.t℃时该溶液的溶解度 今夜你会不会来01年前1
今夜你会不会来01年前1 -
 xbingo 共回答了20个问题
xbingo 共回答了20个问题 |采纳率95%得到25%的该溶液是饱和溶液
S/(100+S)=25% S=33.3g
设原溶液质量xg
x*20%=4+(x-20-4)*25%
x=40g
1.原溶液中含溶质40*20%=8g
2.t℃时该溶液的溶解度33.3g1年前查看全部
- 电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标况)约为
 也是一个ii1年前1
也是一个ii1年前1 -
 今天不上班 共回答了18个问题
今天不上班 共回答了18个问题 |采纳率94.4%阴极产生的是CL2气体
阳极产生1mol铜,则阴极失去2mol电子,产生1molCl2
所以,阴极产生CL2的体积为
1.6/64*22.4=0.56L1年前查看全部
- t度时某溶液200克,蒸发掉20克水后,析出8克晶体,又蒸发20克水后析出晶体12克,则t度时该
t度时某溶液200克,蒸发掉20克水后,析出8克晶体,又蒸发20克水后析出晶体12克,则t度时该
质的 溶解度为多少 我是快刀浪子1年前3
我是快刀浪子1年前3 -
 宇bear 共回答了22个问题
宇bear 共回答了22个问题 |采纳率95.5%溶解度为60g/100g水.
分析:第一次蒸发析出8g晶体,则剩余溶液为温度t时的饱和溶液.第二次再蒸发20g水,析出12g晶体,此时剩余溶液也是饱和溶液.说明12g晶体溶于20g水,在温度t时,饱和.那么100g水可溶解12*100/20=60g.1年前查看全部
- 现在将150g20%的硝酸钾溶液,蒸发掉90g水后再冷却到t°C,析出硝酸钾晶体14g.求t°C时硝酸钾的溶解度
 guoll00271年前1
guoll00271年前1 -
 fangzhang32 共回答了28个问题
fangzhang32 共回答了28个问题 |采纳率92.9%150g20%的硝酸钾溶液
含有溶质=150*0.2=30g
蒸发掉90g水后再冷却到t°C,析出硝酸钾晶体14g
溶质质量=30-14=16
溶剂质量=150-90-16=44
所以溶解度=16*100/44=36.4g1年前查看全部
- (2012•峨眉山市二模)有一杯KNO3溶液,测得温度为80℃,将其置于冷水中冷却,有晶体析出,滤出晶体,测得滤液温度为
(2012•峨眉山市二模)有一杯KNO3溶液,测得温度为80℃,将其置于冷水中冷却,有晶体析出,滤出晶体,测得滤液温度为20℃.下列有关该叙述中,错误的是( )
A. 80℃时KNO3溶液,一定为饱和溶液
B. 20℃时的滤液,一定为饱和溶液
C. KNO3的溶解度随温度的降低而降低
D. 降温结晶过程中,溶剂质量不变,溶液质量、溶质质量、溶液质量分数减小 lzsdel1年前1
lzsdel1年前1 -
 hooly 共回答了15个问题
hooly 共回答了15个问题 |采纳率93.3%解题思路:温度为80℃时的KNO3溶液,将其置于冷水中冷却,有晶体析出,说明溶解度随温度降低而减小,有晶体析出的溶液一定是饱和溶液,降温结晶过程中,溶质质量减小,而溶剂质量不变.A、温度为80℃时的KNO3溶液,将其置于冷水中冷却,有晶体析出,并不能说明80℃时KNO3溶液,一定为饱和溶液,也可能是不饱和溶液,降温到高于20℃时达到饱和,然后再降温也会析出晶体.故A错误;
B、20℃时的溶液中有晶体析出,因此一定为饱和溶液,故说法正确;
C、温度为80℃时的KNO3溶液,将其置于冷水中冷却,有晶体析出,说明硝酸钾的溶解度随温度降低而降低.故说法正确;
D、降温结晶过程中,溶剂质量不变,而溶质质量减少,所以溶液质量、溶液中溶质质量分数也减小,故D说法正确;
故选A点评:
本题考点: 晶体和结晶的概念与现象;饱和溶液和不饱和溶液;固体溶解度的影响因素.
考点点评: 硝酸钾饱和溶液降温一定析出晶体,不饱和溶液降温也可能析出晶体.1年前查看全部
- CuSO4晶体的溶解度计算足量饱和的CuSO4溶液中加入A克CuSO4,析出了B克CuSO4晶体(CuSO4·5H2O)
CuSO4晶体的溶解度计算
足量饱和的CuSO4溶液中加入A克CuSO4,析出了B克CuSO4晶体(CuSO4·5H2O),问这个温度下CuSO4溶液的溶解度.
请拜托写出详尽步骤和必要说明. 芝麻L171年前1
芝麻L171年前1 -
 lctyer 共回答了15个问题
lctyer 共回答了15个问题 |采纳率93.3%B克CuSO4晶体中CuSO4质量为16B/25,水的质量为9B/25
CuSO4晶体中有一部分CuSO4是加入的A克CuSO4
所以9B/25克水中可以溶解CuSO4(16B/25-A)克
所以溶解度为(16B/25-A)/(9B/25)*100=100(16B-25A)/9B1年前查看全部
- 10摄氏度时氯化钾的溶解度为31克,131克饱和氯化钾溶液蒸发十克水后,降温到十摄氏度,析出氯化钾晶体的质量为( )
 盘子枪1年前1
盘子枪1年前1 -
 蝶舞3201 共回答了16个问题
蝶舞3201 共回答了16个问题 |采纳率81.3%3.1g
10摄氏度时氯化钾的溶解度为31克意思是该温度下100g水中溶解31g氯化钾达到饱和.
蒸发前是饱和溶液,蒸发后还是同温度的饱和溶液,因此析出的晶体就是10g水中溶解的氯化钾.
100g水最多溶解31g,10克水当然是3.1g1年前查看全部
- 在t℃时,某物质A的溶液若恒温蒸发10g水,析出2g无水晶体;若恒温蒸发20g水,析出6g无水晶体,下列说法正确的是(
在t℃时,某物质A的溶液若恒温蒸发10g水,析出2g无水晶体;若恒温蒸发20g水,析出6g无水晶体,下列说法正确的是( )
A. t℃时,原溶液是饱和溶液
B. t℃时,A物质的溶解度为20g/100g水
C. t℃时,A物质的溶解度为30g/100g水
D. t℃时,A物质的溶解度为40g/100g水 lq7207191年前1
lq7207191年前1 -
 雷云 共回答了15个问题
雷云 共回答了15个问题 |采纳率100%解题思路:由于原溶液未指明是否饱和,故通过分析两次恒温蒸发水分析出的晶体不相等,故可判断原溶液一定是不饱和溶液,由于第一次蒸发水分后溶液变为饱和溶液,则第二次蒸发的水分与析出的溶液正好配成饱和溶液,据溶解度的定义可知溶液的溶解度应为6g×5=30g.由于原溶液未指明是否饱和,故应先判断溶液是否饱和,通过分析两次恒温蒸发水分析出的晶体不相等,故可判断原溶液一定是不饱和溶液,由于第一种情况:原溶液蒸发10克水分后溶液变为饱和溶液,则第二种情况:原溶液可看成先蒸发10克水分析出2克晶体后溶液变为饱和溶液,再蒸发10克水分分析出4克晶体.据溶解度的定义可知溶液的溶解度应为4/10×100=40g/100g.
故选D点评:
本题考点: 晶体和结晶的概念与现象;固体溶解度的概念.
考点点评: 此题是对物质溶解度的考查,利用溶解度的概念结合恒温蒸发水分的过程进行分析判断即可.1年前查看全部
- 冬天,湖泊中析出Na2Co3晶体;夏天湖泊岸边析出大量NaCl晶体,这是为什么?
 youlin001年前3
youlin001年前3 -
 zyhlzll 共回答了13个问题
zyhlzll 共回答了13个问题 |采纳率69.2%.BC
温度降低,Na2CO3的溶解度减小
夏天水分蒸发,NaCl过饱和1年前查看全部
- 一个饱和溶液,温度降低析出晶体,那么现在的溶液的浓度和原来一样吗,还是饱和溶液吗
 greedisland1年前2
greedisland1年前2 -
 jiangwenjing 共回答了20个问题
jiangwenjing 共回答了20个问题 |采纳率85%还是饱和溶液,但是浓度是不同的.1年前查看全部
- 硫酸镁溶液为什么盐湖中的硫酸镁在盐湖温度降至10摄氏度是都没有析出,而氯化钠则析出?
 云-云1年前1
云-云1年前1 -
 a暗香盈袖a 共回答了12个问题
a暗香盈袖a 共回答了12个问题 |采纳率100%溶解度是随温度的降低而减小的.所以NACL析出.
常温时,硫酸镁的溶解度是54 g.
结晶过程可以看作溶解的反过程,结晶浓度可以认为是饱和浓度,即溶解度
硫酸镁的溶解度(g/100g水):0度25.5,10度30.4,20度35.1,25度37.4,30度39.7,40度44.7,50度50.4,60度54.8,超过70度下降
20摄氏度36g 温度升高溶解度提高 到65度时溶解度最大为54g
所以在65度时重结晶最好1年前查看全部
- 氢氧化钙从溶液中析出的方法是降温结晶吗
 大四zz爱井宝1年前1
大四zz爱井宝1年前1 -
 朵朵053 共回答了12个问题
朵朵053 共回答了12个问题 |采纳率100%不是.氢氧化钙的溶解度曲线是下降型的,即温度升高溶解度会变小.如果用降温结晶,降温了溶解度就变大,所以不但无法结晶,反而还会变成不饱和溶液.
正确方法应该是升温结晶.(氢氧化钙是微溶于水的,所以不适合用蒸发结晶.)1年前查看全部
- 下列溶液加热蒸干后,能析出溶质固体的是( )
下列溶液加热蒸干后,能析出溶质固体的是( )
A.AlCl3
B.KHCO3
C.Fe2(SO4)3
D.Fe(NO3)3 wm9611年前1
wm9611年前1 -
 wnr1980 共回答了17个问题
wnr1980 共回答了17个问题 |采纳率88.2%解题思路:A.AlCl3加热促进水解生成Al(OH)3和HCl,Al(OH)3易分解,HCl易挥发;
B.KHCO3加热易分解;
C.Fe2(SO4)3加热水解生成Fe(OH)3和硫酸,但硫酸难挥发,最后又能得到Fe2(SO4)3;
D.Fe(NO3)3加热促进水解生成Fe(OH)3和HNO3,Fe(OH)3易分解,HNO3易挥发.A.AlCl3加热促进水解生成Al(OH)3和HCl,Al(OH)3易分解生成Al2O3,HCl易挥发,最后得到Al2O3固体,故A错误;
B.KHCO3加热易分解生成K2CO3,最后得到K2CO3固体,故B错误;
C.Fe2(SO4)3加热水解生成Fe(OH)3和硫酸,但硫酸难挥发,最后又能得到Fe2(SO4)3,故C正确;
D.Fe(NO3)3加热促进水解生成Fe(OH)3和HNO3,Fe(OH)3易分解生成Fe2O3,HNO3易挥发,最后得到Fe2O3,故D错误.
故选C.点评:
本题考点: 盐类水解的应用.
考点点评: 本题考查盐类的水解以及元素化合物知识,题目难度中等,注意硫酸和盐酸的挥发性的不同.1年前查看全部
- 把60度的282克硝酸钾饱和溶液冷却降温到20度将析出多少可硝酸钾才能使溶液冲洗达到饱和
 exina1年前1
exina1年前1 -
 SALCE 共回答了14个问题
SALCE 共回答了14个问题 |采纳率92.9%200.9克1年前查看全部
- 求解一道化学题目某硫酸铜溶液100ml,向溶液中侵入50克的铁片,待充分反应后,将铁片取出,洗净并低温下烘干(假设析出的
求解一道化学题目
某硫酸铜溶液100ml,向溶液中侵入50克的铁片,待充分反应后,将铁片取出,洗净并低温下烘干(假设析出的铜全部附在铁片上),称得为50.16克,求:1.)析出铜的质量为多少克? 没有1101年前3
没有1101年前3 -
 1234567mm0 共回答了16个问题
1234567mm0 共回答了16个问题 |采纳率93.8%设析出铜x克
CuSO4+Fe=Cu+FeSO4 △m
64 64-56
x 50.16-50
64÷x=(64-56)÷(50.16-50)
x=1.28(g)
答:析出铜1.28克.1年前查看全部
- 将220克60摄氏度的硝酸钾溶液降温至20摄氏度,析出78.4克硝酸钾晶体,判断原溶液是否饱和(硝酸钾的溶解度60摄氏度
将220克60摄氏度的硝酸钾溶液降温至20摄氏度,析出78.4克硝酸钾晶体,判断原溶液是否饱和(硝酸钾的溶解度60摄氏度时是110克,20摄氏度时是31.6克)
80摄氏度时氯化钾的溶解度为51克,在此温度下氯化钾溶液240克,若要制成饱和溶液,还需加入51克氯化钾,问原溶液中含氯化钾多少克? nature_fine1年前1
nature_fine1年前1 -
 xz4444 共回答了17个问题
xz4444 共回答了17个问题 |采纳率88.2%假设饱和,应该析出的晶体为
220*(110-31.6)/(100+110)=82.1g>78.4g
所以没有饱和
设原有 x g
(x+51)/(240-x)=51/100
x=47.3g1年前查看全部
- 用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
用惰性电极电解CuSO4和NaCl 的混合溶液,开始时阴极和阳极上分别析出的物质是
请解析~ free_air191年前1
free_air191年前1 -
 zx910731 共回答了16个问题
zx910731 共回答了16个问题 |采纳率93.8%Cu、Cl2
根据离子反应顺序.1年前查看全部
- 如何控制高锰酸钾溶液结晶的现象高锰酸钾溶液配完过段时间会有晶体析出附在玻璃容器壁上,怎么才能控制或者延缓结晶,因为我要在
如何控制高锰酸钾溶液结晶的现象
高锰酸钾溶液配完过段时间会有晶体析出附在玻璃容器壁上,怎么才能控制或者延缓结晶,因为我要在玻璃管上装探头,如果有结晶附在玻璃管上那会影响探头的工作 聊呗1年前2
聊呗1年前2 -
 ql584584 共回答了11个问题
ql584584 共回答了11个问题 |采纳率90.9%你装探头的目的是什么?计数还是检验吸光度变化幅度?前者的话可以,后者的话则溶液色度太高,本身就会影响探头的工作.
高锰酸钾溶液你是怎么配的?应该在以冷沸去离子水溶解后贮存约一周后以沙芯漏斗过滤,这样才能使用.
使用的试管必须清洗干净,同时也要尽可能封盖,避免杂质进入造成高锰酸钾被还原产生沉淀.1年前查看全部
- 饱和nacl溶液,滴入浓hcl,是否会因cl离子浓度增大而有晶体析出,为什么
 wannis1年前2
wannis1年前2 -
 srene 共回答了12个问题
srene 共回答了12个问题 |采纳率91.7%不一定,因为HCl可能浓度不够,即浓度小于NaCl中的Cl-的浓度,如果浓度够的话会有c(Na+)*c(Cl-)=Ksp为定值,Cl-浓度增大,显然平衡向沉淀方向移动,除去Cl2中的HCl就是通过饱和NaCl1年前查看全部
- t℃时,将某硝酸钾溶液第一次蒸发掉l 0g水,冷却至原温度析出晶体1g;第二次蒸发掉10g水,冷却至原温度析出
t℃时,将某硝酸钾溶液第一次蒸发掉l 0g水,冷却至原温度析出晶体1g;第二次蒸发掉10g水,冷却至原温度析出晶体3g;第三次再蒸发掉10g水,冷却至原温度析出晶体应为( )
A.等于3g
B.大于3g
C.等于lg
D.小于或等于lg 一绝阿伟1年前1
一绝阿伟1年前1 -
 besd 共回答了18个问题
besd 共回答了18个问题 |采纳率88.9%在一定温度下,将某硝酸钾溶液蒸发掉10g水,析出晶体1g,说明这时候的溶液是饱和溶液;再蒸发掉10g水,析出3g硝酸钾,则可得出此温度下硝酸钾的溶解度就等于30g,再蒸发10g水,会析出3g晶体.
故选A.1年前查看全部
- KNO3与NaCl同时放入水中,搅拌,将水蒸干会不会有KCl与NaNO3析出?
 cosplaymm1年前4
cosplaymm1年前4 -
 waiyz11 共回答了30个问题
waiyz11 共回答了30个问题 |采纳率90%KNO3与NaCl同时放入水中,搅拌后,在溶液中存在着四种离子:K+、NO3-、Na+、Cl-,将将水蒸干,则析出的固体KNO3、NaCl和KCl、NaNO3同时存在.1年前查看全部
- 要使Ba2+,Al3+,Cu2+,Ag2+四种离子从混合溶液逐一沉淀析出,下列选用的试剂和加入顺序正确的是?
要使Ba2+,Al3+,Cu2+,Ag2+四种离子从混合溶液逐一沉淀析出,下列选用的试剂和加入顺序正确的是?
C:Na2SO4-NaCl-NaOH-NH3H2O
D:NaCl-NaOH-H2SO4-NH3H2O
为什么C不行,而D行? walin111年前2
walin111年前2 -
 2801561 共回答了28个问题
2801561 共回答了28个问题 |采纳率82.1%C当然不行..
Na2SO4除去Ba2+,NaCl除去Ag+,NaOH过量除去Cu2+,溶液中存在的是AlO2-..这时候加入NH3·H2O有什么用?.NH3·H2O不能使AlO2-转化为Al(OH)3..
而D则可以.
NaCl除去Ag+,NaOH过量除去Cu2+,并且使Al3+转化为AlO2-,过量H2SO4除去Ba2+,并将AlO2-又变回Al3+,最后用NH3·H2O使铝离子沉淀,注意NH3是无法将Al(OH)3变为AlO2-的.1年前查看全部
- 关于电解的高二化学题用惰性电极电解b L MSO4的水溶液,当阴极上有Wg 金属析出(阴极上无气体产生)时,阳极上产生a
关于电解的高二化学题
用惰性电极电解b L MSO4的水溶液,当阴极上有Wg 金属析出(阴极上无气体产生)时,阳极上产生a L气体(标准状况),同时溶液的PH由原来的6.5变为2.0(设电解前后溶液体积不变).则M的相对原子质量的表示式为
A.100W/b B.200W/b C.22.4W/a D.11.2W/a
请写出解答过程,谢谢
 锋00241年前1
锋00241年前1 -
 q3223926 共回答了22个问题
q3223926 共回答了22个问题 |采纳率86.4%PH由原来的6.5变为2.0,说明水溶液是酸性的,所以产生的气体一定是氧气
H2o+MSO4=H2SO3+ M + O2
X 32
Wg (a/22.4)*32
x=32W/(a/22.4)*32=22.4W/a
C1年前查看全部
- 某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列
某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列说法正确的是( )
A. 原溶液在t℃时一定是不饱和溶液
B. 原溶液一定是稀溶液
C. 最后剩余的溶液一定比原溶液稀
D. 最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小 北方的一条狼1年前1
北方的一条狼1年前1 -
 木鱼糖 共回答了19个问题
木鱼糖 共回答了19个问题 |采纳率94.7%解题思路:根据饱和溶液与不饱和溶液的概念分析;利用溶质质量分数的计算公式分析,溶质质量分数=溶质质量溶液质量×100%A、因为该溶液饱和后恒温蒸发掉10g水,要析出3g晶体,而刚开始恒温蒸发掉10g水,只析出了2g晶体,所以原溶液一定不是饱和溶液,故A正确;
B、溶液的浓稀只是相对来说的,所以不能讨论原溶液的浓稀;故B错误;
C、原溶液为不饱和溶液,而最后的溶液是该温度下的饱和溶液,所以最后的溶液一定比原溶液浓,故C错;
D、原溶液为不饱和溶液,而最后的溶液是该温度下的饱和溶液,所以最后的溶液溶质质量分数比原溶液的溶质质量分数大,故D错;
故选A点评:
本题考点: 晶体和结晶的概念与现象;饱和溶液和不饱和溶液;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系.
考点点评: 本题考查了饱和溶液和不饱和溶液的相关知识,饱和溶液:一定温度下,一定量的溶剂里不能继续溶解某物质的溶液;不饱和溶液:一定温度下,一定量溶剂里还能继续溶解某物质的溶液.1年前查看全部
- 我想知道对苯二甲腈在二甲苯中的溶解度以及在二甲苯中温度低了0-5度之间对苯二甲腈会不会析出
 存在之轻声1年前1
存在之轻声1年前1 -
 爱VS奉献 共回答了24个问题
爱VS奉献 共回答了24个问题 |采纳率91.7%这个数据一般很难查到,况且你也没有给温度/
你最好还是试一下,在一定的温度条件下,取一定质量的对苯二甲腈,加入一定量的二甲苯,搅拌1小时,看是不是全部溶解,如果没有全部溶解,就过滤,称重,就可以算出来了,如果全部溶解,就继续加对苯二甲腈,再搅拌1小时,直到有不溶解的出现,再过滤称重.
至于你说的降低温度,也要看具体是什么温度,从60降低到55,还是从30降低到25,不同的范围,溶解度变化是不一样的.1年前查看全部
- 如下图所示的原电池,一段时间后某极析出1.28克的固体.求:
如下图所示的原电池,一段时间后某极析出1.28克的固体.求:
上述过程中共需转移电子 mol.锌片的质量_______(填”增加”或”减少”)____克

 轻弹流年1年前2
轻弹流年1年前2 -
 等待世界末日 共回答了10个问题
等待世界末日 共回答了10个问题 |采纳率90%这个原电池锌是负极,所以质量会减少,(锌失电子,成为锌离子,跑到溶液里了).而铜离子得电子,成为铜单质 所以析出的就是铜单质 物质的量为0.02moi 因为铜和锌都是二价金属,所以锌减少0.02mol锌的物质的量是65吧貌似 知道物质的量求质量不是很好求吗 那个转移电子数是0.04mol 因为1mol二价金属对应2mol电子.1年前查看全部
- 大海结冰的颜色我们这海边的海水都结冰了,白色的,我想问一下这些白色的到底是海水呢还是海水析出的严分呢...还有就是如果是
大海结冰的颜色
我们这海边的海水都结冰了,白色的,我想问一下这些白色的到底是海水呢还是海水析出的严分呢...
还有就是如果是海阳中间结冰的话应该是什么颜色呢··?(不是北极那种常年的零下...就结个一二十公分厚那种... 张大炮1年前4
张大炮1年前4 -
 没有人相信 共回答了13个问题
没有人相信 共回答了13个问题 |采纳率100%大海结冰的颜色是白色的!不管在大海的什么位置!之所以大海看起来是蓝色的不是因为海水是蓝色的,而是海水对光的反射使得看起来是蓝色的!
海水结的冰,一般都只是淡水!海冰里的盐分不多!1年前查看全部
- 将不饱和溶液蒸发,至开始有晶体析出时停止加热,这时得到的溶液是
将不饱和溶液蒸发,至开始有晶体析出时停止加热,这时得到的溶液是
如上.是 饱和溶液 还是 不饱和溶液?
为什么 小鱼瞎溜达1年前7
小鱼瞎溜达1年前7 -
 oO年 共回答了19个问题
oO年 共回答了19个问题 |采纳率84.2%饱和溶液.
从有晶体开始析出时就是饱和溶液了.因为溶液中已经不能溶解更多的溶质了.1年前查看全部
- 溶质,溶剂,在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.
溶质,溶剂,
在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.饱和溶液中的溶质增加4.饱和溶液中的溶剂减小5.饱和溶液中的溶剂增加6.饱和溶液的总质量不变.以下判断正确的一组是:
A,1.2.4
B:1.3.5
C:3.4.6
D:2.5.6 巴山劲松21年前1
巴山劲松21年前1 -
 redmapleleaf 共回答了25个问题
redmapleleaf 共回答了25个问题 |采纳率92%A 1、2、4
白色粉末是CuSO4,加水后变成五水硫酸铜(CuSO4·5H2O),水减少所以溶剂减少,溶剂减少所以蓝色晶体析出,蓝色晶体析出所以溶质减少,1年前查看全部
- 500克与200克质量分数相同的氯化钾溶液在某一温度时恒温蒸发80克水,两者析出晶体质量比较
 我的故事无人能懂1年前1
我的故事无人能懂1年前1 -
 qw008 共回答了15个问题
qw008 共回答了15个问题 |采纳率80%200克的析出晶体质量比较大,(200克的氯化钾溶液在某一温度时恒温蒸发相对含值较小)1年前查看全部
- 为什么溶解度相减等于析出的晶体?
 吉仓秀1年前1
吉仓秀1年前1 -
 超强悟空 共回答了14个问题
超强悟空 共回答了14个问题 |采纳率92.9%这样想:
两个温度下,物质的溶解度有差异.
就是说,两个温度下,溶液中的溶质不一样多.
那么少了的溶质去哪里了?只能是析出了
所以溶解度相减等于析出的晶体1年前查看全部
- 30℃时,甲杯中盛有80克食盐饱和溶液,乙杯中盛有40克食盐饱和溶液.若各自蒸发掉20克水后再冷却到30℃时,甲杯中析出
30℃时,甲杯中盛有80克食盐饱和溶液,乙杯中盛有40克食盐饱和溶液.若各自蒸发掉20克水后再冷却到30℃时,甲杯中析出m1克食盐晶体,乙杯中析出m2克食盐晶体,则m1与m2的大小关系是(填大于、小于、相等)__________________.30℃时食盐的溶解度是_____________________(用含有m1或m2的式子表示).
是5m1,我要解题的思路和过程 kjwdszy1年前1
kjwdszy1年前1 -
 鱼翅 共回答了17个问题
鱼翅 共回答了17个问题 |采纳率88.2%1因为都是饱和溶液,质量分数相等,蒸发同样多的水,析出的晶体相同.所以相等.
2.因为20克水溶解m1克盐饱和,而都是饱和溶液,质量分数相等,所以设溶解度为x,
m2/(m2+20)=x/(x+100),解得x=5m1
(问一句,你也是初二的吗)1年前查看全部
- 20℃时,有二杯饱和的A溶液:甲杯盛100g,乙杯盛150g,在下列条件下,两杯溶液中析出晶体质量相同的是( )
20℃时,有二杯饱和的A溶液:甲杯盛100g,乙杯盛150g,在下列条件下,两杯溶液中析出晶体质量相同的是( )
A. 两杯溶液都降温至10℃
B. 同温下,甲杯蒸发掉10g水,乙杯蒸发掉60g水
C. 甲杯加25gA溶液,乙杯减少25gA溶液
D. 同温下,两杯都蒸发掉30g水 xbl20021年前1
xbl20021年前1 -
 明明强人一个 共回答了23个问题
明明强人一个 共回答了23个问题 |采纳率91.3%解题思路:A、根据降温后析出晶体的影响因素考虑;B、根据饱和溶液蒸发水,析出晶体的质量的影响因素考虑;C、根据加入溶液和减少溶液后溶液的变化情况考虑;D、根据饱和溶液蒸发水,析出晶体的质量的影响因素考虑.A、饱和溶液降温后析出晶体,与降温后的溶解度有关,还与原来溶液中的溶剂和溶解的溶质的多少有关,由于原来溶液的总质量不同,溶液中含有的溶质和溶剂各不相同,所以降温后析出的晶体的质量也不同,故A错;
B、饱和溶液蒸发溶剂析出晶体的原因是:被蒸发的水中,原来溶解的溶质不能继续被溶解,就以晶体的形式析出,所以析出晶体的质量与蒸发的水有关,与原来溶液的质量无关,因为甲杯蒸发掉10g水,乙杯蒸发掉60g水,蒸发水的质量不同,所以析出晶体的质量也不同,故B错;
C、甲杯加25gA溶液,因为加入的溶液和原来的溶液性质相同,溶液不会析出晶体,乙杯减少25gA溶液,也不会析出晶体,因为溶液是均一的,故C错;
D、饱和溶液蒸发溶剂析出晶体的原因是:被蒸发的水中,原来溶解的溶质不能继续被溶解,就以晶体的形式析出,所以析出晶体的质量与蒸发的水有关,与原来溶液的质量无关,因为两杯都蒸发掉30g水,所以析出晶体质量相同.
故选D.点评:
本题考点: 晶体和结晶的概念与现象.
考点点评: 解答本题关键是要知道饱和溶液蒸发溶剂,析出晶体的质量与原溶液质量无关,只与蒸发水的质量大小有关.1年前查看全部
- 在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
析出晶体1.5克,则30℃时氯酸钾的溶解度是? henryxiang19801年前1
henryxiang19801年前1 -
 llhecf 共回答了17个问题
llhecf 共回答了17个问题 |采纳率94.1%蒸发10克水后溶液析出固体,说明蒸发10克水,溶液已经饱和
这样饱和溶液再蒸发10克水析出1.5-0.5=1克固体.(相当与原溶液直接蒸发20克水)
说明10克水溶解1克氯酸钾达到饱和
1/10=10/100 氯酸钾溶解度为10克/100克水1年前查看全部
- 碘化钾分解析出游离碘的同时是否必定有碘酸盐生成?
碘化钾分解析出游离碘的同时是否必定有碘酸盐生成?
根据百度百科介绍,碘化钾为“白色立方结晶或粉末.在潮湿空气中微有吸湿性,久置析出游离碘而变成黄色,并能形成微量碘酸盐.光及潮湿能加速分解”.那是析出游离碘的同时必定形成碘酸盐,还是析出游离碘后可能生成碘酸盐?其详细的反应式应如何表达? 第九十坷拉1年前2
第九十坷拉1年前2 -
 srtywryw 共回答了22个问题
srtywryw 共回答了22个问题 |采纳率95.5%猜测的机理:
首先是碘化钾被氧气氧化析出单质碘:4KI+O2+2H2O=4KOH+2I2.
然后是碘与氢氧化钾发生歧化反应产生碘酸钾:6KOH+3I2=5KI+KIO3+3H2O.1年前查看全部
- 问一道简单的化学溶液析出晶体的问题
问一道简单的化学溶液析出晶体的问题
溶液中溶质有硝酸钠和氯化钾,加热蒸发时首先析出的晶体是?
答案是氯化钠,硝酸钠和氯化钾又不反映哪来的氯化钠? yuqile1年前2
yuqile1年前2 -
 无情花 共回答了17个问题
无情花 共回答了17个问题 |采纳率82.4%看一下氯化钠和硝酸钠的溶解度曲线便知
氯化钠曲线很平缓(还是上升的),硝酸钠很陡.即氯化钠的溶解度随温度升高不大,而硝酸钠很大.
所以当加热蒸发,硝酸钠溶解度变大,仍旧溶解;NaCl则因为溶剂被蒸发,所以析出.1年前查看全部
大家在问
- 1How old is the baby? He is __. A:six month old B:six-month-o
- 2海枯石烂的反义词是什么
- 3s,t,a,h,k,n能组成什么
- 4关于‘bad habit’的问题
- 5懂数学平面直角坐标系的进!已知点P(x,y),且直线OP平分第二,第四象限,下面的x,y的值符合点P的特征的是( )A
- 62009-5-27 abcdef各代表一个数字,其中a>C ba d>f e
- 7用英语介绍大象的特点 4—5句话
- 8【(2n个1)-(n个2)】的平方根
- 9Jane at do does what last组成合适的句子
- 10天虹商场开展促销活动,买一箱(24盒)牛奶是45.6元,同样牌子的奶人人乐商场买一打(8盒)送1盒,是18元.哪家商场牛
- 11—Excuse me, could you tell me ________?
- 12在第一学期的一节课上用介词in还是on?
- 13碳酸氢钠是碳酸盐吗?
- 14N46透平油和N46抗磨油什么区别
- 15有甲、乙、丙三个人同时同向从同地出发,沿着周长为900米的环行跑道跑步,甲每分钟360米,乙每分钟300米,丙每分钟21
