工业盐酸都是做什么用
 海淀海盗2022-10-04 11:39:541条回答
海淀海盗2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 kaikkkk 共回答了16个问题
kaikkkk 共回答了16个问题 |采纳率87.5%- (高纯、工业)盐酸
产品名:(高纯、工业)盐酸
化学名:盐酸(HCl)
别名:盐镪水、焊锡药水
性状:高纯盐酸为无色透明发烟液体.挥发出的气体具有刺激性和腐蚀性,对动植物有害.HCl含量31~37%,比重1.183~1.190.盐酸是极强的无机酸,接触皮肤或纤维会被腐蚀.盐酸能与很多金属、金属氧化物、碱类和大部份盐类起化学作用.易溶于水、酒精、醚中.与氧化物反应生成剧毒气体(HCN).
质量:HCl≥31%,高纯盐酸质量符合HG/T 2778高纯盐酸质量标准;工业用合成盐酸符合GB 320质量标准.
用途:主要用于化工、染料、医药、食品、印染、皮革、制糖、电镀等行业. - 1年前
相关推荐
- (2009•荆州)某工业盐酸因含Fe3+而呈黄色(不再含其他杂质),为了测定其组成含量,取这种工业盐酸20g,向其中加溶
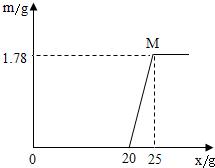 (2009•荆州)某工业盐酸因含Fe3+而呈黄色(不再含其他杂质),为了测定其组成含量,取这种工业盐酸20g,向其中加溶质质量分数为40%的NaOH溶液,其生成Fe(OH)3,沉淀的质量(m)与滴加NaOH溶液的质量(x)的关系如图所示.
(2009•荆州)某工业盐酸因含Fe3+而呈黄色(不再含其他杂质),为了测定其组成含量,取这种工业盐酸20g,向其中加溶质质量分数为40%的NaOH溶液,其生成Fe(OH)3,沉淀的质量(m)与滴加NaOH溶液的质量(x)的关系如图所示.
(1)若所取的这种工业盐酸中Cl-的个数为n1,H+的个数为n2,Fe3+的个数为n3,请写出n1,n2,n3之间存在的等式关系:______
(2)写出滴加NaOH溶液的过程中先后发生反应的化学方程式:______
(3)M点对应的溶液质量为______g(保留二位小数),其中所含的溶质是______.
(4)求这种工业盐酸中HCl的质量分数. (保留一位小数) wrfzxy1年前1
wrfzxy1年前1 -
 bati2000 共回答了16个问题
bati2000 共回答了16个问题 |采纳率93.8%解题思路:(1)根据在溶液中正负电荷的代数和为零来分析;
(2)根据方程式的书写方法考虑;
(3)根据溶液质量的计算方法,溶质要根据反应后的生成物考虑;
(4)根据氢氧化钠与盐酸反应时消耗的氢氧化钠的质量来计算氯化氢的质量,再除以20g即可.(1)在溶液中正负电荷的代数和为零,由于一个H+带一个单位的正电荷,H+的个数为n2则带了n2个正电荷,由于一个Fe3+ 带3个单位的负电荷,所以Fe3+的个数为
n3 所以带了3n3个正电荷,所以正电荷总数为n2+3n3个正电荷;由于一个Cl- 带一个单位的负电荷,Cl-的个数为n1带负电荷数为n1个;所以n1=n2+3n3;
(2)滴加氢氧化钠时,氢氧化钠先与盐酸反应,把盐酸反应掉后,又与氯化铁反应,氢氧化钠与盐酸反应的反应物是氢氧化钠与盐酸,生成物是氯化钠和水,已经平了;氢氧化钠与氯化铁反应的反应物是氢氧化钠和氯化铁,生成物是氢氧化铁沉淀和氯化钠,先配平氢氧根离子,再用观察法配平其它元素即可;
(3)溶液的质量=20g+25g-1.78g=43.22g,根据两个反应的生成物分别是氯化钠、水、氢氧化铁、氯化钠,又因为氢氧化铁是沉淀,所以溶质是氯化钠;
(4)设与氢氧化钠反应消耗氯化氢的质量为x则:
NaOH+HCl═NaCl+H2O
4036.5
20g×40% x
根据:[40/36.5=
20g×40%
x]解得:x=7.3g;
则这种工业盐酸中HCl的质量分数:
7.3g
20g×100%=36.5%.
故答案为:
(1)n1=n2+3n3;
(2)NaOH+HCl═NaCl+H2O;3NaOH+FeCl3═Fe(OH)3↓+3NaCl;
(3)43.22g;NaCl;
(4)36.5%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;溶液的导电性及其原理分析.
考点点评: 要能读懂这个图表示的意义,前20g氢氧化钠溶液是与盐酸反应,后5g氢氧化钠溶液是与氯化铁反应,再根据题意进行进一步计算.1年前查看全部
- 工业盐酸中会因混有氯气呈黄色吗本身是混有铁离子呈黄色的.但有没有混有未参与反应的氯气的可能?
 tykeone1年前1
tykeone1年前1 -
 思念野风筝 共回答了21个问题
思念野风筝 共回答了21个问题 |采纳率90.5%我想 有可能吧
不过制工业盐酸 应该是 氢气和氯气反应 再用水吸收吧 那么如果没反应的氯气 那就是气体的黄绿色 溶液颜色就是杂质问题1年前查看全部
- 工业盐酸的黄色和浓硝酸的黄色原因一样吗?
 minminxiaoya1年前1
minminxiaoya1年前1 -
 xiaoxin_lei 共回答了19个问题
xiaoxin_lei 共回答了19个问题 |采纳率94.7%不一样. 工业盐酸显黄色是因为制取盐酸要用到氯气,而氯气在通过铁的管道时,会把铁氧化,从而使制得的盐酸里面混有三价铁,而显黄色. 浓硝酸显黄色,是因为硝酸见光分解生成NO2,NO2溶于浓硝酸中显黄色.1年前查看全部
- 工业盐酸为什么显黄色
 wjfdfji1年前1
wjfdfji1年前1 -
 李启路 共回答了16个问题
李启路 共回答了16个问题 |采纳率81.3%工业用盐酸一般是用氯气在氢气中燃烧生成氯化氢,然后将生成的氯化氢用水吸收得到的.合成氯化氢的时候会使用一种特殊的燃烧管,此管由2个同心钢管(钢是铁的合金)组成,内管导入氯气,外管导入氢气.由于此管为铁合金,而氯气具强氧化性,因此在生成氯化氢的同时,钢管中的铁也和氯气反应生成了氯化铁,该物质溶于水后会使溶液显黄色.1年前查看全部
- 我配制了一瓶溶液,30%的自来水和70%的工业盐酸,里面加0.2克的五水硫酸铜,溶液呈现黄绿色.
我配制了一瓶溶液,30%的自来水和70%的工业盐酸,里面加0.2克的五水硫酸铜,溶液呈现黄绿色.
放置了一个月左右发现变成了综红黑色了,不知道发生了什么变化, 太内若有情1年前1
太内若有情1年前1 -
 余家村 共回答了21个问题
余家村 共回答了21个问题 |采纳率85.7%铜离子Cu2+在水溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的,水合铜离子呈蓝色,所以我们常见的铜盐溶液大多呈蓝色.而在氯化铜的溶液中,不仅有水合铜离子[Cu(H2O)4]2+,还有氯离子Cl-与铜离子结合形成的四氯合铜络离子[CuCl4]2-,该离子的颜色为黄色.1年前查看全部
- 工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为
工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为( )
A. 1:1
B. 1:3
C. 91:94
D. 1:94 ztgz1年前3
ztgz1年前3 -
 kangfu88 共回答了17个问题
kangfu88 共回答了17个问题 |采纳率94.1%解题思路:根据溶液呈中性,所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等进行设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比.设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得:94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比:1:94,所以,A、B、C错误,D正确.
故选:D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题的关键是:利用了在溶液中所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等的关系进行求离子的个数比.1年前查看全部
- (2012•烟台)在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是应为里面含有氯化铁.为测定这瓶工业盐酸
 (2012•烟台)在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是应为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求该工业盐酸中氯化铁的溶质质量分数.(结果保留至0.1%)
(2012•烟台)在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是应为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如右图所示的关系.求该工业盐酸中氯化铁的溶质质量分数.(结果保留至0.1%)  梦_醒1年前1
梦_醒1年前1 -
 南方狐狸530 共回答了17个问题
南方狐狸530 共回答了17个问题 |采纳率88.2%解题思路:在盐酸存在的条件下,不能形成氢氧化铁沉淀,所以只有把盐酸消耗掉之后,才会生成沉淀,从图中可知与氯化铁反应的氢氧化钠的质量,然后根据氯化铁和氢氧化钠反应的化学方程式可以计算出氯化铁的质量,进而求算出该工业盐酸中氯化铁的溶质质量分数.在盐酸存在的条件下,不能形成氢氧化铁沉淀,只有把盐酸消耗掉之后,才会生成沉淀,根据图中信息可知:在氢氧化钠溶液被消耗至16g时,开始产生沉淀,说明此时盐酸被消耗完全,而消耗氢氧化钠溶液22g时不再产生沉淀,所以可以判断与氯化铁反应的氢氧化钠溶液的质量为22g-16g=6g;
与氯化铁反应消耗氢氧化钠的质量为:6g×10%=0.6g
设20g该工业盐酸中氯化铁的质量为x
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
162.5120
x 0.6g
[162.5/120=
x
0.6g]
解得:x=0.8125g
该工业盐酸中氯化铁的质量分数为
[0.8125g/20g]×100%=4.1%
答:该工业盐酸中氯化铁的质量分数为4.1%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识按照题目要求进行认真地选择或解答即可.1年前查看全部
- 下列说法正确的是 [ ] A.工业盐酸因溶解了氯气而呈现黄色
下列说法正确的是 [ ]A.工业盐酸因溶解了氯气而呈现黄色
B.1mol Cu能与含有2mol H 2 SO 4 的浓硫酸恰好完全反应,生成1molSO 2
C.铁件镀铜,溶液为硫酸铜溶液,电镀过程中溶液的浓度保持不变粗铜精炼过程中,溶液也为硫酸铜溶液,溶液的浓度也保持不变
D.浓度均为0.1mol/L的苯酚钠溶液和CH 3 COONa溶液中:阴离子的总浓度前者小于后者 心灵乐曲1年前1
心灵乐曲1年前1 -
 wuchun82 共回答了20个问题
wuchun82 共回答了20个问题 |采纳率95%D1年前查看全部
- “工业盐酸显黄色是因为其中含有少量氯气.”这个陈述是错的.应该怎么改呢?
 真丢人啦1年前1
真丢人啦1年前1 -
 天煞飞刀 共回答了21个问题
天煞飞刀 共回答了21个问题 |采纳率95.2%工业盐酸显黄色是因为其中含有少量三价铁离子.
【欢迎追问,谢谢采纳!】1年前查看全部
- 工业盐酸为什么呈黄色 写具体反应方程式!
工业盐酸为什么呈黄色 写具体反应方程式!
是人都晓得工业盐酸是由于Fe3+ 但怎么反应?
不会是2Fe+6HCL=2FeCL3+3H2
它好像生成FeCL4-?还是FeCL6 3-?
不要只讲是由于Fe3+!
而且讲易懂点 cantloseyou1年前1
cantloseyou1年前1 -
 头发乱了007 共回答了25个问题
头发乱了007 共回答了25个问题 |采纳率88%肯定不是2Fe+6HCL=2FeCL3+3H2
1、有可能制造过程中与铁锈反应,生成Fe3+.
2、与铁反应生成Fe2+,和空气中的氧气接触,被氧化为Fe3+.1年前查看全部
- 工业品盐酸中因含有Fe3+而带黄色,若工业盐酸中Cl-与Fe+的个数比为20:1,则H+与Cl-的个数比应为?
 吟啸阁1年前1
吟啸阁1年前1 -
 cdheshan 共回答了19个问题
cdheshan 共回答了19个问题 |采纳率89.5%电荷守恒 设H+有X个
阳离子有H+ 和Fe3+
X*1+1*3
阴离子Cl-
阴离子带电=20*1=20
X*1+1*3=20
X=17
H+与Cl-的个数比=17:201年前查看全部
- (2013•荆州)某工业盐酸中因含有少量FeCl3(不含其它杂质)而显黄色,测知该盐酸中H+和Cl-的个数比为88:97
(2013•荆州)某工业盐酸中因含有少量FeCl3(不含其它杂质)而显黄色,测知该盐酸中H+和Cl-的个数比为88:97,则其中Fe3+和Cl-的个数比为( )
A.1:97
B.1:3
C.3:1
D.3:97 巧巧771年前1
巧巧771年前1 -
 candicess 共回答了19个问题
candicess 共回答了19个问题 |采纳率94.7%解题思路:根据已有的知识进行分析,溶液不显电性,在溶液中阴离子和阳离子所带电荷数值相等.H+与Cl-的个数比为88:97,则负电荷总数为97,氢离子所带正电荷总数为88,要保证阴离子所带负电荷数值与阳离子所带正电荷数值相等,则铁离子需要提供9个正电荷,一个铁离子带三个正电荷,故铁离子个数为3,所以Fe3+与Cl-的个数比为3:97,观察选项,故选D.
点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 本题考查了溶液中离子个数比的计算,完成此题,可以依据阴离子所带负电荷总数与阳离子所带正电荷数值相等进行.1年前查看全部
- (2006•南通模拟)工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe
(2006•南通模拟)工业盐酸中因含有Fe3+而带黄色,若某工业品盐酸中H+和Cl-的个数比为91:94,则该盐酸中Fe3+和Cl-的个数比为( )
A.1:1
B.1:3
C.91:94
D.1:94 yaf_3211年前1
yaf_3211年前1 -
 Jawy 共回答了18个问题
Jawy 共回答了18个问题 |采纳率83.3%解题思路:根据溶液呈中性,所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等进行设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比.设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得:94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比:1:94,所以,A、B、C错误,D正确.
故选:D.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系.
考点点评: 解答本题的关键是:利用了在溶液中所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等的关系进行求离子的个数比.1年前查看全部
- 书上说工业盐酸因为含杂质所以是黄的 含什么杂质?所有工业盐酸都是黄色的?
 虞飞儿1年前1
虞飞儿1年前1 -
 ella0923 共回答了24个问题
ella0923 共回答了24个问题 |采纳率87.5%工业盐酸因为含3价铁离子所以是黄的
所有工业盐酸都是黄色的1年前查看全部
- 一吨工业盐酸的体积
 854621年前1
854621年前1 -
 使劲草 共回答了20个问题
使劲草 共回答了20个问题 |采纳率85%盐酸的体积=盐酸的质量÷盐酸的密度
因此,要求一吨工业盐酸的体积,必须知道盐酸的密度.
附录:工业盐酸的密度与对应的质量分数、摩尔浓度(即物质的量浓度)的对应关系如下.
密度 质量分数 摩尔浓度
1 0.4 0.109589041
1.005 1.4 0.385479452
1.01 2.4 0.664109589
1.015 3.4 0.945479452
1.02 4.4 1.229589041
1.025 5.4 1.516438356
1.03 6.4 1.806027397
1.035 7.5 2.126712329
1.04 8.5 2.421917808
1.045 9.5 2.719863014
1.05 10.5 3.020547945
1.055 11.5 3.323972603
1.06 12.5 3.630136986
密度 质量分数 摩尔浓度
1.065 13.5 3.939041096
1.07 14.5 4.250684932
1.075 15.5 4.565068493
1.08 16.5 4.882191781
1.085 17.4 5.172328767
1.09 18.4 5.494794521
1.095 19.4 5.82
1.1 20.4 6.147945205
1.105 21.4 6.478630137
1.055 11.5 3.323972603
1.06 12.5 3.630136986
1.065 13.5 3.939041096
1.07 14.5 4.250684932
1.075 15.5 4.565068493
1.08 16.5 4.882191781
1.085 17.4 5.172328767
1.09 18.4 5.494794521
密度 质量分数 摩尔浓度
1.095 19.4 5.82
1.1 20.4 6.147945205
1.105 21.4 6.478630137
1.11 22.3 6.781643836
1.115 23.3 7.117671233
1.12 24.2 7.425753425
1.125 25.2 7.767123288
1.13 26.2 8.111232877
1.135 27.2 8.458082192
1.14 28.2 8.807671233
1.145 29.2 9.16
1.15 30.2 9.515068493
1.155 31.2 9.872876712
1.16 32.2 10.23342466
密度 质量分数 摩尔浓度
1.165 33.2 10.59671233
1.17 34.2 10.96273973
1.175 35.2 11.33150685
1.18 36.2 11.7030137
1.185 37.2 12.07726027
1.19 38.3 12.48684932
1.195 39.4 12.899452051年前查看全部
- 工业盐酸中二价铁的含量一般是多少
 ffm1年前1
ffm1年前1 -
 kelly200401 共回答了20个问题
kelly200401 共回答了20个问题 |采纳率90%0.002%-0.01%1年前查看全部
- (2006•珠海模拟)工人师傅那里有一堆锈迹斑斑的铁钉.师傅便找了个瓷盆,把铁钉放进去,倒入一些工业盐酸没过铁钉.师傅过
(2006•珠海模拟)工人师傅那里有一堆锈迹斑斑的铁钉.师傅便找了个瓷盆,把铁钉放进去,倒入一些工业盐酸没过铁钉.师傅过一会儿过去晃一晃.经过大约两个小时,这些钉子脱去了红棕色外衣,师傅倒去盘中废液,用清水洗干净.擦干,铁钉变成新的了!真棒!小林把这一切看在了眼里,想出了好主意.晚上小林把自己生了锈的小刀片也照师傅的做法泡在瓷盆的盐酸中就睡觉去了,心中美滋滋的,等着明早拿光亮的小刀.第二天清晨,小林看到瓷盆中的小刀身上残缺不全,都快没有了.小林真不明白,为什么小刀不像铁钉那么亮闪闪呢?小林跑去请教师傅,得到满意的答复.
(1)请你用以学过的知识,将以上叙述中涉及到的化学反应用化学方程式表示.______
(2)如果将瓷盆换成铝盆,又会是什么结果?为什么?______,______. peiti331年前1
peiti331年前1 -
 我在童话里 共回答了25个问题
我在童话里 共回答了25个问题 |采纳率84%解题思路:利用铁锈的主要成分氧化铁能与盐酸反应,铝和铁都能与盐酸反应产生氢气的知识解决,两人结果不同的原因是“师傅过一会儿过去晃一晃.经过大约两个小时”而小林则是“生了锈的小刀片也照师傅的做法泡在瓷盆的盐酸中就睡觉去了,心中美滋滋的,等着明早拿光亮的小刀.第二天清晨”反应的时间存在较大差异,因铁锈完全反应后盐酸会与铁反应,所以时间过长会对铁制品有腐蚀作用.(1)生锈的铁钉的成分是铁和氧化铁,当加入盐酸后氧化铁选与盐酸反应,当氧化铁反应完盐酸还有剩余时铁与盐酸继续反应,化学方程式为Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑;
(2)因为铝比铁活泼,如果换成铝盆的话,倒入盐酸,铝先与盐酸反应,结果铁锈没有除尽.
故答案为:(1)Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑;
(2)铁锈没有除净,铝盆漏了;铝是比铁还活泼的金属,与盐酸反应要比铁快其结果是铝盆漏了,铁锈没有除尽.点评:
本题考点: 金属锈蚀的条件及其防护;金属活动性顺序及其应用;生铁和钢;铁锈的主要成分;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关健是明确生锈铁钉的成分及酸的化学性质,会写化学方程式.1年前查看全部
- 下列溶液有时会显黄色,其中是由于久置时被氧化而变色的是 1.硫酸亚铁溶液 2.碘化钾溶液 3.工业盐酸 4.浓
下列溶液有时会显黄色,其中是由于久置时被氧化而变色的是 1.硫酸亚铁溶液 2.碘化钾溶液 3.工业盐酸 4.浓
下列溶液有时会显黄色,其中是由于久置时被氧化而变色的是
1.硫酸亚铁溶液 2.碘化钾溶液 3.工业盐酸 4.浓硝酸
A:1 B:1.2 C:1.2.3 D:2.4 425234991年前1
425234991年前1 -
 yybb1111 共回答了20个问题
yybb1111 共回答了20个问题 |采纳率85%12FeSO4+3O2+6H2O=4Fe2(SO4)3+4Fe(OH)3
1和2是的
Fe2+ 和 I-还原性强 被氧气氧化
3不是 工业盐酸是含有Fe3+
4不是被氧化 而是分解生成NO2溶解在里面1年前查看全部
- 工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94
工业盐酸中因含有正3价Fe而呈黄色.若某工业盐酸中一价H、负一价Cl的个数比为91:94,则该盐酸中三价Fe和负一价Cl的个数比为? 桃子呼呼1年前1
桃子呼呼1年前1 -
 cbowroad 共回答了13个问题
cbowroad 共回答了13个问题 |采纳率92.3%∵一价H、负一价Cl的个数比为91:94
设有91x个H+和94x个Cl-,则91个H+带有91个单位的正电荷;94个Cl-带有94个单位的负电荷;由于溶液呈电中性,所以剩下的94-91=3个单位的正电荷由Fe3+承担,由于铁+3价,所以只需一个,
因此可得三价Fe和负一价Cl的个数比1:941年前查看全部
- 根据物质分类知识判断,下列物质中属于纯净物的是( ) A.空气 B.蒸馏水 C.家用沼气 D.工业盐酸
 lianglw1年前1
lianglw1年前1 -
 461106oo 共回答了18个问题
461106oo 共回答了18个问题 |采纳率100%A、空气中含有氮气、氧气、二氧化碳等多种物质,属于混合物;
B、蒸馏水中只含有水一种物质,属于纯净物;
C、沼气的主要成分是甲烷,属于混合物;
D、工业盐酸中含有水、氯化氢等多种物质,属于混合物.
故选B.1年前查看全部
- 请问工业盐酸如何检测其浓度?
 晕B1年前1
晕B1年前1 -
 -傻缺- 共回答了19个问题
-傻缺- 共回答了19个问题 |采纳率89.5%工业盐酸的浓度一般为33%,分析纯的为36-38%之间,工业盐酸的具体做法为:取5毫升盐酸于250ml锥形瓶中,加水50ml,加酚酞指示剂2-3滴,用浓度为1%的NaOH溶液滴定至尿黄色,读取NaOH用量A,用A/5 x36.5=B.再对照化学用书上的表,就可以得到其浓度.希望能帮到你!1年前查看全部
- 活性炭、硝酸铅、消石灰、苛性钠、工业盐酸、氰化钠这些原料可以制造什么?
活性炭、硝酸铅、消石灰、苛性钠、工业盐酸、氰化钠这些原料可以制造什么?
应该不会是ZD原料吧!
 carlzhoujian1年前1
carlzhoujian1年前1 -
 流浪16 共回答了23个问题
流浪16 共回答了23个问题 |采纳率91.3%以上原料除工业盐酸外 都是湿法提金的常用原料1年前查看全部
- 一阳离子交换器 直径2.5M 树脂层高1.6M 树脂工作交换量800mol/M3 再生需用密度310g/L的工业盐酸多少
一阳离子交换器 直径2.5M 树脂层高1.6M 树脂工作交换量800mol/M3 再生需用密度310g/L的工业盐酸多少升?
 wuyaofeng1年前1
wuyaofeng1年前1 -
 r3dfl 共回答了18个问题
r3dfl 共回答了18个问题 |采纳率88.9%树脂的体积计算为7.85立方;一般在实际生产中使用3%左右的盐酸体积为树脂的一倍,那么需要约700升即可.这是实际应用.
如果你做的是理论计算,写公式太麻烦了,离子交换树脂的量(摩尔数)=盐酸的量(摩尔数).1年前查看全部
- 某工业盐酸中含铁离子,氯离子,氢离子,若溶液中氢离子与氯离子的比为60;63,则铁离子与氯离子的个数比
 qct03051年前1
qct03051年前1 -
 86516532 共回答了10个问题
86516532 共回答了10个问题 |采纳率80%为方便计算,可设溶液中有氢离子和氯离子的个数分别是60和63,铁离子的个数为x
据溶液中正负电荷代数和为0(即溶液不显电性),可得:
(+1)*60+(-1)*63+(+3)*x=0
整理得x=1
所以铁离子与氯离子的个数比为1:631年前查看全部
大家在问
- 1everyone burst out laughing.there was a lot of ___ A.laughs
- 2青蛙一小时吃多少害虫求大神帮助
- 3某体操队有60名男队员,如果男队员比女队员多百分之20,女队员有多少人
- 4为你打开一扇门课后题第一题400字
- 5The conductor on the bus says,"All ____(fare),please!"
- 6从学校到火车站不是很远英语怎么说
- 7在一个长46厘米宽二十五厘米高三十厘米的长方体观赏鱼缸中放有一块高位二十八厘米体积为4200立方厘米的东西,如果以每分钟
- 8选最佳答案填空 第九题选项A.see B.are seeing C.can see D.s
- 9下列说法正确的是( ) A.在电磁波谱中,X射线与γ射线的区别是由于它们的频率不同
- 10Do you want to be a teacher?(改为肯定陈述句)
- 113支铅笔和2支钢笔一共36元,已经知道一支钢笔的价钱是一支铅笔的3倍,
- 12It's _______ to interrupt the others while they are talking.
- 13高等数学概率论问题两个随机变量同分布是指什么意思?是分布函数相同吗?数学期望相同吗?方差相同吗?都相同还是怎么样? 求详
- 14我在初一(11)班,需要一个中学秋季运动会班级口号,16字,要押韵,带上【11】或【11班】,
- 15现在高二进入一轮复习了,我基础挺好,如果时间够的话不粗心上140是没问题的.但最致命的弱点是速度!问题不是在没思路,而是
