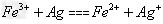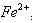蚀刻金属的药水成分?蚀刻铁、铝、铜一般金属药水成分,据我所知道主要是FeCl3和HCl,添加剂蓝色,成分据估计是铜离子,
 小颖猪猪2022-10-04 11:39:541条回答
小颖猪猪2022-10-04 11:39:541条回答蚀刻铁、铝、铜一般金属药水成分,据我所知道主要是FeCl3和HCl,添加剂蓝色,成分据估计是铜离子,要么就是HI,但HI我还很少接触到,再就是有可能有双氧水,加软水混合液,请业内人士给个指导,是否正确?

已提交,审核后显示!提交回复
共1条回复
 ydqgg 共回答了25个问题
ydqgg 共回答了25个问题 |采纳率96%- 碘化氢怎么会有颜色.肯定是金属离子.双氧水也只可能是很淡的蓝啊.应该是铜,和铁作用.
- 1年前
相关推荐
- “蚀刻”印刷电路板和“腐蚀”印刷电路板一样吗?
“蚀刻”印刷电路板和“腐蚀”印刷电路板一样吗?
若一样,这个题应选什么?
下列有关物质的性质与应用不相对应的是:
A:明矾能水解生成氢氧化铝胶体,可用作净水剂.
B:氯化铁溶液能与铜反应,可用于蚀刻印刷电路板.
C:氯气具有漂白性,可用于漂白纸浆.
D:金属钠非常活泼可用于钛等稀有金属.
(ACD)我查过好像都对了. 5171615311年前1
5171615311年前1 -
 爱情陷阱中 共回答了13个问题
爱情陷阱中 共回答了13个问题 |采纳率92.3%选择C
氯气没有漂白性,溶于水形成的HClO有漂白性.Cl2 + H2O ==== HCl + HClO
这是常考的,需要注意.
其他的都对.1年前查看全部
- 微电子工业中化合物A作为半导体、液晶和薄膜太阳能电池等生产过程中的蚀刻剂.在对硅、氮化硅等材料进行蚀刻时具有非常优异的蚀
微电子工业中化合物A作为半导体、液晶和薄膜太阳能电池等生产过程中的蚀刻剂.在对硅、氮化硅等材料进行蚀刻时具有非常优异的蚀刻速率和选择性,在被蚀刻物表面不留任何残留物,对表面无污染.
已知:
①化合物A由两种元素组成,常温下是一种无色、无臭的气体,能助燃,当温度超过350℃时会缓慢分解成两种气体单质,同温同压下气体A相对于某常见黄绿色气态单质的相对密度为1;
②化合物B与单质C在一定条件下反应生成化合物A及化合物D,常温下A、B、C、D均为气体.
③B、D的分子具有相同的电子总数,且均极易溶于水,D的水溶液显酸性常用来作玻璃雕刻的腐蚀液;
④C、A均能与水发生反应.其中,C与水反应生成D溶液及气体单质F;而A与水反应则生成两种酸溶液及一种气态氧化物E(无色、有毒、难溶于水).
(1)化合物B的结构式是______,用相应的化学用语表示B溶于水并发生电离的过程______.
(2)气体A不可燃但能助燃,故气体A的应远离火种且与还原剂、易燃或可燃物等分开存放.结构决定性质,试从结构的角度加以分析:______.
(3)以A对氮化硅(Si3N4)材料的蚀刻为例,用反应方程式来解释为什么在被蚀刻物表面不留任何残留物______.
(4)“已知④”中A与水发生的反应属于氧化还原反应,若反应中生成的气态氧化物E标况下为448mL,则生成两种酸溶液中作为氧化产物的那种酸其物质的量为______mol.
(5)设计实验证明D是一种弱电解质______. 迷失方向的葉子1年前1
迷失方向的葉子1年前1 -
 sssz 共回答了17个问题
sssz 共回答了17个问题 |采纳率94.1%解题思路:①化合物A由两种元素组成,常温下是一种无色、无臭的气体,能助燃,分解成两种气体单质,同温同压下气体A相对于某常见黄绿色气态单质的相对密度为1,黄绿色气体为氯气,则A的相对分子质量为71;
③B、D的分子具有相同的电子总数,且均极易溶于水,D的水溶液显酸性常用来作玻璃雕刻的腐蚀液,则D为HF,B为NH3;
②化合物B与单质C在一定条件下反应生成化合物A及化合物D,常温下A、B、C、D均为气体,即NH3+C→A+HF,由元素守恒可知,C为F2,结合A的相对分子质量,可推知A为NF3;
④F2与水反应生成HF溶液及气体单质F为O2;而NF3与水反应则生成两种酸溶液及一种气态氧化物E(无色、有毒、难溶于水),则应生成HF、HNO3、NO,即E为NO,据此解答.①化合物A由两种元素组成,常温下是一种无色、无臭的气体,能助燃,分解成两种气体单质,同温同压下气体A相对于某常见黄绿色气态单质的相对密度为1,黄绿色气体为氯气,则A的相对分子质量为71;
③B、D的分子具有相同的电子总数,且均极易溶于水,D的水溶液显酸性常用来作玻璃雕刻的腐蚀液,则D为HF,B为NH3;
②化合物B与单质C在一定条件下反应生成化合物A及化合物D,常温下A、B、C、D均为气体,即NH3+C→A+HF,由元素守恒可知,C为F2,结合A的相对分子质量,可推知A为NF3;
④F2与水反应生成HF溶液及气体单质F为O2;而NF3与水反应则生成两种酸溶液及一种气态氧化物E(无色、有毒、难溶于水),则应生成HF、HNO3、NO,即E为NO,
(1)化合物B为NH3,结构式是 ,NH3溶于水并发生电离的过程为:NH3+H2O
,NH3溶于水并发生电离的过程为:NH3+H2O NH3•H2O
NH3•H2O NH4++OH-,
NH4++OH-,
故答案为: ; NH3+H2O
; NH3+H2O NH3•H2O
NH3•H2O NH4++OH-;
NH4++OH-;
(2)NF3分子中N为+3价,有较强氧化性,故气体A的应远离火种且与还原剂、易燃或可燃物等分开存放,
故答案为:NF3分子中N为+3价,有较强氧化性;
(3)以NF3对氮化硅(Si3N4)材料的蚀刻,被蚀刻物表面不留任何残留物,说明生成气体,故应生成氮气与四氟化硅,反应方程式为:4NF3+Si3N4=4N2↑+3SiF4↑,
故答案为:4NF3+Si3N4=4N2↑+3SiF4↑;
(4)④中生成的气态氧化物NO标况下为448mL,其物质的量=[0.448L/22.4L/mol]=0.02mol,生成两种酸溶液中作为氧化产物的那种酸为硝酸,根据电子转移守恒,则生成硝酸的物质的量=
0.02mol×(3−2)
5−3=0.01mol,
故答案为:0.01mol;
(5)实验证明HF是一种弱电解质的方案为:向NaF溶液中加入酚酞,溶液呈红色,说明NaF溶液呈碱性,则HF为弱电解质,
故答案为:向NaF溶液中加入酚酞,溶液呈红色,说明NaF溶液呈碱性,则HF为弱电解质.点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物推断,D的用途是推断突破口,涉及物质性质及其转化在中学中基本不接触,侧重考查学生的综合能力,难度较大.1年前查看全部
- (12分)(1)写出下列反应的离子方程式:①用氯化铁溶液蚀刻印刷铜电路板
(12分)
(1)写出下列反应的离子方程式:
①用氯化铁溶液蚀刻印刷铜电路板
②过量二氧化碳通入澄清石灰水
③氯化铝溶液与足量的氨水反应
(2)写出下列反应的化学方程式:
①铁与水反应
②氧化铝与氢氧化钠溶液反应
③碳酸钠转化为碳酸氢钠的反应 情有qq1年前1
情有qq1年前1 -
 pengxin1204 共回答了20个问题
pengxin1204 共回答了20个问题 |采纳率95%1年前查看全部
- 如图为2008年北京奥运会会徽,妮妮同学想制作一个会徽佩带在身上,于是他想出了“蚀刻”这种方法.
如图为2008年北京奥运会会徽,妮妮同学想制作一个会徽佩带在身上,于是他想出了“蚀刻”这种方法.
【“蚀刻”原理】利用模板材料能被酸“腐蚀”而石蜡不能被酸“溶解”.
【“蚀刻”方法】制作方法与步骤为:
①对模板表面进行打磨等处理:
②在模板上涂上一层防酸材料石蜡;
③在石蜡上面刻出“舞动北京”会徽图象,并使刻有图象部分的模板全部曝露9即清除图象部分的石蜡);
④用稀盐酸对其表面进行处理,稀盐酸就能“腐蚀”曝露部分的模板.
⑤除去石蜡涂层,清洗后,模板上就能显现出一个精美的“舞动的北京”会徽.
请根据上述的内容,填空:
(1)制作模板的材料不能选用______
A.铁B.大理石C.铝D.金
不能选用该材料的理由是______.
(2)请写出(1)中的任意一种可选用材料与盐酸反应的化学方程式:______.
 xile231年前1
xile231年前1 -
 也许是缘分 共回答了13个问题
也许是缘分 共回答了13个问题 |采纳率92.3%(1)根据蚀刻的过程分析可知选用的材料需要能与盐酸反应,分析四个选项中的物质可以看出铁、铝的金属活动性在氢前能与盐酸反应,而金在氢后不能与盐酸反应,大理石的主要成分是碳酸钙也能与盐酸反应,所以不可以采用金做为蚀刻材料;
(2)两种金属均能与盐酸反应生成氢气和盐酸盐,而碳酸钙能与盐酸反应生成氯化钙水和二氧化碳,其方程式分别为:Fe+2HCl=FeCl 2 +H 2 ↑;2Al+6HCl=2AlCl 3 +3H 2 ↑;CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑,
故答案为:(1)D;该物质不能与盐酸反应;(2)Fe+2HCl=FeCl 2 +H 2 ↑(或;2Al+6HCl=2AlCl 3 +3H 2 ↑或CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑)1年前查看全部
- 请谁能帮忙做一下碱性蚀刻盐成分数据分析
 gboy20041年前1
gboy20041年前1 -
 金金鱼 共回答了13个问题
金金鱼 共回答了13个问题 |采纳率69.2%你看看这个,我是做线路板的,蚀刻有很多种,不知道你要的是不是这个,请看!
母液 Cl- 也就是蚀刻盐
1.酸式滴定管
2.吸耳球
3.移液管5ml
4.250ml锥形瓶
5.100ml容量瓶
6.5%铬酸钠指示剂.
7.2%冰醋酸
8.0.1N-AgNO3
化验方法:
1.取样5ml入100ml容量瓶中,加纯水至刻度线,摇匀.
2.取稀释液5ml入250ml锥形瓶中,加纯水50ml
3.加1ml5%铬酸钠指示剂,再加入2%冰醋酸使溶液呈透明黄绿色
4.以0.1N-AgNO3滴定溶液呈红棕色沉淀为终点.
5.计算:Cl-(g/l)=V ×14.2 ×f
注:V- AgNO3消耗量
f- AgNO3摩尔浓度
Cu2+
1.酸式滴定管
2.1ml移液管
3.吸耳球
4.250ml锥形瓶
5.0.05M-EDTA
6.紫尿酸胺指示剂
化验方法:
1.取样1ml入250ml锥形瓶中,加纯水50ml
2.加入小半匙紫尿酸胺指示剂.
3.以0.05M-EDTA滴定溶液由蓝色变为草绿色再变为蓝色为终点.
4.计算:Cu2+(g/l)=V ×63.5 ×0.05
注:V-EDTA消耗量1年前查看全部
- 金属蚀刻后填漆的最好的方法
 han5221年前1
han5221年前1 -
 翩翩红叶 共回答了14个问题
翩翩红叶 共回答了14个问题 |采纳率78.6%先把绣得地方拿砂纸去除干净 如果小的地方就刷层封备底漆 大的就喷 在上原子灰1年前查看全部
- 本人是做蚀刻的,现在想知道三氯化铜蚀刻和三氯化铁蚀刻有什么不同,他们的各自的优点和缺点在哪些地方,
本人是做蚀刻的,现在想知道三氯化铜蚀刻和三氯化铁蚀刻有什么不同,他们的各自的优点和缺点在哪些地方,
氯化铜,和三氯化铁的各自的特点是什么呀, 一条没有泪的鱼1年前2
一条没有泪的鱼1年前2 -
 9890 共回答了25个问题
9890 共回答了25个问题 |采纳率84%酸性氯化铜蚀刻过程的主要化学反应在蚀刻过程中,氯铜中的Cu2+具有氧化性,能将板氧 化成Cu+ ,其反应如下:蚀刻反应:Cu+CuCl2=Cu2Cl2 形成的Cu2Cl2是不易溶于水的,在有过量的Cl-存在下,能形成可溶性的络合离子,其反应...1年前查看全部
- (13分)某研究性学习小组在网上收集到如下信息:Fe(NO 3 ) 3 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原
(13分)某研究性学习小组在网上收集到如下信息:Fe(NO 3 ) 3 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO 3 ) 3 溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO 3 溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe 1 + 具有氧化性,能氧化Ag。
假设2:Fe(NO 3 ) 3 溶液显酸性,在此酸性条件下NO 3 能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe 3 + ,验证了假设1成立。请写出Fe 3 + 氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO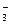 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。实验步骤(不要求写具体操作过程) 预期现象和结论 ①
②
……若银镜消失,假设2成立。
若银镜不消失,假设2不成立。
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO 3 ) 3 溶液中的Fe 3 + 和NO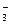 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。 zhongnuoqi1年前1
zhongnuoqi1年前1 -
 buddzk 共回答了17个问题
buddzk 共回答了17个问题 |采纳率100%(1)ade(2)Fe 3+ +Ag= Fe 2+ +Ag + (3)①将银镜在硝酸铜溶液中(4)同意 4Fe 3+ +6H 2 O+9Ag+3NO 3 - =4Fe(OH) 3 +9Ag + +3NO 本题第(1...1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关说法正确的是( )
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子的物质的量之比为2:1
C. 若反应中生成0.2mol HNO3,则反应共转移0.2mol e-
D. NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 春发11年前1
春发11年前1 -
 无挂碍乎无有恐怖 共回答了17个问题
无挂碍乎无有恐怖 共回答了17个问题 |采纳率100%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故D正确.
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- 求Ni元素,Cu元素各价态间的电极电势,在酸性微蚀刻溶液中?
 0606211年前1
0606211年前1 -
 欢乐藤 共回答了19个问题
欢乐藤 共回答了19个问题 |采纳率84.2%Cu2+/Cu+:0.158V
Cu+/Cu:0.522V
Ni4+/Ni2+:1.93V
Ni2+/Ni:-0.23V1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
C.若反应中生成0.2molHNO3,则反应共转移0.2mole-
D.反应中被氧化与被还原的原子物质的量之比为2:1 tjly20051年前1
tjly20051年前1 -
 叶长香花 共回答了17个问题
叶长香花 共回答了17个问题 |采纳率82.4%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故B正确;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故D错误.
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色、无臭,在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列有关说法正确的是( )
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子的物质的量之比为2:1
C. 若反应中生成0.2mol HNO3,则反应共转移0.2mol e-
D. NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 ykdyjkhhcghgc1年前1
ykdyjkhhcghgc1年前1 -
 ljj247763949 共回答了14个问题
ljj247763949 共回答了14个问题 |采纳率92.9%解题思路:反应3NF3+5H2O═2NO+HNO3+9HF中,只有N元素的化合价发生变化,自身发生氧化还原反应,当有3molNF3参加反应,生成2molNO,1molHNO3,反应中氧化剂与还原剂的物质的量之比为2:1,结合方程式以及对应物质的性质解答该题.A.只有N元素的化合价发生变化,自身发生氧化还原反应,故A错误;
B.当有3molNF3参加反应,生成2molNO,1molHNO3,反应中被氧化与被还原的原子的物质的量之比为1:2,故B错误;
C.若反应中生成0.2molHNO3,N元素化合价由+3价升高到+5价,则反应共转移0.4mole-,故C错误;
D.反应中生成NO,与氧气反应生成红棕色的NO2,同时生成硝酸,易与空气中的水蒸气结合形成白雾,故D正确.
故选D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应知识,侧重于氧化还原反应反应的概念和计算的考查,题目难度不大,注意反应中元素化合价的变化,为解答该类题目的关键.1年前查看全部
- (2008•康定县)如图为2008年北京奥运会会徽,妮妮同学想制作一个会徽佩带在身上,于是他想出了“蚀刻”这种方法.
 (2008•康定县)如图为2008年北京奥运会会徽,妮妮同学想制作一个会徽佩带在身上,于是他想出了“蚀刻”这种方法.
(2008•康定县)如图为2008年北京奥运会会徽,妮妮同学想制作一个会徽佩带在身上,于是他想出了“蚀刻”这种方法.
【“蚀刻”原理】利用模板材料能被酸“腐蚀”而石蜡不能被酸“溶解”.
【“蚀刻”方法】制作方法与步骤为:
①对模板表面进行打磨等处理:
②在模板上涂上一层防酸材料石蜡;
③在石蜡上面刻出“舞动北京”会徽图象,并使刻有图象部分的模板全部曝露9即清除图象部分的石蜡);
④用稀盐酸对其表面进行处理,稀盐酸就能“腐蚀”曝露部分的模板.
⑤除去石蜡涂层,清洗后,模板上就能显现出一个精美的“舞动的北京”会徽.
请根据上述的内容,填空:
(1)制作模板的材料不能选用______
A.铁B.大理石C.铝D.金
不能选用该材料的理由是______.
(2)请写出(1)中的任意一种可选用材料与盐酸反应的化学方程式:______. yinghua201年前1
yinghua201年前1 -
 ygnfhwjw 共回答了23个问题
ygnfhwjw 共回答了23个问题 |采纳率91.3%解题思路:(1)根据蚀刻的过程分析选用的材料需要能与盐酸反应分析解答即可;
(2)根据反应物生成物以及化学方程式的书写要求解答即可;(1)根据蚀刻的过程分析可知选用的材料需要能与盐酸反应,分析四个选项中的物质可以看出铁、铝的金属活动性在氢前能与盐酸反应,而金在氢后不能与盐酸反应,大理石的主要成分是碳酸钙也能与盐酸反应,所以不可以采用金做为蚀刻材料;
(2)两种金属均能与盐酸反应生成氢气和盐酸盐,而碳酸钙能与盐酸反应生成氯化钙水和二氧化碳,其方程式分别为:Fe+2HCl=FeCl2+H2↑;2Al+6HCl=2AlCl3+3H2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑,
故答案为:(1)D;该物质不能与盐酸反应;(2)Fe+2HCl=FeCl2+H2↑(或;2Al+6HCl=2AlCl3+3H2↑或CaCO3+2HCl═CaCl2+H2O+CO2↑)点评:
本题考点: 酸的化学性质.
考点点评: 据题目信息分析蚀刻的材料,依据反应物和生成物的情况,利用书写化学方程式的方法及步骤,正确书写化学方程式即可.1年前查看全部
- 关于不锈钢蚀刻液配方刚接触蚀刻,用的新药水三氯化铁浓度是47的,没加水直接就用了、刚开始还行但用了一下蚀刻速度很慢、才刻
关于不锈钢蚀刻液配方
刚接触蚀刻,用的新药水三氯化铁浓度是47的,没加水直接就用了、刚开始还行但用了一下蚀刻速度很慢、才刻了一点东西今天就就发现刻出来的产品有些掉油墨了、蚀刻温度40到45、我刻的是0·2的钢片、有人说是不是药水太浓了、那现在怎么解决!请教下蚀刻技术者、谢谢了. 其实天_涯1年前2
其实天_涯1年前2 -
 godknown 共回答了23个问题
godknown 共回答了23个问题 |采纳率87%蚀刻液三氯化铁比重范围38—42波美度左右,一般还需要加少量的盐酸和助剂起到还原作用.配好的蚀刻液酸度范围0--1.5N/L.1年前查看全部
- 1.玻璃的化学蚀刻利用了(——)能腐蚀玻璃的特性A盐酸B硫酸C草酸D氢氟酸
 llaawei1年前3
llaawei1年前3 -
 秋千-123 共回答了14个问题
秋千-123 共回答了14个问题 |采纳率85.7%选D.1年前查看全部
- 用加热后的三氯化铁溶液蚀刻铝铭牌时,铭牌中某些小的字被蚀刻烂,是技术还是溶液的浓度出问题了,怎样解
用加热后的三氯化铁溶液蚀刻铝铭牌时,铭牌中某些小的字被蚀刻烂,是技术还是溶液的浓度出问题了,怎样解
本人是做铝,不锈钢的铭牌的,现在在制作的过程中,蚀刻这一个步骤出现问题了,就是一些铭牌用三氯化铁蚀刻后,把其中一些比较小的字也腐蚀掉,成不了成品,想问一下是哪些地方做错了,有其他的蚀刻办法吗,腐蚀液的浓度是多少? gjgrgfzs1年前3
gjgrgfzs1年前3 -
 oo女神1 共回答了19个问题
oo女神1 共回答了19个问题 |采纳率89.5%铝材用三氯化铁蚀刻不是太好,可用另外两种方法:一、用碱蚀刻,要换一种油墨能抗碱的,我们公司也有;二、用混合酸按一定的比例蚀刻(混合酸的配方如果您需要的话,我也可以告诉您),而不是用三氯化铁.以上两种方法我有很多客户在用.效果都非常不错.1年前查看全部
- 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
(1)下列有关制备银镜过程的说法正确的是______.
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水.至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag.
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:______.
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生).
[思考与交流]实验步骤(不要求写具体操作过程) 预期现象和结论 ①
②
…若银镜消失,假设2成立.
若银镜不消失,假设2不成立.
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立.则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag.你是否同意丙同学的结论,并简述理由:______. 优哉06011年前1
优哉06011年前1 -
 手牵牛 共回答了11个问题
手牵牛 共回答了11个问题 |采纳率90.9%解题思路:(1)根据银镜反应实验的注意事项以及银镜反应的实验原理进行回答;
(2)根据氧化还原反应的原理来书写方程式;
(3)通过做对比试验的办法来获得结论,可以选择合适的试剂来验证是Fe3+还是NO3-将银氧化;
(4)根据题目所给的信息:假设1成立,假设2也成立来回答.(1)a银氨溶液的配制方法:边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水.至最初的沉淀恰好溶解为止,故a正确;
b、将几滴银氨溶液滴入2mL乙醛中,不能保证溶液显碱性,而银镜实验必须在碱性环境里发生,故b错误;
c、制备银镜时,用酒精灯的外焰给试管底部加热时温度太高,应水浴加热,故c错误;
d、银氨溶液具有较弱的氧化性,可以将醛氧化,故d正确;
e、在银氨溶液配制过程中,溶液的pH增大,保证溶液显碱性,银镜反应必须在碱性环境下发生,故e正确.
故答案为:ade;
(2)Fe3+氧化Ag的离子方程式为:Fe3++Ag=Fe2++Ag+;故答案为:Fe3++Ag=Fe2++Ag+;
(3)可以选择硝酸铜做一下参考实验,即将银镜放在硝酸铜溶液中,若银镜消失,假设2成立,若银镜不消失,假设2不成立,故答案为:将银镜放在硝酸铜溶液中;
(4)同意,因为甲同学验证了假设1成立,乙同学验证了假设2也成立,说明Fe3+和NO3-同时将银氧化,即发生反应4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO;故答案为:同意甲同学验证了假设1成立,乙同学验证了假设2也成立,说明Fe3+和NO3-同时将银氧化,即发生反应4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO.点评:
本题考点: 离子方程式的书写;氧化还原反应;铁盐和亚铁盐的相互转变;化学实验方案的评价.
考点点评: 本题第(1)小题是考查学生实验,最后2小题具有较大的开放度,考查了学生分析和解决问题的能力.1年前查看全部
- 电蚀刻和化学蚀刻各有什么优缺点?
 13853oo3731年前1
13853oo3731年前1 -
 真实自我 共回答了22个问题
真实自我 共回答了22个问题 |采纳率77.3%电蚀刻:电蚀刻是利用金属在以自来水或盐水为蚀刻主体的液体中发生阳极溶解的原理,(电解的作用下)将金属进行蚀刻,接通蚀刻电源,从而达到蚀刻的目的.现在市售的电解蚀刻机都是手动喷淋式的,并且都是以盐水为蚀刻溶液,功率有大小二种,优点是无污染,操作方便,适合实验生产、凹字小面积蚀刻.主要用做研究实验机,或者简单的在金属上蚀刻标记,也称为电打标.缺点是不能大量生产,也不能做凸字大面积蚀刻.不能用做标牌的大批量生化学蚀刻:1、此技术改进了传统的金属处理方法.
2、这种技术可以通过数据,图表.设计及复杂的柱状等来加工凹凸的金属产品.
3、蚀刻技术可以用于制作为孔型及各种形式.
二.蚀刻网技术标准
1、机械制作的最小丝经为0.02mm
2、最大生产面积为500mm*600mm
3、材料的厚度为0.02mm - 0.5mm
三、化学蚀刻适用范围:
1、可加工的金属种类:各种金属、合金及不锈钢板材、带材;
2、板材厚度范围:2mm及以下薄板,特别适用0.5mm以下薄板;
3、行业用途:
(1)石油、化工、食品、制药用精密过滤网、过滤板、过滤筒、过滤器;
(2)电子行业用金属漏板、盖板、平面引脚、引线框架、金属基片;
(3)精密光学及机械平面零件、弹簧零件;
(4)摩擦片及其它凹凸型平面零件;
(5)金属标牌及图案复杂的金属装饰板和精美工艺品.1年前查看全部
- 用氯化铁溶液蚀刻铜印刷电路板反应的离子方程式
 武的东东1年前1
武的东东1年前1 -
 quy9888 共回答了18个问题
quy9888 共回答了18个问题 |采纳率83.3%Cu+2Fe3+=Cu2++2Fe2+1年前查看全部
- 为什么用氯化铁溶液蚀刻铜印刷电路板?
 hen14ry1年前2
hen14ry1年前2 -
 blackcat2007 共回答了30个问题
blackcat2007 共回答了30个问题 |采纳率93.3%三价铁离子与铜发生氧化还原反应,生成二价铁离子和铜离子
2FeCl3+Cu=2FeCl2+CuCl21年前查看全部
- 某研究性学习小组在网上收集到如下信息: 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:&
某研究性学习小组在网上收集到如下信息: 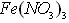 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】 制备银镜,并与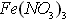 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_____________。
a.边振荡盛有2%的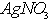 溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】 假设1: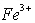 具有氧化性,能氧化Ag。 假设2:
具有氧化性,能氧化Ag。 假设2: 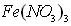 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下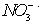 能氧化Ag 。
能氧化Ag 。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出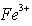 验证了假设1成立。请写出
验证了假设1成立。请写出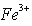 氧化Ag的离子方程式________________________。
氧化Ag的离子方程式________________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: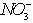 在不同条件下的还原产物较复杂,有时难以观察到气体 产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体 产生)。 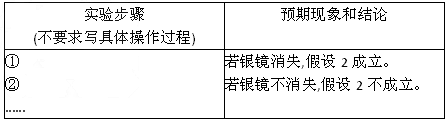
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论: 溶液中的Fe 2+ 和NO 3 - 都氧化了Ag。你是否同意丙同学的结论,并简述理由
溶液中的Fe 2+ 和NO 3 - 都氧化了Ag。你是否同意丙同学的结论,并简述理由
_____________________。 crazyking20081年前1
crazyking20081年前1 -
 allan0477 共回答了14个问题
allan0477 共回答了14个问题 |采纳率92.9%1年前查看全部
- 标牌电蚀刻问题标准的电蚀刻液都是盐水.但是盐水蚀刻标牌太慢,于是有人建议向盐水里加盐酸或氢氟酸或三氯化铁.可是电蚀刻头就
标牌电蚀刻问题
标准的电蚀刻液都是盐水.
但是盐水蚀刻标牌太慢,于是有人建议向盐水里加盐酸或氢氟酸或三氯化铁.可是电蚀刻头就是不锈钢板做的,它尽管是阴极,不受电解腐蚀,可它总要与盐水以外的那几种酸接触呀.因此请懂化学和电化学的朋友回答:
1、盐酸、氢氟酸、硝酸、哪一种会腐蚀不锈钢?
2、蚀刻不锈钢,黄铜板,最快的电解蚀刻液会有哪些组成?
3、有说蚀刻铝牌,用电蚀刻比化学蚀刻快,根据是甚麽? GNNDB1年前1
GNNDB1年前1 -
 世上本无路5 共回答了14个问题
世上本无路5 共回答了14个问题 |采纳率100%1.不锈钢(300系列)在硝酸中会钝化,面盐酸和氢氟酸会造成不锈钢的腐蚀,优以HF为重.
2.蚀刻不锈钢用NaCl(食盐)水溶液就可以,黄铜可以考虑用NaCl和NaNo3(硝酸钠)混合溶液.
3.蚀刻铝牌与其它金属一样,不存在绝对的电蚀比化学蚀刻快,电蚀对小面积细线条的图案,按每次一块与化学蚀刻相丝,要快5-10倍(看蚀刻液配方及蚀刻头形状,阴阳极间距,蚀刻温度,电源波形),但化学蚀刻一次蚀刻的面积可能要较电刻大几十或数百倍(如用PCB机),所以这种说法不准确!1年前查看全部
- 金属蚀刻深度均匀度如何控制
 hkxycrj1年前3
hkxycrj1年前3 -
 jackyshu_xi 共回答了18个问题
jackyshu_xi 共回答了18个问题 |采纳率100%我建议你在百度文库中搜一下关于金属抛光的资料,我认为可以通过相同的原理即先制造出与之互相匹配的模具作为阴极.阳极用原本光滑的金属平板再通以电流经过一定的时间可以得到深度相等的刻槽,前提是阴极那块板能在相应位置突出的高度相同1年前查看全部
- 用三氯化铁蚀刻不锈钢,我想问下,用什么添加济防止油墨不掉,没有白边.你们的配方是怎么配的啊
 yanyan6181年前3
yanyan6181年前3 -
 fandh 共回答了19个问题
fandh 共回答了19个问题 |采纳率100%1.在蚀刻过程中通常会出现掉墨现象,但不一定是蚀刻药水的问题.比如你在蚀刻之前有没有经过高温(固化)或者你用的是什么油墨都会造成掉油墨.
2.你现在的药水比重是多少呢?用了多长时间了(也就是刻了多少钢了)?药水比重一般要控制在41-45之间比较好.
3.(添加济)有买的,你可以找那些卖蚀刻药水的打听下那里有卖,(添加济与盐酸)的比例是1:2.5在使用的过程中一定要注意:切记!先加(添加济)过5分钟后再盐酸.以免散发难闻的臭气体.
希望我的回答能帮上你!可以的话别忘了给我加分,哈哈1年前查看全部
- 蚀刻线路时,线路的顶端在蚀刻时特别快,有没有解决的办法?
蚀刻线路时,线路的顶端在蚀刻时特别快,有没有解决的办法?
蚀刻线路时,线路的顶端在蚀刻时特别快,容易蚀刻成不规则的图形,有没有解决的办法?或者这是个什么反应? lkl8264211年前2
lkl8264211年前2 -
 手握流沙 共回答了27个问题
手握流沙 共回答了27个问题 |采纳率96.3%因为蚀刻顶端接触蚀刻液面积大,时间最长,容易被腐蚀;加强干膜的附着力!1年前查看全部
- 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
(1)下列有关制备银镜过程的说法正确的是______.
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水.至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag.
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag.
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立.请写出Fe3+氧化Ag的离子方程式:______.
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生).
[思考与交流]实验步骤(不要求写具体操作过程) 预期现象和结论 ①
②
…若银镜消失,假设2成立.
若银镜不消失,假设2不成立.
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立.则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag.你是否同意丙同学的结论,并简述理由:______. yueliang1111年前1
yueliang1111年前1 -
 小强0910 共回答了16个问题
小强0910 共回答了16个问题 |采纳率93.8%解题思路:(1)根据银镜反应实验的注意事项以及银镜反应的实验原理进行回答;
(2)根据氧化还原反应的原理来书写方程式;
(3)通过做对比试验的办法来获得结论,可以选择合适的试剂来验证是Fe3+还是NO3-将银氧化;
(4)根据题目所给的信息:假设1成立,假设2也成立来回答.(1)a银氨溶液的配制方法:边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水.至最初的沉淀恰好溶解为止,故a正确;
b、将几滴银氨溶液滴入2mL乙醛中,不能保证溶液显碱性,而银镜实验必须在碱性环境里发生,故b错误;
c、制备银镜时,用酒精灯的外焰给试管底部加热时温度太高,应水浴加热,故c错误;
d、银氨溶液具有较弱的氧化性,可以将醛氧化,故d正确;
e、在银氨溶液配制过程中,溶液的pH增大,保证溶液显碱性,银镜反应必须在碱性环境下发生,故e正确.
故答案为:ade;
(2)Fe3+氧化Ag的离子方程式为:Fe3++Ag=Fe2++Ag+;故答案为:Fe3++Ag=Fe2++Ag+;
(3)可以选择硝酸铜做一下参考实验,即将银镜放在硝酸铜溶液中,若银镜消失,假设2成立,若银镜不消失,假设2不成立,故答案为:将银镜放在硝酸铜溶液中;
(4)同意,因为甲同学验证了假设1成立,乙同学验证了假设2也成立,说明Fe3+和NO3-同时将银氧化,即发生反应4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO;故答案为:同意甲同学验证了假设1成立,乙同学验证了假设2也成立,说明Fe3+和NO3-同时将银氧化,即发生反应4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO.点评:
本题考点: 离子方程式的书写;氧化还原反应;铁盐和亚铁盐的相互转变;化学实验方案的评价.
考点点评: 本题第(1)小题是考查学生实验,最后2小题具有较大的开放度,考查了学生分析和解决问题的能力.1年前查看全部
- PCB酸性蚀刻子液怎样调配的啊
 yuggie1年前1
yuggie1年前1 -
 冉语 共回答了26个问题
冉语 共回答了26个问题 |采纳率88.5%酸性蚀刻液的主要成份:CuCL2.2H2O,HCl,NaCl,NH4Cl,H2O
酸性氯化铜蚀刻过程的主要化学反应在蚀刻过程中,氯铜中的Cu2+具有氧化性,能将板氧
化成Cu1+ ,其反应如下:
蚀刻反应:Cu+CuCl2->Cu2Cl2
形成的Cu2Cl2是不易溶于水的在有过量的Cl-存在下,能形成可溶性的络合离子,其反应如下:
络合反应:Cu2Cl2 +4Cl- ->2[CuCl3]2-
随着铜的蚀刻,溶液中的Cl1+越来越多,蚀刻能力很快就会下降,直到最后失去效能.为保持蚀刻能力,可以过溶液再生的方式将Cu1+重新?成CU2+.刻能力.
蚀刻液的再生:
再生的原理主要是利用氧化剂将溶液中的Cu1+ 氧化成Cu2+.
再生方法一般有以下几种.
1) 通氧气或压缩空气再生:主要的再生反应为:2Cu2Cl2+4HCl+O2 ->4CuCl2+2H2O
但此方法再生反应速率很低.
2)氯气再生:主要的再生反应为:Cu2Cl2+Cl2 ->2CuCl2由于氯气是强氧化剂,直接通
氯气是再生的最好方法.因为它的成本低,再生速率快.但是,很难做到使氯气全部都参
加反应,如有氯气溢出,会污染环境.故该法要求蚀刻设备密封.
3)电解再生:主要的再生反应为:在直流电的作用下,在阳极:Cu1+ ->Cu2+ +e
在阴极:Cu1+ +e->Cu0这种方法的优点是可以直接回收多余的铜,同时又使Cu1+氧
化成Cu2+,使蚀刻液得到再生.但是此方法的再生设备投入较大且
要消耗较多的电能.1年前查看全部
- 英语翻译1.线路缺损:干膜在产品转运过程中,触碰到尖利的东西,导致干膜松动但未脱落,DES时药液渗入,将铜面蚀刻掉,但根
英语翻译
1.线路缺损:干膜在产品转运过程中,触碰到尖利的东西,导致干膜松动但未脱落,DES时药液渗入,将铜面蚀刻掉,但根部有铜箔;
2.焊盘断裂:从不良图片可以看出此产品断裂产生原因主要为FPC焊接或焊接 后工序人员作业操作不当(烙铁温度过高,焊锡时间太长)或受严重外力撞击造成.因为FPC每个焊盘敝司都有做100%电性测试,若有断裂现象则测试会NG,另外若是敝司产生的,最大的可能就是产品受到严重的外力撞击才会出现断裂,如果是此原因产生的,焊盘周围和背面的胶纸会相应的受到损伤出现折痕,但从图片此看,均无此现象,故不良不是我司产生;烦请客户协助调查原因.
1.线路缺损:贴合干膜的产品在转运过程中必须使用物料框转运,且放置的产品不能超过2LOT,以免将干膜松动、擦伤;3.29已经实施 责任人
2.焊盘断裂:敝司都有做100%电性测试,经过电测产品会留有电测防呆针印记,若有断裂(开路)现象则测试会NG.
-- 代表开路 C1 代表线路 U5 代表第5个产品说明:第5个产品179与180两点开路 5000元1年前1
5000元1年前1 -
 忆哭私田 共回答了26个问题
忆哭私田 共回答了26个问题 |采纳率96.2%1. Line Defect: dry in the product during transit, touching something sharp, causing dry loose but not off, DES when the liquid infiltration, the etched copper surface, but the roots, copper foil;
2. pad fracture: bad picture can be seen from the fracture causes of this product mainly for welding or soldering process after the FPC staff job improper operation (high temperature soldering iron, solder too long) or caused by the severe external shock. Democratic Secretary of each pad as FPC have done 100% electrical test, the test will be if breakage NG, also produced if the Democratic Secretary, the biggest is probably the product to severe physical shock to appear broken, if it is Produced this reason, the back pad and tape around the corresponding damage will crease, but the image of this view, this is not the phenomenon is not so bad our generation; please customers to help investigate the cause.
1. Line Defect: dry fit the product in transit must use the material transfer box, and place the product can not exceed 2LOT, so as not to dry loose, scratch; 3.29 persons responsible have been implemented
2. pad broken: Democratic Secretary has to do 100% electrical testing, electrical test after test electronic products would have a needle mark foolproof, if fault (open) the phenomenon of the test will be NG.
- C1 open circuit on behalf of the representative on behalf of line U5 5 Description: The first five products 179 and 180 are opened.1年前查看全部
- PCB板蚀刻药水怎么分析?以及其化学方程式.
PCB板蚀刻药水怎么分析?以及其化学方程式.
我刚接触这个工作,是在化验室分析车间里用来蚀刻线路板的化学药水,以确保药水的酸碱性吧.不然线路板上的铜泊会因为药水的不达标造成厚薄不均等等其它品质问题.我这个岗位就是定时对药水做分析,流程我自己学得差不多了,所以我想进一步了解下一般都用什么试剂,和用什么方法来分析的,最好有具体步骤,因为现在没什么人主动教我,都是看着学的,我只了解的程序是:药水取样-用装有部分纯水的锥形瓶调试剂-用移液管往试剂里倒进蚀刻药水-在用其它东西来干什么我就不太清楚了,有人愿意把相关数据和步骤说下吗? 费劲小林1年前1
费劲小林1年前1 -
 yishuiyang123 共回答了17个问题
yishuiyang123 共回答了17个问题 |采纳率100%不用太在意了,知道也没用,这个就是操作工的活.1年前查看全部
- 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:

I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气.
己知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)过程I 加入铁屑的主要作用是______,从固体B中分离出铜需采用的方法是______;
(2)过程II中发生反应的化学方程式为______,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
=4.0×10-11Ksp c3(OH−) C(Fe3+)=.(列式计算)
=4.0×10-11Ksp c3(OH−)
(3)FeCl3的水溶液呈______性(填“酸”、“碱”、“中”),原因是______(用离子方程式表示),在④过程中应如何操作______. 天地毋庸1年前1
天地毋庸1年前1 -
 商州狼 共回答了16个问题
商州狼 共回答了16个问题 |采纳率87.5%解题思路:废液含有氯化铁、氯化铜,加入试剂Ⅰ为过量铁,发生反应生成氯化亚铁和铜,过滤得到固体B为Cu和Fe,滤液A加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,反应生成氢氧化铁,过滤得到固体D加入稀盐酸溶解得到溶液E,通过蒸发浓缩,冷却结晶过滤洗涤得到氯化铁晶体.(1)过程I 加入铁屑的主要作用是,利用铁和铁离子反应生成亚铁离子,和铜离子反应生成金属铜,过滤得到固体B为Fe和Cu,加入稀盐酸过滤得到铜;
故答案为:回收铜;加盐酸后过滤;
(2)过程II中发生反应是向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁和空气中的氧气反应生成氢氧化铁,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
Ksp
c3(OH−)=4.0×10-11;
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;C(Fe3+)=
Ksp
c3(OH−)=4.0×10-11;
(3)FeCl3的水溶液中铁离子水解显酸性,反应的离子方程式为:Fe3++3H2O⇌Fe(OH)3+3H+,氯化铁溶液得到氯化铁晶体,需要防止铁离子水解,应在稀盐酸或氯化氢气流中加热蒸发浓缩结晶过滤得到晶体;
故答案为:酸;Fe3++3H2O⇌Fe(OH)3+3H+;在盐酸溶液中或氯化氢气流中浓缩结晶并过滤.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离提纯的分析流程的理解应用,掌握物质性质是关键,题目较简单.1年前查看全部
- (2012•海南)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(O
(2012•海南)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(OH)3]=4.0×10-38)
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______:
(2)过程Ⅰ加入铁屑的主要作用是______,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是______;
(3)过程Ⅱ中发生反应的化学方程式为______;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为c(Fe3+)=
=4×10-11mol/L4.0×10−38 (10−9)3 c(Fe3+)=.(列式计算)
=4×10-11mol/L4.0×10−38 (10−9)3  找一个说法1年前1
找一个说法1年前1 -
 蝈蝈是虫 共回答了23个问题
蝈蝈是虫 共回答了23个问题 |采纳率91.3%解题思路:(1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;
(4)过程Ⅱ中调节溶液的pH为5,氢氧化铁沉淀溶液中存在沉淀溶解平衡,依据溶度积常数计算.(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜,
故答案为:回收铜;Cu和Fe;加入盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10-9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)⇌Fe3++3OH-;Ksp=c(Fe3+)×c3(OH-);
c(Fe3+)=
4.0×10−38
(10−9)3=4×10-11mol/L;
故答案为:c(Fe3+)=
4.0×10−38
(10−9)3=4×10-11mol/L.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了铁离子的氧化性,提取铜的反应过程和步骤分析判断,氢氧化铁氢氧化亚铁的转化反应,溶度积的计算应用,题目难度中等.1年前查看全部
- 2010安徽理综化学的问题某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀
2010安徽理综化学的问题
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.[提出假设]假设1:Fe1+具有氧化性,能氧化Ag.假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag.甲同学验证了假设1成立,若乙同学验证了假设2也成立.则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO 都氧化了Ag.你是否同意丙同学的结论,并简述理由:题目中在实验2中测出了Fe(NO3)3的ph值,然后用相同ph的HNO3去溶解银镜,发现银镜溶解,这样为什么不能说明NO3-氧化了银? 答案上说没有检验还原产物 好笨一只猪1年前1
好笨一只猪1年前1 -
 123689354 共回答了14个问题
123689354 共回答了14个问题 |采纳率85.7%三价Fe氧化银还原产物是二价Fe或Fe,而硝酸根离子的还原产物是二(一)氧化氮.个人意见,仅供参考!1年前查看全部
- 电蚀刻和化学蚀刻各有什么优缺点?
电蚀刻和化学蚀刻各有什么优缺点?
我主要蚀刻0.3mm以下不锈钢,做模型蚀刻片,加工量很小,电蚀刻和化学蚀刻各有什么优缺点呢? sealwang1年前2
sealwang1年前2 -
 薄荷兔 共回答了11个问题
薄荷兔 共回答了11个问题 |采纳率100%电蚀刻:
电蚀刻是利用金属在以自来水或盐水为蚀刻主体的液体中发生阳极溶解的原理,(电解的作用下)将金属进行蚀刻,接通蚀刻电源,从而达到蚀刻的目的.现在市售的电解蚀刻机都是手动喷淋式的,并且都是以盐水为蚀刻溶液,功率有大小二种,优点是无污染,操作方便,适合实验生产、凹字小面积蚀刻.主要用做研究实验机,或者简单的在金属上蚀刻标记,也称为电打标.缺点是不能大量生产,也不能做凸字大面积蚀刻.不能用做标牌的大批量生
化学蚀刻:
1、此技术改进了传统的金属处理方法.
2、这种技术可以通过数据,图表.设计及复杂的柱状等来加工凹凸的金属产品.
3、蚀刻技术可以用于制作为孔型及各种形式.
二.蚀刻网技术标准
1、机械制作的最小丝经为0.02mm
2、最大生产面积为500mm*600mm
3、材料的厚度为0.02mm - 0.5mm
三、化学蚀刻适用范围:
1、可加工的金属种类:各种金属、合金及不锈钢板材、带材;
2、板材厚度范围:2mm及以下薄板,特别适用0.5mm以下薄板;
3、行业用途:
(1)石油、化工、食品、制药用精密过滤网、过滤板、过滤筒、过滤器;
(2)电子行业用金属漏板、盖板、平面引脚、引线框架、金属基片;
(3)精密光学及机械平面零件、弹簧零件;
(4)摩擦片及其它凹凸型平面零件;
(5)金属标牌及图案复杂的金属装饰板和精美工艺品.1年前查看全部
- 制作不锈钢铭牌用盐酸加过氧化氢能蚀刻吗,具体配比怎样谢谢
 2月1号1年前1
2月1号1年前1 -
 掐架爱好者 共回答了20个问题
掐架爱好者 共回答了20个问题 |采纳率90%将一块不锈钢板扔进“盐酸加过氧化氢”溶液里,一定会被腐蚀.
这种腐蚀我称它为“无选择全面腐蚀”.
制作腐蚀不锈钢铭牌,与此不同之处是,铭牌版面上印有图案或文字,要求在腐蚀图文的同时,其他版面不被腐蚀.希望不被腐蚀的版面必须采取保护措施.
这个,我称为“有选择腐蚀”.
在腐蚀技术与电镀技术领域,都存在“有选择”和“无选择”的问题,只是不搞标牌的人,没有经历过这个问题因此没有认识罢了.
回到你的问题,过氧化氢与盐酸,皆为强腐蚀剂,能腐蚀多种金属,当然也能腐蚀不锈钢.但这两种材料腐蚀激烈(会破坏保护版面的掩膜),毒性大,易挥发,兑好后要马上使用,价格也高.不适合作为“主剂”配方,来腐蚀不锈钢铭牌.1年前查看全部
- 银是电和热的良导体却不透光,金刚石不是电和热的良导体却透光。科学家们预言,不久的将来,人们可使蚀刻在半导体上的线条的宽度
银是电和热的良导体却不透光,金刚石不是电和热的良导体却透光。科学家们预言,不久的将来,人们可使蚀刻在半导体上的线条的宽度小到十分之一微米以下。研究上述现象所根据的最佳原理是( )
A.经典物理学理论 B.相对论 C.量子理论 D.生物进化论  20431年前1
20431年前1 -
 zhongzhao1 共回答了24个问题
zhongzhao1 共回答了24个问题 |采纳率87.5%C
经典物理学理论所研究的是具有相当直观性,全都看得见、摸得着的物体,排除A项;相对论描绘的是一个崭新的宏观宇宙世界,排除B项;生物进化论是用来解释生物在世代之间具有变异现象的一套理论,排除D项。半导体是随着量子理论的创立而带来的划时代的技术创新之一,它描绘的是微观粒子世界,只有C项符合题意。1年前查看全部
- 碱性蚀刻时,怎样加快蚀刻的速度!氢氧化钠蚀刻!
碱性蚀刻时,怎样加快蚀刻的速度!氢氧化钠蚀刻!
加快蚀刻铝材的同时,不能伤害到外表的保护层(油墨)类!有办法吗? justthinking1年前1
justthinking1年前1 -
 三月的雨96 共回答了18个问题
三月的雨96 共回答了18个问题 |采纳率88.9%油墨有很多种,只要油墨本身不与碱反应就可以了
硫酸铜(其实是不稳定的铜酸钠)不会腐蚀的
你是刻蚀铝?氢氧化钠已经很快了.
方法一:加大氢氧化钠浓度
方法二:当然可以滴几滴硫酸铜(只能几滴,多了会沉淀,这时溶液变蓝),
使之生成不稳定络合物[Cu(OH)4]2-
铝可以从中置换出Cu,形成原电池加快反应1年前查看全部
- 怎样配制盐酸双氧水溶液蚀刻PCB板
 leon18601年前2
leon18601年前2 -
 刚日森格 共回答了15个问题
刚日森格 共回答了15个问题 |采纳率86.7%双氧水和工业浓盐酸浓度都是30%左右.
(H2O2分子量34,氯化氢分子量36.5.所以两者比例3:1到4:1配比就可以,双氧水少点.
化学方程式4HCl+H2O2+Cu====H2CuCl4+2H2O)
但是要注意,必须先加水稀释双氧水,再混合,否则可能发生危险,产生氯气,因为高浓度的双氧水和浓盐酸混合发生氯气事故是有先例的.
如果你自己知道两者浓度更好(工业盐酸和双氧水都是30%左右).
你把双氧水先稀释成等浓度8%到12%,然后与30%盐酸等体积混合,体积比1:1.然后就很容易刻蚀铜箔了.1年前查看全部
- 蚀刻的正常深度是多少?蚀刻的底纹很粗糙.正常是什么样
 飘飞缘1年前2
飘飞缘1年前2 -
 神仙猪 共回答了16个问题
神仙猪 共回答了16个问题 |采纳率87.5%刻蚀哪里有正常的深度,这与刻蚀的工件金属组成及刻蚀液的浓度还有刻蚀时间都有关系.再说不同的产品要求也不同.1年前查看全部
- 冰冻断裂和冰冻蚀刻技术可用于研究细胞膜内部结构,是对还是错?
 1119661年前1
1119661年前1 -
 ioi0 共回答了22个问题
ioi0 共回答了22个问题 |采纳率90.9%正确的.你看看《细胞生物学》翟中和王喜忠版的,第二章讲的很详细.这个技术就是用来观察膜断裂面的蛋白颗粒和膜面结构,有立体感,而且不需要固定和包埋.1年前查看全部
- 蚀刻304不锈钢蚀刻好后会有黑印 以为我蚀刻的面积比较大 想知道三氯化铁的配方
蚀刻304不锈钢蚀刻好后会有黑印 以为我蚀刻的面积比较大 想知道三氯化铁的配方
具体的温度 三氯化铁浓度 要加什么《像盐酸还有什么的比例是多少》 我对蚀刻是深度没要求一点点深度就可以 现在就是蚀刻好有黑印还有地面有针孔 jam_xin1年前2
jam_xin1年前2 -
 small--horse 共回答了18个问题
small--horse 共回答了18个问题 |采纳率100%三氯化铁(30-42)°Be 67%
双氧水 16%
氢氟酸 17%
这个我试过还可以1年前查看全部
- PCB 图形电镀后蚀刻线路上会出现缺口怎么解决
PCB 图形电镀后蚀刻线路上会出现缺口怎么解决
线路板过完蚀刻后,在OAI检板时发现有缺口,请问这是什么情况,是电镀不良吗,什么原因,怎么解决,谢谢!


 656675161年前1
656675161年前1 -
 dennis_jjc 共回答了20个问题
dennis_jjc 共回答了20个问题 |采纳率80%要么铜层和基材结合不良,要么印刷工序,基本没其他可能存在1年前查看全部
- 碱性蚀刻药液分析方法
 心情正在刷新1年前1
心情正在刷新1年前1 -
 apple424 共回答了18个问题
apple424 共回答了18个问题 |采纳率88.9%你是配完之后想化验一下是吧?
化验方法如下:
母液 Cl- 也就是蚀刻盐
1.酸式滴定管
2.吸耳球
3.移液管5ml
4.250ml锥形瓶
5.100ml容量瓶
6.5%铬酸钠指示剂.
7.2%冰醋酸
8.0.1N-AgNO3
化验方法:
1.取样5ml入100ml容量瓶中,加纯水至刻度线,摇匀.
2.取稀释液5ml入250ml锥形瓶中,加纯水50ml
3.加1ml5%铬酸钠指示剂,再加入2%冰醋酸使溶液呈透明黄绿色
4.以0.1N-AgNO3滴定溶液呈红棕色沉淀为终点.
5.计算: Cl-(g/l)=V ×14.2 ×f
注:V- AgNO3消耗量
f- AgNO3摩尔浓度
Cu2+
1.酸式滴定管
2.1ml移液管
3.吸耳球
4.250ml锥形瓶
5.0.05M-EDTA
6.紫尿酸胺指示剂
化验方法:
1.取样1ml入250ml锥形瓶中,加纯水50ml
2.加入小半匙紫尿酸胺指示剂.
3.以0.05M-EDTA滴定溶液由蓝色变为草绿色再变为蓝色为终点.
4.计算: Cu2+(g/l)=V ×63.5 ×0.05
注:V-EDTA消耗量1年前查看全部
- 盐酸和硝酸腐蚀铁的效果做蚀刻的
 ubenc1年前2
ubenc1年前2 -
 明子医生 共回答了21个问题
明子医生 共回答了21个问题 |采纳率90.5%当然是硝酸效果好
但是硝酸会产生有毒的NO等气体
所以建议用盐酸,虽然会慢一些1年前查看全部
- 关于在玻璃上“蚀刻”为什么用HF?
关于在玻璃上“蚀刻”为什么用HF?
为什么不用“氢氧化钠”呢?二氧化硅和氢氧化钠反应生成硅酸钠和水. 渤海之韵1年前1
渤海之韵1年前1 -
 幽幽蓝海 共回答了17个问题
幽幽蓝海 共回答了17个问题 |采纳率82.4%二氧化硅和氢氧化钠反应生成硅酸钠和水,硅酸钠的溶液俗称为“水玻璃”,顾名思意,是像水一样有流动性的脆“玻璃”,它有黏稠性.因此用氢氧化钠“蚀刻”的话,
1)水玻璃”很难去干净,影响蚀刻效果.
2)且这个反应速度较慢,时间一长,水玻璃容易干结,最后形成凹凸不平的坑,达不到预期效果.1年前查看全部
- 银是电和热的良导体却不透光,金刚石不是电和热的良导体却透光。科学家们预言,不久的将来,人们可使蚀刻在半导体上的线条的宽度
银是电和热的良导体却不透光,金刚石不是电和热的良导体却透光。科学家们预言,不久的将来,人们可使蚀刻在半导体上的线条的宽度小到十分之一微米以下。研究上述现象所根据的最佳原理是( )
A.经典物理学理论 B.相对论 C.量子理论 D.生物进化论
 yunhai_mail1年前1
yunhai_mail1年前1 -
 风中的百合_lily 共回答了19个问题
风中的百合_lily 共回答了19个问题 |采纳率94.7%C
经典物理学理论所研究的是具有相当直观性,全都看得见、摸得着的物体,排除A项;相对论描绘的是一个崭新的宏观宇宙世界,排除B项;生物进化论是用来解释生物在世代之间具有变异现象的一套理论,排除D项。半导体是随着量子理论的创立而带来的划时代的技术创新之一,它描绘的是微观粒子世界,只有C项符合题意。1年前查看全部
- 用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺,现对某印刷电路生产厂家蚀刻绝缘板后所得的混合溶液(标记为
用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺,现对某印刷电路生产厂家蚀刻绝缘板后所得的混合溶液(标记为A)进行如下分析:
①取50.0mL A溶液加入足量的硝酸银溶液,析出沉淀86.1g
②取50.0mL A溶液试探性地加入1.12g铁粉,结果全部溶解未见固体析出
③向实验②所得溶液中加入50mL稀硝酸,产生1.12L NO(标准状况),反应后所得溶液的pH为1.
结合上述信息计算:
(1)所得沉淀的物质的量______mol;
(2)该厂所使用的FeCl3溶液的物质的量浓度______mol/L;
(3)A溶液中Cu2+的物质的量浓度. 毛毛虫VS蒲公英1年前1
毛毛虫VS蒲公英1年前1 -
 coffee1234 共回答了14个问题
coffee1234 共回答了14个问题 |采纳率85.7%解题思路:(1)所得沉淀为氯化银,依据n=mM计算物质的量;(2)取50.0mL A溶液试探性地加入1.12g铁粉,结果全部溶解未见固体析出,说明铁和氯化铁反应生成氯化亚铁,溶液中为氯化亚铁和氯化铜溶液;(3)向实验②所得溶液中加入50mL稀硝酸,产生1.12L NO(标准状况),是硝酸氧化亚铁离子的反应,反应后所得溶液的pH为1,说明硝酸剩余无Fe2+.取50.0mL A溶液加入足量的硝酸银溶液,析出沉淀86.1g为氯化银沉淀,物质的量=[86.1g/143.5g/mol]=0.6mol;
取50.0mL A溶液试探性地加入1.12g铁粉物质的量为0.02mol,发生反应为2Fe3++Fe=3Fe2+,溶解Fe3+物质的量0.04mol,生成Fe2+物质的量为0.06mol;
向实验②所得溶液中加入50mL稀硝酸,产生1.12L NO(标准状况)物质的量为0.05mol,反应后所得溶液的pH为1,说明硝酸剩余溶液中已无Fe2+;发生的反应为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,溶解的Fe2+物质的量为0.15mol,则原溶液中Fe2+物质的量为0.15mol-0.06mol-=0.09mol;2Fe3++Cu=2Fe2++Cu2+,消耗铁离子物质的量为0.09mol,生成Cu2+物质的量为0.045mol;
(1)由上述分析可知沉淀86.1g为氯化银沉淀,物质的量=[86.1g/143.5g/mol]=0.6mol,故答案为:0.6mol;
(2)由氯离子守恒,原溶液中Fe3+中氯离子物质的量0.6mol,Fe3+物质的量为 0.2mol,所以原溶液中氯化铁浓度=[0.2mol/0.05mol]=4mol/L,故答案为:4 mol/L;
(3)原溶液中Cu2+物质的量浓度=[0.045mol/0.05L]=0.9mol/l,故答案为:0.9mol/L.点评:
本题考点: 铁盐和亚铁盐的相互转变;化学方程式的有关计算.
考点点评: 本题考查了铁及其化合物性质的计算应用,主要是氯离子守恒计算,氧化还原反应的离子方程式的计算,题目难度中等.1年前查看全部
- 酸性蚀刻与碱性蚀刻哪个更加稳定
 遇见断桥1年前2
遇见断桥1年前2 -
 jingji717 共回答了12个问题
jingji717 共回答了12个问题 |采纳率91.7%酸性刻蚀稳定1年前查看全部
大家在问
- 1mr .black eyesight is too bad,but he doen't like wearing gla
- 2二次函数Y=X的平方+2X+4的最小值为?
- 3Fe3+和S2-生成什么?Fe2S3?Fe & S Fe(OH)3 & H2S 说明反应原理和条件.
- 4用几句英文简单介绍阿姆斯特朗(美国宇航员)..
- 5工业合成氨与制备硝酸一般可连续生产,流程如下:
- 6情景交际:A:Ex 情景交际: A:Excuse me,1.______________________?I haven
- 7英语翻译不要拿那种在线翻译的来糊弄人.I'm trying to change to make best For you
- 8当羟基与羰基并存时,以醛,酮为母体
- 9先从山顶往下打一口竖井,再分别向两头开凿仿写
- 10汉译英 那些手表
- 11“言者无罪,闻者足戒”的意思
- 12证明:若f(x)为奇函数且在点0处连续,则f(0)=0
- 13甲乙丙丁4个数,甲数等于其他3个数的和,甲、丙、丁的和是乙数的3倍,甲、乙、丁的和是丙的4倍,已知丁
- 14我对概率的计算,帮帮忙看看哪里出错
- 15Mrs.Smith missed the last bus,so she decided to walk