溴酸钾在酸性条件下与碘片的反应
 一榔头丢翻2022-10-04 11:39:543条回答
一榔头丢翻2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 薄荷ii真一 共回答了14个问题
薄荷ii真一 共回答了14个问题 |采纳率92.9%- 2HBrO3+I2=2HIO3+Br2
这个反应也是置换反应,但是体现的是溴酸氧化性大于碘酸,并不是体现单质之间的氧化置换,这要和Br2+2KI=2KBr+I2区分记忆.酸性条件为了增加氧化性. - 1年前
 hxz57 共回答了17个问题
hxz57 共回答了17个问题 |采纳率82.4%- 反应生成碘化钾
- 1年前
 甲酉 共回答了11个问题
甲酉 共回答了11个问题 |采纳率- 根据元素周期律,同一主族元素从上到下,元素的还原性逐渐争强,碘可以还原出溴离子,生成碘化钾。反应能发生的几个条件,生成水,沉淀,气体,发生氧化还原
- 1年前
相关推荐
- (2008•威信县)近年,卫生部发出通知:从2005年7月1日起禁止在面粉中加溴酸钾,因溴酸钾(KBrO3)会导致人的中
(2008•威信县)近年,卫生部发出通知:从2005年7月1日起禁止在面粉中加溴酸钾,因溴酸钾(KBrO3)会导致人的中枢神经紊乱,引发癌变.KBrO3中Br元素的化合价为( )
A.+1
B.+3
C.+5
D.-1 jie6411478541年前1
jie6411478541年前1 -
 翠绿小元宝 共回答了20个问题
翠绿小元宝 共回答了20个问题 |采纳率95%解题思路:在化合物中元素的化合价的代数和为零.由于钾、氧的化合价分别为+1和-2,根据上述原则可以计算出溴酸钾中溴的化合价.设溴酸钾中溴的化合价为x.
(+1)+x+(-2)×3=0
解得x=+5
故选:C.点评:
本题考点: 有关元素化合价的计算;常见元素与常见原子团的化合价.
考点点评: 本题主要考查化合物中某元素的化合价的计算,难度较小.1年前查看全部
- 酸性条件下,碘化钾和溴酸钾反应,二者的比例不同,方程式不同,当二者比例是5比3时,反应方程式怎么写啊 BrO3-+6I-
酸性条件下,碘化钾和溴酸钾反应,二者的比例不同,方程式不同,当二者比例是5比3时,反应方程式怎么写啊 BrO3-+6I-+6H+=3I2+3H2O
2BrO3-+10I-+12H+=5I2+6H2O+Br2
6BrO3-+6I-+6H+=5IO3-+3Br2+3H2O
看到有的资料上有这三个方程式,它们是怎么写出的? 紫絮如烟1年前1
紫絮如烟1年前1 -
 网站优化排名 共回答了23个问题
网站优化排名 共回答了23个问题 |采纳率87%1、I(-)充足时:BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
2、BrO3(-)稍过量时:
(1) BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
(2) BrO3(-) + 5Br(-) + 6H(+) = Br2 + 3H2O
(1)+(2)(不能简单相加) 2BrO3-+10I-+12H+=5I2+6H2O+Br2
3、BrO3(-)过量很多时:
(1) BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
(2) BrO3(-) + 5Br(-) + 6H(+) = Br2 + 3H2O
(3) 2BrO3(-) + I2 = 2IO3(-) + Br2
(1)+(2)+(3)(不能简单相加)
6BrO3-+6I-+6H+=5IO3-+3Br2+3H2O
还原性:I(-) > Br(-) > I2
所以反应时如果有I(-)肯定首先氧化I(-),无I(-)时,再氧化Br(-),如果Br(-)也被氧化完了,那就再氧化I2(如果氧化剂过量的话).
5:3比例,自己按思路就可以得出答案.1年前查看全部
- 酸性条件下,碘化钾和溴酸钾反应,二者的比例不同,方程式不同,当二者比例是5比3时,反应方程式怎么写啊
酸性条件下,碘化钾和溴酸钾反应,二者的比例不同,方程式不同,当二者比例是5比3时,反应方程式怎么写啊
BrO3-+6I-+6H+=3I2+3H2O
2BrO3-+10I-+12H+=5I2+6H2O+Br2
6BrO3-+6I-+6H+=5IO3-+3Br2+3H2O
看到有的资料上有这三个方程式,它们是怎么写出的? 小俗人1年前1
小俗人1年前1 -
 wldwzj 共回答了21个问题
wldwzj 共回答了21个问题 |采纳率100%1、I(-)充足时:BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
2、BrO3(-)稍过量时:
(1) BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
(2) BrO3(-) + 5Br(-) + 6H(+) = Br2 + 3H2O
(1)+(2)(不能简单相加) 2BrO3-+10I-+12H+=5I2+6H2O+Br2
3、BrO3(-)过量很多时:
(1) BrO3(-) + 6I(-) + 6H(+) = 3I2 + 3H2O + Br(-)
(2) BrO3(-) + 5Br(-) + 6H(+) = Br2 + 3H2O
(3) 2BrO3(-) + I2 = 2IO3(-) + Br2
(1)+(2)+(3)(不能简单相加)
6BrO3-+6I-+6H+=5IO3-+3Br2+3H2O
还原性:I(-) > Br(-) > I2
所以反应时如果有I(-)肯定首先氧化I(-),无I(-)时,再氧化Br(-),如果Br(-)也被氧化完了,那就再氧化I2(如果氧化剂过量的话).
5:3比例,自己按思路就可以得出答案.1年前查看全部
- 溴酸钾溴化钾溶液的配制要配制0.008mol/L的溴化钾溴酸钾标准溶液,应该怎么配呢,
 坨坨花1年前1
坨坨花1年前1 -
 碎了016 共回答了14个问题
碎了016 共回答了14个问题 |采纳率85.7%0.008mol/L的,先配制0.080mol/L的溴酸钾标准溶液再配制成0.008mol/L溴酸钾-溴化钾标准溶液.
溴酸钾标准储备溶液:c(1/6KBrO3)=0.0800 mol/L.准确称取1.1134 g 溴化钾(优级纯,经180℃烘2h)溶于蒸馏水,移入500ml容量瓶中,用蒸馏水稀释至标线.
溴酸钾-溴化钾标准溶液:c(1/6KBrO5)= 0.0080 mol/L,吸取10.00ml溴酸钾标准储备溶液于100ml容量瓶中,加人0.8000g溴化钾(KBr),用水稀释至标线.1年前查看全部
- 用溴酸钾作基准物标定硫代硫酸钠溶液时,为什么要加入过量的碘化钾溶液
 志毅侠1年前1
志毅侠1年前1 -
 我很垃圾 共回答了14个问题
我很垃圾 共回答了14个问题 |采纳率85.7%硫代硫酸钠不是和溴酸钾反应,而是和碘反应;这个是间接碘量法,用淀粉指示剂.
第一步:溴酸钾和过量的碘化钾反应生成碘.
BrO3- + 6I- + 6H+ == Br- + 3I2 + 3H2O
第二部:再用未知浓度的硫代硫酸钠滴定生成的碘液.
I2+2S2O32-=S4O62-+2I-
计算:先由溴酸钾的量算出生成的碘,再用碘算得硫代硫酸钠的浓度.1年前查看全部
- 简述使用电子天平称量溴酸钾的过程.
 9yy6311年前1
9yy6311年前1 -
 smunicom 共回答了13个问题
smunicom 共回答了13个问题 |采纳率76.9%电子分析天平需要先进行调平,然后用标准砝码校准后使用.称量十分方便快捷,易操作.石家庄电子天平有卖的,在元氏县城嘉惠街.上煤质、铸造分析化验室免费培训化验员.欢迎来电订购,竭诚服务!
百度搜索永芳仪器化玻浏览网站1年前查看全部
- 1、溴酸钾滴定异烟肼时,滴定速度过快有何影响?滴定速度过快有何影响?
 jijiyeye1年前1
jijiyeye1年前1 -
 文章主题 共回答了15个问题
文章主题 共回答了15个问题 |采纳率80%指示剂褪色是不可逆的,滴定过程要充分震摇,过快易造成局部浓度过大提前变色.1年前查看全部
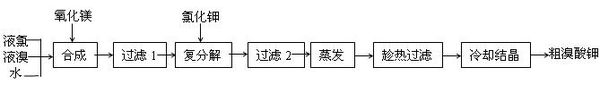
- 溴酸钾(KBrO3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃分解为溴化钾和氧气.用氯气生产溴酸钾的工艺流
溴酸钾(kbro3)为白色晶体,是一种常用的氧化剂和分析试剂,加热到370℃分解为溴化钾和氧气.用氯气生产溴酸钾的工艺流程如下:
(1)“合成”过程所发生的反应中,氧化剂是___________,还原剂是___________.反应的化学方程式为______________________________________________________.
(2)“复分解”过程中反应的化学方程式为__________________________________________.
(3)上述流程中第二次过滤的滤渣主要成分是________________.
(4)“趁热过滤”过程中“趁热”的原因是_________________________________________.
(5)溴酸钾具有毒性,食用少量即可引起呕吐和肾脏的损伤.然而美、日等国都允许在油炸薯片中添加一定量溴酸钾,以改善薯片的口感.***也曾允许用作烘焙面包的添加剂,但已于2005年7月开始全面禁止在食品中使用溴酸钾.2007年,一批来自美国的油炸薯片在珠海口岸被***有关部门检出含有溴酸钾而***止入境.从化学原理分析推测,有关***认为在油炸薯片中添加溴酸钾是“安全”的理由是(用化学方程式表示)______________________________________________,而***认为不安全的理由是____________________________________________________.
求答案及分析
.
 wh36846721年前1
wh36846721年前1 -
 lamzh1212 共回答了20个问题
lamzh1212 共回答了20个问题 |采纳率85%(1)Cl2 Br2 6MgO+Br2+5Cl2 == Mg(BrO3)2+5MgCl2
(2)Mg(BrO3)2+2KCl == MgCl2+2KBrO3
(3)MgCl2
(4)防止溴酸钾结晶析出
(5)2KBrO3 2KBr + 3O2↑
油炸和烘焙的温度条件不能保证溴酸钾完全分解1年前查看全部
- 溴酸钾和As2O3在水溶液中反应生成溴化钾和H3AsO4 已知1g As2O3和As2O5的混合物可以和21ml的0.1
溴酸钾和As2O3在水溶液中反应生成溴化钾和H3AsO4 已知1g As2O3和As2O5的混合物可以和21ml的0.1M KBrO3反应,问As2O3和As2O5的比例
 凉热石头1年前1
凉热石头1年前1 -
 旮旯一小仙 共回答了16个问题
旮旯一小仙 共回答了16个问题 |采纳率93.8%配平后的式子为
9 H2O1 + 2 KBrO3 + 3As2O3=2 KBr+ 6 H3AsO4
经过计算可知道反应的As2O3质量为0.70875(0.1M KBrO3中的0.1M应该是0.1M/L吧,你可以自己算下,应该是这样的)那么最终结果
比例为7:3;(你再检验一下,看看对不)1年前查看全部
- (2008•龙岩)溴酸钾会导致人的中枢神经紊乱、诱发癌变,卫生部明令禁止向面粉中添加溴酸钾.溴酸钾(KBrO3)中溴元素
(2008•龙岩)溴酸钾会导致人的中枢神经紊乱、诱发癌变,卫生部明令禁止向面粉中添加溴酸钾.溴酸钾(KBrO3)中溴元素(Br)的化合价为( )
A.-l
B.+1
C.+3
D.+5 无沔小子1年前1
无沔小子1年前1 -
 敏儿83 共回答了23个问题
敏儿83 共回答了23个问题 |采纳率87%解题思路:根据在化合物中正负化合价代数和为零,结合溴酸钾(KBrO3)的化学式进行解答本题.钾元素显+1价,氧元素显-2价,设溴元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.1年前查看全部
- 氯气能与溴酸钾发生化学反应吗
 jx26881年前1
jx26881年前1 -
 咦仪 共回答了18个问题
咦仪 共回答了18个问题 |采纳率88.9%不能
如果能反应只能生成高溴酸钾,但它是卤素中氧化性最强的,不可能生成1年前查看全部
- 溴酸钾与过量碘化钾在酸性溶液中离子反应方程式
 xiaohu_ds1年前2
xiaohu_ds1年前2 -
 无敌忍者2 共回答了23个问题
无敌忍者2 共回答了23个问题 |采纳率87%BRO3-+I-=BR-+IO3-1年前查看全部
- 氯气和硝酸银,氯气和溴酸钾可以反应吗,化学方程式怎么写
 cdx2571年前2
cdx2571年前2 -
 小猪之呼呼 共回答了17个问题
小猪之呼呼 共回答了17个问题 |采纳率94.1%是Cl2先和H2O反应生成HClO和HCl,然后产物再和AgNO3反应.
Cl2+AgNO3+H2O=HNO3+AgCl↓+HClO
2KBrO3+Cl2=Br2+2KClO31年前查看全部
- 向溴酸钾中滴加少量的溴化钾的硫酸溶液后,所得产物除水后还有什么?
 74875221年前1
74875221年前1 -
 zouzhi0312 共回答了11个问题
zouzhi0312 共回答了11个问题 |采纳率90.9%BrO3- + 5Br- + 6H+ == 3Br2 + 3H2O
K+和SO4 2-结合生成K2SO4
因为溴化钾少量,所以所得产物除水后还有溴酸钾和溴单质和硫酸钾.1年前查看全部
- 过氧化氢与溴酸钾哪个氧化性强
 肥仔COCO1年前3
肥仔COCO1年前3 -
 晕再晕 共回答了17个问题
晕再晕 共回答了17个问题 |采纳率88.2%BrO3- +6H++6e=Br- +3H2O E0=1.44
H2O2+2e=2OH E0=0.88
可见前者的标准电极电位高于后者,所以溴酸钾的氧化性强.1年前查看全部
- 溴酸钾和氯气生成溴和氯酸钾能否说明溴酸钾的氧化性大于氯酸钾 2KBrO3+Cl2=Br2+2KClO3
 lzwhf1年前1
lzwhf1年前1 -
 全靠手动 共回答了17个问题
全靠手动 共回答了17个问题 |采纳率64.7%可以.
氧化剂:KBrO3
氧化产物:KClO3
根据氧化性:氧化剂>氧化产物知,氧化性:KBrO3>KClO31年前查看全部
- 滴定硼氢化钾含量时,行标里用的方法是加入过量碘酸钾,再用硫代硫酸钠滴定.碘酸钾能否用溴酸钾代替
 原始毛毛虫1年前1
原始毛毛虫1年前1 -
 人间战神 共回答了21个问题
人间战神 共回答了21个问题 |采纳率100%不能.
这一过程实际上是碘量法.关键的步骤是硫代硫酸钠与碘反应.
改用溴酸钾后,产生Br2,没有碘生成.测量产生的Br2的浓度困难.
并且由于Br2的氧化性较强,Br-的还原性比I-弱.反应效果不好.不利于滴定反应.1年前查看全部
- 间接碘量法测定苯酚含量实验中,配制溴酸钾-溴化钾标准溶液,称取溴化钾是否应过量,为什么?
 韻韻_o1年前1
韻韻_o1年前1 -
 julycom 共回答了16个问题
julycom 共回答了16个问题 |采纳率100%应该溴化钾过量.不然苯酚溴代之后产生HBr,又生成Br2.1年前查看全部
- 溴化钾和溴酸钾在酸性溶液中发生归中反应,溴元素全部变为溴单质的反应方程式是什么?
 zzfrent1年前2
zzfrent1年前2 -
 a310054903 共回答了22个问题
a310054903 共回答了22个问题 |采纳率90.9%5KBr+KBrO3+3H2SO4===3Br2+3H2O+3K2SO41年前查看全部
- 溴酸钾和溴化钾在硫酸中反应
 65343171年前1
65343171年前1 -
 22446745 共回答了19个问题
22446745 共回答了19个问题 |采纳率94.7%KBrO3+5KBr+3H2SO4=3Br2+3H2O+3K2SO41年前查看全部
- 溴酸钾和溴化钾在酸性溶液中反应,溴元素完全转化成单质溴,试写出反应的离子方程试_____________________
溴酸钾和溴化钾在酸性溶液中反应,溴元素完全转化成单质溴,试写出反应的离子方程试__________________________________________该反应中的___________mol溴酸钾中含有mg溴元素,它能________(氧化,还原)____mol的_______
 但愿海波平1年前1
但愿海波平1年前1 -
 物权王子 共回答了17个问题
物权王子 共回答了17个问题 |采纳率88.2%BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O;1mol;80000 mg;氧化;5mol;溴化钾1年前查看全部
- 稀盐酸HCl与食品添加剂的反应最好是现象明显的反应,给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好如有特别
稀盐酸HCl与食品添加剂的反应
最好是现象明显的反应,
给一些双乙二酸、过氧化钙、溴酸钾或硫(及其化合物)的验证也好
如有特别好的答案, kingkill1年前1
kingkill1年前1 -
 丁香花开了 共回答了24个问题
丁香花开了 共回答了24个问题 |采纳率91.7%盐酸与亚硝酸钠反应,生成黄绿色气体(氯气).1年前查看全部
- (2008•广东)食品添加剂溴酸钾(KBrO3)会致癌,已被禁用,其中溴元素(Br)的化合价为( )
(2008•广东)食品添加剂溴酸钾(KBrO3)会致癌,已被禁用,其中溴元素(Br)的化合价为( )
A.+1
B.+3
C.+5
D.无法确定 清风中的翠竹1年前1
清风中的翠竹1年前1 -
 心如潮 共回答了19个问题
心如潮 共回答了19个问题 |采纳率78.9%解题思路:根据在化合物中正负化合价代数和为零进行解答本题.根据在化合物中正负化合价代数和为零,可得溴酸钾(KBrO3)中溴元素的化合价为:
(+1)+x+(-2)×3=0,
则x=+5;
故选C.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的能力.1年前查看全部
- 化学问题~1.溴酸钾能将碘化钾氧化成 碘(I2) 和碘酸钾,其本身被还原为溴(Br2) 2.溴(Br2)能将碘离子氧化为
化学问题~
1.溴酸钾能将碘化钾氧化成 碘(I2) 和碘酸钾,其本身被还原为溴(Br2)
2.溴(Br2)能将碘离子氧化为碘(I)
3.碘酸钾能将碘离子氧化为碘(I),也能将碘溴子氧化为溴(Br2),其本身被还原为 碘(I2).
现向含有1mol KI 的硫酸溶液中加入含a mol 溴酸钾的溶液,a的取值不同,所得产物也不同.
1/5 眯眯85501年前2
眯眯85501年前2 -
 辉仔1 共回答了27个问题
辉仔1 共回答了27个问题 |采纳率85.2%根据I2和碘酸根物质的量相等,可以设:I2有xmol 碘酸根离子有xmol Br2有ymol
开始碘离子是1mol,碘守恒:2x+x=1
开始溴酸钾种含溴为amol,溴守恒:2y=a
反应中碘离子变成xmolI2,失去2xmol电子,碘离子变成xmol碘酸根离子失去6xmol电子,溴酸根变成ymolBr2,得到10ymol电子
所以 2x+6x=10y
解得a=8/15mol1年前查看全部
大家在问
- 1类似这样的句子:人生就像一杯茶,不会苦一辈子,但总会苦一阵子 。 人生开头的+后
- 2介绍株洲的英语作文介绍株洲就可以了.初中写作水平就可以了.
- 3用适当的形式填空 science health begin invent excite
- 4六年级列方程解应用题及答案90道快!
- 5说明文的常考点,比如语言特点:大约,肯定之内词的解释
- 6is considered to be ________ the other students in her class
- 7有关大气压强在瓶子里装满水,用瓶子把瓶口塞住,然后把瓶子倒立在水中,拔掉瓶塞,这是水会不会从瓶中流出来?请做出解释.
- 8微观经济学的题目预算线:PxX+PyY=I I和Py不变,如果由横轴商品X的价格Px变化所引致的价格消费曲线与横轴平行,
- 9.解放军进行排队表演,组成一个外层有48人,内层有16人的多层中空方阵,这个方阵有几层,一共有几人.
- 10做脆浆时为什么要放油
- 11英语翻译你的梦想就是我的梦想.为了你的梦想去努力吧.我会在这边永远支持你.这段话能用英文帮我翻译出来吗 我在泡妹妹那~哈
- 12把12个棱长都是1厘米的正方体拼成一个长方体,有几种不同的拼法?表面积最大的长方体的长方体(看下面补充
- 13the numbers of和a number of的区别
- 14填诗句,马上漫游祖国各地,面对名山大地,人们自然会产生无限的感慨:站在黄河边上,我们会想起:"( ),( )";站在高山
- 15那个算半衰期的公式是如何推导出的,
