配位化合物H[PtCl3(NH3)]的中心离子是?配位原子是?配位数是?它的系统命名的名称是?四氯合铂(Ⅱ)酸四氨合铂(
 湘中莲2022-10-04 11:39:543条回答
湘中莲2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 ffffffsdaa 共回答了19个问题
ffffffsdaa 共回答了19个问题 |采纳率89.5%- 中心离子 :Pt
配位院子 :Cl N
配位数 :4
系统命名 :三氯-氨合铂(Ⅱ) 酸
四氯合铂(Ⅱ)酸 :H2[PtCl4]
四氨合铂(Ⅱ) :[ Pt(NH3)4 ]2+ ( 2+ 表示正二价 ) - 1年前
 七夜NOI 共回答了1个问题
七夜NOI 共回答了1个问题 |采纳率- 中心离子是铂 配位原子时氯和氮,配位数是4
- 1年前
 炫日宇宙 共回答了1个问题
炫日宇宙 共回答了1个问题 |采纳率- s sha a
- 1年前
相关推荐
- 配位化合物的命名方法
 tony07031年前1
tony07031年前1 -
 吴曦 共回答了21个问题
吴曦 共回答了21个问题 |采纳率95.2%配位化合物命名方法①命名配离子时,配位体的名称放在前,中心原子名称放在后.②配位体和中心原子的名称之间用“合”字相连[1].③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态 ④配...1年前查看全部
- 解释二价金属离子生成正八面体构型弱场配位化合物的稳定性顺序规律
解释二价金属离子生成正八面体构型弱场配位化合物的稳定性顺序规律
麻烦帮我解释下这个顺序的
Mn2+ uselessguy1年前1
uselessguy1年前1 -
 口袋里的hh 共回答了17个问题
口袋里的hh 共回答了17个问题 |采纳率100%这是金属配位化合物中的 Irving-Williams 系列.说实话,现存教科书上对此也没有一个明确地解释.但是,如果学了配位场理论或晶体场理论,你可以从各离子的离子半径的规律,以及价电子层的能级大小出发 (假定弱场配体的配位轨道能量固定).然后考虑配位场中轨道间的相互作用的大小.
这里时wikipedia的一段,供参考:
There are three strands to the explanation of the series.
1.The ionic radius is expected to decrease regularly for Mn2+ to Zn2+.This would be the normal periodic trend and would account for the general increase in stability.
2.The crystal field stabilisation energy (CFSE) increases from zero for manganese(II) to a maximum at nickel(II).This makes the complexes increasingly stable.CFSE for zinc(II) is zero.
3.Although the CFSE for copper(II) is less than for nickel(II),octahedral copper(II) complexes are subject to the Jahn-Teller effect which results in a complex having extra stability.
The actual CFSE values are 0.4Δ for iron,0.8Δ for cobalt and 1.2Δ for nickel.Δ is the crystal field splitting energy.When the stability constants are quantitatively adjusted for these values they follow exactly the trend that is predicted,in the absence of crystal field effects,between manganese and zinc.This was an important factor contributing to the acceptance of crystal field theory,the first theory to successfully account for the thermodynamic,spectroscopic and magnetic properties of complexes of the transition metal ions and precursor to ligand field theory.1年前查看全部
- 中心原子为Ag或中心离子为Ag+的配位化合物有哪些?
 mkgg1年前1
mkgg1年前1 -
 信电 共回答了16个问题
信电 共回答了16个问题 |采纳率93.8%[Ag(NH3)2](+)
[Ag(CN)2](-)
[Ag(X)2](-) X = Cl, Br, I
[Ag(S2O3)2](3-)
[Ag(SCN)2](-)
[Ag(NCO)2](-)
……1年前查看全部
- 为什么会形成配位化合物?就是说形成体和配位体为什么会形成配离子?不能共存吗?
 因内反qq生1年前1
因内反qq生1年前1 -
 保10劫 共回答了16个问题
保10劫 共回答了16个问题 |采纳率93.8%因为在配合物中,中心离子提供空电子轨道,配体提供孤对电子来占据空电子轨道,于是配合物就形成了,因为配合物一般都是相对很稳定的化合物,所以配体和中心原子或离子不能共存1年前查看全部
- 配位化合物【Co(NH3)5Cl]Cl2的配位原子是什么?
 liaoshuang0207111年前1
liaoshuang0207111年前1 -
 葱头五号 共回答了9个问题
葱头五号 共回答了9个问题 |采纳率88.9%N、Cl
配位原子,就是配体中与中心原子直接相连的原子.即N和Cl1年前查看全部
- 分子式为Pt(NH 3 ) 2 Cl 2 的配位化合物有顺铂和反铀两种同分异构体,顺铂的结构式为 具有抗癌作用;反铂的结
分子式为Pt(NH 3 ) 2 Cl 2 的配位化合物有顺铂和反铀两种同分异构体,顺铂的结构式为 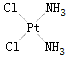
具有抗癌作用;反铂的结构式为  无抗癌作用
无抗癌作用
(1)C、N、O二种元素的电负性由大到小的顺序是_______________;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式_______________
(2)顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:________________。
(3)金属铂的原子堆积方式为面心立方最密堆积,一个金属铂的晶胞中含有_________个铂原子
(4)NH 3 还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物X是NH 3 与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物X会缓慢释放H 2 ,并转变为化合物Y,Y是乙烯的等电子体①化合物X的结构式为______________。(必须标明配位键)②化合物X、Y分子中,N元素分别发生了____________ 杂化。 OpenGL_VC1年前1
OpenGL_VC1年前1 -
 soso2006 共回答了10个问题
soso2006 共回答了10个问题 |采纳率100%1年前查看全部
- 怎么看一个配位化合物是抗磁性物质还是吸磁性物质?
 挥霍生命1年前1
挥霍生命1年前1 -
 littlepie 共回答了12个问题
littlepie 共回答了12个问题 |采纳率75%当然是看中心离子有没有未成对的电子了,这是从结构上分析;
如果实验可以用磁天平就进行检测.1年前查看全部
- 关于配位化合物的问题像六氯合铂酸这种配合物他的内外界之间是离子键还是共价键啊?氢显示正一价的时候有离子键么?难道配合物的
关于配位化合物的问题
像六氯合铂酸这种配合物他的内外界之间是离子键还是共价键啊?
氢显示正一价的时候有离子键么?难道配合物的内外界都是离子键? 楚妖mm1年前2
楚妖mm1年前2 -
 ezvovo 共回答了23个问题
ezvovo 共回答了23个问题 |采纳率95.7%内外界之间是离子键,内界是配位键
对于六氯合铂酸,其实是六水合六氯合铂(IV)酸,它的化学式是H2PtCl6·(H2O)6.
在水溶液中以离子形式存在,也就是(H3O)2 [PtCl6]·4H2O,所以内外界之间是离子键,内界是配位键.1年前查看全部
- 据最新报道,科学家发现了如下反应;O2+PtF6═O2[PtF6],已知O2[PtF6]为配位化合物(其中Pt为+5价,
据最新报道,科学家发现了如下反应;O2+PtF6═O2[PtF6],已知O2[PtF6]为配位化合物(其中Pt为+5价,O显正价,且是科学家最新发现的显正价的氧元素),对此反应,下列说法正确的是( )
A.该配合物的配位原子是F和O,配位数为8
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2[PtF6]中Pt与F之间以离子键相结合
D.反应中每生成1mol O2(PtF6),转移1mol电子 5276905511年前1
5276905511年前1 -
 buti 共回答了19个问题
buti 共回答了19个问题 |采纳率94.7%解题思路:O2[PtF6]为配位化合物,其中Pt为+5价,O显正价,则配位原子为F,配位数为6,反应中O元素的化合价升高,Pt元素的化合价降低,以此来解答.A.该配合物的配位原子是F,配位数为6,故A错误;
B.该反应中,O2生成(O2)+,所以氧气作还原剂,PtF6是氧化剂,故B错误;
C.O2(PtF6)中Pt与F之间以配位共价键结合,故C错误;
D.O2+PtF6=O2(PtF6)中Pt由+6价变为+5价,而O2生成(O2)+,由0价升高到+1价,都是转移1mol电子,所以每生成1mol O2(PtF6)则转移1mol电子,故D正确.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握配位化合物的形成及反应中元素的化合价变化为解答的关键,配位键为解答的难点,题目难度中等.1年前查看全部
- 有色配位化合物的摩尔吸光系数与下列因素有关的是
有色配位化合物的摩尔吸光系数与下列因素有关的是
A 配位化合物浓度 B 配位化合物稳定性 C 入射光波长 暖冬3691年前2
暖冬3691年前2 -
 huahuazhang 共回答了26个问题
huahuazhang 共回答了26个问题 |采纳率84.6%C 入射光波长1年前查看全部
- 求化学帝解释.配位化合物到底有没有化合价?还有氨合电子 ..多的一个电子不是很容易失去吗,怎么结合上去的...
 cumtowen1年前1
cumtowen1年前1 -
 MZaden 共回答了19个问题
MZaden 共回答了19个问题 |采纳率78.9%配位化合物要具体看,有的有,有的没有,还有的不完全配位的.
建议你再看看MO理论吧,就是分子轨道理论,里面解释的很清楚.
氨的一对孤电子对容易吸引亲电子体,也就是贡献这一对电子与亲电子体形成一个新键,形成一个分子轨道,这两个电子在分子轨道里运动而不会失去.1年前查看全部
- 化学配位化合物问题: [Co(CN)6]3-和[Co(NH3)6]2+属于抗磁性的是... 怎么解出来的呢.?
 百舸争先1年前1
百舸争先1年前1 -
 老二的戒指 共回答了14个问题
老二的戒指 共回答了14个问题 |采纳率85.7%cn-是强场配体,nh3是弱场配体,
(强弱源于电负性,记住即可,可以看看书),
一般来说弱场形成外轨型,强场形成内轨型,
内轨就是抗磁的呗1年前查看全部
- (2014•唐山一模)由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:
 (2014•唐山一模)由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.
(2014•唐山一模)由原子序数由小到大的A、B、C、D、E五种元素构成某配位化合物X,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+61Ns1,回答下列问题.
(1)该配位化合物X的化学式为______.
(2)元素B、C、D的第一电离能的由小到大排列顺序为______.(用元素符号表示)
(3)D元素原子的最外层电子轨道表示式为______.
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为______.
(5)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图1:其中碳原子的杂化方式有______.碳铂中含有的作用力有______(填字母).
A.共价键 B.配位键 C.金属键 D.σ键E.π键
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式______.单质E的晶胞如图2所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为p=[4MNA×a3  yaonima1年前0
yaonima1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 配位化合物Na[Al(OH)4]如何读?
配位化合物Na[Al(OH)4]如何读?
另外,还有前几天提问的一个问题至今还没有得到满意答案。丁烯和臭氧反应的产物怎么命名 xasmv1年前2
xasmv1年前2 -
 我要吃苞米 共回答了18个问题
我要吃苞米 共回答了18个问题 |采纳率94.4%四羟基合铝酸钠1年前查看全部
- 配位化合物因其特殊的结构与性质具有多方面的用途.
配位化合物因其特殊的结构与性质具有多方面的用途.
Ⅰ.已知信息:[Ag(NH3)2]OH═[Ag(NH3)2]++OH-;[Ag(NH3)2]+⇌Ag++2NH3
有两种化合物,A:CoCl3•5NH3•H2O;B:CoCl3•5NH3•H2O,根据下面的实验结果,确定它们的配离子、中心离子和配体.
(1)分别取A和B的固体于试管中微热,A中未见明显现象,B中试管口出现少量水珠.
(2)向A和B的溶液中加入AgNO3溶液后均有AgCl沉淀.
(3)沉淀过滤后,分别向滤液中加AgNO3溶液均无变化,但加热煮沸,B溶液中又有AgCl沉淀生成,其沉淀量为原来B溶液中AgCl的一半.
又已知该化合物中心离子配位数均为6,试按照“[Ag(NH3)2]OH”的书写格式写出A、B的化学式:
A______,B______.
Ⅱ.Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)Pt(NH3)2Cl2分子是______(填“平面四边形”或“四面体形”).
(2)请在以下空格内画出这两种固体分子的几何构型图:
(3)淡黄色固体物质是由______分子组成,黄绿色固体物质是由______分子组成(填“极性”或“非极性”).
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是______. 枝上柳绵飞了吗1年前1
枝上柳绵飞了吗1年前1 -
 njiaai 共回答了17个问题
njiaai 共回答了17个问题 |采纳率76.5%解题思路:Ⅰ.分别取A和B的固体于试管中微热,A中未见明显现象,B中试管口出现少量水珠,说明A中水分子在内界,做配体,而B中水分子在外界,向A和B的溶液中加入AgNO3溶液后均有AgCl沉淀,说明都有氯离子在外界,加热煮沸,B溶液中又有AgCl沉淀生成,其沉淀量为原来B溶液中AgCl的一半,说明B的内界有氯离子,其个数为外界的氯离子的一半,而A中无氯离子在内界,由于A和B中心离子的配位数均为6,可以推知,在A中有一个水分子和五个氨分子做配体,而在B中有一个氯离子个和五个氨分子做配体,据此答题;
Ⅱ.(1)根据Pt(NH3)2Cl2可以形成两种固体知:Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上;
(2)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置;
(3)根据水的极性以及题干信息两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大进行解答;
(4)由题给信息结合相似相溶原理分析.Ⅰ.分别取A和B的固体于试管中微热,A中未见明显现象,B中试管口出现少量水珠,说明A中水分子在内界,做配体,而B中水分子在外界,向A和B的溶液中加入AgNO3溶液后均有AgCl沉淀,说明都有氯离子在外界,加热煮沸,B溶液中又有AgCl沉淀生成,其沉淀量为原来B溶液中AgCl的一半,说明B的内界有氯离子,其个数为外界的氯离子的一半,而A中无氯离子在内界,由于A和B中心离子的配位数均为6,可以推知,在A中有一个水分子和五个氨分子做配体,而在B中有一个氯离子个和五个氨分子做配体,所以A的化学式可以写成:[Co(NH3)5(H2O)]Cl3,B的化学式可以写成:[Co(NH3)5Cl]Cl2・H2O;
故答案为:[Co(NH3)5(H2O)]Cl3;[Co(NH3)5Cl]Cl2・H2O;
Ⅱ.(1)Pt(NH3)2Cl2可以形成两种固体,说明Pt(NH3)2Cl2分子是平面四边形,否则只有一种固体形式,
故答案为:平面四边形;
(2)Pt(NH3)2Cl2分子是平面结构,两个Cl原子有相邻和相对两种位置,水是极性分子,一种为淡黄色,在水中的溶解度小,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,正负电荷重心重合,故淡黄色者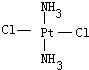 ,
,
另一种为黄绿色,在水中的溶解度较大,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是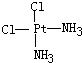 ,
,
故答案为: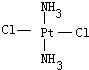 ;
; ;
;
(3)水是极性分子,一种为淡黄色,在水中的溶解度小,则为非极性分子,另一种为黄绿色,在水中的溶解度较大,则为极性分子
故答案为:非极性;极性;
(4)水是极性分子,黄绿色固体在水中溶解度比淡黄色固体大,根据相似相溶原理可知黄绿色为极性分子,淡黄色为非极性分子,
故答案为:水分子和黄绿色结构的分子都是极性分子,根据相似相溶原理可知黄绿色固体在水中的溶解度应比淡黄色固体要大.点评:
本题考点: 配合物的成键情况.
考点点评: 本题主要考查了配合物结构的推导,性质与结构关系,具有很强的综合性,属于要求较高的题目.这类题目要求考生审清题目信息,并与所学知识结合起来解答,题目难度较大.1年前查看全部
- 配位化合物中的旋光异构是怎么一回事?
配位化合物中的旋光异构是怎么一回事?
谁能告诉我旋光异构的本质是什么吗? Y士心1年前1
Y士心1年前1 -
 冰河281公里 共回答了23个问题
冰河281公里 共回答了23个问题 |采纳率91.3%由于晶体或分子的不对称,它们在空间就出现有两种排列的方式,它们之间呈现出犹如实物和镜象的关系
请参见:1年前查看全部
- 分子式为Pt(NH 3 ) 2 Cl 2 的配位化合物有顺铂和反铂两种同分异构体.顺铂的结构式为
分子式为Pt(NH 3 ) 2 Cl 2 的配位化合物有顺铂和反铂两种同分异构体.顺铂的结构式为 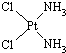
,具有抗癌作用;反铂的结构式为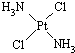
,无抗癌作用.下列说法正确的是( )A.在水中的溶解性:顺铂>反铂 B.Pt与Ni位于同一列,则Pt位于ⅤⅢB族 C.分子中Pt和N之间为离子键 D.分子中的N有一对孤对电子  liangqizhen1年前1
liangqizhen1年前1 -
 wxy81111 共回答了18个问题
wxy81111 共回答了18个问题 |采纳率88.9%A.顺铂是极性分子,反铂为非极性分子,根据形似相溶可知,顺铂更易溶于水,故A正确;
B.Pt与Ni位于同一列,位于ⅤⅢ族,不是ⅤⅢB族,故B错误;
C.分子中Pt和N之间形成配位键,故C错误;
D.NH 3 为配体,与Pt之间形成配位键,N不含孤对电子,故D错误;
故选A.1年前查看全部
- 配位化合物一定是离子化合物吗,还是有分子化合物?一定有离子键?是离子晶体?
 爱妃儿1年前2
爱妃儿1年前2 -
 黄汉 共回答了16个问题
黄汉 共回答了16个问题 |采纳率93.8%不一定,如常见的二氯*二氨合铂.是复杂的分子化合物 ,如有外界,内界和外界是离子键结合,内界是配位化合键结合,本质是共价键1年前查看全部
- 求:有关【配位化合物】的几个问题.
求:有关【配位化合物】的几个问题.
为何人们要研究配合物?配合物的研究价值是什么?配合物中还有什么是值得我们去研究的?[以上问题用于高中论文] 洁如1年前1
洁如1年前1 -
 aa天空的藕 共回答了16个问题
aa天空的藕 共回答了16个问题 |采纳率93.8%因为配位现象其实很普遍啊!比如我们总在说水溶液中有某离子,其实都是不严格的,应该是水合某离子.
配合物可以在很大程度上改变物体的物理化学性质.比如配合物离子可以随着配体的不同而颜色改变.比如离子的氧化还原能力可以随着配位反应的进行而改变.1年前查看全部
- 铜配位化合物有哪些
 小糊涂仙271年前1
小糊涂仙271年前1 -
 zxl_zxs 共回答了26个问题
zxl_zxs 共回答了26个问题 |采纳率96.2%配合物就是配位化合物.配离子,它是由一个金属阳离子和一定数目的中性分子或阴离子以配位键结合而成的复杂离子.配离子和带相反电荷的离子组成的化合物叫配合物.例如:硫酸四氨合铜、四碘化汞酸钾等.也可是由一个简单的金属离子(少数情况下为中性金属原子)与一定数目的阴离子或中性分子以配位键而成的中性配合分子,如二氯二氨合铂、四羰基合镍等.用硫酸四氨合锌为例来解释配合物的组成.二价锌离子处在中心叫中心离子,四个氨分子处在它的四周叫配位体,中心离子和配位体组成内界又叫配离子,硫酸根离子处在内界外面叫外界又叫外界离子,内界和外界组成配合物.中心离子一般提供价电子空轨道,配位体一般是提供孤对电子的分子或阴离子,紧靠在中心离子周围,以配位键和中心离子直接配合.配位体中具有孤对电子并以配位键与中心离子直接相结合的原子叫配位原子,它通常是电负性较大的元素的原子例如N、O、S、F、CL、等,另分单齿配位体,如NH3、H2O、等,还有多齿配位体,如乙二胺.外界离子所带的电荷与配离子所带有的电荷刚好相反,距中心离子较远构成配合物的外界.1年前查看全部
- 一道大学无机化学题,涉及到配位化合物和电极电势的.我想问的是第二题,为什么我在图里画横线的那两项相等?
 芸芸漫步1年前1
芸芸漫步1年前1 -
 尽收眼底 共回答了20个问题
尽收眼底 共回答了20个问题 |采纳率100%[Fe(CN)6]3- + e-=[Fe(CN)6]4- 而且[CN-]=1mol/L
1mol/L 1mol/L
它的本质:
Fe3+ + e- = Fe2+
1 /K稳定 1 /K稳定
因此E0{[Fe(CN)6]3-/[Fe(CN)6]4- }
=E(Fe3+/Fe2+)
=E0(Fe3+/Fe2+)+0.0591v*lg [Fe3+]/[Fe2+]
=E0(Fe3+/Fe2+)+0.0591v*lg [1/K稳定(FeCN)63-)]/[1/K稳定(FeCN)64-)]
=E0(Fe3+/Fe2+)+0.0591v*lg [K稳定(FeCN)64-)]/[K稳定(FeCN)63-)]
=0.771v+0.0591V *lg(10^35/10^42)
=0.357v
2[Fe(CN)6]3- +2I-=2[Fe(CN)6]4- +I2
正极:[Fe(CN)6]3- + e-=[Fe(CN)6]4-
负极:I2 +2e-=2I-
电动势=E0{[Fe(CN)6]3-/[Fe(CN)6]4- }-E0(I2/2I-)1年前查看全部
- 配位化合物硫酸四氨合铜中,铜离子和硫酸根离子所处的化学环境的差别
 yutong_ily1年前2
yutong_ily1年前2 -
 visualzhu 共回答了19个问题
visualzhu 共回答了19个问题 |采纳率89.5%前者属于复杂络离子内部中心离子,难电离出来,后者则是游离的自由离子1年前查看全部
- 配位化合物中配体和中心原子怎么结合?
配位化合物中配体和中心原子怎么结合?
书上说是以配位键结合,配位键的本质是共价键.比如说二氯化二氯·四氨合钴 即[Co(NH 3 ) 4 Cl 2 ]Cl 2 里面的那个氯为什么是氯离子?如果是氯离子的话 那为什么加硝酸银只有外面的氯离子会和银离子结合? 珍重人生1年前2
珍重人生1年前2 -
 www1122334 共回答了16个问题
www1122334 共回答了16个问题 |采纳率93.8%里面的氯不是氯离子,氯原子是配位体,提供孤对电子,与配位中心的钴原子提供的空轨道形成配位键,外面的氯以离子形式存在,只有外面的氯才能与银离子发生离子反应.1年前查看全部
- 配合物问题.十二水硫酸铝钾是不是配位化合物?怎么判断出某化合物是不是配合物?怎么样的水才是结晶水?
 yujia8991年前1
yujia8991年前1 -
 沙__子 共回答了18个问题
沙__子 共回答了18个问题 |采纳率83.3%是,带结晶水的都是.像明矾这样叫水合什么的都是,水以H2O形式存在于化合物中1年前查看全部
- 下列说法中不正确的是( )A 含有配位键的化合物一定是配位化合物B 配位键实质上是一种共价键C
下列说法中不正确的是( )
A 含有配位键的化合物一定是配位化合物
B 配位键实质上是一种共价键
C 配位键也是一种静电作用
D 配位键具有饱和性和方向性 泪有点咸1年前0
泪有点咸1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 为什么说配位化合物 中如 {cu(NH3)4}CL2 它溶于水显弱酸性
 email_011年前1
email_011年前1 -
 1991127 共回答了23个问题
1991127 共回答了23个问题 |采纳率91.3%[Cu(NH3)4]Cl2 类似于强酸弱碱组成的盐,水解显酸性.
[Cu(NH3)4] 2+ 相当于金属离子 .比如:Cu2+
[Cu(NH3)4] 2+ + 2H2O = [Cu(NH3)4] (OH)2 + 2H+1年前查看全部
- 问:碘单质和碘化钾反应生成什么?有人说是K2[I4]配位化合物,到底是什么.
 燕七0061年前3
燕七0061年前3 -
 贵丽萍 共回答了18个问题
贵丽萍 共回答了18个问题 |采纳率94.4%I2 + I- = (I3)-
不可能形成K2[I4]配位化合物,所有元素中以碱金属K,Rb,Cs的配合能力最差,而I-是很弱的配体,不能形成配合物1年前查看全部
- 氮元素可形成卤化物、氮化物、叠氮化物及配位化合物等许多化合物.
氮元素可形成卤化物、氮化物、叠氮化物及配位化合物等许多化合物.
(1)化合物NF3为______分子(填“极性”或“非极性”),若其沸点为-129℃,则其晶体类型为______.
(2)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.
①与N3-互为等电子体的分子、离子有______(各举1例).
②叠氮化物、硫氰化物都能与Fe3+、Co3+等形成配位化合物,如:Fe(SCN)3、[Co(N3)(NH3)5]SO4等,[Co(N3)(NH3)5]SO4中Co3+的配位数为______;FeCl3与KSCN按物质的量之比1:5反应生成的配位化合物的化学式是______.
③NaN3与KN3的结构类似,则NaN3的晶格能______(填“>”或“<”)KN3的晶格能. KQL_681年前1
KQL_681年前1 -
 3225798 共回答了27个问题
3225798 共回答了27个问题 |采纳率85.2%解题思路:(1)NF3中N原子的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型为三角锥型,则分子中正负电荷中心不重合,为极性分子;
根据晶体的性质判断晶体类型;
(2)①原子个数相等且价电子数相等的微粒为等电子体;
②根据构造原理写出其基态核外电子排布式,根据价层电子对互斥理论确定其杂化类型,根据配体个数确定配位数;
③结构相似的离子晶体中,晶格能与离子半径呈反比.(1)NF3中N原子的价层电子对=3+1=4,且含有一个孤电子对,所以其空间构型为三角锥型,则分子中正负电荷中心不重合,为极性分子;
其沸点为-129℃,较低,根据分子晶体的性质,判断为分子晶体;
故答案为:极性;分子晶体;
(2)①N3-中原子个数是3,价电子数是16,则与N3-互为等电子体的分子、离子有:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-,
故答案为:N2O或CO2或CS2或BeCl2;SCN-或OCN-或CNO-;
②铁是26号元素,其核外有26个电子,根据构造原理知铁的基态原子核外电子排布式为[Ar]3d64s2,CN-中C原子的价层电子对=1+1=1,所以采取sp杂化,其配位数是6;
FeCl3与KSCN按物质的量之比1:5反应生成的配位化合物Fe元素和SCN-的数目比例为1:5,故配位化合物的化学式是K2[Fe(SCN)5];
故答案为:6;K2[Fe(SCN)5];
③NaN3与KN3的结构类似,钠离子半径小于钾离子半径,所以NaN3的晶格能>KN3的晶格能,故答案为:>.点评:
本题考点: 氮族元素简介;用晶格能的大小衡量离子晶体中离子键的强弱;配合物的成键情况;“等电子原理”的应用.
考点点评: 本题考查物质结构,涉及配位数的判断、等电子体等知识点,这些都是高考热点,要注重基础知识的积累.1年前查看全部
- 8.试判断下列两组配位化合物顺磁性大小的次序:(最好有过程) (1)A.[Co(NH3)6]3+ B.[Co(NH3)6
8.试判断下列两组配位化合物顺磁性大小的次序:(最好有过程) (1)A.[Co(NH3)6]3+ B.[Co(NH3)6]2+
C.[Co(NO2)6]3- D.[Co(CN)6]4-
(2) A .[FeF6] ]3- B.[Mn(CN)6]3-
C.[Ni(H2O)] 2+ D.[Co(NH3)6] 3+ 联合普法1年前1
联合普法1年前1 -
 imlinux 共回答了20个问题
imlinux 共回答了20个问题 |采纳率70%未成对电子多,顺磁性强:
A>B>D>C
A>D>C>B1年前查看全部
- A、B是什么元素,怎么判断?该配位化合物的化学式为____________,怎么想到的?
A、B是什么元素,怎么判断?该配位化合物的化学式为____________,怎么想到的?
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl,回答下列问题. xlj57651年前1
xlj57651年前1 -
 aaaa567 共回答了20个问题
aaaa567 共回答了20个问题 |采纳率85%A H
B N
C O
D S
E Cu
[Cu(NH3)4]SO4.H2O1年前查看全部
- 【物质结构与性质】某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:
【物质结构与性质】
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素
组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的
二倍,E元素的外围电子排布为(n-1)d n+6 ns l ,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为______,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A 2 B 2 的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个σ键, 个π键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
 可口_1年前1
可口_1年前1 -
 happyhuamao 共回答了20个问题
happyhuamao 共回答了20个问题 |采纳率95%(1)N>O>S
(2)
(3)[Cu(NH 3 ) 4 ]SO 4 •H 2 O。 sp 3 杂化
(4)H 2 O与H 2 O 2 之间形成氢键
(5)H-N=N-H;3;1
(6)CuH 2CuH+3Cl 2 2CuCl 2 +2HCl
2CuCl 2 +2HCl
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1,其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)d n+6 ns l ,则n+6=10,故n=4,故其外围电子排布为3d 10 4s l ,则E为Cu;故该深蓝色晶体应含有[Cu(NH 3 ) 4 ] 2+ 、SO 4 2- ,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH 3 ) 4 ]SO 4 •H 2 O。
(1)同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S。
(2)D为S元素,其原子的最外层电子排布图为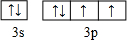 。
。
(3)由上述分析可知,该配位化合物的化学式为:[Cu(NH 3 ) 4 ]SO 4 •H 2 O,配体为NH 3 ,N原子价层电子对数=3+(5−1×3)/2=4,N原子采取sp 3 杂化。
(4)O元素可与H元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,则为H 2 O、H 2 O 2 ,两种化合物可任意比互溶,其主要原因为:H 2 O与H 2 O 2 分子之间存在氢键。
(5)H元素与N元素可形成分子式为N 2 H 2 的化合物,该化合物的分子具有平面结构,N原子之间形成N=N双键,N原子与H原子之间形成N-H键,其结构式为H-N=N-H,分子中含有3个σ键,1个π键。
(6)H元素与Cu元素可形成一种红色化合物,由晶体结构单元可知,4个H原子位于内部,6个H原子位于棱上,晶胞中H原子数目=4+6×1/3=6,3个Cu原子为内部,2个位于面心、12个位于顶点,故晶胞中Cu原子数目=3+2×1/2+12×1/6=6,故该化合物的化学式为CuH,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,应生成CuCl 2 、HCl,反应方程式为:
2CuH+3Cl 2 2CuCl 2 +2HCl。
1年前查看全部
2CuCl 2 +2HCl。
1年前查看全部
- 配位化合物怎么判断括号下面的数字啊?
配位化合物怎么判断括号下面的数字啊?
我记得老师讲过一个可以根据中心原子的化合价来判断的方法,但是我忘记了. 谁能yyyy1年前1
谁能yyyy1年前1 -
 bestliyan 共回答了19个问题
bestliyan 共回答了19个问题 |采纳率94.7%配位数 = 中心原子的化合价×2
比如 铜氨配离子,[Cu(NH3)4]2+ 就满足 配位数 4 = 铜的化合价 2 × 2
银氨配离子,[Ag(NH3)2]+ 就满足 配位数 2 = 银的化合价 1 × 2
这是经验规律,不要问为什么.1年前查看全部
- 下列属于配位化合物的是( ) A.NH 4 Cl B.Na 2 CO 3 •10H 2 O C.CuSO 4 •5H
下列属于配位化合物的是( ) A.NH 4 Cl B.Na 2 CO 3 •10H 2 O C.CuSO 4 •5H 2 O D.CO(NH 3 )6Cl 3  翱翔2191年前1
翱翔2191年前1 -
 chloe66 共回答了20个问题
chloe66 共回答了20个问题 |采纳率85%A.配合物常指含有配位键的复杂的化合物,可以理解成一个氨分子提供一对电子给一个氢离子,形成配位键,但是我们一般不说铵根是配合物,故A不选;
B.Na 2 CO 3 •10H 2 O中不含配位键,不是配合物,故B不选;
C.CuSO 4 •5H 2 O属于配合物,阳离子为[Cu(H 2 O) 4 ] 2+ ,故C选;
D.CO(NH 3 ) 6 Cl 3 属于配合物,阳离子为[CO(NH 3 ) 6 ] 3+ ,故D选.
故选CD.1年前查看全部
- 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6 ns l ,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为 ,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A 2 B 2 的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个s键, 个p键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。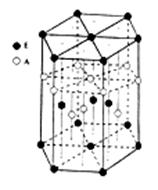
 变形金刚音乐1年前1
变形金刚音乐1年前1 -
 pcq0005 共回答了27个问题
pcq0005 共回答了27个问题 |采纳率92.6%1年前查看全部
- 离子化合物、配位化合物、有机化合物之间的相互作用力是什么?
离子化合物、配位化合物、有机化合物之间的相互作用力是什么?
它们的本质是什么,和分子相互作用力有什么联系? fengyanwen7906231年前1
fengyanwen7906231年前1 -
 761124 共回答了17个问题
761124 共回答了17个问题 |采纳率94.1%这些作用力主要有化学键类型的如离子键 共价键 金属键,还有分子间作用力.
如金属和合金是金属键
原子晶体是共价键
分子晶体是分子间作用力
离子晶体(离子化合物)是离子键1年前查看全部
- 钴配位化合物(1)在0.5 mol•L-1 CoCl2溶液中,滴加6 mol•L-1 氨水产生沉
钴配位化合物
(1)在0.5 mol•L-1 CoCl2溶液中,滴加6 mol•L-1 氨水产生沉淀
(2)再加入几滴1 mol•L-1 NH4Cl溶液和过量的6 mol•L-1 氨水至沉淀溶解
各位兄弟姐妹,我查了很多资料都没有这两步的方程式,请各位高手帮帮忙,帮忙写出这两步的反应化学方程式。
原题是这样的,这是大学无机化学实验中的
在0.5 mol•L-1 CoCl2溶液中,滴加6 mol•L-1 氨水,观察沉淀的颜色,再加入几滴1 mol•L-1 NH4Cl溶液和过量的6 mol•L-1 氨水至沉淀溶解,观察[Co(NH3)6]Cl2溶液颜色。写出各步反应的化学方程式
所以第二步是得到[Co(NH3)6]Cl2。
我就是不清楚具体的方程式。 在南京ww1年前1
在南京ww1年前1 -
 cc主 共回答了23个问题
cc主 共回答了23个问题 |采纳率91.3%CoCl2+2NH3.H2O=Co(OH)2↓+2NH4Cl
Co(OH)2 +6NH3.H2O=[Co(NH3)6](OH)2 +6H2O1年前查看全部
- 无机及分析化学实验中的配位化合物实验步骤咋写
无机及分析化学实验中的配位化合物实验步骤咋写
课本上的太长,写到实验报告之上根本写不下,谁帮我总结一下,要求简短精炼
Cu+4NH3~CU(NH3)4 hwyorzyy1年前1
hwyorzyy1年前1 -
 zjpnc 共回答了22个问题
zjpnc 共回答了22个问题 |采纳率95.5%LZ我不知道你作的是什么化合物,但是反应机理、实验步骤、现象、结果讨论是必要的1年前查看全部
- 配位化合物属于沉淀吗?如题,就像硫氰化铁一样,为什么?
 sanz1年前1
sanz1年前1 -
 captainyzl 共回答了20个问题
captainyzl 共回答了20个问题 |采纳率85%沉淀可分为晶形沉淀和非晶形沉淀两大类型.硫酸钡是典型的晶形沉淀,Fe2O3·nH2O是典型的非晶形沉淀.晶形沉淀内部排列较规则,结构紧密,颗粒较大,易于沉降和过滤;非晶形沉淀颗粒很小,没有明显的晶格,排列杂乱,结构疏松,体积庞大,易吸附杂质,难以过滤,也难以洗干净.配合物不属于这两种.应该不是沉淀1年前查看全部
- 存在配位键的化合物为什么不一定是配位化合物?
 xjw6351年前2
xjw6351年前2 -
 小发135 共回答了22个问题
小发135 共回答了22个问题 |采纳率86.4%可会有共价键和离子键 ,如铵盐中的铵离子内部有一个配位键,但人们通常把它看作离子化合物而不是配合物一样,你也可再看看配合物的定义,就会懂的!1年前查看全部
- 三价铁离子和CN形成配位化合物是内轨还是外轨型?
 rudy021年前1
rudy021年前1 -
 wangjue0527 共回答了19个问题
wangjue0527 共回答了19个问题 |采纳率84.2%内轨型,Fe3+首先发生电子重排,空出2个3d轨道,然后发生d2sp3杂化,与6个CN-配位成键.
CN-一般都形成内轨型配合物,除非中心离子实在没有空的d轨道了,例如[Zn(CN)4]2-,这样才不得不形成外轨型配合物1年前查看全部
- 软硬酸碱理论是只能解释配位化合物么?
软硬酸碱理论是只能解释配位化合物么?
有个题是让用软硬酸碱理论解释为什么在含有Ag离子的溶液中加入Cl离子,氨水,Br离子等沉淀交替产生.如果用软硬酸碱理论解释就要牵扯到AgCl,但它不是配合物啊,能用软硬酸碱理论解释么? vinnyfu1年前1
vinnyfu1年前1 -
 1云中漫步1 共回答了18个问题
1云中漫步1 共回答了18个问题 |采纳率94.4%SHAB原则是软酸与软碱容易生成稳定的络合物,硬酸与硬碱容易生成稳定的络合物,交界酸碱生成的络合物稳定性不大.即为《软亲软,硬亲硬,软硬结合不稳定》.把它用在物质的溶解性上,例如氟化银、氯化银、溴化银、碘化银,从左至右随着碱的软度增加,它们的溶解度也随着减小.又由于银处在二B付族属于过渡元素难与氟离子和含氧配位原子的配位体形成稳定的络合物,因为它们是属硬软结合的缘故.在配位体中还要看可提供孤对电子的原子,氮元素在氨水中是直接提供孤对电子的故属硬碱,而银离子也属硬,故容易生成配合物,而溴、碘离子难与银离子形成稳定本配合物之故.请不要网友复制!1年前查看全部
- 化学什么情况下有络合物,和配位化合物有什么区别
 A200112581年前2
A200112581年前2 -
 leomohair 共回答了14个问题
leomohair 共回答了14个问题 |采纳率85.7%配位化合物 Ps:SO4 硫酸四氨合铜 Ni(CO)4 Ptcl2(NH3)2 配位盐:K3 CL3 配位酸:H H 配位碱:(OH)2 OH1年前查看全部
- 在配位化合物中,什么是高自旋低自旋排布,是在晶体场理论中的d分裂中提到的
在配位化合物中,什么是高自旋低自旋排布,是在晶体场理论中的d分裂中提到的
另外,强弱场配体,能不能将常见的几个列举一下
比如钴(2)是d7,可以成高自旋t2g(5)eg2.低自旋t2g6eg1,Fe(3)是d5,t2g3eg2与t2g5eg0,而镍(2)3d8为什么没有高低自旋态,盼望回答什么情况有,如何排布 htht1231年前2
htht1231年前2 -
 ssss6dazszd 共回答了21个问题
ssss6dazszd 共回答了21个问题 |采纳率90.5%晶体场理论认为,当受到配位负电场的作用时,中心离子的d轨道会发生能级分裂.八面体配合物中,dx2和dx2-y2的能量升高(称为eg或dy轨道),dxz、dyz和dxy的能量降低(称为t2g或dg轨道),四面体配合物中恰恰相反.而这两组轨道之间能量的差值称为分裂能Δ.一般来说,同一种构型的配合物中对于相同的中心金属离子,分裂能与配体的电荷或偶极矩相关.常见配体配位场强弱顺序:
I-<Br-<Cl-<F-<OH-<C2O42-<H2O<SCN-<NH3<en(乙二胺)<SO32-<o-phen(1,10-菲绕啉)<NO2-<CN-,CO
其中C2O42-以前是弱场配体,H2O到NH3为中等强场配体,en以后为为强场配体.
除了Δ以外,还有一种能量,称为电子成对能P.根据Hund规则,电子应以相同自旋的方式尽量占据不同轨道.因此,电子在同一轨道内配对会使得能量升高,这个升高值即为P.
对于弱场配体,通常P>Δ,所以电子会尽量分占不同轨道,出现许多未成对电子,即为高自旋配合物,具有顺磁性.
对于强场配体,通常P<Δ,所以电子会尽量成对出现在能量低的轨道上,因此未成对电子少,即为低自旋配合物,有可能是反磁性(电子全部配对).
因为对于3d8的构型,无论如何也会把能量低的轨道填满(6个位置)……所以只有一种构型:t2g6eg21年前查看全部
- 关于配位化合物的问题Ni2+ 与CN- 生成反磁性的正方形配离子[Ni(CN)4]2-,与Cl- 却生成顺磁性的四面体形
关于配位化合物的问题
Ni2+ 与CN- 生成反磁性的正方形配离子[Ni(CN)4]2-,与Cl- 却生成顺磁性的四面体形配离子[NiCl4]2-,请用价键理论解释该现象. zxl100001年前1
zxl100001年前1 -
 tootboy 共回答了15个问题
tootboy 共回答了15个问题 |采纳率73.3%Ni2+ 电子排布 3d8
CN- 是强场配体,和它配为后 Ni为 d2sp 杂化,则离子构型是平面正方形,d轨道里也没有单电子,因此是反磁性的
而Cl-是弱场配体,和它配位后 Ni 为sp3 杂化,则离子构型是四面体,d轨道里有两个单电子,因此是顺磁性的.1年前查看全部
- 配位化合物中的配离子中的磁距是怎么回事
 4dream1年前1
4dream1年前1 -
 云云123 共回答了19个问题
云云123 共回答了19个问题 |采纳率94.7%磁矩μ是用来表示物质磁性强弱的
配合物中,配离子的未成对电子数n越大,磁矩就越大.关系式如下
μ=sqrt[n(n+2)]
根据此式,可以估算出未成对电子数n=1~5的μ的理论值,相反,测定配合物的磁矩,也可以了解中心离子的未成对电子数.
例如说,Fe3+有5个未成对电子,其磁矩应该为5.92
实验测得[FeF6]3-的磁矩为5.90,所以可以判定[FeF6]3-中Fe3+仍然保留着5个未成对电子,从而可以判断其以sp3d2杂化轨道与配原子F形成外轨配键,所以[FeF6]3-属于外轨型
而[Fe(CN)6]3-的磁矩为2.0,与具有1个未成对电子的磁矩理论值1.73相接近,证明成键过程中中心离子的未成对d电子数减少,d电子重新分布,腾出2个空d轨道,以d2sp3杂化轨道与配位原子C形成内轨配键,所以[Fe(CN)6]3-属于内轨型
其实,磁矩就是判断杂化轨道类型的,具体的知识,在高教社有机化学上面,专门有一章,叫做配位化合物1年前查看全部
- 有关高中化学结构部分配位键,配位化合物问题
有关高中化学结构部分配位键,配位化合物问题
1.配位化合物中中心原子提供空轨道,具体是如何提供的?比如铜氨络离子中的CU2+
2.任意给出一个物质,如何判断其是不是配合物?例如单反,KCL.MgCL2.6H2O
3.配位化合物的立体结构如何判断,是否与配位数有关?
4.络盐,混盐,复盐辨析
我要模拟了!必修三只是有点遗忘!分数解答后一定额外给的! 雷蹴1年前1
雷蹴1年前1 -
 不花钱的猪 共回答了25个问题
不花钱的猪 共回答了25个问题 |采纳率88%你应该是高三学生,你提出的问题,对高三学生的要求
1:不要求中心原子提供空轨道,具体是如何提供的?
2:配合物的中心原子大多为过渡元素的金属离子.高考也只考这方面,所以KCl.MgCl2.6H2O是复盐.
3:配位化合物的立体结构肯定与配位数有关,但高中阶段不要求,教材中没提.
4:看定义可区分混盐和复盐:
复盐:由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子.例如,明矾(硫酸铝钾)是KAl(SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.复盐溶于水时,电离出的离子,跟组成它的简单盐电离出的离子相同.使两种简单盐的混合饱和溶液结晶,可以制得复盐.例如,使CuSO4和(NH4)2SO4的溶液混合结晶,能制得硫酸铜铵[(NH4)2SO4·CUSO4·6H2O].
混盐:是指一种金属离子与多种酸根离子所构成的盐.如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐.
它们都是纯净物(都有确定的化学式).
所以KCl.MgCl2.6H2O是复盐.1年前查看全部
- (2014•攀枝花模拟)某配位化合物为深蓝色晶体,由原子序数依次增大的A、0、j、D、E0种元素组成,其原子个数比为l4
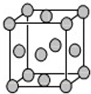 (2014•攀枝花模拟)某配位化合物为深蓝色晶体,由原子序数依次增大的A、0、j、D、E0种元素组成,其原子个数比为l4:4:5:1:1.其中j、D元素同主族且原子序数D为j的二倍,E元素的外围电子排布为(n-1)dn+0ns1,回答下列问题.
(2014•攀枝花模拟)某配位化合物为深蓝色晶体,由原子序数依次增大的A、0、j、D、E0种元素组成,其原子个数比为l4:4:5:1:1.其中j、D元素同主族且原子序数D为j的二倍,E元素的外围电子排布为(n-1)dn+0ns1,回答下列问题.
(1)元素D在周期表中的位置是______.
(2)该配位化合物的化学式为______.
(3)j元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为______.
(4)A元素与0元素可形成分子式为A202的某化合物,该化合物的分子具有平面结构,则其结构式为______.
(5)已知E的晶胞结构如图所示,又知晶胞边长为3.01×10-0jm,则E的密度为______;EDj4常作电镀液,其中Dj42-的空间构型是______,其中D原子的杂化轨道类型是______. ywbguan1年前1
ywbguan1年前1 -
 patrick_shine 共回答了15个问题
patrick_shine 共回答了15个问题 |采纳率86.7%解题思路:某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O,据此解答.某配位化合物为深蓝色晶体,由原子序数由小到大的少、B、C、D、Et种元素构成,其原子个数比为14:4:九:1:1.其中C、D元素同主族且原子序数D为C的你倍,则C为O元素、D为S元素;E元素的外围电子排布为(小-l)d小+6小sl,则小+6=10,故小=4,故其外围电子排布为她d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(小H她)4]小+、SO4小-,结合原子序数可知少为H、B为小,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(小H她)4]SO4•H小O,
(1)D为S元素,处于周期表中第三周期Ⅵ少族,故答案为:第三周期Ⅵ少族;
(小)由了述分析可知,该配位化合物的化学式为:[Cu(小H她)4]SO4•H小O,
故答案为:[Cu(小H她)4]SO4•H小O;
(她)C元素可与少元素形成两种常见的化合物,其原子个数比分别为1:1和l:小,分别为H小O与H小O小,由于H小O与H小O小之间形成氢键,两种化合物可任意比互溶,
故答案为:H小O与H小O小之间形成氢键;
(4)少元素与B元素可形成分子式为H小小小的化合物,该化合物的分子具有平面结构,应存在小=小双键,则其结构式为:H-小=小-H,
故答案为:H-小=小-H;
(九)晶胞中Cu原子数目=8×[1/8]+6×[1/小]=4,故晶胞质量=[4×64
6.0小×10小她十,示,又知晶胞边长为她.61×10-8cm,则Cu的密度=
4×64
6.0小×10小她十÷(她.61×10-8cm)她=9.04十/cm她;
CuSO4常作电镀液,其中SO4小-中S原子价层电子对数=4+
6+小−小×4/小]=4,S原子不含孤对电子,故其为正四面体构型,S原子采取sp她杂化,
故答案为:9.04十/cm她;正四面体;sp她杂化.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题是对物质结构的考查,涉及元素化合物推断、氢键、结构式、微粒构型判断、杂化轨道、晶胞计算等知识点,关键是根据配位化合物为深蓝色晶体进行推断,难度中等.1年前查看全部
- 硫化镍与氨水形成配位化合物的现象怎么解释?
硫化镍与氨水形成配位化合物的现象怎么解释?
取一只试管加入2ml 0.20mol/L NiSO4溶液,再逐滴加入2.0mol/L NH3·H2O溶液,边滴边震荡,待生成的沉淀完全溶解(沉淀是什么物质,如何生成,又如何溶解.是否生成配合物.)后,把溶液分装在两个试管中,分别加入少量的0.1mol/L BaCl2溶液和0.1mol/LNaOH溶液.观察现象,写出化学方程式,并解释现象.
最好用配位化合物和方程式解释,谢谢! nancy1001年前1
nancy1001年前1 -
 壮乡漓妹 共回答了14个问题
壮乡漓妹 共回答了14个问题 |采纳率92.9%取一只试管加入2ml 0.20mol/L NiSO4溶液,再逐滴加入2.0mol/L NH3·H2O溶液,边滴边震荡,待生成的沉淀完全溶解(沉淀是什么物质,如何生成,又如何溶解.是否生成配合物.)后,把溶液分装在两个试管中,分别加入少量的0.1mol/L BaCl2溶液和0.1mol/LNaOH溶液.观察现象,写出化学方程式,并解释现象.
NiSO4 + 2NH3•H2O → Ni(OH)2↓ + (NH4)2SO4 沉淀——复分解反应
Ni(OH)2 + 4NH3•H2O → [Ni(NH3)4(H2O)2]²+(OH-)2 + 2H2O 沉淀溶解——生成可溶性配合物
加入少量的0.1mol/L BaCl2溶液:立即生成沉淀,硫酸根的反应:SO4²- + Ba²+ → BaSO4↓
加入少量的 0.1mol/LNaOH溶液:无明显现象.——Ni²+ 离子作为二水四氨合镍络离子的中心,很少以游离Ni²+形式存在,于是少量氢氧根不至于使其生成氢氧化镍沉淀.
这个实验说明络合物具有内界和外界的区分,内界中的各种组分以相互结合的形式存在,很少游离;内界以外的离子和组分则是游离的.1年前查看全部
- 配位化合物 中如 {cu(NH3)4}CL2 它溶于水是怎么电离的 会出现 NH4+吗
 qjsj67671年前3
qjsj67671年前3 -
 冥鱼 共回答了17个问题
冥鱼 共回答了17个问题 |采纳率100%因为{cu(NH3)4}这是一个整体的 由配位键连接,配位键相当于共价键,相当牢固.配位体和氯离子形成的是离子键,这个就比较容易断裂了,所以呢 溶液中会存在{cu(NH3)4}阳离子和氯离子1年前查看全部
大家在问
- 1题目是What do you think of good habits ?的英语作文50词
- 21.已知 a_n=n/n^2+156 ( n ∈ N),则在数列{a_n}的最大项为_______
- 3升旗仪式开始了,大家向国旗注目礼 改病句
- 4下面图形中能折成正方体的是( )
- 5教师节即将来临,六(2)班的同学给敬爱的老师制作了一张贺卡,他们在贺卡上写下了"___,____"的名句来赞颂老师
- 6男生对女生说这句话到底是什么意思?!
- 7甲,乙两地的路程为480千米,一列快车从甲地开出,每小时行驶90千米,一列慢车从乙地开出,每小时行驶70千米.
- 8英语翻译有 朋友约我见面,我想把时间改成星期天的下午,请问用英语怎么说
- 9盒中有10只晶体管,其中2只是次品,每次随机地抽取1只,作不放回抽样,连抽两次,求下列事件的概率:1只正品,1只次品
- 10已知-5∈{x| x2-ax-5=0},求集合{x|x2=ax=3=0}中所有元素之和
- 11与word相似单词
- 12作文,第一篇我的初中生活 第二篇有趣的一件事 第三篇因为有你 第四篇题目自匿
- 13大数学家高斯在上学时曾研究过这样一个问题:1+2+3+.=100=?经过研究,这个问题的结论计算2分之1加4分
- 14I beg your pardon的用法
- 15敌人冲上来了(扩写句子) 用比喻的修辞手法




