碱金属元素在空气中燃烧后是否都能生成M2O(M为碱金属元素)
 浪漫生活2022-10-04 11:39:545条回答
浪漫生活2022-10-04 11:39:545条回答
已提交,审核后显示!提交回复
共5条回复
 suming020 共回答了17个问题
suming020 共回答了17个问题 |采纳率94.1%- 不一定
锂在空气中燃烧生成Li2O
但钠空气中燃烧生成Na2O2
钾在空气中燃烧生成KO2
后面的更复杂 不一定都是M2O的 - 1年前
 lixiao0116 共回答了23个问题
lixiao0116 共回答了23个问题 |采纳率- 不是的,
NA,K,RB,CS,在空气中燃烧生成【过氧化物】或者【超氧化物】,不能生成简单的氧化物 - 1年前
 有个人很平凡 共回答了26个问题
有个人很平凡 共回答了26个问题 |采纳率84.6%- Na在空气中燃烧生成Na2O2,常温下在空气中放置时则被氧化为Na2O
- 1年前
 keren 共回答了9个问题
keren 共回答了9个问题 |采纳率- 金属越活泼在空气中燃烧的产物就是过氧化物,如碱金属从上到下分别是Li Na K Ru Cs 锂在空气中燃烧的产物是氧化锂,钠燃烧的产物是过氧化钠,钾燃烧的产物也是过氧化物。
- 1年前
 wangwenqi 共回答了11个问题
wangwenqi 共回答了11个问题 |采纳率- 过氧化物,超氧化物还有臭氧化物MO3,氧为负三分之一价
- 1年前
相关推荐
- 下列有关碱金属的说法中,不正确的是 [ ] A.IA族元素都是碱金属元素
下列有关碱金属的说法中,不正确的是 [ ]A.IA族元素都是碱金属元素
B.K的还原性强于Na
C.Na和Na + 灼烧时都能使火焰呈黄色
D.Na在空气中燃烧时生成Na 2 O 2 历史的天空_小何1年前1
历史的天空_小何1年前1 -
 crystal汪汪 共回答了20个问题
crystal汪汪 共回答了20个问题 |采纳率95%A1年前查看全部
- 有关碱金属元素的说法不正确的是( )
有关碱金属元素的说法不正确的是( )
A.随着原子序数的增加金属性增强
B.碱金属的熔沸点从上至下增大
C.碱金属元素与氧气反应的产物随着原子序数的增加而越复杂
D.钾在水中的反应现象比钠剧烈 pingguo91年前1
pingguo91年前1 -
 qingqingbolu 共回答了21个问题
qingqingbolu 共回答了21个问题 |采纳率100%解题思路:A、碱金属元素从上到下金属性逐渐增强;
B、碱金属的熔沸点逐渐降低;
C、碱金属金属性越强与氧气反应的产物越复杂;
D、金属性越强,与水反应越剧烈.A、碱金属元素从上到下,原子的失电子能力增强,则金属性逐渐增强,故A正确;
B、碱金属从上至下金属键减弱,则碱金属的熔沸点逐渐降低,故B错误;
C、碱金属元素从上到下金属性逐渐增强,与氧气反应的产物越复杂,则碱金属元素与氧气反应的产物随着原子序数的增加而越复杂,故C正确;
D、金属性越强,与水反应越剧烈,金属性:K>Na,则钾在水中的反应现象比钠剧烈,故D正确.
故选B.点评:
本题考点: 碱金属的性质.
考点点评: 本题考查碱金属的性质相似性和递变规律,可以根据元素周期律知识来回答,注意把握金属晶体熔点的比较方法,难度不大.1年前查看全部
- 以下各项叙述中错误的是( )A.同一种碱金属元素的离子半径比原子半径小B.碱金属单质的密度比较为Li<Na<K<Rb<
以下各项叙述中错误的是( )
A.同一种碱金属元素的离子半径比原子半径小
B.碱金属单质的密度比较为Li<Na<K<Rb<Cs
C.碱金属单质的熔、沸点比较为Li>Na>K>Rb>Cs
D.碱金属单质还原性比较为Li<Na<K<Rb<Cs 湖思1年前1
湖思1年前1 -
 wing_x 共回答了17个问题
wing_x 共回答了17个问题 |采纳率94.1%解题思路:A、碱金属原子失去最外层电子形成离子;
B、依据同主族金属性质递变分析判断;
C、依据同主族金属性质递变分析判断;
D、依据同主族金属性质递变分析判断;A、碱金属原子失去最外层电子形成离子,同一种碱金属元素的离子半径比原子半径小,故A正确;
B、碱金属单质的密度比较,密度有反常的变化(Na与K的位置颠倒),故B错误;
C、碱金属单质的熔、沸点依次减小,沸点比较为Li>Na>K>Rb>Cs,故C正确;
D、碱金属单质还原性从上到下失电子能力减弱,还原性增强,故D正确;
故选B.点评:
本题考点: 碱金属的性质.
考点点评: 本题考查了碱金属性质的递变规律应用,依据周期表同主族递变规律分析判断,关键是密度比较时的反常掌握.1年前查看全部
- 氢元素是非金属元素,为什么与碱金属元素同在IA族?
 xh8801061年前1
xh8801061年前1 -
 362959769 共回答了15个问题
362959769 共回答了15个问题 |采纳率86.7%因为最外层电子数都是1.1年前查看全部
- 根据元素周期表和元素周期律,判断下列有关描述正确的是 A.碱金属元素中,金属活泼性最强的是Li B.第三周期元素中,原子
根据元素周期表和元素周期律,判断下列有关描述正确的是
A.碱金属元素中,金属活泼性最强的是Li B.第三周期元素中,原子半径最大的是Cl C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H 2 SO 4 D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键  紫堇城1年前1
紫堇城1年前1 -
 小小的大大88 共回答了15个问题
小小的大大88 共回答了15个问题 |采纳率86.7%D
1年前查看全部
- 卤族元素与碱金属元素的区别
 Atirain1年前2
Atirain1年前2 -
 helen_miao 共回答了26个问题
helen_miao 共回答了26个问题 |采纳率92.3%卤族元素是VIIA族元素,最外层都有7个电子,化学反应中容易得到1个电子,显氧化性、非金属性
碱金属是IA族(不包括H),最外层只有1个电子,化学反应中容易失去最外层的1个电子,显还原性、金属性1年前查看全部
- 钠与铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是(
钠与铯都是碱金属元素,下列关于铯及其化合物的叙述中不正确的是()
A.其单质在常温下与H 2 O的反应比Na更剧烈 B.其单质能从NaCl水溶液中置换出Na C.CsOH属于强碱,其碱性强于NaOH D.其单质极易被氧化,可保存在煤油中  onlyou5201年前1
onlyou5201年前1 -
 huangjiahui 共回答了15个问题
huangjiahui 共回答了15个问题 |采纳率100%B
铯与钠同属碱金属元素,化学性质相似,随着核电荷数增加和原子半径增大,铯比钠金属活动性更强,单质的还原性更强,单质更易被氧化,氢氧化物碱性也更强,A、C、D三项均正确。由于铯与水剧烈反应,生成氢氧化铯和氢气,它不能从NaCl溶液中置换出Na,B项错误。1年前查看全部
- 碱金属元素的原子结构相同点不同点
碱金属元素的原子结构相同点不同点
现在要 马上 fr253911年前4
fr253911年前4 -
 碎日猎夜 共回答了21个问题
碎日猎夜 共回答了21个问题 |采纳率90.5%相同点:原子结构的最外层电子数相同,都是1.不同点:随着核电荷数的增加,电子层数逐渐增加,原子半径增大.1年前查看全部
- 碱金属元素是周期性表现得最鲜明和最有规律的一族元素.下列说法正确的是( )
碱金属元素是周期性表现得最鲜明和最有规律的一族元素.下列说法正确的是( )
A. 碱金属单质中锂的密度最小,熔点最低
B. 碳酸钾溶液的pH<7
C. 乙醇与金属钾反应生成氢气
D. 用电解铯盐溶液的方法冶炼金属铯 ShmilyR1年前1
ShmilyR1年前1 -
 aini7749 共回答了15个问题
aini7749 共回答了15个问题 |采纳率93.3%解题思路:A、碱金属自上而下密度呈增大趋势,锂的密度最小,从锂到铯离子半径逐渐增大,金属键逐渐减弱;
B、碳酸钾是强碱弱酸盐,碳酸根水解,溶液呈碱性;
C、碱金属自上而下原子半径逐渐增大,原子核对吸引减弱,金属性增强;
D、电解铯盐溶液,铯离子不能放电,溶液中氢离子放电,不能得到金属铯.A、碱金属自上而下密度呈增大趋势,锂的密度最小,从锂到铯离子半径逐渐增大,金属键逐渐减弱,熔点降低,锂的熔点最高,故A错误;
B、碳酸钾是强碱弱酸盐,碳酸根水解,溶液呈碱性,溶液PH>7,故B错误;
C、碱金属自上而下原子半径逐渐增大,原子核对吸引减弱,金属性增强,钠与乙醇反应生成氢气,钾与乙醇反应也可以生成氢气,故C正确;
D、电解铯盐溶液,铯离子不能放电,溶液中氢离子放电,不能得到金属铯,应电解熔融的铯盐,故D错误.
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查碱金属的性质递变规律与相似性、元素周期律等,难度不大,掌握同主族元素性质的相似性与递变性.1年前查看全部
- .碱金属元素原子半径越大,熔点越低,单质的活泼性越小?
 yf1031年前3
yf1031年前3 -
 flying1 共回答了15个问题
flying1 共回答了15个问题 |采纳率93.3%碱金属元素原子半径越大 熔点越低 正确 半径大 原子间吸引减小 易熔
单质的活泼性越小 错误 因为半径越大 对最外层电子的吸引越小 越容易失去电子 所以化学性质越活泼1年前查看全部
- 碱金属元素原子最外层的电子数都是______个,在化学反应中它们容易失去______个电子;碱金属元素中金属性最强的是_
碱金属元素原子最外层的电子数都是______个,在化学反应中它们容易失去______个电子;碱金属元素中金属性最强的是______,原子半径最小的是______.卤素原子最外层的电子都是______个;在卤素中非金属性最强的是______,原子半径最小的是______.
 转运啦1年前4
转运啦1年前4 -
 clwy_56 共回答了22个问题
clwy_56 共回答了22个问题 |采纳率86.4%解题思路:根据碱金属元素原子最外层的电子数1,很容易失去电子,同一主族元素的原子,从上到下原子半径逐渐增大,金属性逐渐增强;根据卤素原子最外层的电子数是7,很容易得到电子,同一主族元素的原子,从上到下原子半径逐渐增大;碱金属元素原子最外层的电子数1,很容易失去1个电子,同一主族元素的原子,从上到下,原子半径逐渐增大,金属性逐渐增强;卤素原子最外层的电子数是7,很容易得到电子,同一主族元素的原子,从上到下,原子半径逐渐增大,
故答案为:1;1;Cs;Li;7;F;F.点评:
本题考点: 同一主族内元素性质递变规律与原子结构的关系.
考点点评: 解答本题的关键是元素周期律的应用,难度不大.1年前查看全部
- 关于化合价的问题碱金属元素形成化合物时只有+1价的么?没有特例么?氢元素在什么情况下会为-1价?举几个例子?金属元素在化
关于化合价的问题
碱金属元素形成化合物时只有+1价的么?没有特例么?
氢元素在什么情况下会为-1价?举几个例子?
金属元素在化合物中一定是负价么?什么时候不是?举几个例子? smallcat66881年前2
smallcat66881年前2 -
 liukang198 共回答了22个问题
liukang198 共回答了22个问题 |采纳率90.9%是,没有.
LIH,NAH时候H都是-1.
金属元素在化合物中都是正的啊没有(-)价.1年前查看全部
- 为什么碱金属元素的最高价氧化物的水化物的碱性逐渐从上到下逐渐增强?我发现好像与单质还原性有关.
为什么碱金属元素的最高价氧化物的水化物的碱性逐渐从上到下逐渐增强?我发现好像与单质还原性有关.
单质还原性:Cs>Rb>K>Na>Li
最高价氧化物的水化物的碱性:Cs>Rb>K>Na>Li
其中有什么关系吗?
如果有可以说说碱性与其还原性的关系是什么吗?
还有就是辅导书上说Cs的最高价氧化物的水化物的碱性最强,那Fr在它下面还原性更强不是应该碱性也更强吗? 血色倾情1年前1
血色倾情1年前1 -
 王斌琪 共回答了19个问题
王斌琪 共回答了19个问题 |采纳率89.5%其实两者之间并没有什么联系.
氢氧化物的碱性取决于中心离子的离子势Φ的平方根,其中Φ=Z/r,Z为中心离子所带电荷,r为离子半径.由于从Li+到Cs+的半径逐渐增大,而所带电荷均为1,所以其氢氧化物的碱性逐渐增强.
而单质的还原性,从根本上讲,取决于原子失去电子的能力.气态原子的还原性取决于第一电离能,溶液中原子的还原性则还要考虑溶剂合能等其它因素.而气态原子从Li到Cs的第一电离能是逐渐降低的,因此从Li到Cs的还原性逐渐增强.
如果仅从ⅠA族看,碱性与还原性的规律一致;但是如果放在所有金属中就不成立了.比如Ba的还原性比Na强,但是Ba(OH)2的碱性不如NaOH.
Fr是放射性的元素,其原子的稳定性远低于Cs,很难得到稳定的Fr化合物,因此不对Fr作讨论.当然,如果成功制得FrOH,那么其碱性确实比CsOH要强.1年前查看全部
- 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN 3 )受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH) 4 +CO 2 →2Al(OH) 3 ↓+Na 2 CO 3 +H 2 O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH) 3 和Na 2 CO 3 的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH) 3 和Na 2 CO 3 的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:铵盐的质量/g 10.00 20.00 30.00 50.00 浓硫酸增加的质量/g m m 1.29 0
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。 雪在哭81年前1
雪在哭81年前1 -
 稻草也是人 共回答了16个问题
稻草也是人 共回答了16个问题 |采纳率87.5%(1)(3分) 40.32;(2)(3分) 0.25mol/L;(3)(6分) 14mol、10mol;
(4)(4分)(NH 4 ) 2 SO 4 与NH 4 HSO 4 的混合物;16.7%
1年前查看全部
- 卤族元素和碱金属元素的单质为什么是气态?
卤族元素和碱金属元素的单质为什么是气态?
卤族元素和碱金属为什么在气态下形成单质?应该是从化学键的角度回答。 西湖夜雨1年前3
西湖夜雨1年前3 -
 gtwlm 共回答了22个问题
gtwlm 共回答了22个问题 |采纳率86.4%卤素单质都是小分子,分子之间的作用力远不如化学键强,形成分子晶体,因此熔沸点较低;但随着分子量的增大,分子间作用力增强,熔沸点会升高.
在卤素单质中,常温下,F2和Cl2是气体,Br2是液体,而I2是固体;所以不能说卤素单质都是气体.
碱金属元素单质原子之间都以金属键相互作用,而金属键属于化学键,因此作用力比较强;
但化学键的强弱与成键的原子半径关系密切,半径越大,键越弱;而碱金属是同一周期元素中原子半径最大的,因此它们的金属键也都很弱,是除Hg外金属键最弱的,熔沸点都不太高.尽管如此,碱金属元素单质在常温下还都是固体,其中熔点最低的Cs(铯)只有29摄氏度.1年前查看全部
- 根据元素周期表和元素周期律,判断下列有关描述正确的是( ) A.碱金属元素中,金属活泼性最强的是L
根据元素周期表和元素周期律,判断下列有关描述正确的是()
A.碱金属元素中,金属活泼性最强的是Li B.第三周期元素中,原子半径最大的是Cl C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H 2 SO 4 D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键  韦总小蜜1年前1
韦总小蜜1年前1 -
 黑的眼睛黑的发 共回答了18个问题
黑的眼睛黑的发 共回答了18个问题 |采纳率94.4%D
1年前查看全部
- 几道填空题碱金属元素的密度逐渐-----,熔沸点逐渐--------碱金属元素中金属性最强的是-----,原子半径最小的
几道填空题
碱金属元素的密度逐渐-----,熔沸点逐渐--------
碱金属元素中金属性最强的是-----,原子半径最小的是----- hqcd20061年前3
hqcd20061年前3 -
 darling540 共回答了23个问题
darling540 共回答了23个问题 |采纳率91.3%首先说明一下,这道题并不严谨:“逐渐”是指什么?如果是指元素周期表中第一主族元素从上到下的顺序(即原子序数递增的顺序)的话,答案就应该是这样的:
碱金属元素的密度逐渐(增大),熔沸点逐渐(降低).
碱金属元素中金属性最强的是(钫),原子半径最小的是(锂).
需要说明的是,第一个空并不完全正确,但在做题的角度只能如此填写.因为碱金属元素从锂到钫,密度基本是逐渐增大的(因为相对原子质量逐渐增大),但相同条件下金属钾的密度比金属钠小,钾、钠是反常的.其他的空就应该没有什么疑问了,理论依据课本上应该讲得很详细.1年前查看全部
- 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物
在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物
判断正确与否,再说碱金属氧化物是什么,若错误,举出反例 风随我动1581年前2
风随我动1581年前2 -
 0b9b 共回答了21个问题
0b9b 共回答了21个问题 |采纳率85.7%浑拉浑拉!碱性氧化物是和酸性、两性、中性氧化物一起体现的.随着周期表中元素序数往右,碱性变两性变纯酸性.氧化物也一样.过氧化钠到氧化铝到三氧化硫.而碱金属氧化物就是由第一主族元素形成的氧化物,不可能有酸性的1年前查看全部
- 一道关于金属的化学题某种碱金属元素组成的两种碳酸盐的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一
一道关于金属的化学题
某种碱金属元素组成的两种碳酸盐的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的体积(标况)和消耗稀盐酸的体积,得到下面图中的曲线.
计算:
1.混合物中碳元素的质量分数
2.确定这两种碳酸盐的化学式
3.所滴加盐酸的物质的量浓度.
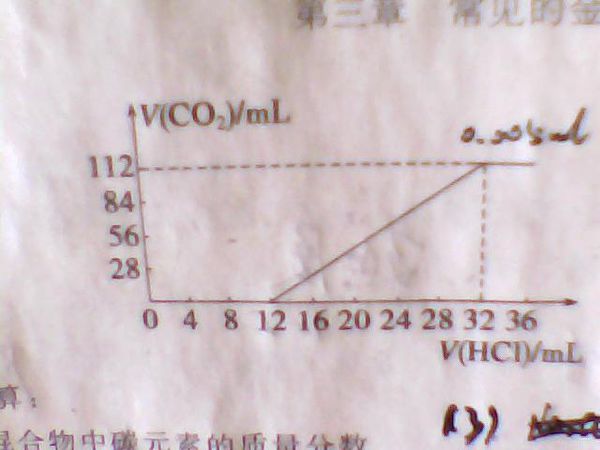
 后悔买了波导1年前1
后悔买了波导1年前1 -
 chirspp 共回答了23个问题
chirspp 共回答了23个问题 |采纳率91.3%1、
n(CO2)=0.112/22.4=0.005mol
m(C)=0.005*12=0.06g
C%=0.06/0.614=9.772%
2、
混合物的平均摩尔质量M(平均)=6.14/0.05=122.8g/mol
若M(M2CO3)=122.8g/mol,则M(M)=31.4g/mol
若M(MHCO3)=122.8g/mol,则M(M)=61.8g/mol
31.4g/mol1年前查看全部
- 1) 碱金属元素从上到下(li na k rb cs),随着核电荷数的增加,与水和氧气反应越来越 .生成的氧化物越来越
1) 碱金属元素从上到下(li na k rb cs),随着核电荷数的增加,与水和氧气反应越来越 .生成的氧化物越来越 .最高价氧化物对应水化物的碱性越来越 .li+.na+.k+.rb+.cs+.的氧化性(得电子能力)越来越 .
2)总结碱金属元素的物理性质的相似性与递变性
2) wsawithjl1年前2
wsawithjl1年前2 -
 anyexiaoyao 共回答了17个问题
anyexiaoyao 共回答了17个问题 |采纳率82.4%1)与水和氧气反应越来越剧烈.生成的氧化物越来越稳定.最高价氧化物对应水化物的碱性越来越强.li+.na+.k+.rb+.cs+.的氧化性(得电子能力)越来越弱.
2)
碱金属元素的物理性质的相似性:强碱性(金属性)、柔软
碱金属元素的物理性质的递变性:密度递增性、原子半径递减性、熔沸点递减性1年前查看全部
- 在元素周期表中,从左到右共有18个纵行.第1纵行(除氢以外)为碱金属元素,稀有气体是第18纵行.下列说法中正确的是(
在元素周期表中,从左到右共有18个纵行.第1纵行(除氢以外)为碱金属元素,稀有气体是第18纵行.下列说法中正确的是( )
A.铝元素位于第3纵行
B.过渡元素在周期表中占10个纵行
C.第17纵行所有元素的化合价都有+7价
D.第16纵行元素都是非金属元素 dyttdht1年前1
dyttdht1年前1 -
 yxwh2046 共回答了25个问题
yxwh2046 共回答了25个问题 |采纳率84%解题思路:从左到右共有18个纵行.第1纵行(除氢以外)为碱金属元素,稀有气体是第18纵行,则Al在第13纵行,第16纵行为第ⅥA族,第17纵行为ⅤⅡA族,以此来解答.A.铝元素位于第13纵行,故A错误;
B.过渡元素包括7个副族和1个ⅤⅢ族,在周期表中占10个纵行,故B正确;
C.第17纵行中除F元素,其它元素的化合价都有+7价,F没有正价,故C错误;
D.第16纵行元素为氧族元素,含非金属元素(O、S等)和金属元素(Po),故D错误;
故选B.点评:
本题考点: 元素周期表的结构及其应用.
考点点评: 本题考查元素周期表的结构及应用,为高频考点,把握纵行与族的关系为解答的关键,注重分析能力及迁移应用能力的考查,题目难度不大.1年前查看全部
- 碱金属元素中钾元素的密度为什么不合规律
 renjinjun1年前2
renjinjun1年前2 -
 tws1974 共回答了19个问题
tws1974 共回答了19个问题 |采纳率94.7%根据“密度=相对原子质量/原子体积”,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小.即单质的密度由相对原子质量和原子体积两个因素决定.对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小.1年前查看全部
- 1mol的x同酸反应能置换出1克氢气,为什么就能判断出是碱金属元素
 叙说骄傲1年前3
叙说骄傲1年前3 -
 草原鸿雁 共回答了17个问题
草原鸿雁 共回答了17个问题 |采纳率70.6%写出反应式:
2X + 2H+ = 2X n+ + H2
2 mol 2g
1 mol 1g
可见:n = 1方程式成立:
2X + 2H+ = 2X+ + H2
生成X+,只有碱金属,如果是碱土金属,n=21年前查看全部
- 关于碱金属元素的试题(把解析写一下)
关于碱金属元素的试题(把解析写一下)
质量均为m g的Na,Mg,Fe分别与100mL 1mol/L HCl反应,产生气体的体积依次是a L,b L ,c L(标准状况),下列关系式一定错误的是( )
A.ab C.ac
你的答案不对 (老师说b>a>或=c)‘ 我给你分但你要改正错误’ uyiyu1年前2
uyiyu1年前2 -
 必须折腾 共回答了22个问题
必须折腾 共回答了22个问题 |采纳率86.4%23 -1 2NA +2HCL =2NACL+H2 生成m/23克氢气
24 -2=>12 -1 MG+2HCL=MGCL2+H2 生成m/12克氢气
56 -2=>28 -1 FE+2HCL=FECL2+H2 生成m/28克氢气
c1年前查看全部
- 铯是一种碱金属元素,下列关于铯的叙述中,正确的是( )
铯是一种碱金属元素,下列关于铯的叙述中,正确的是( )
a.csoh是一种可溶于水的强碱
b.cs在空气中燃烧,生成一种氧化物cs2o
c.cs与水反应能发生***,并放出氧气
d.加热cs2co3可生成氧化铯和二氧化碳 oo0不想一个人1年前1
oo0不想一个人1年前1 -
 rocket729 共回答了15个问题
rocket729 共回答了15个问题 |采纳率86.7%解题思路:A、碱金属元素对应的碱的碱性从上到下是逐渐增强的;
B、根据金属钠、钾的燃烧来推得金属Cs的燃烧产物;
C、活泼金属和水的反应产生强碱和氢气;
D、根据碳酸钠、碳酸钾的稳定性来推理即可.A、碱金属元素对应的碱的碱性从上到下是逐渐增强的,氢氧化钠、氢氧化钾均是强碱,所以CsOH是一种可溶于水的强碱,故A正确;
B、金属钠、钾的燃烧产物分别是过氧化钠、超氧化钾等,所以Cs在空气中燃烧,生成的氧化物一定不是Cs2O,故B错误;
C、活泼金属Na、K和水的反应会产生强碱氢氧化钠、氢氧化钾和氢气,所以金属铯和水的反应不会产生氧气,故C错误;
D、碳酸钠、碳酸钾的性质稳定,受热不会分解,所以加热Cs2CO3也不会发生分解,故D错误.
故选A.点评:
本题考点: 碱金属的性质.
考点点评: 本题考查学生碱金属元素的性质递变规律知识,注意同族元素,从上到下,金属的活泼性是逐渐增强的,元素性质具有相似性和递变性,难度不大.1年前查看全部
- 以X代表碱金属元素,请写出碱金属单质跟水的化学方程式的通式.
 seedoef1年前1
seedoef1年前1 -
 yangqi3235 共回答了13个问题
yangqi3235 共回答了13个问题 |采纳率84.6%2 X + 2 H2O = 2 XOH + H2↗
X是碱金属,所以氢氧化物是XOH1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 宝宝爱饭饭1年前1
宝宝爱饭饭1年前1 -
 wongyei 共回答了20个问题
wongyei 共回答了20个问题 |采纳率95%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 qinqin84101年前1
qinqin84101年前1 -
 tonyscau 共回答了16个问题
tonyscau 共回答了16个问题 |采纳率100%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 铷(Rb)为碱金属元素,其最高价氧化物对应的水化物属于( )
铷(Rb)为碱金属元素,其最高价氧化物对应的水化物属于( )
A.强碱
B.弱碱
C.强酸
D.弱酸 苦苦专1年前1
苦苦专1年前1 -
 默存_lee 共回答了20个问题
默存_lee 共回答了20个问题 |采纳率100%解题思路:元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强(但O、F除外).元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强(但O、F除外),Rb和Na属于同一主族元素,金属性比钠强,所以氢氧化铷的碱性大于氢氧化钠,氢氧化钠为强碱,则氢氧化铷也是强碱,故选A.
点评:
本题考点: 碱金属的性质.
考点点评: 本题考查了元素周期律,明确同一主族元素性质的相似性和递变性是解本题关键,根据元素周期律采用对比的方法分析解答,题目难度不大,1年前查看全部
- 高一 碱金属元素将Na投入下列液体中 反应的剧烈程度由强到弱的是(1)水 (2)NaOH溶液 (3)0.1mol/L的H
高一 碱金属元素
将Na投入下列液体中 反应的剧烈程度由强到弱的是
(1)水 (2)NaOH溶液 (3)0.1mol/L的HCl (4)0.1mol/L的CuSO4
A 4321 B 4312 C 3412 D 1342
能给下理由就更好了 谢谢各位 o半生缘o1年前2
o半生缘o1年前2 -
 哈酷拉玛塔塔 共回答了17个问题
哈酷拉玛塔塔 共回答了17个问题 |采纳率88.2%c
H+浓度高的快1年前查看全部
- (2013•许昌一模)钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛的应用.
(2013•许昌一模)钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛的应用.
(1)将0.01mol下列物质①Na2O2②Na2O ③Na2CO3④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)______;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为______.肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.该电池放电时其负极的电极反应式是______;
(3)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg,则该混合物样品中Na2CO3的质量分数是[62a−168b/62a×100% 3276466121年前1
3276466121年前1 -
 9l6tjpbl 共回答了16个问题
9l6tjpbl 共回答了16个问题 |采纳率87.5%解题思路:(1)等物质的量的Na2O2与Na2O分别于水反应生成等物质的量的NaOH,消耗的水的量相同,生成的OH-浓度相同,均约为0.2mol/L,Na2CO3因水解,使阴离子浓度稍增大:CO32-+H2O⇌HCO3-+OH-.
(2)依据氧化还原反应电子守恒分析判断产物和配平化学方程式,燃料电池,燃料在负极失电子发生氧化反应;
(3)NaHCO3不稳定,加热易分解,根据质量的变化利用差值法解答;
(4)反应的方程式为2NaN3
2Na+3N2↑,根据方程式计算;撞击 .
(5)结合反应的方程式2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑计算.(1)由①反应为2Na2O2+2H2O=4NaOH+O2↑,②反应为Na2O+H2O=2NaOH溶于水,二者消耗的水的量相同,生成等物质的量的NaOH,故生成的OH-浓度相同,均约为0.2mol/L,故为①=②;③中碳酸根水解使得阴离子浓度稍大于④,而④中NaCl的浓度为0.1mol/L,则所得溶液中阴离子浓度的大小顺序是①=②>③>④,
故答案为:①=②>③>④;
(2)NH3与NaClO反应可得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,肼--空气燃料电池是一种碱性电池,该电池放电时,负极是肼燃烧生成氮气和水,负极的电极反应式为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;N2H4+4OH--4e-=4H2O+N2;
(3)NaHCO3不稳定,加热易分解,发生2NaHCO3
△
.
]Na2CO3+H2O+CO2↑,
则2NaHCO3
△
.
Na2CO3+H2O+CO2↑△m
168g 106g 62g
x bg
x=[168b/62]g,
则样品中Na2CO3的质量为ag-[168b/62]g=[62a−168b/62]g,
所以该混合物样品中Na2CO3的质量分数是[62a−168b/62a×100%,
故答案为:
62a−168b
62a×100%;
(4)反应的方程式为2NaN3
撞击
.
]2Na+3N2↑,则
2NaN3
撞击
.
2Na+3N2↑,
130g 67.2L
m 40.32L
m=[130g×40.32L/67.2L]=78g,
故答案为:78;
(5)设钠、钾的物质的量分别为a、b,反应的方程式为2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑,
则a+b=0.075mol×2=0.15mol,
该溶液中氢氧根离子的物质的量浓度是[0.15mol/0.2L]=0.75mol/L,
且23a+39b=5.05(质量守恒),
解之得a=0.050mol,b=0.10mol,n(Na):n(K)=1:2,该钠-钾合金化学式为NaK2,
故答案为:0.75(mol/L);NaK2.点评:
本题考点: 钠的重要化合物;碱金属的性质;有关混合物反应的计算.
考点点评: 本题考查较为综合,涉及碱金属的单质以及混合物的性质,侧重于学生的分析能力和计算能力的考查,注意把握题给信息,学习中注意相关基础知识的积累,根据反应的方程式解答该题,难度不大.1年前查看全部
- 关于碱金属元素计算某种碱金属元素组成的两种碳酸盐的混合物6.14克,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定
关于碱金属元素计算
某种碱金属元素组成的两种碳酸盐的混合物6.14克,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出二氧化碳的体积(标况)和消耗稀盐酸的体积,得到下图所示的曲线.
1)混合物中碳元素的质量分数
2)这两种碳酸盐的化学式
3)所滴加盐酸的物质的量的浓度
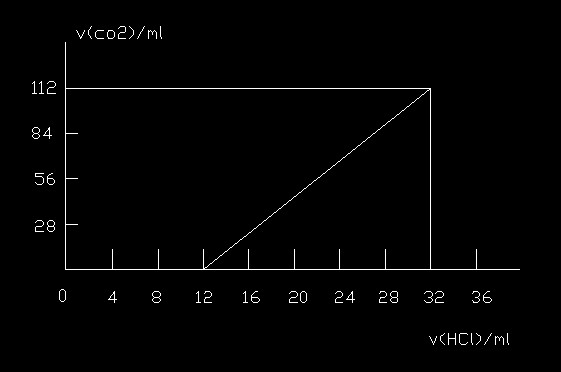
 与时俱进00011年前1
与时俱进00011年前1 -
 rush0214 共回答了19个问题
rush0214 共回答了19个问题 |采纳率100%碳元素到最后肯定变成了CO2中的C,那么生成的总CO2量是112mL,合0.005mol
由于我们取的是1/10的混合物,所以C的质量分数是0.005*12/0.614=9.77%
由于开始加入HCl没有气体出现,说明存在碳酸盐或者碱式碳酸盐,又由于出现CO2的时刻在12,而非32的一半16处,可以断定是酸式盐和正盐(由于阳离子是正一价的碱金属)
那么设是MHCO3 和N2CO3
相对分子量是(M+61)和(2N+60),
根据CO32-全部变成HCO3-用去了H+是12mL
HCO3-变成CO2用去了H+是20mL
我们设MHCO3是xmol,N2CO3是ymol
则y/(x+y)=12/20
即x/y=2/3
由于x+y=0.005
解得x=0.002.,y=0.003
那么0.002(M+61)+0.003(2N+60)=0.614
所以M+3N=156
由于碱金属是Li Na K Rb Cs
当N是Li时7,M是156-21=135无此元素
当N是Na,23 则M是156-23*3=87无此元素
当N是K,39,解得M也是K,成立
当N是Rb时,3N>156无解
所以M,N都是K
即是K2CO3和KHCO3
取样中碳酸根的物质的量是0.03mol
当它全部变成碳酸氢根的时候,用去了H+当然是0.03mol
体积是12mL
即盐酸的物质的量的浓度时0.03/0.012=30/12=10/4=2.5mol/L1年前查看全部
- 含有1.4g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1.79g,则该混合物中碱金属元素的
含有1.4g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1.79g,则该混合物中碱金属元素的质量分数为多少?
 迫于果腹撒1年前1
迫于果腹撒1年前1 -
 木砚 共回答了22个问题
木砚 共回答了22个问题 |采纳率86.4%解题思路:由于碱金属不确定,可用极端假设法加以讨论,即讨论1.40g全部为碱金属单质及1.40g全部为碱金属氧化物时生成碱的质量,然后根据平均值规律建立不等式进行解答,得出碱金属名称,然后再根据碱金属及其氧化物质量、与水反应生成的碱的质量计算出二者组成.设M的相对原子质量为a,发生反应的方程式有:2M+2H2O═2MOH+H2↑、M2O+H2O═2MOH,
若1.40g全部为碱金属单质,则产生的MOH的质量为:m(MOH)=[1.40g/ag/mol]×(17+a)g/mol=
1.4(a+17)
ag;
若1.40g全部为碱金属氧化物,则产生的MOH的质量为:m(MOH)=
1.40(a+17)
a+8×2×(17+a)g/mol=
1.40(a+17)
a+8g,
则
1.40(a+17)
a+8g<1.79g<
1.4(a+17)
ag.
解得24.3<a<61.03,只有钾符合条件,xg设K和K2O的质量分别为xg和yg,根据反应方程式2K+2H2O═2KOH+H2↑、K2O+H2O═2KOH可得:
xgxg+yg=1.40g,[56x/39+
2×56y
94]=1.79,解得x≈0.498g,y≈0.902g,所以混合物中碱金属元素的质量分数为[0.498g/1.4g]×100%=35.6%.
答:混合物中碱金属元素的质量分数为35.6%.点评:
本题考点: 化学方程式的有关计算;元素质量分数的计算.
考点点评: 本题考查了有关混合物的计算,题目难度较大,解题关键是利用极端假设法加以讨论得出碱金属名称,掌握掌握计算混合物组成的方法,试题培养了学生的逻辑推理能力及化学计算能力,有利于提高学生灵活应用所学知识解决实际问题能力.1年前查看全部
- (2012•上海模拟)碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
(2012•上海模拟)碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )元素 熔点(℃) 沸点(℃) 与水作用 纯液体的导电性 X -183 -162 不与水反应也不溶于水 不导电 Y -102 19 放热,形成的酸是弱酸 不导电 Z 680 - 剧烈反应生成H2,溶液呈碱性 导电
A.X、Y、Z
B.Z、X、Y
C.Y、X、Z
D.Z、Y、X 夜雨飘零1年前1
夜雨飘零1年前1 -
 pengpeng0822 共回答了19个问题
pengpeng0822 共回答了19个问题 |采纳率100%解题思路:同周期从左向右金属性在减弱,金属性越弱,其金属氢化物的共价性越大,被水分解的难度也就越大.对非金属氰化氢来说,非金属性越强,键的极性越大,根据相似相溶可知,越易溶于水.同周期从左向右金属性在减弱,金属性越弱,其金属氢化物的共价性越大,被水分解的难度也就越大.对非金属氰化氢来说,非金属性越强,键的极性越大,根据相似相溶可知,越易溶于水,由同一短周期元素X、Y、Z三种元素氢化物的某些性质可知,Z的金属性最强,Y的非金属性最大,X介于二者之间,
则原子序数为Y>X>Z,
故选C.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置、结构、性质,明确同周期元素金属性、非金属性的变化是解答的关键,注重基础知识的考查,题目难度不大.1年前查看全部
- 碱金属元素结构特点递变性
 7261606zszzsz1年前2
7261606zszzsz1年前2 -
 蓝色诺曼底 共回答了18个问题
蓝色诺曼底 共回答了18个问题 |采纳率88.9%碱金属位于IA族,其周期律性质主要表现为自上而下,碱金属元素的金属性逐渐增强
每个碱金属元素最外层都是一个电子,并且每向下一个周期,就多一层
好像就是这么简单,1年前查看全部
- 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN 3 )受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生
40.32 L(标准状况下)氮气,至少需要叠氮化钠______g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
①计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
②计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:2NaAl(OH) 4 +CO 2 →2Al(OH) 3 ↓ +Na 2 CO 3 +H 2 O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH) 3 和15 mol Na 2 CO 3 ,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH) 3 和Na 2 CO 3 的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。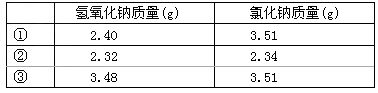
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。  vivienwy1年前1
vivienwy1年前1 -
 qingjinger 共回答了9个问题
qingjinger 共回答了9个问题 |采纳率88.9%(1)78
(2)①c(OH - )= ×1000=0.75(mol/L)
×1000=0.75(mol/L)
②设上述合金中含amolNa、bmolK,
a+b=0.75×223a+39b=5.05 a=0.050molb=0.10mol,该钠-钾合金化学式为NaK 2
(3)溶液含NaOH,NaOH与CO 2 反应生成的Na 2 CO 3 :15-1/2×24=3(mol)
112LCO 2 的物质的量:112/22.4=5(mol)
n[Al(OH) 3 ]:n(Na 2 CO 3 )=[(5-3)×2]:5=4:5
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=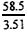 ×2.40=40g/mol
×2.40=40g/mol
M2(NaOH)= ×2.32=58g/mol
×2.32=58g/mol
M2(NaOH)=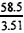 ×3.48=58g/mol
×3.48=58g/mol
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H 2 O1年前查看全部
- 碱金属元素的原子,随着核电荷数的增加( )
碱金属元素的原子,随着核电荷数的增加( )
A.最外层电子数增多 B.单质的熔点升高
C.原子的得电子能力增强 D.单质的还原性增强
请写明原因谢谢 bnmv1年前1
bnmv1年前1 -
 mickle584521 共回答了23个问题
mickle584521 共回答了23个问题 |采纳率91.3%D1年前查看全部
- 俗名为苏打的化学式为是?用于发酵面包的小苏打的化学式是?碱金属元素中金属性最强的是?在k和na中,与酸
 沙汀鱼1年前4
沙汀鱼1年前4 -
 zhy_sor 共回答了14个问题
zhy_sor 共回答了14个问题 |采纳率85.7%苏打是碳酸钠,小苏打是碳酸氢钠,碱金属中从上到下金属性增强1年前查看全部
- 第IA 族为碱金属元素 第VIIA族为卤族元素 其他族的呢?
第IA 族为碱金属元素 第VIIA族为卤族元素 其他族的呢?
元素周期表还是弄不懂! 游子的心声1年前3
游子的心声1年前3 -
 我爱酸菜豆米 共回答了16个问题
我爱酸菜豆米 共回答了16个问题 |采纳率87.5%主要都是给有典型性质的一族命名.
主要还有:IVA碳族元素,VA氮族元素,VIA氧族元素1年前查看全部
- 碱金属的密度碱金属元素的单质的密度,随着原子序数的增大而递增.那里错了,我认为是对的啊
 你的vincent1年前1
你的vincent1年前1 -
 qingnianmao 共回答了13个问题
qingnianmao 共回答了13个问题 |采纳率100%也不一定,在已知的化学周期表中没有不符合的,但它们没有特定的关系1年前查看全部
- 碱金属元素在化学反应中容易失电子,形成什么离子?
碱金属元素在化学反应中容易失电子,形成什么离子?
他们都还可以作什么剂? yuwen18231年前1
yuwen18231年前1 -
 cyy0530 共回答了19个问题
cyy0530 共回答了19个问题 |采纳率84.2%都可以作为还原剂,失电子后形成金属阳离子.1年前查看全部
- 下列关于碱金属元素的原子结构和性质的叙述不正确的是 a碱金属原子最外层都只有1个电子,在化学反应中...
下列关于碱金属元素的原子结构和性质的叙述不正确的是 a碱金属原子最外层都只有1个电子,在化学反应中...
下列关于碱金属元素的原子结构和性质的叙述不正确的是
a碱金属原子最外层都只有1个电子,在化学反应中容易失去
b碱金属单质都是强还原剂
c碱金属单质都能在氧气里燃烧生成过氧化物
d碱金属单质都能与水反应生成碱 audia6tdi1年前3
audia6tdi1年前3 -
 胡日日 共回答了14个问题
胡日日 共回答了14个问题 |采纳率100%C、错误,锂在氧气中燃烧产物是氧化锂.Li满足对角线规则,性质与Mg相似,产物是Li2O,而不是Li2O2.因为Li是第二周期元素,金属性还不是特别强.1年前查看全部
- 下列关于碱金属元素的叙述正确的是()
下列关于碱金属元素的叙述正确的是()
A.碱金属的密度随着原子序数的递增逐渐减小
B.碱金属元素的最高价氧化物对应水化物的碱性依次增强
C.钾与氧气或水反应比钠与氧气或水反应剧烈,铷、铯的相应反应更剧烈
D.碱金属元素阳离子的氧化性随着原子序数的递增依次增强
@@@@化学很差,能看懂的设最佳 牡丹乔1年前1
牡丹乔1年前1 -
 feuerdragon 共回答了17个问题
feuerdragon 共回答了17个问题 |采纳率94.1%密度呈减小趋势(但钾反常)
碱金属的化学性质
2.都能与水反应,生成氢氧化物和氢气
3.均为强还原剂
从锂到铯递变规律:
1.与氧气反应越来越剧烈.
2.与水反应越来越剧烈.
3.金属性逐渐增强.1年前查看全部
- 下列有关碱金属元素性质的叙述中,正确的是.
下列有关碱金属元素性质的叙述中,正确的是.
A它们都是活泼金属,投入水中都能和水剧烈反应放出氢气
B除钠较软外,其余碱金属硬度较大不易被小刀切开
C在自然界中它们无游离态存在
D它们都是很强的还原剂,锂最强 我爱桃子111年前2
我爱桃子111年前2 -
 sue0 共回答了17个问题
sue0 共回答了17个问题 |采纳率100%选C
A中锂与水反应不剧烈
B中碱金属硬度较小,易被小刀切开
C中碱金属都是活泼金属,在自然界中它们无游离态存在
D中碱金属都是很强的还原剂,铯(放射性元素钫除外)最强1年前查看全部
- 有某碱金属的单质和其氧化物的混合物1.98g,加入适量的水使成为氢氧化物后得到氢氧化物为2.76g.求原来的碱金属元素使
有某碱金属的单质和其氧化物的混合物1.98g,加入适量的水使成为氢氧化物后得到氢氧化物为2.76g.求原来的碱金属元素使何种元素,其单质、氧化物的质量各为多少?
 梦日月1年前1
梦日月1年前1 -
 uu下的鱼313 共回答了22个问题
uu下的鱼313 共回答了22个问题 |采纳率90.9%原来的碱金属元素是Na,其单质是Na,质量是0.457125g,氧化物是Na2O,其质量是1.522875g.1年前查看全部
- 铷(Rb)为碱金属元素,其最高价氧化物对应的水化物属于( )
铷(Rb)为碱金属元素,其最高价氧化物对应的水化物属于( )
A. 强碱
B. 弱碱
C. 强酸
D. 弱酸 零点刺猬1年前4
零点刺猬1年前4 -
 smallyellowdog 共回答了19个问题
smallyellowdog 共回答了19个问题 |采纳率84.2%解题思路:元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强(但O、F除外).元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强(但O、F除外),Rb和Na属于同一主族元素,金属性比钠强,所以氢氧化铷的碱性大于氢氧化钠,氢氧化钠为强碱,则氢氧化铷也是强碱,故选A.
点评:
本题考点: 碱金属的性质.
考点点评: 本题考查了元素周期律,明确同一主族元素性质的相似性和递变性是解本题关键,根据元素周期律采用对比的方法分析解答,题目难度不大,1年前查看全部
- 有关元素周期表的几个小问题1.“最高价为+6价的元素一定是主族元素”,为什么不对?可以举特例吗?2.“在碱金属元素中,所
有关元素周期表的几个小问题
1.“最高价为+6价的元素一定是主族元素”,为什么不对?可以举特例吗?
2.“在碱金属元素中,所有碱金属的氧化物均为碱性氧化物”,为什么不对?
3.“虽然自然界含钾的物质均易溶于水,但土壤中钾含量太少,故需施用钾肥”,为什么不对? 用户名5461年前5
用户名5461年前5 -
 柳御寒 共回答了13个问题
柳御寒 共回答了13个问题 |采纳率84.6%1.铁:高铁酸盐如Na2FeO4
2.碱金属的氧化物还有过氧化物(Na2O2),超氧化物(KO3)),臭氧化物(KO3)
3.自然界含钾的物质均易溶于水错误,钾长石主要成分(KAlSi3O8)为难溶物1年前查看全部
- 碱金属元素中沸点最低的是哪个
 ckrym1年前1
ckrym1年前1 -
 为人父 共回答了18个问题
为人父 共回答了18个问题 |采纳率88.9%锂钠钾铷铯钫
如果不考虑不稳定的放射性元素钫
那么熔点最低的就是铯Cs1年前查看全部
- 关于碱金属元素的几个小问题.1.碱金属与水反应(碱金属用R表示)2.碱金属与盐酸、稀硫酸反应(离子方程式)
 beyond_yin1年前2
beyond_yin1年前2 -
 shgfq 共回答了12个问题
shgfq 共回答了12个问题 |采纳率83.3%碱金属是指第一主族的金属元素
1.碱金属与水反应(碱金属用R表示) :2R + 2H2O == 2ROH + H2(气体)
2.碱金属与盐酸、稀硫酸反应(离子方程式) :2R + 2H+ == 2R+ + H2(气体)1年前查看全部
大家在问
- 1呼吸机叹气(SIGH)功能有什么意义和用处?
- 2有没有人帮我写一篇作文啊.面对挫折,议论文.800字左右.
- 3化学高一题,求解答,要详细过程,谢了
- 4英语中much跟more能连在一起用吗
- 5不等式应用题某商品推销员有两种计酬方案:甲方案月底薪1000元,推销商品按销售额提成0.2%,乙方按月底新1500元,推
- 6自然数a除以自然数b,商是18,没有余数,a与b的最小公倍数是 ()最大因数是多少
- 7解不等式:log2(x^2-1)≤1
- 8设z=f(x,y) 由方程sin z-xyz=0 所确定的具有连续偏导数的函数 ,求dz
- 9以知x的绝对值是5,y²的平方根是4,且x-y的绝对值=x-y,求x+y的平方根
- 10已知α .β是方程χ^-2χ-4=0的两实数根,求α3+8β+6的值(提示:α是方程的根,代入可得α^=2α+4,利用这
- 11mum,a lot of,dad,purse,exciting的近义词
- 12若A=x-3分之x²+6x+9,B=x²-6x+9分之x+3,若x=x分子一,求M=A×B,N=A÷
- 13文具盒里的争吵 作文
- 14请用一元一次方程或算术法解决问题,需要一步一步详细解释.甲、乙两个旅行团去某景点旅游,该景点的票价因人数不同而有所变化:
- 15— What __________ is Maria in now?

