“酒是陈的香”的原因之一是储存过程中生成了有香味的酯。实验室用下图所示装置制取乙酸乙酯。 (1)试管a中生成乙酸乙酯的化
 vera-zjy2022-10-04 11:39:541条回答
vera-zjy2022-10-04 11:39:541条回答| “酒是陈的香”的原因之一是储存过程中生成了有香味的酯。实验室用下图所示装置制取乙酸乙酯。 |
 |
| (1)试管a中生成乙酸乙酯的化学反应方程式是 。 (2)试管b中盛放的试剂是 溶液,试管b中的导管不伸入液面下的原因是 。试管b中发生反应的化学方程式是 。 (3)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有( 填序号) 。 ①单位时间里,生成1mol 乙酸乙酯,同时生成1mol 水 ②单位时间里,生成1mol 乙酸乙酯,同时生成1mol 乙酸 ③单位时间里,消耗1mol 乙醇,同时消耗1mol 乙酸 ④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化 |

已提交,审核后显示!提交回复
共1条回复
相关推荐
- 关于 酒是陈的香酒是陈的香 这个原理有解释是乙醇氧化得乙醛,氧化得乙酸,酯化得乙酸乙酯那么1.为什么陈酒中乙醛人服用不会
关于 酒是陈的香
酒是陈的香 这个原理有解释是
乙醇氧化得乙醛,氧化得乙酸,酯化得乙酸乙酯
那么
1.为什么陈酒中乙醛人服用不会中毒
2.为什么乙醇在密封条件下也能氧化得乙醛再得乙酸
3.可以详细描述关于乙醇到乙酸乙酯中间反应的大概时间么?(因为没有催化剂所以速度慢,所以想知道大概时间以制陈酒) 轻舞飞扬981年前2
轻舞飞扬981年前2 -
 烂8筒 共回答了15个问题
烂8筒 共回答了15个问题 |采纳率86.7%酒是陈的香 这个原理有解释是
乙醇氧化得乙醛,氧化得乙酸,酯化得乙酸乙酯
这个原理这么解释是没有错.乙醛中素中素那也得有个量啊,就自然氧化的那点量还不够让人中毒呢.
表观上我们看是密封的,但是那里有绝对密封的东西?大量的乙醇存在条件下,有少量的氧进行氧化,在很长的时候作用之下,从理论上讲也是有可能氧化得到乙酸的.
最后一个问题,可能要五粮液厂的人来回答了.
我只是给你说,我们喝的那个洒,不是一个单纯的乙醇和水的混合物,其中本身就含有一些酯类的东西.醇香,一个混合气味,单一的乙醇味是个新那的味.1年前查看全部
- (12分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。
(12分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式 。
(2)饱和碳酸钠溶液的主要作用是 。
(3)浓硫酸的作用是 与 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。 hfljy1年前1
hfljy1年前1 -
 eqmoo 共回答了22个问题
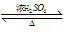
eqmoo 共回答了22个问题 |采纳率100%(1)CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O
CH 3 COOC 2 H 5 + H 2 O
(2)冷却,酯在其中的溶解度更小有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味
(3)催化剂 (4)倒吸 (5)分液
(1)实验室用乙酸和乙醇在浓硫酸的作用下通过酯化反应生成乙酸乙酯。
(2)由于产生的乙酸乙酯中含有挥发出的乙酸和乙醇,可用饱和碳酸钠溶液除去,其作用是酯在其中的溶解度更小有利于酯分离,除去粗产品中的乙酸和乙醇有利于闻到酯香味。
(3)因为酯化反应是可逆的,所以浓硫酸除起催化剂的作用外,还起吸水剂的作用。
(4)由于乙醇和乙酸都是和水互溶的,所以不能插入溶液中的目的是防止倒吸。
(5)乙酸乙酯不溶于水,分液即可实现分离。1年前查看全部
- (2013•济宁)俗话说“酒是陈的香”,白酒的主要成分是乙醇,把酒窖封存在地下窖藏几年后,其中的乙醇就和白酒中少量的乙醇
(2013•济宁)俗话说“酒是陈的香”,白酒的主要成分是乙醇,把酒窖封存在地下窖藏几年后,其中的乙醇就和白酒中少量的乙醇发生反应,生成一种有浓郁果香味、名叫乙酸乙酯(化学式为C4H8O2),的物质,上述反应速度较慢,窖藏时间越长,乙酸乙酯量越多,酒就越醇香.
阅读上面信息后回答:
(1)乙酸乙酯分子中C、H、O三种原子的个数比为______;
(2)乙酸乙酯中______元素的质量分数最大. aganepngyou1年前1
aganepngyou1年前1 -
 suining0102 共回答了18个问题
suining0102 共回答了18个问题 |采纳率100%解题思路:(1)根据1个乙酸乙酯分子的构成进行分析解答.
(2)根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析解答.(1)1个乙酸乙酯分子是由4个碳原子、8个氢原子和2个氧原子构成的,则乙酸乙酯分子中C、H、O三种原子的个数比为4:8:2=2:4:1.
(2)乙酸乙酯中碳原子的相对原子质量之和为12×4=48,氢原子的相对原子质量之和为1×8=8,氧原子的相对原子质量之和为16×2=32,碳元素的相对原子质量之和最大,则碳元素的质量分数最大.
故答案为:(1)2:4:1;(2)碳.点评:
本题考点: 元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- (16分)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回
(16分)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:

(1)写出试管a中发生的化学方程式:
。
(2)试管b中所盛的溶液为 ,其主要作用是 。
,其主要作用是 。
(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是 。
(4)该实验中,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯? (填“能”或“不能”)原因是

 。(不考虑原料损耗)。
。(不考虑原料损耗)。 tyson_l1年前1
tyson_l1年前1 -
 yihangci 共回答了21个问题
yihangci 共回答了21个问题 |采纳率85.7%1年前查看全部
- 酒,还是陈的香!人,亦如此 表达的人生哲理
 zxcvlkjlk3jlkfja1年前1
zxcvlkjlk3jlkfja1年前1 -
 不爱这么多 共回答了19个问题
不爱这么多 共回答了19个问题 |采纳率89.5%酒经过酝酿和发酵的时间越长,就越充分,就越熟,就更香!人生活时间越长,阅历就越丰富,性格就越稳重,为人处理就越完善.1年前查看全部
- “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式______
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
______.
(3)浓硫酸的作用是:①______;②______.
(4)饱和碳酸钠溶液的主要作用是______.
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止______.
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是______.
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是______.
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)______.
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化. 子悠1年前2
子悠1年前2 -
 蓝山咖啡0211 共回答了29个问题
蓝山咖啡0211 共回答了29个问题 |采纳率96.6%解题思路:(1)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(2)类比浓硫酸的稀释进行进行解答;
(3)浓硫酸起到了催化作用和吸水作用;
(4)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(5)根据导管伸入液面下可能发生倒吸分析;
(6)分离互不相溶的液体,可用分液的方法分离;
(7)液体加热要加碎瓷片,防止暴沸;
(8)当可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率等于化学计量数之比(不同物质),各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化.(1)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+C2H5OH
浓硫酸
△CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH
浓硫酸
△CH3COOC2H5+H2O;
(2)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,
故答案为:先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸;
(3)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,故答案为:催化作用;吸水作用;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:酯在其中的溶解度更小,有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味;
(5)导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:倒吸;
(6)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,防止暴沸,故答案为:防止暴沸;
(8)①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间里,生成1mol乙酸乙酯表示正反应速率,生成1mol乙酸表示逆反应速率,等于化学计量数之比,说明到达平衡,故②正确;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④正反应的速率与逆反应的速率相等,说明到达平衡状态,故④正确;
⑤混合物中各物质的浓度不再变化,反应到达平衡状态,故⑤正确;
故选:②④⑤.点评:
本题考点: 乙酸乙酯的制取.
考点点评: 本题考查乙酸乙酯的制备,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.1年前查看全部
- (1)“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图装置制取乙酸乙酯.
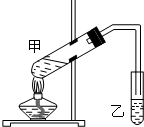 (1)“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图装置制取乙酸乙酯.
(1)“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图装置制取乙酸乙酯.
回答下列问题:
①插入试管乙的导气管不插入液面以下,其原因为______.
②试管乙中用于接收乙酸乙酯的常用溶液为______.
③做此实验时,有时还向作反应容器的试管里加入几块碎瓷片,其目的是______.
(2)某同学做实验时发现,常温下完全相同的铝片与c(H+)相同、体积相同的稀盐酸和稀硫酸分别发生反应,盐酸生成氢气的速率较快.该同学对产生此现象的原因提出了多种假设,请你试写出其中的两种:
假设①:______;
假设②:______.
设计简单实验验证你的假设①是否正确______. jyurynmn72041年前1
jyurynmn72041年前1 -
 david_sss 共回答了14个问题
david_sss 共回答了14个问题 |采纳率92.9%解题思路:(1)①乙酸和乙醇易溶于水,属于导管伸入液面下可能发生倒吸;
②饱和碳酸钠溶液能够吸收乙酸和乙醇,且乙酸乙酯在在饱和碳酸钠溶液中的溶解度较小;
③乙酸、乙醇和浓硫酸的混合液体在加热时容易发生暴沸现象;
(2)根据题干信息可知,铝片和 氢离子浓度相同,不同的是氯离子与硫酸根离子,据此提出假设;证明氯离子能够加快反应速率,设置对比试验,取两支试管,都加入同体积、同浓度的稀硫酸,然后一支试管加入氯化钠,另一个不加入氯化钠,再分别加入相同大小的铝片,根据现象进行判断.(1)①导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:防止倒吸;
②制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、便于闻乙酸乙酯的香味,降低乙酸乙酯的溶解度,便于分层,
故答案为:饱和碳酸钠溶液;
③给混合液体加热时可能发生暴沸现象,向作反应容器的试管里加入几块碎瓷片的目的是防止暴沸,
故答案为:防止暴沸;
(2)常温下完全相同的铝片与c(H+)相同、体积相同的稀盐酸和稀硫酸分别发生反应,盐酸生成氢气的速率较快,影响反应速率的因素只能为氯离子和硫酸根离子,所以假设1为:Cl-能加快铝与酸反应的速率;假设2:SO42-能减慢铝与酸反应的速率;证明假设1的方法为:分别在两支试管中加入同体积同浓度的稀硫酸,并在其中一支试管中加入适量氯化钠固体,同时加入完全相同的两块铝片,对比反应速率,若加入氯化钠的试管中反应速率较快,则假设①正确,否则不正确,
故答案为:Cl-能加快铝与酸反应的速率;SO42-能减慢铝与酸反应的速率;分别在两支试管中加入同体积同浓度的稀硫酸,并在其中一支试管中加入适量氯化钠固体,同时加入完全相同的两块铝片,对比反应速率,若加入氯化钠的试管中反应速率较快,则假设①正确,否则不正确.点评:
本题考点: 乙酸乙酯的制取;化学反应速率的影响因素.
考点点评: 本题考查了乙酸乙酯的制取、化学反应速率的影响因素,题目难度中等,注意明确乙酸乙酯的制取原理,掌握浓硫酸、饱和碳酸钠溶液在反应中作用;掌握影响化学反应速率的因素.1年前查看全部
大家在问
- 1E在一维空间上上且可测,mE>0,求证E有不可测的子集.
- 2膜电位计是什么?怎么用它测定菌根细胞膜的点位变化?
- 3Singapore Flyer was launched in 2008 and states to hold the
- 410.5的3分之2减去,88除以4分之11的商,差是多少?
- 51982年,英国的《自然》杂志发表了一篇文章:有两个美国实验小组共同研制出转基因超级鼠,也就是把小鼠变成大鼠.转基因鼠比
- 6资料显示:人体中的血液占体重的1/13,血液里2/3是水,李叔叔体重是65千克,他的血液中大约含水多少千克?
- 7曲线运动2 (20 16:19:45)
- 8关于如何解三角函数类的题目.求经验和方法!
- 9在一个等腰三角形中底边的长度是腰的一半这个等腰三角形的周长为50厘米,那么它的底边和腰的长分别是多少
- 10重庆市江北区洋河中路208号怎么用英语写?
- 11(2009•江苏)如图为大陆西岸四个地点的地理位置示意图.读图回答19~20题.
- 12AutoCAD的符号怎么打啊?cad建筑制图中比如标高正负零是用%%p来打出来,哪位前辈有关于建筑的符号代码大全,比如一
- 13英语 任务型阅读Celine Dion (席琳.迪翁) was born in a small town in Mont
- 14(1+24+25)x(24+25+26)-(1+24+25+26)x(24+25)简便计算
- 15初一(上海牛津版)英语问题because、as...as、make good use of、 different fro