谁会这道题:高性能的电子计算机能
 fist13392022-10-04 11:39:541条回答
fist13392022-10-04 11:39:541条回答| 高性能的电子计算机能进行一系列复杂的运算,因此,有人认为计算机是有意识的.从哲学上看,这一观点否认了 | [ ] |
| A.意识是大脑的机能 B.意识能够反映客观事物 C.意识对人脑的依赖 D.世界上没有不可认识的事物 |

已提交,审核后显示!提交回复
共1条回复
 13834180023 共回答了20个问题
13834180023 共回答了20个问题 |采纳率95%- C
- 1年前
相关推荐
- 火箭使用的推进剂是高性能的,无污染的液氧/煤油和液氧/液氢.
火箭使用的推进剂是高性能的,无污染的液氧/煤油和液氧/液氢.
下列对该推进剂发生反应的叙述正确的是( )
A.发生的反应是复分解反应
B.液氧和液氢反应时,氢被还原
C.液氧和煤油、液氢反应时,液氧为还原剂
D.反应生成的水是还原产物 疯求狂1年前1
疯求狂1年前1 -
 CCICC1 共回答了13个问题
CCICC1 共回答了13个问题 |采纳率92.3%D1年前查看全部
- (2011•常州三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,
(2011•常州三模)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.

已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
物质 Fe(OH)3 Fe(OH)2 Mn(OH)2 开始沉淀pH 2.7 7.6 8.3 完全沉淀pH 3.7 9.6 9.8
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO42Fe3++SO2+2H2O=2Fe2++SO42-+4H+.物质 MnS CuS PbS Ksp 2.5×10-13 6.3×10-36 8.0×10-28
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可) gmkgjmkjmg1年前1
gmkgjmkjmg1年前1 -
 zzjoyzzz 共回答了16个问题
zzjoyzzz 共回答了16个问题 |采纳率87.5%解题思路:(1)软锰矿浆是二氧化锰,MnSO4溶液水解显酸性,Fe3+将SO2氧化为硫酸;
(2)MnO2可将Fe2+氧化成Fe3+,Fe3+完全沉淀的pH较Fe2+低;
(3)碳酸钙与溶液中的H+反应,使溶液中的PH升高;
(4)加入一种反应物能提高另一种反应物的装化率;MnCO3,NH4HCO3与酸反应;
(5)锰矿与煤炭粉混合,焙烧生成二氧化硫,污染空气.(1)软锰矿浆是二氧化锰,MnSO4溶液水解先酸性,根据2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.Fe3+可将SO2氧化为硫酸,故答案为:小;工业制备硫酸;
(2)MnO2可将Fe2+氧化成Fe3+,Fe3+完全沉淀的pH较Fe2+低;故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe2+ 转变为Fe3+,Fe3+完全沉淀的pH较低(或Fe3+更易沉淀);
(3)碳酸钙与溶液中的H+反应,使溶液中的PH升高,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀,故答案为:与溶液中的酸反应,使溶液中的Fe3+、Al3+转化为氢氧化物沉淀;
(4)加入稍过量的NH4HCO3能提高MnSO4的装化率,使MnCO3沉淀完全,溶液的pH不过低,H+可与MnCO3,NH4HCO3反应,故答案为:使MnCO3沉淀完全;MnCO3沉淀量少,NH4HCO3与酸反应.(或MnCO3、NH4HCO3与酸反应溶解);
(5)锰矿与煤炭粉混合,焙烧生成二氧化硫,污染空气,而工艺A不仅不产生二氧化硫,且能生产硫酸,故答案为:节约能源、治理含SO2的工业废气等.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查制备实验方案的设计,注意一些不常见方程式的书写.1年前查看全部
- 英语翻译摘要:碳纤维的品质在很大程度上取决于原丝,干燥致密化是碳纤维原丝制备中一道重要工艺.本文介绍了制取高性能碳纤维原
英语翻译
摘要:碳纤维的品质在很大程度上取决于原丝,干燥致密化是碳纤维原丝制备中一
道重要工艺.本文介绍了制取高性能碳纤维原丝的关键设备之一——干燥机(组)
的结构组成及研究概况,对主机主要零部件:辊筒轴部件受力情况进行了分析研
究;对保温部件进行了结构设计;对润滑方式和电气控制方式进行了简单分析和选
择.对碳纤维干燥设备有了进一步创新.
关键词:碳纤维 保温 润滑 干燥机(组)
不要翻译器啊~ 大双心湖1年前3
大双心湖1年前3 -
 不做高人才怪 共回答了14个问题
不做高人才怪 共回答了14个问题 |采纳率92.9%Abstract:The quality of carboform highly depends on the protofilament,drying densification is a significant part in the process of carboform protofilament preparation.The report will provide an overiew of the instrument,which is the crucial tool of making up high quality carboform protofilament——the drier,about its construction and relevant researches by far.Additionally,the report will provide more information on the main engine's spare parts,and analyze the intensity of bearing in roller shaft; also as the design of construction of temperature-maintaining spare parts; the methods of how to analyse and choose the means of lubricating system and electric control.The final part will be focus on the futher innovation of carboform drying equipment.
Key words:carboform,thermal insulation,lubrication,drie1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为Co x Fe 3-x O 3+x 的化合物,已知氧为-2价
录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为Co x Fe 3-x O 3+x 的化合物,已知氧为-2价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为______,铁的化合价为______,钴的化合价为______.  输了也要投io1年前1
输了也要投io1年前1 -
 purple_puck 共回答了22个问题
purple_puck 共回答了22个问题 |采纳率95.5%通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
考虑x≠0,符合要求的应是Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1,
故答案为:1;+3价;+2价.1年前查看全部
- (2014•湖南一模)利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料
(2014•湖南一模)利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3).其中一种工业流程如下:

已知某些物质完全沉淀的pH如下表:
回答下列问题:沉淀物 Fe(OH)3 Al(OH)3 Cu(OH)2 Mn(OH)2 CuS MnS MnCO3 沉淀完全时的pH 3.7 5.2 6.4 9.8 ≥0 ≥7 ≥7
(1)过程②中,所得滤渣的主要成分是______.
(2)过程③中,发生反应的离子方程式是______.
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是______.
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2
2MnO2+2CO2.加热 .
现在空气中加热460.0g MnCO3,得到332.0g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是______(用百分数表示,小数点后保留1位). 我是耳环1年前1
我是耳环1年前1 -
 victor_cheng 共回答了16个问题
victor_cheng 共回答了16个问题 |采纳率100%解题思路:(1)根据表中各物质完全沉淀需要的pH判断滤渣的主要成分;
(2)结合表中数据可知,pH≥7时硫化锰才沉淀完全,而硫化铜在pH≥0已经沉淀完全,所以加入硫化锰目的是除去铜离子,据此写出反应的离子方程式;
(3)根据产生的气体能够使澄清石灰水变浑浊可知,该气体为二氧化碳,反应物为碳酸氢根离子和锰离子,反应产物为碳酸锰、二氧化碳气体和水,据此写出反应的离子方程式;
(4)460.0g MnCO3的物质的量为4mol,设备氧化生成二氧化锰的物质的量为xmol,则没有被氧化的氧化锰(4-x)mol,根据332.0g产品列式计算出二氧化锰的物质的量,再计算出二氧化锰的含量.(1)根据表中数据可知,氢氧化铝完成沉淀的pH为5.2,氢氧化铁完全沉淀的pH为3.7,所以调节pH在5.2,Fe2+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在,即滤渣的成分为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(2)CuS在pH≥0时完全沉淀,而MnS在pH≥7时完全沉淀,所以加入MnS是为了使其中Cu2+产生CuS沉淀除去,故搅拌目的是使MnS 与 Cu2+快速、充分反应,反应的离子方程式:MnS+Cu2+=Mn2++CuS↓,
故答案为:MnS+Cu2+=Mn2++CuS↓;
(3)生成的气体J可使澄清石灰水变浑浊,该气体为二氧化碳,Mn2+和加入的HCO3-反应,产生CO2气体和MnCO3沉淀,反应的离子方程式:Mn2++2HCO3-=MnCO3+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3+CO2↑+H2O;
(4)MnCO3受热分解为MnO,MnO部分氧化为MnO2,产品中杂质有MnO,460.0 gMnCO3的物质的量为:[460.0g/115g/mol]=4mol,受热产生4molMnO,设产生MnO2物质的量为xmol,即有xmolMnO氧化,剩余MnO为(4-x)mol,产物的总质量为:(4-x)mol×71g/mol+xmol×87g/mol=332g,解得x=3,则MnO2的质量分数=[3mol×87g/mol/332g]×100%=78.6%,
故答案为:78.6%.点评:
本题考点: 常见离子的检验方法.
考点点评: 本题考查了铁盐和亚铁盐的相互转变、常见离子的检验方法、难溶电解质的溶解平衡及离子方程式的书写,题目难度中等,解题关键是合理分析题中生成流程及表中离子完全沉淀时的数据的含义,试题培养了学生分析、理解能力及灵活应用所学知识的能力.1年前查看全部
- A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于第________族,与A同族但相对原子质量比A小的元素B的原子结构示意图为________,A与B在原子的电子层结构上的相同点是_______________________。
(2)易与C发生化学反应的酸是______ (填名称),反应的化学方程式是_______。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学方程式:______________________________________,___________________________________________________________________。
②要将NaOH高温熔化,下列坩埚中不可选用的是_________________________。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(4)100 g C与石灰石的混合物充分反应后生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。 ccwenwen1年前1
ccwenwen1年前1 -
 oldyeah 共回答了12个问题
oldyeah 共回答了12个问题 |采纳率83.3%(1)ⅣA 最外层均有4个电子,最内层均有2个电子
最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO 2 +4HF=SiF 4 ↑+2H 2 O
(3)①SiO 2 +Na 2 CO 3 Na 2 SiO 3 +CO 2 ↑
Na 2 SiO 3 +CO 2 ↑
Na 2 SiO 3 +CO 2 +H 2 O=Na 2 CO 3 +H 2 SiO 3 ↓
②A、B、C
(4)50%
(1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,比硅相对原子质量小的同族元素为碳。
(2)C为SiO 2 ,能与SiO 2 反应的酸只有氢氟酸。
(3)SiO 2 与NaOH反应生成Na 2 SiO 3 和H 2 O,故含SiO 2 的材料(普通玻璃、石英玻璃)以及Al 2 O 3 等都能与NaOH在高温下反应,故不能用以上材质的坩埚熔化NaOH。
(4)根据反应SiO 2 +CaCO 3 CaSiO 3 +CO 2 ↑,
CaSiO 3 +CO 2 ↑,
CaCO 3 CaO+CO 2 ↑可知,无论SiO 2 和CaCO 3 是否恰好完全反应,均有关系式CaCO 3 ~CO 2 存在,故n(CaCO 3 )=n(CO 2 )="0.5" mol,m(CaCO 3 )="50" g。
1年前查看全部
CaO+CO 2 ↑可知,无论SiO 2 和CaCO 3 是否恰好完全反应,均有关系式CaCO 3 ~CO 2 存在,故n(CaCO 3 )=n(CO 2 )="0.5" mol,m(CaCO 3 )="50" g。
1年前查看全部
- 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)在元素周期表中,A位于______族,与A同族但相对原子质量比A小的元素B的原子结构示意图为______,A与B在原子的电子层结构上的相同点是______.
(2)易与C发生化学反应的酸是______,反应的化学方程式是______.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D和F的化学反应方程式:SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
②要将纯碱高温熔化,下列坩埚中可选用的是______.
A.普通玻璃坩埚B.石英玻璃坩埚C.氧化铝坩埚D.铁坩埚. KK35211年前1
KK35211年前1 -
 oldliu-1 共回答了9个问题
oldliu-1 共回答了9个问题 |采纳率77.8%解题思路:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)Si位于第三周期第ⅣA族;与A同族但相对原子质量比A小的元素B为C;B元素的原子最外层电子数与Si相同,二者最外层电子数相同;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水;
(3)①B元素的原子最外层电子数与Si相同,二者最外层电子数相同,相对原子质量比A小的元素,则B为C,①由题目信息可知,二氧化碳与碳酸钠在高温条件下反应生成硅酸钠与二氧化碳;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应.含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,(1)Si位于第三周期第ⅣA族;与A同族...
点评:
本题考点: 无机物的推断.
考点点评: 本题考查无机物推断、元素化合物性质,重在考查分析能力和综合应用知识的能力,难度不大,注意对基础知识的掌握.1年前查看全部
- 像用的高性能磁粉,主要材料之一是由钴(Co)、铁、氧三种元素组成的化合物,其化学式是Cox Fe3
像用的高性能磁粉,主要材料之一是由钴(Co)、铁、氧三种元素组成的化合物,其化学式是CoxFe3-xO3+x、其中钴和铁均可能呈+2或+3价,则 x的值是( )
A.1
B.2
C.3
D.4 骒不是ff1年前1
骒不是ff1年前1 -
 panchunyan 共回答了14个问题
panchunyan 共回答了14个问题 |采纳率92.9%解题思路:根据在化合物中正负化合价代数和为零,结合CoxFe3-xO3+x的化学式进行解答本题.通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
氧元素显-2价,若Co的化合价为+3,Fe的化合价为+2,利用化合物中正负化合价的代数和为零,则(+3)×x+(+2)×(3-x)+(-2)×(3+x)=0,解得x=0,该可能不符合题意.
氧元素显-2价,若Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算化学式中指定数值的方法即可正确解答.1年前查看全部
- 一种高性能磁粉,广泛用于制造软磁盘其主要成分的化学式为COxFe3-xO3+x的化合物
一种高性能磁粉,广泛用于制造软磁盘其主要成分的化学式为COxFe3-xO3+x的化合物
一种高性能磁粉,广泛用于制造软磁盘其主要成分的化学式为COxFE3-xQ3+x的化合物,已知氧为-2价,Co和铁可能呈+2或+3价,且上述化合物中,每种元素只有一种化合价,则x的值为?铁的化合价为?co的化合价为? smallpig8881年前2
smallpig8881年前2 -
 真的是想不通 共回答了24个问题
真的是想不通 共回答了24个问题 |采纳率95.8%若Co和铁均+2价
化合价代数和=2x+2(3-x)-2(3+x)应等于0
x=0舍
若Co和铁均+3价
3x+3(3-x)-2(3+x)=0
x=1.5舍
若Co+2,铁+3
2x+3(3-x)-2(3+x)=0
x=1
若Co+3,铁+2
3x+2(3-x)-2(3+x)=0
x=0舍
所以Co+2,铁+3,x=11年前查看全部
- A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物B可用于制造高性能的现代通讯材料--光导纤维,B与烧碱反应生
A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物B可用于制造高性能的现代通讯材料--光导纤维,B与烧碱反应生成含A元素的化合物D.
(1)易与B发生化学反应的酸是______(填化学名称),该化学反应的重要应用是______.
(2)将B与纯碱混合,高温熔融时也发生化学反应生成D,同时还生成氧化物C;
①写出生成D和C的化学反应方程式:SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
②要将纯碱高温熔化,下列坩埚中不______可选用的是______.
A.普通玻璃坩埚B.石英玻璃坩埚C.氧化铝坩埚D.铁坩埚
③将过量的C通入D的溶液中发生反应的化学方程式是:______.
(3)B与石灰石、B与纯碱发生相似的化学反应.100g B与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是______.
(4)A的单质与烧碱溶液和铝的单质与烧碱溶液发生相似的化学反应.相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为______. 5GJ1MPA1年前1
5GJ1MPA1年前1 -
 mrfs 共回答了23个问题
mrfs 共回答了23个问题 |采纳率100%(1)氢氟酸能与二氧化硅反应与生成四氟化硅气体,用氢氟酸作玻璃的刻蚀剂和不能使用玻璃容器盛装氢氟酸,都属于SiO2+4HF═SiF4↑+2H2O的重要应用,故答案为:氢氟酸;用氢氟酸作玻璃的刻蚀剂;
(2)①SiO2与Na2CO3反应生成的Na2SiO3与CO2的物质的量之比是1:1,化学方程式:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑;
②SiO2与纯碱在高温下反应生成硅酸钠和二氧化碳,原因是难挥发性酸酐制取挥发性酸酐,由于碳酸酸性比硅酸强,则二氧化碳通入硅酸钠溶液中生成硅酸沉淀和碳酸钠,由于普通玻璃坩埚、石英玻璃坩埚、氧化铝坩埚等在高温下都能与碳酸钠反应而使坩埚炸裂,则应用铁坩埚,故答案为:ABC;
③过量CO2通入Na2SiO3溶液中生成的物质是NaHCO3而不是Na2CO3,反应的化学方程式是:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3,
故答案为:Na2SiO3+2CO2+2H2O═H2SiO3↓+2NaHCO3;
(3)首先要仿照Na2CO3与SiO2的化学反应确定CaCO3与SiO2的化学反应,然后要找出CaCO3+SiO2
高温
.
CaSiO3+CO2↑和CaCO3
高温
.
CaO+CO2↑两个化学反应中n(CaCO3)与n(CO2)的关系:n(CaCO3)=n(CO2).
生成标准状况下CO2气体11.2L,其物质的量=[11.2L/22.4L/mol]=0.5mol,
m(CaCO3)=0.5mol×100g/mol=50g
样品中碳酸钙的质量分数:[50g/100g]×100%=50%
故答案为:50%;
(4)根据Si+2NaOH+H2O═Na2SiO3+2H2↑和2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的A的单质与铝的单质分别跟足量的烧碱溶液反应,生成的气体在同温同压下的体积之比为4:3,故答案为:4:3.1年前查看全部
- 录象用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x的化合物.已知其中氧元素为-2价、钴(
录象用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x的化合物.已知其中氧元素为-2价、钴(Co)和铁可能呈现+2价或+3价.且上述化合物中,每种元素只有一种化合价,则x值为______,铁的化合价为______,钴的化合价为______.
 善念1年前1
善念1年前1 -
 小小美食家 共回答了19个问题
小小美食家 共回答了19个问题 |采纳率89.5%解题思路:根据由三种元素组成的化合物的化学式为CoxFe3-xO3+x,利用已知元素的化合价“已知其中氧元素为-2价、钴(Co)和铁可能呈现+2价或+3价”及“化合物中正负化合价的代数和为0”来解答.通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
因为考虑x≠0,符合要求的应是Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1,
故答案为:1;+3;+2点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求原子个数及元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)B元素的原子最外层电子数与A相同,但相对原子质量比A小的元素,A与B在原子的电子层结构上的相同点是______.
(2)写出C与氢氟酸发生反应的化学方程式是______.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出C与纯碱混合高温熔融时生成D和E的化学反应方程式:______.
②要将纯碱高温熔化,下列坩埚中可选用的是______.
A.普通玻璃坩埚B.石英玻璃坩埚C.铁坩埚D.瓷坩埚. 刺毛球1年前1
刺毛球1年前1 -
 76499766 共回答了17个问题
76499766 共回答了17个问题 |采纳率94.1%含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO 2 ,C与烧碱反应生成含A元素的化合物D为Na 2 SiO 3 ,
(1)B元素的原子最外层电子数与Si相同,二者最外层电子数相同,均有4个电子,
故答案为:最外层均有4个电子;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水,反应方程式为:SiO 2 +4HF═SiF 4 ↑+2H 2 O,
故答案为:SiO 2 +4HF═SiF 4 ↑+2H 2 O;
(3)B元素的原子最外层电子数与Si相同,二者最外层电子数相同,相对原子质量比A小的元素,则B为C,①由题目信息可知,二氧化碳与碳酸钠在高温条件下反应生成硅酸钠与二氧化碳,反应方程式为:SiO 2 +Na 2 CO 3
高温
.
Na 2 SiO 3 +CO 2 ↑,
故答案为:SiO 2 +Na 2 CO 3
高温
.
Na 2 SiO 3 +CO 2 ↑;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应,故选C,
故答案为:C.1年前查看全部
- 1.高性能磁带上的磁粉主要组成是CoxFe3-xO4的化合物,已知其中的Co的化合价可能是+2或+3,铁元素的化合价为+
1.高性能磁带上的磁粉主要组成是CoxFe3-xO4的化合物,已知其中的Co的化合价可能是+2或+3,铁元素的化合价为+3,则该化合物的化学式为____.
2.以晒盐后的海水(含氯化镁)和石灰石为原料制取氢氧化镁.写出有关反应的化学方程式:
1.______________
2._______________
3.____________
3.如何除去氢氧化钠中的碳酸钠?用什么试剂,方程式. 天师之手1年前1
天师之手1年前1 -
 nico丑丑 共回答了17个问题
nico丑丑 共回答了17个问题 |采纳率94.1%1,若钴是+2价,则2x+3(3-x)=8,x=1
若钴为+3价,则3x+3(3-x)=8,无解
所以化学式为CoFe2O4
2,CaCO3==高温==CaO+CO2↑
CaO+H2O==Ca(OH)2
Ca(OH)2+MgCl2==Mg(OH)2↓+CaCl2
3,加氢氧化钙溶液
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓1年前查看全部
- 下列化合物含+7价元素的是A.KCIO3 B.K2MnO4C.H3PO4D.KMnO4录象用的高性能磁粉,主要材料之一是
下列化合物含+7价元素的是
A.KCIO3
B.K2MnO4
C.H3PO4
D.KMnO4
录象用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe3-xO3+x(x,3-x,3+x表示原子个数)的化合物.已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价,则x值为_______,铁的化合价为________,钴的化合价为_______. 77285211年前4
77285211年前4 -
 跟着猫走路 共回答了23个问题
跟着猫走路 共回答了23个问题 |采纳率87%1.D 由化合价知识可知 MnO4 -1价 O4 是-8价 所以 Mn 7价
2.依题易可知 X>0 3-X>0 3+X>0 所以01年前查看全部
- 微型化录音、录像机的高性能磁带中含有的磁性材料之一是化合物CoFe2O4,其中钴(Co)和铁的化合价只有一种,可能是+2
微型化录音、录像机的高性能磁带中含有的磁性材料之一是化合物CoFe2O4,其中钴(Co)和铁的化合价只有一种,可能是+2价或+3价,试确定化合物中钴的化合价是______,铁的化合价是______.
 sstxgt3331年前1
sstxgt3331年前1 -
 晋F89898 共回答了18个问题
晋F89898 共回答了18个问题 |采纳率88.9%解题思路:根据在化合物中正负化合价代数和为零,结合CoFe2O4的化学式进行解答本题.若钴和铁元素的化合价相同时,即都为+2价时,则CoFe2O4中化合价的代数和为:(+2)+(+2)×2+(-2)×4≠0;都为+3价时,CoFe2O4中化合价的代数和为:(+3)+(+3)×2+(-2)×4≠0,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,CoFe2O4中化合价的代数和为:(+3)+(+2)×2+(-2)×4≠0,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,CoFe2O4中化合价的代数和为:(+2)+(+3)×2+(-2)×4=0,符合要求.
故填:+2;+3.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度较大,掌握利用化合价的原则计算指定元素的化合价的方法是正确解答的关键.1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为Co x Fe (3-x) O (3+x) 的化合物。已知氧为
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为Co x Fe (3-x) O (3+x) 的化合物。已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价。则x值为______,铁的化合价______,钴的化合价________。
 fenni51年前1
fenni51年前1 -
 asdgkhawkjrggh 共回答了11个问题
asdgkhawkjrggh 共回答了11个问题 |采纳率90.9%1 +3价 +2价
假设Co为+3价,则铁为+2价。则有3x+2(3-x)-2(3+x)=0(化合价代数和为零),解x=0(无Co),不合理。 (据此即可判断应该是Co为+2价,铁为+3价,2x+3(3-x)-2(3+x)=0,解得x=1);当然,如果开始假设 Co为+2价,则铁为+3价,则可直接得出结果。1年前查看全部
- 氢氧燃料电池是一种高性能电池,总反应为2 H 2 + O 2 =" 2" H 2 O,电解质溶液为KOH溶液,下列有关该
氢氧燃料电池是一种高性能电池,总反应为2 H 2 + O 2 =" 2" H 2 O,电解质溶液为KOH溶液,下列有关该电池的叙述中不正确的是( )
A.H 2 为负极,O 2 为正极 B.工作时电解质溶液的PH不断增大 C.负极反应:2H 2 -4e - +4OH - =4H 2 O D.正极反应:O 2 + 4e - +2 H 2 O=4OH -  小芹芹1年前1
小芹芹1年前1 -
 笑看天下粽 共回答了25个问题
笑看天下粽 共回答了25个问题 |采纳率92%B
A正确,燃料电极工作时,燃料进入负极,氧气进入正极;B错,工作时产生水,稀释了KOH,使溶液碱性减小,即PH不断减小;C正确,负极反应:2H 2 -4e - +4OH - =4H 2 O;D正确,O 2 + 4e - +2 H 2 O=4OH -1年前
81年前查看全部
- 近年来,中国铁路采用高性能动车组不断进行列车大提速。当列车高速经过时,如果人离铁道太近,很容易被吸进铁道,应特别注意安全
近年来,中国铁路采用高性能动车组不断进行列车大提速。当列车高速经过时,如果人离铁道太近,很容易被吸进铁道,应特别注意安全。请你用学过的物理知识对这个现象进行解释。  lily87801年前1
lily87801年前1 -
 舞之后 共回答了15个问题
舞之后 共回答了15个问题 |采纳率100%这是因为列车与人之间的空气流速加大,压强减小;而人背着列车的一侧空气流速较小,压强较大。因此人向着列车的一侧受到空气的压力较小,背着列车的一侧受到空气的压力较大,在这两个压力的共同作用下,人很容易被吸进铁道,应特别注意安全。1年前查看全部
- 近年来,中国铁路采用高性能动车组不断进行列车大提速.当列车高速经过时,如果人离铁道太近,很容易被吸进铁道,应特别注意安全
近年来,中国铁路采用高性能动车组不断进行列车大提速.当列车高速经过时,如果人离铁道太近,很容易被吸进铁道,应特别注意安全.请你用学过的物理知识对这个现象进行解释.  sky1759287821年前1
sky1759287821年前1 -
 坐禅的人 共回答了20个问题
坐禅的人 共回答了20个问题 |采纳率100%答:人离高速列车比较近时,高速列车的速度很大,人和高速列车的之间的空气流动速度很大,压强小,人外侧的压强不变,人受到外侧压强大于人内侧受到的压强,人在较大的压强差作用下很容易被压向列车,发生交通事故.1年前查看全部
- (2009•佛山一模)北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能
(2009•佛山一模)北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于第ⅢA族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE膜(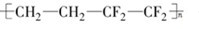 )是由一种单体加聚而成的
)是由一种单体加聚而成的  nlife1年前1
nlife1年前1 -
 tacer 共回答了20个问题
tacer 共回答了20个问题 |采纳率95%解题思路:A.合金熔点低硬度大;
B.氮化镓化学式为GaN;
C.化合价降低做氧化剂;
D.加聚产物的单体推断方法:凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体.A.合金的熔点比各组分金属的低,硬度比组分金属的大,故A错误;
B.Ga处于第ⅢA族,化合价为+3价,所以氮化镓化学式为GaN,故B正确;
C.Al与V2O5反应冶炼钒时,V2O5作氧化剂,故C错误;
D.ETFE的单体为CH2CH2和CF2CF2,故D错误.
故选B.点评:
本题考点: 金属与合金在性能上的主要差异;元素周期律和元素周期表的综合应用;聚合反应与酯化反应.
考点点评: 本题考查合金、元素周期表、铝热反应和加聚产物的单体推断方法,难度不大,注意凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种.1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)
录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为______,铁的化合价为______,钴的化合价为______.
 四黑1年前1
四黑1年前1 -
 我的小猫0 共回答了9个问题
我的小猫0 共回答了9个问题 |采纳率100%解题思路:根据化合物的化学式为CoxFe3-xO3+x,利用已知元素的化合价及化合物中正负化合价的代数和为0来解答.通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
考虑x≠0,符合要求的应是Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1,
故答案为:1;+3价;+2价.点评:
本题考点: 化合价规律和原则;有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求原子个数及元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 北京奥运会主体育场“鸟巢”运用了高强度、高性能的钒氮合金钢和ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.下列有关
北京奥运会主体育场“鸟巢”运用了高强度、高性能的钒氮合金钢和ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )
A.钒氮合金钢只含有钒、氮两种元素
B.Ga为ⅢA族元素,则氮化镓的化学式为Ga3N2
C.用铝作还原剂从V2O5中冶炼金属钒时,吸收大量热
D.ETFE膜(-[CH2-CH2-CF2-CF2]n-)是合成高分子化合物 hh军事迷1年前1
hh军事迷1年前1 -
 wx8753 共回答了14个问题
wx8753 共回答了14个问题 |采纳率92.9%解题思路:A、根据其含有的元素判断.
B.最外层电子数=最高正价=主族序数.
C、V、Cr、Mn、W等高熔点金属可利用铝热反应产生的高温来冶炼,铝热反应是放热反应.
D.根据其通式判断化合物类型.A、钒氮合金钢除含有钒、氮两种元素外,还含有铁,故A错误.
B.镓(Ga)处于IIIA族,最高升价为+3价,Ga3N2中Ga为+2价,故B错误;
C.V可利用铝热反应产生的高温来冶炼,但铝热反应是放热反应不是吸热反应,故C错误.
D.ETFE膜(-[CH2-CH2-CF2-CF2]n-)的分子量很大,属于高分子化合物,且其又是合成的,所以是合成高分子化合物,故D正确.
故选D.点评:
本题考点: 生活中常见合金的组成;常用合成高分子材料的化学成分及其性能.
考点点评: 本题考查了合金的组成,难度不大,注意铝热反应是放热反应不是吸热反应.1年前查看全部
- 化合物CoFe 2 O 4 是现代信息技术中用到的一种高性能磁粉,其中铁元素的化合价为+3,则钴元素(Co)的化合价为(
化合物CoFe 2 O 4 是现代信息技术中用到的一种高性能磁粉,其中铁元素的化合价为+3,则钴元素(Co)的化合价为( ) A.+1 B.+2 C.+3 D.+4  残疾木木1年前1
残疾木木1年前1 -
 yuanfengling 共回答了23个问题
yuanfengling 共回答了23个问题 |采纳率95.7%根据在化合物中正负化合价代数和为零,铁元素显+3,氧元素显-2,设钴元素(Co)的化合价是x,可知化合物CoFe 2 O 4 中钴元素(Co)素的化合价:x+(+3)×2+(-2)×4=0,则x=+2.
故选B.1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为 的化合物,已知氧为价,钴(Co)和铁可能是+2价或+3价,
录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为  的化合物,已知氧为价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为___________________,铁的化合价为_________,钴的化合价为_________________。
的化合物,已知氧为价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为___________________,铁的化合价为_________,钴的化合价为_________________。  airforcecdw1年前1
airforcecdw1年前1 -
 橙色水滴 共回答了17个问题
橙色水滴 共回答了17个问题 |采纳率100%1 ;+3价 ;+2价1年前查看全部
- (2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(C
(2013•汇川区质检)微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则铁和钴的化合价分别为( )
A.+3、+2
B.+2、+3
C.+2、+2
D.+3、+3 mond1年前1
mond1年前1 -
 放开nagenvhai 共回答了15个问题
放开nagenvhai 共回答了15个问题 |采纳率93.3%解题思路:根据在化合物中正负化合价代数和为零,结合CoFe2O4的化学式进行解答本题.若钴和铁元素的化合价相同时,即都为+2价时,则CoFe2O4中化合价的代数和为:(+2)+(+2)×2+(-2)×4≠0;都为+3价时,CoFe2O4中化合价的代数和为:(+3)+(+3)×2+(-2)×4≠0,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,CoFe2O4中化合价的代数和为:(+3)+(+2)×2+(-2)×4≠0,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,CoFe2O4中化合价的代数和为:(+2)+(+3)×2+(-2)×4=0,符合要求.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度较大,掌握利用化合价的原则计算指定元素的化合价的方法是正确解答的关键.1年前查看全部
- 有关高科技在减灾防灾中的利用说法不正确的是 [ ] A.高性能计算机技术
有关高科技在减灾防灾中的利用说法不正确的是 [ ]A.高性能计算机技术的配合,可以得到有关气象灾害的更为准确的信息
B.通过生物技术转变农作物的基因,可以增强农作物抵抗病虫害的能力
C.喷洒剧毒农药,扑灭病虫害
D.通过人工增雨,缓解旱灾多发地区的旱情 yfr18681年前1
yfr18681年前1 -
 小信子 共回答了12个问题
小信子 共回答了12个问题 |采纳率75%C1年前查看全部
- 移动电话已成为现代人及时便捷进行沟通的工具。但有时人们在需要联系时却发现电池没电的情况,因此研究高性能、大容量的超长待机
移动电话已成为现代人及时便捷进行沟通的工具。但有时人们在需要联系时却发现电池没电的情况,因此研究高性能、大容量的超长待机的锂离子电池,是摆在移动电话制造商面前的重要课题。锂离子电池相当于一个直流电源,下图是某公司生产的型号为SGH-D508的移动电话的锂电池的铭牌。这种移动电话在正常待机时,流过电池的电流约为80 mA,通话时电流约为150mA。某同学想比较精确的测出该锂电池的电动势和内阻,他通过查阅资料了解到一般锂电池的内阻在零点几欧到几欧之间。实验室备有以下器材:
A.电压表 量程
量程 ,内阻未知;
,内阻未知;
B.电压表 量程
量程 ,内阻未知;
,内阻未知;
C.电流表 量程200mA,内阻
量程200mA,内阻 ;
;
D.电流表 量程0.6A,内阻
量程0.6A,内阻 约为
约为 ;
;
E.滑动变阻器阻值变化范围为 ;
;
F.滑动变阻器阻值变化范围为 ;
;
G.开关、导线(该导线可以与锂电池方便的连接)若干;
H.学生电源。
(1)为能较准确地测得电动势  和内阻
和内阻 ,除锂电池外,上述器材中应该选择_____________(填器材序号字母)。
,除锂电池外,上述器材中应该选择_____________(填器材序号字母)。
(2)实验中,当电流表读数为 时,电压表读数为
时,电压表读数为 ;当电流表读数为
;当电流表读数为 时,电压表读数为
时,电压表读数为 。则
。则 和
和 的计算公式为:
的计算公式为: _____________;
_____________; _____________。
_____________。  淘淘不淘气1年前1
淘淘不淘气1年前1 -
 molili0122 共回答了27个问题
molili0122 共回答了27个问题 |采纳率92.6%1年前查看全部
- (2014•台州一模)液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图.两边电解液存储罐盛放的电解液分别是含有V
 (2014•台州一模)液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图.两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环. 下列说法不正确的是( )
(2014•台州一模)液流电池是一种新型可充电的高性能蓄电池,其工作原理如下图.两边电解液存储罐盛放的电解液分别是含有V3+、V2+的混合液和VO2+、VO2+酸性混合液,且两极电解液分开,各自循环. 下列说法不正确的是( )
A.充电时阴极的电极反应是V3++e-=V2+
B.放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被氧化
C.若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol
D.若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 3795141771年前1
3795141771年前1 -
 郝凯华 共回答了25个问题
郝凯华 共回答了25个问题 |采纳率80%解题思路:根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析,
A、充电时,阴极上得电子发生还原反应;
B、放电时,正极上发生得电子的还原反应,负极上发生失电子的氧化反应,根据 V2+与转移电子之间的关系式判断;
C、放电过程中,电解质溶液中的氢离子向正极移动,转移电子的物质的量和氢离子物质的量是相等的;
D、放电过程中,电解质溶液中的阴离子向负极移动.A、充电时,阴极上得电子发生还原反应,电极反应为V3+被还原生成v2+,即V3++e-=V2+,故A正确;
B、放电时,正极上发生得电子的还原反应,VO2++2H++e-=VO2++H2O,VO2+作氧化剂,在正极被还原,负极上发生失电子的氧化反应,V2+-e-=V3+,V2+做还原剂,在负极被氧化,故B错误;
C、放电过程中,转移电子的物质的量和氢离子物质的量是相等的,充电时当有1mole-发生转移时,左槽电解液的H+的物质的量增加了1mol,故C正确;
D、放电过程中,电解质溶液中的阴离子向负极移动,即放电时阴离子由左罐移向右罐,故D正确.
故选B.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.1年前查看全部
- 像用的高性能磁粉,主要材料之一是由钴(Co)、铁、氧三种元素组成的化合物,其化学式是Co x F
像用的高性能磁粉,主要材料之一是由钴(Co)、铁、氧三种元素组成的化合物,其化学式是Co x Fe 3-x O 3+x 、其中钴和铁均可能呈+2或+3价,则 x的值是( ) A.1 B.2 C.3 D.4  ericxuwei1年前1
ericxuwei1年前1 -
 种子289讨力 共回答了16个问题
种子289讨力 共回答了16个问题 |采纳率87.5%通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
氧元素显-2价,若Co的化合价为+3,Fe的化合价为+2,利用化合物中正负化合价的代数和为零,则(+3)×x+(+2)×(3-x)+(-2)×(3+x)=0,解得x=0,该可能不符合题意.
氧元素显-2价,若Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1.
故选A.1年前查看全部
- 手机中使用锂电池是一种新型的高性能电池,已知锂电池放电时的化学方程式:Li+MnO 2 ═LiMnO 2 ,下列有关说法
手机中使用锂电池是一种新型的高性能电池,已知锂电池放电时的化学方程式:Li+MnO 2 ═LiMnO 2 ,下列有关说法错误的是( ) A.该反应在常温下就可发生 B.该反应实现由化学能转变为电能 C.该反应产物属于氧化物 D.反应前后Li元素的化合价发生了变化  漂流啊啊1年前1
漂流啊啊1年前1 -
 飞车勇士 共回答了15个问题
飞车勇士 共回答了15个问题 |采纳率100%A、该反应在常温下就可发生,正确.
B、该反应实现由化学能转变为电能,正确.
C、该反应产物中含义三种元素,不属于氧化物.不正确.
D、反应前后Li元素的化合价由0价变成+1价.
故选C.1年前查看全部
- 用物理光学原理制成的录像机在录像时有的高性能磁粉,主要材料之一是有3种元素组成的(CoxFe3-x03+x)化合物,氧-
用物理光学原理制成的录像机在录像时有的高性能磁粉,主要材料之一是有3种元素组成的(CoxFe3-x03+x)化合物,氧-2价,钴和铁可能呈现+2或+3价,且每种只有1种化合价.则x值为_____,铁的化合价为_____,钴的化合价为__
 九龠1年前1
九龠1年前1 -
 c9600 共回答了15个问题
c9600 共回答了15个问题 |采纳率100%1,+3 ,+2、1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为Co x Fe (3-x) O (3+x) 的化合物.已知氧为
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为Co x Fe (3-x) O (3+x) 的化合物.已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价.则x值为______,铁的化合价______,钴的化合价______.  coffice7781年前1
coffice7781年前1 -
 莪钔d瑷 共回答了22个问题
莪钔d瑷 共回答了22个问题 |采纳率90.9%假设Co为+3价,则铁为+2价.
根据化合价代数和为零,则有3x+2(3-x)-2(3+x)=0,解x=0(无Co),不合理.
据此即可判断应该是Co为+2价,铁为+3价,则有2x+3(3-x)-2(3+x)=0,解得x=1.
故答案为:1;+3;+2.
注意(如果开始假设Co为+2价,则铁为+3价,则可直接得出结果).1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)
录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为______,铁的化合价为______,钴的化合价为______.
 钰树临风mg1年前1
钰树临风mg1年前1 -
 wuruofan 共回答了13个问题
wuruofan 共回答了13个问题 |采纳率84.6%解题思路:根据化合物的化学式为CoxFe3-xO3+x,利用已知元素的化合价及化合物中正负化合价的代数和为0来解答.通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
考虑x≠0,符合要求的应是Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1,
故答案为:1;+3价;+2价.点评:
本题考点: 化合价规律和原则;有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求原子个数及元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- (2005•嘉兴)微型录音机的高性能磁带中,有一种重要的化合物CoFe2O4,其中铁元素的化合价为+3价.则钴元素的化合
(2005•嘉兴)微型录音机的高性能磁带中,有一种重要的化合物CoFe2O4,其中铁元素的化合价为+3价.则钴元素的化合价为( )
A. +1
B. +2
C. +3
D. +4 tk701年前3
tk701年前3 -
 轻远 共回答了16个问题
轻远 共回答了16个问题 |采纳率87.5%解题思路:根据在化合物中正负化合价代数和为零,结合化合物CoFe2O4的化学式进行解答本题.根据在化合物中正负化合价代数和为零,铁元素显+3,氧元素显-2,设钴元素(Co)的化合价是x,则:x+(+3)×2+(-2)×4=0,则x=+2.
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 高性能录音磁带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,已知Co(钴元素)和Fe都有可能为+2、+3价
高性能录音磁带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,已知Co(钴元素)和Fe都有可能为+2、+3价但在上述化合物中每种元素只有一种化合价,则在CoFe2O4中Co和Fe的化合价分别为( )
A. +2、+3
B. +3、+2
C. +2、+2
D. +3、+3 Waveson1年前1
Waveson1年前1 -
 yilicoffee29 共回答了21个问题
yilicoffee29 共回答了21个问题 |采纳率100%解题思路:根据化合物的化学式为CoFe2O4,利用已知元素的化合价及化合物中正负化合价的代数和为0以及氧元素的化合价为-2价来解答即可.磁粉的化学式为:CoFe2O4;
因为化合物中各元素的化合价代数和为0,而且氧元素的化合价为-2价,所以该化合物中钴和铁的化合价的和为+8;
若钴和铁元素的化合价相同时,即都为+2价时,则钴和铁的化合价的和为:+2+(+2)×2=+6;都为+3价时,钴和铁的化合价的和为:+3+(+2)×3=+9,则都不符合要求,故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,钴和铁的化合价的和为:+3+(+2)×2=+7,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,钴和铁的化合价的和为:+2+(+3)×2=+8,符合要求.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 微型新录音录像的高性能带中磁粉主要材料之一是化学组成丰当于CoFe2O4的化合物,若钴为+2价,则铁的化合价为( )
微型新录音录像的高性能带中磁粉主要材料之一是化学组成丰当于CoFe2O4的化合物,若钴为+2价,则铁的化合价为( )
A.+3
B.+2
C.-2
D.-3 51benz1年前1
51benz1年前1 -
 x1mao 共回答了18个问题
x1mao 共回答了18个问题 |采纳率94.4%解题思路:根据在化合物中正负化合价代数和为零,结合化合物CoFe2O4的化学式进行解答本题.根据在化合物中正负化合价代数和为零,氧元素显-2价,钴为+2价,设铁元素的化合价是x,则:(+2)+2x+(-2)×4=0,则x=+3.
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 高中化学,硅专属含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤
高中化学,硅专属
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A的化合物D.
(1)在元素周期表中,求A位于的族和与A同族但相对原子质量比A小的元素B的原子结构示意图.
(2)易与C发生化学反应的酸是什么?该化学反应的重要应用是什么?
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成A的化合物F.
①写出生成D和F的化学方程式
②要将纯碱高温熔化,下列坩埚中不可选用的是( )
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(4)C与石灰石、C与纯碱发生相似的化学反应.100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,求100g混合物中石灰石的质量分数.
 hytux1年前1
hytux1年前1 -
 黑色的东方 共回答了24个问题
黑色的东方 共回答了24个问题 |采纳率91.7%A为硅,C为SiO2,D为Na2SiO3.A位于周期表中的第三周期IVA族.B为C,原子结构示意图:(+6) 2,4.与C反应的酸是氢氟酸——HF,重要用途可以腐蚀雕刻玻璃.E为CO2,Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓,F为硅酸——H2SiO3(也可写为:Na2SiO3 + CO2 + 2H2O = Na2CO3 + H4SiO4↓,F为原硅酸——H4SiO4).
①写出生成D和F的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O,SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温),Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓.
②要将纯碱高温熔化,下列坩埚中不可选用的是( A、B )
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
C与石灰石:SiO2 + CaCO3 = CaSiO3 + CO2↑(高温),生成11.2L÷22.4L/mol = 0.5mol的CO2,可知参加反应的SiO2为0.5mol×60g/mol=30g,参加反应的CaCO3为0.5mol×100g/mol=50g,30g+50g=80g1年前查看全部
- 微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+
微型化录音录像的高性能磁带中的磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都可能有+2、+3价,且上述化合物中每种元素只具有一种化合价,则钴和铁的化合价分别为( )
A. +2、+2
B. +2、+3
C. +3、+3
D. +3、+2 金川公夫1年前1
金川公夫1年前1 -
 元旦节快乐 共回答了27个问题
元旦节快乐 共回答了27个问题 |采纳率85.2%解题思路:根据化合物的化学式为CoFe2O4,利用已知元素的化合价及化合物中正负化合价的代数和为0以及氧元素的化合价为-2价来解答即可.磁粉的化学式为:CoFe2O4;
因为化合物中各元素的化合价代数和为0,而且氧元素的化合价为-2价;
所以该化合物中钴和铁的化合价的和为+8;
若钴和铁元素的化合价相同时,即都为+2价时,则钴和铁的化合价的和为:+2+(+2)×2=+6;都为+3价时,钴和铁的化合价的和为:+3+(+2)×3=+9;则都不符合要求;故化合物中Co和Fe的化合价不同;
因此Co、Fe的化合价可能为+2、+3价或+3、+2价;
若Co的化合价为+3,Fe的化合价为+2时,钴和铁的化合价的和为:+3+(+2)×2=+7,不符合要求;
若Co的化合价为+2,Fe的化合价为+3,钴和铁的化合价的和为:+2+(+3)×2=+8,符合要求;
故选B.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)B元素的原子最外层电子数与A相同,但相对原子质量比A小的元素,A与B在原子的电子层结构上的相同点是______.
(2)写出C与氢氟酸发生反应的化学方程式是______.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出C与纯碱混合高温熔融时生成D和E的化学反应方程式:SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
②要将纯碱高温熔化,下列坩埚中可选用的是______.
A.普通玻璃坩埚B.石英玻璃坩埚C.铁坩埚D.瓷坩埚. 天边的那一抹云1年前1
天边的那一抹云1年前1 -
 记忆里的微笑 共回答了17个问题
记忆里的微笑 共回答了17个问题 |采纳率100%解题思路:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,(1)B元素的原子最外层电子数与Si相同,二者最外层电子数相同;(2)二氧化硅与氢氟酸反应生成四氟化硅与水;(3)B元素的原子最外层电子数与Si相同,二者最外层电子数相同,相对原子质量比A小的元素,则B为C,①由题目信息可知,二氧化碳与碳酸钠在高温条件下反应生成硅酸钠与二氧化碳;②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应.含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)B元素的原子最外层电子数与Si相同,二者最外层电子数相同,均有4个电子,
故答案为:最外层均有4个电子;
(2)二氧化硅与氢氟酸反应生成四氟化硅与水,反应方程式为:SiO2+4HF═SiF4↑+2H2O,
故答案为:SiO2+4HF═SiF4↑+2H2O;
(3)B元素的原子最外层电子数与Si相同,二者最外层电子数相同,相对原子质量比A小的元素,则B为C,①由题目信息可知,二氧化碳与碳酸钠在高温条件下反应生成硅酸钠与二氧化碳,反应方程式为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑;
②普通玻璃坩埚、石英玻璃坩埚、瓷坩埚都含有二氧化硅,高温下能与碳酸钠反应,故选C,
故答案为:C.点评:
本题考点: 无机物的推断;硅和二氧化硅.
考点点评: 本题考查无机物推断、元素化合物性质,难度不大,注意对基础知识的掌握.1年前查看全部
- 录像用的高性能磁粉,其主要材料之一是由三种元素组成的化学式为CoFe2O4的化合物,已知氧为-2价,钴(Co)和铁可能呈
录像用的高性能磁粉,其主要材料之一是由三种元素组成的化学式为CoFe2O4的化合物,已知氧为-2价,钴(Co)和铁可能呈现+2或+3价,且上述化合物中,每种元素只有一种化合价,则铁的化合价为 ,钴的化合价为 .
 baitouweng1年前1
baitouweng1年前1 -
 pangdahai78 共回答了14个问题
pangdahai78 共回答了14个问题 |采纳率85.7%+3 +21年前查看全部
- 化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐
化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料.
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是______.A可由X与焦炭在高温下反应制得,其反应的化学方程式为SiO2+2C
Si+2CO↑高温 .SiO2+2C.
Si+2CO↑高温 .
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液.X与纯碱高温熔融能发生反应的原因是______;M与Z的水溶液能发生反应的原因是______.要将纯碱高温熔化,下列坩埚中不可选用的是______.
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应.一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体.则Y的化学式是______.
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是(不必配平)4Al+3TiO2+3C
2Al2O3+3TiC高温 .4Al+3TiO2+3C.
2Al2O3+3TiC高温 . ptarmigann1年前1
ptarmigann1年前1 -
 用英文跟女生gg 共回答了13个问题
用英文跟女生gg 共回答了13个问题 |采纳率92.3%解题思路:化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维,应为SiO2,
(1)A的一种单质是一种重要的半导体材料,应为Si,可由SiO2和C在高温条件下反应生成;
(2)SiO2与纯碱在高温下反应生成硅酸钠和二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸沉淀和碳酸钠;
(3)C的单质既可与盐酸、又可与NaOH溶液反应,应为Al,W是一种含有10个电子的碱性气体,应为NH3,则Y为AlN;
(4)根据反应物结合质量守恒定律解答.化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维,应为SiO2,(1)A的一种单质是一种重要的半导体材料,应为Si,位于周期表第3周期、ⅣA,可由SiO2和C在高温条件下反应生成,反应的方程式为SiO2+2C...
点评:
本题考点: 无机物的推断;硅和二氧化硅.
考点点评: 本题考查无机物的推断,题目难度中等,本题中侧重于物质的应用为考查点,注意把握Si和Al的单质及化合物的性质和用途,为高频考点.1年前查看全部
- 英语翻译随着移动互联网的发展、技术进步和高性能低功耗处理芯片的推出,部分穿戴式设备已经从概念化走向商用化,新式穿戴式设备
英语翻译
随着移动互联网的发展、技术进步和高性能低功耗处理芯片的推出,部分穿戴式设备已经从概念化走向商用化,新式穿戴式设备不断推出. 虎贲1年前1
虎贲1年前1 -
 不得消停 共回答了20个问题
不得消停 共回答了20个问题 |采纳率85%With the development of Internet,advanced technology and the appearing of high performanced chip,some wearable devices has been put into the market from conceptualization, and new wearable equipment will be avaliable continuously.1年前查看全部
- 化学题如下所示微型录音录象用的高性能磁带中,其铁粉主要材料之一是化学组成相当于CoFe2O4的化合物,已知Co和Fe都可
化学题如下所示
微型录音录象用的高性能磁带中,其铁粉主要材料之一是化学组成相当于CoFe2O4的化合物,已知Co和Fe都可能是+2,+3价,且上述化合物中每种元素只有一种化合价,则钴和铁的化合价分别为什么 henkua1年前1
henkua1年前1 -
 LM_1314 共回答了14个问题
LM_1314 共回答了14个问题 |采纳率78.6%你可以直接代入,假设Co是+3价的话,Fe不论几价均不满足,仅当Co+2价,Fe+3价满足.1年前查看全部
- 温度越高性能越好the higher the temperature the better the conducting
温度越高性能越好
the higher the temperature the better the conducting property can be; 请问大家 怎么翻译更准确些 , 多谢大家了 浴鱼1年前1
浴鱼1年前1 -
 gsme 共回答了16个问题
gsme 共回答了16个问题 |采纳率75%这个句子语法完全正确
有一点 conducting property这个用词太中式了,用conductivity比较好1年前查看全部
- AB使位于同一主族的两种短周期元素 由A元素组成的一种单质是重要的半导体材料 A的氧化物甲可用于制造高性能的现代通讯材料
AB使位于同一主族的两种短周期元素 由A元素组成的一种单质是重要的半导体材料 A的氧化物甲可用于制造高性能的现代通讯材料
A是什么 B是什么 甲是什么
下列物质的主要成分不是甲的是 A 水晶 B石英 C黏土 D玛瑙
甲鱼一种酸能发生反应 该反应化学方程式
将甲于纯碱混合 高温熔融时能发生反应生成乙 同时还生成B元素的最高价氧化物
写出化学方程式
B元素的最高价氧化物与足量乙的水溶液发生反应的化学方程式 我是过去时1年前1
我是过去时1年前1 -
 dpssl 共回答了23个问题
dpssl 共回答了23个问题 |采纳率91.3%A Si;B C; 甲:SiO2;
粘土的主要成分是硅酸钠 Na2SiO3
Si+4HF=SiF4+2H2
SiO2+Na2CO3(熔融)=CO2+Na2SiO3
CO2+Na2SiO3+H2O=Na2CO3+H2SiO31年前查看全部
- 含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)在元素周期表中,A位于 族,与A同族但相对原子质量比A小的元素B的原子结构示意图为 ,A与B在原子的电子层结构上的相同点是 。
(2)易与C发生化学反应的酸是 ,反应的化学方程式是 。
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式: 。
②要将纯碱高温熔化,下列坩埚中可选用的是 。
A.普通玻璃坩埚B.石英玻璃坩埚
C.氧化铝坩锅D.铁坩锅
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是 。 紫菜汤汤1年前1
紫菜汤汤1年前1 -
 织造局 共回答了17个问题
织造局 共回答了17个问题 |采纳率82.4%(1)ⅣA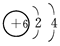 最外层均有4个电子,最内层均有2个电子
最外层均有4个电子,最内层均有2个电子
(2)氢氟酸 SiO 2 +4HF=SiF 4 ↑+2H 2 O
(3)①SiO 2 +Na 2 CO 3 Na 2 SiO 3 +CO 2 ↑,
Na 2 SiO 3 +CO 2 ↑,
Na 2 SiO 3 +CO 2 +H 2 O=Na 2 CO 3 +H 2 SiO 3 ↓
②D (4)50%
(1)A元素单质可作半导体材料,含A元素的某化合物是制造光导纤维的原料,可知A为硅元素,C为SiO 2 ,D为Na 2 SiO 3 。比硅相对原子质量小的同族元素B为碳。
(2)C为SiO 2 ,能与SiO 2 反应的酸只有氢氟酸。
(3)SiO 2 与Na 2 CO 3 高温下反应生成Na 2 SiO 3 和CO 2 ,含SiO 2 的材料(普通玻璃、石英玻璃)以及Al 2 O 3 等都能与Na 2 CO 3 在高温下反应,故不能用以上材质的坩埚熔融Na 2 CO 3 。
(4)若SiO 2 恰好完全反应或过量,与CaCO 3 反应的化学方程式只有一个,即CaCO 3 +SiO 2 CaSiO 3 +CO 2 ↑。若CaCO 3 过量,除发生上述反应外,还会发生反应:
CaSiO 3 +CO 2 ↑。若CaCO 3 过量,除发生上述反应外,还会发生反应:
CaCO 3 CaO+CO 2 ↑。总之,CaCO 3 的多少决定了CO 2 的产量,可通过以下关系列式求
CaO+CO 2 ↑。总之,CaCO 3 的多少决定了CO 2 的产量,可通过以下关系列式求
CaCO 3 ~ CO 2
100 g 22.4 L
m(CaCO 3 ) 11.2 L
m(CaCO 3 )=50 g
混合物中CaCO 3 的质量分数: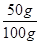 ×100%=50%。
1年前查看全部
×100%=50%。
1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)
录像用的高性能磁粉,主要材料之一是由三种元素组成的,化学式为CoxFe3-xO3+x的化合物,已知氧为-2价,钴(Co)和铁可能是+2价或+3价,且上述化合物中每种元素只有一种化合价,则x值为______,铁的化合价为______,钴的化合价为______.
 Q爱1年前3
Q爱1年前3 -
 云流去 共回答了18个问题
云流去 共回答了18个问题 |采纳率88.9%解题思路:根据化合物的化学式为CoxFe3-xO3+x,利用已知元素的化合价及化合物中正负化合价的代数和为0来解答.通过观察分析,若钴和铁元素的化合价相同时不符合元素正负化合价的代数和为0,则化合物中Co和铁的化合价不同,因此Co、Fe的化合价可能为+2、+3价或+3、+2价,
考虑x≠0,符合要求的应是Co的化合价为+2,Fe的化合价为+3,利用化合物中正负化合价的代数和为零,则(+2)×x+(+3)×(3-x)+(-2)×(3+x)=0,解得x=1,
故答案为:1;+3价;+2价.点评:
本题考点: 化合价规律和原则;有关元素化合价的计算.
考点点评: 本题考查利用元素化合价的计算原则来求原子个数及元素的化合价,本题难点是利用原则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物.已知氧为-2价,钴(
录像用的高性能磁粉,主要材料之一是由三种元素组成的化学式为CoxFe(3-x)O(3+x)的化合物.已知氧为-2价,钴(Co)和铁可能呈现+2价或+3价,且上述化合物中,每种元素只有一种化合价.则x值为______,铁的化合价______,钴的化合价______.
 ygjun1年前1
ygjun1年前1 -
 binn 共回答了18个问题
binn 共回答了18个问题 |采纳率88.9%解题思路:根据化合物的化学式为CoxFe3-xO3+x,利用已知元素的化合价及化合物中正负化合价的代数和为0来解答.若Co、Fe的化合价均为+2,则2x+2(3-x)-2(3+x)=-2x,不符合化合价代数和为0,不成立;若Co、Fe的化合价均为+3,则3x+3(3-x)-2(3+x)=0,则x=1.5,不是整数;假设Co为+3价,则铁为+2价,根据化合价代数和为零,...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查利用元素化合价规则来求原子个数及元素的化合价,本题难点是利用化合价规则来确定钴和铁元素的化合价,学生应根据信息合理选择元素的化合价是关键.1年前查看全部
- 由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素
由A元素组成的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料,C与烧碱反应生成含A元素的化合物D.
(1)列举化合物D的两种用途:______.
(2)下列物质的主要成分为C的有______(填字母).
a.沙子b.水玻璃c.黏土d.玛瑙
(3)将C与纯碱混合,高温熔融时也能发生反应生成D,同时还生成B元素的最高价氧化物E;将E通入足量D的水溶液中,又发生反应生成含A元素的化合物F.
①C与纯碱混合高温熔融时发生反应的化学方程式为SiO2+Na2CO3
Na2SiO3+CO2↑高温 .SiO2+Na2CO3.
Na2SiO3+CO2↑高温 .
②E与足量D的水溶液反应的离子方程式为______. 秘密tt20061年前1
秘密tt20061年前1 -
 wf1ove 共回答了24个问题
wf1ove 共回答了24个问题 |采纳率91.7%解题思路:含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料--光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3.
(1)C为SiO2,D为Na2SiO3,根据Na2SiO3的性质进行解答;
(2)C为SiO2,沙子、玛瑙的主要成分为SiO2,水玻璃、黏土主要成分为硅酸盐;
(3)将SiO2与纯碱混合,高温熔融时生成DNa2SiO3,同时还生成E为CO2;将E物质CO2通入足量DNa2SiO3的水溶液中,碳酸比硅酸强,二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;生成含A元素的化合物H2SiO3,
①C为SiO2,与纯碱混合高温熔融时生成硅酸钠和二氧化碳;
②E为CO2,通入足量DNa2SiO3的水溶液中,生成硅酸沉淀;含A元素的一种单质是一种重要的半导体材料,则A为Si,含A元素的一种化合物C可用于制造高性能的现代通讯材料:光导纤维,则C为SiO2,C与烧碱反应生成含A元素的化合物D为Na2SiO3,
(1)C为SiO2,与烧碱反应SiO2+2NaOH=Na2SiO3+H2O,生成含A元素的化合物D,D为Na2SiO3,
Na2SiO3(硅酸钠)俗称水玻璃具有广泛的用途,是建筑水泥快干等工业的粘合剂,也是一种溶雪剂的成分之一,也可制备硅胶、木材防火剂,
故答案为:制备硅胶、木材防火剂;
(2)a.沙子主要成分为二氧化硅;b.水玻璃是硅酸钠的水溶液;c.黏土主要成分为硅酸盐;d.玛瑙主要成分为二氧化硅,C为SiO2,所以a、d符合,
故答案为:a、d;
(3)将SiO2与纯碱混合,高温熔融时SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,生成DNa2SiO3,同时还生成E为CO2;将E物质CO2通入足量DNa2SiO3的水溶液中,碳酸比硅酸强,二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;反应为:2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,生成含A元素的化合物H2SiO3,
①C为SiO2,与纯碱混合高温:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑,
故答案为:SiO2+Na2CO3
高温
.
Na2SiO3+CO2↑;
②E为CO2,通入足量DNa2SiO3的水溶液中2CO2+Na2SiO3+2H2O═2NaHCO3+H2SiO3↓,离子反应为:2CO2+SiO32-+2H2O═2HCO3-+H2SiO3↓,
故答案为:2CO2+SiO32-+2H2O═2HCO3-+H2SiO3↓;点评:
本题考点: 硅和二氧化硅.
考点点评: 本题考查无机物的推断,题目难度中等,本题中侧重于物质的应用为考查点,注意把握Si的单质及化合物的性质和用途,为高频考点.1年前查看全部
大家在问
- 1写出词语(5个)1.形容生活富裕 (四个字) 2.不必论及,谈不上 (两个字) 3.形容气势大 4.形容简陋或过于简朴而
- 2归途 作文
- 3They are doing some exercise with Mr Ma 为什么用doing
- 4翻译英语英译中Now, the VOA Special English program, WORDS AND THEIR
- 5中央电视台天气预报主持人介绍天气的台词
- 6对二甲苯的相对分子质量
- 7房子的楼梯坡是怎样计算每坡高度和宽度的?
- 8Now computers can work ____faster than before.
- 9★★★★★请问Cu2HgI4中,Cu显几价?★★★★★
- 10关于X的不等式绝对值A减去2X大于X减去2在(0,2)上恒成立,求A的取值范围
- 11在密闭容器中进行下列反应:CO2(g)+C(s)⇌2CO(g)△H>0,起始通入2molCO,达到平衡后,改变下列条件
- 12代数式3x-8与2互为相反数,则x=______.
- 13I like this kind of chicken wings.It's much______than the ot
- 14含有互文手法的诗句,例:东市买骏马,西市买鞍鞯,南市买辔头,北市买长鞭.
- 15平方差公式解因式分解 (a+b)的平方-9a的平方 怎样做


