配位个体可以是中性分子也可以是带电荷的离子
 买支绩优股2022-10-04 11:39:542条回答
买支绩优股2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 自己的角色 共回答了20个问题
自己的角色 共回答了20个问题 |采纳率95%- 配体既可以是分子,也可以是离子.
配体是分子比较常见,比如 Ag(NH3)2 +
离子也可以.比如 Fe(C2O4)3 3-.配体是-2价的草酸根离子C2O42- - 1年前
 4485660 共回答了17个问题
4485660 共回答了17个问题 |采纳率76.5%- 应该吧
- 1年前
相关推荐
- 关于配合物配体请列举各种常见的配体,包括单齿的多齿的等等,并列举他们的配位原子,带电情况 有多种配位方式的尽量都标出(如
关于配合物配体
请列举各种常见的配体,包括单齿的多齿的等等,并列举他们的配位原子,带电情况 有多种配位方式的尽量都标出(如NO2-)就有四种.
说得好再加分 沙漠火巫1年前2
沙漠火巫1年前2 -
 dogdog2320 共回答了14个问题
dogdog2320 共回答了14个问题 |采纳率71.4%X-(X=F、Cl、Br、I):单齿配体
SCN-:单齿配体,可以S配位,也可以N配位,属于两可配体
NO2^-:单齿配体,可以N配位,也可以O配位,属于两可配体
NO3^-:单齿配体,O配位
N3^-:单齿配体
OH-:单齿配体,O配位
H2O:单齿配体,O
NH3:单齿配体,N
CO:单齿配体,C
CN^-:单齿配体,C
S2O3^2-:单齿配体,S
三苯基膦PPh3:单齿配体,P
砒啶(py)C5H5N:单齿配体,N
2,2'-联吡啶(bipy):双齿配体,N
乙二胺(en)H2N-CH2-CH2-NH2:双齿配体,2个N
1,10-二氮菲(phen):双齿配体,2个N
草酸根离子C2O4^2-:双齿配体,2个O
EDTA乙二胺四乙酸根离子:六齿配体,4个O和2个N
乙酸根离子CH3COO^-:单齿配体,O
有机物作为配体,一般利用N、O原子.
以上配体在特殊的物质中也可以发生其它变化,如,乙酸根离子CH3COO^-在Cr2(CH3COO)4.2H2O中就成为双齿配体,在两个Cr上架桥.
而,OH-、CO、SCN-、H2O、X-在一些特殊的物质中也可以形成桥配合物.1年前查看全部
- 配合物的配位键形成时,配位电子对有没有离开配位体的原子轨道
配合物的配位键形成时,配位电子对有没有离开配位体的原子轨道
是不是配位体的原子轨道和中心原子的空轨道杂化形成了杂化轨道 无心竹凌1年前2
无心竹凌1年前2 -
 阿净 共回答了12个问题
阿净 共回答了12个问题 |采纳率83.3%电子严格上来说,一定程度上离开了原来的轨道,当然,按你的意思来说就是没有离开,你理解的是对的
价键理论的是在于两个轨道发生重叠,使电子运动范围增大,所以我说一定程度上离开了原来的轨道,理解一下就好啦~再就是说最后这个问题,你理解的不对,杂化轨道指的是原子轨道线性组合成新的原子轨道,他要求轨道全是单独原子的轨道,然后新的原子轨道再与其它原子的原子轨道重叠.
你的理解是近似分子轨道,是两个并列的概念,不要混淆了~1年前查看全部
- 做配体时的名称以及配位提供的电子数?NO2+、NO2、NO2-、NO+、NO(考虑N、O分别配位时)
 笨蛋湘琴1年前2
笨蛋湘琴1年前2 -
 心结难解 共回答了26个问题
心结难解 共回答了26个问题 |采纳率88.5%N做配体时提供1个电子,孤电子视为1对.做中心原子提供5个.氧做配体提供0个,做中心原子提供6个.中心原子提供的价电子要里的考虑所带电荷数.你列举出来的这些肯定是要把O做配位的,提供的都是0个.中心原子价电子数依次是3,5,7,4,5.价电子对依次是2.3.4.2.31年前查看全部
- NO4-中N的杂化形式是什么-_-///呃…答案是sp3.其实我想问的是 等性杂化还是不等性杂化,因为有一个轨道成了配位
NO4-中N的杂化形式是什么
-_-///呃…答案是sp3.其实我想问的是 等性杂化还是不等性杂化,因为有一个轨道成了配位键。 cuicuizhang1年前2
cuicuizhang1年前2 -
 闷闷鱼 共回答了13个问题
闷闷鱼 共回答了13个问题 |采纳率76.9%这个离子叫过氧硝酸根,是硝酸中一个氧变成过氧键的物质(硝酸是HO-NO2,过氧硝酸是HO-O-NO2),所以N和硝酸根一样仍然是sp2杂化,并未改变.1年前查看全部
- 分析化学配位滴定问题混合等体积的0.15mol/升的EDTA和0.1mol/升的Ni(NO3)2溶液,在pH为9的缓冲溶
分析化学配位滴定问题
混合等体积的0.15mol/升的EDTA和0.1mol/升的Ni(NO3)2溶液,在pH为9的缓冲溶液中(不考虑水解等副反应),缓冲剂的组成不与Ni2+配合,求没有配合的Ni离子浓度.lgKni=18.56
各位xdjm,最好能有详细的解答过程,练习册的答案是3.89*10-8 mol/L,但就是算不对。 cvfg2301年前1
cvfg2301年前1 -
 回贴专业户 共回答了14个问题
回贴专业户 共回答了14个问题 |采纳率85.7%方程式:Ni2++EDTA4ˉ=Ni(EDTA)2ˉ.然后用平衡常数解出,不过好难解啊!1年前查看全部
- 五水合硫酸铜中心铜离子配位的水分子数为?
 almostoveryou1年前1
almostoveryou1年前1 -
 ahcw18 共回答了19个问题
ahcw18 共回答了19个问题 |采纳率78.9%41年前查看全部
- 请化学帝解释一下这些键之间哪个的force最强:(极性共价键,非极性共价键,配位共价键)(离子键)(氢键)(sigma键
请化学帝解释一下这些键之间哪个的force最强:(极性共价键,非极性共价键,配位共价键)(离子键)(氢键)(sigma键,pi键)(金属键)(范德华力).解释到sat2需要了解的程度就可以了!
 比蚊咬1年前1
比蚊咬1年前1 -
 bigmo 共回答了16个问题
bigmo 共回答了16个问题 |采纳率87.5%物质熔沸点的高低由物质固态时的晶体类型及构成物质的微粒间的作用力决定.一般来说,原子晶体的熔沸点最高,离子晶体较高,分子晶体最低.金属的熔沸点一般较高,但差别较大,按具体情况决定.由离子键构成的物质:活泼的金...1年前查看全部
- 化学键的种类有都哪些?比如共轭,配位;π键,σ键.
 tianzuo19861年前3
tianzuo19861年前3 -
 墨鱼墨鱼 共回答了21个问题
墨鱼墨鱼 共回答了21个问题 |采纳率85.7%化学键类型可分为:离子键、共价键、金属键三种.以形成共价键的两原子核的连线为轴作旋转操作,共价键的电子云的图形不变.这种共价键称为σ键,这种特征称为轴对称.σ键的种类有s-s σ键、s-p σ键、p-pσ键三种.p电子...1年前查看全部
- 为什么二茂铁中的铁原子是六配位的?
为什么二茂铁中的铁原子是六配位的?
为什么呢? 霸道男人1年前2
霸道男人1年前2 -
 yyomn 共回答了23个问题
yyomn 共回答了23个问题 |采纳率91.3%1、根据环戊二烯基的结构来看:
实际组成为:C5H5 -
五个C拿出5个电子再加上负离子一个电子,所以一共有六个电子,同时与Fe(II)成键.
2、根据Fe(II)电子层结构来看:
3d6结构,可以采取d2sp3杂化,形成六配位的结构
3、关于夹心类的配合物
夹心类配合物是非经典的配合物,通常成键情况和经典配位已经有所不同,此时二茂铁是上下各有六个电子同时与铁配位,这类配合物比较好的解释是用分子轨道理论而非价键理论了.1年前查看全部
- 铜是一种重要的金属元素,铜元素与银元素同处第ⅠB族,+1价的铜和+1价的银都可形成二配位的络离子,如Ag(NH 3 )
铜是一种重要的金属元素,铜元素与银元素同处第ⅠB族,+1价的铜和+1价的银都可形成二配位的络离子,如Ag(NH 3 ) 2 + 、AgCl 2 - 等,含铜最丰富的天然资源是黄铜矿(CuFeS 2 ).
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜.这种方法的缺点是、.
(2)现有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高.其主要流程如下:
①写出反应Ⅰ中FeCl 3 与CuFeS 2 所发生反应的化学方程式:______;
②写出反应Ⅳ中发生反应的离子方程式:______.
③反应Ⅲ是FeCO 3 在空气中煅烧,写出化学方程式:______.
④反应Ⅴ所得溶液A中含有的溶质有______. 走头无路的绝望1年前1
走头无路的绝望1年前1 -
 杭州格格 共回答了17个问题
杭州格格 共回答了17个问题 |采纳率88.2%(1)富铜矿砂与空气在高温下煅烧,使其转变为铜,反应产物有污染性气体二氧化硫生成,要消耗大量的热能,生成SO 2 会导致大气污染,故答案为:SO 2 会导致大气污染,同时要消耗大量的热能.
(2)①CuFeS 2 和3FeCl 3 之间发生的是氧化还原反应,化学方程式为:CuFeS 2 +3FeCl 3 =CuCl↓+4FeCl 2 +2S↓,故答案为:CuFeS 2 +3FeCl 3 =CuCl↓+4FeCl 2 +2S↓;
②结合CuCl和NaCl反应生成Na[CuCl 2 ],反应实质为:Cl - +CuCl=[CuCl 2 ] - ,故答案为:Cl - +CuCl=[CuCl 2 ] - ;
③FeCO 3 在空气中煅烧会和氧气发生反应:4FeCO 3 +O 2
高温
.
4CO 2 +2Fe 2 O 3 ,故答案为:4FeCO 3 +O 2
高温
.
4CO 2 +2Fe 2 O 3 .
④反应Ⅴ为Na[CuCl 2 ]和H 2 O之间的反应,生成物是Cu、NaCl和CuCl 2 ,所得的溶液中的溶质是CuCl 2 、NaCl,故答案为:CuCl 2 、NaCl;1年前查看全部
- 用饱和小苏打溶液做电解液,铜做电极,先有沉淀,后溶解(氢氧化铜溶于碳酸钠溶液生成深蓝色配位离子溶液
用饱和小苏打溶液做电解液,铜做电极,先有沉淀,后溶解(氢氧化铜溶于碳酸钠溶液生成深蓝色配位离子溶液
Na2[Cu(CO3)2](暗蓝色),再加醋酸欲使铜离子沉淀,用电磁炉进行水浴加热,溶液变红,后有红色沉淀,PP材料容器底部有薄薄一层非絮状红带黄的沉淀 , 灵月遥霜1年前1
灵月遥霜1年前1 -
 james-tang 共回答了12个问题
james-tang 共回答了12个问题 |采纳率91.7%恭喜你,生成了氧化亚铜胶体.电解时铜离子被还原了.1年前查看全部
- (2014•盐城三模)卟吩易与金属离子配位形成金属配合物,卟吩可由甲醛(HCHO)与吡咯[结构式如图(a)所示]合成.
(2014•盐城三模)卟吩易与金属离子配位形成金属配合物,卟吩可由甲醛(HCHO)与吡咯[结构式如图(a)所示]合成.
(1)甲醛分子中碳原子轨道杂化类型为______,HCHO空间构型为______(用文字描述).
(2)1mol吡咯中σ键数目为______.
(3)卟吩分子内存在氢键,在图(b)中用(…)画出氢键结构.
(4)卟吩铜是一种配合物.
①Cu2+基态时核外电子排布式为______.
②在图(c)中画出卟吩铜中Cu2+与N原子间的化学键.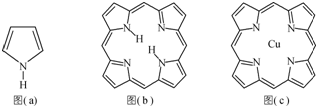
 影F1年前1
影F1年前1 -
 wuxin2003 共回答了12个问题
wuxin2003 共回答了12个问题 |采纳率100%解题思路:(1)利用甲醛中的成键来分析碳原子的杂化类型;利用杂化类型来分析空间结构;
(2)共价单键是σ键,共价三键中含有2个π键1个σ键,共价双键中含有1个σ键1个π键;
(3)含F、O、N元素的物质中分子内或分子之间能形成氢键,卟吩分子内存在N元素,1个氮原子有1个孤电子对,以此来解答;
(4)①Cu的原子序数为29,价电子排布为3d104s1;②Cu2+含有空轨道,N原子含有孤对电子,可形成配位键.(1)甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,因甲醛中碳原子采取sp2杂化,则分子的空间构型为平面三角形,
故答案为:sp2;平面三角形;
(2)吡咯分子式为:C4H5N,1个分子中存在1个C-C、2个C-N,2个C=C,4个C-H,1个N-H,含有10个σ键,
故答案为:10 mol(或10×6.02×1023);
(3)因N的电负性较大,则卟吩分子内存在氢键,1个氮原子有1个孤电子对,与1个氢形成分子内氢键,结构如图: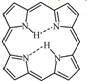 ,
,
故答案为: ;
;
(4)①Cu的原子序数为29,价电子排布为3d104s1,则基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
②Cu2+含有空轨道,1个氮原子有1个孤电子对,可形成配位键,配离子中1个Cu2+与4个N形成配位键,可表示为: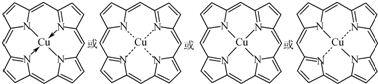 ,
,
故答案为: .
.点评:
本题考点: 原子轨道杂化方式及杂化类型判断;原子核外电子排布;判断简单分子或离子的构型;配合物的成键情况.
考点点评: 本题考查物质结构和性质,较为综合,涉及电子排布式的书写、晶胞的结构、杂化类型的判断等知识,是对学生分析、思维能力的考查,注意配合物卟吩铜中Cu2+与N原子间的化学键,题目难度中等.1年前查看全部
- 在硝酸中,双键氧和配位氧哪个氧的电子云密度较大?是双键氧吗?
 _rwup__6ecun5c9e1年前1
_rwup__6ecun5c9e1年前1 -
 y1esi 共回答了17个问题
y1esi 共回答了17个问题 |采纳率88.2%两个氧是等价的,形成一个三中心四电子大π键,但由于形成分子内氢键,与羟基氢形成氢键的氧的电子云密度要大些(此时这个氧可以看做是配位氧).1年前查看全部
- (2013•平顶山)氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质
 (2013•平顶山)氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(2013•平顶山)氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①Ti的基态原子有______种能量不同的电子;
②BH-4的空间构型是______ (用文字描述).
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2⇌2NH3实现储氢和输氢.下列说法正确的是______.
A.NH3分子中N原子采用sp3杂化
B.NH3分子的空间构型是正四面体
C.NH3和NH4+是等电子体
D.CN-的电子式为: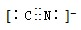
E.相同压强时,NH3沸点比PH3高
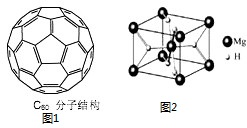
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,说明C60是______ 分子(选填:“极性”、“非极性”);
②C60分子结构如图1所示,则C60分子中含有π键数目为______.
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示.
①MgH2遇水就能释放H2,该反应的化学方程式为______;
②已知该晶体的密度a g•cm-3,则该晶胞的体积为[52a•NA  延庆oo1年前0
延庆oo1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 配位配合物Cu(NH3)4 2+ 为什么是内轨型化合物?
配位配合物Cu(NH3)4 2+ 为什么是内轨型化合物?
二价Cu离子的价电子结构是3d9,那么它是如何形成4个杂化轨道的?是一个3d和一个4s,两个4p一起杂化形成的吗? 流浪的FOX1年前1
流浪的FOX1年前1 -
 血峰狼孩 共回答了24个问题
血峰狼孩 共回答了24个问题 |采纳率87.5%没有这个化合物(或者说,不能观察到这个化合物)
正确的应该是[Cu(NH3)4(H2O)2]2+,六配位化合物.
内轨型,外轨型化合物的说法已被摒弃多年.没必要学它.1年前查看全部
- HCl和PbCl4反应,HCl的氯离子怎配位到PbCl4的Cl上,PbCl4的Cl上有空轨道吗?
 z熊猫z1年前1
z熊猫z1年前1 -
 tmgs2001 共回答了23个问题
tmgs2001 共回答了23个问题 |采纳率91.3%配位是Pb提供空轨道,形成配位键,不是Cl
Pb 原子的核外电子排布为 [Kr]4f14 5d10 6s2 6p2
Pb4+ 离子的核外电子排布为 [Kr]4f14 5d10
其中,6s、6p、6d都是空轨道.
实际的配位情况要复杂得多,但这不失为一种简单的理解方法.
Pb也不能达到6s、6p、6d全充满的9配位1年前查看全部
- 配体多齿配位是不是都是外轨型就是说多齿配体多是强场配体还是弱场配体
 农丫1年前1
农丫1年前1 -
 cgang11 共回答了14个问题
cgang11 共回答了14个问题 |采纳率100%根据配合物中心原子参与杂化轨道的种类来分类:如果中心原子全部采用最外层轨道参与杂化成键,形成的是外轨型配合物;如sp、sp3、sp3d2.通俗地说,就是s左边没有d.如果中心原子采用次了外层d轨道与最外层s、p轨道进行杂成键,形成的就是内轨型配合物.
形成内轨型配合物时,中心原子d轨道必要时要进行d电子重排,以保证有效的d轨道参与杂化.如Fe3+离子的价层电子组态为3d5,重排后d电子排列方式发生变化,即↑ ↑ ↑ ↑ ↑变为↑↓ ↑↓ ↑.1年前查看全部
- 用前线分子轨道理论解释CO的配位能力大于N2
 wrx1984241年前1
wrx1984241年前1 -
 mednick 共回答了16个问题
mednick 共回答了16个问题 |采纳率100%从HOMO的能级来看,CO比N2高,电子容易流出,对sigma配键形成有利;从LUMO的能级来看,CO比N2低,电子容易流入,对反馈pai配键形成有利;综上,从FMO可以解释CO和N2互为等电子体,但配位能力CO明显强于N21年前查看全部
- Se如何配位8个原子?
 llhcq1年前1
llhcq1年前1 -
 lady2 共回答了16个问题
lady2 共回答了16个问题 |采纳率100%在化合物中,Se配位8个原子的可能性极小,常见的配位数应该是4;就算在高压下,配位数达到6已是不错了.
不过有一种情况可能达到配位数8甚至12,那就是在超高压下,将Se单质金属化,形成类似金属的密堆积结构.1年前查看全部
- 配位个体与配合物的区别?还有配位数到底属于谁啊?是属于配体还是中...
配位个体与配合物的区别?还有配位数到底属于谁啊?是属于配体还是中...
配位个体与配合物的区别?还有配位数到底属于谁啊?是属于配体还是中心体? sunzhgang1年前3
sunzhgang1年前3 -
 itena 共回答了19个问题
itena 共回答了19个问题 |采纳率84.2%配位个体,也叫配位单元,是指中心体和配体之间通过配位键形成而成的结构单元,是配合物的核心单元.配位个体可以是中性分子,也可以是带电荷的离子.
配合物是含有配位个体的化合物.如果配位个体不带电荷,那么配位个体就是配合物.如果配位个体带电荷,那么配位个体与带异号电荷的离子一起构成的化合物才是配合物.
配位数属于中心体.1年前查看全部
- 高碘酸如何二配位举例
 过去了的6781年前2
过去了的6781年前2 -
 lintenghui 共回答了18个问题
lintenghui 共回答了18个问题 |采纳率72.2%脱掉两个氢配 也可以是双键氧 和一个羟基配 根据实际情况 根据电荷数判断1年前查看全部
- 配位离子的d电子数如何判断?
 kaaoo1年前2
kaaoo1年前2 -
 bfghe44 共回答了18个问题
bfghe44 共回答了18个问题 |采纳率83.3%先看中心原子的3d电子与4s电子的总数,再减去配位离子带的正电荷数目,即为d电子数.
如[Cr(NH3)6]3+,Cr的外层电子为3d5 4s1,共6个电子.NH3不带电,故Cr带三个单位的正电荷.6-3=3,为3个d电子.
再如[ZnCl4]2-,Zn的外层电子为3d10 4s2,共12个电子.Cl-带一个单位负电,四个Cl-带4个单位负电,总体带2个单位负电,故Zn带2个单位正电荷,12-2=10,为10个d电子.1年前查看全部
- 浓盐酸有些什么化学性质?什么叫配位能力,
 包装上的兰色小花1年前1
包装上的兰色小花1年前1 -
 597566021z 共回答了19个问题
597566021z 共回答了19个问题 |采纳率89.5%浓盐酸,酸性 具有酸的通性,属于强酸(至于酸的通性就不必说了吧)
还原性 是其中氯元素的性质 例如 它可以被二氧化锰氧化
4HCl(浓)+MnO2=MnCl2+Cl2+2H2O(加热条件)
这个也是实验室制取氯气的方法之一
注:浓盐酸与稀盐酸的化学性质差别不大,只是还原性比稀盐酸要强,例如上
面的反应,必须用浓稀盐酸,稀盐酸就不行
因此,一般情况下,要利用盐酸的还原性,总是用浓盐酸
若 只是利用 酸性 稀盐酸就可以了1年前查看全部
- 焦磷酸钠与硫酸铜配位取硫酸铜加入焦磷酸钠中发生配位反应的反应式是什么啊?继续加入焦磷酸钠沉淀又消失的反应式又是什么样的呢
焦磷酸钠与硫酸铜配位
取硫酸铜加入焦磷酸钠中发生配位反应的反应式是什么啊?继续加入焦磷酸钠沉淀又消失的反应式又是什么样的呢? nyj19741年前1
nyj19741年前1 -
 cxbride 共回答了12个问题
cxbride 共回答了12个问题 |采纳率91.7%2CuSO4+Na4P2O7=Cu2P2O7(沉淀)+2Na2SO4
Cu2PO7+3Na4P2O7=2Na6[Cu(P2O7)2]
这是正确答案,我查过书的1年前查看全部
- 在下列化学反应中,反应时不形成配位建的是
在下列化学反应中,反应时不形成配位建的是
①H+ + OH- = H2O
②2H2 + O2 = 2H2O
③HCL + NH3 = NH4CL
④BaCL2 + (NH4)2SO4 = BaSO4 + 2NH4CL
⑤Fe + Cu2+ = Cu + Fe2+
⑥NaNH3 + H2O = NaOH + NH3 梨子71年前3
梨子71年前3 -
 kesai79123 共回答了21个问题
kesai79123 共回答了21个问题 |采纳率95.2%配位键既特殊共价键,成键的两原子间共享的两个电子不是由两原子各提供一个,而是来自一个原子,2、4、5反应时不能形成配位键1年前查看全部
- 柠檬酸和金属离子能直接配位吗比如cu2+,ni2+,cr3+,cd2+,pb2+能直接和柠檬酸配位吗?如果能配位,金属离
柠檬酸和金属离子能直接配位吗
比如cu2+,ni2+,cr3+,cd2+,pb2+能直接和柠檬酸配位吗?如果能配位,金属离子与柠檬酸的物质的量的比例是多少呢 ?谢谢! kyleliu1年前1
kyleliu1年前1 -
 wwww 共回答了18个问题
wwww 共回答了18个问题 |采纳率94.4%可以,一般为1:2,也有1:3的.柠檬酸分子中可以有2个配位原子.1年前查看全部
- 命名下列配合物,并指出中心离子,配体,配位原子,配位数,配位离子的电荷.1.Na2[Zn(OH)4] 2.[Pt(NH3
命名下列配合物,并指出中心离子,配体,配位原子,配位数,配位离子的电荷.1.Na2[Zn(OH)4] 2.[Pt(NH3)2Cl4] 3.[CoCl(NH3)5] 4.[Cu(en)2]Br2
 誓风1年前0
誓风1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 混合等体积的0.2000mol/L-1EDTA和Mg(NO3)溶液.假设此溶液的pH=9.00,问此溶液中未配位的Mg2
混合等体积的0.2000mol/L-1EDTA和Mg(NO3)溶液.假设此溶液的pH=9.00,问此溶液中未配位的Mg2+浓度时多少?
logKMGY=8.69,pH=9.00时,logaY(H)=1.28 4213294401年前1
4213294401年前1 -
 我的初吻献了烟 共回答了17个问题
我的初吻献了烟 共回答了17个问题 |采纳率100%混合等体积的0.2000mol/L-1EDTA和Mg(NO3)溶液,生成EDTA-Mg的溶液为0.1000mol/L
条件稳定常数=logKMGY-logaY(H)=8.69-1.28=7.41
0.1000/c2(Mg2+)=10^7.41
c(Mg2+)=6.2X10-5mol/L1年前查看全部
- co中的键 C←=O 碳和氧共用两对电子,氧提供一对电子配位.那为什么高中理综考试中问CO含有的化学键类型答案中只有共价
co中的键 C←=O 碳和氧共用两对电子,氧提供一对电子配位.那为什么高中理综考试中问CO含有的化学键类型答案中只有共价键没有配位键
 liucahngxin1年前1
liucahngxin1年前1 -
 tofudog 共回答了22个问题
tofudog 共回答了22个问题 |采纳率81.8%配位键是特殊的共价键,也是共价键,答共价就对.1年前查看全部
- 阴离子配位能力强弱(相同阳离子条件)
阴离子配位能力强弱(相同阳离子条件)
硬碰硬,软碰软
(总感觉剧毒的CN-离子是冠军,稳定常数超高,不过对轻金属好象配合不了)
是不是浓HI像浓硫酸,硝酸可以溶解除了绝大部分金属?
例如:
Cu+2HI(浓)=(CuI2)-+H2
Hg+4HI(浓)=(HgI4)2-+H2
2Ag+2HI(浓)=2AgI+H2
对于硬酸和软酸各是什么?
离子种类数目越多越好!
F-,Cl,Br,I-,NH3,H2N-CH2-CH2-NH2,(PO3)2-,(C2O42)-,SCN-,(S2O3)2-,EDTA,一些常见螯合离子等
指溶液中阴离子配位能力强弱,大小排序!
指溶液中阴离子配位能力强弱,大小排序!
指溶液中阴离子配位能力强弱,大小排序! 庄若冰1年前3
庄若冰1年前3 -
 fz100 共回答了16个问题
fz100 共回答了16个问题 |采纳率93.8%软酸:Ir、Pd、Pt、Cu、Ag、Au、Cd、Hg、Tl.这些金属在元素周期变中的位置呈三角形,称为软三角区,远离这些的为硬酸,边缘的是交界酸.
硬碱:N、O、F、Cl以及以它们配位的配体(如:NH3、OH-、(C2O42)-、EDTA、H2N-CH2-CH2-NH2、(S2O3)2、等等)
交界碱:Br-
软碱:S2-、I-、CO、CN-、SCN-等等1年前查看全部
- 碳原子和氮原子谁的配位能力强
 飞哥的传说1年前2
飞哥的传说1年前2 -
 HANA_11132 共回答了16个问题
HANA_11132 共回答了16个问题 |采纳率93.8%碳原子的原子核外有四个电子,这四个电子都要参与成键,它就没有孤电子对,很难形成配位键;氮原子的核外有5个电子,除三个电子参与成键外,还有一对电子是孤电子对,可以形成配位键;所以氮的配位能力强1年前查看全部
- 什么叫配位能力强比如说氟离子的配位能力强,是指氟离子作为配合物中心原子的能力强,还是作为配体的能力强?
 gjwlzly1年前2
gjwlzly1年前2 -
 vv的汤 共回答了17个问题
vv的汤 共回答了17个问题 |采纳率82.4%单从氟离子来说是作为配体的能力强.1年前查看全部
- 偏铝酸跟是配位离子?
 Airness1年前1
Airness1年前1 -
 jinyinglai 共回答了19个问题
jinyinglai 共回答了19个问题 |采纳率94.7%偏铝酸钠其实就是Na[Al(OH)4],是配合物.其中的阴离子[Al(OH)4]-是配位离子1年前查看全部
- 化学键强弱排序:共价键 离子键 配位共价键 金属键
 玉yu1年前1
玉yu1年前1 -
 五十五非 共回答了24个问题
五十五非 共回答了24个问题 |采纳率95.8%金属键>离子键>配位共价键>共价键1年前查看全部
- 为啥N原子的配位能力比O原子的配位能力强?
为啥N原子的配位能力比O原子的配位能力强?
因为相对于氧原子来说,N的电负性比较小,吸引电子的能力比较弱,也就是说比较容易给出电子,所以它的配位能力比较强
也就是说,给电子能力强,配位能力就强 踢七十脚1年前2
踢七十脚1年前2 -
 rosewomen 共回答了13个问题
rosewomen 共回答了13个问题 |采纳率92.3%你都说了啊...1年前查看全部
- S原子和N原子哪个的配位能力强?
 hetaoduoduo1年前3
hetaoduoduo1年前3 -
 凡石 共回答了23个问题
凡石 共回答了23个问题 |采纳率87%应该是N原子的配位能力强1年前查看全部
- 正二价镍离子的配位我想知道正二价镍离子在其配合物为正四面体构型时镍的d电子排布和其配合物为平面正方形构型时的镍的d电子排
正二价镍离子的配位
我想知道正二价镍离子在其配合物为正四面体构型时镍的d电子排布和其配合物为平面正方形构型时的镍的d电子排布! 呼延飞1年前1
呼延飞1年前1 -
 亚当山 共回答了14个问题
亚当山 共回答了14个问题 |采纳率92.9%原子镍价电子是:3d8,4s2
二价镍为3d8
正四面体构型是sp3杂化,接受4个配体的4对电子,d电子依照原先情况填充
平面正方形构型为sp2d杂化,接受4个配体的4对电子,8个d电子填满能量较低的4个d轨道,未参与杂化的p轨道空
配位化合物不适宜用VB法分析其成键,更适合用晶体场或者配位场理论,如果用VB法解释分子磁性,可能与事实产生大量冲突.1年前查看全部
- 化学键的种类有都哪些?比如共轭,配位;π键,σ键.
 guykmy1年前3
guykmy1年前3 -
 j6oc 共回答了22个问题
j6oc 共回答了22个问题 |采纳率86.4%共价键,离子键,金属键等属于化学键,而氢键,分子键是属于非化学键的.1年前查看全部
- CaCl2·8NH3是几配位Ca与NH3是6配位还是8配位为什么?有没有什么理论依据呢?
 daiming9991年前1
daiming9991年前1 -
 korutia 共回答了26个问题
korutia 共回答了26个问题 |采纳率84.6%8配位1年前查看全部
- 配位方式和配位环境的区别
 珍惜生活的人1年前1
珍惜生活的人1年前1 -
 vivianzc 共回答了16个问题
vivianzc 共回答了16个问题 |采纳率100%我举个例子,相信你能理解.
配位环境:N02
配位方式:一种是氧配位,一种是氮去配位.
再细分N02有5种配位方式,如形成氧桥等等.
以上称为键合异构,是常见的关于配位化合物的异构.1年前查看全部
- 关于配位离子的几个问题本人高一水平,希望回答的人能说通俗点……1、什么条件下容易产生配位离子?2、若没有可以和配位离子结
关于配位离子的几个问题
本人高一水平,希望回答的人能说通俗点……
1、什么条件下容易产生配位离子?
2、若没有可以和配位离子结合的东西,那么配位离子以离子状态存在吗?
3、配位离子是用背的吗?还是有什么规律?如果是背的请说出高中常见的几种配位离子以及产生条件;如果有规律请说明规律. 天空心情111年前2
天空心情111年前2 -
 雪蠓 共回答了22个问题
雪蠓 共回答了22个问题 |采纳率77.3%配体有孤对电子,受体有空轨道,一般在碱性条件下配例子稳定.而且软酸软碱的配离子稳定性大于硬酸硬碱.
有的配位离子上面是可以接东西的比方说蔡司盐类的配合物(包括很多有机金属络合物),但是大多数的均是以离子性质存在,有的络合物可以形成内配盐(电中性)例如乙酰丙酮的络合物.
配位离子是不用背的,楼主要化学竞赛么?不搞的话记住几个常用的就可以了,化学竞赛要学到晶体场理论,配位化合物自然就通了.规律就太多了,还是自学无机化学吧!1年前查看全部
- 硫代硫酸钠的结构为什么是S替代了O的配位而不是替代O-?
 约会阳光1年前1
约会阳光1年前1 -
 绿叶和树 共回答了21个问题
绿叶和树 共回答了21个问题 |采纳率90.5%其实SO42-裏面每个O都是等价的,因此S替代哪个O都一样.但是我们说取代的是S=O双键的O是因为加入H+之後O得到质子能力比S强,没有形成-SH的倾向,所以看做是取代双键的O1年前查看全部
- 过氧根离子是二配位吗
 gouji1111年前1
gouji1111年前1 -
 apple83 共回答了19个问题
apple83 共回答了19个问题 |采纳率100%是的1年前查看全部
- 轻金属和重金属的配位能力那个比较强?
轻金属和重金属的配位能力那个比较强?
当然啦,前提是同一种配位体,比如蛋白质好了,说实话,我也在研究这个问题,为什么重金属能使蛋白质变性(通过配位),而轻金属不具有这种能力?我的猜想空轨道太少(和相对原子质量小有间接的关系)的原因,
但是我超想知道,对于同一个配体,配位能力的强弱与什么有关呢?
也就是问 跟中心原子(团)得什么性质有关系? zyy8881年前3
zyy8881年前3 -
 daidaimami 共回答了17个问题
daidaimami 共回答了17个问题 |采纳率82.4%轻金属有铝、镁、钾、钠、钙、锶、钡等,重金属有铜、镍、钴、铅、锌、锡、锑、铋、镉、汞等.可见重金属元素的轨道更多,有的涉及到d轨道,配位能力应该更强.1年前查看全部
- 在配位离子化合物中中心原子空轨道指什么(如何判断有无空轨道) 如Na+,Al+.
 nunoiss1年前1
nunoiss1年前1 -
 dearok 共回答了23个问题
dearok 共回答了23个问题 |采纳率87%中心原子空轨道指中心原子没有电子的轨道
如Na+,由于Na是第三周期元素,有spd轨道,3s轨道有1个电子,3p轨道没有电子、3d轨道也没有电子,所以有3+5=8个空轨道1年前查看全部
- (NH4)2[Hg(SCN)4]的内界、外界、中心离、配位体、配位院子、配位数和化学名称是什么
 亲情树peter1年前2
亲情树peter1年前2 -
 东方剑虹 共回答了16个问题
东方剑虹 共回答了16个问题 |采纳率87.5%四硫氰合汞化铵.其中[Hg(SCN)4]2-是内界,(NH4)+是外界.
Hg2+ 是配位中心,SCN2- 配位体,SCN2- 中的4是配位数.
命名规则:先命名含配位的离子团,然后根据配位离子团的正负来命名.如果是正的,则把这个作为金属离子,按金属盐的命名来进行.如果是负的,则作为酸根,**化**1年前查看全部
- 6配位配合物有顺反异构吗?
 孤独rr1年前1
孤独rr1年前1 -
 馨瑶99 共回答了25个问题
馨瑶99 共回答了25个问题 |采纳率92%有的有,比如[Co(NH3)4Cl2]+1年前查看全部
- 配位滴定法中EDTA以哪种形态和金属离子配位?
配位滴定法中EDTA以哪种形态和金属离子配位?
EDTA常用H4Y表示,滴定剂常用其二钠盐Na2H2Y·H2O ,EDTA在水溶液中以7种形体存在,有六级解离平衡.在7种形体中,一般Y与金属离子直接配位.
那么Y到底是哪一种形体? cycyc71年前1
cycyc71年前1 -
 时光倒流jc 共回答了26个问题
时光倒流jc 共回答了26个问题 |采纳率88.5%Y就是乙二胺四乙酸根(4-),带有四个负电荷并与金属离子进行配位.滴定剂通常选择H2Y(2-)无妨,因为滴定反应会把氢离子放出来,仍然是Y4-进行配位.1年前查看全部
大家在问
- 1初中化学如何区分酸碱盐酸碱盐的定义又是什么啊.
- 2直角三角形的两个锐角平分线角成的角的度数为( )
- 3某生物学习小组想探究种子萌发所需的外界条件,于是选用一定数量同一品种的、具有萌发能力的小麦种子,用四个培养皿做了正确的探
- 4光具有能量,请举一个将光能转化为内能的例子:______.光在真空中的传播速度为______m/s.
- 5一批货用大车装要用36辆,用小车装要45辆,每辆大车比小车多装4吨,这批货共几吨?
- 6孤山寺北贾亭西中的北、西是啥子意思
- 7卡尔·林耐的主要贡献是坚持使用和广泛传播了( )
- 8感抗公式能否根据自感电动势E=LI/t 推导
- 9设椭圆C :x^2/a^2+y^2/b^2=1(a>b>0)的右焦点为F,过F的直线l与椭圆C相交于A、B两点,直线l的
- 10幼儿园买进大小两种毛巾各40条,共用258.8元.大毛巾的单价比小毛巾单价的2倍多0.11元.这两种毛巾单价各是多少元?
- 111 2 4 8 16 32 64 …… n 求第n个数
- 12(2007•杭州一模)在△ABC中,|AB|=2,|AC|=3,|BC|=10,则cosA=[1/4][1/4].
- 13study well and make progress every day.怎么读有道词典
- 14_____________斗酒诗百篇,长安市上酒家眠。天子呼来不上船,自称臣是酒中仙。 [
- 15关于王勃的《滕王阁序》中上联“滕王阁中,高朋满座,子安书宾客之美,山川美景,赞宴会盛况,抒盛筵难...

