m g的铁与n g的HNO3充分反应,求硝酸被还原的质量
 woaixiaowei2022-10-04 11:39:542条回答
woaixiaowei2022-10-04 11:39:542条回答m:n=1:3

已提交,审核后显示!提交回复
共2条回复
 seeseaelaine 共回答了18个问题
seeseaelaine 共回答了18个问题 |采纳率88.9%- (n/4)g
m:n=1:3
n(Fe):n(HNO3)=(1/56):(3/63)=3:8
3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O
被还原的硝酸占总硝酸的1/4
硝酸被还原的质量=n*1/4=(n/4)g - 1年前
 qq158365596 共回答了435个问题
qq158365596 共回答了435个问题 |采纳率- 63M56=9M/8
- 1年前
相关推荐
- 有一包有CuO和木炭混合而成的黑色粉末称重50g,将其放入试管内加热,让两者充分反应(如图所示),停止加热并冷却,称得剩
有一包有CuO和木炭混合而成的黑色粉末称重50g,将其放入试管内加热,让两者充分反应(如图所示),停止加热并冷却,称得剩余固体混合物的质量为39g,(碳与试管内少量氧气的反应忽略不计).

(1)反应中生成二氧化碳______g.
(2)参加反应的氧化铜的质量是多少?
(3)小静认为通过以上数据可以算出混合物中氧化铜所占的百分比,小红则认为不可以,你同意______的观点,你的理由是______. 雪冰菱1年前1
雪冰菱1年前1 -
 Aska911 共回答了18个问题
Aska911 共回答了18个问题 |采纳率88.9%解题思路:(1)欲知反应中生成二氧化碳的质量,须知生成二氧化碳质量=反应前物质的质量-反应后物质的质量,据此答题;
(2)欲知参加反应的氧化铜的质量,需根据化学方程式,得出各物质之间的质量比,写出比例式,就可计算得出;
(3)欲正确解答本题,需充分考虑实验过程中的各种情况.(1)由反应的化学方程式可知,生成物中二氧化碳气体逸出,故反应中生成二氧化碳质量=反应前物质的质量-反应后物质的质量=50g-39g=11g.故答案为:11g;
(2)设参加反应的氧化铜的质量为x
2CuO+C
高温
.
2Cu+CO2↑
160 44
x 11g
∴160:44=x:11g
解之得:x=40g
答:参加反应的氧化铜的质量是40克.
(3)因为在本题中不清楚氧化铜是否反应完全,无法计算出混合物中氧化铜所占的百分比,所以小红的观点正确;
故答案为:小红,在本题中不清楚氧化铜是否反应完全.点评:
本题考点: 根据化学反应方程式的计算;碳的化学性质;质量守恒定律及其应用.
考点点评: 本题主要考查学生充分考虑实验现象的认识和运用化学方程式进行计算的能力.1年前查看全部
- 现将石灰石样品15克与105.4克稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反映前后烧杯内物质的质量变化
现将石灰石样品15克与105.4克稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反映前后烧杯内物质的质量变化如下表所示:反应时间s 20 20 20 20 20 20 质量g 119.52 118.64 117.76 116.88 116 116 (1)样品中碳酸钙的质量分数.(保留一位小数)(2)反应后所得溶液中溶质的质量分数.
 浅绿丝绒1年前1
浅绿丝绒1年前1 -
 玻璃沙拉 共回答了10个问题
玻璃沙拉 共回答了10个问题 |采纳率100%反应时间s 20 20 20 20 20 20 质量g 119.52 118.64 117.76 116.88 116 116 设样品中碳酸钙的质量为X克.由表可知,反应完全后,剩余的质量为116克.那么生成二氧化碳气体的质量就是15+105.4-116=4.4g2HCl+CaCO3=CaCl2+H2...1年前查看全部
- 在标准状况下,将5.6LCO2通过足量的Na2O2充分反应,求所生成的碳酸钠的质量和氧气的物质的量. 在线等待,
在标准状况下,将5.6LCO2通过足量的Na2O2充分反应,求所生成的碳酸钠的质量和氧气的物质的量. 在线等待,
在标准状况下,将5.6LCO2通过足量的Na2O2充分反应,求所生成的碳酸钠的质量和氧气的物质的量. 在线等待,十分感谢 剑神一笑天外飞仙1年前3
剑神一笑天外飞仙1年前3 -
 聆水 共回答了25个问题
聆水 共回答了25个问题 |采纳率92%n(CO2)=5.6/22.4=0.25mol
2CO2+2Na2O2=2Na2CO3+O2
0.25 0.25 0.125
生成的碳酸钠的质量:0.25×106=26.5g O2 0.125mol1年前查看全部
- (2014•虹口区一模)如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
 (2014•虹口区一模)如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
(2014•虹口区一模)如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
①计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)
②实验前后分别称量了装置A和装置B的质量如表中所示.若数据Ⅰ准确,请回答:
a.反应后A中固体的成分是______.
b.数据Ⅱ存在的问题是______,可能的原因是______.
反应前质量(g) 反应后质量(g) Ⅰ 装置A 125.3 124.2 Ⅱ 装置B 152 152.3  融化的雪1年前1
融化的雪1年前1 -
 人ll无敌 共回答了19个问题
人ll无敌 共回答了19个问题 |采纳率84.2%解题思路:①假设0.1mol氧化铜全部和碳反应,则可以计算出生成的二氧化碳的质量;
②a、分析氧化铜和碳反应的化学方程式可以知道,A中减少的质量为氧化铜中氧元素的质量,然后计算出氧化铜中氧元素的质量,比较后即可得出解答;
b、根据生成的二氧化碳不能被完全吸收进行解答.①0.1mol氧化铜的质量为:0.1mol×80g/gmol=8g
设生成二氧化碳的质量为x
2CuO+C
高温
.
2Cu+CO2↑
160 44
8gx
[160/8g]=[44/x]
解得:x=2.2g
答:该实验最多可以生成2.2克二氧化碳.
②a、氧化铜中氧元素的质量为:8g×([16/16+64]×100%)=1.6g
根据表格中A组数据可以知道反应前后减少的质量为:125.3g-124.2g=1.1g
1.1g<1.6g
所以可以判断氧化铜没有完全反应,即A中的固体为氧化铜和铜的混合物.
b、根据B中的数据可以知道,被吸收的二氧化碳的质量小于生成的二氧化碳的质量,可能的原因是澄清石灰水的量不足,没有将生成的二氧化碳全部吸收.
故答案为:①2.2g
②氧化铜和铜;数据Ⅱ中反应后的质量偏小;澄清石灰水量不足,没有将生成的二氧化碳全部吸收.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生充分考虑实验现象的认识和运用化学方程式进行计算的能力.1年前查看全部
- 1.钠和水反映生成NaOH 和H2,现向95.6g 水中加入4.6g 钠,充分反应(有水剩余),请计算生成NaOH的质量
1.钠和水反映生成NaOH 和H2,现向95.6g 水中加入4.6g 钠,充分反应(有水剩余),请计算生成NaOH的质量是多少?
2.在反应2A+5B=2C+4D中,C.D的相对分子质量之比为9:22,若2.6gA与B完全反应,生成8.8gD,则在此反应中B与D的质量比为多少? rainbowcao1年前4
rainbowcao1年前4 -
 帮忙兄弟3 共回答了22个问题
帮忙兄弟3 共回答了22个问题 |采纳率90.9%1、写出方程式 2Na+2H2O=2NaOH+H2因为水有剩余 所以4.6g Na完全反应
设 生成NaOH的质量是x
2Na+2H2O=2NaOH+H2
46 80
4.6g x 46/80 =4.6g/x x=8g
生成NaOH的质量是8g
2、设C的 相对分子质量为9M.则D的 相对分子质量为22M,
设生成C的质量为Y ,由2A+5B=2C+4D得
2A + 5B= 2C + 4D
2X9M 4X22M
Y 8.8g 18M/88M=Y/8.8g Y=1.8g
2.6gA与B完全反应,生成8.8gD,生成C的质量为1.8g,根据质量守恒定律
则参加反应的B的质量为:8.8g+1.8g-2.6g=8.0g
在此反应中B与D的质量比为8/8.8=10/111年前查看全部
- 某石灰石样品中含有少量二氧化硅杂质.5g该样品与50mL2mol/L盐酸充分反应后得到1064mL二氧化碳.
某石灰石样品中含有少量二氧化硅杂质.5g该样品与50mL2mol/L盐酸充分反应后得到1064mL二氧化碳.
计算:(1)石灰石样品中二氧化硅的质量分数.
(2)中和多余盐酸所需1mol/L烧碱溶液的体积. 飞天猪二代1年前1
飞天猪二代1年前1 -
 我是恐龙我怕who 共回答了19个问题
我是恐龙我怕who 共回答了19个问题 |采纳率84.2%CO2为0.0475mol所以石灰石为4.75克 二氧化硅为0.25克,所以5% 盐酸共0.1mol,与石灰石反应了0.09mol 还剩0.01mol 所以10ml1年前查看全部
- (1)用相同质量相同质量分数的盐酸分别跟碳酸钠和碳酸氢钠充分反应来制得二氧化碳,那个值得的二氧化碳多?为什么?
(1)用相同质量相同质量分数的盐酸分别跟碳酸钠和碳酸氢钠充分反应来制得二氧化碳,那个值得的二氧化碳多?为什么?
(2)相同质量的碳酸钠和碳酸氢钠跟足量的盐酸充分反应,那个放出的二氧化碳多?为什么? f6lcb1年前1
f6lcb1年前1 -
 foxofsnow 共回答了17个问题
foxofsnow 共回答了17个问题 |采纳率88.2%1)Na2CO3+2HCl=2NaCl+CO2+H2O
NaHCO3+HCl=NaCl+CO2+H2O
所以和相同质量的HCl反应,碳酸氢钠放出的CO2多.
2)Na2CO3+2HCl=2NaCl+CO2+H2O
106 73 44
44/52 30/66 18/48
NaHCO3+HCl=NaCl+CO2+H2O
84 1.5 44
44/52 18/81.5 23/32
根据比例即可得知碳酸钠消耗酸多,碳酸氢钠生成CO2多1年前查看全部
- 现将石灰石样品15克与105.4克稀盐酸放入烧杯中充分反应(杂质不与稀盐酸反应),反应时间与反映前后烧杯内物质
 最爱烟雨楼1年前1
最爱烟雨楼1年前1 -
 独资等候 共回答了18个问题
独资等候 共回答了18个问题 |采纳率88.9%总得来说,杯中石灰石随时间推移,逐渐减少.具体杯中内容物,这要看石灰石纯度和稀盐酸的浓度是多少.根据反应方程知,约100g碳酸钙与约72g盐酸正好反应完全,生成110g氯化钙、44g二氧化碳和18g水.首先要看是石灰石过量还是盐酸过量,然后再判断1年前查看全部
- 将15.6gNa2O2与2.7gA1粉混合后,投入足量的水中,充分反应(没能产生的气体全部放出).
将15.6gNa2O2与2.7gA1粉混合后,投入足量的水中,充分反应(没能产生的气体全部放出).
(1)Na2O2与水反应的离子方程式为______;
15.6gNa2O2在该反应中转移电子的物质的量为______;
(2)反应结束时生成气体的体积在标准状况下为______;
(3)取agNa2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是[22.4a/156]<V≤[156.8a/264][22.4a/156]<V≤[156.8a/264](用含a的代数式表示,结果可不化简). 有心装载1年前1
有心装载1年前1 -
 寂寥的风铃 共回答了20个问题
寂寥的风铃 共回答了20个问题 |采纳率90%解题思路:(1)过氧化钠与水反应生成氢氧化钠与氧气,据此书写离子方程式;过氧化钠完全反应,反应中过氧化钠起氧化剂、还原剂作用,各占[1/2],据此计算;
(2)发生反应2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,生成气体为氢气和氧气,通过反应方程式计算氧气的体积,结合方程式进行氢氧化钠与铝反应的过量计算,根据不足的物质计算生成的氢气;
(3)Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,根据反应2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,过氧化钠的物质的量与Al的物质的量之比大于或等于1:2,据此根据极限法计算.(1)过氧化钠与水反应生成氢氧化钠与氧气,反应离子方程式为2Na2O2+2H2O=4N+a+4OH-+O2↑,
15.6gNa2O2的物质的量为[15.6g/78g/mol]=0.2mol,过氧化钠完全反应,反应中过氧化钠起氧化剂、还原剂作用,各占[1/2],
转移电子数为0.2mol×[1/2]×2=0.2mol,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;0.2mol;
(2)15.6gNa2O2的物质的量为[15.6g/78g/mol]=0.2mol,令生成的氢氧化钠的物质的量为xmol,氧气为ymol,则:
2Na2O2+2H2O═4NaOH+O2↑、
2 4 1
0.2molxmol ymol
所以x=0.4,y=0.1.
2.7gA1粉的物质的量为0.1mol,由方程式2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,0.1mol铝完全反应需要氢氧化钠0.1mol,铝完全反应,令铝反应生成氢气zmol,则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
0.1mol zmol
所以z=0.15,
所以在标准状况下反应结束时生成气体的体积为(0.1mol+0.15mol)×22.4L/mol=5.6L.
故答案为:5.6L;
(3)若Al和Na2O2与水反应生成的NaOH恰好反应.根据反应2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,过氧化钠的物质的量与Al的物质的量之比等于1:2,令过氧化钠的物质的量为xmol,则铝为2xmol,所以78x+54x=a,解得x=[a/132].所以生成气体为:
2Na2O2+2H2O═4NaOH+O2↑,
2 1
[a/132] mol[1/2]×[a/132]mol
2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
2 3
2×[a/132]mol 3×[a/132]mol
所以生成的气体体积为([1/2]×[a/132]mol+3×[a/132]mol)×22.4L/mol=[156.8a/264]L,
若只有过氧化钠,ag过氧化钠的物质的量为[ag/78g/molo]=[a/78]mol,生成气体为:
2Na2O2+2H2O═4NaOH+O2↑
2 1
[a/78]mol[1/2]×点评:
本题考点: 钠的重要化合物;铝的化学性质.
考点点评: 本题考查混合物的计算,难度较大,清楚反应过程注意根据反应的有关化学方程式进行计算,(3)中固体完全溶解,根据反应2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑判断过氧化钠的物质的量与Al的物质的量之比大于或等于1:2是关键.1年前查看全部
- 在光照下将等物质的量CH4和CL2充分反应,得到最多的物质是哪个怎么算?
 刚入市又怕又激动1年前1
刚入市又怕又激动1年前1 -
 hujiakang 共回答了15个问题
hujiakang 共回答了15个问题 |采纳率86.7%由CH 4 与Cl 2 发生取代反应的化学方程式可知,每生成1 mol 卤代烃可生成1 mol HCl,由于CH 4 和Cl 2 发生的每一步取代反应中都有HCl生成,所以产物中HCl的物质的量最多.1年前查看全部
- 向200ml0.5mol.L负一H2SO4的溶液中投入足量的锌,充分反应标准情况下生成H4的体积是多少
 碧雨萍1年前1
碧雨萍1年前1 -
 昶月的天空 共回答了18个问题
昶月的天空 共回答了18个问题 |采纳率100%硫酸物质的量为0.25mol,H物质的量为0.5mol,H2为0.25mol,体积为0.25乘22.4等于5.6L1年前查看全部
- 某有机物A的结构简式为,若取等质量的A分别与足量的Na、NaOH、新制的Cu(OH)2充分反应,理论上消耗这三种物质的物
某有机物A的结构简式为
 ,若取等质量的A分别与足量的Na、NaOH、新制的Cu(OH)2充分反应,理论上消耗这三种物质的物质的量之比为( )
,若取等质量的A分别与足量的Na、NaOH、新制的Cu(OH)2充分反应,理论上消耗这三种物质的物质的量之比为( )
A. 3:2:1
B. 3:2:2
C. 6:4:5
D. 3:2:3 leon1781年前4
leon1781年前4 -
 fanluwen 共回答了11个问题
fanluwen 共回答了11个问题 |采纳率81.8%解题思路:该有机物中含醇-OH、酚-OH、-COOH、-CHO,结合醇、酚、羧酸、醛的性质来解答.该有机物中含醇-OH、酚-OH、-COOH、-CHO,
若A均为1mol,
醇-OH、酚-OH、-COOH与Na反应,消耗3molNa;
酚-OH、-COOH与NaOH反应,消耗2molNaOH;
-COOH、-CHO与新制的Cu(OH)2反应,-CHO被氧化生成-COOH也参与反应,共消耗3molCu(OH)2,
故选D.点评:
本题考点: 有机物的结构和性质;有机物分子中的官能团及其结构.
考点点评: 本题考查有机物的结构与性质,注意把握官能团与性质的关系,熟悉醇、醛、羧酸、酚的性质即可解答,与氢氧化铜的反应为解答的难点,题目难度不大.1年前查看全部
- 1mol的Cl2和足量的NaOH充分反应为什么只转移1mol的电子,为什么不是2mol.
 driftinghh鞋1年前2
driftinghh鞋1年前2 -
 流浪的道路 共回答了15个问题
流浪的道路 共回答了15个问题 |采纳率100%2NaOH + Cl2===NaCl + NaClO + H2O
在此反应中,氯化钠既是氧化剂又是还原剂
一个氯原子失去一个电子变成次氯酸钠中氯
另一个氯原子得到一个电子变成负二价的氯离子
所以,当有1mol的氯气进行反应时,转移的只有1mol电子.
转移的电子数只能以得到或者失去的电子数为标准,不能将两个相加.1年前查看全部
- 将3.2gCu跟30ml,10mol/l的HNO3充分反应,还原产物有NO,NO2
将3.2gCu跟30ml,10mol/l的HNO3充分反应,还原产物有NO,NO2
若反应后溶液中有amolH离子,则次时溶液中含硝酸根离子物质的量 httafc1年前1
httafc1年前1 -
 发小呆 共回答了19个问题
发小呆 共回答了19个问题 |采纳率89.5%【答】:
硝酸的物质的量:0.03*8=0.24mol,3.2克铜,0.05mol
Cu+4HNO3==Cu(NO3)2+NO2↑+2H2O
3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O
反应后的溶液中,剩下Cu(NO3)2、HNO3
所以,n(NO3-) = 0.05 * 2 + a = 0.1 + a (mol)1年前查看全部
- 1..每____份质量的 P(磷) 与160份质量的 O2(氧气) 充分反应可生成284份质量的 P2O5 ( 5氧化2
1..每____份质量的 P(磷) 与160份质量的 O2(氧气) 充分反应可生成284份质量的 P2O5 ( 5氧化2磷 )
什么160分质量的氧气?
2.在CO和CO2的混合气体中,氧元素的质量分数为64%,10g该混合气体中含有CO2的质量为多少克? anny2007021年前1
anny2007021年前1 -
 81605666 共回答了23个问题
81605666 共回答了23个问题 |采纳率95.7%1.氧气与5氧化2磷质量比为160:284
答案是:每124份磷
2.设有CO x mol,CO2 y mol
(16x+32y)/(28x+44y)=0.64
28x+44y=10g
x:y=2:1
28x:44y=56:44
含有CO2 4.4g1年前查看全部
- (2008•益阳)将一定量的CO和C02的混合气体依次通过足量的NaOH溶液、灼热的氧化铜,充分反应(假设每次反应均反应
(2008•益阳)将一定量的CO和C02的混合气体依次通过足量的NaOH溶液、灼热的氧化铜,充分反应(假设每次反应均反应完全).最后所得到的气体( )
A.只有CO2
B.只有CO
C.CO和CO2都有
D.最后没有气体 收割少年1年前1
收割少年1年前1 -
 shan2000 共回答了16个问题
shan2000 共回答了16个问题 |采纳率93.8%解题思路:根据二氧化碳能与氢氧化钠反应而被其溶液吸收,一氧化碳能与热的氧化铜反应从而转化成二氧化碳判断.二氧化碳能与氢氧化钠反应而被其溶液吸收,一氧化碳与氢氧化钠不反应,故经氢氧化钠溶液后气体只剩一氧化碳,再通过灼热的氧化铜时,一氧化碳能与热的氧化铜反应从而转化成二氧化碳,故最终气体为二氧化碳.
故选A.点评:
本题考点: 常见气体的检验与除杂方法;二氧化碳的化学性质;一氧化碳的化学性质.
考点点评: 物质的推断是初中化学的难重点,也是中考的热点之一,了解物质的性质是解题的前提条件,解题时还要注意前后步骤间的联系,充分利用综合归纳法得出完整合理的结论.1年前查看全部
- 若向PH=3的盐酸溶液中加入相同体积的0.3mol/l的氨水,充分反应(题未打错)
若向PH=3的盐酸溶液中加入相同体积的0.3mol/l的氨水,充分反应(题未打错)
离子浓度大到小顺序 独孤秋1年前1
独孤秋1年前1 -
 虚假的我 共回答了16个问题
虚假的我 共回答了16个问题 |采纳率87.5%NH4+,OH-,Cl-,H+1年前查看全部
- 将 3.8g 二氧化碳和一氧化碳的混合气体,先通过足量的灼热的氧化铁充分反应,然后把生成的气体 通入到足量的澄清的石灰水
将 3.8g 二氧化碳和一氧化碳的混合气体,先通过足量的灼热的氧化铁充分反应,然后把生成的气体 通入到足量的澄清的石灰水中,经过滤,干燥,得沉淀 10g,求原混合气体中碳元素的质量分数
 大嘴龙1年前1
大嘴龙1年前1 -
 Hays_ghf 共回答了19个问题
Hays_ghf 共回答了19个问题 |采纳率94.7%3CO+ Fe2O3 =高温= 2Fe + 3CO2
CO2 +Ca(OH)2 ==CaCO3↓+ H20
混合物中的碳元素质量等于最后生成的碳酸钙中的碳元素质量
C--------CaCO3
12 100
X 10g
12/x=100/10g
X=1.2g
原混合气体中碳元素的质量分数 1.2g/3.8g*100%=31.6%1年前查看全部
- 将10.00gNaCl、KBr和CaCl2组成的混合物溶于水中,通入Cl2充分反应,然后把溶液蒸干并灼烧(高温加热),灼
将10.00gNaCl、KBr和CaCl2组成的混合物溶于水中,通入Cl2充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813g.若将此残留物再溶于水,并加入足量的Na2CO3溶液,所得的沉淀经干燥后质量为0.712g.求原混合物中KBr的质量分数.
 小小木头子1年前1
小小木头子1年前1 -
 梦断京都 共回答了22个问题
梦断京都 共回答了22个问题 |采纳率95.5%这题当中有一点不知你注意没有,就是通入Cl2后会生成Br2,但是在高温加热这一环节Br2会挥发出去,这是本题隐含的条件,找出这点就好办了,高温灼烧后剩余物只有KCl,NaCl和CaCl2了,三者总质量为9.813g.
Na2CO3 + CaCl2 === CaCO3(沉淀) + 2NaCl
111 100
a(氯化钙质量) 0.712g
a=0.79032g
由于上面已经算出KCl,NaCl和CaCl2了,三者总质量为9.813g.所以KCl,NaCl质量为9.813-0.79032=9.02268g
设有Na离子xmol,K离子ymol.
根据元素守恒得:
74.5y+58.5x=9.02268
58.5x+119y=10-0.79032
解得y=0.0042mol
所以KBr=0.0042mol换算成质量为0.0042*119=0.5g
所以kBr%=0.5/10*100%=5%1年前查看全部
- 化学金属及其化合物综合题将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设气体全部放出)(1
化学金属及其化合物综合题
将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设气体全部放出)
(1)Na2O2与水反应的化学方程式为————
15.6g Na2O2在该反应中转移电子的物质的量为——————
(2)反应结束时生成的气体在标准状况下为———— 上yy一飞1年前1
上yy一飞1年前1 -
 倾情一夜 共回答了10个问题
倾情一夜 共回答了10个问题 |采纳率100%2 Na2O2 + 2 H2O === 4 NaOH + O2
1 mol Na2O2反应转移1 mol电子,15.6 g Na2O2(0.2 mol)反应转移0.2 mol电子
0.2 mol Na2O2产生0.4 mol NaOH,而Al只有0.1 mol,NaOH过量.0.2 mol Na2O2产生0.1 mol O2,0.1 mol Al转移0.3 mol电子,产生0.15 mol H2,素以气体总物质的量为0.25 mol,折合标况下5.6 L1年前查看全部
- 铝|计算题|某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应)
铝|计算题|某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应)
某含铝90%的铝合金1.5g,跟40mL 6mol/L的盐酸充分反应(合金中的其他成分不与盐酸反应),过滤出不溶物,将滤液稀释到200mL……
见图:
答案是:16.8L;800mL
我哪里做错了?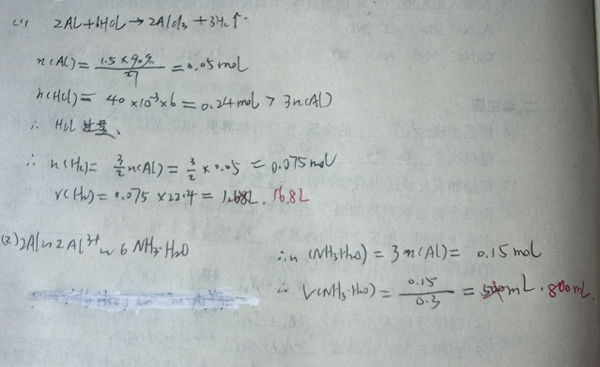
到底应该怎么做?
请详细说明,谢谢~~
 gezhidan1年前1
gezhidan1年前1 -
 天狼一笑 共回答了23个问题
天狼一笑 共回答了23个问题 |采纳率95.7%第1问,应该是1.68L,你做对的.
但第2问,你错了,盐酸过量,所以氨水先要中和盐酸.
可根据恰好完全与盐酸反应和沉淀Al3+后,溶液中只剩NH4Cl,即Cl-与NH4+等,则盐酸0.24mol,即需要氨水0.24mol,即800mL.1年前查看全部
- 钠与水反应生成NaOH和H 2 ,现向95.6克水中加入4.6克钠,充分反应(有水剩余).求:
钠与水反应生成NaOH和H 2 ,现向95.6克水中加入4.6克钠,充分反应(有水剩余).求:
(1)生成NaOH的质量是多少?
(2)反应后溶液中溶质的质量分数是多少? 海里的水1年前1
海里的水1年前1 -
 天狗小旺 共回答了19个问题
天狗小旺 共回答了19个问题 |采纳率94.7%(1)设氢氧化钠的质量为X,氢气的质量为Y.
2Na+2H 2 O═2NaOH+H 2 ↑
46 802
4.6gXY
46
4.6g =
80
X =
2
Y
X=8.0g
Y=0.2g
(2)反应后溶液的质量=95.6克+4.6克-0.2克=100克,则溶液中氢氧化钠的质量分数=
8.0g
100g ×100%=8%.
答:生成氢氧化钠的质量为8.0克;反应后溶液中氢氧化钠的质量分数为8%.1年前查看全部
- 某过氧化钠(Na2O2)样品中含有少量Na2CO3,取一定质量的样品跟过量稀硫酸充分反应(2Na2O2+2H2SO4═2
某过氧化钠(Na2O2)样品中含有少量Na2CO3,取一定质量的样品跟过量稀硫酸充分反应(2Na2O2+2H2SO4═2Na4SO4+O2↑+2H2O2,可通过测定产生O2的体积来计算过氧化钠的含量.请用如图所示装置设计一个简单实验,以测定样品中过氧化钠的含量.

请回答:
(1)按气流从左至右的方向,各装置的连接顺序是______.
(2)装置②中反应的离子方程式是______.
(3)装置③的作用是______. iwantu1年前1
iwantu1年前1 -
 大五留级生 共回答了15个问题
大五留级生 共回答了15个问题 |采纳率86.7%解题思路:样品和稀硫酸反应后,生成的气体通过②除去二氧化碳,发生2NaOH+CO2=Na2CO3+H2O,通过③检验二氧化碳是否除尽,通过①把水排出,通过④测定氧气的体积,根据氧气的体积结合反应2Na2O2+2H2SO4═2Na4SO4+O2↑+2H2O2,可确定过氧化钠的含量.(1)样品和稀硫酸在⑤中反应生成氧气,混有少量二氧化碳,可通过②除去二氧化碳,通过③检验二氧化碳是否除尽,通过①把水排出,通过④测定氧气的体积,测定产生O2的体积来计算过氧化钠的含量,则实验顺序为⑤→②→③→①→④,故答案为:⑤→②→③→①→④;
(2)装置②为二氧化碳和氢氧化钠的反应,反应的离子方程式为CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(3)装置③的作用是验证CO2是否除净,如没有除净,溶液会变浑浊,故答案为:验证CO2是否除净.点评:
本题考点: 探究物质的组成或测量物质的含量;钠的重要化合物.
考点点评: 本题考查物质的组成和含量的测定的实验设计,侧重于考查学生的实验探究能力和分析能力,题目难度不大,注意把握实验原理和先后顺序,为解答该题的关键,题目较为简单.1年前查看全部
- 为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3%的稀盐酸在烧杯(烧杯质量为20g)中充分反应(
为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3%的稀盐酸在烧杯(烧杯质量为20g)中充分反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水).有关实验数据如下表

(1)配制上述质量分数为7.3%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是?
(2)反应中生成二氧化碳的质量是?
(3)求解12g该石灰石样品中碳酸钙的质量分数? 411157752611年前1
411157752611年前1 -
 HBLinx 共回答了18个问题
HBLinx 共回答了18个问题 |采纳率100%(1)100*7.3%/36.5%=20g
(2)120g+12g-127.6g=4.4g
(3)4.4/44*100=10g1年前查看全部
- 氢气和氧气共3克,混合点燃使之充分反应生成1.8克水.
氢气和氧气共3克,混合点燃使之充分反应生成1.8克水.
则混合的氧气最多为多少?请写出步骤, 人格符号1年前1
人格符号1年前1 -
 天dd的宠儿 共回答了25个问题
天dd的宠儿 共回答了25个问题 |采纳率92%2H2 + O2 == 2H2O
4 ′ 32 ′ 36
0.2 ′ ′ 1.8g
H2的质量最少为0.2g
所以O2最多质量为3g-0.2g=2.8g1年前查看全部
- 将一些氧化铜粉末加入到100克14%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入20克铁粉(过量),充分反应
将一些氧化铜粉末加入到100克14%的硫酸溶液中,微热至氧化铜全部溶解,再向该蓝色溶液中加入20克铁粉(过量),充分反应后过滤,仍得到干燥后的固体物质20克.求:(1)原加入的氧化铜有多少克?(2)最后得到的溶液溶质质量分数是多少?
 鸿蒙过客1年前1
鸿蒙过客1年前1 -
 chen1005 共回答了18个问题
chen1005 共回答了18个问题 |采纳率83.3%解题思路:由题意可知,共有3个主要反应:①CuO+H2SO4═CuSO4+H2O②Fe+H2SO4═FeSO4+H2↑③Fe+CuSO4═FeSO4+Cu,铁参加反应两部分.由于100克14%的硫酸最终全部转化成FeSO4,故可先求出FeSO4和总的铁的质量.由于加入20g铁最后质量不变,所以增重的质量和与硫酸反应消耗的铁的质量相等,利用反应的物质的质量关系,可求出氧化铜的质量,与硫酸铜反应的铁的质量.根据以上计算可求出与硫酸反应的铁的质量,进而求出生成的氢气的质量,最后求出得到的溶液溶质质量分数.由题意可知,发生的反应有:CuO+H2SO4═CuSO4+H2O,Fe+H2SO4═FeSO4+H2↑,Fe+CuSO4═FeSO4+Cu,(1)设参加反应的Fe的总质量为x,反应生成FeSO4的总质量为y,则由上述反应可得:Fe~H2SO4 ~FeSO456&nb...
点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题考查了复杂的化学方程式的计算,解题的关键是首先审清题意,发生反应有哪些,物质的质量关系有哪些.1年前查看全部
- 一氧化碳和氧气的混合气体4.8g充分反应生成二氧化碳44g,求原混合气体中的一氧化碳和氧气各多少克?
 小精灵8207261年前1
小精灵8207261年前1 -
 cyx008ccc1 共回答了20个问题
cyx008ccc1 共回答了20个问题 |采纳率90%2CO+O2=2CO2
56 32 88
xg yg 44g
56/x=32/y=88/44
x=28g y=16
所以剩下的48-28-16=4克可能全是氧气 也可能全是一氧化碳
所以质量比可能为CO:O2=28:20=7:5或CO:O2=32:16=2:11年前查看全部
- 某同学为了检验实验室里锌粒的纯度,称取20g锌粒样品,投入到装有200g稀硫酸的烧杯中,充分反应(硫酸足量,锌粒样品的杂
某同学为了检验实验室里锌粒的纯度,称取20g锌粒样品,投入到装有200g稀硫酸的烧杯中,充分反应(硫酸足量,锌粒样品的杂质不与酸反应)后,残余物的质量为219.4g.
请根据题意计算:
(1)反应后生成的氢气的质量为多少克?
(2)锌粒样品中锌的质量分数是多少? them1年前1
them1年前1 -
 lssq741022 共回答了14个问题
lssq741022 共回答了14个问题 |采纳率92.9%解题思路:(1)锌和稀硫酸反应会产生氢气,根据质量守恒定律可知,反应后减少的总质量即为生成氢气的质量.
(2)根据锌和稀硫酸反应的化学方程式,利用氢气的质量可求出参加反应的锌的质量,进而求出锌的质量分数即可.(1)反应生成氢气的质量为:20g+200g-219.4g=0.6g
设参加反应的铁的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.6g
[65/x]=[2/0.6g]
解得:x=19.5g
(2)锌粒样品中锌的质量分数是:[19.5g/20g]×100%=97.5%
答:(1)反应后生成的氢气的质量为0.6克;
(2)锌粒样品中锌的质量分数是97.5%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是利用化学方程式的计算,其中利用反应前后总质量的差值来求产生气体的质量是此类题常用的方法.1年前查看全部
- 在光照条件下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
在光照条件下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
A. CH3Cl
B. CH2Cl2
C. CCl4
D. HCl mai77221年前1
mai77221年前1 -
 纯不纯净水 共回答了15个问题
纯不纯净水 共回答了15个问题 |采纳率93.3%解题思路:由CH4与Cl2发生取代反应的化学方程式可以知道,每生成1mol卤代烃,可生成1molHCl,CH4与Cl2发生的每一步取代反应中都有HCl生成.由CH4和氯气发生取代反应的化学方程式可以知道,每生成1mol卤代烃,可生成1molHCl,由于CH4和Cl2发生的每一步取代反应中都有HCl生成,不要错误地认为n(CH4):n(Cl2)=1:1,则按下式进行反应:CH4+Cl2
光照
CH3Cl+HCl,不再发生其它反应,其实,该反应一旦发生,生成的CH3Cl与Cl2发生“连锁”反应.
故选D.点评:
本题考点: 甲烷的化学性质.
考点点评: 本题考查甲烷的性质,题目难度不大,在CH4和Cl2的取代反应中可生成四种有机取代产物,同时也生成无机产物HCl.在解此题时往往忽略HCl.由于CH4的四种取代反应中都有HCl生成,无论哪一种取代产物多,都生成HCl,因此生成的HCl量最多.1年前查看全部
- (2011•黄石)钠与水反应生成NaOH和H2,现向95.6克水中加入4.6克钠,充分反应(有水剩余).求:
(2011•黄石)钠与水反应生成NaOH和H2,现向95.6克水中加入4.6克钠,充分反应(有水剩余).求:
(1)生成NaOH的质量是多少?
(2)反应后溶液中溶质的质量分数是多少? ct_流风1年前1
ct_流风1年前1 -
 zayz 共回答了12个问题
zayz 共回答了12个问题 |采纳率100%解题思路:(1)写出化学方程式并代入钠的质量计算出氢氧化钠的质量.
(2)写出化学方程式并代入钠的质量计算出氢气的质量,然后计算出反应后溶液的质量.(1)设氢氧化钠的质量为X,氢气的质量为Y.
2Na+2H2O═2NaOH+H2↑
46 802
4.6gXY
[46/4.6g]=[80/X]=[2/Y]
X=8.0g
Y=0.2g
(2)反应后溶液的质量=95.6克+4.6克-0.2克=100克,则溶液中氢氧化钠的质量分数=[8.0g/100g]×100%=8%.
答:生成氢氧化钠的质量为8.0克;反应后溶液中氢氧化钠的质量分数为8%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 掌握化学方程式的计算格式和规范性,本题的关键是计算出反应后溶液的质量.1年前查看全部
- 在CuCl2和MgCl2混合溶液中加入过量的铁锌粉充分反应过滤,所得固体是什么.
 zyupon1年前2
zyupon1年前2 -
 雨咝198618 共回答了25个问题
雨咝198618 共回答了25个问题 |采纳率92%因为Zn+CuCl2==ZnCl2+Cu
而且是过量的,但是Mg更活泼,所以没有办法置换出来!
所以剩余的固体是Cu单质,还有剩余的Fe、Zn单质!1年前查看全部
- 现有氧化铝和氧化铁的混合物共10克,用一氧化碳充分反应还原后,测得共生成二氧化碳的质量为8.8克.
现有氧化铝和氧化铁的混合物共10克,用一氧化碳充分反应还原后,测得共生成二氧化碳的质量为8.8克.
则混合物中金属元素的质量分数为 acrilk1年前1
acrilk1年前1 -
 langke882 共回答了21个问题
langke882 共回答了21个问题 |采纳率100%好象是初中化学,用质量列方程
AI2O3+3CO=2AI+3CO2
102 132
X 132X/102
Fe2O3+3CO=2Fe+3CO2
160 132
Y 132Y/160
X+Y=10
132X/102+132Y/160=8.8
12.7%和88.3%1年前查看全部
- 氢气和氧气共3g,混合点燃后使之充分反应生成1.8g水,则混合气体中氧气最多可为多少g?
 whuiwhu1年前3
whuiwhu1年前3 -
 城堡中的花 共回答了22个问题
城堡中的花 共回答了22个问题 |采纳率81.8%1 反应的H2与O2与生成的水的质量比=1:8:9
反应的H2质量=1.8/9=0.2
反应的O2质量=1.8*8/9=1.6
H2 O2在点燃情况下不共存
H2 O2只有一者剩余
1 设H2剩余
m(H2)=3-1.6=1.4
m(O2)=1.6
2 设O2剩余
m(H2)=0.2
m(O2)=3.0-0.2=2.8
则混合气体中氧气最多可为2.8g1年前查看全部
- 用1摩尔二氧化锰和含4摩尔氯化氢的盐酸充分反应(共热)
用1摩尔二氧化锰和含4摩尔氯化氢的盐酸充分反应(共热)
在不考虑氯化氢挥发的情况下,得到绿的氯气( )
A.等于2摩尔
B.等于1摩尔
C.小于1摩尔
D.大于1摩尔 williamhu951年前3
williamhu951年前3 -
 qwer120339 共回答了20个问题
qwer120339 共回答了20个问题 |采纳率95%C.小于1摩尔
因为MnO2+4HCl(浓)===(共热)MnCl2++Cl2+2H2O
反应过程中,生成的水会逐渐使盐酸变稀,而反应一定要浓盐酸才能生成氯气.
1摩尔二氧化锰和4摩尔氯化氢生成1摩尔氯气,所以稀盐酸生成的氯气是小于1摩尔的.1年前查看全部
- 称量10.0g铁屑样本,加入一定质量的稀硫酸,加热使之充分反应(杂志不参加反应)然后冷却,秤量
称量10.0g铁屑样本,加入一定质量的稀硫酸,加热使之充分反应(杂志不参加反应)然后冷却,秤量
反应后烧杯中物质的质量比反应前减少了0.34g,求:(1)生铁中杂质的质量(2)生产100t这种生铁,至少需要含氧化铁80%的赤铁矿的质量 nishusheng-1041年前1
nishusheng-1041年前1 -
 巴豆巴豆82 共回答了17个问题
巴豆巴豆82 共回答了17个问题 |采纳率94.1%(1)0.48 g (2)170 t
1、根据质量守恒定律,0.34 g是生成H2的质量,
设Fe质量为x
Fe + H2SO4 = FeSO4 + H2↑
56 2
x 0.34 g
x = 9.52 g
即Fe质量为9.52 g
杂质质量10-9.52 = 0.48 g
2、设要含氧化铁80%的赤铁矿的质量为y
Fe2O3+3CO=3CO2+2Fe
160 112
0.8y 100*(1-4.8%)
y = 170 t
至少需要含氧化铁80%的赤铁矿的质量170 t1年前查看全部
- 1molNA2O2与足量CO2充分反应转移电子书为2NA对不
 ptusdu1年前2
ptusdu1年前2 -
 沥血长枪 共回答了18个问题
沥血长枪 共回答了18个问题 |采纳率100%不对 ,NA2O2既做氧化剂又做还原剂1年前查看全部
- 在化学用语中,“完全反应”“充分反应”“恰好完全反应”的具体区别为什么?
 Samdy1年前1
Samdy1年前1 -
 注意卫生就快好了 共回答了15个问题
注意卫生就快好了 共回答了15个问题 |采纳率86.7%完全反应就是说另一种反应物可能有剩余,但是该种反应物一定用尽.比如说c+o2=co2,说c完全反应,那么o2可能有剩余
充分反应是在可能的条件下尽可能多地反应掉某种物质
恰好完全反应是说反应物完全剩余,恰好用完1年前查看全部
- 关于一些化学的基础问题请问在大理石与稀盐酸反应中,生成的CaCl2溶不溶于水.若要求杂质(杂质不反应)是不是就是充分反应
关于一些化学的基础问题
请问在大理石与稀盐酸反应中,生成的CaCl2溶不溶于水.若要求杂质(杂质不反应)是不是就是充分反应后剩下的固体质量? rtdr1年前4
rtdr1年前4 -
 asrd 共回答了15个问题
asrd 共回答了15个问题 |采纳率93.3%CaCl2溶于水,若要求杂质(杂质不反应)就是恰好完全反应后剩下的固体质量.
充分反应也可以是碳酸钙有剩余,而盐酸用完造成的.
充分反应至少有一种反应物用完;恰好完全反应所有的反应物用完.1年前查看全部
- 将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分反应
将一定量的氧化铜加入到100ml 0.5mol/l的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10g充分反应后过滤,烘干,得干燥的固体物质为10g.
(1)参加反应的铁为多少?
(2)原加入的氧化铜为多少?
(3)最后得到的溶液为100ml,其物质的量浓度为多少? 灰蓝海1年前1
灰蓝海1年前1 -
 lfl19829 共回答了20个问题
lfl19829 共回答了20个问题 |采纳率90%我来吧
首先分析一下反应过程
(先不论反应是否过量问题,以免落入题目陷阱)
首先CuO与H2SO4反应,然后Fe又从CuSO4中置换出Cu (计算可知,H2SO4相对于CuO过量,最后的固体是Fe、Cu混合物)
换言之,最后溶液中没有Cu,
那我们可以这么理解,简化过程,理解成过程中只有 Fe与H2SO4反应,最后剩下FeSO4溶液,
那么第一问
H2SO4~~~~~~反应的Fe
1 56
100*10-3* 0.5 X
解得 过程中反应的Fe有2.8(g)
接着是第二问
剩余的Fe=加入的10 gFe — 反应掉的Fe =10-2.8=7.2(g)
最后10 g固体物质中的Cu=固体物质 — 剩余的Fe =10-7.2=2.8(g)
Cu~~~~~~~~~~~~~~~CuO
64 80
2.8 Y
解得 原加入的CuO有4(g)
最后一问,其实都不用算,由SO42-守衡知道,FeSO4也有0.05mol,既然体积不变那么物质的量浓度也不变
很晚了,脑子有点瞌睡了,表述不清之处,还请见谅,不明白再来问我吧,说道你懂为止1年前查看全部
- 在一个密闭容器内有A、B、C、D四种物质,在一定积极作用下充分反应(其中只发生一个化学反应),测得反应前后各物质的质量如
在一个密闭容器内有A、B、C、D四种物质,在一定积极作用下充分反应(其中只发生一个化学反应),测得反应前后各物质的质量如表所示:
试判断该密闭容器中发生反应的化学反应基本类型为( )物质 A B C D 反应前的质量/g 35 2 24 15 反应后的质量/g 待测 64 0 10
A.化合反应
B.分解反应
C.置换反应
D.无法判断 xiaduaner1年前1
xiaduaner1年前1 -
 sailorZ 共回答了23个问题
sailorZ 共回答了23个问题 |采纳率87%解题思路:由题意可知,根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;根据各物质的质量变化情况,确定出反应物和生成物,进而判断出该反应的类型.由题意可知,由表中数据可知,B物质增加了62g,是生成物;C物质减少了24g,是反应物;D物质减少了5g,是反应物.根据质量守恒定律,A是反应物,参加反应的A的质量为33g.故A、C、D是反应物,B是生成物,属于化合反应.
故选A.点评:
本题考点: 质量守恒定律及其应用;反应类型的判定.
考点点评: 本题难度不大,主要考查了学生运用质量守恒定律进行计算、推断的能力,解答本题要充分理解质量守恒定律和反应类型的判断方法.1年前查看全部
- 将一定质量的含50%Fe2O3的赤铁矿装入一硬质试管中,通入CO,高温下充分反应(杂质不参加反应)
将一定质量的含50%Fe2O3的赤铁矿装入一硬质试管中,通入CO,高温下充分反应(杂质不参加反应)
将一定质量的含50%Fe2O3的赤铁矿装入一硬质试管中,通入CO,高温下充分反应(杂质不参加反应),将生成的气体全部通入足量的澄清石灰水中,生成白色沉淀3g.将反应后留在试管中的剩余固体冷却后进行检验,结果是铁和赤铁矿的混合物,称重共4.8g.问原赤铁矿有多少克?
28g,问了好多人答案都不唯一,有10.56g还有6.88g,我算出来是6.88g可是错的. 789shangcheng1年前2
789shangcheng1年前2 -
 央央乐 共回答了12个问题
央央乐 共回答了12个问题 |采纳率91.7%3CaCO3 3CO2 Fe2O3~3O
3*100 3*16
3 x
x==0.48 g 即反应使固体减少的质量,就是CO带走的O的质量
所以原混合物是 0.48 +4.8==5.28 g1年前查看全部
- 3molNO2和H2O充分反应为什么转移2mol电子 为什么1molCL2和足量NaOH反应电子转移是1mol?怎么算的
3molNO2和H2O充分反应为什么转移2mol电子 为什么1molCL2和足量NaOH反应电子转移是1mol?怎么算的啊 我会算得失电子 这转移有怎么搞
 一粒猪1年前4
一粒猪1年前4 -
 zqjb9adgg4299 共回答了13个问题
zqjb9adgg4299 共回答了13个问题 |采纳率92.3%您好:3NO2+H2O=2HNO3+NO,这个问题可以通过得失电子数目相等来解释:
在NO2中,N是+4价,在HNO3中,N是+5价,在NO中,N是+2价,所以,在这个反应中,NO2中有1mol的N通过得电子,从NO2中+4价的N变化为+2价的N,转移了2mol的电子,所以,反应中转移的电子数目为2mol
转移几摩尔的电子是通过反应的系数来确定的,因为在化学反应方程式中NO2的系数是3,所以要有3mol的NO2反应才能实现有2mol的N转移到HNO3中,1mol的N转移到NO中,所以转移的电子数是2NA
与3mol有关系,对应的,如果条件是3amol,那么转移的电子数就是2aNA
化学方程式:Cl2 + 2NaOH===NaCl+NaClO+H2O
离子方程式:Cl2 + 2OH- ===Cl- + ClO- + H2O
1个Cl2分子中有2个氯原子,其中1和失去1个电子变成ClO-
而另一个氯原子得到这个电子变成Cl-,所以1个Cl2分子转移一个电子,1mol氯气转移1mol电子
希望对你的学习有帮助
满意请采纳O(∩_∩)O谢谢1年前查看全部
- 在化学反应2A+B2==2AB中,A与B2反应的质量关系为1:1,现将6gA和8gb2充分反应 则生成AB质量为?12g
在化学反应2A+B2==2AB中,A与B2反应的质量关系为1:1,现将6gA和8gb2充分反应 则生成AB质量为?12g?还有选项9g 11g 14g 多选 (也可以选一个)
 nnml1年前3
nnml1年前3 -
 zhichiyyz 共回答了17个问题
zhichiyyz 共回答了17个问题 |采纳率88.2%答案是12g的...
A与B2反应的质量关系为1:1,通俗的说就是A与B2反应的质量相等,
也就是说6gA只能和6gB2反应.剩余2gB2不参与反应.
根据质量守恒定律,反应物 的质量等于生成物质量,6g+6g=12g.
还有楼上的,人家说的是 质量关系..与参与反应的分子(原子)个数没有关系吧.1年前查看全部
- 如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
①计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)
②实验前后分别称量了装置A和装置B的质量如表中所示.若数据Ⅰ准确,请回答:
a.反应后A中固体的成分是______.
b.数据Ⅱ存在的问题是______,可能的原因是______.反应前质量(g) 反应后质量(g) Ⅰ 装置A 125.3 124.2 Ⅱ 装置B 152 152.3 
 -点点红豆1年前1
-点点红豆1年前1 -
 6762sk 共回答了17个问题
6762sk 共回答了17个问题 |采纳率82.4%①0.1mol氧化铜的质量为:0.1mol×80g/gmol=8g设生成二氧化碳的质量为x2CuO+C 高温 . 2Cu+CO 2 ↑160 448gx 160 8g = 44 x 解得:x=2.2g答:该实验最多可以生成2....1年前查看全部
- 如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。反应前质量(g) 反应后质量(g) Ⅰ 装置A 125.3 124.2 Ⅱ 装置B 152 152.3  xiejun20021年前1
xiejun20021年前1 -
 ljslfjldjfe 共回答了20个问题
ljslfjldjfe 共回答了20个问题 |采纳率95%(1)2.2g;(2)a氧化铜和铜 b数据Ⅱ中反应后的质量偏小 澄清石灰水量不足,没有将生成的二氧化碳全部吸收
1年前查看全部
- 先回答 完全反应,恰好完全反应,充分反应区别!不要抄网上的!要准确
 iNPRwANG1年前1
iNPRwANG1年前1 -
 易风之 共回答了25个问题
易风之 共回答了25个问题 |采纳率96%完全是指 一个物质没了 一个物质不知道还多不多(应该是多出来的 但哪个就不确定了 一般都是计算题中要你过量判断的)
恰好是指 两个物质按照化学配比正好消耗完 反应物都没了
充分是指 要你求的那个物质反应完了 比如氢气在过量氧气中充分燃烧 那肯定是氧气还多咯
ps 上面一楼的完全反应解释不对的 不一定没有1年前查看全部
- 一道高三化学题将15.6gNa2O2与2.7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出),反应结束
一道高三化学题
将15.6gNa2O2与2.7gAl粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出),反应结束时生成气体的体积在标准状况下为___L;取agNa2O2与Al份组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围为___.(用含a的代数式表示,结果可不化简)
请各位高手写出详细过程谢谢 mashaohua1年前1
mashaohua1年前1 -
 karonesh 共回答了19个问题
karonesh 共回答了19个问题 |采纳率94.7%第一题:
2Na2O2+2H2O=4NaOH+O2
2Al+2NaOH+2H2O=2NaAlO2+3H2
n(Na2O2)=15.6/78 mol=0.2mol
n(O2)=0.1mol
n(Al)=2.7/27 mol=0.1mol,NaOH过量
n(H2)=1.5n(Al)=0.15mol
V=(0.1+0.15)22.4L=5.6L
第二题:
用字母代数值,然后极端假设.
1.没有铝,此时只有氧气,V最小.
n(O2)=1/2n(Na2O2)
V1=a/78*0.5*22.4L
2.铝与生成的NaOH恰好完全反应,此时V最大.n(H2)=n(NaOH)
V2=V(O2)+V(H2)
=a/78*0.5*22.4L+a/78*2*22.4L
=a/78*2.5*22.4L
答案:V11年前查看全部
- 有一包有CuO和木炭混合而成的黑色粉末称重50g,将其放入试管内加热,让两者充分反应(如图所示),停止加热并冷却,称得剩
有一包有CuO和木炭混合而成的黑色粉末称重50g,将其放入试管内加热,让两者充分反应(如图所示),停止加热并冷却,称得剩余固体混合物的质量为39g,(碳与试管内少量氧气的反应忽略不计)。
(1)反应中生成二氧化碳_______g。
(2)参加反应的氧化铜的质量是多少?
 马上去接宝宝1年前1
马上去接宝宝1年前1 -
 小民呼唤 共回答了20个问题
小民呼唤 共回答了20个问题 |采纳率75%1年前查看全部
- 某气体X中可能含有H2、CO、CO2、水蒸气中的一种或几种.把X通入灼热的盛有过量的CuO的试管(已排尽空气),充分反应
某气体X中可能含有H2、CO、CO2、水蒸气中的一种或几种.把X通入灼热的盛有过量的CuO的试管(已排尽空气),充分反应后,管内物质质量减少1.6g.将反映后的气体全部通入过量的澄清的石灰水,充分反应后得到10g白色沉淀,则气体X的组成不可能是() (已知:氢气和一氧化碳均能将氧化铜还原为金属铜,分别生成水和二氧化碳)
A.CO B.H2 CO2 C.CO H2 H2O D.CO CO2 小豆瓣YU1年前3
小豆瓣YU1年前3 -
 chongchong_3399 共回答了18个问题
chongchong_3399 共回答了18个问题 |采纳率77.8%物质减少1.6是O元素的质量,所以反应的CuO就是0.1摩,白色沉淀碳酸钙0.1摩,说明CO2有0.1摩,C选项中,若有CO,则必须是0.1摩,若有H2,那么产物中就没那么多CO2.D选项中,若有CO就必须是0.1摩,那么CO2量就多,所以不行1年前查看全部
大家在问
- 1《遥远的绝响》——余秋雨 其中“绝响”是指什么?
- 2we each后跟单数还是复数?
- 3已知函数f(x)=sinπx^2,-1≤x≤0 e^x-2,x>0 则满足f(x0)=1的实数x0=
- 4已知等比数列{xn}的公比为q,则有lim n→∞ {[(x1)/(1+q)]-q^n}=1/2
- 51958年,中共中央错误发动“大跃进”和人民公社化运动的原因是
- 6The study of discourse analysis in the teaching of English r
- 7在“as...as”及其否定结构中,形容词若作定语修饰可数名词单数时,不定冠词应放在( ).
- 8《锁》的阅读答案
- 9画一画,画图表示下列算式的意义.
- 10设a为锐角,且a不等于45度,若2sina*cosa+1/3sina-1/3cosa=1,写出以tana,cota为根的
- 111.下面关于思想道德与法律关系的阐述正确的事( ) A.都是调节人们思想行为,协调人际关系维护社会次序的重要.B.在调节
- 12用60千克小麦可磨出42千克的面粉,平均磨一千克面粉需要多少小麦?
- 13第20课《真理诞生于一百个问号之后》课后题目与答案
- 14My day with Canada’s cops
- 15如图,在屋顶A处看一栋楼底部C处,刚好经过小树顶端M点,在楼顶D处看房底部B点处,也刚好经过小树顶端M点,小树MN高3c

