把8g铁、铜合金放入到盛有29.2g的稀盐酸的烧杯中,恰好完全反应,生成0.2g气体, (1)合金中铜的质量
 落落离花2022-10-04 11:39:541条回答
落落离花2022-10-04 11:39:541条回答(2)稀盐酸中溶液的质量分数
(3)反应后所得溶液的浓度

已提交,审核后显示!提交回复
共1条回复
 丫的我就不登陆 共回答了18个问题
丫的我就不登陆 共回答了18个问题 |采纳率88.9%- 铜与盐酸不反应
Fe + 2HCl === FeCl2 + H2↑
56 73 127 2
x y z 0.2g
56/x=73/y=127/z=2/0.2g
x=5.6g
y=7.3g
z=12.7g
(1)合金中铜的质量 8g-5.6g=2.4g
(2)稀盐酸中溶液的质量分数 7.3g/29.2g*100%=25%
(3)反应后所得溶液的浓度 12.7g/(5.6g+29.2g-0.2g)*100%=36.7% - 1年前
相关推荐
- 铁、铜合金粉末共a(mol),投入b(mol)的稀硝酸中,铜物质的量为x(mol),充分反应后,稀硝酸的还原产物只有NO
铁、铜合金粉末共a(mol),投入b(mol)的稀硝酸中,铜物质的量为x(mol),充分反应后,稀硝酸的还原产物只有NO,(已知:2Fe3++Fe==3Fe2+;2Fe3++Cu==2Fe2++Cu2+),问:1、溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围.
2、当x=0.5,且溶液中Fe2+、Fe3+物质的量相等,在标准状况下,产生672ml的气体,求a、b的值. chilam7271年前1
chilam7271年前1 -
 追逸女孩 共回答了11个问题
追逸女孩 共回答了11个问题 |采纳率90.9%过量的稀硝酸会氧化二价铁变为三价铁,所以最多完全反应b为2a.但能不能无限小,要让溶液里有铜离子,应大于2(a-x).
有三价铁证明完全反应无固体金属,先算出铜和稀硝酸反应生成气体,用总气体减去铜的.因为二价铁和三价铁物质的量相等,根据其生成气体的量就可以根据化学方程式算出总的铁的量了.
但是你给的数好像是错的.因为光是铜生成的量就大于672ml了.怀疑是不是67、2L.1年前查看全部
- 有一金,铜合金块,总质量为185.5g,
 流浪水妖1年前1
流浪水妖1年前1 -
 谁动了我的密码 共回答了13个问题
谁动了我的密码 共回答了13个问题 |采纳率84.6%金的质量为m,则铜质量是185.5-m,利用总体积列等式:
m/ρ金+(185.5-m)/ρ铜=15
m/19.3+(185.5-m)/8.9=15
m=96.5
所以铜的质量是:89克.1年前查看全部
- 有铁,铜合金,且铁,铜总为amol,铜的物质的量分数为x,研成粉末,全投入b molHNO3的稀溶液中
有铁,铜合金,且铁,铜总为amol,铜的物质的量分数为x,研成粉末,全投入b molHNO3的稀溶液中
微热充分反应,且硝酸还原产物只有NO当x=0.5时溶液中Fe2+和Fe3+物质的量相同,在标况下气体体积为672ml,求a,
(不是铁先与硝酸反应吗,为什么要通过铜物质的量来算铁呢?)
可是标准答案b=0.12mol额,这是什么情况阿 掺水咖啡1年前1
掺水咖啡1年前1 -
 儿子还就TMD爱我 共回答了19个问题
儿子还就TMD爱我 共回答了19个问题 |采纳率78.9%溶液中有Fe2+ 说明硝酸已经反应完全,且有一部分铜与3价的铁反应
NO有0.672/22.4=0.03MOL.
把0.03MOL的HNO3还原为NO转移电子为0.09MOL
X=0.5且二价三价铁离子一样多.根据电子转移守恒列出等式
0.5a*2+0.25a*2+0.25a*3=0.09MOL
a=0.04.
铜离子0.02MOL.二价铁离子0.01MOL.三价铁离子0.01MOL
所以溶液中硝酸根离子有0.09MOL
加上还原为NO的0.09MOL..b=0.181年前查看全部
- 一块锡铜合金重90千克,其中铜的含量是锡的1.5倍,合金中含锡和铜各多少克?
 给TTYA拉票1年前1
给TTYA拉票1年前1 -
 悠幽 共回答了15个问题
悠幽 共回答了15个问题 |采纳率86.7%设这块合金含锡x千克
x+1.5x=90
2.5x=90
x=36
则这块合金含铜1.5x=54千克
答:这块合金含锡36千克,含铜54千克1年前查看全部
- 现有一块铜合金,可能是黄铜(铜锌合金);青铜(铜锡合金)或白铜(铜镍合金) 中的一种,欲测定其组成.
现有一块铜合金,可能是黄铜(铜锌合金);青铜(铜锡合金)或白铜(铜镍合金) 中的一种,欲测定其组成.
{质料}:锌,锡,镍皆能与稀硫酸发生置换反应,生成+2价的金属离子
{实验步骤及数据}取5克合金粉碎后放入烧杯中,将20克15%稀硫酸分四次加入烧杯中充分反应后,测定剩余固体质量数据记录如下:
次数
1
2
3
4
加入酸质量/g
5.0
5.0
5.0
5.0
剩余固态质量
4.5
4
3.5
3.2
试求:
1.合金中铜的质量分数?
2.通过计算判断合金中另一金属为何种金属? 王睿你是我的1年前1
王睿你是我的1年前1 -
 魔鱼西西 共回答了18个问题
魔鱼西西 共回答了18个问题 |采纳率88.9%①合金中铜的质量分数=
3.2g
5g
×100%═64%
②设该金属的化学式为R,其相对原子质量为x,则:
R+H2SO4 ═RSO4+H2↑
x 98
5g-4.5g=0.5g 5.0g×15%=0.75g
x
0.5g
═
98
0.75g
x=65.3≈65
故另一种金属为锌.
答:(1)合金中铜的质量分数64%.
(2)合金中另一金属为锌.1年前查看全部
- 34常见合金的主要应用(一)1.铜合金:各种铜合金的组成________(青铜:________;黄铜:________
34常见合金的主要应用(一)
1.铜合金:各种铜合金的组成________(青铜:________;黄铜:________,还含有少量锡、铅、铝等;白铜:含________及少量锰).
2.钢
(1)碳素钢:钢是以铁、碳为主要成分的合金,它的含碳量一般________2.11%.碳素钢是由生铁冶炼获得的合金,除铁、碳为其主要成分外,还含有少量的________________________________________,按含碳量又可分为________(含碳量<=0.3%),韧性、焊接性好,强度低;________(0.3%<含碳量<0.6%),强度高、韧性及加工性好;________(含碳量>=0.6%),硬而脆,热处理好后弹性好.
(2)合金钢是____________________________________________得到的多元合金.合金钢具有优良的性能. chenyunyun011年前2
chenyunyun011年前2 -
 jiuyinongmin 共回答了20个问题
jiuyinongmin 共回答了20个问题 |采纳率85%1.青铜:铜锡合金 黄铜(含锌及少量的锡、铅、铝等)及白铜(含镍、锌及少量锰)成分
2.钢是以 铁、碳为主要成分的合金,它的含碳量一般小于2.11%
‘碳素钢’是由生铁冶炼获得的合金,除铁、碳为其主要成分外,还含有少量的锰、矽、硫、磷等杂质.
碳素钢 *低碳钢 (含碳量≤0.3%)
*中碳钢 (0.3%<含碳量<0.6%)
*高碳钢 (含碳量≥0.6%)
合金钢’是在碳钢基础上,有目的地加入某些元素(称为合金元素)而得到的多元合金.1年前查看全部
- 铜合金属于A金属材料B复合材料C合成材料D无机非金属材料
铜合金属于A金属材料B复合材料C合成材料D无机非金属材料
急用,顺便再将选项中的各类材料的特征说一下,谢 我很着急1年前1
我很着急1年前1 -
 rtyrhygfhhghh 共回答了19个问题
rtyrhygfhhghh 共回答了19个问题 |采纳率89.5%A 金属材料金属材料:金属元素或以金属元素为主构成的具有金属特性的材料的统称.包括纯金属、合金、金属材料金属间化合物和特种金属材料等. (注:金属氧化物(如氧化铝)不属于金属材料)复合材料:是由两种或两种以...1年前查看全部
- 碲加入金属铜合金中可以改变什么性能
 这里的我1年前2
这里的我1年前2 -
 成柳 共回答了20个问题
成柳 共回答了20个问题 |采纳率95%碲消费量的80%是在冶金工业中应用:铜合金加入少量碲,能改善其切削加工性能并增加硬度.1年前查看全部
- 初三化学小科在学习了金属的化学性质后,想对锌、铜合金中锌的质量分数进行粗略测定.在老师的指导下,他
初三化学小科在学习了金属的化学性质后,想对锌、铜合金中锌的质量分数进行粗略测定.在老师的指导下,他
小科在学习了金属的化学性质后,想对锌、铜合金中锌的质量分数进行粗略测定.在老师的指导下,他设计了如图所示的实验装置,并选用了三种试剂:A.蒸馏水 B.锌、铜合金 C.稀硫酸.根据小科的实验思路,请你思考:
(1)在广口瓶中加入一定量的蒸馏水,在底部有小孔的试管内应加入 (填写试剂的相应字母标号).
(2)如要测定部分被氧化成氧化锌的锌粒中锌单质的质量分数,能否用上述实验方法,请说明理由: .
这题我有点看不懂,麻烦详细点,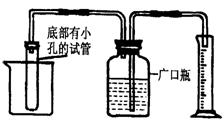
 小佳希1年前1
小佳希1年前1 -
 GT沉落沧澜 共回答了15个问题
GT沉落沧澜 共回答了15个问题 |采纳率80%B 锌铜合金可以 氧化锌与稀硫酸生成水和盐 只有锌单质与稀硫酸反应才有气体H2生成
试管中加入锌铜合金(底部开孔) 在最左端烧杯加入稀硫酸 与合金反应 只有Zn能与稀硫酸反应放出H2 (Cu活泼性较差)可以用生成H2的量 来推算原合金中Zn的量 从而计算质量分数生成的H2导入广口瓶 将广口瓶中的水压入右侧量筒内 量筒内水的体积可以近似看成生成H2的体积
对于第二问 H2体积即为Zn未氧化部分的反应产物氧化锌与稀硫酸产物为水和硫酸锌用生成H2的量推算混合物中Zn的量 → 质量分数1年前查看全部
- 有银和铜合金一块,其中铜重301克,相当于银的八分之七还少40克,合金中银重多少克?
 青云观潮1年前2
青云观潮1年前2 -
 xuanzc1079 共回答了22个问题
xuanzc1079 共回答了22个问题 |采纳率90.9%设银为x,则铜为7/8*x-40
7/8x-40=301
7/8x=301
x=344
银重344克1年前查看全部
- 药金又称愚人金,实为锌、铜合金.由于药金外观与黄金相似,常被不法商贩用来冒充黄金谋取暴利.设计实验,验证试验台上的药金戒
药金又称愚人金,实为锌、铜合金.由于药金外观与黄金相似,常被不法商贩用来冒充黄金谋取暴利.设计实验,验证试验台上的药金戒指不是黄金戒指.
 小麦191年前5
小麦191年前5 -
 radmanovic100 共回答了15个问题
radmanovic100 共回答了15个问题 |采纳率93.3%1,加入稀酸(与金属不发生氧化还原反应的),看是否有气体产生,产生者为愚人金
2.放在火上烘烤,若表面出现黑色固体且不易除去者为愚人金
3.投入铁的盐溶液中,表面能有黑色固体生成者为愚人金1年前查看全部
- 铜及铜合金根据所含的合金元素,可以分为( )( )( )及( )等.
 寒露kmi1年前2
寒露kmi1年前2 -
 naisheep 共回答了25个问题
naisheep 共回答了25个问题 |采纳率92%铜及铜合金根据所含的合金元素,可以分为(紫铜)、(黄铜)、(青铜)及(白铜)等.1年前查看全部
- 在空气中铜合金眼镜框表面形成一层铜绿属于原电池反应,
 我来我徵服1年前3
我来我徵服1年前3 -
 kofely 共回答了14个问题
kofely 共回答了14个问题 |采纳率92.9%(-)2Cu+CO2+4OH-=CuCO3·Cu(OH)2+H2O+4e-(+)O2+2H2O+4e-=4OH-总反应2Cu+O2+H2O+CO2=CuCO3·Cu(OH)2电池负极为铜,但正极不一定为金属,一些可以导电的尘埃颗粒也有可能作正极.另外该反应在一些细菌的作用下也会发生,细...1年前查看全部
- GMT-N114铜合金修补剂
 tupu1年前1
tupu1年前1 -
 漫步云端00 共回答了12个问题
漫步云端00 共回答了12个问题 |采纳率75%东莞市骏诚特种设备有限公司拥有多年的零件修复经验,对球铁,铸铁,蠕墨铸铁,生铁,铜合金,铝合金,纯铝,模具,碳钢,不锈钢,合金钢等材料表面砂眼、气孔、裂纹可以用本体材料进行无温修复,对铸造件渗漏可以进行铸件浸渗还原处理.
进口GMT纳米零件表面修补剂以高分子纳米复合材料、金属、合金、高分子数脂等组成的聚合金属复合型无温冷焊修补材料,固化后具有优异的机械性能,可进行钻孔、切削、磨削及攻丝等各种机械加工,用于各种零件、金属铸件的修补及各种铸件气孔、砂眼、裂纹、磨损、腐蚀的修复.
适用于铜铸件或铜合金制品的气孔、凹陷、裂缝、腐蚀、磨损、断裂的修补与再生,修复后颜色与基材基本一致,具有很高的强度,及优异的耐磨抗蚀与耐老化特性.1年前查看全部
- 铝,铁,铜合金溶于足量烧碱溶液时相关反应的离子方程式
 yinjun11年前1
yinjun11年前1 -
 kyleswy 共回答了23个问题
kyleswy 共回答了23个问题 |采纳率95.7%只发生一个反应,Al 与 NaOH的反应
离子方程式 2 Al + 2 OH- + 2 H2O = 2 AlO2- + 3 H2↑
化学方程式 2 Al + 2 NaOH + 2 H2O = 2 NaAlO2 + 3 H2↑
Cu、Fe都不反应1年前查看全部
- 如果用Na2S2O3标准溶液测定铜矿或铜合金中的铜,用什么基准物标定Na2S2O3溶液的浓度最好?为什么?
 我爱葡萄0001年前1
我爱葡萄0001年前1 -
 ivyandivy 共回答了27个问题
ivyandivy 共回答了27个问题 |采纳率81.5%准确移取25ml已知浓度的重铬酸钾溶液于锥形瓶中,+5mlHCI,5mlKI放于暗处5分钟,有硫代硫酸钠滴定至淡黄色,+2ml淀粉指示剂,继续用硫代硫酸钠滴定至亮绿色为终点1年前查看全部
- 将20g黄铜(锌和铜合金)与足量的稀硫酸反应产生0.2g的氢气,求:(1)黄铜中锌的质量(2)锌与铜的质量比
 SMDANG1年前1
SMDANG1年前1 -
 紫珂 共回答了10个问题
紫珂 共回答了10个问题 |采纳率90%Zn + H2SO4 = ZnSO4 + H2
65 2
x 0.2
x=6.5g
(1)黄铜中锌的质量=6.5g
铜的质量=20=6.5=13.5g
(2)锌与铜的质量比 =6.5:13.5=13:271年前查看全部
- 纯锡焊锡丝、锡铜合金焊锡丝、锡银铜合金焊锡丝、松香焊锡丝、免清洗焊锡丝哪个好?各有什么优缺点、熔点各是多少?
 这该nn的生活1年前1
这该nn的生活1年前1 -
 百合格格 共回答了16个问题
百合格格 共回答了16个问题 |采纳率100%我一般使用的是松香焊锡丝,这种焊锡丝是空心的里面带有助焊剂,很方便,效果也不错.
具体熔点不知道.其它类型没用过1年前查看全部
- 关于一道大学无机及分析化学的题某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59
关于一道大学无机及分析化学的题
某年级学生用碘量法测定某铜合金中铜的质量分数,得到120个分析结果基本符合正态分布N(59.11,0.36)。求分析结果出现在区间(58.39,59.70)内的概率。求大神解答啊,刚开始学有点不明白
 shiyu19971年前1
shiyu19971年前1 -
 丽江女儿 共回答了15个问题
丽江女儿 共回答了15个问题 |采纳率73.3%总体平均值是59.11,总体标准偏差是0.36,然后根据边界值求u,再据u值去查概率积分表即可。1年前查看全部
- CuSn5Zn5Pb5铜合金化学成分是什么?
 i36ba1年前2
i36ba1年前2 -
 luoligang6954 共回答了15个问题
luoligang6954 共回答了15个问题 |采纳率93.3%Sn4~6%
Zn4~6%
Pb4~6%
其余的是Cu及杂质的含量.
铜合金的化学成份很好辨认,基本上,元素后面的数字就是百分含量1年前查看全部
- 请问这个牌号的铜合金成分多少?CuAl10Ni具体到范围,
 海上的小王子1年前2
海上的小王子1年前2 -
 燕赤不侠 共回答了22个问题
燕赤不侠 共回答了22个问题 |采纳率100%Aluminum (Al) 8.5 - 11.0 %
Nickel (Ni) 4.0 - 6.5%
Iron (Fe) 3.5 - 5.5 %
Manganese (Mn) 3.0% max.
Copper (Cu) 馀量
铝青铜, 有较高的强度及硬度,且具优良的耐海水特性及润滑性.1年前查看全部
- 熔化极氩弧焊的特点是A不能焊铜合金B用钨极做电极C可采用高密度电流D焊件变形比钨极氩弧焊大
熔化极氩弧焊的特点是A不能焊铜合金B用钨极做电极C可采用高密度电流D焊件变形比钨极氩弧焊大
选择 i_chocolate1年前1
i_chocolate1年前1 -
 老鼠过街人人让 共回答了10个问题
老鼠过街人人让 共回答了10个问题 |采纳率90%C1年前查看全部
- 把一副铜合金镜架的质量为2x10的一2次方Kg,若以钛合金代替铜合金,求这副镜架的质量.(已知铜合金架密度为8·0x10
把一副铜合金镜架的质量为2x10的一2次方Kg,若以钛合金代替铜合金,求这副镜架的质量.(已知铜合金架密度为8·0x10的3次方千克每立方米,钛合金架密度为4·5x10的3次方)
 卢小1年前2
卢小1年前2 -
 程金镇1 共回答了19个问题
程金镇1 共回答了19个问题 |采纳率89.5%V=M/PV=2*10^-2kg/8.0*10^3kg/m^-3=0.25*10^-5kgm=pvm=4.5*10^3*0.25*10^-5=1.125*10^-2kg1年前查看全部
- 在空气中铜合金眼镜框表面形成一层铜绿属于原电池反应,
 test061511年前3
test061511年前3 -
 hualong0923 共回答了21个问题
hualong0923 共回答了21个问题 |采纳率90.5%铜绿形成的化学方程式:2Cu+CO2+H2O+O2=Cu2(OH)2CO3
铜做负极失电子,与空气中的氧气和二氧化碳生成碱式碳酸铜1年前查看全部
- (2005•烟台)有一均匀的颗粒状锌、铜合金Wg.某学生利用如图所示的装置,通过测定合金与酸反应产生氢气的体积来测定合金
(2005•烟台)有一均匀的颗粒状锌、铜合金Wg.某学生利用如图所示的装置,通过测定合金与酸反应产生氢气的体积来测定合金锌、铜的质量分数.试回答下列问题(在空格处填写相应的字母标号):
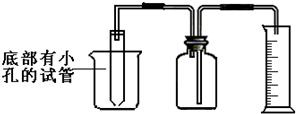
(1)实验时应在烧杯中加入______,在试管中加入______,在广口瓶中加入______.
提供试剂:A.蒸馏水B.稀硝酸C.稀硫酸D.锌、铜合金
(2)实验过程中的部分操作如下:
a.读出量筒内液体的体积b.依次向烧杯与广口瓶加入试剂
c.取出试管d.向试管中加入药品,置于烧杯中
正确的操作顺序是:______.
(3)若合金与酸充分反应后,量筒中接收的液体的体积为VL,为求出合金中锌、铜的质量分数,还缺少的一个数据是______.
A.反应前烧杯试剂的体积 B.反应前烧杯中试剂的质量分数
C.实验广口瓶中试剂的体积 D.实验条件下氢气的密度. 0624_xx1年前1
0624_xx1年前1 -
 ncsnake1977 共回答了23个问题
ncsnake1977 共回答了23个问题 |采纳率100%解题思路:通过测定合金与酸反应产生氢气的体积来测定合金锌、铜的质量分数,此合金中是锌与稀硫酸反应产生氢气,要根据氢气求锌的质量,还需知道氢气的密度.(1)排在氢前的金属可以与盐酸或稀硫酸反应生成氢气,与硝酸等强氧化性酸不能产生氢气,要测定生成氢气的体积,可以使用排水法,所以本题答案为:C,D,A;
(2)进行实验时,为防止生成的氢气散逸造成结果不准确,首先取出试管,向烧杯和广口瓶中加入药品,然后再向试管中加入试剂,置于烧杯中,使反应进行,反应完毕,读出读数即可,所以本题答案为:cbda;
(3)根据方程式进行的计算是物质质量间的计算,所以知道了氢气的体积,要求氢气的质量,还需要知道氢气的密度,所以本题答案为:D.点评:
本题考点: 金属活动性顺序及其应用;实验步骤的探究;量气装置;酸的化学性质.
考点点评: 本题考查了金属性质的应用,要测定其中某成分的含量,可以使其发生化学反应,而另一种金属不反应.根据生成物质的质量来进行起算.1年前查看全部
- 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 .
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 . 零度飘雪1年前2
零度飘雪1年前2 -
 途中的吉木 共回答了15个问题
途中的吉木 共回答了15个问题 |采纳率73.3%1)写出Cu2O跟稀硝酸反应的离子方程式
【3Cu2O+14H++2NO3=6Cu2++2NO+7H2O】
(2)若将上述混合物用足量的H2加热还原,所得到的固体的质量为
【若将上述混合物用足量的H2加热还原,所得到的固体的质量为16g】【依据CU元素守恒】
设CuO、Cu2O的物质的量分别为x、y
则0.2+2y=0.3mol【得失电子守恒】
0.1+x+2y=0.25mol【Cu元素守恒】
x=0.05mol;y=0.05mol
(3)若混合物中含0.1molCu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为
【0.1mlol】(CuO~H2SO4)(Cu2O~H2SO4)
(4)若混合物中Cu的物质的量为nmol,则n的取值范围为
【n的取值范围为0.051年前查看全部
- 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:(1)向硫酸铜、氯化钠混合溶液中滴加
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:(1)向硫酸铜、氯化钠混合溶液中滴加
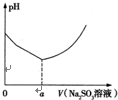 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
(1)向硫酸铜、氯化钠混合溶液中滴加亚硫酸钠溶液生成CuCl沉淀,
实验测得溶液的pH与亚硫酸钠溶液体积的关系曲线如图所示.
①用离子方程式解释亚硫酸钠溶液呈碱性的原因:______.
②用离子方程式解释图象中V<a时溶液酸性增强的原因:______.
当V>a时,随着亚硫酸钠溶液的体积增大,溶液pH增大的原因是______
(2)已知:Ksp(AgCl)=8×10-10,Ksp(CuCl)=1.2×10-6.向CuCl 浊液中滴加硝酸银溶液,
发生反应CuCl(s)+Ag+(aq)═AgCl(s)+Cu+(aq),该应平衡常数K=______.
(3)硫酸铜溶液中含少量硫酸铁,加入氢氧化铜,过滤,除去三价铁离子,写出加入氢氧化铜时发生反应的离子方程式:______.
(4)测定CuCl和CuCl2混合物中CuCl含量的原理为用氯化铁溶液溶解样品,以邻菲罗啉作指示剂,用Ce(SO4)2溶液滴定至终点,滴定反应为Ce4++Fe3+=Fe2++Ce3+.氯化铁与氯化亚铜反应的离子方程式为______.
 身与白云间1年前1
身与白云间1年前1 -
 yearnJJ 共回答了13个问题
yearnJJ 共回答了13个问题 |采纳率92.3%(1)①亚硫酸钠溶液呈碱性的原因是亚硫酸根水解生成亚硫酸氢根和氢氧根,离子方程式为:SO32-+H2O?HSO3-+OH-,故答案为:SO32-+H2O?HSO3-+OH-;
②硫酸铜、氯化钠和亚硫酸钠反应生成氯化亚铜和硫酸、氯化钠,离子方程式为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;随着亚硫酸钠溶液的体积增大,因为亚硫酸钠溶液呈碱性,所以消耗了溶液中的氢离子,溶液pH增大,
故答案为:2Cu2++2Cl-+SO32-+H2O═2CuCl↓+SO42-+2H+;亚硫酸钠消耗了溶液中H+;
(2)由CuCl(s)+Ag+(aq)═AgCl(s)+Cu+(aq),得K=
C(Cu+)
C(Ag+)=
Ksp(CuCl)
C(Cl?)
Ksp(AgCl)
C(Cl ?)=
Ksp(CuCl)
Ksp(AgCl)=
1.2×10 ?6
8×10 ?10=1.5×103;故答案为:1.5×103;
(3)铁离子和氢氧化铜反应生成氢氧化铁和铜离子,离子方程式为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+,故答案为:2Fe3++3Cu(OH)2═2Fe(OH)3↓+3Cu2+;
(4)氯化铁与氯化亚铜反应生成氯化亚铁和氯化铜,离子方程式为:Fe3++CuCl═Fe2++Cu2++Cl-,故答案为:Fe3++CuCl═Fe2++Cu2++Cl-.1年前查看全部
- 有金和铜合金1000克,其中含金2份,含铜3份,要改变合金成分,是它含金1份含铜4份,应加入同几克 急
 caizy1681年前1
caizy1681年前1 -
 山贼 共回答了23个问题
山贼 共回答了23个问题 |采纳率87%1000×0.4=400(g)1000×0.6=600(g)
设加入x克同,则
400/(1000+x)=0.2
x=2000(g)
所以要加入2000克铜1年前查看全部
- 有一块金、铜合金块,总质量185.5g 总体积15平方厘米,金密度19.3,铜密度8.9,求含金多少克?
 Q212841年前1
Q212841年前1 -
 szzw913 共回答了12个问题
szzw913 共回答了12个问题 |采纳率83.3%列方程设金体积为x,铜(15-x)
19.3x+8.9(15-x)=185.5
解得x=5cm³ m=ρv=19.3g/cm³×5cm³ =86.5g1年前查看全部
- 铜合金日本牌号C6801的成分是?
 素色红菱艳1年前1
素色红菱艳1年前1 -
 wenwenwa 共回答了20个问题
wenwenwa 共回答了20个问题 |采纳率90%C6801 俗称环保用快削黄铜,切削性良好,符合环保低,低镉,低铬,低汞等要求,适用於电脑,电子,钟表,钓具,笔,灯饰,螺丝,螺帽,光学,医疗,照相机等各种五金零件.化学成分如下:
Cu 57.64.0%
Bi 0.4.0%x09
Sn 0.2.5%x09
Al1年前查看全部
- (2010•安庆模拟)将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得
(2010•安庆模拟)将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时收集到NO气体的体积为2.24L 孤独langzi1年前1
孤独langzi1年前1 -
 双眼单皮 共回答了15个问题
双眼单皮 共回答了15个问题 |采纳率80%解题思路:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属);
C.根据守恒可知n(NaOH)=n(OH-),根据V=[n/c]计算加入的氢氧化钠溶液的体积;
D.根据电子转移守恒计算n(NO),但NO所处的状态不确定.将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,则
A.根据电子转移守恒,镁和铜的总的物质的量为[0.3mol/2]=0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故A正确;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属)=[8/3]×0.15mol=0.4mol,故B错误;
C.根据守恒可知n(NaOH)=n(OH-)=0.3mol,加入的氢氧化钠溶液的体积=[0.3mol/3mol/L]=0.1L=100mL,故C正确;
D.根据电子转移守恒,n(NO)=[0.3mol/5−2]=0.1mol,NO所处的状态不确定,其体积不一定是2.24L,故D错误.
故选AC.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度较大.1年前查看全部
- 23.(共7分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.
23.(共7分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.
23.(共7分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况).请回答下列问题:(1)写出Cu2O跟稀硝酸反应的离子方程式 .(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 .
(1)……(2)16克(3)0.1(4)0.05 dk66661年前3
dk66661年前3 -
 dongtao 共回答了21个问题
dongtao 共回答了21个问题 |采纳率81%方程式3Cu2o+14HNO3=6Cu(NO)2+2NO+7H2O 3Cu+8HNO3=3Cu(NO)3+2NO+4H2O
1.5X 7X X 1.5Y 4Y Y
7X+4Y=0.6 X=0.2/3
X+Y=0.1 Y=0.1/3
Cu2O=0.1mol Cu=0.05mol
Cu2O+H2=2Cu+H2O CuO+H2=Cu+H2O这样继续算下去就行了1年前查看全部
- 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
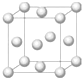 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
(1)基态Cu原子的电子排布式是______;铜晶体晶胞如图所示,该晶胞实际拥有______个铜原子;
(2)①某+1价铜的配离子为[Cu(CN)4]3−,与配体互为等电子体的一种微粒是______(写化学式).
②许多+1价铜的配合物溶液能吸收CO和烯烃(如C2H4、CH3CH=CH2等),CH3CH=CH2分子中c子采取的杂化方式有______.
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:______;根据价层电子对互斥模型,预测SO42-的空间构型为______. zhouyaxin1年前1
zhouyaxin1年前1 -
 水译三年的新tt 共回答了21个问题
水译三年的新tt 共回答了21个问题 |采纳率95.2%解题思路:(1)铜是29号元素,原子核外有29个电子,根据构造原理书写其基态核外电子排布式;利用均摊法计算原子个数;
(2)①原子个数相同、价电子数相同的微粒是等电子体;
②根据价层电子对互斥理论确定杂化方式;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,根据价层电子对互斥理论确定其空间构型.(1)铜是29号元素,原子核外有29个电子,根据构造原理知其核外电子排布式为:1s22s22p63s22p63d104s1,该晶胞中铜原子个数=8×[1/8+6×
1
2=4,
故答案为:1s22s22p63s22p63d104s1;4;
(2)①某+1价铜的配离子为[Cu(CN)4]3−,其配体是CN-,与配体为等电子体的微粒有:CO、N2等,故答案为:CO、N2;
②CH3CH=CH2分子中甲基上的C原子含有4个共价单键,属于SP3杂化,碳碳双键两端上的碳原子含有3个 σ键,属于SP2杂化,故答案为:SP3、SP2;
(3)氢氧化铜和氨水反应生成铜氨络合离子和氢氧根离子,离子反应方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,SO42-中S原子价层电子对=4+
1
2](6+2-4×2)=4,且不含孤电子对,所以是正四面体结构,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;正四面体.点评:
本题考点: 原子核外电子排布;判断简单分子或离子的构型;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查物质结构,较综合,这些都是学习重点,会利用价层电子对互斥理论确定杂化方式、微粒空间构型,难度中等.1年前查看全部
- 写出铝,铝合金,铜,铜合金的各种性能,(力学性能,工艺性能)详细点,
写出铝,铝合金,铜,铜合金的各种性能,(力学性能,工艺性能)详细点,
如题. 张洪浪1年前1
张洪浪1年前1 -
 小颠婆 共回答了18个问题
小颠婆 共回答了18个问题 |采纳率88.9%我的百度文库有详细的合金各种性能的ppt,免财富值的
铝,铝合金
铜,铜合金1年前查看全部
- 铜合金中各元素的作用我想知道CuAl10Ni5Fe4铜合金中铁和镍的作用是什么,如果铁和镍含量有0.5%左右偏差会不会有
铜合金中各元素的作用
我想知道CuAl10Ni5Fe4铜合金中铁和镍的作用是什么,如果铁和镍含量有0.5%左右偏差会不会有什么影响?
这种铜合金是英国的牌号。含3-5%铁,4-6的镍,我们分析下来发现2.5%左右的铁,6.5左右的镍,(这种零件主要用于止推作用,需要一定的耐磨、强度) swlong1年前1
swlong1年前1 -
 pingpingxiaoyu85 共回答了15个问题
pingpingxiaoyu85 共回答了15个问题 |采纳率100%你这个成分相差太多了,理论上影响不好要不你测量下其硬度值(如洛氏硬度),再测下抗拉强度,看是不是达标我是学材料科学的,参考资料我们老师的ppt中讲得较清楚铝青铜中铁、镍的含量要差不多才能保证良好的机械性能ppt中...1年前查看全部
- 金属材料鉴别铜合金有很多种类.常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金.现有一种铜合金,未确定其为四种合金中哪一种
金属材料鉴别
铜合金有很多种类.常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金.现有一种铜合金,未确定其为四种合金中哪一种,作如下实验
将20克合金粉末加入到98克20%稀硫酸中,恰好完全反应后过滤,将滤液蒸干后得到固体纯净物32.2克
(1)此合金含有的另一种金属的化学式为?
(2)求解生成氢气的质量?
(3)该合金中含铜的质量
知道里面过去以有的解答我看过,看不懂. 枭首于阵1年前2
枭首于阵1年前2 -
 ll一小棵 共回答了22个问题
ll一小棵 共回答了22个问题 |采纳率90.9%首先,不可能是铜银合金,这不用说.由题意,恰好完全反应,即硫酸完全反应,硫酸根全部由硫酸转移到反应后滤液中,也就是硫酸根全在蒸干后的固体纯净物中,反应前硫酸根怎么算?稀硫酸中溶质的质量=98*20%=19.6克,硫酸根的质量=19.6×96/98=19.2克,这对吧,那么固体纯净物中金属质量就是32.2-19.2=13克,金属与硫酸比为13:19.6=65:98,相对分子质量65是什么?锌.然后就是列方程式计算了,则生成氢气的质量为0.4克,该合金中含铜的质量=20-13=7克.全手打.1年前查看全部
- 高中化学题目,解释下列关于合金的说法正确的是A青铜是一种用途广泛的铜合金B铝合金的硬度一般比纯铝大C生铁的熔点高于纯铁D
高中化学题目,解释
下列关于合金的说法正确的是
A青铜是一种用途广泛的铜合金
B铝合金的硬度一般比纯铝大
C生铁的熔点高于纯铁
D某些金属加工成合金可增强其抗腐蚀性能
下列关于Na2o2的说法正确的是
A具有强氧化性,可用作漂白剂
B阴阳离子个数比为1:1 conniefa1年前3
conniefa1年前3 -
 davydl 共回答了26个问题
davydl 共回答了26个问题 |采纳率88.5%D某些金属加工成合金可增强其抗腐蚀性
A具有强氧化性,可用作漂白剂1年前查看全部
- 一副铜合金的眼镜架的质量是0.02Kg,若以钛合金代替铜合金,求这副钛合金镜架的质
 睁着眼睛睡觉觉1年前1
睁着眼睛睡觉觉1年前1 -
 东东鱼 共回答了20个问题
东东鱼 共回答了20个问题 |采纳率90%铜的密度是8.9克/立方厘米,钛的密度是4.5克/立方厘米
所以这副钛合金镜架的质量差不多是0.01KG,也就是10g左右吧1年前查看全部
- 高温熔解镀金件成含金的铜合金,硝酸溶解后怎样提出金?
高温熔解镀金件成含金的铜合金,硝酸溶解后怎样提出金?
溶解铜合金后形成红色的沉淀物… wangxaa41年前1
wangxaa41年前1 -
 野豌豆21_alec 共回答了17个问题
野豌豆21_alec 共回答了17个问题 |采纳率94.1%有不溶于硝酸的物质呗 是银的含量吧反应中硝酸只有1/4被还原,因此,设反应的硝酸物质的量为x,铜的物质的量为y 3Cu+8HNO3=3Cu(NO3)2+2NO+1年前查看全部
- 碘量法测铜为什么用盐酸分解铜合金
 χīлg1年前1
χīлg1年前1 -
 jerry988 共回答了12个问题
jerry988 共回答了12个问题 |采纳率75%是用的稀盐酸和过氧化氢,不是单独的盐酸1年前查看全部
- 有银和铜合金200g,其中含银2份,含铜3份,现在要改变合金成分,使含银3份,含铜7份,应加铜几克
 二岩河1年前1
二岩河1年前1 -
 ever518007 共回答了20个问题
ever518007 共回答了20个问题 |采纳率85%应加铜 66.67克1年前查看全部
- 锡铜合金在干燥还是潮湿腐蚀的快
 0320132101年前1
0320132101年前1 -
 zhunaoke 共回答了22个问题
zhunaoke 共回答了22个问题 |采纳率90.9%潮湿.
水里才有离子.会发生电化反应,像电池一样.1年前查看全部
- 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+1、+2等,故能形成多种铜的化合物。
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+1、+2等,故能形成多种铜的化合物。
(1)基态铜原子的电子排布式是____________;铜晶体晶胞结构如图所示,该晶胞实际拥有________ 个铜原子;该种堆积方式______(填“是”或“不是”)密置堆积。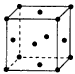
(2)许多+1价铜的配合物溶液能吸收CO和烯烃(如C 2 H 4 、CH 3 CH=CH 2 等)。试问,形成配合物的条件是________________ ,已知CO和N 2 属于等电子体,试写出CO的结构式______________,CH 3 CH=CH 2 分子中碳原子采取的杂化方式有________________。
(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,后沉淀溶解形成深蓝色的溶液。写出蓝色沉淀溶解的离子方程式__________________________;根据价层电子对互斥理论,预测SO 4 2- 的空间构型为___________,与SO 4 2- 互为等电子体的原子团有____________ (试写两例)。 凤落1年前1
凤落1年前1 -
 绝望米奇 共回答了15个问题
绝望米奇 共回答了15个问题 |采纳率93.3%1年前查看全部
- 向m g镁、铜合金中加入稀硝酸溶液至合金恰好完全溶解(设硝酸的还原产物只有NO),向所得溶液中加入物质的量浓度
向m g镁、铜合金中加入稀硝酸溶液至合金恰好完全溶解(设硝酸的还原产物只有NO),向所得溶液中加入物质的量浓度为2mol/L的NaOH溶液至沉淀达到最大值,产生沉淀的质量为(m+n)g,则下列有关叙述中不正确的是( )
A. 若n=5.1,则m的值可能为9.8
B. 若n=5.1,则参加反应的硝酸的物质的量为0.4 mol
C. 若n=5.1,则加入的NaOH溶液的体积为150 mL
D. 若n=5.1,则被还原的硝酸的物质的量为0.1 mol starnshao1年前1
starnshao1年前1 -
 fronda 共回答了13个问题
fronda 共回答了13个问题 |采纳率84.6%解题思路:mg镁、铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入2mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,生成NO为0.1mol,
A.金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属);
C.根据V=[n/c]计算加入的氢氧化钠溶液的体积;
D.被还原的硝酸生成NO,故氮元素守恒计算被还原的硝酸.mg镁、铜合金加入到稀HNO3中,二者恰好反应,金属、硝酸都没有剩余,反应中还原产物只有NO,发生反应:3Mg+8HNO3(稀)═3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH═Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH═Cu(OH)2↓+2NaNO3,
沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为[0.3mol/2]=0.15mol,生成NO为[0.3mol/5−2]=0.1mol,
A.镁和铜的总的物质的量为0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属)=[8/3]×0.15mol=0.4mol,故B正确;
C.加入的氢氧化钠恰好与硝酸镁、硝酸铜反应,由上述分析可知,加入的NaOH为0.15mol×2=0.3mol,故加入NaO溶液的体积为[0.3mol/2mol/L]=0.15L=150mL,故C正确;
D.被还原的硝酸生成NO,根据氮元素守恒可知,被还原的硝酸的物质的量等于NO的物质的量,即被还原硝酸的物质的量为0.1mol,故D正确;
故选:A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题主要考查混合物有关计算,侧重考查电子转移守恒、质量守恒等综合运用和解决复杂问题的能力,是一道不错的能力考查题目,难度中等,B选项也可以利用氮原子守恒计算硝酸的物质的量.1年前查看全部
- 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2.已知Cu2O与稀硫酸反应,溶液呈蓝色.现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况).请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 .
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 .
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 .
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为
PS:只用回答三四问即可!第三问答案:0.1mol(4)0.05 monkgeky1年前2
monkgeky1年前2 -
 feweoflklkjjk 共回答了17个问题
feweoflklkjjk 共回答了17个问题 |采纳率94.1%(1)3Cu2O + 14H+ + 2NO3- ---->6Cu2+ + 2NO + 7H2O
(2)3Cu+8HNO3---->3Cu(NO3)2+2NO+4H2O ; CuO+2HNO3---->Cu(NO3)2+H2O
n(NO)=2240/22400=0.1mol ; m(Cu)=64*(0.6-0.1)/2=16g
(3)Cu:xmol ; Cu2O:ymol ; CuO:zmol
x+2y+z=16/64=0.25 ; x+2y=0.1*3/2=0.15 .
x=0.1mol,y=0.025mol,z=0.1mol
n(H2SO4)=y+z=0.125mol
(4)z=0.1mol,x+2y=0.15,01年前查看全部
- 铜及铜合金焊接时主要问题是什么,应采取什么样的预防措施
 didiubs5211年前1
didiubs5211年前1 -
 落离子 共回答了26个问题
落离子 共回答了26个问题 |采纳率96.2%铜及铜合金焊接时主要问题:1、铜的导热率大焊接热量易散失,容易产生未焊透与未融合等缺陷;2、液态铜对氢溶解能力很大,因而容易形成气孔;3、铜在高温下容易氧化生成氧化亚铜,氧化亚铜极易与铜形成共晶造成焊接裂纹;4、合金成分蒸发主要是Zn.
预防措施:焊接方法选择氩弧焊、气焊、手弧焊、埋弧焊、等离子焊;焊接前清理焊缝,减少焊缝氢的引入;焊接前预热或焊接过程中采用预热方式.用含硅焊丝配合含硼砂的溶剂,以阻碍Zn的蒸发.1年前查看全部
- 选取3克锌铜合金与足量的稀硫酸,反应完全后,得到气体的体积为0.1L,求锌,铜合金中锌的质量分数是多少?
选取3克锌铜合金与足量的稀硫酸,反应完全后,得到气体的体积为0.1L,求锌,铜合金中锌的质量分数是多少?
氢气的密度为0.089g/L uu小混混1年前1
uu小混混1年前1 -
 做男人真难 共回答了23个问题
做男人真难 共回答了23个问题 |采纳率82.6%设得到气体的体积为0.1LH2需要X克锌
Zn+H2SO4=ZnSO4+H2
65-----------------------22.4
X--------------------------0.1
X=0.29克
锌,铜合金中锌的质量分数是:
0.29/3=9.7%1年前查看全部
- (2010•安庆模拟)将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得
(2010•安庆模拟)将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A. 开始加入合金的质量可能为6.4g
B. 参加反应的硝酸的物质的量为0.1mol
C. 生成沉淀完全时消耗NaOH溶液的体积为100mL
D. 溶解合金时收集到NO气体的体积为2.24L 2007_10251年前2
2007_10251年前2 -
 兰若zyq 共回答了17个问题
兰若zyq 共回答了17个问题 |采纳率100%解题思路:将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属);
C.根据守恒可知n(NaOH)=n(OH-),根据V=[n/c]计算加入的氢氧化钠溶液的体积;
D.根据电子转移守恒计算n(NO),但NO所处的状态不确定.将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3 (稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3 (稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为[5.1g/17g/mol]=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,则
A.根据电子转移守恒,镁和铜的总的物质的量为[0.3mol/2]=0.15mol,假定全为镁,质量为0.15mol×24g/mol=3.6g,若全为铜,质量为0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)为3.6g<m<9.6g,故A正确;
B.根据方程式可知参加反应的n反应(HNO3)=[8/3]n(金属)=[8/3]×0.15mol=0.4mol,故B错误;
C.根据守恒可知n(NaOH)=n(OH-)=0.3mol,加入的氢氧化钠溶液的体积=[0.3mol/3mol/L]=0.1L=100mL,故C正确;
D.根据电子转移守恒,n(NO)=[0.3mol/5−2]=0.1mol,NO所处的状态不确定,其体积不一定是2.24L,故D错误.
故选AC.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度较大.1年前查看全部
- 您好,我想问铝合金、铜合金和钛合金的特性特征是什么?他们的区别是?还有各自的应用范围,请帮忙回答下吧,
 ucsgation1年前1
ucsgation1年前1 -
 s倾城s 共回答了14个问题
s倾城s 共回答了14个问题 |采纳率85.7%答:(骑车装具店里装了一个下护板)是民用的,一般民用不可能用钛合金,是铝合金表面镀一层钛合金.店主说是钛合金的,可是我怎么看都是铝合金,1年前查看全部
大家在问
- 1以下为我将一些古文句窜在一起,说得过去吗?
- 2第二节:短文改错 (共10小题;每小题1.5分,满分15分)文中共有10处语言错误,每句中最多两处。错误涉及一个单词的增
- 3洗衣机高90cm,底面是边长为50cm的正方形,要给洗衣机做一个布罩,至少要多少布?= =.
- 4黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
- 5为什么雨伞上方的空气流速比下方大?导致雨伞向上飞..
- 6(2011•贺兰县模拟)把左边的图形能够放大成原来面积的4倍,形状不变,画在右边的方格纸中.
- 7我会填。按照课文内容填空。1.嫩绿的树梢________,广场上成了____________。2.小妹妹撅着两条____
- 8英语翻译1这个女孩从小就显示出对音乐的偏爱.(tendency)2他把事情的经过一五一十地讲给我们听.(detail)3
- 9设二维随机变量(X,Y)在以点(0,1),(1,0),(1,1)为顶点的三角形上均匀分布,求E(X+Y),D(X+Y)
- 10在新学期,你认识一位来自美国的新同学tony.请根据下面的提示,写一篇60词左右的短文,把他介绍给大家
- 11高二物理有哪些你内容啊
- 12地球还有一个“兄弟”吗?
- 13The apples i bought yesterday(weigh)ten kilos适当形式填空
- 14红楼梦和三国演义,还有水浒传分别是谁写的?
- 15长方体礼盒长8cm,宽20cm,高9cm,彩带的接头处12cm,需要多长的彩带?

