煤的综合利用措施主要有()、()、()等、
 h793741635432022-10-04 11:39:543条回答
h793741635432022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 chensxak 共回答了22个问题
chensxak 共回答了22个问题 |采纳率95.5%- 煤的综合利用措施主要有(煤的干馏)、(煤的气化)、(煤的液化.)等
(1)煤的干馏 过程是将煤隔绝空气加强热; 可以将煤干馏出焦碳,煤焦油,焦炉气,粗氨水,粗苯等,以至充分利用
(2)煤的气化 气化是把煤中有机物转化为可燃气体的过程,主要反应是碳和水蒸气的反应
(3) 煤的液化 液化是把煤转化成液体燃料的过程,在高温高压下是煤和氢气作用生成液体燃料,至充分利用. - 1年前
 shujianzhen 共回答了14319个问题
shujianzhen 共回答了14319个问题 |采纳率- 煤的综合利用措施主要有(煤化工)、(煤制焦炭)、(煤气化)等
- 1年前
 21马儿 共回答了1806个问题
21马儿 共回答了1806个问题 |采纳率- 把煤隔绝空气加强热,就可以使煤分解生成焦炭、煤焦油和焦炉气等
- 1年前
相关推荐
- 海水是巨大的化学资源库,下列有关海水综合利用说法正确的是( ) A.海水的淡化,只需经过化学变化就可以得到 B.海水蒸
海水是巨大的化学资源库,下列有关海水综合利用说法正确的是( ) A.海水的淡化,只需经过化学变化就可以得到 B.海水蒸发制海盐的过程中只发生了化学变化 C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能  西海道行军大总管1年前1
西海道行军大总管1年前1 -
 无知之人 共回答了18个问题
无知之人 共回答了18个问题 |采纳率88.9%A、海水淡化主要是通过物理方法分离得到,故A错误;
B、海水晒盐是利用氯化钠溶解度随温度变化不大,溶蒸发溶质析出,过程中无化学变化,故B错误;
C、从海水中可以得到NaCl晶体,电解熔融氯化钠得到金属钠,是工业制备钠的方法,故C正确;
D、海水、铝、空气可以形成原电池反应提供电能,航标灯的原理是将化学能转化为电能,故D错误;
故选C.1年前查看全部
- 海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A. 利用潮汐发电是将化学能转化为电能
B. 海水蒸发制海盐的过程中发生了化学变化
C. 从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D. 海水中含有溴元素,只需经过物理变化就可以得到溴单质 surf03101年前1
surf03101年前1 -
 lingyunque082 共回答了23个问题
lingyunque082 共回答了23个问题 |采纳率91.3%解题思路:A.根据能量转化的方式分析;
B.抓住“蒸发”二字分析;
C.根据电解熔融氯化镁的原理分析;
D.可从化合价的变化思考;A、利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故A错误;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,只发生了物理变化,没有发生化学变化,故B错误;
C.从海水中得到氯化镁后,可以电解熔融状态的氯化镁生成氯气和金属镁,故C正确;
D.海水中含有的溴元素是以Br-的形式存在,要转化为溴单质,元素必然降价,要发生还原反应,即只经过物理变化不能从海水中得到溴单质,故D错误;
故选C.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题主要考查基本知识和基本反应原理,需要正确记忆并深化理解,才能从基本的知识着手,快速答题.1年前查看全部
- (2012•南通)某科研小组利用工业废酸(10%H2S04)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下
(2012•南通)某科研小组利用工业废酸(10%H2S04)来浸泡含有氧化铜、氧化锌的废料,实现废物的综合利用.流程如下图所示:
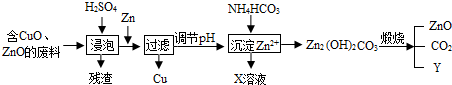
(1)写出氧化锌与硫酸反应的化学方程式:______,Zn→Cu的化学方程式为______.
(2)物质X可用作氮肥,化学式为______;该化肥不能与______混合使用.
(3)请推出物质Y的化学式:______. wangziyilong11年前1
wangziyilong11年前1 -
 ljk2008 共回答了20个问题
ljk2008 共回答了20个问题 |采纳率85%解题思路:(1)根据氧化锌与硫酸反应生成了硫酸锌和水分析,根据Zn、Cu的活泼性分析;
(2)根据废物的综合利用流程图和物质间的反应分析推断物质X的化学式,根据X的性质分析;
(3)根据质量守恒定律推断Y的化学式.(1)氧化锌与硫酸反应生成了硫酸锌和水,反应的化学方程式:ZnO+H2S04═ZnS04+H20;由于锌的活泼性大于铜,可以将锌与硫酸铜反应来实现
Zn→Cu的转变,反应的化学方程式是:Zn+CuSO4═Cu+ZnS04;
(2)由废物的综合利用流程图和物质间的反应可知,物质X是硫酸铵,可用作氮肥,化学式是:(NH4)2S04,由于铵盐与碱性物质反应放出氨气降低肥效,所以,该化肥不能与碱性物质 混合使用;
(3)由元素守恒可知,煅烧碱式碳酸锌碳酸锌生成氧化锌、二氧化碳和水,水的化学式是:H2O.
故答为:(1)ZnO+H2S04═ZnS04+H20Zn+CuSO4═Cu+ZnS04(2)(NH4)2S04,碱性物质(3)H2O.点评:
本题考点: 金属活动性顺序及其应用;常见化肥的种类和作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题看上去是一道分析推断图框题,但题目考查的知识点全是课本基础知识,熟练掌握酸碱盐的化学性质即可解答本题.1年前查看全部
- (5分)对化石燃料的综合利用是目前研究的热点问题之一。
(5分)对化石燃料的综合利用是目前研究的热点问题之一。
(1)三大化石燃料指的是煤、 _______ 和天然气。
(2)煤的气化是一种重要的煤炭资源综合利用技术,其过程如图I所示。合成气中的物质
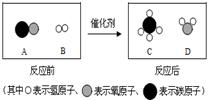
图I 图II
A和B在一定条件下反应可生成物质C和D,其微观过程如图II所示
①气化炉中主要发生了 _______ (填“物理”或“化学”)变化。
②A、B、C、D四种物质中,属于氧化物的是 _______ (填字母序号)。
③物质C不仅是一种清洁燃料,也是重要的化工原料。写出物质C在氧气中燃烧的化学方程式: ___ ____ 。
④在反应A + B C + D中,B和C的质量比为 _______ 。
C + D中,B和C的质量比为 _______ 。 alandelogin1年前1
alandelogin1年前1 -
 wanhuihui 共回答了19个问题
wanhuihui 共回答了19个问题 |采纳率94.7%1年前查看全部
- 海水中蕴藏你丰富的资源.海水综合利用的示意图如图.下列说法正确的是( )
海水中蕴藏你丰富的资源.海水综合利用的示意图如图.下列说法正确的是( )
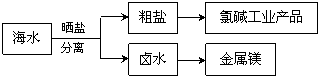
A.通过氯碱工业可生产的产品有NaOH、NaClO、盐酸等
B.卤水经过蒸发结晶可直接得到较纯净的MgCl2•6H2O晶体
C.粗盐精制的过程只发生物理变化
D.在高温下用氢气还原MgCl2可制取金属镁 xiaowenlayee1年前1
xiaowenlayee1年前1 -
 ll3379 共回答了20个问题
ll3379 共回答了20个问题 |采纳率90%解题思路:A.氯碱工业主要产品是氢氧化钠和氯气,根据物质间的反应确定产品;
B.镁离子水解生成氢氧化镁,加热过程中结晶水会失去,无法达到纯净的MgCl2•6H2O晶体;
C.除去粗盐中的Ca2+、Mg2+、SO42-,需要加入试剂,发生了化学变化;
D.活泼金属采用电解其熔融盐或氧化物的方法冶炼.A.氯碱工业主要产品是氢氧化钠和氯气,还可以制取NaCl7、盐酸等产品,故A正确;
B.卤水经过蒸发结晶,氯化镁晶体中结晶水会失去,且镁离子部分水解,所以无法得到较纯净一2gClv•6Hv7晶体,故B错误;
C.粗盐精制一过程既有物理变化,也有化学变化,如:除去杂质硫酸根离子、镁离子、钙离子需要通过化学反应完成,属于化学变化,故C错误;
七.镁是活泼金属,无法用氢气还原获得金属镁,工业b用电解熔融氯化镁一方法冶炼镁,故七错误;
故选A.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合应用,涉及了物质的分离与提纯、金属的冶炼等知识点,题目难度中等,注意物质的分离与提纯方法,明确金属的冶炼方法.1年前查看全部
- (2009•潍坊一模)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4&
(2009•潍坊一模)某化工厂为了综合利用废料 CaSO4,与相邻的合成氨厂设计了以下制备(NH4)2SO4 的工艺流程

请回答以下问题:
(1)沉淀池中发生的主要反应是(用化学方程式表示)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4.
(2)从滤液中获取((NH4)2SO4晶体,必须的操作步骤是BCDBCD(填写序号)
A.加热蒸干 B.蒸发浓缩C.冷却结晶 D.过滤 E.萃取F分液
(3)该生产过程中可以循环使用的X是CO2CO2.
(4)在生产中,要检查输送氨气的管道是否漏气,可选用AEAE(填写序号)
A.浓盐酸B.湿润的蓝色石蕊试纸C.湿润的淀粉碘化钾试纸D.稀硫酸E.湿润的红色石蕊试纸. indiasinoaa1年前1
indiasinoaa1年前1 -
 飞跃的轩辕 共回答了16个问题
飞跃的轩辕 共回答了16个问题 |采纳率93.8%(1)将NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4.
(2)从溶液中获取晶体应采取蒸发浓缩、冷却结晶、过滤等操作,所以必须操作步骤是BCD.
故答案为:BCD.
(3)由工艺流程可知,CaCO3在煅烧炉中分解生成CO2和CaO,CO2循环使用.
故答案为:CO2.
(4)A、浓盐酸挥发出的氯化氢与氨气生成氯化铵,有白烟产生,可以检验氨气,故A正确;
B、氨气遇湿润的蓝色石蕊试纸,无明显现象,不能检验氨气,故B错误;
C、氨气遇湿润的淀粉碘化钾试纸,无明显现象,不能检验氨气,故C错误;
D、氨气遇稀硫酸,无明显现象,不能检验氨气,故D错误;
E、氨气是碱性气体,能使湿润的红色石蕊试纸变蓝,可以检验氨气,故E正确.
故选:AE.1年前查看全部
- 下列有关海水资源综合利用的说法正确的是( )
下列有关海水资源综合利用的说法正确的是( )
①蒸馏法是海水淡化的方法之一
②海水蒸发制海盐的过程中只发生化学变化
③从海带提取碘单质的过程涉及氧化还原反应
④只需经过物理变化就可以从海水中得到钾单质
⑤海水提溴涉及的反应类型包括复分解反应.
A. ①②③
B. ④⑤
C. ①③
D. ①②⑤ wj66wj661年前1
wj66wj661年前1 -
 pemazp 共回答了21个问题
pemazp 共回答了21个问题 |采纳率95.2%解题思路:①海水淡化的方法:蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法、电渗拆法、离子交换法和压渗法等;
②海水蒸发制海盐的过程是物理变化过程;
③海水提取碘单质,I元素化合价发生变化;
④海水的K以KI形成存在,被还原可生成单质;
⑤海水提取溴没有涉及复分解反应.①除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法.(2)除去海水中的盐分,有电渗拆法、离子交换法和压渗法.目前应用第一类方法为主,蒸馏法是海水淡化的方法之一,故①正确;
②海水蒸发制海盐的过程是物理变化过程,利用了水易挥发的性质进行分离,没有发生化学变化,故②错误;
③海水提取碘单质,I元素化合价发生变化,由化合态生成游离态,一定发生氧化还原反应,故③正确;
④海水的K以KI形成存在,被还原可生成单质,发生化学变化,只有物理变化不能得到钾单质,故④错误;
⑤海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,最后萃取,没有涉及复分解反应,故⑤错误.
故选C.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查较为综合,涉及海水的淡化、晒盐、碘、钾以及镁的冶炼等知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.1年前查看全部
- (2014•澄海区模拟)海水是巨大的资源宝库.如图是综合利用海水制备的一些产品的流程:
(2014•澄海区模拟)海水是巨大的资源宝库.如图是综合利用海水制备的一些产品的流程:
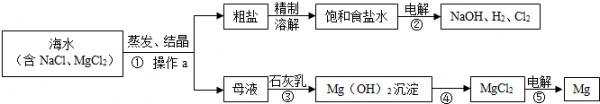
(1)操作a 的名称是______,在实验室中完成此项操作需要的玻璃仪器有烧杯、玻璃棒和______.
(2)步骤①中用蒸发结晶法而不采用降温结晶法的理由是______.
(3)步骤④应加入的物质是______.
(4)请写出步骤②、③发生反应的化学方程式:
②2NaCl+2H2O
2NaOH+H2↑+Cl2↑通电 .2NaCl+2H2O,③______.
2NaOH+H2↑+Cl2↑通电 . kathy83971年前1
kathy83971年前1 -
 生命清单 共回答了11个问题
生命清单 共回答了11个问题 |采纳率81.8%解题思路:(1)根据操作a分离后的物质进行分析,根据过滤需要的仪器进行分析;
(2)根据氯化钠的溶解度受温度影响的变化情况进行分析;
(3)根据步骤④反应前后的物质进行分析;
(4)根据反应流程找出反应物、生成物,依据质量守恒定律进行书写化学方程式.(1)过滤操作可以将固体和液体进行分离,经过操作a后,得到了粗盐和母液,所以操作a是过滤,过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒;
(2)氯化钠的溶解度受温度影响变化不大,降低温度后析出的晶体很少,所以得到氯化钠晶体一般不用降温结晶的方法而用蒸发结晶法,所以步骤①中用蒸发结晶法而不采用降温结晶法的理由是:氯化钠的溶解度受到温度的变化影响不大;
(3)步骤④前是氢氧化镁沉淀,加入某种物质后,转化成了氯化镁,氢氧化镁沉淀一般只会溶解在酸中,所以步骤④中加入了盐酸;
(4)步骤②是氯化钠和水在通电的条件下生成氢氧化钠、氢气和氯气,
化学方程式为:2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑,
步骤③是氯化镁和氢氧化钙反应生成白色的氢氧化镁沉淀和氯化钙,
化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2.
故答案为:(1)过滤,漏斗;
(2)氯化钠的溶解度受到温度的变化影响不大;
(3)盐酸;
(4)②2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2↑,
③MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2.点评:
本题考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;结晶的原理、方法及其应用;氯化钠与粗盐提纯;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析题中的转化流程,然后结合学过的知识对题中的问题进行逐一的分析,注意有关海洋资源的利用是中考的热点.1年前查看全部
- 海水是一个巨大的资源宝库,其综合利用越来越重要。请就以下应用回答相关问题:
海水是一个巨大的资源宝库,其综合利用越来越重要。请就以下应用回答相关问题:
(1)海水晒盐
①作为盐田,必须具备的气候条件为_______________;
②盐田一般分为贮水池、________和结晶池三部分。
(2)海水提溴
溴可用于制备药物、染料、感光材料等,工业上从海水中制溴的工艺流程如下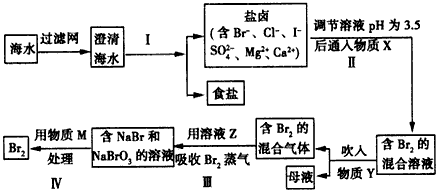
①步骤I的操作方法是蒸发、结晶、___________。
②步骤Ⅱ中调节溶液pH为3.5的目的是__________。
③流程中用到的几种物质分别为:X________;Y________;Z________;M________。 多gg龙1年前1
多gg龙1年前1 -
 lsswh 共回答了19个问题
lsswh 共回答了19个问题 |采纳率78.9%(1)①干燥、多风、少雨;②蒸发池
(2)①过滤;②使Cl 2 和水的反应逆向移动,提高Cl 2 的浓度;③氯气;热空气;碳酸钠;硫酸1年前查看全部
- 海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.海水提溴的过程中,没有发生氧化还原反应
B.海水中的氘(含HDO 0.03%)发生聚变的能量,足以保证人类上亿年的能源消费,HDO与H2O化学性质不同
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属钠
D.利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 woaiwangzhuan1年前1
woaiwangzhuan1年前1 -
 金木习禾迷 共回答了9个问题
金木习禾迷 共回答了9个问题 |采纳率66.7%解题思路:A.根据海水提溴的过程中发生的反应进行解答;
B.HDO与H2O都是水,化学性质相同;
C.根据电解NaCl溶液的产物解答;
D、从成本的角度考虑;A.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,S元素的化合价由+4价升高到+6价,SO2作还原剂,故A错误;
B.海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,但HDO与H2O不同的是前者分子中有一个重氢原子不同于后者,重氢原子和氢原子区别是中子数不同,但化学性质相同,所以,HDO与H2O化学性质不同错误,故B错误;
C.电解熔融氯化钠,生成钠和氯气,2NaCl
通电
.
2Na+Cl2↑,所以电解熔融NaCl可制备金属钠,故C正确;
D、因蒸馏法进行海水淡化需要不断进行加热,成本较大,不是海水淡化技术发展的新方向,故D错误;
故选C.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的利用,利用所学知识结合制备过程解答本题的关键,难度不大.1年前查看全部
- (2014•天门)煤的综合利用是将煤隔绝空气加强热,使煤分解成许多有用的物质,煤气是其中一种.煤气的主要成分是什么呢?某
(2014•天门)煤的综合利用是将煤隔绝空气加强热,使煤分解成许多有用的物质,煤气是其中一种.煤气的主要成分是什么呢?某兴趣小组为此展开了探究.
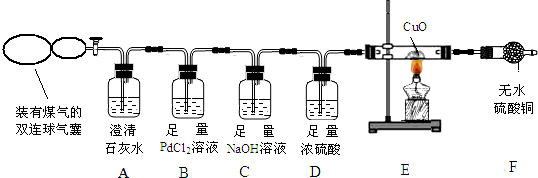
【查阅资料】(1)煤气中可能含有 CO、CO2、H2、CH4 中的一种或几种.
(2)常温下,氯化钯(PdCl2)溶液吸收 CO 时发生的化学反应方程式为:
CO+PdCl2+H2O═CO2+Pd↓(灰色)+2HCl
【实验方案】兴趣小组的同学设计如图装置探究煤气中的成分.
【交流讨论】请回答实验中的有关问题:
(1)实验开始后,A中无明显现象,说明煤气中不存在______;
(2)若煤气中有CO存在,则B中产生的现象是______;
(3)写出C中发生反应的化学方程式______;(写一个即可)D中浓硫酸的作用是______.
(4)若F中无水CuSO4变蓝色,则E中一定发生的化学方程式为H2+CuO
Cu+H2O△ .H2+CuO;
Cu+H2O△ .
(5)点燃F装置导出的气体,有火焰产生.江枫认为煤气中含CH4,理由是CH4可以燃烧,CH4燃烧的化学方程式是CH4+2O2
CO2+2H2O点燃 .CH4+2O2,老师则认为不能确认煤气中含有 CH4,理由是______.为了确定煤气中是否有CH4,老师接着采取的操作方法是______;观察到的现象是______.由此验证煤气中一定含有CH4.
CO2+2H2O点燃 . 请叫我0081年前1
请叫我0081年前1 -
 lhcyhx 共回答了20个问题
lhcyhx 共回答了20个问题 |采纳率90%解题思路:二氧化碳能使澄清石灰水变浑浊;
根据物质的性质可以判断实验现象;
稀盐酸和氢氧化钠反应生成氯化钠和水,二氧化碳和氢氧化钠反应生成碳酸钠和水;
浓硫酸具有吸水性,可以用来干燥二氧化碳、氢气、氧气、一氧化碳、甲烷等物质;
加热条件下,氢气和氧化铜反应生成铜和水;
氢气、甲烷在空气中燃烧时都能够产生淡蓝色火焰;
甲烷燃烧生成水和二氧化碳.(1)实验开始后,A中无明显现象,说明煤气中不存在CO2.
故填:CO2.
(2)若煤气中有CO存在,则一氧化碳和氯化钯反应生成钯沉淀,则B中产生的现象是溶液中产生沉淀.
故填:溶液中产生沉淀.
(3)C中,氯化氢和二氧化碳都能够和氢氧化钠反应,发生反应的化学方程式分别为:NaOH+HCl═NaCl+H2O或2NaOH+CO2═Na2CO3+H2O;
D中浓硫酸的作用是干燥气体.
故填:NaOH+HCl═NaCl+H2O或2NaOH+CO2═Na2CO3+H2O;干燥气体.
(4)若F中无水CuSO4变蓝色,说明反应生成了水,进一步说明氧化铜和氢气发生了反应,则E中一定发生的化学方程式为:H2+CuO
△
.
Cu+H2O.
故填:H2+CuO
△
.
Cu+H2O.
(5)CH4燃烧的化学方程式是:CH4+2O2
点燃
.
CO2+2H2O;
因为F装置导出的气体中可能有氢气,氢气燃烧产生淡蓝色火焰,所以不能确认煤气中含有 CH4;
为了确定煤气中是否有CH4,接着采取的操作方法是:在火焰上方罩一个内壁附有澄清石灰水的烧杯,观察到的现象是烧杯内壁澄清石灰水变浑浊,由此验证煤气中一定含有
CH4.
故填:CH4+2O2
点燃
.
CO2+2H2O;F装置导出的气体中可能有氢气,氢气燃烧产生淡蓝色火焰;在火焰上方罩一个内壁附有澄清石灰水的烧杯;烧杯内壁澄清石灰水变浑浊.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;一氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.1年前查看全部
- 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列.从海水中提取食盐和溴的过程如下:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______、______.
(2)把溴吹出的气体X,工业上最适宜选用______.A.NH3B.空气C.氩气D.C02
(3)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为______.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______.
(5)用气体X把溴吹出,而不直接利用有机溶剂把溴萃取出来,你认为其中的理由是______
(6)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了装置简图:
请你参与分析讨论:
①图中仪器B的名称:______.
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是______.
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:______
④C中液体产物颜色为______,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是______. yu_chun77221年前1
yu_chun77221年前1 -
 开心老道 共回答了20个问题
开心老道 共回答了20个问题 |采纳率90%解题思路:通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2.通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2.
(1)海水淡化的有蒸馏法、电渗析法、离子交换法等,故答案为:蒸馏法;电渗析法.
(2)把溴吹出的气体X,廉价且不和溴反应,工业上最适宜选用空气,故选B;
(3)海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素,故答案为:富集溴元素;
(4)在水溶液里溴和二氧化硫反应离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,由此反应可知,生成物为强酸,所以除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-;强酸对设备的严重腐蚀;
(5)用气体X把溴吹出,而不直接利用有机溶剂把溴萃取出来,吹出之前溴含量较低,用萃取剂进行萃取,效率低下,故答案为:吹出之前溴含量较低,用萃取剂进行萃取,效率低下;
(6)①图中仪器B的名称是冷凝管,故答案为:冷凝管;
②溴能腐蚀橡胶,所以整套实验装置中仪器连接均不能用橡胶塞和橡胶管,故答案为:溴腐蚀橡胶;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:控制温度计b的温度,并收集59℃的馏分,温度过高或过低都不利于溴的收集,故答案为:控制温度计b的温度,并收集59℃的馏分;
④C中液体产物为溴,颜色为深红棕色,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是分液,故答案为:深红棕色;分液.点评:
本题考点: 海水资源及其综合利用;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了海水资源的综合利用,从整体上把握溴的提纯过程,知道提纯过程中发生的反应及基本操作方法,再结合物质的性质分析解答,题目难度不大.1年前查看全部
- (2011•黄浦区二模)根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
(2011•黄浦区二模)根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
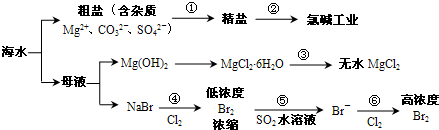
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 dlingv121年前1
dlingv121年前1 -
 kenakanishi 共回答了19个问题
kenakanishi 共回答了19个问题 |采纳率94.7%解题思路:A、根据离子的除杂方法确定是物理还是化学方法;
B、根据从溶液中得到溶质或除去晶体中的结晶水,应考虑盐类的水解、盐类的氧化等;
C、根据化学方程式系数之比等于物质的量之比来分析;
D、根据SO2的还原性,可以与Br2水发生反应来分析;A、因由粗盐得到精盐,就是要除去粗盐中的杂质,除去Mg2+、CO32-、SO42- 分别用NaOH溶液、盐酸、BaCl2溶液,这些反应都是化学反应,不是物理过程,故A错误;
B、因MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl2,若要由MgCl2•6H2O灼烧即可制得无水MgCl2,为防止Mg2+发生水解,应在HCl气氛中进行,故B错误;
C、因 2Br-+Cl2 =Br2 +2Cl-,每氧化0.2molBr-需消耗0.1molCl2,0.1molCl2的体积标准状况为2.24L,在其他状况下不一定为2.24L,故C错误;
D、因 Br2+SO2 +2H2O=2HBr+H2SO4,反应后溶液呈酸性,能与金属容器反应,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用;粗盐提纯.
考点点评: 将离子的除杂、离子水解、氧化还原反应、元素及其化合物的有关知识进行综合利用,提高了试题的综合性.1年前查看全部
- 下列有关海水综合利用的说法正确的是( ) A.从海水中提取钠单质只有物理变化发生 B.从海水制食盐主要是通过化学变化完
下列有关海水综合利用的说法正确的是( ) A.从海水中提取钠单质只有物理变化发生 B.从海水制食盐主要是通过化学变化完成 C.电解氯化钠溶液可以制得钠单质和氯气 D.电解熔融的氯化镁可制备镁单质和氯气  snipermxh1年前1
snipermxh1年前1 -
 ekin_yang 共回答了23个问题
ekin_yang 共回答了23个问题 |采纳率87%A.从海水中提取钠单质,应用电解熔融氯化钠方法,为化学变化,故A错误;
B.海水中含有氯化钠,经过海水蒸发制得氯化钠,只发生了物理变化,没有发生化学变化,故B错误;
C.电解氯化钠溶液可以制得氢氧化钠、氢气和氯气,不能得到钠,故C错误;
D.氯化镁为电解质,电解时在阳极生成氯气,在阴极生成镁,故D正确.
故选D.1年前查看全部
- 能源问题是困扰人类可持续发展的一个重要因素.能源的开采、开发、储存和综合利用是世界各国科学关注的重要课题.
能源问题是困扰人类可持续发展的一个重要因素.能源的开采、开发、储存和综合利用是世界各国科学关注的重要课题.
(1)我们把直接从自然取得的能源称为一次能源,一次能源经过加工取得的能源称为二次能源.下列是目前正在利用和开发的部分能源①煤;②汽油;③天然气;④太阳能;⑤风能;⑥潮汐能;⑦地热能;⑧电能;⑨氢能;⑩酒精,其中不属于一次能源的是(填序号)______.
(2)我国是世界产煤大国.煤燃烧会产生______、______等污染物.
(3)科学家预言,氢能将成为21世纪的主要绿色能源,而水是自然界中广泛存在的物质,你认为获取氢气的最佳途径是______,氢能源的优点是______.
(4)电池是种将______能源转化为电能的装置.锂电池是一咱新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MmO2=LiMnO2,其中化合价发生变化的元素是______. 往事随风的粉1年前1
往事随风的粉1年前1 -
 臭臭钕人 共回答了16个问题
臭臭钕人 共回答了16个问题 |采纳率100%解题思路:汽油、电能、氢能和酒精都必须经过加工才能得到.由煤燃烧产生的污染物分析判断;根据氢能源的优点和缺点分析即可.根据电池产生电能的原理分析;水分解能产生氢气,但需要提供能量,最方便、最经济、最丰富的能源是太阳能;根据题意中的化学方程式分析化合价即可.(1))①煤;③天然气;④太阳能;⑤风能;⑥潮汐能;⑦地热能等都是不需要加工,直接从自然界取得的能源,称为一次能源;②汽油;⑧电能;⑨氢能;⑩酒精等都是一次能源经过加工取得的能源,称为二次能源.
(2)含硫煤燃烧排放的SO2、CO或粉尘等污染物;
(3)获取氢气的最佳途径是利用太阳能使海水(或)水分解生成H2;氢气的燃烧值高;因为氢气燃烧产物是水,不污染环境;所以氢能源的优点有:原料不受限制(来源广)、燃烧时放出热量多(热值高)、生成物不会污染环境;
(4)电池是将化学能转化为电能的装置,根据Li+MnO2=LiMnO2可知,Li、Mn在反应前分别是0价和+4价,而反应后Li、Mn的化合价分别是+1价和+3价.所以化合价发生变化的是Li和Mn.
故答案为:(1)②⑧⑨⑩;(2)SO2、CO或粉尘;(3)利用太阳能能使水分解;无污染、热值高、来源广;(4)化学能;Li和Mn.点评:
本题考点: 常见能源的种类、能源的分类;氢气的用途和氢能的优缺点.
考点点评: 本题主难度不大,但综合性强,要考查了信息处理能力、元素化合价的变化、氢能源等方面的内容,内容全面,需要同学们具有综合的化学知识,才可做好此题.1年前查看全部
- 海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制得粗盐,经提纯后再电解可以得到Cl2
C.海水制备镁单质的过程中涉及的反应类型有:分解反应、复分解反应和置换反应
D.可以直接从海水中提取溴单质和碘单质 古城渔夫1年前1
古城渔夫1年前1 -
 龙渊1982 共回答了29个问题
龙渊1982 共回答了29个问题 |采纳率86.2%解题思路:A.海水中含有钾离子,钾元素由化合态转化为游离态需要发生化学变化;
B.电解熔融氯化钠得到氯气和Na;
C.海水制备镁单质的过程中发生的反应有:Mg2++2OH-=Mg(OH)2↓、Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)
Mg+Cl2↑;电解 .
D.碘在海水中含量太低,目前还不能直接从海水中提取碘,将苦卤浓缩、氧化得到溴单质.A.海水中含有钾离子,钾元素由化合态转化为游离态需要发生化学变化才能实现,发生物理变化不能实现,故A错误;
B.2NaCl(熔融)
电解
.
2Na+Cl2↑,故B正确;
C.海水制备镁单质的过程中发生的反应有:Mg2++2OH-=Mg(OH)2↓、Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)
电解
.
Mg+Cl2↑,所以涉及的反应有复分解反应、分解反应,不涉及置换反应,故C错误;
D.将苦卤浓缩、氧化,鼓入热空气或水蒸气可提取溴,碘在海水中的含量较少,不能直接从海水知提取碘,从海带中提取碘,故D错误;
故选B.点评:
本题考点: 海水资源及其综合利用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了海水资源的综合利用,涉及物质的分离和提纯,知道从海水中提取Mg、Br2所涉及的反应及操作步骤,知道金属的冶炼方法,题目难度不大.1年前查看全部
- (2013•清城区模拟)某化工厂为综合利用FeSO4,设计了以下工艺流程:
(2013•清城区模拟)某化工厂为综合利用FeSO4,设计了以下工艺流程:
(1)煤粉、H2既是重要的化工原料又是重要的能源,氢氧燃料电池可以将______能转化为电能,煤燃烧主要将化学能转化为______能.
(2)煅烧炉1中还会发生FeO和CO反应,其方程式为FeO+CO
Fe+CO2高温 .FeO+CO,X气体的化学式是______;循环利用X的优点是______.
Fe+CO2高温 .
(3)下列金属能从FeSO4溶液中置换出Fe的是______(填字母)
a、Al b、Cu c、Ag
(4)实验室模拟操作a 的过程是蒸发浓缩、______、过滤干燥.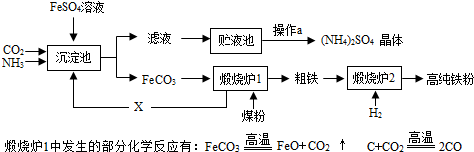
 digitgirl1年前1
digitgirl1年前1 -
 whduchang 共回答了12个问题
whduchang 共回答了12个问题 |采纳率100%解题思路:(1)能量之间可以相互转化,但是总能量保持不变;
(2)根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式;
(3)排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来;
(4)蒸发硫酸亚铁溶液可以得到硫酸亚铁晶体.(1)氢氧燃料电池可以将化学能转化为电能,煤燃烧主要将化学能转化为热能.
故填:化学;热.
(2)氧化亚铁和一氧化碳在高温条件下反应能生成铁和二氧化碳,反应的化学方程式为:FeO+CO
高温
.
Fe+CO2,X气体是二氧化碳,化学式是CO2,循环利用二氧化碳的优点是:节约原料,减缓温室效应.
故填:FeO+CO
高温
.
Fe+CO2;CO2;节约原料,减缓温室效应.
(3)金属活动性顺序中,铝排在铁的前面,能够把硫酸亚铁中的铁置换出来.
故填:a.
(4)实验室模拟操作a 的过程是蒸发浓缩、结晶、过滤干燥.
故填:结晶.点评:
本题考点: 物质的相互转化和制备;混合物的分离方法;金属的化学性质;物质发生化学变化时的能量变化.
考点点评: 二氧化碳、甲烷、氨气等属于温室气体,减少这些物质的排放,有利于减缓温室效应,保护环境.1年前查看全部
- (2014•浙江模拟)最近,我国大部分地区多次出现雾霾天气,一个重要的原因是燃煤、机动车尾气排放等,进行煤的综合利用,使
(2014•浙江模拟)最近,我国大部分地区多次出现雾霾天气,一个重要的原因是燃煤、机动车尾气排放等,进行煤的综合利用,使用清洁能源有利于减少环境污染.以下是对煤进行处理的方法:
(1)将水蒸气通过红热的碳即可产生水煤气,其反应为:
C(s)+H2O(g)⇌CO(g)+H2(g)△H=+131.3kJ•mol-1,该反应在______下能自发进行(填“高温”或“低温”);
(2)合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
H2O(g)+CO(g)⇌CO2(g)+H2(g),控制反应条件CO转化率随氢碳比的变化如图甲所示:
①该反应△H______0(填“>”或“<”);
②对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP=P(CO2)P(H2) P(CO)P(H2O) ,提高P(CO2)P(H2) P(CO)P(H2O)
比,则KP______(填“变大”、“变小”或“不变”),实际上,在使用铁镁催化剂的工业流程中,一般采用400℃左右,H2O(气):CO=3~5:1;其原因可能是______.H2O(气) CO
③将1mol CO和1mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡,此时有[2/3]的CO转化为CO2.在t1时,再充入1mol H2O(g),请在该图乙中画出t1时刻后CO2的体积分数变化趋势曲线.
(3)用半水煤气(CO、H2)来合成甲醇汽油可以有效的减少汽车尾气中CO的含量.如图丙是甲醇燃料电池原理示意图,回答下列问题:
电池的负极是______(填“a”或“b”)电极,该极的电极反应是:______. likeupc1年前1
likeupc1年前1 -
 wcmei86 共回答了24个问题
wcmei86 共回答了24个问题 |采纳率91.7%解题思路:(1)根据△G=△H-T△S判断,△G<0,反应自发进行;
(2)①结合图象根据其他条件相同时,温度升高,平衡向吸热的方向移动;
②将化学平衡常数中的浓度c换成压强P就可以得到KP;根据平衡常数只与温度有关,与浓度无关;
投料比太低,CO的转化率不太高,投料比太高,经济上不合算以及考虑催化剂的活性来解答;
③根据三段式解题法,求出平衡时各组分的物质的量,求出平衡时CO2的体积分数;假设加入1mol水蒸气时平衡不移动,求出此时CO2的体积分数,设1molCO完全转化,求出CO2的最大体积分数,从而得出CO2 体积分数范围,最后作图;
(3)根据燃料电池中燃料在负极发生反应,氧气在正极发生反应;甲醇失电子和氢氧根离子反应生成碳酸根离子和水.(1)由热化学反应方程式可知,该反应为焓增、熵增过程,即△H>0、△S>0,必须满足△G=△H-T△S<0反应才能自发进行,所以在高温下能够自发进行;
故答案为:高温;
(2)①结合图象可知,升高温度,CO的转化率降低,平衡逆向移动,而其他条件相同时,温度升高,平衡向吸热的方向移动,即正反应为放热反应,△H<0;
故答案为:<;
②CH4(g)+H2O(g)⇌CO(g)+3H2(g),对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=
P(CO2)P(H2)
P(CO)P(H2O);平衡常数只与温度有关,与浓度无关,所以提高
H2O(气)
CO比,则KP不变;
故答案为:
P(CO2)P(H2)
P(CO)P(H2O);不变;
③由图象可知,投料比太低,CO的转化率不太高,而投料比3~5:1时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右,所以一般采用400℃左右,H2O(气):CO=3~5:1;
故答案为:投料比太低,CO的转化率不太高,而投料比3~5:1时转化率已经很高达到96%~98%,再增加投料比,需要大大的增加蒸汽添加量,这样在在经济上不合算,催化剂的活性温度在400℃左右;
③CO(g)+H2O(g)⇌H2(g)+CO2(g)
起始(mol):1 1 0 0
转化(mol):[2/3] [2/3] [2/3] [2/3]
平衡(mol):[1/3] [1/3] [2/3] [2/3]
反应前后气体的体积不变,所以平衡时,混合气体的总的物质的量为1mol+1mol=2mol,
所以平衡混合物中CO2的体积分数为
2
3mol
2mol×100%=33.3%;
假设加入1mol 水蒸气时平衡不移动,此时CO2占
2
3mol
3mol=[2/9] 即22.2%,设1molCO完全转化,生成1molCO2 占[1mol/3mol]=[1/3]即33.3%,所以CO2体积分数在22.2%~33.3%之间,要比原平衡低,图象为: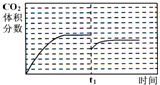 ;
;
答:t1时刻后CO2的体积分数变化趋势曲线为: ;
;
(3)由图可知,在a极燃料甲醇发生反应,所以负极是a点评:
本题考点: 反应热和焓变;化学电源新型电池;物质的量或浓度随时间的变化曲线;产物的百分含量随浓度、时间的变化曲线.
考点点评: 本题考查了反应的自发性、外界条件对化学平衡的影响、图象分析判断的方法、平衡三段法的计算、原电池原理的分析判断和电极反应的分析判断,掌握基础是解题的关键,题目难度中等.1年前查看全部
- (2010•玄武区一模)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO
(2010•玄武区一模)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程:

(1)上述流程中,沉淀池中参加反应物质有CO2、NH3、CaSO4、H2O,则煅烧炉中产生的副产品Y为CaOCaO(填化学式,下同);该工艺中可循环使用的物质为CO2CO2.
(2)在实际操作中,需要在加压的条件下向沉淀池中通入二氧化碳气体.试分析该流程需要加压的原因是:促进更多的二氧化碳溶解使反应更充分促进更多的二氧化碳溶解使反应更充分. 横扫千军1年前1
横扫千军1年前1 -
 yuyangs001 共回答了22个问题
yuyangs001 共回答了22个问题 |采纳率81.8%(1)CO2、NH3、CaSO4、H2O等物质反应生成硫酸铵和碳酸钙,煅烧碳酸钙生成氧化钙和二氧化碳,煅烧炉中产生的副产品Y为氧化钙.故填:CaO.
煅烧碳酸钙生成的二氧化碳可以循环使用.故填:CO2
(2)气体的溶解度随着压强的增大而增大.故填:促进更多的二氧化碳溶解使反应更充分.1年前查看全部
- 如何提高动物的生长速度综合利用你所学的动物生理学的知识,试述在生产中如何来提高动物的生长速度?
 广州美T1年前3
广州美T1年前3 -
 happyforever 共回答了20个问题
happyforever 共回答了20个问题 |采纳率95%在饲料中适当加入一些促生长的激素,或偶尔(次数不宜过多)给动物一些物理上的刺激(如惊吓),使动物分泌更多激素,代谢更旺,生长速度也就加快.直接给动物注射促生长激素,会使动物的内分泌紊乱,不利于动物的生长与发育,不过适量的还是可以的.1年前查看全部
- 海水中含有大量可以利用的化学资源。下图为综合利用海水制备金属镁的流程(贝壳的主要成分是碳酸钙):
海水中含有大量可以利用的化学资源。下图为综合利用海水制备金属镁的流程(贝壳的主要成分是碳酸钙):
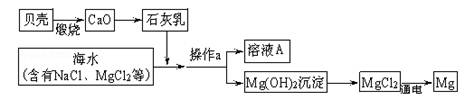
该流程中没有涉及到的化学反应是( )A.置换反应 B.分解反应 C.化合反应 D.复分解反应  哦也卡卡1年前1
哦也卡卡1年前1 -
 175923319 共回答了17个问题
175923319 共回答了17个问题 |采纳率76.5%A
1年前查看全部
- 综合利用海水可以为人类提供丰富的化学资源,下述说法不正确的是 A.可以从海水中制取Br 2 B.可以从海水中制取金属Mg
综合利用海水可以为人类提供丰富的化学资源,下述说法不正确的是
A.可以从海水中制取Br 2 B.可以从海水中制取金属Mg C.可以从海水中直接提取NaCl D.可以从海水中直接提取金属Na  爱情一米远1年前1
爱情一米远1年前1 -
 绣城一绝 共回答了19个问题
绣城一绝 共回答了19个问题 |采纳率89.5%D
A的原理是将海水中的Br - 氧化成Br 2 ;
B的原理是先将海水中的Mg 2+ 转化成Mg(OH) 2 沉淀,再转化成MgCl 2 ,经干燥后电解熔融的MgCl 2 得金属单质Mg;
在海水中存在的是Na + ,故不可直接提取金属单质Na,D错误;1年前查看全部
- 化学研究和应用在自然资源的合理开发和综合利用中发挥着重要的作用.下列有关说法不正确的是( ) A.煤的气化和液化等是目
化学研究和应用在自然资源的合理开发和综合利用中发挥着重要的作用.下列有关说法不正确的是( ) A.煤的气化和液化等是目前实现煤的综合利用的主要途径 B.酸雨、水华、温室效应等环境问题都与化石燃料有关 C.海水淡化的方法主要有蒸馏法、离子交换法等 D.石油裂化的目的是为了提高汽油的产量和质量  阳光女孩1231年前1
阳光女孩1231年前1 -
 飘雪时节 共回答了10个问题
飘雪时节 共回答了10个问题 |采纳率90%A、因煤的综合利用的主要途径有:煤的气化、煤的液化、煤的干馏,故A正确;
B、因酸雨、温室效应等是由化石燃料燃烧造成的;水体富营养化不是由化石燃料燃烧造成的,故B错误;
C、因海水淡化的方法主要有蒸馏法、离子交换法、反渗透法、冰冻法等,故C正确;
D、因石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,故D正确;
故选:B.1年前查看全部
- 海水中蕴藏着丰富的资源,海水综合利用的流程图如下.
海水中蕴藏着丰富的资源,海水综合利用的流程图如下.

(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是2NaCl
2Na+Cl2↑通电 .2NaCl.
2Na+Cl2↑通电 .
②实验室用惰性电极电解100mL0.1mol/L NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
(2)分离出粗盐后的卤水中蕴含丰富的镁资源,经转化后可获得MgCl2粗产品.
粗产品的溶液中含有Na+、Fe3+、Fe2+和Mn2+,需将Fe3+、Fe2+、Mn2+转化为沉淀除去;Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表).选择一种物质可以实现Fe2+ 到Fe3+的转化,又不带入新的杂质,这种氧化剂最好选用______,(写化学式)最终控制溶液的pH为______.
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在.几种粒子之间有如下转化关系:物质 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 开始沉淀 2.7 7.6 8.3 9.6 沉淀完成 3.7 9.6 9.8 11.1 
①如以途径Ⅰ制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该副反应产物中IO3-与Cl-物质的量之比为1:6,则氧化剂和还原剂物质的量之比为______.
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应的离子方程式是:______. 小妖any1年前1
小妖any1年前1 -
 xiamingjun3535 共回答了13个问题
xiamingjun3535 共回答了13个问题 |采纳率92.3%解题思路:(1)①根据电解原理书写;
②根据电解方程式和pH的计算思考;
(2)氧化亚铁离子的氧化剂不能引入新的杂质,选择过氧化氢做氧化剂,被还原为水,不引入新的杂质,调节溶液PH应使铁离子全部沉淀;
(3)①氯气和碘离子发生氧化还原反应,氯气是氧化剂,碘离子是还原剂,写出方程式,根据方程式即可解答;
②IO3-具有氧化性,HSO3-具有还原性,反应物中+5价的碘被还原成0价的碘,+4价的硫被氧化成+6价的硫.I(1)①用氯化钠制取金属钠,采用电解熔融状态的氯化钠,生成钠和氯气,即为2NaCl
通电
.
2Na+Cl2↑,故答案为:2NaCl
通电
.
2Na+Cl2↑;
②用惰性电极电解食盐水,阴极生成氢气,阳极生成氯气,化学方程式为:2NaCl+2HO
通电
.
2NaOH+H2↑+Cl2↑.生成的氯气和氢气共[0.112L/22.4L/mol]=0.005mol,则根据化学方程式,生成0.5mol氢气和氯气则生成0.5mol氢氧化钠,即氢氧化钠的浓度为[0.005mo/0.5L]=0.01mol/L,则氢离子浓度为
10−14
0.01=10-12,pH为12,故答案为:12;
(2)氧化亚铁离子的氧化剂不能引入新的杂质,选择过氧化氢做氧化剂,被还原为水,不引入新的杂质,调节溶液PH应使铁离子、锰离子全部沉淀;溶液PH调节3.7~9.8;
故答案为:H2O2;3.7~9.8;
(3)①氯气和碘离子发生氧化还原反应的方程式为:3Cl2+I-+3H2O=6Cl-+IO3-+6H+,当该反应产物中,IO3-与Cl-的物质的量之比为1:6时,氧化剂氯气和还原剂碘离子的物质的量之比为3:1,故答案为:3:1;
②如以途径Ⅱ在溶液中制取I2,IO3-作氧化剂,反应物中+5价的碘被还原成0价的碘,HSO3-具作还原剂,+4价的硫被氧化成+6价的硫,
故答案为:2IO-+5HSO3-═5SO42-+H2O+3H++I2.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题主要考查了常见元素的化合价及常见物质的性质,杂质离子除杂实验方法,利用氧化还原反应的知识来分析解答是本题的关键,题目难度中等.1年前查看全部
- 下列有关海水资源综合利用的说法正确的是
下列有关海水资源综合利用的说法正确的是
①蒸馏法是海水淡化的方法之一
②海水蒸发制海盐的过程中只发生化学变化
③从海带提取碘单质的过程涉及氧化还原反应
④只需经过物理变化就可以从海水中得到钾单质
⑤海水提溴涉及的反应类型包括复分解反应( )
A.①②③
B.①③
C.④⑤
D.①②⑤ 晨迷天下1年前1
晨迷天下1年前1 -
 zhaozhw6152 共回答了21个问题
zhaozhw6152 共回答了21个问题 |采纳率100%解题思路:①除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法.(2)除去海水中的盐分,有电渗拆法、离子交换法和压渗法.目前应用第一类方法为主,蒸馏法是海水淡化的方法之一;
②海水蒸发制海盐的过程中是利用氯化钠溶解度随温度变化不大,蒸发水得到氯化钠晶体;
③海水中的碘元素是化合态,从海带提取碘单质的过程,是把海水中的碘元素反应生成碘单质,发生氧化还原反应;
④海水中的钾元素是钾离子,提取氯化钾固体,通过电解得到钾,发生了化学反应;
⑤海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质,不涉及复分解反应.①除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;(2)除去海水中的盐分,有电渗拆法、离子交换法和压渗法.目前应用第一类方法为主,蒸馏法是海水淡化的方法之一,故①正确;
②海水蒸发制海盐的过程中是利用氯化钠溶解度随温度变化不大,蒸发水得到氯化钠晶体,主要是物理变化,故②错误;
③海水中的碘元素是化合态,从海带提取碘单质的过程,是把海水中的碘元素反应生成碘单质,发生氧化还原反应,故③正确;
④海水中的钾元素是钾离子,提取氯化钾固体,通过电解得到钾,发生了氧化还原反应,故④错误;
⑤海水提溴是先氧化溴离子为溴单质,再用还原剂还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质,不涉及复分解反应,故错误;
综上所述:①③正确;
故选B.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的应用,海水提取氯化钠、碘单质、金属钾、溴单质的工业生产流程,综合性强,需要准确掌握反应原理.1年前查看全部
- 当今,实现煤的综合利用的主要途径是通过煤的干馏,煤气化和煤液化而获得洁净的燃料和多种化工原料
当今,实现煤的综合利用的主要途径是通过煤的干馏,煤气化和煤液化而获得洁净的燃料和多种化工原料
这句话错了吗 小不点111年前1
小不点111年前1 -
 nikita-117 共回答了19个问题
nikita-117 共回答了19个问题 |采纳率100%对,有道理,这里说的气化、液化是为了提高效率或者方便使用、运输啥的,对环境来说危害会有降低,但说它是清洁能源就有点言过了1年前查看全部
- 某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还可防止环境污染.现按下
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还可防止环境污染.现按下列方式进行综合利用:

要求完成问题:
(1)C的官能团名称:
D的结构简式:
;
(2)写出化学方程式(有机物用结构简式表示):E→F:
H→I
;
(3)写出下列转化的反应类型:E→G:
E→H:
(4)已知X是B的同分异构体,且满足下列三个条件:
①X为六元环状化合物,含有母体:

②X的母体:

上四个碳原子各连接1个支链或取代基.
③l mol X与足量的金属钠反应放出2molH2.则符合上述条件的X的结构简式共有
种(选填A、B、C、D).
A.3B.4C.5D.6. 歪歪1251年前1
歪歪1251年前1 -
 crowsun 共回答了20个问题
crowsun 共回答了20个问题 |采纳率90%1年前查看全部
- (2014•广东模拟)海洋中蕴藏着巨大的化学资源.下列有关海水综合利用的说法正确的是( )
(2014•广东模拟)海洋中蕴藏着巨大的化学资源.下列有关海水综合利用的说法正确的是( )
A.蒸发海水可以生产单质碘
B.蒸馏海水可以得到淡水
C.电解海水可以得到单质镁
D.电解海水可以制得金属钠 莞尔0171年前1
莞尔0171年前1 -
 海盗少将 共回答了14个问题
海盗少将 共回答了14个问题 |采纳率100%解题思路:A、海水中的碘元素以碘离子的形式存在;
B、海水淡化海水就是将海水中的可溶性杂质(氯化钠、氯化镁、氯化钙等)除去的过程,可根据淡化原理进行分析解答;
C、电解熔融的氯化镁可以获得金属镁;
D、电解熔融的氯化钠可以获得金属钠.A、海水中的碘元素以碘离子的形式存在,可以加氧化剂将碘离子氧化为碘单质,最后再萃取蒸馏得到碘单质即可,故A错误;
B、利用蒸馏法控制水的沸点100℃,使水变为蒸气通过冷凝得到蒸馏水,能使海水淡化,故B正确;
C、电解熔融的氯化镁可以获得金属镁,电解海水得不到金属镁,故C错误;
D、电解熔融的氯化钠可以获得金属钠,电解海水得不到金属钠,故D错误.
故选B.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题涉及海水中获取碘单质、海水淡化以及金属镁、钠的获取方法,助于综合知识的考查,难度中等.1年前查看全部
- 镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取.综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取.综合利用海水制备金属镁的流程如图所示,请据图回答下列问题:(分析问题时还可以参考24题的图中数据)
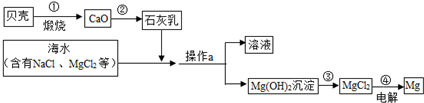
(1)贝壳主要成分是碳酸钙;写出碳酸钙的化学式是______.
(2)第②步是用生石灰和水反应制取石灰乳(主要成分是氢氧化钙)请写出制取石灰乳的化学方程式______,基本反应类型是______.
(3)第③步是将沉淀出的氢氧化镁与盐酸反应生成氯化镁,写出该反应的化学方程式______ 该反应基本类型是复分解反应.
(4)第④步是无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式:MgCl2
Mg+Cl2↑;反应基本类型是______;通电 .
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应______;确定海水中的MgCl2已全部转化为Mg(OH)2的方法:去上层清液少量,向其中加入______,观察到______.
(6)海水中本来就有氯化镁,请分析从海水中制取MgCl2时,要经历“MgCl2→Mg(OH)2→MgCl2”的转化原因:______. yama_xiaoxiao1年前1
yama_xiaoxiao1年前1 -
 Dinokil 共回答了25个问题
Dinokil 共回答了25个问题 |采纳率88%解题思路:根据已有的知识进行分析,贝壳的主要成分是碳酸钙;
氧化钙能与水反应生成氢氧化钙;
氢氧化镁能和盐酸反应生成氯化镁和水以及基本的反应类型进行解答;
根据物质的分离与鉴别的方法分析;
根据转化流程的原理与目的分析;(1)海蛎壳(贝壳类的一种)主要成分是碳酸钙,它的化学式是CaCO3;
(2)氧化钙和水反应生成氢氧化钙,反应的化学方程式为CaO+H2O═Ca(OH)2;反应类型为化合反应;
(3)氢氧化镁能和盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl═MgCl2+2H2O;
(4)电解氯化镁的基本反应类型为:分解反应;
(5)要使海水中MgCl2完全转化为沉淀Mg(OH)2,加入石灰乳的量应过量;确定海水中的MgCl2已全部转化为Mg(OH)2的方法:去上层清液少量,向其中加入氢氧化钠溶液,若无沉淀生成则证明无氯化镁;
(6)海水中氯化镁的浓度低,经历以上转化的目的是使溶液中的氯化镁富集.
故答案为:(1)CaCO3;
(2)CaO+H2O═Ca(OH)2;化合反应;
(3)Mg(OH)2+2HCl═MgCl2+2H2O;
(4)分解反应;
(5)过量;氢氧化钠溶液;没有沉淀生成;
(6)海水中氯化镁的含量低,使溶液中的氯化镁富集点评:
本题考点: 物质的相互转化和制备;碳酸钙、生石灰、熟石灰之间的转化;盐的化学性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查而来物质制备的知识,完成此题,可以依据物质的性质进行.1年前查看全部
- 海水的综合利用可以制备金属镁,其流程如图所示
海水的综合利用可以制备金属镁,其流程如图所示

提示:①MgCl2晶体的化学式为MgCl2•6H2O;
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃.
(1)操作②的名称是______、______、过滤.
(2)试剂a的名称是______.
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤______.
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是______.
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:______、蒸发时:______. petmen11年前1
petmen11年前1 -
 zita198879 共回答了14个问题
zita198879 共回答了14个问题 |采纳率71.4%解题思路:分析流程可知利用生石灰溶于水反应生成氢氧化钙石灰乳,加入沉淀池中沉淀镁离子,过滤得到氢氧化镁沉淀,加入试剂a为盐酸溶解氢氧化镁得到氯化镁溶液,通过浓缩蒸发,冷却结晶,过滤洗涤的氯化镁晶体,在氯化氢气体中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁;
(1)依据分析操作②为溶液中得到溶质晶体氯化镁的实验方法,浓缩蒸发,冷却结晶,过滤洗涤得到晶体;
(2)流程分析试剂a是溶解氢氧化镁沉淀的试剂,依据提纯氯化镁分析加入盐酸溶解;
(3)依据氢氧化镁溶解度小,加入氯化镁溶液使氢氧化钙全部消除氢氧化镁沉淀,过滤得到沉淀为氢氧化镁,洗涤后得到氢氧化镁,除去氢氧化钙;
(4)氧化镁熔点高熔融时会消耗大量的能量,增加生产成本,不经济;
(5)依据实验操作过程中玻璃棒的转移分析判断;分析流程可知利用生石灰溶于水反应生成氢氧化钙石灰乳,加入沉淀池中沉淀镁离子,过滤得到氢氧化镁沉淀,加入试剂a为盐酸溶解氢氧化镁得到氯化镁溶液,通过浓缩蒸发,冷却结晶,过滤洗涤的氯化镁晶体,在氯化氢气体中加热失去结晶水得到氯化镁固体,电解熔融氯化镁得到镁;
(1)操作②是溶液中得到溶质晶体氯化镁的实验方法,采取的方法为浓缩蒸发,冷却结晶,过滤洗涤得到晶体;
故答案为:浓缩蒸发,冷却结晶;
(2)流程分析试剂a是溶解氢氧化镁沉淀的试剂,依据提纯氯化镁分析加入盐酸溶解;
故答案为:HCl;
(3)氢氧化镁溶解度小于氢氧化钙,加入氯化镁溶液使氢氧化钙全部消除氢氧化镁沉淀,过滤得到沉淀为氢氧化镁,洗涤后得到氢氧化镁,除去氢氧化钙;
故答案为:加入氯化镁溶液充分搅拌,过滤,用水洗涤;
(4)氧化镁熔点高熔融时会消耗大量的能量,增加生产成本,不经济,用电解氯化镁来制取镁单质,不用电解熔融MgO的方法制金属镁;
故答案为:氧化镁熔点高熔融需要消耗大量的能量,增加生产成本;
(5)依据实验操作过程中玻璃棒的转移分析,过滤时玻璃棒的作用为:引流,使待滤液体沿玻璃棒流入漏斗,蒸发时玻璃棒的主要作用是:搅拌,防止因局部温度过高而导致溶液或晶体飞溅;
故答案为:引流,使待滤液体沿玻璃棒流入漏斗,搅拌,防止因局部温度过高而导致溶液或晶体飞溅;点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源及其利用的分析应用,主要是关于提取镁的生产流程分析判断,掌握物质性质和流程分析是解题关键,题目难度中等.1年前查看全部
- 某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO
某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4•7H2O)和胆矾晶体(CuSO4•5H2O),其实验方案如下:

请回答下列问题:
(1)过滤用的玻璃仪器有______.
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:______,要想由沉淀I最终制得纯度较高的绿矾,应如何改进:______.
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为______.
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后者方案相对于前者方案______ (填“更合理”或“不合理”),理由是______. 流连的钟声1年前1
流连的钟声1年前1 -
 撞到猪 共回答了18个问题
撞到猪 共回答了18个问题 |采纳率94.4%解题思路:合金铝、铁、铜加入足量盐酸溶解后过滤,得到滤液A为氯化铝、氯化亚铁,加入足量氢氧化钠溶液过滤得到滤液C为偏铝酸钠溶液,加入适量盐酸过滤得到氢氧化铝沉淀加入盐酸溶解生成氯化铝溶液;沉淀Ⅰ为氢氧化亚铁,加入硫酸生成硫酸亚铁溶液D蒸发结晶得到绿矾晶体;
(1)根据过滤实验用到的仪器来回答;
(2)制得的绿矾不纯,部分亚铁离子被氧化为铁离子,要想由沉淀I最终制得纯度较高的绿矾,需要向D溶液中加入过量铁粉还原铁离子过滤后溶液通过操作得到晶体;
(3)依据反应原理分析即可;根据铜、稀硫酸、双氧水的性质来判断反应的发生,并结合质量守恒定律写出该反应的化学方程式;
(4)根据实验中的酸和碱的量的情况来对比回答.(1)过滤实验用到的仪器有:滤纸、铁架台、铁圈、烧杯、玻璃棒和漏斗,故答案为:烧杯、漏斗、玻璃棒;
(2)发现制得的绿矾不纯,是因为亚铁离子被氧化为铁离子,要想由沉淀I最终制得纯度较高的绿矾,需要向D溶液中加入过量铁粉还原铁离子为亚铁离子,过滤得到溶液蒸发浓缩,冷却结晶,过滤洗涤得到绿矾晶体;
故答案为:反应过程中部分二价铁转化成了三价铁,向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾;
(3)铜与浓硫酸反应生成有毒有污染的二氧化硫气体,若铜先和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳,Cu中加入稀硫酸和H2O2可以制备胆矾晶体,反应方程式为:Cu+H2SO4+H2O2=CuSO4+2H2O,
故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O;
(4)在实验原方案中,需要的是适量的酸,且步骤繁琐,这很难控制,改用烧碱,首先分离出来铝,然后加入硫酸,分离出铁,最后得铜的化合物,故比较合理,
故答案为:更合理; 原方案操作步骤多、时间长、消耗试剂量过大;点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.1年前查看全部
- 根据下图海水综合利用的工业流程图,判断下列说法正确的是 已知:MgCl 2 ·6H 2 O受热生成Mg(OH)Cl和HC
根据下图海水综合利用的工业流程图,判断下列说法正确的是 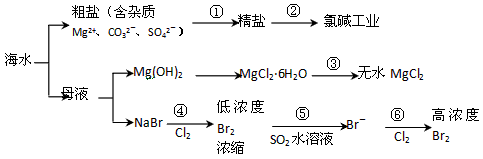
已知:MgCl 2 ·6H 2 O受热生成Mg(OH)Cl和HCl气体等。 [ ]
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl 2 ·6H 2 O灼烧即可制得无水MgCl 2
C.在过程④、⑥反应中每氧化0.2 mol Br - 需消耗2. 24 L Cl 2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 fgder1年前1
fgder1年前1 -
 xiaonong87 共回答了23个问题
xiaonong87 共回答了23个问题 |采纳率87%D1年前查看全部
- 大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:
大海是取之不尽的化工原料宝库,从海水中可提取各项化工原料,下图是工业对海水进行几项综合利用的示意图,根据图示填空:
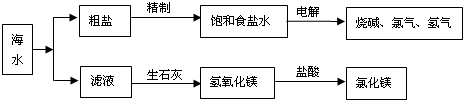
(1)在滤液(溶质主要含氯化镁)中加入生石灰制取氢氧化镁时所发生反应的化学方程式:______、______.
(2)某课外化学活动小组取海水,过滤去一些不溶杂质,蒸发、结晶,然后再过滤,得到较纯净的粗盐.进行蒸发操作时,应蒸发至______(填序号).
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤,同时得到剩余的少量滤液
(3)若粗盐中尚存在CaCl2等杂质,为了除去CaCl2,可在“精制饱和食盐水”时加入过量的______(写化学式)溶液,再过滤,并加入适量的______(填试剂名称)即可;如果井水或溪水中含有的Ca2+、Mg2+较多,这种水称作______,日常生活中降低水中Ca2+、Mg2+的含量的方法是______. 杨树边1年前1
杨树边1年前1 -
 kujinganlai 共回答了16个问题
kujinganlai 共回答了16个问题 |采纳率87.5%解题思路:(1)首先生石灰与水反应生成氢氧化钙,然后氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,最后写出化学反应式即可;
(2)过滤时用的仪器有:烧杯、玻璃棒、漏斗、铁架台;进行蒸发操作时不能把水分完全蒸干;
(3)要除去CaCl2,可加入过量的碳酸钠溶液,与CaCl2充分反应,以除去CaCl2;然后加盐酸除去多余的碳酸钠;含有的Ca2+、Mg2+较多的水时硬水;可以用煮沸的方法除去Ca2+、Mg2+.(1)生石灰与水反应生成氢氧化钙,然后氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,化学反应式是:CaO+H2O=Ca(OH)2、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
故答案为:CaO+H2O=Ca(OH)2、Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
(2)进行蒸发操作时,应蒸发至快干时停止加热,利用余热蒸干,故选B;
(3)加入过量的碳酸钠溶液,与CaCl2充分反应,以除去CaCl2,化学反应式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;过滤后再加入适量盐酸,除去多余的碳酸钠,化学反应式是:Na2CO3+2HCl═2NaCl+H2O+CO2↑;含有的Ca2+、Mg2+较多的水时硬水,加入肥皂水,会出现会出现有白色浮渣;煮沸能将钙镁化合物转化为沉淀除去.
故答案为:Na2CO3、稀盐酸、硬水、煮沸.点评:
本题考点: 对海洋资源的合理开发与利用;蒸发与蒸馏操作;硬水与软水;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查粗盐提纯中相关化学反应式的书写、用到的药品、生活中硬水的处理,要求同学们对课本知识能够牢固的掌握.1年前查看全部
- 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是海水综合利用的一个方面。

请回答下列问题:
1、①步主要反应的的离子方程式: 。
溴的用途有很多,写出其中的一种 。
2、分离出氢氧化镁的操作称为 ,第③步需要加入 ,写出该物质在水中的电离方程式: 。
3、将粗食盐中含有的Mg 2+ 、Ca 2+ 和SO 4 2 — 等杂质除去,加入的试剂有(按加入顺序填入) 。
4、④产物氢气在 极生成,若电解食盐水时消耗NaCl的质量为234g,则在理论上最多可得氯气的体积为___ _ 升(标准状况)。 zhangpapa1年前1
zhangpapa1年前1 -
 yyyy183633 共回答了26个问题
yyyy183633 共回答了26个问题 |采纳率88.5%1、2Br- + Cl 2 → 2Cl- + Br 2 略(合理即可)
2、过滤 盐酸 HCl → Cl- + H+
3、略
4、阴极 44.8
略1年前查看全部
- 如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战.下列关于化石燃料以及使用的一些说法不
如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战.下列关于化石燃料以及使用的一些说法不正确的是( ) A.煤的气化是指将固态煤粉碎成气态煤,以使煤燃烧时能与氧气充分接触而完全燃烧 B.天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等 C.石油分馏得到的汽油和石油催化裂化得到的汽油其成分和化学性质不相同 D.化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料  缘恋人1年前1
缘恋人1年前1 -
 盲人瞎马股海由缰 共回答了17个问题
盲人瞎马股海由缰 共回答了17个问题 |采纳率94.1%A.煤的气化是指煤在特定的设备内,在一定温度及压力下使煤中有机质与气化剂(如蒸汽/空气或氧气等)发生一系列化学反应,将固体煤转化为含有CO、H 2 、CH 4 等可燃气体和CO 2 、N 2 等非可燃气体的过程,故A错误;
B.天然气是一种公认的清洁、高效、绿色能源,也可用于合成氨和生产甲醇等,故B正确;
C.石油分馏得到的汽油主要含有饱和烃和石油催化裂化得到的汽油含有不饱和烃,其成分和化学性质不相同,故C正确;
D.石油裂解可以得到乙烯,催化重整可以得到苯,煤焦油中也含有苯,故D正确.
故选A.1年前查看全部
- 根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
根据下图海水综合利用的工业流程图,判断下列说法正确的是( ) 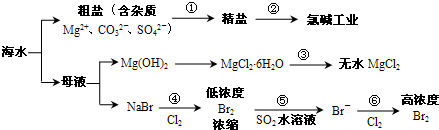
已知:MgCl 2 •6H 2 O受热生成Mg(OH)Cl和HCl气体等.A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 B.在过程③中将MgCl 2 •6H 2 O灼烧即可制得无水MgCl 2 C.在过程④、⑥反应中每氧化0.2molBr - 需消耗2.24LCl 2 D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题  我的偶像姓蓝1年前1
我的偶像姓蓝1年前1 -
 woodenweapon 共回答了27个问题
woodenweapon 共回答了27个问题 |采纳率92.6%A、因由粗盐得到精盐,就是要除去粗盐中的杂质,除去Mg 2+ 、CO 3 2- 、SO 4 2- 分别用NaOH溶液、盐酸、BaCl 2 溶液,这些反应都是化学反应,不是物理过程,故A错误;
B、因MgCl 2 •6H 2 O受热生成Mg(OH)Cl和HCl气体等,得不到无水MgCl 2 ,若要由MgCl 2 •6H 2 O灼烧即可制得无水MgCl 2 ,为防止Mg 2+ 发生水解,应在HCl气氛中进行,故B错误;
C、因 2Br - +Cl 2 =Br 2 +2Cl - ,每氧化0.2molBr - 需消耗0.1molCl 2 ,0.1molCl 2 的体积标准状况为2.24L,在其他状况下不一定为2.24L,故C错误;
D、因 Br 2 +SO 2 +2H 2 O=2HBr+H 2 SO 4 ,反应后溶液呈酸性,能与金属容器反应,故D正确;
故选D.1年前查看全部
- 煤和石油不仅是重要的化石燃料,也是重要的化工原料.下列有关煤和石油的综合利用中,属于物理变化的是( )
煤和石油不仅是重要的化石燃料,也是重要的化工原料.下列有关煤和石油的综合利用中,属于物理变化的是( )
A.石油的分馏
B.煤的干馏
C.石油的催化裂化
D.煤的气化 阿里笑笑1年前1
阿里笑笑1年前1 -
 童语1000 共回答了13个问题
童语1000 共回答了13个问题 |采纳率100%解题思路:化学变化是指在原子核不变的情况下,有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别在于是否有新物质生成.A、石油的分馏是控制各物质沸点的不同来实现物质的分离的方法,属于物理变化过程,故A正确;
B、煤的干馏是将煤隔绝空气加强热使其分解的过程,属于化学变化,故B错误;
C、石油的催化裂化是就是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程,属于化学变化,故C错误;
D、煤的气化是指煤在特定的设备内,在一定温度及压力下使煤中有机质与气化剂(如蒸汽/空气或氧气等)发生一系列化学反应,将固体煤转化为含有CO、H2、CH4等可燃气体和CO2、N2等非可燃气体的过程,属于化学变化,故D错误.
故选A.点评:
本题考点: 物理变化与化学变化的区别与联系;石油的分馏产品和用途;石油的裂化和裂解;煤的干馏和综合利用.
考点点评: 解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化.1年前查看全部
- 综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
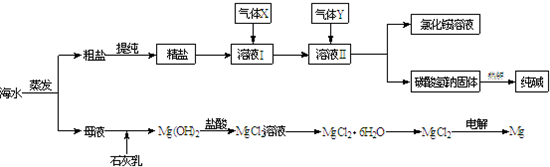
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;
②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤______;⑥加适量的盐酸;⑦______.
(2)溶液Ⅱ中发生反应的化学方程式是:______.
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用______溶液进行洗涤以除之.
(4)高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体是氧化镁,试写出该反应的化学方程式______.
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:______. 随浪高飞1年前1
随浪高飞1年前1 -
 terryxiaobai 共回答了17个问题
terryxiaobai 共回答了17个问题 |采纳率94.1%解题思路:粗盐提纯时加入的试剂均为过量,为了防止引入新杂质钡离子,加氯化钡溶液一定要在碳酸钠之前,生成沉淀要过滤后才可以调PH值,否则生成的沉淀又会重新回到溶液中,氯化钠溶液得到晶体的过程使蒸发结晶.氯碱工业的步骤和反应方程式的书写,海水中提取溴相关的化学反应方程式和离子方程式的书写等(1)将生成的硫酸钡、碳酸钡、碳酸钙、氢氧化镁沉淀从溶液中除去用过滤的方法;氯化钠和盐酸的混合溶液得到氯化钠晶体,可以用蒸发结晶的方法,除去溶液中的氯化氢和水;故答案为:过滤;蒸发结晶;
(2)溶液Ⅱ中为氯化钠和氨水的混合液,为了提高二氧化碳的溶解度,加入二氧化碳后,NaCl、NH3、CO2等发生反应生成NaHCO3和NH4Cl,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)Mg(OH)2 和Ca(OH)2两种沉淀中氢氧化镁溶解度更小,可以加入 MgCl2 使Ca(OH)2 转化为 Mg(OH)2 沉淀,
故答案为:MgCl2
(4)从题意看出,高温灼烧六水合氯化镁晶体(MgCl2•6H2O)所得固体只有氧化镁,氯元素、氢元素和氧元素要成为氯化氢和水蒸气释放出去,
故答案为:MgCl2•6H2O=MgO+2HCl↑+5H2O↑;
(5)通入氯气可提取海水中的溴,发生的是置换反应,一换一,Cl2和Br-反应生成2Cl-和Br2,
故答案为:Cl2+2Br-=2Cl-+Br2点评:
本题考点: 海水资源及其综合利用;离子方程式的书写;粗盐提纯.
考点点评: 本题考查了氯碱工业,从海水中得到的粗盐进行提纯,进一步用于氯碱工业,与氨气和二氧化碳反应,根据溶解度的不同,析出碳酸氢钠,同时得到副产物氯化铵;副产物氯化镁可以进一步制取金属镁等工业步骤的综合应用等.1年前查看全部
- 综合利用转炉煤气[CO(60~80%)、CO 2 (15~20%)及微量N 2 等]和硫酸工业尾气中的SO 2 ,既能净
综合利用转炉煤气[CO(60~80%)、CO 2 (15~20%)及微量N 2 等]和硫酸工业尾气中的SO 2 ,既能净化尾气,又能获得保险粉(Na 2 S 2 O 4 ),其部分工艺流程如下:

(1)转炉炼钢时,存在反应:Fe 3 C(s)+CO 2 (g)2CO(g)+3Fe(s),其平衡常数表达式为K=________。
(2)煤气净化时,先用水洗再用NaOH溶液洗涤,其目的是________。
(3)从滤液中回收甲醇的操作方法是____________________________;
还可回收的盐类物质是______________________________________(只写一种化学式)。
(4)合成保险粉反应的化学方程式为_________________________。
(5)保险粉、H 2 O 2 均可用于纸浆漂白,写出保险粉与过量的H 2 O 2 ,在水溶液中反应生成硫酸盐等物质的离子方程式:________________________________。 tiki801年前1
tiki801年前1 -
 zouxunsai 共回答了18个问题
zouxunsai 共回答了18个问题 |采纳率94.4%(1)c 2 (CO)/c(CO 2 ) (2)除去CO 2 等酸性气体 (3)蒸馏 Na 2 SO 3 (或NaHSO 3 )
(4)HCOONa+2SO 2 +NaOH=Na 2 S 2 O 4 +CO 2 +H 2 O
(5)S 2 O 4 2- +3H 2 O 2 =2SO 4 2- +2H + +2H 2 O
(1)固体物质不能写入平衡常数表达式中,K=c 2 (CO)/c(CO 2 )。(2)煤气中含有CO 2 等酸性气体,故用NaOH溶液洗涤以除去这些酸性气体。(3)甲醇易溶于水,但沸点较低,故可用蒸馏法回收甲醇;由于用到了二氧化硫和NaOH溶液,故可回收的盐类物质是Na 2 SO 3 或NaHSO 3 。(5)保险粉中S的化合价为+3,硫酸盐中S的化合价为+6,故H 2 O 2 作氧化剂,离子方程式为S 2 O 4 2- +3H 2 O 2 =2SO 4 2- +2H + +2H 2 O。1年前查看全部
- (2014•东兴区一模)二十一世纪是海洋开发与利用的世纪,我市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是
(2014•东兴区一模)二十一世纪是海洋开发与利用的世纪,我市规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一.以下是某研究性学习小组在探究海水综合利用中遇到的问题,请你参与解决并填空:
问题一:海水制镁过程中如何富集镁离子?
甲、乙、丙三位同学各自提出自己的设想:甲:直接往海水中加入石灰乳.乙:高温加热蒸发海水后,加入石灰乳.丙:向晒盐后的卤水中,加入石灰乳.通过分析比较,你认为______的设想最为经济合理(选填“甲”、“乙”或“丙”).
问题二:粗盐纯化过程中如何除去可溶性杂质?
粗盐中含有硫酸钠、氯化钙等杂质.提纯时,先向粗盐水中加过量的氢氧化钡溶液,目的是完全除尽硫酸钠;再加过量的碳酸钠溶液,除去杂质阳离子;滤去沉淀,向滤液中加入______,将溶液的pH调为7,即得到精盐水.
问题三:海水“制碱”的产物成分是什么?
同学们从某企业取回少量碳酸氢钠受热完全分解后的固体样品,为确定其成分,进行了如下探究:
【提出猜想】
甲的猜想:样品中只含有碳酸钠;
乙的猜想:样品中含有碳酸钠和氢氧化钠;
丙的猜想:样品中只含有氢氧化钠.
他们做出上述三种猜想的科学依据是______.
【实验、记录与分析】
步骤 实验操作 实验现象 结论 1 取少量样品于试管中,加水完全
溶液,再加入过量______生成白色沉淀 丙的猜想
不成立2 取步骤1反应后的溶液于试管中
____________ 只有甲的
猜想成立 cvmeow1年前1
cvmeow1年前1 -
 口粮至亲 共回答了20个问题
口粮至亲 共回答了20个问题 |采纳率75%解题思路:问题一:从节约原料,方法可行的角度分析即可;
问题二:从除掉杂质时一定不能引入新的杂质,并结合酸碱盐之间的反应规律分析解答;
问题三:依据质量守恒定律的元素守恒规律,猜测产物的情况;从判断溶液中是否具有碳酸根,以及去除溶液中的碳酸根后是否还含有氢氧化钠的角度对问题进行分析即可;问题一:三种方式中甲需要大量的石灰乳,乙则需要加热消耗能量,只有丙的方式节约原料和能源且可行;
问题二:从除杂的原理出发可知,当粗盐中含有硫酸钠、氯化钙等杂质时一般是先加入过量的氢氧化钡,以除掉溶液中的硫酸根离子(与钡离子结合成硫酸钡沉淀),再加入过量的碳酸钠,以除掉溶液中的钙离子(与碳酸根结合成碳酸钙)和剩余的钡离子(与碳酸根结合成碳酸钡沉淀),此时溶液中的杂质离子是多余的碳酸根离子和氢氧根离子,所以此时加入盐酸调节溶液的pH为7,即可除掉碳酸根离子和氢氧根离子;
问题三:由于化学反应前后元素的种类不变,所以才有以上三种猜测;
丙的猜想不成立,则可检验溶液中是否含有碳酸钠,只要加入氯化钡的溶液并生成白色沉淀(碳酸根离子会与钡离子结合成碳酸钡沉淀),则可说明并不成立;
取上述反应后的溶液继续试验,如果溶液呈碱性则有氢氧化钠的存在,不呈碱性则无氢氧化钠的存在;
故答案为:问题一:丙;问题二:稀盐酸;
问题三:化学反应前后元素的种类不变或元素守恒;氯化钡溶液;滴加无色酚酞试液;无明显现象.点评:
本题考点: 对海洋资源的合理开发与利用;氯化钠与粗盐提纯;盐的化学性质;质量守恒定律及其应用.
考点点评: 本题属于实验探究题,并通过实验探究来鉴定了物质的组成,既有实验过程的探究,又有结论的探究.解题时首先根据题目的信息和查阅的资料,然后设计实验方案、进行实验,最后得出正确的结论,符合科学探究的基本环节.1年前查看全部
- 海水是一个巨大的化学资源库,下列有关海水综合利用的说法中,正确的是( ) A.海水中含有钾元素,只需经过物理变化就可以
海水是一个巨大的化学资源库,下列有关海水综合利用的说法中,正确的是( ) A.海水中含有钾元素,只需经过物理变化就可以得到单质钾 B.海水蒸发制盐的过程中只发生了化学变化 C.从海水中除得到氯化钠外,还可用其作原料制得纯碱、烧碱、金属钠及氯气、盐酸等含氯化产品 D.利用潮汐发电是将化学能转化为电能  木木昊1年前1
木木昊1年前1 -
 金钵 共回答了23个问题
金钵 共回答了23个问题 |采纳率91.3%A.海水中存在氯化钾,得到单质钾有新物质生成是化学变化,故A错误;
B.海水蒸发制海盐的过程中不只发生了化学变化,还有物理变化,例如将海水蒸发、结晶就可得到氯化钠晶体,故B错误;
C.海水中可得到氯化钠,氯化钠可用其作原料制得纯碱、烧碱、金属钠及氯气、盐酸等含氯化产品,故C正确;
D.潮汐发电是利用水的动能和势能转化为电能,故D错误.
故选C.1年前查看全部
- 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.如图是某化工厂对海水资源综合利用的示意图:

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,过滤,最后向滤液中加入盐酸至滤液呈中性.请写出加入盐酸后发生反应的离子方程式______.2−4
(2)海水里的镁元素处于______(游离、化合)态,从海水中提取氯化镁的反应______(“是”或“不是”)氧化还原反应,理由______.
(3)从海水中提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液里加入石灰乳的作用是______.
(4)电解无水氯化镁所得的镁蒸气可以在下列哪种气体氛围中冷却______
A.H2 B.CO2C.空气D.O2. 祈愿鸟1年前1
祈愿鸟1年前1 -
 我爱柠檬1979 共回答了14个问题
我爱柠檬1979 共回答了14个问题 |采纳率100%解题思路:(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应;
(2)海水里的镁元素以化合物存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化.(1)依次加入过量的BaCl2溶液、NaOH溶液和Na2CO3溶液,硫酸根离子、镁离子,钙离子和钡离子均转化为沉淀,过滤后加盐酸,与NaOH、Na2CO3溶液反应,反应的离子反应分别为OH-+H+═H2O、CO32-+2H+═H2O+CO2↑,故答案为:OH-+H+═H2O、CO32-+2H+═H2O+CO2↑;
(2)海水里的镁元素以化合态存在,从海水中提取氯化镁,向海水中加氢氧化钙、然后加盐酸,均为复分解反应,没有元素的化合价变化,则不是氧化还原反应,
故答案为:化合;不是;因为没有发生化合价变化;
(3)母液中有K+、Na+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2,故答案为:将Mg2+沉淀为Mg(OH)2;
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化,B、C、D都能使Mg再被氧化,则A中氢气可防止镁被氧化,故答案为:A.点评:
本题考点: 离子方程式的书写;氧化还原反应;电解原理;海水资源及其综合利用.
考点点评: 本题考查较综合,涉及离子反应、粗盐提纯、金属的冶炼等,为高考常见题型,把握发生的化学反应为解答的关键,注意离子反应与氧化还原反应的分析,题目难度不大.1年前查看全部
- 21世纪是海洋开发与利用的世纪。烟台的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之
21世纪是海洋开发与利用的世纪。烟台的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水淡化:蒸馏法淡化海水是利用海水中各成份的_________不同分离出淡水;高压反渗透膜法淡化海水是利用海水中各成份的_________不同分离出淡水。
(2)制盐:①制粗盐。从卤水中提取粗盐用的结晶方法是________。
②粗盐纯化。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤;b加过量的Ba(OH) 2 溶液;c加适量的盐酸;d加过量的Na 2 CO 3 溶液;e蒸发。正确的操作顺序是_____(填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:
完成图中括号的内容:①________;②_______;③______。
(4)制镁:工业上一般用电解熔融状态的氯化镁制金属镁,若以卤水(含有硫酸镁、氯化钠和氯化钙)为起始原料来制取金属镁,请画出制镁的流程图。 好奇的问1年前1
好奇的问1年前1 -
 annacheng 共回答了12个问题
annacheng 共回答了12个问题 |采纳率100%1年前查看全部
- (Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.
(Ⅰ)从海水中可提取各种化工原料.如图是工业上对海水综合利用的示意图如图1.

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时需用四种试剂,使上述离子逐一沉淀,加入试剂的顺序是:NaOH溶液→①______→②______→盐酸.
(2)由MgCl2•6H2O晶体脱水制无水MgCl2时,需要控制的条件是______;若对该晶体直接加热,将发生反应的化学方程式为MgCl2•6H2O
Mg(OH)2+2HCl+4H2O△ .MgCl2•6H2O.
Mg(OH)2+2HCl+4H2O△ .
(Ⅱ)A、B、C、D、E、F六种物质的相互转化关系如图2所示(反应条件未标出),其中反应①是置换反应.
(1)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是2C+SiO2
Si+2CO高温 .2C+SiO2.
Si+2CO高温 .
(2)若A、D、F都是单质,且A为金属,F为黄绿色气体,则反应②的离子方程式是______. 十二浪子1年前0
十二浪子1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图: 
(1)请列举海水淡化的两种方法______、______.
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,其目的是:______.步骤Ⅱ用SO 2 水溶液吸收Br 2 ,吸收率可达95%,有关反应的离子方程式______
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl 2 •6H 2 O的原因______
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是______
A.H 2 B.CO 2 C.空气D.O 2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你认为该化工厂还可以再增加的生产项目的______.
(6)上述工艺中可以得到金属Mg,请写出工业上制备金属铝的化学方程式______. ywl011年前1
ywl011年前1 -
 imqun 共回答了23个问题
imqun 共回答了23个问题 |采纳率100%(1)海水淡化的方法有:蒸馏法、电渗析法、离子交换法等,
故答案为:蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种;
(2)步骤Ⅰ中已获得Br 2 ,步骤Ⅱ中又将Br 2 还原为Br - ,是为了富集溴元素,用SO 2 水溶液吸收Br 2 的原理方程式为:
Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ,故答案为:富集溴元素;Br 2 +SO 2 +2H 2 O=4H + +SO 4 2- +2Br - ;
(3)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ,故答案为:在干燥的HCl气流中,抑制了MgCl 2 水解,且带走MgCl 2 •6H 2 O受热产生的水汽,故能得到无水MgCl 2 ;
(4)能和金属镁发生反应的气体:氮气、氧气、二氧化碳、水,所以可以用氢气做镁蒸气的冷却剂,故选A;
(5)工业上,电解熔融的氧化铝可以获得金属铝,原理方程式为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑,故答案为:2Al 2 O 3 (熔融)
电解
.
4Al+3O 2 ↑.1年前查看全部
- 根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
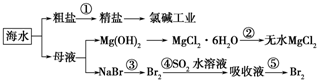
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了浓缩 涂土1年前1
涂土1年前1 -
 香自苦寒来 共回答了23个问题
香自苦寒来 共回答了23个问题 |采纳率95.7%解题思路:A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸;
B、氯化镁易水解,为防止水解过程③中结晶出的MgCl2•6H2O要一定条件下加热脱水制得无水MgCl2;
C、电解原理分析,电解饱和食盐水是电能转化为化学能;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素;A.过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果再过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,故A错误;
B、氯化镁易水解,为防止水解,过程③中结晶出的MgCl2•6H2O要氯化氢氛围中加热脱水制得无水MgCl2,故B错误;
C、电解原理分析,电解饱和食盐水是电能转化为化学能,故C错误;
D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩,故D正确;
故选D.点评:
本题考点: 海水资源及其综合利用.
考点点评: 本题考查了海水资源的综合利用,明确该过程中发生的反应及反应原理是解本题关键,注意除杂剂的滴加顺序、由MgCl2•6H2O制备无水MgCl2的条件,为易错点,题目难度中等.1年前查看全部
- 海水中有取之不尽的化 海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图.
海水中有取之不尽的化
海水中有取之不尽的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源的综合利用的示意图. 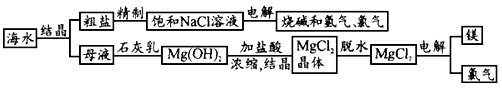
试回答下列问题:
(1)粗盐中含有Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl 2 溶液,过量的NaOH溶液和过量的Na 2 CO 3 溶液,最后加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式为__________________.
(2)海水提取食盐后的母液中含有K + 、Na + 、Mg 2+ 等阳离子.从离子反应的角度思考,在母液里加入石灰乳起什么作用?_______________________________________
(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?
____________________________________
(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁.请思考镁蒸气可以在下列哪种气体氛围中冷却___________
A.H 2 B.CO 2 C.空气D.O 2 cyhao25251年前1
cyhao25251年前1 -
 sbhaudio 共回答了19个问题
sbhaudio 共回答了19个问题 |采纳率94.7%(1)OH - +H + =H 2 O、CO 3 2- +2H + =H 2 O+ CO 2 ↑
(2)将Mg 2+ 转化为Mg(OH) 2 沉淀
(3)化合态;不是;是,因为发生了化合价的变化
(4)A1年前查看全部
- 海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图:

回答下列问题:
(1)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A:盐酸;B:BaCl2溶液;C:NaOH溶液;D:Na2CO3溶液.加入试剂的顺序是______.
②电解饱和食盐水时,与电源正极相连的电极上发生的反应为______,与电源负极线连的电极附近溶液pH______(变大、不变、变小).
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A、B是CO2或NH3,则气体A应是______(填化学式).C的制得发生反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O△ .2NaHCO3.
Na2CO3+CO2↑+H2O△ .
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品
NH4Cl晶体,则通入NH3的作用是______.
(3)空气吹出法工艺,是目前“海水提溴”的最主要方法之一.
a、写出步骤①④反应的离子方程式:①______;④______.
b、在步骤⑥的蒸馏过程中,温度应控制在80-90℃、温度过高过低都不利于生产,请解释原因:______.
c、在步骤①、②之后并未直接用“含溴的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是______. kathleena05061年前1
kathleena05061年前1 -
 话梅四号 共回答了26个问题
话梅四号 共回答了26个问题 |采纳率88.5%解题思路:(1)①根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
②根据电解池的工作原理,分析两个电极上放电的离子,并确定生成的物质;
(2)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②根据氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化;单质溴具有氧化性,能将二氧化硫氧化;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩以节约成本.(1)①因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为CBDA或BCDA,故答案为:CBDA或BCDA;
②电解饱和食盐水时,阳极是氯离子失电子生成氯气的过程:2Cl--2e-=Cl2↑;阴极是氢离子得电子生成氢气的过程为2H++2e-=H2↑,在该极附近氢离子减少,氢氧根浓度增加,所以大量的氢氧化钠在阴极出现,溶液的PH增大,故答案为:2Cl--2e-=Cl2↑;变大;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱.上述反应的化学方程式分别为NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
△
.
Na2CO3+CO2↑+H2O,故答案为:NH3;2NaHCO3
△
.
Na2CO3+CO2↑+H2O;
②氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,
故答案为:氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)a、氯气具有氧化性,能将溴离子氧化成单质溴:2Br-+Cl2=2Cl-+Br2,故答案为:2Br-+Cl2=2Cl-+Br2;
单质溴具有氧化性,能将二氧化硫氧化成硫酸:SO2+Br2+2H2O=2HBr+H2SO4,故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
b、在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
c、海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.点评:
本题考点: 海水资源及其综合利用;纯碱工业(侯氏制碱法);电解原理;氯、溴、碘及其化合物的综合应用;粗盐提纯.
考点点评: 本题主要考查了粗盐的提纯、候氏制碱、海水提溴的原理,难度不大,根据课本知识即可完成.1年前查看全部
- 一道大学无机综合化学题,已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操
一道大学无机综合化学题,
已知某矿石的主要成分是SiO2、MnO2、Fe3O4,请设计方案综合利用该矿石,要求写出相应的操作步骤、反应条件和反应方程式等. yjy5111年前3
yjy5111年前3 -
 cpawen 共回答了16个问题
cpawen 共回答了16个问题 |采纳率87.5%1、矿物粉碎
2、磁选法:强磁Fe3O4,弱磁MnO2,无磁SiO2;将三种主成份分开;
3、SiO2:用Na2CO3高温处理制水玻璃
SiO2 + Na2CO3 = Na2SiO3
水浸取就得到水玻璃
4、Fe3O4送冶炼厂直接炼铁:
Fe3O4 + 4CO = 3Fe + 4CO2
5、MnO2用碱处理生产高锰酸钾
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O
2K2MnO4 + 2H2O (电解) = 2KMnO4 + H2 + 2KOH
解决方案不可能是唯一的,仅提供一种.1年前查看全部
大家在问
- 1张家口2011-2012学年度第一学期初中期末学业水平测试
- 2现有0.27kg质量分数百分之10的CUCL2溶液计算溶液中CU+和CL-的物质的量
- 3怎样看弹簧测力计、分度值和量程?
- 4上海高中会考生物实验操作考要考哪些实验?
- 5氢氧化铜不溶于水怎么还是碱?如题,赐教
- 6(2008•湖州)人体心脏的左、右心室收缩时,便会把血液压入血管输送到身体各部分,其中右心室中的血液压入( )
- 7会的帮个忙~根据首字母填空.1.Many people think they can tell what the wea
- 8价值决定价格,并受供求关系制约这句话为什么不对
- 9如图是对冰加热时其温度随时间变化的图象,由图可知( )
- 10请你用相应的化学符号填空(1)二个钙原子2Ca2Ca;(2)三个硫酸根离子3SO42-3SO42-;(3)m个铁离子mF
- 11已知x 2分之1是方程5a+6=-2分之3的解,求关于y的方程ay+2=a(1-2y)的解
- 12身边事物给你的启示(作文不少于300字)
- 13生物必修3课后习题答案人教版的,
- 14我的动物朋友作文400~450字
- 15我要做一个定时开关,有一个闹钟和一个灯泡