把ag铝铁合金粉末溶于足量盐酸中 再加入过量氢氧化钠溶液 过滤出沉淀 经洗涤干燥灼烧 得到红棕色粉末的质量为ag 则此合
 vvqi2022-10-04 11:39:541条回答
vvqi2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 sunshine2114 共回答了23个问题
sunshine2114 共回答了23个问题 |采纳率91.3%- 直接用原子守恒就可以了
2Fe-------------Fe2O3
112 160
X a
X=112a/160
所以铁的质量分数为112a/160a=70%
所以铝为30%
不懂问 - 1年前
相关推荐
- 钢和生铁都是铁的合金,其中钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%.将质量为8.6g的铁合金粉末样品加
钢和生铁都是铁的合金,其中钢的含碳量为0.03%~2%,生铁的含碳量为2%~4.3%.将质量为8.6g的铁合金粉末样品加入烧杯中,然后注入100g稀硫酸溶液,恰好完全反应.测得反应后烧杯中的物质总质量为108.3g.(假设样品中除碳外不含其他杂质)
(1)求反应中产生氢气的质量;
(2)通过计算说明该铁合金样品是生铁还是钢. smithaction1年前1
smithaction1年前1 -
 看见后立刻 共回答了14个问题
看见后立刻 共回答了14个问题 |采纳率85.7%(1)产生的氢气质量为:100g+8.6g-108.3g=0.3g;
(2)设样品中铁的质量为x.
Fe+H 2 SO 4 ═FeSO 4 +H 2 ↑
562
x0.3g
56
2 =
x
0.3g
解得:x=8.4g
所以样品中碳的质量分数为:
8.6g-8.4g
8.6g ×100%=2.3%;
根据计算可以知道含碳量在2%-4.3%之间,所以该合金样品是生铁.
答:(1)产生氢气0.3 g;
(2)该合金样品是生铁.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末于稀硫酸反应,进行了三次实验,所得相关的实验数据记录如表:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末于稀硫酸反应,进行了三次实验,所得相关的实验数据记录如表:
(1)从上表中数据分析,第______次实验中的锌与稀硫酸恰好完全反应;第一次 第二次 第三次 所取合金的质量/克 10 10 20 所用稀硫酸的质量/克 50 80 50 生成氢气的质量/克 0.2 0.2 0.2
(2)试计算该10克铜锌合金中的锌的质量______克;
(3)计算稀硫酸中溶质的质量分数.(列式计算) 月色柔情1年前1
月色柔情1年前1 -
 核桃7007 共回答了21个问题
核桃7007 共回答了21个问题 |采纳率95.2%解题思路:(1)从三次实验数据可知,第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第二次、第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应进行解答;
(2)根据氢气的质量求出参加反应锌的质量即可;
(3)根据氢气的质量求出所用硫酸的中溶质的质量,即可求出稀硫酸中溶质的质量分数进行解答.(1)从三次实验数据可知,第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第二次、第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应;故填:一;
(2)设合金中锌的质量为x,50g稀硫酸中溶质的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
xy 0.2g
[65/x=
2
0.2g]
x=6.5g
[98/y=
2
0.2g]
y=9.8g
(3)稀硫酸中溶质的质量分数=
9.8g
50g×100%=19.6%
答:(2)该10克铜锌合金中的锌的质量为6.g;(3)稀硫酸中溶质的质量分数为19.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫
某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气.下列说法正确的是( )
A. 当粉末为Cu~Fe合金时,反应所得溶液中一定含有Fe2+和Cu2+
B. 当粉末为Cu~Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50%
C. 当粉末为Al~Fe合金时,a<0.2g
D. 当粉末为Al~Fe合金时,所需稀硫酸溶质质量分数>9.8% 鉴定完毕0061年前1
鉴定完毕0061年前1 -
 wing82618 共回答了20个问题
wing82618 共回答了20个问题 |采纳率85%解题思路:Cu~Fe合金中,Cu和稀硫酸不反应,只有Fe和稀硫酸反应生成Fe2+;Al~Fe合金可先假设Al和Fe分别是5.6g时,各自和稀硫酸反应生成氢气的质量和所需硫酸溶质的质量,然后再来找出Al~Fe合金和稀硫酸反应生成氢气的范围及硫酸质量分数的范围.A、当粉末为Cu~Fe合金时,因为Cu和稀硫酸不反应,只有Fe和稀硫酸反应生成Fe2+,所以溶液中不可能有Cu2+.故A错误;
B、当粉末为Cu~Fe合金时,若a为0.1g,即氢气为0.1g,根据铁和稀硫酸反应方程式,用氢气质量求出铁的质量为2.8g,即合金中含铁的质量分数为50%.故B正确;
C、当粉末为Al~Fe合金时,假设铝为5.6g,通过计算可知5.6g铝会产生0.62g氢气;如果铁是5.6g,通过计算可知5.6g铁会产生0.2g氢气,也就是说5.6gAl~Fe合金产生的氢气质量大于0.2g而小于0.62g.故C错误;
D、当粉末为Al~Fe合金时,假设铝为5.6g,通过计算可知5.6g铝消耗硫酸溶质是30.5g,即100g硫酸溶液中溶质的质量分数为30.5%;如果铁是5.6g,通过计算可知5.6g铁消耗硫酸溶质是9.8g,即100g硫酸溶液中溶质的质量分数为9.8%,所以5.6gAl~Fe合金和硫酸反应需硫酸溶质的质量分数大于9.8% 而小于30.5%.故D正确.
故选BD点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题常用的方法就是极端假设法,同学们掌握了此方法,就可以解决这一类的问题.1年前查看全部
- 为了测定铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了四次试验,所的相关实验数据记录如下表:
为了测定铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了四次试验,所的相关实验数据记录如下表:
第一次 第二次 第三次 第四次
所含合金的质量(g) 8.0 8.0 8.0 12.0
所用稀硫酸的体积(ml) 8.0 16.0 24.0 一定体积
剩余合金的质量(g) 6.7 5.4 4.8 8.1
1、第四次所加硫酸的体积为()
2、试计算8.0克铜锌合金中锌的质量和第一次试验后所得溶液的溶质质量分数.(已知稀硫酸的密度是1.17克每毫升) 五娃1年前1
五娃1年前1 -
 骑倒蜗牛追帅锅 共回答了16个问题
骑倒蜗牛追帅锅 共回答了16个问题 |采纳率93.8%1、第四次所加硫酸的体积为(24ml)
2、8.0克铜锌合金中锌的质量 8.0g-4.8g=3.2g
8.0g-6.7g=1.3g
8*1.17=9.36g
Zn + H2SO4 === ZnSO4 + H2↑
65 161 2
1.3g x y
65/1.3g=161/x=2/y
x=3.22g
y=0.04g
第一次试验后所得溶液的溶质质量分数 3.22g/(1.3g+9.36g-0.04g)*100%=30.3%1年前查看全部
- 为测定某Cu-Zn合金中的Cu的含量,取该合金粉末10g,与足量的盐 酸反应,经测定产生了2.24L氢气(标况),则该合
为测定某Cu-Zn合金中的Cu的含量,取该合金粉末10g,与足量的盐 酸反应,经测定产生了2.24L氢气(标况),则该合金中Cu含量是多少?
 水手回头1年前1
水手回头1年前1 -
 pijiang123 共回答了17个问题
pijiang123 共回答了17个问题 |采纳率88.2%Zn+ 2HCl == ZnCl2 + H2
65g 22.4L
m g 2.24L
m=6.5g
m(Cu)=10-6.5=3.5g
Cu的含量:3.5/10 =35%1年前查看全部
- 15.为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如
15.为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)试计算该铜锌合金中锌的质量分数.第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 60 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应. wzacszy1年前1
wzacszy1年前1 -
 wowo_wowo 共回答了21个问题
wowo_wowo 共回答了21个问题 |采纳率81%解题思路:(1)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.(1)设合金中锌的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
[65/x=
2
0.2g]
解得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5g/10g]×100%=65%
答:该铜锌合金中锌的质量分数为65%;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5.
故答案为:1:5.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 ___ (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
【探究结论】猜想3成立.实验方案 实现现象 结论 ①取一定量的合金粉末,加过量的 ___ ,充分反应后过滤,滤渣备用. 粉末部分溶解,并有气体放出. 合金中一定含有 ___ . ②取步骤①所得滤渣,加过量的 ___ ,充分反应. 滤渣部分溶解,并有气体放出,溶液呈浅绿色. 合金中一定含有 ___ .
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 ___ .
 170732761年前1
170732761年前1 -
 avocado的uu 共回答了20个问题
avocado的uu 共回答了20个问题 |采纳率95%解题思路:【猜想】根据可能含有的物质进行组合分析;
【实验探究】根据铝会与碱反应生成氢气,而铁和铜不会与碱,根据滤渣溶解会生成气体,且溶液显浅绿色反应进行分析;
【反思】根据铝会与盐酸反应生成氢气进行分析.【猜想】根据所给的猜想我们可以确定猜想2,可能含有铜.而在检验合金的组成时,可以利用合金中不同的金属的不同化学性质和所给的信息来进行了鉴定.检验是否含有铝时,用氢氧化钠和铝反应生成氢气来确定.而检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行.
故答案为:铜;
【实验探究】铝会与碱反应生成氢气,而铁和铜不会与碱反应,滤渣溶解会生成气体,且溶液显浅绿色反应,铜不会与酸反应,可以先用氢氧化钠鉴别铝的存在,然后再根据与酸反应时的现象鉴别铁和铜的存在,故答案为:
实验方案实现现象结论①取一定量的合金粉末,加过量的30%的氢氧化钠溶液,充分反应后过滤,滤渣备用.粉末部分溶解,并有气体放出.合金中一定含有 铝.②取步骤①所得滤渣,加过量的10%盐酸,充分反应.滤渣部分溶解,并有气体放出,溶液呈浅绿色.合金中一定含有铁和铜.【反思】2Al+6HCl═2AlCl3+3H2↑.点评:
本题考点: 物质的鉴别、推断;金属的化学性质;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析需要鉴别的物质的性质,然后结合题中的现象进行逐一的鉴别.1年前查看全部
- 某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20
某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象. 

计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g). 紫陌纤红1年前1
紫陌纤红1年前1 -
 撕破aa膜 共回答了12个问题
撕破aa膜 共回答了12个问题 |采纳率83.3%1年前查看全部
- (2009•佛山)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情
(2009•佛山)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑(产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______(填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
【探究结论】猜想3成立.实验方案 实现现象 结论 ①取一定量的合金粉末,加过量的______,充分反应后过滤,滤渣备用. 粉末部分溶解,并有气体放出. 合金中一定含有______. ②取步骤①所得滤渣,加过量的______,充分反应. 滤渣部分溶解,并有气体放出,溶液呈浅绿色. 合金中一定含有______.
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式______. LIVE_IN_HOPE1年前1
LIVE_IN_HOPE1年前1 -
 挤吧挤吧挤吧 共回答了11个问题
挤吧挤吧挤吧 共回答了11个问题 |采纳率100%解题思路:【猜想】根据可能含有的物质进行组合分析;
【实验探究】根据铝会与碱反应生成氢气,而铁和铜不会与碱,根据滤渣溶解会生成气体,且溶液显浅绿色反应进行分析;
【反思】根据铝会与盐酸反应生成氢气进行分析.【猜想】根据所给的猜想我们可以确定猜想2,可能含有铜.而在检验合金的组成时,可以利用合金中不同的金属的不同化学性质和所给的信息来进行了鉴定.检验是否含有铝时,用氢氧化钠和铝反应生成氢气来确定.而检验是否有铁时,可用稀盐酸来检验.检验是否有铜时,利用铜和稀盐酸不能反应来进行.
故答案为:铜;
【实验探究】铝会与碱反应生成氢气,而铁和铜不会与碱,滤渣溶解会生成气体,且溶液显浅绿色反应,铜不会与酸反应,可以先用氢氧化钠鉴别铝的存在,然后再根据与酸反应时的现象鉴别铁和铜的存在,故答案为:
实验方案 实现现象 结论
①取一定量的合金粉末,加过量的30%的氢氧化钠溶液,充分反应后过滤,滤渣备用. 粉末部分溶解,并有气体放出. 合金中一定含有 铝.
②取步骤①所得滤渣,加过量的10%盐酸,充分反应. 滤渣部分溶解,并有气体放出,溶液呈浅绿色. 合金中一定含有铁和铜.【反思】2Al+6HCl═2AlCl3+3H2↑.点评:
本题考点: 物质的鉴别、推断;金属的化学性质;金属活动性顺序及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析需要鉴别的物质的性质,然后结合题中的现象进行逐一的鉴别.1年前查看全部
- 将30g某合金粉末与足量的稀硫酸发生反应,生成1g氢气,这种合金的成分可能组成是( )
将30g某合金粉末与足量的稀硫酸发生反应,生成1g氢气,这种合金的成分可能组成是( )
A. 镁和铁
B. 镁和铝
C. 铁和锌
D. 铁和铝 davidfox20051年前1
davidfox20051年前1 -
 蓝色牵挂 共回答了19个问题
蓝色牵挂 共回答了19个问题 |采纳率94.7%解题思路:首先判断金属能否与酸反应,然后从金属与酸反应生成氢气的质量关系考虑.根据化学方程式,可得出如下金属与氢气的质量关系:Mg-H2:12-1 Al-H2:9-1 Fe-H2:28-1 Zn-H2:32.5-1;利用平均值法:金属A的数值<混合物金属的数值<金属B的数值根据化学方程式已知金属与氢气的质量关系:Mg-H2:12-1 Al-H2:9-1 Fe-H2:28-1 Zn-H2:32.5-1;利用平均值生成1克氢气应该符合:金属A的数值<30<金属B的数值
A、12和 28均小于30,不可能;
B、12和 9均小于30,不可能;
C、28g<30g<32.5g,可能;
D、9和28均小于30,不可能.
故选C.点评:
本题考点: 金属的化学性质.
考点点评: 记住记住常见金属与酸反应生成氢气的质量比,对解决此类题目很有帮助.1年前查看全部
- 1.某研究小组测定Cu--Fe合金和Fe--Al合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分
1.某研究小组测定Cu--Fe合金和Fe--Al合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生a g氢气.则下列说法正确的是 ( )
A.当粉末为Fe--Al合金时,a可能为0.2
B.当粉末为Cu--Fe合金时,反应完全后,生成物溶液里一定含有亚铁离子和铜离子
C.当粉末为Cu--Fe合金时,若a为0.1 ,则这种合金中含铁的质量分数为20%
D.当粉末为Fe--Al合金时,所需稀硫酸溶液质量分数一定大于9.8%
2.为探究稀硫酸中溶质的质量分数,小明和小勇分别取质量分数相等的稀硫酸100g ,小明向其中加入13g锌粒,反应结束时观察到锌粒完全消失;小勇向其中加入6.5g锌粒,反应结束时观察到锌粒有剩余.有关实验的推理一定正确的是( )
A.反应后小明所得的溶液中溶质只有稀硫酸
B.反应后小勇所得容易中一定不含硫酸
C.两位同学试验中生成的氢气的质量均少于0.4g
D.原稀硫酸中溶质的质量分数一定大于9.8%小于19.6% zqapple12021年前1
zqapple12021年前1 -
 爆爆a 共回答了11个问题
爆爆a 共回答了11个问题 |采纳率81.8%1、A,如果是这样的话,那说明合金是纯铁,不符合合金的概念!
B、铜不与酸反应,所以没有铜离子!
C、0.1时,应该是百分之五十!
D、要与铁铝合金5.6克反应,需要的硫酸总量至少为大于9.8克,因为纯铁的话都需要9.8克,加上铝就需要更多的硫酸!
D正确!
2、A、溶质可以是一种也可以是多种,小明的溶液中溶质至少有硫酸锌,可能会有纯硫酸!
B、小勇由于有剩余,所以肯定是没有稀硫酸了!
C、直接由锌的消耗量来算氢气,小明的产生了0.4克的氢气!
D、根据小明的反应,原稀硫酸至少应该是等于19.6%!
B正确!
第2题似乎你写的题目有点问题,里面应该有个稀释的过程,要不同样的硫酸,13克没剩余,6.5克有剩余,很难理解!
我还在念小学,不妥之处,多多批评哦!1年前查看全部
- Cu-Zn合金外观类似黄金.取Cu-Zn合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的
Cu-Zn合金外观类似黄金.取Cu-Zn合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g.求:
(1)产生氢气的质量;
(2)求出该合金中铜的质量分数. xuzhilijun1年前1
xuzhilijun1年前1 -
 读史 共回答了22个问题
读史 共回答了22个问题 |采纳率95.5%解题思路:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以生成氢气的质量=参加反应前各物质的质量总和-反应后生成各物质的质量总和;
(2)根据锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该合金中锌的质量,则该合金中铜的质量=合金质量-该合金中锌的质量,进而求出铜的质量分数;(1)产生氢气的质量=20g+50g-69.8g=0.2g;
(2)设该合金中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
[65/x=
2
0.2g],
x=6.5g
则该合金中铜的质量分数为:[20g−6.5g/20g]×100%=67.5%;
故答案为:(1)产生氢气的质量为0.2g;(2)该合金中铜的质量分数为67.5%;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生对金属的化学性质的认识,以及运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2009•宣武区一模)某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴
(2009•宣武区一模)某合金的主要成分有锌、铜、碳等物质.为测定合金的某些含量做如下实验:向50.3g合金粉末中逐次滴加等质量的质量分数为20.0%的硫酸铜溶液(已知碳不参与反应),充分反应后,得到如下部分数据和图象.
次数 第1次 第2次 硫酸铜溶液的质量/g 80.0 80.0 粉末的质量/g 50.2 50.1 
计算反应后:
(1)粉末减轻的质量.
(2)加入320.0g硫酸铜时,硫酸盐中铜元素与硫酸根离子的质量比.
(3)粉末中铜元素的质量分数(反应后测定碳元素的质量为4.0g). 马丙丁1年前1
马丙丁1年前1 -
 老谷 共回答了18个问题
老谷 共回答了18个问题 |采纳率100%解题思路:在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,锌能与硫酸铜反应生成硫酸锌和铜.(1)根据图象结合表格提供的数据可以看出加入硫酸铜的质量为240g粉末质量不再改变,每加入80g硫酸铜粉末减轻0.1g,所以粉末共减轻0.1g×3=0.3g;
(2)铜元素与硫酸根离子的质量比=(80.0 g×20.0%×[64/160]):(320.0 g×20.0%×[96/160])=1:6;
(3)反应后粉末中铜元素的质量分数=
(50.3−4.0−0.3)g
(50.3−0.3)g×100%=92.0%.
答:粉末减轻的质量为0.3 g,铜元素与硫酸根离子的质量比为1:6,充分反应后,剩余粉末中铜元素的质量分数为92.0%.点评:
本题考点: 金属活动性顺序及其应用;根据化学反应方程式的计算.
考点点评: 本题考查了金属活动性顺序及其应用和有关的计算,完成此题,可以依据金属活动性顺序及其意义进行.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. 鬼魅泥沙1年前1
鬼魅泥沙1年前1 -
 zp555 共回答了17个问题
zp555 共回答了17个问题 |采纳率94.1%解题思路:(1)由于铜与稀硫酸不反应,故铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应,可直接写出反应方程式;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(4)根据(3)中化学方程式的比例关系,求出溶质的质量,及溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)Zn+H2SO4→ZnSO4+H2↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4→ZnSO4+H2↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5/10]×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 小华为测定黄铜中铜的质量分数,她称取10克该合金粉末,在粉末中连续三次加入稀盐酸中反映,记录数据如下:三次加入稀盐酸的质
小华为测定黄铜中铜的质量分数,她称取10克该合金粉末,在粉末中连续三次加入稀盐酸中反映,记录数据如下:三次加入稀盐酸的质量都为10克,第一次生成氢气的质量为0.08克,第二次为0.08克,第三次为0.04克,求1.黄铜中 铜的质量分数 2.稀盐酸的溶质质量分数.
 斜我小1年前1
斜我小1年前1 -
 阿古佳 共回答了27个问题
阿古佳 共回答了27个问题 |采纳率92.6%从数据看,每10克盐酸完全反应就能生成氢气质量为0.08克,总生成氢气质量为0.08*2+0.04=0.2克,
设锌质量为X
Zn + 2HCl === ZnCl2 + H2↑
65 2
X 0.2克
X=6.5克,
所以黄铜中铜的质量分数为(10-6.5)/10=35%
(2)设生成0.08克氢气需要氯化氢质量为X
Zn + 2HCl === ZnCl2 + H2↑
73 2
X 0.08克
X=2.92克,
所以盐酸溶液中溶质质量分数为2.92/10=29.2%
亲,有其他题目请另外发问,此问题有疑问,以上都是本人自己纯手工做的,有错误,请指出.我是诚心的想帮你,若满意请请点击在下答案旁的"好评",互相探讨,互相理解,请不要随意给差评,1年前查看全部
- 小刚取cu-zn合金粉末65克与足量稀盐酸充分反应 得到0.4G气体.计算出该合金中铜质量分数
小刚取cu-zn合金粉末65克与足量稀盐酸充分反应 得到0.4G气体.计算出该合金中铜质量分数
我其他学科成绩很好 就是化学学不上路`
谢谢第一位朋友点播` 我算出来了` 80%没错吧`? 蝶花缘1年前1
蝶花缘1年前1 -
 缘来就是你啊 共回答了18个问题
缘来就是你啊 共回答了18个问题 |采纳率88.9%锌与稀盐酸反应生成氢气,写出化学方程式后求出锌的质量,在用合金粉末总质量减去锌的质量求出铜的质量,最后将铜的质量比合金粉末的质量得出铜的质量分数.
80%是正确的1年前查看全部
- 一道化学题 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了实验,所得相关的实验数据记录
一道化学题 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了实验,所得相关的实验数据记录如下:
所取合金的质量:10g
所用稀硫酸的质量:50g
生成氢气的质量:0.2g
试计算该铜锌合金中含锌的质量分数.
注:实验合金粉末与稀硫酸刚好完全反应. babby211年前1
babby211年前1 -
 秋沙鸭 共回答了31个问题
秋沙鸭 共回答了31个问题 |采纳率90.3%1 因为生成氢气的质量为 0.2g 则H2物质的量 0.2/2 = 0.1mol
Zn + H2SO4 = ZnSO4 + H2↑
锌物质的量 0.1mol 锌的质量 0.1×65 = 6.5g
该铜锌合金中含锌的质量分数 6.5/10 = 65%1年前查看全部
- 某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫
某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气.下列说法正确的是( )
A. 当粉末为Cu~Fe合金时,反应所得溶液中一定含有Fe2+和Cu2+
B. 当粉末为Cu~Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50%
C. 当粉末为Al~Fe合金时,a<0.2g
D. 当粉末为Al~Fe合金时,所需稀硫酸溶质质量分数>9.8% aleon6661年前1
aleon6661年前1 -
 VactoR 共回答了23个问题
VactoR 共回答了23个问题 |采纳率95.7%解题思路:Cu~Fe合金中,Cu和稀硫酸不反应,只有Fe和稀硫酸反应生成Fe2+;Al~Fe合金可先假设Al和Fe分别是5.6g时,各自和稀硫酸反应生成氢气的质量和所需硫酸溶质的质量,然后再来找出Al~Fe合金和稀硫酸反应生成氢气的范围及硫酸质量分数的范围.A、当粉末为Cu~Fe合金时,因为Cu和稀硫酸不反应,只有Fe和稀硫酸反应生成Fe2+,所以溶液中不可能有Cu2+.故A错误;
B、当粉末为Cu~Fe合金时,若a为0.1g,即氢气为0.1g,根据铁和稀硫酸反应方程式,用氢气质量求出铁的质量为2.8g,即合金中含铁的质量分数为50%.故B正确;
C、当粉末为Al~Fe合金时,假设铝为5.6g,通过计算可知5.6g铝会产生0.62g氢气;如果铁是5.6g,通过计算可知5.6g铁会产生0.2g氢气,也就是说5.6gAl~Fe合金产生的氢气质量大于0.2g而小于0.62g.故C错误;
D、当粉末为Al~Fe合金时,假设铝为5.6g,通过计算可知5.6g铝消耗硫酸溶质是30.5g,即100g硫酸溶液中溶质的质量分数为30.5%;如果铁是5.6g,通过计算可知5.6g铁消耗硫酸溶质是9.8g,即100g硫酸溶液中溶质的质量分数为9.8%,所以5.6gAl~Fe合金和硫酸反应需硫酸溶质的质量分数大于9.8% 而小于30.5%.故D正确.
故选BD点评:
本题考点: 根据化学反应方程式的计算;金属活动性顺序及其应用.
考点点评: 此题常用的方法就是极端假设法,同学们掌握了此方法,就可以解决这一类的问题.1年前查看全部
- 某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg 2 + 检验方法:取2滴待检液,加入2滴2mol·L -1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg 2 + 。Ag + 、Cu 2 + 、Fe 3 + 、NH 4 + 会妨碍Mg 2 + 检出
②Mg(OH) 2 可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。试验序号 实 验 步 骤 实 验 现 象 结 论 ① 取少量该焰火原料加入冷水 无明显现象 ________________ ② 取少量该焰火原料加入稀盐酸 完全溶解,有大量气体 _________________
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量
氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n B.m、yC.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________ 憨痴1年前1
憨痴1年前1 -
 lacushuahua 共回答了17个问题
lacushuahua 共回答了17个问题 |采纳率100%1年前查看全部
- (2014•武汉)将4.0g Cu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应.过滤、称量滤液的质量.相关实
(2014•武汉)将4.0g Cu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应.过滤、称量滤液的质量.相关实验数据如下:
(1)Cu-Zn合金属于______材料(“金属”或“有机合成”)反应前物质的质量/g 反应后物质的质量/g Cu-Zn合金 稀硫酸 滤液 4.0 10 11.26
(2)若不考虑该合金中除Cu、Zn以外的其他成分,请计算原Cu-Zn合金中Zn的质量.写出必要的计算过程. ☆风云男孩☆1年前1
☆风云男孩☆1年前1 -
 simon-1347 共回答了20个问题
simon-1347 共回答了20个问题 |采纳率85%解题思路:(1)根据合金属于金属材料分析;
(2)滤液的质量为锌的质量和硫酸的质量之和减去氢气的质量.(1)Cu-Zn合金属于金属材料;
故答案为:金属;
(2)设铜锌合金中Zn质量为x,Cu的质量为4.0g-x,
则生成氢气的质量=10+x-11.26g=x-1.26g
Zn+H2SO4=Zn SO4+H2↑
65 2
x x-1.26g
[65/2=
x
x−1.26g]
x=1.3g
答:合金中Zn的质量为1.3g.点评:
本题考点: 根据化学反应方程式的计算;金属材料及其应用.
考点点评: 要找准各量之间的关系,难度较大.1年前查看全部
- 把a g铝铁合金粉末溶于足量盐酸中,再加入过量氧化钠溶液后过滤,将沉淀洗涤,干燥、灼烧,得到红棕色粉末的质量仍
把a g铝铁合金粉末溶于足量盐酸中,再加入过量氧化钠溶液后过滤,将沉淀洗涤,干燥、灼烧,得到红棕色粉末的质量仍为a g,则此合金铝的质量分数为( )
A. 70%
B. 30%
C. 52.4%
D. 22.2% ccr10011年前1
ccr10011年前1 -
 NUOMIDOU 共回答了20个问题
NUOMIDOU 共回答了20个问题 |采纳率90%解题思路:a g铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.由铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,过滤后向滤液中通入足量二氧化碳,沉淀为氢氧化铝,则经洗涤、干燥、灼烧,得到的固体粉末是氧化铝,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,则合金中Al的质量分数等于氧化铁中氧的质量分数=[16×3/160]×100%=30%,
故选B.点评:
本题考点: 有关混合物反应的计算;铝的化学性质;铁的化学性质.
考点点评: 本题考查混合物的有关计算,难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒.1年前查看全部
- (2004•镇江)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实
(2004•镇江)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)试计算该铜锌合金中合金锌的质量.第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的比为______时,表明合金中的锌与稀硫酸恰好完全反应.
(3)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数. 冰镇矿泉水681年前1
冰镇矿泉水681年前1 -
 ovpynn110 共回答了25个问题
ovpynn110 共回答了25个问题 |采纳率92%解题思路:(1)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(2)从三次实验数据可知,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据(1)中化学方程式的比例关系,求出溶质的质量,根据质量守恒得出溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 1612
x y0.2g
[65/x=
2
0.2g=
161
y]
解之得:x=6.5g
y=16.1g
答:合金中锌的质量为6.5克.
(2)从三次实验数据可知,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,即当合金的质量和稀硫酸的质量比为1:5时恰好反应完全.
故答案为 1:5
(3)根据(1)得出生成溶质硫酸锌的质量为16.1g;
所得溶液的质量为反应前加入合金和硫酸的质量之和减去生成氢气的质量.
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%
答:所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生分析图表数据和根据化学方程式进行计算的能力.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下: 
(1)写出有关反应的化学方程式
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸恰好完全反应。(提示:铜与稀硫酸不反应)
(3) 试计算该铜锌合金中锌的质量分数。 danis71年前1
danis71年前1 -
 蓟门桥的鱼 共回答了18个问题
蓟门桥的鱼 共回答了18个问题 |采纳率77.8%1年前查看全部
- (2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉
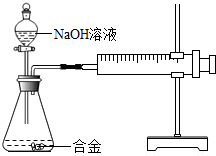 (2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
(2013•徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
(1)铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
(2)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑(NaAlO 2 溶于水,溶液现无色)
【进行猜想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液.
表1实验记录
【得出结论】猜想3成立.实验步骤 实验现象 结论 ①取一定量的合金粉末,加过量的______,充分反应后过滤,滤渣备用 粉末部分溶解,并有无色气体放出 合金中一定含有______ ②取步骤①所得滤渣,加过量______,充分反应 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 合金中一定含有______
【反思】
1.一般来说,活泼金属能与稀硫酸等算反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的基本类型是______反应.
2.上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把______,并不断搅拌.
3.若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是______.
【拓展与分析】请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱______. 放飞的小鸟1年前1
放飞的小鸟1年前1 -
 tianyu_26 共回答了16个问题
tianyu_26 共回答了16个问题 |采纳率81.3%解题思路:【猜想】根据可能含有的物质进行组合分析;
【实验探究】根据题目资料中的信息:铝会与碱反应生成氢气,而铁和铜不会与碱反应,根据铁能与酸反应产生气体且溶液呈浅绿色,联系题目中所给现象--滤渣溶解会生成气体,且溶液显浅绿色反应进行分析得知合金中有铁;滤渣部分溶解,说明有不与酸反应的固体,铜在金属活动性顺序中排在氢的后面,不能与酸反应,得知合金中含有铜.
【反思】1、根据铝会与盐酸反应生成氢气的化学方程式联系置换反应的定义进行分析;
2、稀释浓硫酸的方法是教材上的知识,由于浓硫酸溶于水时放热,所以要把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.
3、在金属活动性顺序中,只有排在氢前面的金属才能与酸反应放出氢气,排在氢后面的金属,不能与酸反应,其中铜排在氢的后面,不与酸反应;【猜想】合金中除了含有铝之外,还含有铁、铜中的一种或两种,结合题中的猜想可知还有铜,故答案为:铜;
【实验探究】铝会与碱反应生成氢气,而铁和铜不会与碱,滤渣溶解会生成气体,且溶液显浅绿色反应,铜不会与酸反应,可以先用氢氧化钠鉴别铝的存在,然后再根据与酸反应时的现象鉴别铁和铜的存在,故答案为:
实验操作 实验现象 实验结论
①30%氢氧化钠溶液 ------ 铝
②20%的硫酸溶液 ------ 铁、铜【反思】1、根据铝会与盐酸反应生成氢气的化学方程式联系置换反应的定义可知该反应属于置换反应,故答案为:置换
2、由于浓硫酸溶于水时放出大量的热,所以要把浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌.故答案为:浓硫酸沿烧杯壁慢慢注入水中
3、在金属活动性顺序中,铜排在氢的后面,不与酸反应,故答案为:铜
【拓展与分析】根据金属与盐溶液反应的条件,在金属活动性顺序中,排在前面的金属能把排在后面的金属从其盐溶液中置换,所以铝能置换出铁,铜不能置换出铁.
故答案为:把一根用砂纸打磨过的铝丝和铜丝分别插入盛有硫酸亚铁溶液的试管中,过一会观察现象.点评:
本题考点: 实验探究物质的性质或变化规律;浓硫酸的性质及浓硫酸的稀释;金属的化学性质;碱的化学性质;反应类型的判定.
考点点评: 此题以实验探究的形式考查了金属的化学性质,在解此类题时,首先分析需要鉴别的物质的性质,然后结合题中的现象进行逐一的鉴别.1年前查看全部
- (2012•天桥区二模)镁、锌合金粉末5g恰好与一定质量10%的稀盐酸完全反应,将反应后的溶液蒸发,得到不含结晶水的固体
(2012•天桥区二模)镁、锌合金粉末5g恰好与一定质量10%的稀盐酸完全反应,将反应后的溶液蒸发,得到不含结晶水的固体12.1g,则反应中生成氢气的质量为( )
A.0.1g
B.0.2g
C.0.3g
D.0.4g 动动20021年前1
动动20021年前1 -
 跳舞的键盘 共回答了21个问题
跳舞的键盘 共回答了21个问题 |采纳率85.7%解题思路:根据蒸发后的固体混合物的质量减去反应前的固体是两种金属混合物的质量就是盐酸中氯离子的质量,由氢元素和氯元素的质量比可以进行分析解答本题.蒸发后的固体为混合物,反应前的固体是镁和锌的质量为5g,所以12.1g-5g=7.1g为氯元素的质量,在盐酸中,氢元素与氯元素的质量比为1:35.5,
设产生的氢气的总质量为x,
则[1/35.5]=[x/7.1g]
解得:x=0.2g.
分析所给的选项可以知道选项B是正确的,
故选B.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生灵活运用质量守恒定律和化学反应方程式解答问题的能力,在解题时注意元素守恒的运用.1年前查看全部
- (2014•兰州一模)为测定Cu-Zn合金的组成,小华同学利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记
(2014•兰州一模)为测定Cu-Zn合金的组成,小华同学利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
请计算:第一次 第二次 第三次 所取合金的质量/g 1O 10 20 加入硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(1)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应;
(2)该合金中锌的质量为多少克?(计算结果保留一位小数)
(3)所用合金中的锌与稀硫酸恰好完全反应时所得溶液中溶质的质量分数为多少?(计算结果精确到0.1%) because19831年前1
because19831年前1 -
 robbines56 共回答了14个问题
robbines56 共回答了14个问题 |采纳率71.4%解题思路:(1)由表中数据可知,向10g合金中加入50g稀硫酸时,生成氢气的质量为0.2g,向10g合金中加入80g稀硫酸时,生成氢气的质量为0.2g,说明10g合金中的锌完全反应时至多消耗50g稀硫酸,向20g合金中加入50g稀硫酸时,生成氢气的质量为0.2g,说明50g稀硫酸最多能和10g合金中的锌反应,因此10g合金与50g稀硫酸恰好完全反应;
(2)根据生成氢气的质量可以计算该合金中锌的质量;
(3)根据生成氢气的质量可以计算生成硫酸锌的质量,进一步可以计算所用合金中的锌与稀硫酸恰好完全反应时所得溶液中溶质的质量分数.(1)10g合金与50g稀硫酸恰好完全反应,当所取合金与所用稀硫酸恰好完全反应时的在路边为:10g:50g=1:5,
故填:1:5.
(2)设合金中锌的质量为x,生成硫酸锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑,
651612
xy0.2g
[65/x]=[2/0.2g],
x=6.5g,
[161/y]=[2/0.2g],
y=16.1g,
答:该合金中锌的质量为6.5g;
(3)所得溶液中硫酸锌的质量分数为:[16.1g/6.5g+50g−0.2g]×100%=28.6%,
答:所得溶液中硫酸锌的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.1年前查看全部
- 小华想测定Cu-Zn合金中铜的的质量分数,他将该合金粉末32.5g与足量稀盐酸反应,经测定,产生气体0.4g.请求出该合
小华想测定Cu-Zn合金中铜的的质量分数,他将该合金粉末32.5g与足量稀盐酸反应,经测定,产生气体0.4g.请求出该合金中铜的质量分数
 wang尖尖1年前1
wang尖尖1年前1 -
 夜晚绝望的百合 共回答了20个问题
夜晚绝望的百合 共回答了20个问题 |采纳率80%铜不反应
Zn+2HCl=ZnCl2+H2
65 2
x 0.4g
65/x=2/0.4g
x=13g
(32.5g-13g)/32.5g*100%=60%1年前查看全部
- 测定cu—zn合金中zn的质量分数,取该合金粉末32.5g与足量稀H2SO4充分反应,生成0.4g气
测定cu—zn合金中zn的质量分数,取该合金粉末32.5g与足量稀H2SO4充分反应,生成0.4g气
求合金中铜的质量分数 谜迭魅影1年前1
谜迭魅影1年前1 -
 unfurlsails 共回答了14个问题
unfurlsails 共回答了14个问题 |采纳率100%0.4g
mZn=0.4*65/2=13g
mCu=32.5-13=19.5g
mCu:mZn=19.5:13 Zn+H2SO4=H2↑+ZnSO4
65 2
x 0.4g
65/2=x/0.4gx=13g
m(Cu)=32.5g-13g=19.5g
铜的质量分数为19.5g/32.5g×100%=60.0%锌的质量分数为1-60%=40%祝你学习进步!理解请及时采纳!1年前查看全部
- 甲乙丙三人进行下列实验;各取30.0ml同浓度盐酸(密度为1.01g/ml)加入同一镁、铝合金粉末,产生气体,
甲乙丙三人进行下列实验;各取30.0ml同浓度盐酸(密度为1.01g/ml)加入同一镁、铝合金粉末,产生气体,
有关数据如下; 甲 乙 丙
合金质量(g) 0.225 0.385 0.459
气体质量(g) 0.025 0.03 0.03
问; 1、盐酸的溶质质量分数(精确到0.1%)
2、合金中镁铝的质量比. 触网e族1年前1
触网e族1年前1 -
 bm7ba 共回答了15个问题
bm7ba 共回答了15个问题 |采纳率100%设盐酸的质量为x 镁的质量为y
Mg+2Hcl==Mgcl2+H2↑
24 73 2
y x 0.03
x=1.095
y=0.36
盐酸的质量=密度×体积=30.0ml×1.01g/ml=30.3g
盐酸的质量分数=1.095g/30.3g×100%=3.6%
铝的质量=0.385g-0.36g=0.025g
0.36g:0.025g=72:5
仅供参考 对错不知道1年前查看全部
- 为了测定铜锌合金的组成,某校化学课外活动利用该合金粉末与稀硫酸反应进行了四次实验,所得相关实验数
为了测定铜锌合金的组成,某校化学课外活动利用该合金粉末与稀硫酸反应进行了四次实验,所得相关实验数
第一次 第二次 第三次 第四次
所含合金的质量/克 8.0 8.0 8.0 12.0
所用稀硫酸的体积/毫升 8.0 16.0 24.0 一定体积
剩余合金的质量/克 6.7 5.4 4.8 8.1
第四次所加硫酸的体积为
试计算8.0g铜锌合金中锌的质量和第一次试验后所得溶液的溶质质量分数.(已知稀硫酸的密度是1.17g/mL) chenjuzi1年前1
chenjuzi1年前1 -
 起名字真不容易 共回答了15个问题
起名字真不容易 共回答了15个问题 |采纳率86.7%计算比较麻烦:我只提供思路
不管怎么写,你必须算出“铜锌合金的比值”,
反映的原理是:锌与稀硫酸反映而铜不会.
通过第一次的反应结果和第二次的反应结果和第三次的反应结果可看出:
第一次与第二次:“剩余合金的质量”的差值:1.3g(差值是因为多用了8.0ml的稀硫酸)
第二次与第三次:“剩余合金的质量”的差值:0.6g(如果按第一次与第二次的接结果来推算,那么在多用0.8ml的稀硫酸,则差值应该是:4.1g)
结论:4.8g是铜的质量;
所以8.0g的锌铜合金中铜为4.8g,锌为3.2g
再由化学方程式公式:Zn+H2SO4=ZnSO4+H2↑
即得:自己算吧!1年前查看全部
- 为了测定铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次试验,所得相关的实验数据记录如下表
为了测定铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次试验,所得相关的实验数据记录如下表
第一次 第二次 第三次 第四次
所含合金的质量/g 8.0 8.0 8.0 12.0
所用稀硫酸的体积/ml 8.0 16.0 24.0 一定体积
剩余合金的质量/g 6.7 5.4 4.8 8.1
已知稀硫酸的密度是1.17g/ml
⑴试计算8.0g铜锌合金中锌的质量.
⑵第四次所加硫酸的体积.
⑶第一次实验后所得溶液的溶质质量分数.
3.2g ⑵ 24ml ⑶30.3%) sytysk1年前1
sytysk1年前1 -
 时尚Patty 共回答了13个问题
时尚Patty 共回答了13个问题 |采纳率84.6%貌似原题是:
为了测定黄铜屑(由锌和铜形成的合金)样品的组成,甲、乙、丙、丁四位同学分别取样和稀硫酸反应(稀硫酸的密度为1.17g/mL)实验数据记录如下:
甲 乙 丙 丁
取用黄铜屑的质量/g 8.0 8.0 8.0 12.0
取用稀硫酸的体积/mL 8.0 16.0 24.0 一定体积
残留金属的质量/g 6.7 5.4 4.8 8.1
根据表格计算:(1)8.0g黄铜屑中锌的质量;(2)丁同学所加稀硫酸的体积;(3)甲同学最后所得溶液中溶质的质量分数.
1) ...根据甲乙数据可知,每反应8毫升硫酸,就有1.3克锌参加反应
丙比乙硫酸多8毫升,而多反应的锌只有0.6克
所以,丙实验中锌反应完全,则铜含量为4.8克
所以锌的质量为3.2克 8g-4.8g=3.2g
2)丁同学的实验中,锌反应了3.9克,则所需硫酸体积为
3.9/1.3*8ml = 24ml
3) 参加反应的锌的质量为8g-6.7g=1.3g
设生成ZnSO4的质量为x,H2的质量为y
Zn+H2SO4=ZnSO4+H2↑
65 161 2
1.3g x y
65:1.3g=161:x=2:y
x=3.22g y=0.04g
稀硫酸的质量为 8ml X 1.17g/ml = 9.36g
甲同学最后所得溶液中溶质的质量分数为
3.22g/(1.3g+9.36g-0.04g) x 100% =30.3%1年前查看全部
- 某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫
某研究小组测定Cu~Fe合金和Al~Fe合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气.下列说法正确的是( ) A.当粉末为Cu~Fe合金时,反应所得溶液中一定含有Fe 2+ 和Cu 2+ B.当粉末为Cu~Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50% C.当粉末为Al~Fe合金时,a<0.2g D.当粉末为Al~Fe合金时,所需稀硫酸溶质质量分数>9.8%  坐拥双子1年前1
坐拥双子1年前1 -
 心情馆 共回答了20个问题
心情馆 共回答了20个问题 |采纳率90%A、当粉末为Cu~Fe合金时,因为Cu和稀硫酸不反应,只有Fe和稀硫酸反应生成Fe 2+ ,所以溶液中不可能有Cu 2+ .故A错误;B、当粉末为Cu~Fe合金时,若a为0.1g,即氢气为0.1g,根据铁和稀硫酸反应方程式,用氢气质...1年前查看全部
- Cu-Zn合金外观类似黄金.取Cu-Zn合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的
Cu-Zn合金外观类似黄金.取Cu-Zn合金粉末20g放入烧杯中,加入50g的稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8g.求:
(1)产生氢气的质量;
(2)求出该合金中铜的质量分数. xiaocongba1年前1
xiaocongba1年前1 -
 仙羿示樵夫 共回答了23个问题
仙羿示樵夫 共回答了23个问题 |采纳率87%解题思路:(1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.所以生成氢气的质量=参加反应前各物质的质量总和-反应后生成各物质的质量总和;
(2)根据锌与稀硫酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出该合金中锌的质量,则该合金中铜的质量=合金质量-该合金中锌的质量,进而求出铜的质量分数;(1)产生氢气的质量=20g+50g-69.8g=0.2g;
(2)设该合金中锌的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
[65/x=
2
0.2g],
x=6.5g
则该合金中铜的质量分数为:[20g−6.5g/20g]×100%=67.5%;
故答案为:(1)产生氢气的质量为0.2g;(2)该合金中铜的质量分数为67.5%;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生对金属的化学性质的认识,以及运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 某研究小组测定Cu-Fe合金和Fe-Al合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫
某研究小组测定Cu-Fe合金和Fe-Al合金中铁的质量分数.向5.6g其中一种合金粉末中加入100g某溶质质量分数的稀硫酸,恰好完全反应,并产生ag氢气,则下列说法正确的是( )
A.当粉末为Fe-Al合金时,a可能为0.2g
B.当粉末为Cu-Fe合金时,反应完全后,生成物的溶液里一定含有Fe2+和Cu2+
C.当粉末为Cu-Fe合金时,若a为0.1g,则该种合金中含铁的质量分数为50%
D.当粉末为Fe-Al合金时,所需稀硫酸溶质质量分数一定大于9.8% dingshine1年前1
dingshine1年前1 -
 lvjfeng 共回答了14个问题
lvjfeng 共回答了14个问题 |采纳率92.9%解题思路:因为铝的相对原子质量比铁小,所以相同质量的铝与酸完全反应时,产生的氢气质量多,而铜与酸不反应,所以可以将铜的相对原子质量看成无限大.假设合金中铁的质量为5.6 g,则根据化学反应的方程式:Fe+H2SO4=FeSO4+H2↑可计算出此时产生氢气的质量为0.2 g,同理可计算出5.6 gAl与足量硫酸反应产生氢气的质量大于0.2 g,因此当粉末为Fe-Al合金时,a>0.2 g;铜不与硫酸反应产生氢气,因此当粉末为Cu-Fe合金时,a<0.2 g;当粉末为Cu-Fe合金时若a为0.1g时,利用化学方程式可计算出需铁的质量为2.8g,故该种合金中含铁的质量分数为50%.当粉末为Fe-Al合金时,因相同质量的铝消耗硫酸的质量比铁消耗硫酸的质量大,而5.6 g铁时,消耗硫酸的质量为9.8 g,所以合金为为Fe-Al合金时,所需稀硫酸溶质质量分数一定大于9.8%.
故选CD点评:
本题考点: 实验探究物质的组成成分以及含量;有关溶质质量分数的简单计算;合金与合金的性质;根据化学反应方程式的计算.
考点点评: 相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量有关.若相对原子质量越大,产生的氢气质量越小.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. 语了1年前1
语了1年前1 -
 JSTTYF 共回答了17个问题
JSTTYF 共回答了17个问题 |采纳率100%(1)Zn+H 2 SO 4 →ZnSO 4 +H 2 ↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H 2 SO 4 →ZnSO 4 +H 2 ↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:
6.5
10 ×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO 4 的质量分数:
16.1g
6.5g+50g-0.2g ×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO 4 的质量分数为28.6%.1年前查看全部
- 1.为了测定Cu-Zn合金的组成,小华称取10克该合金粉末
1.为了测定Cu-Zn合金的组成,小华称取10克该合金粉末,在粉末里连续三次加入稀硫酸反应.每加一次盐酸,小华都记录下所得气体的质量,实验数据:第一次加人10毫升盐酸,生成0.08克氢气,第二次加入10毫升盐酸,生成0.08克氢气,第三次加入10毫升盐酸,生成0.04克氢气.求该合金中铜的质量分数. 2.有两种外观类似黄金的Cu-Zn合金和Cu-Ag合金,若实验室只提供一瓶稀硫酸和必要的仪器. (1)你认为能测出____合金中的铜的质量分数;不能测定另一种合金中铜的质量分数的原因是__________ (2)取上述(1)中合金粉末20克放入烧杯中,加入50克稀硫酸,恰好完全反应,测得烧杯内剩余物质的质量为69.8克.求: ①产生氢气是质量 ②该合金中铜的质量分数
 hope1331年前1
hope1331年前1 -
 新人5631 共回答了20个问题
新人5631 共回答了20个问题 |采纳率80%1、第一次,第二次生成的氢气量一样的,说明合金中的Zn过量,还没有反应完,第三次再加入同体积的盐酸,产生的氢气量变少了,说明合金中的Zn已经反应完了.
生成氢气的量=0.08+0.08+0.04=0.2克
Zn + 2HCl = ZnCl2 + H2
65 2
X 0.2
解得X=6.5
所以合金中的铜的质量=10-6.5=3.5克.
该合金中铜的质量分数=3.5/10*100%=35%.
2、(1)Cu-Zn合金中的铜的质量分数.能测定另一种合金中铜的质量分数的原因是合金中的两种金属都不能与盐酸反应.
(2)Zn+H2SO4===ZnSO4 + H2
65 2
x 70-69.8
x=6.5g
H2质量0.2g
Cu的质量=20-6.5=13.5g
质量分数=13.5/20=67.5%
答:
好好学习,天天向上.1年前查看全部
- (2012•青浦区二模)常温下,将ag钠铝合金粉末加入一定量水中,混合物全部溶解,收集到b mL气体(标准状况
 (2012•青浦区二模)常温下,将ag钠铝合金粉末加入一定量水中,混合物全部溶解,收集到b mL气体(标准状况).然后往溶液中加入1mol/L的盐酸,生成沉淀的质量与消耗盐酸的体积关系如图所示.若V1=20mL,则下列关系正确的是( )
(2012•青浦区二模)常温下,将ag钠铝合金粉末加入一定量水中,混合物全部溶解,收集到b mL气体(标准状况).然后往溶液中加入1mol/L的盐酸,生成沉淀的质量与消耗盐酸的体积关系如图所示.若V1=20mL,则下列关系正确的是( )
A.a=0.92
B.b=896
C.m=1.56
D.V2=100 恋木头1年前1
恋木头1年前1 -
 尘梦 共回答了21个问题
尘梦 共回答了21个问题 |采纳率95.2%解题思路:钠铝合金置于水中,合金全部溶解,发生2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
由图象可知,加入盐酸没有立即产生沉淀,故首先发生反应NaOH+HCl═NaCl+H2O,该阶段消耗盐酸20mL,
然后发生反应NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl),该阶段消耗盐酸体积为40mL-20mL=20mL,根据方程式计算n[Al(OH)3],根据铝元素守恒n(Al)=n[Al(OH)3],
最后发生反应Al(OH)3↓+3HCl═AlCl3+3H2O,根据氢氧化铝的物质的量计算该阶段消耗盐酸的体积,
A.根据m=nM计算Na、Al合金的质量;
B.根据Na、Al的物质的量,计算生成氢气的体积,再根据V=nVm计算生成的氢气的体积;
C.根据氢氧化铝的物质的量,根据m=nM计算氢氧化铝的质量;
D.溶解氢氧化铝消耗的盐酸体积与40mL之和为V2的值.钠铝合金置于水中,合金全部溶解,发生2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,
由图象可知,加入盐酸没有立即产生沉淀,故首先发生反应NaOH+HCl═NaCl+H2O,该阶段消耗盐酸20mL,
然后发生反应NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,生成氢氧化铝沉淀,40mL时沉淀达最大值,此时溶液中溶质为NaCl,由钠元素守恒可知n(Na)=n(NaCl)=0.04L×1mol/L=0.04mol,该阶段消耗盐酸体积为40mL-20mL=20mL,根据方程式计算n[Al(OH)3]=n(HCl)=0.02L×1mol/L=0.02mol,根据铝元素守恒n(Al)=n[Al(OH)3]=0.02mol,
最后发生反应Al(OH)3↓+3HCl═AlCl3+3H2O,消耗盐酸的物质的量为0.02mol×3=0.06mol,故该阶段消耗的盐酸体积为[0.06mol/1mol/L]=0.06L=60mL,
A.由上述分析可知,Na、Al合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误;
B.由方程式可知,0.04molNa生成氢气为0.04mol×[1/2]=0.02mol,0.02molAl生成氢气为0.02mol×[3/2]=0.03mol,硅生成氢气的物质的量为0.02mol+0.03mol=0.05mol,其标况下的体积为0.05mol×22.4L/mol=1.12L,故B错误;
C.由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故C正确;
D.由上述计算可知,溶解氢氧化铝消耗盐酸的体积为60mL,则V2为40mL+60mL=100mL,故D正确;
故选CD.点评:
本题考点: 有关混合物反应的计算;钠的化学性质;铝的化学性质.
考点点评: 本题考查混合物的有关计算及钠、铝的化学性质等,明确发生的化学反应及反应与图象的对应关系是解答本题的关键,注意利用元素守恒的方法来解答,难度较大.1年前查看全部
- 在装潢、装饰和书写对联时,常用到一种“金粉”,已知这种“金粉”是由两种金属形成的合金粉末。三位同学做了如下探究实验。
在装潢、装饰和书写对联时,常用到一种“金粉”,已知这种“金粉”是由两种金属形成的合金粉末。三位同学做了如下探究实验。
甲同学:取少量“金粉”放入燃烧匙中,用酒精灯加热,发现“金粉”变黑,立即将燃烧匙伸入盛有H 2 的集气瓶中,黑色粉末又恢复金黄色。
乙同学:另取,放入试管中,加足量稀盐酸,有气体产生,始终有红色固体不能溶解。
丙同学:通过定量实验测得一些数据,再计算出“金粉”中与稀盐酸反应的金属的相对原子质量为65.4。
回答下列问题:① 写出与实验现象对应的化学反应方程式,并判断反应类型。
甲同学的实验中金粉变黑: ,()反应
乙同学的实验中产生气体: ,()反应
② 假设“金粉”是纯的黄金,在甲、乙两同学的实验中应观察到:
甲 ,乙 。
③ 在乙同学的实验中,若把稀盐酸换为AgNO 3 溶液,可能发生反应的化学方程式为 、 。
④ 丙同学的实验中,至少应该测量的一组数据是 (填下列选项的字母标号)。A.“金粉”的质量 B.“金粉”溶于盐酸后剩余固体的质量 C.反应放出气体的质量 D.反应放出气体的体积和密度  donwill1年前1
donwill1年前1 -
 oo狼 共回答了27个问题
oo狼 共回答了27个问题 |采纳率96.3%① 2Cu+O 2 △=== 2CuO 化合 Zn+2HCl=== ZnCl 2 +H 2 ↑置换
②“金粉”始终不变色加盐酸时无现象
③ Zn+2AgNO 3 === Zn(NO 3 ) 2 +2Ag Cu+2AgNO 3 === Cu(NO 3 ) 2 +2Ag
④ABC或ABD(2分,全对才给分)
本题考查了铜的化学性质,由甲同学可知“金粉”是铜粉,铜和氧气反应时生成黑色的氧化铜,氢气还原氧化铜又生成红色的铜1年前查看全部
- 小华想测定Cu—Zn合金及Cu—Ag合金中铜的质量分数,取32.5g合金粉末与足量稀盐酸反应,反应后,
小华想测定Cu—Zn合金及Cu—Ag合金中铜的质量分数,取32.5g合金粉末与足量稀盐酸反应,反应后,
烧杯内总质量减少了0.4g,求合金中铜的质量分数 rhondda271年前1
rhondda271年前1 -
 爱上魔发师R吻 共回答了14个问题
爱上魔发师R吻 共回答了14个问题 |采纳率85.7%设:合金中锌的质量为x Zn+2HCl=ZnCl2+H2↑
65 2
x 0.4g
65 / x = 2/0.4g
x=13g
合金中铜的质量为:32.5g-13g=19.5g
合金中铜的质量分数= 19.5g/32.5g×100%=60%
答:合金中铜的质量分数为60%.
∵Cu的活动性比H弱,不与HCl(稀)发生反应,Zn的活动性比H强,能与HCl发生反应,
∴Cu—Zn合金能测定出Cu的质量分数;
∵Ag的活动性比H弱,也不与HCl发生反应,
∴Cu—Ag合金不能测定出铜的质量分数;1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. 纸翅膀1年前1
纸翅膀1年前1 -
 futuantuan 共回答了17个问题
futuantuan 共回答了17个问题 |采纳率88.2%解题思路:(1)由于铜与稀硫酸不反应,故铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应,可直接写出反应方程式;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(4)根据(3)中化学方程式的比例关系,求出溶质的质量,及溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)Zn+H2SO4→ZnSO4+H2↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4→ZnSO4+H2↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5/10]×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究.请完成下列探究报告.
某化学课外研究小组拟对一种焰火原料(由两种短周期中的常见金属元素的单质组成的合金粉末)进行探究.请完成下列探究报告.
探究目的:探究该焰火原料的组成
资料检索:
①Mg 2+ 检验的方法:取2滴待检液,加入2滴2mol•L -1 NaOH溶液,再加入2滴镁试剂(I)染料(对硝基苯偶氮苯二酚).若出现沉淀并吸附镁试剂(I)染料呈天蓝色,表示待测液中含有Mg 2+ .(注:Ag + 、Cu 2+ 、Fe 3+ 、NH 4 + 会妨碍Mg 2+ 的检测)
②Mg(OH) 2 可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液.
③很多合金是金属互化物,有确定的化学组成.
探究思路:①确定该焰火原料所含金属种类;②测定该火焰原料的化学式.
实验探究:(1)甲同学进行了初步实验,实验步骤和实验现象如下.请填写下表
(2)乙同学取甲同学第②组实验所得的溶液,加入2滴NaOH溶液及镁试剂(I)染料,未见天蓝色物质.他得出合金中不含镁的结论.乙同学的结论______,(选填“正确”或“错误”)你的理由是______.试验序号 实验步骤 实验现象 结论 ① 取少量该焰火原料,
加入冷水无明显现象 ______ ② 取少量该焰火原料,
加入足量稀盐酸完全溶解,有大量气体
产生、溶液呈无色______
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下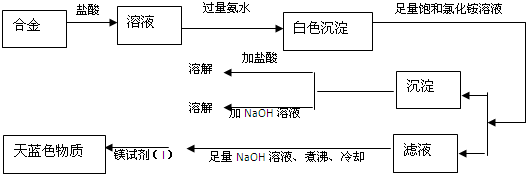
由丙同学的实验记录可知该焰火原料是由______和______两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是______.
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成.
问题讨论:
①能确定合金组成的数据组有______(填写选项字母).
A.m、nB.m、yC.n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol.试在右图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为______. pcimhoxrv1年前1
pcimhoxrv1年前1 -
 adaguo 共回答了22个问题
adaguo 共回答了22个问题 |采纳率95.5%(1)①原料加入冷水无现象表明不含Li、Na等活泼金属;
②原料与盐酸反应产生气体表明含有能与盐酸反应的较活泼的金属;
故答案为:①合金中不含Li、Na等活泼金属;②含有能与盐酸反应的较活泼的金属;
(2)第②组实验所得的溶液含有过量盐酸,加入2滴NaOH溶液则不会产生沉淀,从而不能吸附镁试剂(I)染料呈天蓝色,
故答案为:错误;若稀盐酸过量,则不产生沉淀,就不能吸附镁试剂(I)染料,检验不出Mg 2+ ;
(3)由图结合题意知该合金含镁、铝(不溶于足量饱和氯化铵溶液的白色沉淀既能溶液盐酸又能溶液氢氧化钠),由于Mg(OH) 2 可溶于浓的氯化铵溶液,因此用镁试剂(Ⅰ)染料检验Mg 2+ 时要排除NH 4 + 的干扰,所以滤液加入足量氢氧化钠溶液将NH 4 + 转化为NH 3 ,煮沸将氨气赶出,
故答案为:Mg和Al;将NH 4 + 转化为NH 3 ,煮沸促进氨气逸出,防止NH 4 + 干扰Mg 2+ 的检验(或排除溶液中NH 4 + 的干扰);
(4)①镁和铝都能与盐酸反应生成氢气,根据氢气的体积结合合金总质量可确定合金的组成,加入过量氢氧化钠得到的沉淀为氢氧化镁,灼烧后可得到氧化镁,根据氧化镁的质量可知镁的质量,则可知铝的质量,已知镁的质量和镁铝生成氢气的体积可知铝的质量,则A、B、C都可测定合金的组成,
故答案为:A、B、C;
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,相对分子质量较小的为镁,如x=0,则全被为铝,7mol铝反应生成10.5mol氢气,如全被为镁,即x=7,则生成氢气7mol,则图象为 ,
,
故答案为: ;
;
③③当y=8.5mol时,该合金是一种金属互化物,设合金中Mg为m mol,Al为n mol,则
m+n=7
m+1.5n=8.5 ,解得m=4,n=3,
则化学式为Mg 4 Al 3 ,
故答案为:Mg 4 Al 3 .1年前查看全部
- (要详解的)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,
 liling06221年前1
liling06221年前1 -
 gaozhenhu 共回答了15个问题
gaozhenhu 共回答了15个问题 |采纳率86.7%为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:x0d第一次 第二次 第三次x0d所取合金的质量/克 10 10 20x0d所用稀硫酸的质量/克 50 80 50x0d生成氢气的质量/克 0.2 0.2 0.2x0d(1)试计算10克铜锌合金中锌的质量.x0d(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为_____时,表明合金中的锌与稀硫酸恰好完全反应.x0d(3)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,化学懂的来,没分了,呜呜
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,化学懂的来,没分了,呜呜
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
第一次 第二次 第三次
所取合金的质量/克 25 25 50
所用稀硫酸的质量/克 120 160 100
生成氢气的质量/克 0.4 0.4 0.4
从上表数据分析,当所取合金与所用稀硫酸的质量比为_____时,表明合金中的锌与稀硫酸恰好完全反应.
我真得好难理解呀,答案是1比4,第一次和第二次比较,我能看出来,第二次的硫酸过量,第一次的锌被完全反应,就是第一次和第三次很难看出来.太抽象了,请讲得形象点, Zusanisha1年前1
Zusanisha1年前1 -
 段君顺 共回答了16个问题
段君顺 共回答了16个问题 |采纳率68.8%前两次对比,说明25克合金最多能生成0.4克气体
以此来推,说明50克合金最多能生成0.8克气体
第三次生成了0.4克
说明只是恰好反应了一半
假如全都反应了
就应该再来一倍的硫酸
应该来200克
所以质量比是1:41年前查看全部
- 有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为6
有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为69.8g 1、求产生氢气的质量 2、求该合金中铜的质量分数3、稀硫酸中、溶质的质量分数
 liu_che1年前1
liu_che1年前1 -
 贰天 共回答了14个问题
贰天 共回答了14个问题 |采纳率92.9%氢气0.2g
铜67.5%
硫酸19.6%1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下:
第一次 第二次 第三次
所取合金的质量/g 10 10 20
所用稀硫酸的质量/g 60 80 50
生成氢气的质量 0.2 0.2 0.2
所取合金与稀硫酸的质量比是______时,合金中的锌与稀硫酸中的硫酸恰好完全反应.
计算该铜锌合金中的铜的质量分数.
计算稀硫酸的浓度与配制后溶液溶剂的质量分数. 我爱荷塘1年前1
我爱荷塘1年前1 -
 云中燕99 共回答了18个问题
云中燕99 共回答了18个问题 |采纳率88.9%从三次实验中可以看出第一第二次酸过量,第三次合金过量,以第一次反应计算铜不会与稀硫酸反应释放出氢气,而锌会,那么 Zn + H2SO4 ---- ZnSO4 + H2 65.4 98 2 x y 0.2 ...1年前查看全部
- (2014•泰安)兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸
(2014•泰安)兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160g中,二者恰好完全反应.同时为了充分利用资源,还对反应后的物质进行回收处理.请结合下列图式计算:

(1)该合金样品中含铁的质量分数;(计算结果精确至0.1%)
(2)所得固体铜的质量a为多少克?
(3)向不饱和滤液中加入多少克水,能得到5%的硫酸亚铁溶液,用于缺铁花卉的营养液.((2)(3)中计算结果精确至0.1g) 布布子1年前1
布布子1年前1 -
 edenking 共回答了22个问题
edenking 共回答了22个问题 |采纳率90.9%解题思路:(1)根据硫酸铜的质量求出参加反应铁的质量从而求出铁的质量分数进行解答;
(2)根据铁与硫酸铜的方程式计算出生成的铜再加上样品中的铜就是a的值进行解答;
(3)计算出所得溶液的溶质质量分数,根据稀释溶液时溶质质量不变解答.(1)设:样品中铁的质量为x,生成铜的质量为y,生成硫酸亚铁的质量为z.
硫酸的质量=160g×10%=16g
Fe+CuSO4 =FeSO4 +Cu
56 160 152 64
x16g zy
[56/x=
160
16g],[160/16g=
64
y],[160/16g=
152
z]
x=5.6g,y=6.4g,z=15.2g
(1)该合金样品中含铁的质量分数:
5.6g
6g×100%=93.3%;
(2)所得固体铜的质量a为:6.4g+(6g-5.6g)=6.8g;
(3)设,得到5%的硫酸亚铁溶液,需向不饱和滤液中加入水的质量为m,
15.2g
5.6g+160g−6.4g+m×100%=5%
m=144.8g
答:(1)该合金样品中含铁的质量分数93.3%,
(2)所得固体铜的质量a为6.8g,
(3)得到5%的硫酸亚铁溶液,需向不饱和滤液中加入水的质量为144.8g.点评:
本题考点: 根据化学反应方程式的计算;用水稀释改变浓度的方法.
考点点评: 掌握化学方程式的计算格式和规范性,本题的难点是(3)的计算,一定要考虑杂质的质量.1年前查看全部
- 为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)写出有关反应的化学方程式;第一次 第二次 第三次 所取合金的质量/g 10 10 20 所用稀硫酸的质量/g 50 80 50 生成氢气的质量/g 0.2 0.2 0.2
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为______时,表明合金中的锌与稀硫酸恰好完全反应.(提示:铜与稀硫酸不反应)
(3)试计算该铜锌合金中锌的质量分数.
(4)计算当所用合金与稀硫酸恰好完全反应时,所得溶液中溶质的质量分数. celine_chen1年前1
celine_chen1年前1 -
 _raojc0bso5a8_0_ 共回答了20个问题
_raojc0bso5a8_0_ 共回答了20个问题 |采纳率90%解题思路:(1)由于铜与稀硫酸不反应,故铜锌合金与稀硫酸的反应,为锌与稀硫酸的反应,可直接写出反应方程式;
(2)从三次实验数据可知,第一、第二次反应中稀硫酸过量,第三次反应中锌过量,又因为第三次反应中硫酸产生的氢气恰好为0.2g,所以第一次反应中合金中的锌与稀硫酸恰好完全反应,从而得出它们的质量比.
(3)根据第一次实验产生氢气的质量和其所取用的稀硫酸与合金样品的质量,可求出合金中锌的质量;
(4)根据(3)中化学方程式的比例关系,求出溶质的质量,及溶液的总量,代入公式可以求出恰好完全反应后所得溶液中溶质的质量分数.(1)Zn+H2SO4→ZnSO4+H2↑;
(2)由于合金中的锌与稀硫酸恰好完全反应所取合金与所用稀硫酸分别为10g,50g,故其质量比为1:5;
故答案为:1:5.
(3)设合金中锌的质量为x,生成硫酸锌质量为y.
Zn+H2SO4→ZnSO4+H2↑
65 161 2
xy 0.2g
∴x:65=0.2g:2,
解之得:x=6.5g,
该铜锌合金中锌的质量分数为:[6.5/10]×100%=65%;
(4)y:161=0.2g:2,
解之得:y=16.1g,
所得溶液中ZnSO4的质量分数:[16.1g/6.5g+50g−0.2g]×100%=28.6%.
答:(3)该铜锌合金中锌的质量分数为65%;
(4)所得溶液中ZnSO4的质量分数为28.6%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;酸的化学性质.
考点点评: 本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.1年前查看全部
- 将10.2克的Mg.Al合金粉末溶于500ml...
将10.2克的Mg.Al合金粉末溶于500ml...
将10.2克的Mg.Al合金粉末溶于500ml,4mol/L盐酸中,所得溶液中加入8mol/L的KOH溶液,要使得溶液中的沉淀量达到最大,侧应加入8mol/L的KOH溶液多少ml charleshe1年前1
charleshe1年前1 -
 zhanghong555 共回答了18个问题
zhanghong555 共回答了18个问题 |采纳率88.9%溶于盐酸变成氯化物
再加KOH溶液,当加入的Cl-和OH-的物质的量相等的时候,沉淀最多
500*4=V*8
V就是250ml
不用担心盐酸过量,过量的氢离子要被氢氧根中和后再发生生成沉淀的反应1年前查看全部
- 有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为6
有黄金cu-zn合金,和cu-Ag合金,取合金粉末是20克放烧杯中,架50克稀硫酸恰好完全反应,测烧杯中剩余物的质量为69.8g 1、求产生氢气的质量 2、求该合金中铜的质量分数3、稀硫酸中、溶质的质量分数
 jokey_adam1年前1
jokey_adam1年前1 -
 一人听风 共回答了18个问题
一人听风 共回答了18个问题 |采纳率83.3%首先,质量守恒,氢气质量=20g+50g-69.8g-0.2g
Zn + H2SO4 = ZnSO4 + H2
65 98 2
x y 0.2g
65/x=98/y=2/0.2g
x=6.5g
y=9.8g
所以 1.氢气的质量0.2g
2.求该合金中铜的质量分数67.5%
3.稀硫酸中溶质的质量分数19.6%1年前查看全部
大家在问
- 1甲乙两个商店以同样的定价出售一种饮料,为了促销,甲店按原价的75%出售,乙店买四送一,
- 2将二次函数y=ax的平方+bx+c可化成y=a(x-h)的平方+k的形式 y=ax的平方+bx+c=
- 3我的父母为我而骄傲用英语怎么说2种
- 4句型转换Mike is good for your health.(改为一般疑问句,并做肯定和否定回答)
- 5我想用一块手机电池一个LED灯珠做一个灯,需要串电阻吗?
- 6一个400米跑道的运动场,共8个跑道,每条宽1.2米,操场最外圈跑道长多少米?
- 7李白的送友人,诗中将什么比作孤蓬,为什么这样比喻?诗中写斑马萧萧长鸣的作用是什么?挥手自兹去的去是什么意思.
- 8什么是本初子午线和赤道
- 9金鱼在水中吐出的气泡,上升过程中为什么从小变大
- 10以My favorite teacher 写一篇作文
- 11已知a属于[-π\3,π\4],求函数y=tan^2(a)+2tana+3的最值,并求出相应的a值
- 12She can't understand people who talked f______.麻烦各位哥哥填上,
- 13甲乙两人各掷一次骰子,所得点数为x,y.求x
- 14根据具以及首字母提示完成单词 .3ke you
- 15七年级某班同学准备从学校出发,去烈士公园参加秋游活动.出发前,他们在比例尺为1:100000的地图上量出两地距离是5厘米






