1吨煤 含硫量是6%,需要配多少生石灰脱硫?
 luyixuelai9992022-10-04 11:39:541条回答
luyixuelai9992022-10-04 11:39:541条回答1吨煤 含硫量是6%,需要配多少石粉脱硫?

已提交,审核后显示!提交回复
共1条回复
 一头祥云 共回答了23个问题
一头祥云 共回答了23个问题 |采纳率87%- 含硫元素质量60千克 一摩尔氧化钙 能固定一摩尔硫原子 所以需要氧化钙质量:60/32*56等于105千克.
- 1年前
相关推荐
- 用含硫量较高的生铁来炼钢时,应采取的措施是( )
用含硫量较高的生铁来炼钢时,应采取的措施是( )
A.使用较多的生石灰
B.加入较多的焦炭
C.加入较多的硅铁
D.掺入含磷较高的废钢 左右两个蛋1年前1
左右两个蛋1年前1 -
 郝明1 共回答了17个问题
郝明1 共回答了17个问题 |采纳率88.2%解题思路:根据炼钢的目的及加入各物质的作用分析.炼钢的目的是降低生铁中碳的含量,除去P、S等有害元素,调整硅、锰、铬等合金元素的含量.
A、加入较多的生石灰是为了除硫,FeS+CaO
高温
.
CaS+FeO,故A正确.
B、加入较多的焦炭与炼钢的目的相违背,故B错误.
C、加硅的目的是脱氧,2FeO+Si
高温
.
2Fe+SiO2故C错误.
D、掺入含磷较高的废钢与炼钢的目的相违背,故D错误.
故选A.点评:
本题考点: 二氧化硫的污染及治理.
考点点评: 本题考查了炼钢时除硫剂的选择,根据元素的性质选择相应的试剂,运用化学知识解决生产生活实际问题,让化学知识为生产生活服务.1年前查看全部
- 快到碗里来,秸秆是一种相对清洁的可再生能源,平均含硫量只有千分之三点八,而煤的平均含硫量约为百分之一.某地燃烧秸秆的发电
快到碗里来,
秸秆是一种相对清洁的可再生能源,平均含硫量只有千分之三点八,而煤的平均含硫量约为百分之一.某地燃烧秸秆的发电厂一年燃烧秸秆约2.0乘100000t,可节约煤1.0乘100000t.假设燃料中的硫元素经燃烧后全部转化为二氧化硫,该发电厂燃烧秸秆比烧煤每年少排放二氧化硫多少吨? 风雨断肠13141年前1
风雨断肠13141年前1 -
 欧阳88 共回答了12个问题
欧阳88 共回答了12个问题 |采纳率91.7%(100000x2x0.0038-100000x0.01)x64除以32
(秸秆的硫量-煤的硫量)除以硫的相对分子质量x二氧化硫的相对分子质量1年前查看全部
- 某锅炉燃煤量100t/h,煤含硫量1%,硫进入灰渣中的比例为20%,烟气脱硫设施的效率为80%,排入大气中的SO2量?
某锅炉燃煤量100t/h,煤含硫量1%,硫进入灰渣中的比例为20%,烟气脱硫设施的效率为80%,排入大气中的SO2量?
怎么求的写下, 萧萧蠢材1年前1
萧萧蠢材1年前1 -
 悠悠小笨熊 共回答了18个问题
悠悠小笨熊 共回答了18个问题 |采纳率83.3%开始我也不明白为什么要×2,刚才我查了元素周期表氧是8,硫是16.1个S的质量=2个O的质量.我们算出的时S,所以SO2的质量就应该=2个S的质量,因此要×2.祝我们都能考试通过!1年前查看全部
- 酸雨在重庆地区经常出现,主要是使用含硫量高的煤及汽车尾气产生有害气体SO2等造成的.二氧化硫有很强的氧化性,可以使高锰酸
酸雨在重庆地区经常出现,主要是使用含硫量高的煤及汽车尾气产生有害气体SO2等造成的.二氧化硫有很强的氧化性,可以使高锰酸钾溶液腿色,该反应方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X.则X的化学式为( )
A.H2SO3
B.H2SO4
C.H2S
D.H2O2 qiaomingbo21年前1
qiaomingbo21年前1 -
 心有玲惜 共回答了12个问题
心有玲惜 共回答了12个问题 |采纳率66.7%解题思路:根据质量守恒定律进行分析,化学反应前后元素的种类和原子的个数不变可解答此题;5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X,反应前含有5个硫原子,2个钾原子,2个锰原子,4个氢原子,20个氧原子,反应后已有2个钾原子,2个锰原子,3个硫原子,12个氧原子,故2X中含有4个氢原子,2个硫原子和8个氧原子,故X中含有2个氢原子、1个硫原子和4个氧原子,故X为硫酸;
故选B点评:
本题考点: 质量守恒定律及其应用.
考点点评: 根据反应的化学方程式,利用反应前后原子的种类和原子不变的原则,可对反应中某一未知物质的组成或分子的构成进行推断.1年前查看全部
- 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【实验目的】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),请完成该反应的离子方程式:
()SO 2 +( )MnO 4 — +( ) =( ) +( )Mn 2+ +( )
根据上述资料,甲同学和丙同学分别设计实验方案进行探究。
【实验探究】甲同学:甲同学进行了如下图所示A、B两步实验:
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(2)乙同学认为甲的方案不合理,其理由是:
【实验探究】丙同学:丙同学进行了如下图所示实验(部分装置在图中略去):
(3)上图C装置的作用是
(4)证明煤中含有碳元素和硫元素的现象是:
(5)装置C中的高锰酸钾溶液也可以替换为
A.足量I 2 的淀粉溶液 B.足量饱和NaHCO 3 溶液 C.足量Na 2 SO 3 溶液 D.足量溴水 aifei8141年前1
aifei8141年前1 -
 3557989 共回答了22个问题
3557989 共回答了22个问题 |采纳率81.8%(1)( 5 )SO 2 +( 2 )MnO 4 — +( 2 ) H 2 O =( 5 ) SO 4 2- +( 2 )Mn 2+ +( 4 ) H +
(2)SO 2 也能使澄清石灰水变浑浊,不能证明煤中含有碳元素
(3)除去SO 2 并检验其是否除尽
(4)B中褪色, C中不褪色, D中变浑浊
(5)A D
1年前查看全部
- 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO 2 +2KMnO 4 +2H 2 O=K 2 SO 4 +2MnSO 4 +2X ”。这个化学方程式中最后一种物质X的化学式是:______。
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】甲同学: “实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(3)乙同学认为甲同学的实验方案不合理,其理由是:_________________。
丙同学: “实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(4)上图C装置的作用是_______________。
(5)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中________________。 llllllc1年前1
llllllc1年前1 -
 dx26030 共回答了19个问题
dx26030 共回答了19个问题 |采纳率100%(1)H 2 SO 4
(2)SO 2 +Ca(OH) 2 =CaSO 3 ↓+H 2 O
(3)二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素
(4)除去过多的二氧化硫或排除二氧化硫的干扰
(5)B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊1年前查看全部
- (2011•湛江)近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气
(2011•湛江)近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的,此外,各种机动车排放的尾气也是形成酸雨的重要原因.
提出问题:通过实验证明煤中含有碳元素和硫元素.
查阅资料:(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X”.这个化学方程式中最后一种物质X的化学式是:______.
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊.”请写出二氧化硫与澄清石灰水反应的化学方程式:______.
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究.
实验探究:(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(4)乙同学认为甲同学的实验方案不合理,其理由是:______.
(5)丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
探究与结论:(6)上图C装置的作用是______.
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中______. 废话就是多1年前1
废话就是多1年前1 -
 snjrh 共回答了19个问题
snjrh 共回答了19个问题 |采纳率78.9%解题思路:(1)根据质量守恒定律考虑;
(2)根据方程式的写法考虑;
(4)根据二氧化硫的特点考虑;
(6)根据高锰酸钾溶液的特点考虑;
(7)先验证二氧化硫再除去二氧化硫再验证二氧化碳.(1)根据反应前后各原子种类和数目不变做题;
(2)由二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,说明二氧化硫与澄清石灰水反应有沉淀生成,再写方程式即可;
(4)由于二氧化硫也能使石灰水变浑浊,所以不能判断含有碳元素;
(6)主要是验证二氧化硫是否被除尽;
(7)先通过使高锰酸钾溶液褪色证明有二氧化硫,再除去二氧化硫,再验证二氧化碳即可.
故答案为:(1)H2SO4
(2)SO2+Ca(OH)2=CaSO3↓+H2O
(4)二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素.
(6)除去过多的二氧化硫或排除二氧化硫的干扰.
(7)B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊.点评:
本题考点: 酸雨的产生、危害及防治;有关化学式的计算和推断;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道了根据质量守恒定律计算化学式的方法(利用反应前后原子个数不变),还弄懂了二氧化硫与二氧化碳的检验方法.二氧化硫用高锰酸钾溶液来检验,二氧化碳用石灰水检验.1年前查看全部
- 某人用重量法测定某药物中的含硫量,称取此样0.520克,最后计算出此药物中含硫量为0.520克,最
某人用重量法测定某药物中的含硫量,称取此样0.520克,最后计算出此药物中含硫量为0.520克,最
某人用重量法测定某药物中的含硫量,称取此样0.520克,最后计算出此药物中含硫量为0.520克,最后计算出此药物含硫量为0.063%,你认为是否合理?为什么? menghoang1年前2
menghoang1年前2 -
 A20011973 共回答了22个问题
A20011973 共回答了22个问题 |采纳率86.4%不合理
因为重量分析法是常量分析法的一种,常量分析的标准是样品中至少有1%的待测组分
而题中说仅为0.063%,显然这个数值根本就不能用重量分析法测定,或者测出来也是不准确的
需要用其他的,测定微量组分的分析方法,来重新进行测定
固体样品中待测组分>1%的称为常量组分,0.01%-1%的称为微量组分,1年前查看全部
- 近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
【提出问题】煤中是否含有碳元素和硫元素.
【查阅资料】①二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO 2 +2KMnO 4 +2H 2 O=K 2 SO 4 +2MnSO 4 +2X,其中X的化学式是:______.
②二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应的化学方程式为:SO 2 +Ca(OH) 2 =CaSO 3 ↓+H 2 O.
根据上述资料,甲、乙同学进行了如下实验探究.
【实验探究】甲同学进行了如下图所示A、B两步实验:
实验现象为 A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.由此甲同学认为:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.乙同学认为甲同学的方案不合理,于是进行了如下图所示实验(夹持装置略去):
【结论与反思】(1)乙同学认为甲同学的实验方案不合理,其理由是:______.
(2)上图C装置的作用是______.
(3)要证明煤中含有碳元素和硫元素的现象是:乙同学的实验中______. ks_凌燕1年前1
ks_凌燕1年前1 -
 skypilot 共回答了17个问题
skypilot 共回答了17个问题 |采纳率94.1%【查阅资料】①根据质量守恒定律可以判断X是硫酸,即H 2 SO 4 ,故答案为:H 2 SO 4
【结论与反思】(1)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,因此甲同学的实验方案不合理,故答案为:二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素
(2)C装置的作用是把二氧化硫全部吸收,避免产生干扰,故答案为:除去过多的二氧化硫或排除二氧化硫的干扰
(3)乙的实验方案中,只要B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊,就证明煤中含有碳元素和硫元素.故答案为:B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊1年前查看全部
- 已知某种煤的含硫量的百分之一质量分数进行煤的脱硫处理时1t煤中至少应加入多少千克石灰石,反应后可得硫酸钙多少千克
 63504513yu1年前1
63504513yu1年前1 -
 182斯文帅哥 共回答了16个问题
182斯文帅哥 共回答了16个问题 |采纳率75%S +O2= SO2
32 64
1000KG*1% X=2000KG
2SO2+O2= 2SO3
128 160
2000KG Q=2500KG
SO3+ CA(OH)2= CASO4+ H2O
80 74 136
2500KG X=2312.5KG Y=4250KG
CACO3= CAO+CO2
100 56
W=3125KG 1750KG
CAO+H2O= CA(OH)2
56 74
Z=1750KG 2312.5KG
已知某种煤的含硫量的百分之一质量分数进行煤的脱硫处理时1t煤中至少应加入3125千克石灰石caco3,反应后可得硫酸钙4250千克1年前查看全部
- 某工厂每日燃煤1000吨,煤中含硫量为1%,约有10%的硫转入炉渣中,该工厂每日可向大气中排放SO2( 18t ).
某工厂每日燃煤1000吨,煤中含硫量为1%,约有10%的硫转入炉渣中,该工厂每日可向大气中排放SO2( 18t ).
为什么不选9t? 耳沉厂1年前1
耳沉厂1年前1 -
 2006忘了吧 共回答了15个问题
2006忘了吧 共回答了15个问题 |采纳率86.7%1000×1%×90%×64/32=18t1年前查看全部
- 煤中含有硫可以采用石灰石脱硫法进行处理,写出有关反应的方程式.已知某种煤的含硫量为1%,在进行脱硫处理时100t的煤中需
煤中含有硫可以采用石灰石脱硫法进行处理,写出有关反应的方程式.已知某种煤的含硫量为1%,在进行脱硫处理时100t的煤中需要加入多少吨的石灰石?反应可得硫酸钙多少吨?
 沧浪之水清兮1年前3
沧浪之水清兮1年前3 -
 mmmm_zzzz 共回答了21个问题
mmmm_zzzz 共回答了21个问题 |采纳率81%解题思路:向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,反应方程式为2CaCO3+O2+2SO2
2CaSO4+2CO2,根据关系式S~SO2~CaCO3~2CaSO4计算.高温 .向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4,反应方程式为2CaCO3+O2+2SO2
高温
.
2CaSO4+2CO2,
令需要加入x吨的石灰石,反应可得硫酸钙y吨,则:
S~SO2~CaCO3~CaSO4计算.
32 100 136
100 t×1% x ty t
所以32:100=100t×1%:xt,解得x=3.125,
32:136=100 t×1%:y t,解得y=4.25,
答:方程式为2CaCO3+O2+2SO2
高温
.
2CaSO4+2CO2,需要加入3.125吨的石灰石,反应可得硫酸钙4.25吨.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式的计算,难度不大,书写方程式是关键,注意根据关系式计算的计算.1年前查看全部
- (2012•沙洋县模拟)近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
(2012•沙洋县模拟)近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
【提出问题】煤中是否含有碳元素和硫元素.≠
【查阅资料】①二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X,其中X的化学式是:______.
②二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应的化学方程式为:SO2+Ca(OH)2=CaSO3↓+H2O.
根据上述资料,甲、乙同学进行了如下实验探究.
【实验探究】甲同学进行了如下图所示A、B两步实验: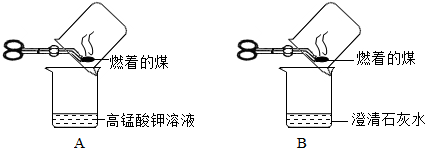
实验现象为 A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.由此甲同学认为:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.乙同学认为甲同学的方案不合理,于是进行了如下图所示实验(夹持装置略去):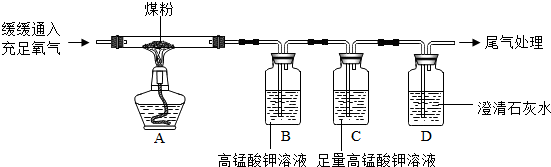
【结论与反思】(1)乙同学认为甲同学的实验方案不合理,其理由是:______.
(2)上图C装置的作用是______.
(3)要证明煤中含有碳元素和硫元素的现象是:乙同学的实验中______. cherjin1年前1
cherjin1年前1 -
 ill_apple 共回答了20个问题
ill_apple 共回答了20个问题 |采纳率100%解题思路:根据质量守恒定律可以判断物质的化学式;根据题目信息可知:二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,因此甲同学的实验方案不合理;C装置的作用是把二氧化硫全部吸收,避免产生干扰;只要B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊,就证明煤中含有碳元素和硫元素.【查阅资料】①根据质量守恒定律可以判断X是硫酸,即H2SO4 ,故答案为:H2SO4
【结论与反思】(1)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,因此甲同学的实验方案不合理,故答案为:二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素
(2)C装置的作用是把二氧化硫全部吸收,避免产生干扰,故答案为:除去过多的二氧化硫或排除二氧化硫的干扰
(3)乙的实验方案中,只要B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊,就证明煤中含有碳元素和硫元素.故答案为:B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;酸雨的产生、危害及防治;质量守恒定律及其应用.
考点点评: 本考点探究了煤炭的组成元素,属于实验探究题,既有实验过程的探究,又有结论的探究.首先提出问题、查阅资料,然后设计实验方案、进行实验,最后得出正确的结论.还考查了学生的实验评价能力,找出实验的不足之处,并加以改进.本考点主要出现在实验题中.1年前查看全部
- 目前一座中等城市每年用媒约300万吨,其含硫量若按1%计算,则每年可排放多少吨so2?如果全...
目前一座中等城市每年用媒约300万吨,其含硫量若按1%计算,则每年可排放多少吨so2?如果全...
目前一座中等城市每年用媒约300万吨,其含硫量若按1%计算,则每年可排放多少吨so2?如果全部用生石灰进行处理,理论上需要多少吨生石灰?
“麻烦详细点” 感激不尽! 小贰黑1年前2
小贰黑1年前2 -
 Littlepeachtao 共回答了18个问题
Littlepeachtao 共回答了18个问题 |采纳率83.3%S+O2点燃=SO2
32 64
3 x
x=6(万吨)
CaO+SO2=CaSO3
56 64
y 6
y=5.25万吨1年前查看全部
- 酸雨是由于含硫物质的大量燃烧引起的,普通煤炭中的含硫量为2%……
酸雨是由于含硫物质的大量燃烧引起的,普通煤炭中的含硫量为2%……
酸雨是由于含硫物质的大量燃烧引起的,普通煤炭中的含硫量为2%,若燃烧4吨煤炭,则产生的二氧化硫有多少?这些二氧化硫用10%的氢氧化钠来吸收,需要10%的氢氧化钠多少千克? phoenix60301年前3
phoenix60301年前3 -
 对付也 共回答了15个问题
对付也 共回答了15个问题 |采纳率100%设生成SO2Xkg需要百分之十的氢氧化钠ykg.
mS=4t×2%=0.08t=80kg
S+O2===SO2↑
32 64
80kg y
x= 160kg
SO2 +H2O+2 NaOH=Na2SO3+2 H2O
64 80
160kg x
x=100kg
100kg÷10%=1000kg
答..1年前查看全部
- 煤炭含硫量约为4%-6%,燃烧时会产生二氧化硫等污染物,为保护环境,下列措施中不能采取的是()
煤炭含硫量约为4%-6%,燃烧时会产生二氧化硫等污染物,为保护环境,下列措施中不能采取的是()
A.高烟囱排放
B.用氨水吸收后排放
C.用烧碱吸收后排放
D.用活性炭吸收后排放.
为什么? daviszhe1年前4
daviszhe1年前4 -
 xjj12345 共回答了22个问题
xjj12345 共回答了22个问题 |采纳率86.4%选A. 因为其它B,C,D三种都进行了脱硫处理,
答案是对的,要给加分奥1年前查看全部
- 煤炭含硫量1点8算什么底硫吗?煤炭含硫量1点8算底硫吗?
 2006年第一个mm1年前1
2006年第一个mm1年前1 -
 sangexiaotian 共回答了15个问题
sangexiaotian 共回答了15个问题 |采纳率93.3%超过1.5的就算高硫1年前查看全部
- 湿法脱硫塔如何设计如何计算脱硫塔的选择直径和高度呢,现在有一个7500m3/h的沼气气量,含硫量为6mg/m3.脱到10
湿法脱硫塔如何设计
如何计算脱硫塔的选择直径和高度呢,现在有一个7500m3/h的沼气气量,含硫量为6mg/m3.脱到100mg/m3各位大大,给一套设备方案的计划好吗,急用.比如说多大的塔,多大的泵,多少的扬程,多大的槽和多少组喷射器. ysx_51年前2
ysx_51年前2 -
 草乙张 共回答了24个问题
草乙张 共回答了24个问题 |采纳率83.3%含硫量是600mg吧,气量不大.好脱.塔径由处理气量和空塔气速决定,泵由循环量决定.楼上的没有做过脱硫吧.
你这个气量我算了算(粗略,吸收压力我不知道,按照常压计算的):塔径2m绰绰有余;塔高16m;160m3/h的泵也就够了.1年前查看全部
- 双碱法脱硫的计算25T循环流化床锅炉日燃煤量 70T 煤的含硫量0.04% 处理烟气量:60000m3/h脱硫装置入口S
双碱法脱硫的计算
25T循环流化床锅炉日燃煤量 70T 煤的含硫量0.04% 处理烟气量:60000m3/h
脱硫装置入口SO2浓度:3.685g/m3
排放SO2浓度:200mg/Nm3 脱硫剂为氢氧化钠 置换为电石渣Ca(OH)含量为 80% (气液比为1)求氢氧化钠一次性加入量和电石渣日消耗量 SchumiLu1年前1
SchumiLu1年前1 -
 feeada 共回答了22个问题
feeada 共回答了22个问题 |采纳率95.5%每小时脱除的SO2量=烟气量*(脱硫入口SO2浓度-排放SO2浓度)
NaOH:SO2=2:1(摩尔比),可换算成质量比
从以上两项可算出每小时所需NaOH质量.
而Ca(OH)2:SO2=1:1(摩尔比),同理可算出Ca(OH)2的用量.
电石渣量=Ca(OH)2量/80%1年前查看全部
- 消除酸雨危害的有效方法是( )A.燃烧含硫量低的煤和石油B.下雨时应对建筑物、户外雕塑等进行有效的保护C.向空中喷洒碱性
消除酸雨危害的有效方法是( )
A.燃烧含硫量低的煤和石油
B.下雨时应对建筑物、户外雕塑等进行有效的保护
C.向空中喷洒碱性物质,中和酸性
D.禁止二氧化硫的排放 wwwwww20021年前1
wwwwww20021年前1 -
 蝶舞雨恋 共回答了20个问题
蝶舞雨恋 共回答了20个问题 |采纳率95%选D,煤里面是含有一定硫的,酸雨危害不只是对建筑物,喷洒碱性物质也太无厘头了1年前查看全部
- 某10t/h锅炉,最大耗煤量为50kg/h,含硫量为1.0%,煤炭引风机风量为200m3/h,烟气排放SO2排放量为?
某10t/h锅炉,最大耗煤量为50kg/h,含硫量为1.0%,煤炭引风机风量为200m3/h,烟气排放SO2排放量为?
答案为222.2mg/s,请问是怎么求出来的呢?
 bioeva1年前1
bioeva1年前1 -
 扬州府才子1 共回答了19个问题
扬州府才子1 共回答了19个问题 |采纳率84.2%不知道这是道现实问题还是考试题目.我只说我的做法,50kg/h的耗煤量,换算单位为mg/s,乘以1.0%,就是S含量,燃烧成SO2,S分子量32,O是16,相当于重量增加1倍.但是我计算出来时277.8mg/s.如果正确答案是222.2,那么可能需要计算当前引风风量相当的负荷率.如果是考试题目,这道题出的不严谨,效率不同、燃烧情况不一样,这点数据也计算不出来.如果是现实问题,那么需要你去查锅炉效率、负荷情况等等,答案也不一定是这个.1年前查看全部
- 煤的含硫量怎么算?一吨煤含多少硫燃烧后生成多少SO2?怎么算?
 为帮主值得1年前2
为帮主值得1年前2 -
 chenyamei 共回答了16个问题
chenyamei 共回答了16个问题 |采纳率100%假设有M吨的煤,其含硫量为x,则这些煤中含有的硫的质量为Mx吨,根据燃烧反应方程式:S+O2=SO2可以知道反应的S和生成的SO2的质量之比为32:64=1:2,所以生成的SO2的质量为2Mx吨
如果已知生成的SO2的量也可以计算出一定质量的煤中含有的S的质量,从而可以很容易的算出煤的含硫量
煤中含硫量的计算公式:煤中含有的硫的质量/煤的总质量1年前查看全部
- 一百吨煤含硫量零点五 脱硫效率百分之六十五请计算二氧化硫排放量
一百吨煤含硫量零点五 脱硫效率百分之六十五请计算二氧化硫排放量
要具体的计算步骤还有公式谢谢了! 别说有意思1年前1
别说有意思1年前1 -
 13_I10 共回答了16个问题
13_I10 共回答了16个问题 |采纳率100%100吨=100000kg
含硫:100000x0.005=500kg
脱硫率65%,则剩余1-65%=35%
即500kgx35%=175kg
S:SO2=32:64
则二氧化硫排放量为:175x63/32=350kg1年前查看全部
- 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成.
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成.
【提出问题】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4+2X”.这个化学方程式中最后一种物质X的化学式是:______.
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊.”请写出二氧化硫与澄清石灰水反应的化学方程式:______.并写出实验室制取二氧化碳的化学方程式:______.
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究.
【实验探究】(3)甲同学:“实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”:A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.
(4)乙同学认为甲同学的实验方案不合理,其理由是:______.
(5)丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是______.
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中______. xavierhere1年前1
xavierhere1年前1 -
 忍者神龟钟 共回答了14个问题
忍者神龟钟 共回答了14个问题 |采纳率92.9%解题思路:(1)反应前后,元素的种类不变,原子的种类、总个数都不变;(2)氢氧化钙和二氧化硫反应生成亚硫酸钙沉淀和水;碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳;(4)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,当澄清石灰水变浑浊时,气体可能是二氧化碳,也可能是二氧化硫,也可能是二氧化碳和二氧化硫的混合物;(6)除去二氧化硫的气体,如果能使澄清石灰水变浑浊,说明该气体是二氧化碳;(7)根据实验设计,可以判断实验现象.(1)根据质量守恒定律可知,每个X中含有2个氢原子、1个硫原子和4个氧原子,是硫酸,化学式是
H2SO4.
故填:H2SO4.
(2)①二氧化硫与澄清石灰水反应的化学方程式为:Ca(OH)2+SO2═CaSO3↓+H2O.
故填:Ca(OH)2+SO2═CaSO3↓+H2O.
②实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石和石灰石的主要成分是碳酸钙,通常情况下,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)甲同学的实验方案不合理,其理由是:二氧化碳和二氧化硫都能使澄清石灰水变浑浊,该实验不能说明煤燃烧产生二氧化碳.
故填:因为二氧化碳和二氧化硫都能使澄清石灰水变浑浊,该实验不能说明煤燃烧产生二氧化碳.
(6)上图C装置的作用是除去二氧化硫,以免影响对二氧化碳的判断.
故填:除去二氧化硫.
(7)实验现象是:B中稀高锰酸钾褪色说明有二氧化硫产生,证明煤中有硫元素,D中澄清石灰水变浑浊说明有二氧化碳产生,证明煤中有碳元素.
故填:B中稀高锰酸钾溶液褪色,D中澄清石灰水变浑浊.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;二氧化碳的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.1年前查看全部
- (1999•杭州)含硫量大的煤炭,燃烧生成的______气体,对大气造成污染.
 黛三1年前1
黛三1年前1 -
 恋上回忆 共回答了18个问题
恋上回忆 共回答了18个问题 |采纳率100%解题思路:根据已有的知识进行分析,硫燃烧能生成二氧化硫,二氧化硫能形成酸雨.硫燃烧生成的二氧化硫对空气具有污染性,所以本题答案为:SO2.
点评:
本题考点: 酸雨的产生、危害及防治.
考点点评: 本题考查了酸雨形成的知识,完成此题,可以依据已有的知识进行.1年前查看全部
- (2012•房山区二模)近几年我国某些城市酸雨污染较为严重,主要原因之一是大量燃烧含硫量高的煤而形成的.
(2012•房山区二模)近几年我国某些城市酸雨污染较为严重,主要原因之一是大量燃烧含硫量高的煤而形成的.
【提出问题】通过实验证明煤中含有碳元素和硫元素.
【查阅资料】
(1)二氧化硫能使高锰酸钾溶液褪色(由紫色变为无色),该反应的化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X,X的化学式为______.
(2)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊.根据上述资料,甲、乙、丙同学分别设计实验方案进行探究.
【实验探究】甲同学进行了如图1所示A、B两步实验:
观察到了A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊的现象,于是他得出了煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素的结论.
乙同学认为甲同学的实验方案不合理,理由是______.
丙同学进行了如图2所示实验(部分装置在图中略去):
【解释与结论】上图C装置的作用是______.丙同学通过______的现象,得出了煤中含有碳元素和硫元素的结论. rr石头1年前1
rr石头1年前1 -
 laolang3 共回答了25个问题
laolang3 共回答了25个问题 |采纳率92%解题思路:本题以实验探究的形式,检验煤的碳元素和硫元素,需要我们知道质量守恒定律;会书写化学反应式;了解试验装置的合理性;会分析各种试验现象.(1)5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X,反应前含有5个硫原子,2个钾原子,2个锰原子,4个氢原子,20个氧原子,反应后已有2个钾原子,2个锰原子,3个硫原子,12个氧原子,故2X中含有4个氢原子,2个硫原子和8个氧原子,故X中含有2个氢原子、1个硫原子和4个氧原子,故X为H2SO4;
【实验探究】据资料知,A试验中的稀高锰酸钾溶液褪色,说明煤中含硫元素.B试验中的澄清石灰水变浑浊,说明煤中可能含有碳元素也可能含有硫元素.故不合理.
故答案为:因为二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素
【解释与结论】浓高锰酸钾溶液可与二氧化硫反应除去二氧化硫,故C装置的作用是:除去过多的二氧化硫或排除二氧化硫的干扰
B中的溶液褪色,说明煤燃烧生成了二氧化硫,C中的溶液不褪色说明二氧化硫与B中的高锰酸钾完全反应,D中澄清的石灰水变浑浊,说明煤燃烧生成了二氧化碳,故可得出煤中含有碳元素和硫元素的结论
故答案为:【查阅资料】(1)H2SO4;【实验探究】二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素;
【解释与结论】除去过多的二氧化硫或排除二氧化硫的干扰;B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊;点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;常见气体的检验与除杂方法;防治空气污染的措施.
考点点评: 本题以实验探究的形式,检验物质的存在和物质的性质.培养了学生的动手能力和动脑思考的能力.1年前查看全部
- 已知,某燃煤型锅炉燃烧能力为:10t/h,燃烧用煤的含硫量为0.9%,燃烧前经水洗脱硫20%,燃烧后的烟尘经除尘设备脱硫
已知,某燃煤型锅炉燃烧能力为:10t/h,燃烧用煤的含硫量为0.9%,燃烧前经水洗脱硫20%,燃烧后的烟尘经除尘设备脱硫95%.请计算该锅炉SO2的产生量和排放量
 kmxv1年前1
kmxv1年前1 -
 chunjian82 共回答了15个问题
chunjian82 共回答了15个问题 |采纳率86.7%SO2产生量计算公式是:G=1.6×B×S
其中:B—耗煤量
S—硫份
所以你的问题就好计算了.
SO2 产生量: G = 1.6×B×S = 1.6×10×0.9% = 0.144t/h
因为脱硫效率为95%.
所以SO2排放量:
G = 1.6×B×S×(1-95%)= 1.6×10×0.9% ×5% = 0.0072t/h1年前查看全部
- 煤炭含硫量约为4%~6%,燃烧产生SO2等大气污染物,为保持环境,下列措施不能采用的是
煤炭含硫量约为4%~6%,燃烧产生SO2等大气污染物,为保持环境,下列措施不能采用的是
A.高烟囱排放 B.用氨水吸收后排放C.用氢氧化钠吸收后排放D.用活性炭吸收后排放 试分析其主要原因 静语阑珊1年前2
静语阑珊1年前2 -
 宝奕宝 共回答了19个问题
宝奕宝 共回答了19个问题 |采纳率73.7%A.高烟囱排放 不正确,污染环境,不可取
B.用氨水吸收后排放 正确,SO2可以和NH3反应生成亚硫酸铵
C.用氢氧化钠吸收后排放 正确,SO2可以和NaOH反应生成亚硫酸钠
D.用活性炭吸收后排放 试分析其主要原因
正确,活性炭疏松多孔,可以通过物理吸附作用吸附SO21年前查看全部
- 硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
硫铁矿在焙烧后产出的铁渣的含铁量和硫铁矿的含硫量的关系怎么算假设是这个公式:4FeS2+11O2=2Fe2O3+8SO2
如题,硫酸沸腾焙烧里面的, jjzxz6661年前1
jjzxz6661年前1 -
 奔腾的芯 共回答了16个问题
奔腾的芯 共回答了16个问题 |采纳率87.5%该题只能假设硫铁矿中的杂质不含S、Fe元素,且焙烧过程中杂质没有质量损失才可以计算.
设硫铁矿质量分数为X,
那么单位重量硫铁矿中的黄铁矿重量为(64+56)/64*X,杂质重量为1-(64+56)/64*X
黄铁矿经焙烧生成氧化铁的重量为(64+56)/64*X*160*2/(4*(64+56))=1.25X
焙烧后铁渣的总重量为(64+56)/64*X*160*2/(4*(64+56))+1-(64+56)/64*X=1-0.625X
烧渣中铁的重量为1.25X*112/160=0.875X
所以:烧渣中铁的品位为0.875X/(1-0.625X)1年前查看全部
- 近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化
学方程式为:5SO 2 + 2KMnO 4 + 2H 2 O = K 2 SO 4 + 2MnSO 4 + 2 X ”。这个化学方程式中
最后一种物质X的化学式是: 。
(2)“二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊。”请写出二氧化硫与澄清石灰水反应的化学方程式: 。并写出实验室制取二氧化碳的化学方程式: 。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】(3)甲同学:“实验操作”:甲同学进行了如下图所示A、B两步实验:
“实验现象”: A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是: 。
(5)丙同学:
“实验操作”:丙同学进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是 。
(7)要证明煤中含有碳元素和硫元素的现象是:丙同学的实验中 。 缺憾是有的1年前1
缺憾是有的1年前1 -
 一剑雕舟 共回答了9个问题
一剑雕舟 共回答了9个问题 |采纳率77.8%(1)H 2 SO 4
(2)①Ca(OH) 2 +SO 2 =CaSO 3 ↓+ H 2 O ;
②CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2 ↑ 。
(4)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,不能说明问题 。
(6)除去二氧化硫 ;
(7)B中稀高锰酸钾褪色说明有二氧化硫,证明煤中有硫元素,D中澄清石灰水变浑浊说明有二氧化碳,证明煤中有碳元素 。
1年前查看全部
- 煤炭如何降低挥发份、含硫量?在洗煤的过程中,用何种方式才能降低煤的挥发份和含硫量呢?请全面、具体的讲讲方法和过程,
 ricd1年前1
ricd1年前1 -
 奶奶教教主 共回答了18个问题
奶奶教教主 共回答了18个问题 |采纳率94.4%洗煤的原理是利用比重的不同,把煤炭和矸石分开.所以想洗出低挥发和低硫的煤炭,基本是不现实的.
可以这样,你按照不同方法洗煤,将每种的煤炭分别作下工业分析,然后找出低硫和低挥发的那种,然后这按照那个标准去洗就可以了.
不知道你是用什么方法选煤的.给你个思路,1年前查看全部
- 煤碳中含硫量过高,放石灰会减少硫的含量吗
 cnc91年前2
cnc91年前2 -
 雪凌伊笑 共回答了14个问题
雪凌伊笑 共回答了14个问题 |采纳率92.9%假如你是指燃烧后废气中硫含量,就可以
生石灰:2CaO+2SO2+O2=2CaSO4
熟石灰:2CaCO3+2SO2+O2=2CaSO4+2CO21年前查看全部
- 以1kg/s的速率烧煤,已知煤的含硫量为3%,计算每年的so2的排放量.计算时通常假设燃煤有5%的硫最终残留在有5%的灰
以1kg/s的速率烧煤,已知煤的含硫量为3%,计算每年的so2的排放量.计算时通常假设燃煤有5%的硫最终残留在有5%的灰分中!
 今雨rain1年前1
今雨rain1年前1 -
 红苹果蓝彤彤 共回答了20个问题
红苹果蓝彤彤 共回答了20个问题 |采纳率90%煤炭的含硫量是3%,每千克煤含硫1000×3%=300(克),
燃烧后,每一个硫原子和空气中的两个氧原子组成一个二氧化硫分子,硫原子量是32、二氧化硫的分子量是64,因此,煤燃烧1克硫,产生的二氧化硫是:1×(64/32)=2(克).
1克硫经燃烧后有5%残留在灰分中,一年365天,每天24小时,每小时60分钟,每分钟60秒.
因此:
2×(1-5%)×365×24×60×60=59918400(克)=59918.4(千克)=59.9184(吨)1年前查看全部
- 溶解橡胶要用什么溶剂啊因为我有一样东西无法辨认它的成分,初步怀疑是碳或含硫量相当高的橡胶,古想请各位前辈或专家指教,
 玉树宁锋1年前1
玉树宁锋1年前1 -
 hmfish 共回答了22个问题
hmfish 共回答了22个问题 |采纳率90.9%硫化的橡胶在理论上是不可能被溶解的.用红外分光光度计分析一下看看吧1年前查看全部
- 秸杆是一种相对清洁的可再生资源,平均含硫量只有千分之三点八,而煤的平均含硫量约为百分之一.某地燃...
秸杆是一种相对清洁的可再生资源,平均含硫量只有千分之三点八,而煤的平均含硫量约为百分之一.某地燃...
秸杆是一种相对清洁的可再生资源,平均含硫量只有千分之三点八,而煤的平均含硫量约为百分之一.某地燃烧秸杆的发电厂一年燃烧秸杆约是2.0乘10的5次方,可节约煤1.0乘10的5次方.假设燃烧中的硫元素经燃烧后全部转化为SO2,试计算该发电厂燃烧煤每年少排放SO2多少吨? zhaorz20041年前1
zhaorz20041年前1 -
 街道转角 共回答了13个问题
街道转角 共回答了13个问题 |采纳率92.3%1X10*5X(1%-2X0.38%)
=100000X0.24
=24X10*3
因为你题目里没有出现过任何单位,所以我也不知道24吨对不对.1年前查看全部
- 急 某地开采的煤,含碳量64%,含硫量0.2%,燃烧这种煤1吨,生成二氧化碳与二氧化硫多少吨?(以上碳元素、硫元素均可按
急
某地开采的煤,含碳量64%,含硫量0.2%,燃烧这种煤1吨,生成二氧化碳与二氧化硫多少吨?(以上碳元素、硫元素均可按单质计算) goingsure1年前2
goingsure1年前2 -
 weidongzhu 共回答了23个问题
weidongzhu 共回答了23个问题 |采纳率95.7%C +O2= CO2
12 44
64%*1T X=2.346T
S+ O2= SO2
32 64
0.2%*1T X=0.004T
某地开采的煤,含碳量64%,含硫量0.2%,燃烧这种煤1吨,生成二氧化碳2.346吨与二氧化硫0.004吨1年前查看全部
- (2012•沙洋县模拟)近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
(2012•沙洋县模拟)近几年我国某些城市酸雨污染较为严重,主要原因是燃烧含硫量高的煤及机动车排放的尾气.
【提出问题】煤中是否含有碳元素和硫元素.≠
【查阅资料】①二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2X,其中X的化学式是:H2SO4 H2SO4 .
②二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,反应的化学方程式为:SO2+Ca(OH)2=CaSO3↓+H2O.
根据上述资料,甲、乙同学进行了如下实验探究.
【实验探究】甲同学进行了如下图所示A、B两步实验: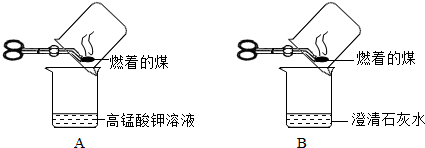
实验现象为 A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊.由此甲同学认为:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素.乙同学认为甲同学的方案不合理,于是进行了如下图所示实验(夹持装置略去):
【结论与反思】(1)乙同学认为甲同学的实验方案不合理,其理由是:二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素.
(2)上图C装置的作用是除去过多的二氧化硫或排除二氧化硫的干扰除去过多的二氧化硫或排除二氧化硫的干扰.
(3)要证明煤中含有碳元素和硫元素的现象是:乙同学的实验中B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊. 伤心的白衣天使1年前1
伤心的白衣天使1年前1 -
 风行冬忍 共回答了17个问题
风行冬忍 共回答了17个问题 |采纳率100%【查阅资料】①根据质量守恒定律可以判断X是硫酸,即H2SO4 ,故答案为:H2SO4
【结论与反思】(1)二氧化硫和二氧化碳一样,也能使澄清石灰水变浑浊,因此甲同学的实验方案不合理,故答案为:二氧化硫也会使澄清石灰水变浑浊,无法证明煤中含有碳元素
(2)C装置的作用是把二氧化硫全部吸收,避免产生干扰,故答案为:除去过多的二氧化硫或排除二氧化硫的干扰
(3)乙的实验方案中,只要B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊,就证明煤中含有碳元素和硫元素.故答案为:B中的溶液褪色,C中的溶液不褪色,D中澄清的石灰水变浑浊1年前查看全部
- 一道化学的有关碳酸钙的计算已知某种煤的含硫量为1%(质量分数),进行煤的脱硫处理时,1t煤种至少应加入多少千克石灰石?反
一道化学的有关碳酸钙的计算
已知某种煤的含硫量为1%(质量分数),进行煤的脱硫处理时,1t煤种至少应加入多少千克石灰石?反应后可得硫酸钙多少千克? cool头1年前1
cool头1年前1 -
 yyy780120 共回答了27个问题
yyy780120 共回答了27个问题 |采纳率92.6%1吨煤中硫的质量=1000*1%=10kg
解得x=31.25kg,y=42.5kg
所以加入的石灰石为31.25千克,得到硫酸钙42.5千克
注意:方程式的反应过程
CaCO3=CaO+CO2
S+O2=SO2
SO2+1/2O2=SO3
CaO+SO3=CaSO41年前查看全部
- 煤:全水11.9 ,干基灰分37.2,干基挥发分24.7,固定碳37.6,含硫量1.2,结焦特征2,高位发热量4558,
煤:全水11.9 ,干基灰分37.2,干基挥发分24.7,固定碳37.6,含硫量1.2,结焦特征2,高位发热量4558,
低位发热量3818cal/g
这是什么煤
希望回答详细 谢谢 般若菠汤1年前6
般若菠汤1年前6 -
 浪子在古城 共回答了24个问题
浪子在古城 共回答了24个问题 |采纳率91.7%缺一些关键指标,如粘结指数G和胶质层最大厚度y.
单从这个指标只能判断是烟煤的一种.具体很难判断.
中低发热量,中高硫.1年前查看全部
- 硫酸 含硫量98% 密度1.84g/mL 体积500mL
硫酸 含硫量98% 密度1.84g/mL 体积500mL
(1)该瓶内含溶质量为多少g
(2)若要配制400g10%的稀硫酸,应取该浓硫酸多少毫升 爱情是游戏1年前2
爱情是游戏1年前2 -
 金牛星 共回答了21个问题
金牛星 共回答了21个问题 |采纳率85.7%(1)1.84*500=9.2g
9.2g*98%=9.016g
(2)400g*10%=40g
40g/1.84g/ml=21.73ml1年前查看全部
- 燃煤烟尘排放量计算项目用煤量600t/a,燃煤含硫量为0.51%.计算二氧化硫的排放量?
 komilll1年前1
komilll1年前1 -
 小蝙蝠 共回答了20个问题
小蝙蝠 共回答了20个问题 |采纳率85%每年600吨煤,含硫量大约600x0.51% = 3.06吨.因为在二氧化硫 SO2中,硫的分子量只占有其一半的量(分子量分别为S = 32;O = 16).所以,二氧化硫的排放量就应该是 3.06吨 x 2 = 6.12 吨.
即,项目每年的二氧化硫排放量,大约是 6.12吨.1年前查看全部
大家在问
- 1我的元旦假期英语作文(100词左右,带翻译)
- 2In the Park 的作文(急啊)
- 3若把连续掷两次骰子分别得到的点数m、n作为点P的坐标,则点P落在圆x 2 +y 2 =25外的概率是( ) A. 7
- 4甲乙两车从相距342km的两地相向行驶,2小时后相遇,已知甲和乙的速度比是4:5,求乙行完全程要多少小时
- 5碘化亚铁溶液中通入过量氯气反应的现象是什么?方程式和例子反应式怎么写?
- 6I'm looking forward to the day holding your little hands and
- 7英语翻译《孟子-梁惠王上-二》贤者而后乐此整句话的翻译为“只有有德行的人才能体会到这种快乐”,那么这句的中后是什么意思,
- 8NH3.H2O与同浓度NH4Cl溶液中哪个NH4+多?
- 9在400米的标准运动场上举行4×100米的接力赛跑,每条跑道的宽度为1.2米,不同跑道上的运动员要经过不同的
- 10山清水秀风光好和绿柳舒眉辞旧岁的下句
- 11小华、小林和小黄三人期末考试数学成绩总和为289分,已知小华比小林多8分,小林比小黄少8分,三个人个的多少分?
- 12作文:通过1件事你明白了1句名言
- 13英语翻译杭州是我国著名的历史文化名城,也是七大古都之一.在元朝时期,杭州成为东南重镇,经济繁荣,风景优美,被意大利旅游家
- 14It is cute cat.改为感叹句。 the cat is!
- 15已知函数f(x)=a-1/lxl 求证:函数y=f(x)在(0,+∞)上是增函数
