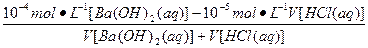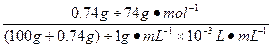水的电离平衡曲线如右图所示,下列说法不正确的是( )
 aa1232022-10-04 11:39:541条回答
aa1232022-10-04 11:39:541条回答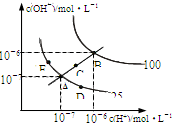 水的电离平衡曲线如右图所示,下列说法不正确的是( )
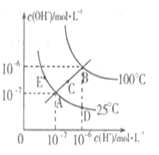
水的电离平衡曲线如右图所示,下列说法不正确的是( )A.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.图中五点KW间的关系:B>C>A=D=E
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性

已提交,审核后显示!提交回复
共1条回复
 arc111 共回答了11个问题
arc111 共回答了11个问题 |采纳率90.9%- 解题思路:A、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.A、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,故A错误;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且E点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故C正确;
D、若处在B点时,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=
10−12
10−10=10-2mol/L,溶液显中性,故D正确.
故选A.点评:
本题考点: 水的电离;物质的量浓度的相关计算.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小. - 1年前
相关推荐
- 水的电离平衡曲线如图所示,下列说法正确的是( )
水的电离平衡曲线如图所示,下列说法正确的是( )
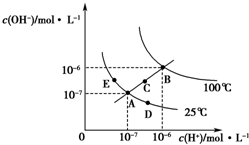
A.图中五点KW间的关系:B=C=A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 种见1年前1
种见1年前1 -
 遗憾今生 共回答了18个问题
遗憾今生 共回答了18个问题 |采纳率88.9%解题思路:A.A、D、E都处于250C时,Kw相等,然后比较B、C、E三点的c(H+)和c(OH-)的大小,依此比较Kw的大小;
B.从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C.从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.A.ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A错误;
B.加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,故C错误;
D.若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol•L-1,等体积混合,恰好中和,溶液显中性,故D错误;
故选B.点评:
本题考点: 水的电离.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
- (4分)设水的电离平衡曲线如图所示:
(4分)设水的电离平衡曲线如图所示:
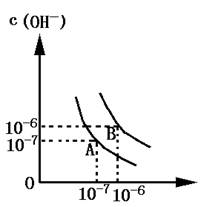
⑴若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 .
⑵将pH=8的Ba(OH) 2 溶液与PH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH) 2 与盐酸的体积比为 gusroom1年前1
gusroom1年前1 -
 灰心1234 共回答了21个问题
灰心1234 共回答了21个问题 |采纳率90.5%⑴10 -14 、10 -12 (2分)⑵ 2:9(2分)
⑴此时水的离子积从10 -14 增加到10 -12
⑵根据酸碱中和反应,溶液PH=7计算,可得Ba(OH) 2 与盐酸的体积比为2:91年前查看全部
- 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题:
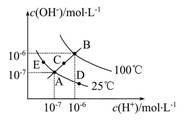
(1)图中五点K w 间的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温b.加入少量的盐酸 c.加入少量的NH 4 Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H 2 SO 4 溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H 2 SO 4 溶液的体积比为 。 sssssddddd1年前1
sssssddddd1年前1 -
 龙城飞雪 共回答了12个问题
龙城飞雪 共回答了12个问题 |采纳率100%(1)B>C>A=D=E (2)b、c (3)10∶1
(1)K w 只与温度有关,温度升高促进水的电离,K w 增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH - )=n(H + ),则V(NaOH)×10 -5 mol/L=V(H 2 SO 4 )×10 -4 mol/L,得V(NaOH)∶V(H 2 SO 4 )=10∶1。1年前查看全部
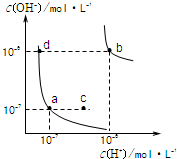
- 水的电离平衡曲线如图所示,下列说法正确的是( )
水的电离平衡曲线如图所示,下列说法正确的是( )
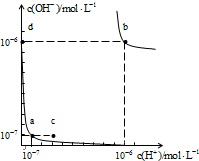
A.图中对应点的温度关系为:a>b
B.水的离子积常数Kw数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从a点变到c点
D.在b点对应的温度下,pH=6的溶液显酸性 小苯象1年前1
小苯象1年前1 -
 orange9934121 共回答了18个问题
orange9934121 共回答了18个问题 |采纳率94.4%解题思路:水的电离是吸热反应,升高温度促进水电离,水的离子积常数=c(H+).c(OH-),根据图片知,a点水的离子积常数=10-7 mol/L×10-7 mol/L=10-14 (mol/L)2,b点时水的离子积常数=10-6mol/L×10-6 mol/L=10-12 (mol/L)2,据此分析解答.A.水的电离是吸热反应,升高温度促进水电离,水的离子积常数=c(H+).c(OH-),根据图片知,a点水的离子积常数=10-7 mol/L×10-7 mol/L=10-14 (mol/L)2,b点时水的离子积常数=10-6mol/L×10-6 mol/L=10-12 (mol/L)2,所以温度a<b,故A错误;
B.a、d点水的离子积常数不变,说明温度相等,a点温度小于b,所以水的离子积常数b>d,故B正确;
C.a、c两点温度不同,其离子积常数不同,温度不变,其离子积常数不变,所以加入少量NaOH不能使溶液从a点变到c点,故C错误;
D.在b点对应的温度下,中性溶液中c(H+)=10-6mol/L,pH=6的溶液显中性,故D错误;
故选B.点评:
本题考点: 离子积常数;水的电离.
考点点评: 本题考查离子积常数,明确离子积常数只与温度有关,与溶液浓度、溶液酸碱性无关,溶液酸碱性要根据溶液中氢离子浓度和氢氧根离子浓度的相对大小判断,不能根据溶液的pH判断,为易错点.1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是
水的电离平衡曲线如图所示,下列说法不正确的是 ( )
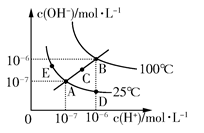
A.图中五点K W 间的关系:B>C>A=D=E B.若从A点到D点,可采用在水中加入少量酸的方法 C.若从A点到C点,可采用温度不变时在水中加入适量NH 4 Cl固体的方法 D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性  zhujx12341年前1
zhujx12341年前1 -
 生产大cc 共回答了35个问题
生产大cc 共回答了35个问题 |采纳率82.9%C
水的离子积常数只与温度有关,图中A、D、E三点的K W 相等,都是25℃时水的电离平衡状态;B点是100℃时水的电离平衡状态,水的电离程度最大,K W 最大;C点的K W 介于A点和B点之间。从A点到D点,c(OH - )减小,c(H + )增大,溶液显酸性,可以采用加入少量酸的方法。从A点到C点,c(OH - )和c(H + )都增大,且增大之后仍然有c(H + )=c(OH - ),应是温度升高所致,加入NH 4 Cl固体后溶液显酸性,C项错误。在B点时,K W =10 -12 ,pH=2的硫酸中,c(H + )=0.01 mol/L;pH=10的KOH溶液中c(OH - )=0.01 mol/L,二者等体积混合时恰好反应,溶液显中性。1年前查看全部
- (2013•闸北区二模)水的电离平衡曲线如图所示.下列说法错误的是( )
 (2013•闸北区二模)水的电离平衡曲线如图所示.下列说法错误的是( )
(2013•闸北区二模)水的电离平衡曲线如图所示.下列说法错误的是( )
A.水的电离常数KW数值大小关系为:b>c>d
B.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO2−4
C.温度不变,加入少量NaOH可使溶液从c点变到 a点
D.在b点对应温度下,将pH=2的HCl与pH=10的NaOH溶液等体积混合后,溶液显中性 赵兵1年前1
赵兵1年前1 -
 pyang204 共回答了23个问题
pyang204 共回答了23个问题 |采纳率95.7%解题思路:A、依据图象数据分析,纵轴是氢氧根离子浓度,横轴是氢离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算判断;
B、图象分析a点是常温下的溶液,氢氧根离子浓度和氢离子浓度相等,依据离子性质分析;
C、c、a点是不同温度下的溶液,离子积是随温度变化的;
D、b点Kw=10-12,中性溶液pH=6.A、依据图象分析可知,b点Kw=10-12,c点Kw=10-13,d点Kw=10-14,所以b>c>d,故A正确;
B、a点是常温下的溶液,氢氧根离子浓度和氢离子浓度相等,溶液呈中性,a点对应的溶液中大量存在Na+、Cl-、SO42-,但Fe3+、水解显酸性,不符合溶液中性,故B错误;
C、温度不变加入氢氧化钠溶液Kw不变,c、a点是不同温度下的溶液,故C错误;
D、b点Kw=10-12,中性溶液PH=6;将pH=2的HCl与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故D正确;
故选BC.点评:
本题考点: 水的电离.
考点点评: 本题考查了水的电离,离子积的概念应用和影响条件分析,离子积是随温度变化的量,题目难度中等.1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是( )
水的电离平衡曲线如图所示,下列说法不正确的是( )
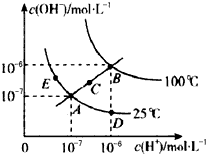
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用:温度不变在水中加入少量的酸
C. 若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. 若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 心痛过吗1年前1
心痛过吗1年前1 -
 zsw85 共回答了22个问题
zsw85 共回答了22个问题 |采纳率90.9%解题思路:A、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性;
D、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化.A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol•L-1,等体积混合,恰好中和,溶液显中性,故C正确;
D、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,加入适量的NH4Cl固体Kw不变,故D错误;
故选D.点评:
本题考点: 电解质在水溶液中的电离.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
- (2014•宁夏二模)已知水的电离平衡曲线如图所示,下列说法中正确的是( )
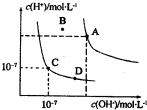 (2014•宁夏二模)已知水的电离平衡曲线如图所示,下列说法中正确的是( )
(2014•宁夏二模)已知水的电离平衡曲线如图所示,下列说法中正确的是( )
A.水的离子积常数关系为:kW(B)>kW(A)>kW(C)>kW(D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.温度升高可实现由C点到D点 197707131年前1
197707131年前1 -
 Lamar_7 共回答了22个问题
Lamar_7 共回答了22个问题 |采纳率86.4%解题思路:A.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大;
B.温度不变,Kw不变,从C点到D点c(OH-)变大,c(H+)变小;
C.B点温度处于A点和C点之间,所以离子积常数大小顺序是Kw(A)>Kw(B)>Kw(C),根据c(H+)和c(OH-)之间的相对大小判断溶液的酸碱性;
D.C点溶液呈中性,D点溶液呈碱性.A.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大,
依据图象分析可知,水的离子积常数关系为:kW(A)>kW(B)>kW(C)=kW(D),故A错误;
B.温度不变,Kw不变,向水中加入醋酸钠固体,溶液中c(OH-)变大,c(H+)变小,所以可以实现从C点到D点,故B正确;
C.B点温度处于A点和C点之间,所以离子积常数大小顺序是Kw(A)>Kw(B)>Kw(C),B点温度下,pH=4的硫酸与pH=10的氢氧化钠溶液中c(H+)<c(OH-),等体积混合后溶液呈碱性,但pH不一定等于7,故C错误;
D.C点溶液呈中性,D点溶液呈碱性,所以不能通过升高温度实现由C点到D点,故D错误;
故选B.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
- (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L -1 的NaOH溶液中,由水电离出的c(H + )=___________mol·L -1 。25 ℃时,向水的电离平衡体系中加入少量NH 4 Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
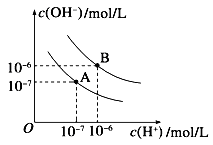
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
①25℃时,等浓度的CH 3 COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na + ) ________化学式 电离平衡常数(25℃) HCN K=4.9×10 -10 CH 3 COOH K=1.8×10 -5 H 2 CO 3 K 1 =4.3×10 -7 、K 2 =5.6×10 -11
c(CH 3 COO - )(填“>”、“<”或“=”)。
②25℃时,有等浓度的①NaCN溶液、②Na 2 CO 3 溶液、③CH 3 COONa溶液,三种溶液的pH由大到小的顺序为___________。(填序号)
③向NaCN溶液中通入少量CO 2 ,所发生反应的化学方程式为_________________________________。 海纳于心1年前1
海纳于心1年前1 -
 可爱瞳 共回答了19个问题
可爱瞳 共回答了19个问题 |采纳率94.7%(1)1×10 -12 促进 (2)>;②>①>③;②>③;NaCN+H 2 O+CO 2 =HCN+NaHCO 3
1年前查看全部
- 已知水的电离平衡曲线如图所示,下列说法中正确的是( ) A.水的离子积常数关系为:k W (B)>k W (A)>k
已知水的电离平衡曲线如图所示,下列说法中正确的是( ) A.水的离子积常数关系为:k W (B)>k W (A)>k W (C)>k W (D) B.向水中加入醋酸钠固体,可从C点到D点 C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 D.温度升高可实现由C点到D点 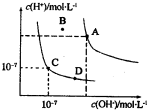
 非典型肝炎1年前1
非典型肝炎1年前1 -
 qqqqqq001 共回答了14个问题
qqqqqq001 共回答了14个问题 |采纳率100%A.水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的离子积常数越大,
依据图象分析可知,水的离子积常数关系为:k W (A)>k W (B)>k W (C)=k W (D),故A错误;
B.温度不变,Kw不变,向水中加入醋酸钠固体,溶液中c(OH - )变大,c(H + )变小,所以可以实现从C点到D点,故B正确;
C.B点温度处于A点和C点之间,所以离子积常数大小顺序是K w (A)>K w (B)>K w (C),B点温度下,pH=4的硫酸与pH=10的氢氧化钠溶液中c(H + )<c(OH - ),等体积混合后溶液呈碱性,但pH不一定等于7,故C错误;
D.C点溶液呈中性,D点溶液呈碱性,所以不能通过升高温度实现由C点到D点,故D错误;
故选B.1年前查看全部
- (2014•山东模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
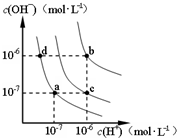 (2014•山东模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
(2014•山东模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
A.水的电离常数KW数值大小关系为:b<c<d
B.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42-
C.温度不变,加入少量NaOH可使溶液从c点变到 a点
D.在b点对应温度下,将pH=2的HCl与pH=10的NaOH溶液等体积混合后,溶液显中性 无影幽灵1年前1
无影幽灵1年前1 -
 yorkinghu 共回答了18个问题
yorkinghu 共回答了18个问题 |采纳率94.4%解题思路:A.依据图象数据分析,纵轴是氢氧根离子浓度,横轴是氢离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算判断;B.图象分析a点是常温下的溶液,氢氧根离子浓度和氢离子浓度相等,依据离子性质分析;C.c、a点是不同温度下的溶液,离子积是随温度变化的;D.b点Kw=10-12,中性溶液pH=6.A.依据图象分析可知,b点Kw=10-12,c点Kw=10-13,d点Kw=10-14,所以b>c>d,故A错误;
B.a点是常温下的溶液,氢氧根离子浓度和氢离子浓度相等,溶液呈中性,a点对应的溶液中大量存在Na+、Cl-、SO42-,但Fe3+、水解显酸性,不符合溶液中性,故B错误;
C.温度不变加入氢氧化钠溶液Kw不变,c、a点是不同温度下的溶液,故C错误;
D.b点Kw=10-12,中性溶液PH=6;将pH=2的HCl与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡;水的电离.
考点点评: 本题考查了水的电离、离子积的概念应用和影响条件,注意离子积常数是随温度变化的,不能根据氢离子浓度确定溶液酸碱性,为易错点.1年前查看全部
- 水的电离平衡曲线如图所示: (1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡
水的电离平衡曲线如图所示:
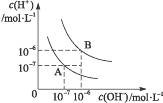
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH) 2 溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH) 2 与盐酸的体积之比为________________________________。
(3)已知A n B m 的离子积=[C(A m+ )] n ·[C(B n- )] m ,式中的C(A m+ )、C(B n- )表示离子的物质的量浓度。若某温度下CA(OH) 2 溶解度为0.74 g,其饱和溶液密度设为1 g·mL -1 ,其离子积约为_____________________________________________。 findboy1年前1
findboy1年前1 -
 戴个帽子 共回答了18个问题
戴个帽子 共回答了18个问题 |采纳率94.4%1年前查看全部
- (8分)水的电离平衡曲线如下图所示。
(8分)水的电离平衡曲线如下图所示。
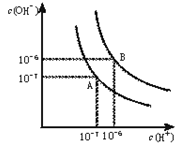
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)常温下,将pH=10的Ba(OH) 2 溶液与pH=5的稀盐酸混合,然后保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH) 2 与盐酸的体积比为 。
(3)在某温度下,Ca(OH) 2 的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,Ca(OH) 2 的离子积为 。
(4))25℃时,在等体积的① pH=0的H 2 SO 4 溶液、②0.05mol/L的Ba(OH) 2 溶液,③pH=10的Na 2 S溶液,④pH=5的NH 4 NO 3 溶液中,发生电离的水的物质的量之比是 worldbigbi1年前1
worldbigbi1年前1 -
 Coft 共回答了20个问题
Coft 共回答了20个问题 |采纳率95%1年前查看全部
- (2012•浦东新区模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
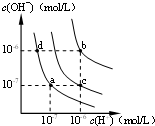 (2012•浦东新区模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
(2012•浦东新区模拟)水的电离平衡曲线如图所示.下列说法正确的是( )
A.图中对应点的温度关系为:a>b>c
B.纯水仅升高温度,可从a点变到c点
C.水的电离常数KW数值大小关系为:b>c>d
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 zjh7871年前1
zjh7871年前1 -
 vaionuts 共回答了22个问题
vaionuts 共回答了22个问题 |采纳率86.4%解题思路:A.依据图象数据分析,纵轴是氢氧根离子浓度,横轴是氢离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算判断;
B.根据C点溶液的酸碱性判断;
C.温度越高,水的离子积常数越大;
D.b点Kw=10-12,中性溶液pH=6.A.温度越高,水的离子积常数越大,根据图象知,b点Kw=10-12,c点Kw=10-13,a点Kw=10-14,所以b>c>a,故A错误;
B.c点Kw=10-13,则c曲线的纯水中6<pH<7,c点的pH=6,则该溶液呈酸性,所以纯水仅升高温度,不能从a点变到c点,故B错误;
C.a、d曲线温度相同,则离子积常数相同,即d点Kw=10-14,b点Kw=10-12,c点Kw=10-13,所以水的电离常数KW数值大小关系为:b>c>d,故C正确;
D.b点Kw=10-12,中性溶液PH=6;将pH=2的硫酸与pH=10的NaOH溶液等体积混合后,氢离子浓度和氢氧根离子浓度相同,等体积混合溶液呈中性,故D正确;
故选CD.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了水的电离、离子积的概念应用和影响条件,注意离子积常数是随温度变化的,不能根据氢离子浓度确定溶液酸碱性,为易错点.1年前查看全部
- 已知水的电离平衡曲线如图所示,试回答下列问题: (1)图中五点K w 间的关系是 ...
已知水的电离平衡曲线如图所示,试回答下列问题: (1)图中五点K w 间的关系是  ...已知水的电离平衡曲线如图所示,试回答下列问题:
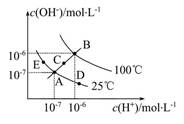
(1)图中五点K w 间的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温b.加入少量的盐酸 c.加入少量的NH 4 Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H 2 SO 4 溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H 2 SO 4 溶液的体积比为 。
 败北蛙1年前1
败北蛙1年前1 -
 yy天使 共回答了21个问题
yy天使 共回答了21个问题 |采纳率90.5%(1)B>C>A=D=E (2)b、c (3)10∶1
(1)K w 只与温度有关,温度升高促进水的电离,K w 增大,因此有B>C>A=D=E。
(2)从A点到D点,溶液由中性转化为酸性,因此选项b和c均符合题意。
(3)25 ℃时所得混合溶液的pH=7,酸碱恰好中和,即n(OH - )=n(H + ),则V(NaOH)×10 -5 mol/L=V(H 2 SO 4 )×10 -4 mol/L,得V(NaOH)∶V(H 2 SO 4 )=10∶1。1年前查看全部
- 水的电离平衡曲线如下图所示。 (1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,
水的电离平衡曲线如下图所示。
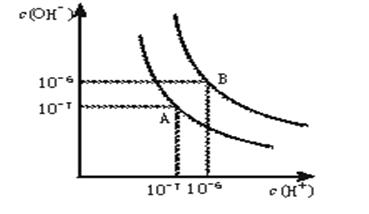
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH) 2 溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH) 2 与盐酸的体积比为 。 yuxinwuk1年前1
yuxinwuk1年前1 -
 他大婶 共回答了16个问题
他大婶 共回答了16个问题 |采纳率87.5%(1)10 -14 , 10 -12 ;(各1分)(2)2∶9; (2分)
略1年前查看全部
- 水的电离平衡曲线如图所示,下列说法正确的是( )
水的电离平衡曲线如图所示,下列说法正确的是( )
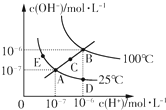
A.图中五点KW间的关系:B>C>A=D=E
B.若从D点到A点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法
D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性 forgerlansir1年前1
forgerlansir1年前1 -
 终_点 共回答了20个问题
终_点 共回答了20个问题 |采纳率95%解题思路:A.A、D、E都处于25℃时,Kw相等,然后比较B、C、E三点的c(H+)和c(OH-)的大小,依此比较Kw的大小;
B.从D点到A点c(H+)减小,c(OH-)增大,温度不变,Kw不变;
C.从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次改变的条件;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.A.ADE都处于25℃时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B.加入酸,溶液中c(H+)变大,c(OH-)变小,而从D点到A点c(H+)减小,c(OH-)增大,故B错误;
C.若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,且c(H+)=c(OH-),溶液显示中性,无法通过加入氢氧化钠溶液实现,只能为升高温度,故C错误;
D.若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=12的KOH中c(OH-)=1mol•L-1,等体积混合,氢氧根离子过量,溶液显进行,故D错误;
故选A.点评:
本题考点: 水的电离.
考点点评: 本题考查水的电离平衡移动问题,题目难度中等,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
- 已知水的电离平衡曲线如图所示,下列说法正确的是
已知水的电离平衡曲线如图所示,下列说法正确的是
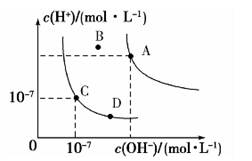
A.水的离子积常数关系为:K W (B)>K W (A)>K W (C)>K W (D)
B.向水中加入醋酸钠固体,可从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点 shuiranshuiran1年前1
shuiranshuiran1年前1 -
 未满十八 共回答了19个问题
未满十八 共回答了19个问题 |采纳率89.5%B
1年前查看全部
- 近来在一些地区的高三化学高考模拟试卷中三次读到以“水的电离平衡曲线”为背景的试题.对试题中的“水的电离平衡曲线”的含义,
近来在一些地区的高三化学高考模拟试卷中三次读到以“水的电离平衡曲线”为背景的试题.对试题中的“水的电离平衡曲线”的含义,觉得难以解释.
例如下面的一道题.
水的电离平衡曲线如右图所示,下列说法不正确的(C )
A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少
量酸的方法
C.若从A点到C点,可采用温度不变时在
水中加入适量NH4C1固体的方法
D.若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合,所得溶液呈中性
试题的附图,即试题所说的“水的电离平衡曲线图”.图中纵、横坐标分别表示氢氧根离子、氢离子浓度值.坐标系中有两条曲线、一条直线.猜想“水的电离平衡曲线”可能指的是标有25℃、 100℃的两条曲线,分别是25℃、100℃时的“水的电离平衡曲线”.但是,想想似乎不对.由水电离出的氢离子、氢氧根离子浓度,大小关系并不符合反比例关系,它们的大小总是相等的.两条曲线中只有A、B点具有这一特点.如果,“水的电离平衡曲线”是指过A、C、B点的直线,直线上的各点都符合上述特点,说的通.如果,三条先线都是所谓的“水的电离平衡曲线”,
解析两条曲线的函数关系,应该是表示25℃(或 100℃)时水溶液中氢离子、氢氧根离子浓度的大小关系(符合反比例关系),它们的乘积恒等于水的离子积 Kw(10-14或10-12).这与水的电离平衡有关系,但说成是“水的电离平衡曲线”,似乎不妥.
该怎样理解“水的电离平衡曲线”,提出来求教于同行. 寒香1年前1
寒香1年前1 -
 封刀大漠 共回答了20个问题
封刀大漠 共回答了20个问题 |采纳率85%水的电离平衡中,氢离子浓度并不总和氢氧根离子相同——具体将取决于你是否加入了酸或碱,以及加入的量
以加酸为例,氢离子浓度将会非常的高,但(特定情形下的)离子积是个常数,所以,氢氧根离子浓度就会变得非常低,反之亦然.
师弟,化学科要认真听讲啊1年前查看全部
- 水的电离平衡曲线如图所示: 若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到
水的电离平衡曲线如图所示:

若以A点表示25 ℃时水电离平衡时的离子的浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。 gcfad1年前1
gcfad1年前1 -
 哭泣海豚 共回答了16个问题
哭泣海豚 共回答了16个问题 |采纳率87.5%1×10 -14 1×10 -12 水的电离是吸热过程,温度升高,水的电离程度增大,水电离出来的c(H + )与c(OH - )增大,K W 增大
25 ℃时,K W =c(H + )·c(OH - )=1×10 -14 ,100 ℃时,K W =c(H + )·c(OH - )=1×10 -12 ,故水的离子积增大,原因是温度升高,水的电离程度增大,水电离出来的c(H + )与c(OH - )增大,K W 增大。1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是 [ ] A.图中五点Kw间
水的电离平衡曲线如图所示,下列说法不正确的是 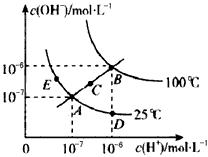 [ ]
[ ]A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH 4 Cl同体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 walklocktalk1年前1
walklocktalk1年前1 -
 Tracy0429 共回答了13个问题
Tracy0429 共回答了13个问题 |采纳率76.9%C1年前查看全部
- (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。100℃时1 mol·L ﹣1 的NaOH溶液中,由水电离出的c(H + )=_______mol/L, Kw(25℃)______Kw(100℃)(填“>”、“<”或“=”之一)。
(2)25℃时,向水的电离平衡体系中加入少量NH 4 Cl固体,对水的电离平衡的影响是__________(填“促进”“抑制”或“不影响”之一)。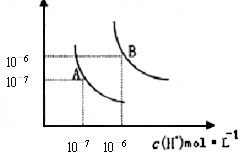
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知 
①25℃时,有等浓度的NaCN溶液、Na 2 CO 3 溶液、CH 3 COONa溶液,三溶液的pH由大到小的顺序为_____________________。
②25℃时,等浓度的CH 3 COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则 c(Na + )_______ c(CH 3 COO - )(填“>”、“<”或“=”之一)。
③向NaCN溶液中通入少量CO 2 ,所发生反应的化学方程式为___________________ 。 lexue581年前1
lexue581年前1 -
 xsm0921 共回答了27个问题
xsm0921 共回答了27个问题 |采纳率85.2%(1)1×10 -12 ;<
(2)促进
(3)①Na 2 CO 3 溶液的pH>NaCN溶液的pH>CH 3 COONa溶液的pH;②>;③NaCN+H 2 O+CO 2 =HCN+NaHCO 31年前查看全部
- 已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 (1)则25 ℃时,水的电离平衡曲线应为__________(填“
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示 
(1)则25 ℃时,水的电离平衡曲线应为__________(填“A”或“B”),请说明理由___________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H 2 SO 4 溶液混合,若所得混合溶液的pH=7,则NaOH溶液与
H 2 SO 4 溶液的体积比为__________。
(3)95℃时,若100体积pH 1 =a的某强酸溶液与1体积pH 2 =b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH 1 与强碱的pH 2 之间应满足的关系是_____________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:______________。 mj521年前1
mj521年前1 -
 4k_wugsh 共回答了22个问题
4k_wugsh 共回答了22个问题 |采纳率86.4%(1)A;水的电离是吸热过程,温度低时,电离程度小,c(H + )·c(OH - )小
(2)10∶1
(3)a+b=14(或pH 1 +pH 2 =14)
(4)曲线B对应95 ℃,此时水的离子积为10 -12 ,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H + ,使溶液pH=51年前查看全部
- 水的电离平衡曲线如下图所示.下列说法正确的是
水的电离平衡曲线如下图所示.下列说法正确的是
A.图中对应点的温度关系为:a>b
B.水的电离常数KW数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从c点变到a点x05
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
C选项不明白意思.
请把各选项意思都解释一遍
 sz123451年前1
sz123451年前1 -
 神的半身250 共回答了19个问题
神的半身250 共回答了19个问题 |采纳率84.2%这个曲线是反比例函数图象 因为水的离子积是个常数,因此 温度不变时,各个对应氢离子浓度不同的点应该在同一曲线上,而看c选项,溶液从c点到a点,c点明显在a所处在的曲线之外,因此要实现它,肯定伴随温度变化 所以 C选项有误1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是( )
水的电离平衡曲线如图所示,下列说法不正确的是( )

A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 saixian_361年前1
saixian_361年前1 -
 zz_pp 共回答了21个问题
zz_pp 共回答了21个问题 |采纳率95.2%解题思路:A、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性;
D、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化.A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol•L-1,等体积混合,恰好中和,溶液显中性,故C正确;
D、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,加入适量的NH4Cl固体Kw不变,故D错误;
故选D.点评:
本题考点: 电解质在水溶液中的电离.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
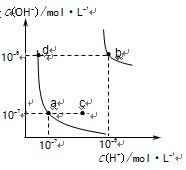
- 水的电离平衡曲线如右图所示,下列说法不正确的是 ( )
水的电离平衡曲线如右图所示,下列说法不正确的是()
A.图中五点Kw间的关系:B>C>A=D=E B.若从A点到D点,可采用在水中加入少量酸的方法 C.若从A点到C点,可采用温度不变时在水中加入适量NH 4 C1固体的方法 D.若处在B点时,将pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性  打字员小察1年前1
打字员小察1年前1 -
 aa江湖 共回答了9个问题
aa江湖 共回答了9个问题 |采纳率88.9%C
Kw与温度有关,温度越高值越大,EAD在一条等温线上,所以相等,B>C>A=D=E,因为温度升高。A正确。若从A点到D点,C(H + )变大,C(OH-)变小,可采用在水中加入少量酸的方法。B正确。若从A点到C点,Kw改变温度改变。C错误。若处在B点时,Kw=10 -12 (mol/L) 2 pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性.1年前查看全部
- 水的电离平衡曲线如图1所示:(1)若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态
水的电离平衡曲线如图1所示:
(1)若以A点表示25℃时水的电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到______,造成水的离子积增大的原因是______.
(2)已知:25℃时,0.1L 0.1mol.L-1的NaA溶液的pH=10,则HA在水溶液中的电离方程式为______
(3)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所有得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______
(4)100℃时,若10体积的PH=a某强酸溶液与1体积的PH=b某强碱溶液混合后溶液呈中性,则混合之前,a与b之间应满足的关系是______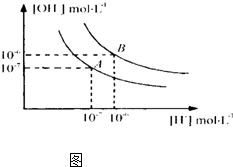
 amdk80041年前1
amdk80041年前1 -
 依然范特西2007 共回答了17个问题
依然范特西2007 共回答了17个问题 |采纳率100%解题思路:(1)水的电离是吸热反应,升高温度促进水的电离,c(H+).c(OH-)=Kw,纯水中氢离子和氢氧根离子浓度相等;(2)25℃时,0.1L 0.1mol.L-1的NaA溶液的pH=10,说明NaA为强碱弱酸盐,其溶液呈碱性,HA为弱电解质,存在电离平衡;(3)100℃时,将pH=9的NaOH溶液中,c(NaOH)=10−1210−9mol/L=10-3mol/L,pH=4的硫酸溶液中c(H+)=10-4mol/L,若所有得混合溶液pH=7,为碱性;(4)混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量.(1)水的离子积KW=c(H+)•c(OH-),25℃时,KW=c(H+)•c(OH-)=10-7×10-7=10-14,100℃时,KW=c(H+)•c(OH-)=10-6×10-6=10-12,水的电离为吸热反应,升高温度促进水电离,导致水的离子积常数增大,
故答案为:10-14;10-12;水的电离为吸热反应,升高温度促进水电离;
(2)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,HA属于弱电解质,电离方程式为:HA⇌H++A-,
故答案为:HA⇌H++A-;
(3)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=9的NaOH溶液中,氢氧根离子的浓度为:10-3mol/L,pH=4的硫酸溶液中氢离子浓度为:10-4mol/L,
二者混合后溶液的pH=7,溶液酸性碱性,溶液中氢氧根离子的浓度为10-5mol/L,即氢氧化钠过量,即10-3mol/L×xL=10-4mol/L×y+10-5mol/L(x+y),
解得x:y=1:9,
故答案为:1:9;
(4)设强酸溶液的pH为a,体积为10V,溶液中氢离子浓度为:10-amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10-(12-b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10-amol/L×10VL=10-(12-b)mol/L×VL,
解得:1-a=b-12,a+b=13,
故答案为:a+b=13.点评:
本题考点: 弱电解质在水溶液中的电离平衡;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了弱电解质的电离,明确弱电解质的电离特点及影响弱电解质电离的因素,(4)中“混合溶液呈中性,根据“强酸和强碱反应时氢离子和氢氧根离子的物质的量相等”即可分析解答,难度较大.1年前查看全部
- (2011•烟台模拟)水的电离平衡曲线如图所示:下列说法不正确的是( )
(2011•烟台模拟)水的电离平衡曲线如图所示:下列说法不正确的是( )
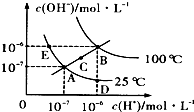
A.图中各点KW间的关系;:B>C>A=D=E
B.温度不变在水中加入少量的酸,则A点可到D点
C.25℃时,在水中加入适量的NH4Cl固体,则A点可到C点
D.将pH=2的硫酸与pH=10的KOH在B点温度等体积混合,溶液显中性 fgneourei1年前1
fgneourei1年前1 -
 03453afa7502616c 共回答了18个问题
03453afa7502616c 共回答了18个问题 |采纳率94.4%解题思路:A、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、从A点到C点c(H+)和c(OH-)的变化以及Kw只受温度影响来分析;
D、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且E点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,故B正确;
C、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,但在250C时在水中加入适量的NH4Cl固体,c(H+)变大,c(OH-)变小,Kw不变,故C错误;
D、若处在B点时,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=
10−12
10−10=10-2mol/L,溶液显中性,故D正确.
故选C.点评:
本题考点: 水的电离.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小是做题的关键.1年前查看全部
- 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是 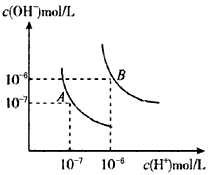 [ ]
[ ]A.纯水中25℃时的c(H + )比100℃时的c(H + )大
B.100℃时某溶液中由水电离产生的c(H + )=1×10 -11 mol/L, 则该溶液的pH可能是11或3
C.将pH=9的Ba(OH) 2 溶液与pH =4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH) 2 溶液和盐酸的体积比为10:1
D.25℃时,某Na 2 SO 4 溶液中c(SO 4 2- )=5×10 -4 mol/L,则溶液中c(Na + ):c(OH - )为10 4 :l 81804581年前1
81804581年前1 -
 cara5172 共回答了14个问题
cara5172 共回答了14个问题 |采纳率92.9%D1年前查看全部
- (2014•聊城一模)水的电离平衡曲线如图所示.下列说法正确的是( )
 (2014•聊城一模)水的电离平衡曲线如图所示.下列说法正确的是( )
(2014•聊城一模)水的电离平衡曲线如图所示.下列说法正确的是( )
A.图中对应点的温度关系为:a>b
B.水的电离常数KW数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从c点变到a点
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性 zzz00261年前1
zzz00261年前1 -
 快疯了995 共回答了19个问题
快疯了995 共回答了19个问题 |采纳率84.2%解题思路:A.升温促进水的电离;
B.d点与a点温度相同Kw相同,根据ab点时Kw计算酸与碱溶液中c(H+)和c(OH-);
C.从c点到a点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化;
D.根据b点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性.A.升温促进水的电离,b点时水电离的氢离子浓度较大,说明温度较高,故A错误;
B.d点与a点温度相同Kw相同,a点时Kw=10-14,b点时Kw=10-12,KW数值大小关系为:b>d,故B正确;
C.温度不变,Kw不变,若从c点到a点,c(OH-)不变,c(H+)变大,故C错误;
D.若处在B点时,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的NaOH中c(OH-)=
10 −12
10 −10=10-2mol/L,溶液显中性故D错误.
故选B.点评:
本题考点: 水的电离.
考点点评: 本题考查水的离子积常数、影响水电离的因素等,难度不大,注意升温促进电离,水中氢离子浓度增大.1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是( )
水的电离平衡曲线如图所示,下列说法不正确的是( )

A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用:温度不变在水中加入少量的酸
C. 若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. 若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 冷-妍-冰1年前1
冷-妍-冰1年前1 -
 十度dd 共回答了16个问题
十度dd 共回答了16个问题 |采纳率87.5%解题思路:A、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性;
D、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化.A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol•L-1,等体积混合,恰好中和,溶液显中性,故C正确;
D、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,加入适量的NH4Cl固体Kw不变,故D错误;
故选D.点评:
本题考点: 电解质在水溶液中的电离.
考点点评: 本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.1年前查看全部
- (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离
(1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度.100°C时1mol•L -1 的
NaOH溶液中,由水电离出的c(H + )=______mol•L -1 ,
K W (25°C)______ K W (100°C)(填“>”、“<”或“=”之一).25°C时,向水的电离平衡体系中加入少量NH 4 Cl固体,对水的电离平衡的影响是______(填“促进”“抑制”或“不影响”之一).
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知
①25℃时,有等浓度的NaCN溶液、Na 2 CO 3 溶液、CH 3 COONa溶液,三溶液的pH由大到小的顺序为______.化学式 电离常数(25℃) HCN K=4.9×l0 -10 CH 3 COOH K=1.8×l0 -5 H 2 CO 3 K 1 =4.3×l0 -7 、K 2 =5.6×l0 -11
②25℃时,等浓度的CH 3 COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na + )______c(CH 3 COO - )(填“>”、“<”或“=”之一).
③向NaCN溶液中通入少量CO 2 ,所发生反应的化学方程式为:______.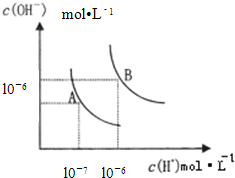
 管天地1年前1
管天地1年前1 -
 3971419 共回答了15个问题
3971419 共回答了15个问题 |采纳率80%(1)25℃时纯水中C(H + )=C(OH - )=10 -7 mol/L,K w =C(H + ).C(OH - )=10 -14 ,当温度升高到100℃,纯水中C(H + )=C(OH - )=10 -6 mol/L,K w =C(H + ).C(OH - )=10 -12 ;
100°C时1mol•L -1 的NaOH溶液中K w =C(H + ).C(OH - )=10 -12 ;c(OH-)=1mol/L,水电离出的c(H + )=1×10 -12 ;水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以K W (25°C)<K W (100°C); NH 4 Cl固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,水的电离被促进;
故答案为:1×10 -12 ;<;促进;
(2)①依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na 2 CO 3 溶液、CH 3 COONa溶液水解程度等浓度的Na 2 CO 3 溶液>NaCN溶液>CH 3 COONa溶液,溶液PH为Na 2 CO 3 溶液的>NaCN溶液的>CH 3 COONa溶液的;
故答案为:Na 2 CO 3 溶液的>NaCN溶液的>CH 3 COONa溶液的;
②等浓度的CH 3 COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H + )<c(OH - )依据溶液中电荷守恒c(H + )+c(Na + )=c(OH - )+c(CH 3 COO - ),c(Na + )>c(CH 3 COO - );
故答案为:>;
③向NaCN溶液中通入少量CO 2 ,H 2 CO 3 酸性大于HCN大于HCO 3 - ,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H 2 O+CO 2 =HCN+NaHCO 3 ;
故答案为:NaCN+H 2 O+CO 2 =HCN+NaHCO 3 ;1年前查看全部
- 水的电离平衡曲线如图所示,下列说法不正确的是 [ ] A.图中五点Kw间
水的电离平衡曲线如图所示,下列说法不正确的是 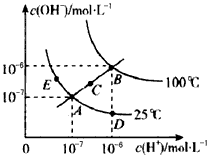 [ ]
[ ]A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH 4 Cl同体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 wahw20061年前1
wahw20061年前1 -
 mylio 共回答了15个问题
mylio 共回答了15个问题 |采纳率86.7%C1年前查看全部
大家在问
- 1已知向量a=(1,2),b=(-2,1),向量x=a+(t*2+1)b,y=-ka+1/tb,k、t为正实数,是否存在k
- 2两句诗句或两个成语一句中含有hui ,一句中含有jun,关于爱情方面的,用做婚礼主题的,
- 3老子是怎么成为孔子的老师的
- 4设A是m×n阶矩阵,b是m维列向量,已知AX=0只有零解,则以下错误的结论是( )
- 5冷后面可以填哪两个字
- 6【高中物理】重力势能两个底面积都是S的圆桶,用一根带阀门的很细的管子相连接,放在水平地面上,两筒内均装有密度为ρ的液体,
- 7核苷酸的构成是什么呢
- 8计算出涂色部分的面积
- 9用于核移植的供体细胞一般选用十代以内的细胞原因
- 10索绪尔的语言学共性是什么?
- 11along with 和 as well as 区别,以及一些同类词
- 12是否存在幂集与自然数集等势的集合?
- 13电解水 电解水实验中用多少V的电压220V的电压可不可以
- 14(1)观察右边的一列数:[1/2],[1/6],[1/12],[1/20],[1/30],[1/42],…,根据其规律可
- 15小华做一道整数加法题时,错把个位上的,七看成一十位上的九看成六,结果得到的和为136请你帮他算出正确的结果是多少,求过程