CuSO4 + FeS2 + H2O -----> Cu2S + FeSO4 + H2SO4 请用逆向配平法来配,要详细
 excedi2022-10-04 11:39:545条回答
excedi2022-10-04 11:39:545条回答
CuSO4 + FeS2 + H2O -----> Cu2S + FeSO4 + H2SO4 请用逆向配平法来配,要详细一点,
我要的是思维的过程而不是答案,我知道答案是14 CuSO4 + 5 FeS2 + 12 H2O = 7 Cu2S + 5 FeSO4 + 12 H2SO4,
我要的是思维的过程而不是答案,我知道答案是14 CuSO4 + 5 FeS2 + 12 H2O = 7 Cu2S + 5 FeSO4 + 12 H2SO4,

已提交,审核后显示!提交回复
共5条回复
 风清月影 共回答了14个问题
风清月影 共回答了14个问题 |采纳率92.9%- 14 CuSO4 + 5 FeS2 + 12 H2O = 7 Cu2S + 5 FeSO4 + 12 H2SO4
- 1年前
 fatallywind 共回答了24个问题
fatallywind 共回答了24个问题 |采纳率- 氧化还原反应方程式:FeS2 CuSO4 H2O——FeSO4 Cu2S H2SO4 配平后为:5FeS2 14CuSO4 12H2O=5FeSO4 7Cu2S 12H2SO4 这是一个氧化还原反应,有化合价的
- 1年前
 享受潜意识 共回答了2个问题
享受潜意识 共回答了2个问题 |采纳率- 此题用逆向配平法较为繁琐
不如直接用假设化合价法
变价元素为S和Cu发现假设Cu较为繁琐,于是假设所有化合物中S均为+6价
则得到Cu(+2)SO4 + Fe(-12)S2 + H2O -----> Cu(-3)2S + Fe(+2)SO4 + H2SO4
根据化合价升降原则
用奇偶配平法易得(2-(-12))Cu(+2)SO4 + (2-(-3)) Fe(... - 1年前
 qwert778899 共回答了27个问题
qwert778899 共回答了27个问题 |采纳率- 14CuSO4+FeS2+8H2O=7Cu2SO4+FeSO4+8H2SO4
- 1年前
 efzkjc 共回答了1个问题
efzkjc 共回答了1个问题 |采纳率- 14 CuSO4 + 5 FeS2 + 12 H2O = 7 Cu2S + 5 FeSO4 + 12 H2SO4
- 1年前
相关推荐
- 甲乙两人分别从圆的直径两端同时出发,沿圆周行进,如果逆向行走,则50秒相遇,如果同向行走则甲追上乙需
甲乙两人分别从圆的直径两端同时出发,沿圆周行进,如果逆向行走,则50秒相遇,如果同向行走则甲追上乙需
500秒,那么甲比乙的速度快多少!快,急,有重赏,最快最好者加分 rain5203331年前1
rain5203331年前1 -
 深情款款井男人 共回答了14个问题
深情款款井男人 共回答了14个问题 |采纳率78.6%以圆周的一半为1
甲乙速度和为1/50
甲乙速度差为1/500
甲乙速度比为(1/50+1/500)÷(1/50-1/500)=11:9
甲比乙快(11-9)/9=2/91年前查看全部
- 水平传送带以v的速度水平向右匀速运动,传送带两端A,B间的距离为x,将一质量为m的木块以初速度为v0放在B端与传送带逆向
水平传送带以v的速度水平向右匀速运动,传送带两端A,B间的距离为x,将一质量为m的木块以初速度为v0放在B端与传送带逆向运动,木块与传送带间的动摩擦因数为u,求木块运动的时间
应分三种情况讨论
v0>v
v0=v
v0 TOP盗版1年前1
TOP盗版1年前1 -
 lingyue83 共回答了14个问题
lingyue83 共回答了14个问题 |采纳率92.9%1.当v0v时
v^2-v0^2=-2μgS,S=(v0^2-v^2)/(2μg)
由v-v0=-μgt1,t1=(v0-v)/(μg)
t2=(x-s)/v
木块运动的时间t=t1+t2=(v0-v)/(μg)+(x-s)/v1年前查看全部
- Zn+Ag2O==ZnO+2Ag(正向放电,逆向充电)【电解质为KOH】 充电中,阴极为什么PH减小?
Zn+Ag2O==ZnO+2Ag(正向放电,逆向充电)【电解质为KOH】 充电中,阴极为什么PH减小?
充电中,阴极PH减小为什么错? 12个啸坤1年前2
12个啸坤1年前2 -
 MJKASAS 共回答了21个问题
MJKASAS 共回答了21个问题 |采纳率81%阴极:ZnO+H2O+2e==Zn+2OH- 生成OH-离子,pH增加
阳极:2Ag+2OH-==Ag2O+H2O+2e
所以你确定充电时阴极pH减小?1年前查看全部
- 水的电离平衡方向移动判断.往水中加入少量浓盐酸,为啥水的电离平衡逆向移动?答案说增加了浓盐酸电离出H+,增加了H+浓度
水的电离平衡方向移动判断.
往水中加入少量浓盐酸,为啥水的电离平衡逆向移动?
答案说增加了浓盐酸电离出H+,增加了H+浓度 所以逆向
那我不能说是浓盐酸的H+把水电离出的OH-消耗掉了,故水电离出的OH-少了,所以向正移动吗?
同理,水中加入少量CH3COONa,平衡逆向移动.
为什么不能说醋酸钠电离出的CH3COO- 与水电离出的H+反应,消耗了H+,所以正向移动?
这类题应该怎么判断?求详解. jaminjing1年前1
jaminjing1年前1 -
 小囡不爱说话 共回答了18个问题
小囡不爱说话 共回答了18个问题 |采纳率83.3%这种题目要弄清楚整个过程.
在没加入浓盐酸之前存在水的电离平衡.
即H2O=OH-+H+
加入盐酸之后盐酸完全电离
即HCl=Cl-+H+
你说的对,氢离子来了确实要和水电离的氢氧根结合
即OH-+H+=H2O,而这不就已经说明了水的电离逆向移动吗.
你又讲,水中氢氧根少了,水的电离平衡向右移动,但你没有注意到,由于大量的加入额外的氢离子,即水的电离平衡中生成物大量增加,已经抑制了水的电离,比起那点消耗的氢氧根,氢离子的增加才是最主要的,记住,水的电离是非常微弱的,仅凭那一点消耗的氢氧根是不可能使水的电离平衡向正方向移动的.大量的氢离子已经绝对抑制住了水的电离.
再看醋酸钠.我不太明白,向水中加入醋酸钠,水的电离平衡确实是向正方向移动啊,你讲的没错啊.向水中加入强碱弱酸盐或是强酸弱碱盐确实会改变电离平衡,而且一般情况下都是向右移动啊.
总之,一句话,一旦加入强酸或强碱,水的电离一定被抑制.加入能够水解的盐,水的电离被促进.1年前查看全部
- 下列判断正确的是( )A.碳酸溶液中c(H+)>2c(CO32−)B.常温下,向水中加入冰醋酸,水的电离平衡逆向移动,
下列判断正确的是( )
A.碳酸溶液中c(H+)>2c(CO32−)
B.常温下,向水中加入冰醋酸,水的电离平衡逆向移动,c(H+)降低
C.二氧化碳溶于水达到平衡后,加入少量固体NaOH,一定有c(Na+)=c(HCO3-)+2c(CO32- )
D.用pH=2和pH=3的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Vb<10Va hnxcym1年前1
hnxcym1年前1 -
 JLAN825 共回答了19个问题
JLAN825 共回答了19个问题 |采纳率94.7%解题思路:A.碳酸为二元弱酸,以第一步电离为主;
B.水中加入醋酸,抑制水的电离,但溶液氢离子浓度增大;
C.溶液不一定呈中性,结合电荷守恒判断;
D.醋酸为弱酸,浓度越大,电离程度越小.A.碳酸为二元弱酸,以第一步电离为主,且第一步电离远大于第二步电离,则c(H+)>2c(CO32- ),故A正确;
B.向水中加入冰醋酸,水的电离平衡逆向移动,但c(H+)增大,故B错误;
C.二氧化碳溶于水达到平衡后,加入少量固体NaOH,溶液遵循电荷守恒:c(H+)+c(Na+)=c(HCO3-)+2c(CO32- ),溶液不一定呈中性,则二则不一定相等,故C错误;
D.醋酸为弱酸,浓度越大,电离程度越小,pH=2和pH=3的醋酸溶液相比较,前者浓度大于后者10倍,中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Vb>10Va,故D错误.
故选A.点评:
本题考点: 离子浓度大小的比较;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查较为综合,侧重于弱电解质的电离的考查,注意把握弱电解质的电离特点,能运用电荷守恒解答该题题目,难度中等.1年前查看全部
- 有机重排问题为什么有些有机物会发生重排现象?比如说烯醇与醛的重排,为什么会发生?还有会不会逆向重排?这样重排的产率大概有
有机重排问题
为什么有些有机物会发生重排现象?
比如说烯醇与醛的重排,为什么会发生?还有会不会逆向重排?这样重排的产率大概有多少? chel1年前1
chel1年前1 -
 Darrow 共回答了21个问题
Darrow 共回答了21个问题 |采纳率90.5%重排反应是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类.重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,以下例子中取代基R由碳原子1移动至碳原子2:
分子间重排反应也有可能发生.
按反应机理,重排反应可分为:基团迁移重排反应和周环反应.
基团迁移重排反应 反应物分子中的一个基团在分子范
围内从某位置迁移到另一位置的反应.常见的迁移基团是烃
基.迁移基团的原来位置称为迁移起点[1],迁移后的位置称为
迁移终点,这类反应又可按价键断裂方式分为异裂和均裂 ,
前者重要得多,其中尤以缺电子重排最为重要.
缺电子重排反应是反应物分子先在迁移终点形成一个缺
电子活性中心,从而促使迁移基团带着键裂的电子对发生迁
移,并通过进一步变化生成稳定产物.以频哪酮重排反应为
例,反应物分子中的一个羟基与酸作用形成锌盐后失水变为
缺电子活性中心正碳离子,促使邻位带羟基碳原子上的一个
甲基带着电子对发生1,2-迁移,同时羟 基氧原子 上未共用
电子对转移至碳?氧之间构成双键,最后失去质子而得产物
(见上反应式).在迁移终点形成一个富电子活性中心后 ,
促使迁移基团不带键裂电子对而转移,叫富电子重排反应 ,
例如法沃斯基重排:a - 卤代酮 在强碱作用 下重排,生成碳
架不同的羟酸酯,反应通过富电子活性中心负碳离子进行 :
环反应 反应物因分子内共价键协同变化而发生重排
的反应,有电环化反应和δ迁移反应.例如环丁烯经加热发
生逆向电环化而得1,3-丁二烯,1,3-己二烯经加热发生氢
原子1,5-迁移而得2,4-己二烯.这类重排在合成中应用最
多的是属于3,3-迁移的科 普重排和克 莱森重排.科普重排
是1,5-二烯受热重排为另一个1,5-二烯的反应.例如内消
旋-3,4-二甲基-1,5-己二烯经加热几乎定量地转变为(Z ,
E)-2,6-辛二烯:
克莱森重排反应是参与反应的体系中有一个氧原子代替
了碳原子.例如,苯基烯丙醚经加热重排生成的环己二烯酮,
随即异构化为邻烯丙基苯酚1年前查看全部
- 一定温度下,在下图所示装置中,固体X与气体Y反应。生成气态产物,当改变温度时该气态产物发生逆向反应,重新生成X和Y。 利
一定温度下,在下图所示装置中,固体X与气体Y反应。生成气态产物,当改变温度时该气态产物发生逆向反应,重新生成X和Y。 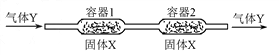
利用上述反应原理和装置,对含杂质的固体Co进行提纯(杂质不参加反应),发生的化学反应为:  (固)
(固)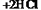 (气)
(气) 
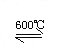 (气)
(气)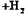 (气)。下列说法正确的是[ ]
(气)。下列说法正确的是[ ]A.容器1中的温度为600℃
B.容器2中的固体是纯净的
C.该装置最终导出的气体是 和
和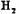
D.固体 从容器1到容器2的过程为物理变化
从容器1到容器2的过程为物理变化 jacky09131年前1
jacky09131年前1 -
 秋天到来吧 共回答了15个问题
秋天到来吧 共回答了15个问题 |采纳率86.7%B1年前查看全部
- 增加A物质的量,相当于增加A浓度,第一个反应,平衡应该正向移动,可是增加物质的量也是增大压强,平衡应该逆向移动,这个地方
增加A物质的量,相当于增加A浓度,第一个反应,平衡应该正向移动,可是增加物质的量也是增大压强,平衡应该逆向移动,这个地方到底是怎样?我纠结…

 wl07081年前1
wl07081年前1 -
 lz是疯子 共回答了28个问题
lz是疯子 共回答了28个问题 |采纳率89.3%我们先假设第二次投入的A的量为第一次投入量的二倍,再想象一下这样一个等效平衡的情况:“第一次投入一倍的A,在一体积的容器中”应该与“投入二倍的A在两体积的容器中”为等效平衡(两种情况压强相等,则等比即等效),那么转化率应该相等.但实际情况是“第二次投入二倍的A却在一体积的容器中”,相当于在“投入二倍的A在两体积的容器中”这种状况下压缩体积,也就是增大了压强,对于第一个反应来说会导致平衡左移,转化率减小,第二个反应则相反.
这种找等压情况下的等效平衡来对比的思路还是很实用你所纠结的情况的,希望对你有所帮助.1年前查看全部
- 甲乙两人在环形路上同向而行,甲比乙快,甲第一次遇上乙后即逆向而行,当第二次遇上乙时,甲正好行了4圈,则甲乙速度之比为:
甲乙两人在环形路上同向而行,甲比乙快,甲第一次遇上乙后即逆向而行,当第二次遇上乙时,甲正好行了4圈,则甲乙速度之比为:
A:√2:1 B:√3:1 C:2:1 D:3:2 谁是谁de1年前1
谁是谁de1年前1 -
 烟花飞落无觅处 共回答了17个问题
烟花飞落无觅处 共回答了17个问题 |采纳率82.4%A:√2
设甲速度为VX,乙速度为V,甲乙第一次相遇时间为T1,第二次相遇时间为t2,环路周长为L,
第一次相遇:(VX-V)T1=L---------1
第二次相遇:(VX+V)T2=L----------2
甲总共走了四圈:VX(T1+T2)=4L ----3
1式求出T1=L/(VX-V)------4
2式求出T2=L/(VX+V)----------5
4,5式代入3式就可求出X1年前查看全部
- 甲、乙两人分别从圆的直径两端同时出发,沿圆周行进.若甲逆向行走则50秒相遇,若同向行走则甲追上乙需300秒,甲、乙的速度
甲、乙两人分别从圆的直径两端同时出发,沿圆周行进.若甲逆向行走则50秒相遇,若同向行走则甲追上乙需300秒,甲、乙的速度比是______:______.
 冷色山花1年前2
冷色山花1年前2 -
 没精神的柚子 共回答了16个问题
没精神的柚子 共回答了16个问题 |采纳率100%解题思路:把甲乙两人距离看作单位“1”,根据沿圆周行进.若逆向行走则50秒相遇可得:两人的速度和是[1/50],又根据若同向行走则甲追上乙需300秒可得:甲的速度比乙快[1/300],先用两人速度和减甲比乙快的速度,再除以2即可求出乙的速度据此即可解答.([1/50−
1
300])÷2,
=[1/60÷2,
=
1
120],
([1/120+
1
300]):[1/120],
=[7/600]:[1/120],
=7:5,
答:甲、乙的速度比是7:5.
故应填:7,5.点评:
本题考点: 简单的行程问题;比的意义.
考点点评: 解答本题的关键是根据数量间的等量关系,表示出两人的速度.1年前查看全部
- 平衡常数~~~~~急某1dm^3容器含有1.00摩尔光气,并按以下的反应进行分解: COCl2(g) 逆向反应 CO(g
平衡常数~~~~~急
某1dm^3容器含有1.00摩尔光气,并按以下的反应进行分解:
COCl2(g) 逆向反应 CO(g)+Cl2(g)
a)平衡时,Cl2的浓度是0.028mol dm^-3 , CO和COCl2的浓度分别是多少 ?
b)计算反应的平衡常数. idob1年前1
idob1年前1 -
 vesslan009 共回答了23个问题
vesslan009 共回答了23个问题 |采纳率91.3%COCl2 = CO + Cl2
1 0 0
0.028 0.028 0.028
0.972 0.028 0.028
平衡常数=(0.028*0.028)/ 0.972 = 8.065 * 10 ^ -4 mol/l1年前查看全部
- 难溶电解质平衡……如果溶液中的AgCl达到溶解平衡,再向溶液中加一定浓度的NaCl溶液,溶解平衡逆向移动,银离子物质的量
难溶电解质平衡……
如果溶液中的AgCl达到溶解平衡,再向溶液中加一定浓度的NaCl溶液,溶解平衡逆向移动,银离子物质的量浓度降低,可以说氯化银的溶解度降低吗?
氯化银的溶解度都与什么有关啊? xlz87249191年前1
xlz87249191年前1 -
 光的上星tt 共回答了23个问题
光的上星tt 共回答了23个问题 |采纳率87%NACL应该是和溶液里什么东西反应了.平衡向被反应的地方移动1年前查看全部
- 物理能量分析一个传送带水平放着,逆向转动时候,把一个物体放在上面,物体刚好从右端落下,问在这一过程中,机器多做了多少功给
物理能量分析
一个传送带水平放着,逆向转动时候,把一个物体放在上面,物体刚好从右端落下,问在这一过程中,机器多做了多少功
给出两种解法的思路,详细的!
还有 机器多做的功和机器多做的能量是一回事吗?
谢谢
当传送带转动的时候,以一个向右的初速度放在传送带的左边 after19491年前5
after19491年前5 -
 麻绳的SM 共回答了21个问题
麻绳的SM 共回答了21个问题 |采纳率85.7%没那么简单机器多做的功和传送带的速度是有关的.设传送带的速度始终是v0,物体的质量是m,摩擦因数是μ,传送带长是L,物体的初速度是v,整个过程用时t则ma=μmgat=v在时间t内,传送带反向转过的距离s=v0t所以机器多做的功...1年前查看全部
- 乙酸能否被逆向还原成乙醇?具体的反应式和步骤是什么啊?
 知唔知1年前2
知唔知1年前2 -
 doru 共回答了14个问题
doru 共回答了14个问题 |采纳率78.6%可以,用强的还原剂就行!如LiAlH4
CH3COOH→→→CH3CH2OH 横线上写上还原剂1年前查看全部
- 化学反应与体积分数的关系xA+yB=zC(可逆反应)反应平衡逆向移动 C的体积分数为什么下降?
 3cat5381年前1
3cat5381年前1 -
 BT16 共回答了20个问题
BT16 共回答了20个问题 |采纳率95%很好理解啊,既然是逆向移动,C被消耗了,A、B生成了,所以C体积分数下降了.1年前查看全部
- 方程式配平求讲解.两端配平法,逆向配平,归中反应的配平,缺项配平,会几个讲几个
 萄就是不吐葡萄皮1年前1
萄就是不吐葡萄皮1年前1 -
 一点红 共回答了20个问题
一点红 共回答了20个问题 |采纳率95%汗,来搞这么多 搞乱学生.我就2个 百配百行!你先看看反应有没化合价的变化 你高一学了氧化还原了吗?你懂没化合价的变化吧?例如复分解反应那些 看到没化合价变化的 直接用初中的方法去配!看到有化合价的变化的 如果是书本的方程式 我建议你背1背 不用每次都配这么麻烦 当然你要掌握氧化还原的配平方法.!其实只要用电子守恒 电子守恒懂吧?我举个例子 稀硝酸和铜的反应 CU+HNO3=NO+CU(NO3)2+H2O 这个方程式好难直接去配 所以用电子守恒去搞 先标出反应物、生成物的化合价CU0价 hon3的 N是+5 然后其他化合价都标出来 然后写生成物的化合价 NO中 N是+2 CU是+2 那么你想 根据电子得失守恒 1个CU变成1个硝酸铜失去2个电子 1个硝酸变成1个一氧化氮失去3个电子 然后既然要电子守恒嘛 那么就乘他的最小公倍数 又因为HNO3变成硝酸铜和NO 先不配他 先配铜 铜乘以3 然后再配NO是2 然后再配出HNO3就是8了!然后把其他方程式配平
高中只要掌握这2种就行了.!纯手打 累啊!1年前查看全部
- 恒容密闭融资中发生如下反应2nh3+no+no2=n2+3h2o,达到平衡后增大压强,则平衡一定逆向移动,为啥不对呢
恒容密闭融资中发生如下反应2nh3+no+no2=n2+3h2o,达到平衡后增大压强,则平衡一定逆向移动,为啥不对呢
不好意思,N2前面的系数是2 反应前体积为4,反应后为5,是放热反应 illusory1年前4
illusory1年前4 -
 60302260 共回答了21个问题
60302260 共回答了21个问题 |采纳率76.2%恒温恒压下,充入惰性气体,压强增大,平衡不移动1年前查看全部
- 醋酸加水,老师讲得促进电离,平衡正向移,可用勒夏特列不就是减少反应物浓度,平衡逆向移吗?
醋酸加水,老师讲得促进电离,平衡正向移,可用勒夏特列不就是减少反应物浓度,平衡逆向移吗?
还有加纯醋酸,是纯醋酸,老师讲得是平衡逆向移动,用勒夏不就该是增加反应物浓度,平衡正向移吗?还有,就算是逆向移为什么氢离子浓度和醋酸根离子浓度都变大呢?我完全搞不懂! 木浅浅1年前1
木浅浅1年前1 -
 古城散人 共回答了21个问题
古城散人 共回答了21个问题 |采纳率66.7%11年前查看全部
- 既然在水电离时加NaOH消耗氢离子 那么就算使氢氧根增加了 为什么平衡向逆向移动
 pangniugui1年前1
pangniugui1年前1 -
 闪雷惊燕 共回答了28个问题
闪雷惊燕 共回答了28个问题 |采纳率82.1%因为OH-增加了.1年前查看全部
- S0,则逆向自发那么可逆反应是双向自发的,请问这个如何在吉布斯自由能中体现呢?
 taotaojianghe1年前1
taotaojianghe1年前1 -
 hym1 共回答了20个问题
hym1 共回答了20个问题 |采纳率95%可逆反应在吉布斯自由能中体现就是ΔG既可以大于零,又可以小于零,还可以等于零,吉布斯自由能有一个表达方式就是ΔG=-RTlnK,K为平衡常数,由此可以看出T一定时,ΔG是随K变化的.1年前查看全部
- 醋酸溶液中加少量醋酸钠固体,平衡逆向移动?
醋酸溶液中加少量醋酸钠固体,平衡逆向移动?
我想问的是,醋酸钠呈碱性,水解出的氢氧根难道不会和醋酸电离出的氢离子反应,使平衡右移吗? abc32191年前3
abc32191年前3 -
 小赖儿 共回答了9个问题
小赖儿 共回答了9个问题 |采纳率77.8%首先是你加入醋酸钠,醋酸钠是强电解质,溶液中的醋酸根浓度迅速增加,因为醋酸是弱电解质,醋酸根浓度增加抑制醋酸电离.
其次你说的水解的氢氧根,水解很微弱,在这种情况下醋酸根的抑制占主导.1年前查看全部
- 百度百科 不过按照地球标准,以一次日出到下一次日出算一天的话,则金星上的一天要远远小于243天.这是因为金星是逆向自转的
百度百科 不过按照地球标准,以一次日出到下一次日出算一天的话,则金星上的一天要远远小于243天.这是因为金星是逆向自转的缘故;在金星上看日出是在西方,日落在东方;一个日出到下一个日出的昼夜交替只是地球上的116.75天.关于日落在东方;一个日出到下一个日出的昼夜交替只是地球上的116.75天,我还是无法解?怎么是116.75天?逆向自转后就会增加昼夜交替次数吗?怎样来的?
 小草6241年前1
小草6241年前1 -
 失忆的月光宝盒 共回答了20个问题
失忆的月光宝盒 共回答了20个问题 |采纳率95%逆向自转不仅仅是转个方向而已,它在这里的意思是:自转方向和公转方向相反.
因为自转的同时还要公转且方向相反,它自转的时候还没转够360度就会再次看到日出,所以它的一天,小于自转一周所需天数243
算法是这样的,公转每天转1.6021度,自转每天转1.481度,两个角度相加,它每天实际转过的角度是3.083度.360度/3.083度=116.7天1年前查看全部
- 为什么在可逆反应中反应物的物质的量浓度增大的倍数大于压强增大的倍数,说明此过程中平衡逆向移动?
为什么在可逆反应中反应物的物质的量浓度增大的倍数大于压强增大的倍数,说明此过程中平衡逆向移动?
如题.谢谢. zaishuiyifan11年前2
zaishuiyifan11年前2 -
 doddle82 共回答了18个问题
doddle82 共回答了18个问题 |采纳率88.9%题目应该是类似减小一倍体积但是 某物质的浓度却增加了一倍以上吧? 这就说明你那个反应是个体积增大的反应,增大压强平衡自然逆向移动.1年前查看全部
- 为什么生态系统中能量不能逆向流动也不能循环流动?
 西班牙队主教练1年前1
西班牙队主教练1年前1 -
 plmqsc520 共回答了18个问题
plmqsc520 共回答了18个问题 |采纳率83.3%能量是生态系统的基础,一切生命都存在着能量的流动和转化.没有能量的流动,就没有生命和生态系统.流量流动是生态系统的重要功能之一,能量的流动和转化是服从于热力学第一定律和第二定律的,因为热力学就是研究能量传递规律和能量形式转换规律的科学.
能量流动可在生态系统、食物链和种群三个水平上进行分析.生态系统水平上的能流分析,是以同一营养级上各个种群的总量来估计,即把每个种群都归属于一个特定的营养级中(依据其主要食性),然后精确地测定每个营养级能量的输入和输出值.这种分析多见于水生生态系统,因其边界明确、封闭性较强、内环境较稳定.食物链层次上的能流分析是把每个种群作为能量从生产者到顶极消费者移动过程中的一个环节,当能量沿着一个食物链在几个物种间流动时,测定食物链每一个环节上的能量值,就可提供生态系统内一系列特定点上能流的详细和准确资料.实验种群层次上的能流分析,则是在实验室内控制各种无关变量,以研究能流过程中影响能量损失和能量储存的各种重要环境因子.
在这里我们还介绍一下食物链、食物网、营养级、生态金字塔等概念.植物所固定的能量通过一系列的取食和被取食关系在生态系统中的传递,这种生物之间的传递关系称为食物链(food chains).一般食物链是由4~5环节构成的,如草→昆虫→鸟→蛇→鹰.但在生态系统中生物之间的取食和被取食的关系错综复杂,这种联系象是一个无形的网把所有生物都包括在内,使它们彼此之间都有着某种直接或间接的关系,这就是食物网(food web).一般而言,食物网越复杂,生态系统抵抗外力干扰的能力就越强,反之亦然.在任何生态系统中都存在着两种最主要的食物链,即捕食食物链(grazing food chain)和碎屑食物链(detrital food chain),前者是以活的动植物为起点的食物链,后者则以死生物或腐屑为起点.在大多数陆地和浅水生态系统中,腐屑食物链是最主要的,如一个杨树林的植物生物量除6%是被动物取食处,其余94%都是在枯死凋落后被分解者所分解.一个营养级(trophic levels)是指处于食物链某一环节上的所有生物种群的总和,在对生态系统的能流进行分析时,为了方便,常把每一生物种群置于一个确定的营养级上.生产者属第一营养级,植食动物属第二营养级,第三营养级包括所有以植食动物为食的肉食动物,一般一个生态系统的营养级数目为3~5个.生态金字塔(ecological pyramids)是指各个营养级之间的数量关系,这种数量关系可采用生物量单位、能量单位和个体数量单位,分别构成生物量金字塔、能量金字塔和数量金字塔.1年前查看全部
- 高一化学(化学平衡的问题)2NO2=N2O4当这个可逆反应平衡后,若在恒容的条件下,增加生成物N2O4的浓度,则平衡逆向
高一化学(化学平衡的问题)
2NO2=N2O4
当这个可逆反应平衡后,若在恒容的条件下,增加生成物N2O4的浓度,则平衡逆向移动.
可是在恒容条件下,若增加生成物N2O4的浓度,不也就相当于增大了压强么?增大压强,平衡不应该像气体体积减小的方向移动,也就是平衡正向移动么?
这是怎么回事?平衡到底向哪个方向移动呢? 坚硬的锡兵1年前7
坚硬的锡兵1年前7 -
 hylt7758 共回答了15个问题
hylt7758 共回答了15个问题 |采纳率86.7%应该说,增加生成物N2O4的浓度,从过程上看,平衡逆向移动,但平衡移动只能减小影响,不能消除影响,故新平衡中N2O4的浓度大于旧平衡中N2O4的浓度,也就是说,从结果上看,平衡正向移动.
算题时,用增大了压强算就可以了.
当年,这也困扰过我,所以很乐意提供帮助.不过自己思考是最好的.
PS我发现,压强对反应的影响永远是通过浓度来作用的,比如说,压强对气体反应速率的影响,比如说,你在上述容器中加入N2增大了压强,平衡也不移动.1年前查看全部
- 为什么在醋酸溶液中加入水进行稀释,电离度会增加,不是应该醋酸的浓度变小,反应逆向移动吗,%B
 liyu651年前3
liyu651年前3 -
 nkbadboy 共回答了16个问题
nkbadboy 共回答了16个问题 |采纳率100%醋酸是弱电解质,一定条件下的醋酸溶液中,醋酸的电离达成平衡,即醋酸离解成H+和醋酸根离子的速率等于H+和醋酸根离子结合成醋酸的速率.加水稀释后,单位体积内的H+和醋酸根离子数目减少,H+和醋酸根离子结合醋酸的几率变小,因此电离平衡向右移动,即醋酸的电离度增大.1年前查看全部
- 平衡移动与转化率关系!有一平衡态,如果平衡正向移动,则转化率一定增大.如果平衡逆向移动,转化率一定减小.这么说,我认为,
平衡移动与转化率关系!
有一平衡态,如果平衡正向移动,则转化率一定增大.如果平衡逆向移动,转化率一定减小.
这么说,
我认为,压强,温度导致的移动,这么说是正确的.
而浓度导致的移动是不符合的.
着重针对浓度导致的移动. sz-雯雯1年前4
sz-雯雯1年前4 -
 rwtb 共回答了7个问题
rwtb 共回答了7个问题 |采纳率85.7%第一问的说法是错误的,设想我增加反应物的浓度,平衡也是正向移动,但转化率是降低的.这可由勒沙特列原理来解释,只能缓解浓度增加,但不能消除浓度变化带来的影响,转化率下降.1年前查看全部
- 一条小艇以不变的速度在流速稳定的河水中逆向行驶,已知水流的速度大小是2.5米/秒,在小艇经过一航标时投一木块落入水中顺流
一条小艇以不变的速度在流速稳定的河水中逆向行驶,已知水流的速度大小是2.5米/秒,在小艇经过一航标时投一木块落入水中顺流而下,京1.5分钟后小艇回头以不变的速度去追赶木块,结果距航标?米处的下游追上了木块.
 faraday1年前1
faraday1年前1 -
 天堂鸟Zw 共回答了13个问题
天堂鸟Zw 共回答了13个问题 |采纳率84.6%以水流为参照物,则木块是静止不动的,小艇速度恒定为v
∵1.5分钟后小艇返回追赶木块,而木块静止,小艇速度不变
∴仍然需要1.5分钟追上木块
再以地球为参照物,则木块速度为水速
∴据航标s=vt=2.5m/s×90s=225m1年前查看全部
- 高中化学氧化还原反应的“逆向配平法”?请举些例子吧.
 lh1gj1年前1
lh1gj1年前1 -
 miaomiao304 共回答了19个问题
miaomiao304 共回答了19个问题 |采纳率100%当配平反应物(氧化剂或还原剂)中的一种元素出现几种变价的氧化—还原方程式时,如从反应物开始配平则有一定的难度,若从生成物开始配平,则问题迎刃而解.
例:P+CuSO4+H2O-Cu3P+H3PO4+H2SO4
分析:这一反应特点是反应前后化合价变化较多,在配平时可选择变化元素较多的一侧首先加系数.本题生成物一侧变价元素较多,故选右侧,采取从右向左配平方法(逆向配平法).应注意,下列配平时电子转移都是逆向的.
P+CuSO4+H2O- Cu3P+H3PO4+H2SO4
所以,Cu3P的系数为5,H3PO4的系数为6,其余观察配平.
11P+15CuSO4+24H2O = 5Cu3P+6H3PO4+15 H2SO41年前查看全部
- 这一题的D选项为什么是错的?难道1处可以测的动作电位?神经元之间不是不能逆向传递吗?
 kevinxiaofei1年前2
kevinxiaofei1年前2 -
 guanjilin 共回答了14个问题
guanjilin 共回答了14个问题 |采纳率92.9%D 除了5还有3能检测到动作电位1年前查看全部
- 对一道逆向思维的不解有一道趣味题是这样的:有四个相同的瓶子,怎样摆放才能使其中任意两个瓶口的距离都相等呢?把三个瓶子放在
对一道逆向思维的不解
有一道趣味题是这样的:有四个相同的瓶子,怎样摆放才能使其中任意两个瓶口的距离都相等呢?
把三个瓶子放在正三角形的顶点,将第四个瓶子倒过来放在三角形的中心位置,答案就出来了.把第四个瓶子“倒过来”,
可是这么麻烦做什么,为什么不直接把三个瓶子摆成正三角形的三个点,另外一个放在这个正三角形的中点位置就好了?这样不就是四个瓶口距离相等了 RemdyBoy1年前2
RemdyBoy1年前2 -
 某叮泪水 共回答了19个问题
某叮泪水 共回答了19个问题 |采纳率89.5%为了符合题意,要么四个瓶子口重合,要么必须考虑空间分布
所以,原答案是重合,还有一种答案是达成正四棱锥的四个顶点,
你后来的答案不对,两个底边瓶口距离与底边至中间瓶口距离不等1年前查看全部
- 向盐溶液中加入OH-的话,水的电离就逆向进行,那么是不是又消耗少量OH-离子?
 蹩脚的小丑1年前2
蹩脚的小丑1年前2 -
 齐天大猪 共回答了19个问题
齐天大猪 共回答了19个问题 |采纳率78.9%是少电离出一些OH-.也可以理解成消耗了.1年前查看全部
- 物理中用逆向思维解题时要用文字交代吗
物理中用逆向思维解题时要用文字交代吗
还是直接列出等式就好? 素描天下1年前3
素描天下1年前3 -
 婉骧奕 共回答了25个问题
婉骧奕 共回答了25个问题 |采纳率96%要交代.我们那个变态物理老师说的1年前查看全部
- 风会影响声音的速度吗?比喻风吹向东边,那东边收到声音比风逆向收到的时间快吗?
风会影响声音的速度吗?比喻风吹向东边,那东边收到声音比风逆向收到的时间快吗?
我突然对物理有很大的乐趣,还有:冰传播声音的速度和铁一样算吗? WeirdBird1年前1
WeirdBird1年前1 -
 留住你的那场雨 共回答了23个问题
留住你的那场雨 共回答了23个问题 |采纳率91.3%风不会影响声音的传播,固体传声是定值,所以一样1年前查看全部
- 高中化学题(关于强弱电解质)“25度时,向水中加入ch3coona,水的电离平衡:h2o——h+ +oh- 逆向移动,c
高中化学题(关于强弱电解质)
“25度时,向水中加入ch3coona,水的电离平衡:h2o——h+ +oh- 逆向移动,c(h+)降低”说法错误.
我是这么想的:ch3coona是强碱,且谁强显谁性,则ch3coona呈碱性,所以平衡逆向移动.错在哪儿呢? cxvmsdkfsaodipuf1年前3
cxvmsdkfsaodipuf1年前3 -
 六七次 共回答了18个问题
六七次 共回答了18个问题 |采纳率88.9%加入电解质,水的电离平衡时正向移动的,只不过还有另一个平衡存在,那就是H+ + CH3COO- ------CH3COOH,总的结果就是H2O + CH3COONa-------CH3COOH + Na+ + OH- .你的想法中“谁强显谁性”是靠这个来推导出来的,用这个结论去推原理是不对的.1年前查看全部
- 从A地坐船到B地,共1500米,顺水用30分钟,逆向(B到A)用去50分钟.如果要求在一个小时内返航,且中途不能停留,路
从A地坐船到B地,共1500米,顺水用30分钟,逆向(B到A)用去50分钟.如果要求在一个小时内返航,且中途不能停留,路线不变.请问船应在什么时间折返.请列出算式.
 如来之子1年前2
如来之子1年前2 -
 三千零一万 共回答了17个问题
三千零一万 共回答了17个问题 |采纳率82.4%讲授“比例尺”时,可以介绍按“比例尺”计算“图上距离”或“实际距离”,以及按“比例尺”绘制图纸,在建筑、科研、军事等方面的重要作用等等.
由已知我们可以得到:顺水和逆水航行同一路程的时间比是3:5
因为在一个小时内需要往返 则路程相等 所以在这一个小时内的它们的时间比还是3:5
所以 60*3/3+5=60*3/8=22.5 也就是说在22分30秒的时候就要返回!1年前查看全部
- 一种镁电池的反应为:xMg+Mo3S4=MgxMo3S4,正向放电,逆向充电.放电时,下列说法错误的是:
一种镁电池的反应为:xMg+Mo3S4=MgxMo3S4,正向放电,逆向充电.放电时,下列说法错误的是:
a.Mo3S4发生还原反应
b.正极反应反应式为:Mo3S4+2e-=(Mo3S4)2-
c.Mg2+向正极迁移
d.负极反应反应式为:xMg2+ -2xe- =xMg2+
请说说如何判断,不太懂. 独恋WB1年前1
独恋WB1年前1 -
 07年9月28日 共回答了15个问题
07年9月28日 共回答了15个问题 |采纳率86.7%答案选A
在该反应中,正向放电,作是原电池,逆向充电,是电解池.
在原电池反应中,Mg作负极失去电子,四硫化三钼作正极得到电子,故B、D正确
在负极发生反应的Mg生成的镁离子会转移到正极与正极电离的离子中和使得电荷守恒,同时也形成闭合的回路.
然而A选项中,错在Mo3S4发生的是氧化反应,而不是还原反应.在原电池中,负极失去电子
,化合价升高,发生还原反应,正极得电子,化合价降低,发生氧化反应.所以说A选项是错的1年前查看全部
- 同底数幂除法法则的逆向使用,已知a^m-n=20,a^n=4,那么a^m=-------已知x^m=4,x^n=9,那么
同底数幂除法法则的逆向使用,
已知a^m-n=20,a^n=4,那么a^m=-------
已知x^m=4,x^n=9,那么x^(3m-2n)=-------- yi8hkhjegw1年前1
yi8hkhjegw1年前1 -
 铁印 共回答了14个问题
铁印 共回答了14个问题 |采纳率100%1)
∵a^(m-n)=a^m/a^n=20
∴a^m=20*a^n
又a^n=4
∴a^m=20*4=80
(2)
∵x^m=4,x^n=9,
∴x^(3m-2n)
=x^(3m)/x^(2n)
=(x^m)^3/(x^n)2
=4^3/9^2
=64/811年前查看全部
- 关于化学的平衡移动比如一个式子 A+B=C 如果要让A的浓度减小 不应该是正向消耗掉他么 为什么有时候要逆向使他增大 什
关于化学的平衡移动
比如一个式子 A+B=C 如果要让A的浓度减小 不应该是正向消耗掉他么 为什么有时候要逆向使他增大 什么时候是正向减小 什么时候要“对着干”让他增大 还有吗1年前3
还有吗1年前3 -
 zzuzhumj 共回答了18个问题
zzuzhumj 共回答了18个问题 |采纳率88.9%你在这里需要分清一些概念,浓度减小,那么c=n/V,如果恒容,那么物质的量减小就行,那么只需要改变温度,使得反应正向移动即可,或者抽取部分产物,使得反应正向移动;
也可以改变体积,比如增加体积,那么A的浓度就减小;
题目中还会出现体积分数,转化率等,你一定要通过计算的原始公式来看,不要简单凭感觉;1年前查看全部
- 什么叫做平衡的移动?什么叫正向移动?什么叫逆向移动?增大反应物的浓度,平衡一定移动吗?
 停止de旋律1年前1
停止de旋律1年前1 -
 超女大本营 共回答了16个问题
超女大本营 共回答了16个问题 |采纳率100%正向移动:V正>V逆 反应物浓度减小,生成物浓度增大
逆向移动:V正1年前查看全部
- 奥斯特发现电流周围存在磁场,于是科学家用逆向思维提出一个新问题,是什么?
 SANG杰1年前4
SANG杰1年前4 -
 清风鸣月 共回答了15个问题
清风鸣月 共回答了15个问题 |采纳率93.3%磁生电1年前查看全部
- 主要想知道逆向求导方法.比如这个题怎么做:∫上面1下面0,√(4-x^2)注意,这只是例题,主要想知道这类题的方法例题做
主要想知道逆向求导方法.
比如这个题怎么做:∫上面1下面0,√(4-x^2)
注意,这只是例题,主要想知道这类题的方法
例题做一下……还要方法……7都不到位啊,我说9这种题的方法,别打广告啊 地铁ll1年前1
地铁ll1年前1 -
 pzyzy911 共回答了18个问题
pzyzy911 共回答了18个问题 |采纳率100%这道题主要考积分的几何意义——积分上下限和图像以及x轴围成图形的面积(有正负之分)
直接通过作图法即可求得结果 被积式是上半圆的函数表达式一个扇形面积加一个三角形面积 1/2*π/6*2^2+1/2*√3*1=π/3+√3/2 (其实这题也是可以用三角代换做的不过没这个直观而且计算挺复杂,就不介绍了,到大学会详细学习这种方法)
做到这类题找不到原函数(求导前的函数)就想一想它的几何意义!1年前查看全部
- 动量定理,大一ABl两船在平静的湖面上平行逆向航行,当两船擦肩相遇时,两船各自向对方平稳的传递50重物,结果A船停下来,
动量定理,大一
ABl两船在平静的湖面上平行逆向航行,当两船擦肩相遇时,两船各自向对方平稳的传递50重物,结果A船停下来,B船以3.4m/s速度向前驶去,AB原有质量分别为500,1000,求传递前两船的速度. A dong1年前1
A dong1年前1 -
 找个女友享受生活 共回答了17个问题
找个女友享受生活 共回答了17个问题 |采纳率88.2%设传递前两船的速度为v1,v2
500v1-1000v2=-3.4*1000
450v1-50v2=0
解得:v1=34/85m/s,v2=9v11年前查看全部
- 醋酸在水中电离后的电力平衡常数为K,加入盐酸,氢离子浓度增加了,醋酸电离平衡逆向移动
醋酸在水中电离后的电力平衡常数为K,加入盐酸,氢离子浓度增加了,醋酸电离平衡逆向移动
逆向移动使得醋酸电离程度改变,但是为什么加入盐酸前后醋酸的电离平衡常数不变?电离平衡常数不是表示电离程度吗 renbang791年前2
renbang791年前2 -
 goldwater1 共回答了17个问题
goldwater1 共回答了17个问题 |采纳率94.1%1
逆向移动使得醋酸电离程度改变 这句话是对的
因为电离度(α)= (已电离弱电解质分子数/原弱电解质总的分子数)平衡逆向移动 电离的减少 分母不变 所以减小了 当然会改变了
2
但是为什么加入盐酸前后醋酸的电离平衡常数不变?
从以下两个方面分别理解
第一 平衡常数是一个和温度压强相关的物理量 高中阶段我们仅认为和温度有关 所以你改变浓度对它没有影响
第二 平衡常数的表达式K=[CH3COO-]*[H+]/[CH3COOH] 现在平衡移动
【H+】随着加盐酸在增大 平衡逆向移动【CH3COO-】减小【CH3COOH】在增加 现在你的平衡常数分子分母都在改变 你怎么能够判断最终K是增大的?还是减小的 其实根据数据计算 事实上是不变的
3
电离平衡常 和 电离程度
电离度看 1 是弱电解质电离的程度 它和浓度有关
电离平衡常数就是反映出了 电离进行的程度 条件一定之后 仅仅和温度有关 改变浓度和K无关 他表示了这种电解质在这个温度的电离程度 (你可以根据化学平衡常数来结合理解) 他是一个弱电解质本身的属性~
K 和浓度无关 但是可以用浓度来计算 就和物理上的 重力加速度g差不多 仅仅和纬度有关与质量无关 但是我们可以用Mg=F来计算1年前查看全部
- 光速不变求解两艘宇宙飞船,速度都是V,一艘和光同向,一艘逆向,为什么测出的光速都是C?请列出详细证明过程
 39371511年前7
39371511年前7 -
 pingod 共回答了17个问题
pingod 共回答了17个问题 |采纳率100%光速不变是一个原理,比较基本,好比牛顿第一定律,像长度收缩,时间膨胀都要依据它才能推出,也可以靠这些结论反推光速不变.利用几个由光速不变推出的式子反推一下不就OK了吗?当然这样做对问题本质的理解并无价值(仅仅在式子间绕圈圈过家家).爱因斯坦当初靠直觉就认为光速不变,一个比较主要的原因是他对麦克斯韦理论等的比较深入的思考(麦克斯韦理论说光速为定值,如果要真正理解爱因斯坦怎么会假定光速不变,是要涉及这个理论的,当然也靠他对物理基本概念的比较透彻的思考,深刻的思考使他找出了人们日常有关时空思维的逻辑漏洞).所以,光速为何为C?主要是要理解人们为何能提出它并坚定认为这是正确的,而不是仅仅在绕式子过家家.所以你要了解历史上物理学的一些创造理论的过程,何以他们思维之所以使然,那才是本质的,真正有用的.Well,ok?1年前查看全部
- 化学平衡常数K受什么影响?记得老师说是只与温度有关,但是课本上是说:改变浓度,若Q>K,平衡逆向移动;若Q<K,平衡正向
化学平衡常数K受什么影响?
记得老师说是只与温度有关,但是课本上是说:改变浓度,若Q>K,平衡逆向移动;若Q<K,平衡正向移动.改变压强,若Q>K,平衡逆向移动;Q<K,平衡正向自动.升高温度,有利于平衡向吸热方向移动.Why?
 我不是格罗索1年前1
我不是格罗索1年前1 -
 adyduu 共回答了19个问题
adyduu 共回答了19个问题 |采纳率94.7%只受温度和反应内在机理影响.Q为浓度熵,只是通过Q来判断反应是正向还是逆向进行,只是人为判断工具,不影响K值.1年前查看全部
- 在反应Fecl3+3K(SCN)3=Fe(SCN)3+3KCl中,加KCl(aq),平衡逆向移动
在反应Fecl3+3K(SCN)3=Fe(SCN)3+3KCl中,加KCl(aq),平衡逆向移动
老师上课时说,加溶液相当于加水,浓度变小,逆向移动.可是为什么浓度变小,逆向移动?在其他反应中,浓度变小,平衡一定逆向移动吗? tie7kghe3i1年前1
tie7kghe3i1年前1 -
 紫天菲 共回答了12个问题
紫天菲 共回答了12个问题 |采纳率100%越稀越电离... 当然如果弱电解质在反应物这边的话那肯定就是正向移动了啊1年前查看全部
- 求写逆向思维作文的开头和结尾 要有点文学色彩
 yoyorizhao1年前1
yoyorizhao1年前1 -
 zhang1c 共回答了22个问题
zhang1c 共回答了22个问题 |采纳率86.4%比如人们常说:人定胜天!
但我不这么认为.风云变幻,海啸山洪,干旱地震.试问人定胜个试试.
其实人在自然、宇宙面前很渺小,只是其中的一个微小元素.
我们对待自然的态度不是要战胜,而是要有敬畏、关爱之心1年前查看全部
- 400米环形跑道,甲乙二人,V甲〉V乙 同向跑3分钟20秒相遇 逆向跑40秒相遇 求V甲,限定一
400米环形跑道,甲乙二人,V甲〉V乙 同向跑3分钟20秒相遇 逆向跑40秒相遇 求V甲,限定一
400米环形跑道,甲乙二人,V甲〉V乙 同向跑3分钟20秒相遇 逆向跑40秒相遇 求V甲,限定一元一次方程 RoseVis1年前0
RoseVis1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1你知道蝙蝠是什么动物它有什么特点吗
- 2某菜农为提高大棚内蔬菜的产量,向大棚内施加气肥,你认为气肥的主要成分应该是( )
- 3123456可以用什么来表示呢
- 4太阳是人类的“能源之母”,太阳能属于______(填“可”或“不可”) 再生能源.小明家的太阳能热水器每天得到
- 5电能表上标有“220V 2.5(10)A 1500r/KWh”将电灯泡和电能表接好后,发现在4分钟内,电能表转了10转,
- 6let me have a book
- 7一到十数字开头成语接龙急`````有答案的马上来啊
- 8We bought some food as gift 后面是to friend还是for friend
- 9计算(x-8y)(x-y)-(x+y)的平凡
- 10(2012•民乐县模拟)在一个直角三角形中,最大角与最小角的度数比是5:1,最小角是______度.
- 11两只灯泡串联在电路中,其中一只亮,另一只不亮,这原因可能是
- 12宣州谢佻楼饯别校书叔云(李白)
- 13你既不是王子,也不是骑士,用英语怎么说
- 141.一个圆柱体的侧面展开是一个边长是8cm的正方形.这个圆柱的侧面积是( )平方厘米.
- 15“盛”字 第五笔的笔画名称是什么?
