1mol水在100°C和101.325kPa向真空蒸发,变成100°C和101.325kPa的水蒸气,试计算此过程的体系
 宽阔居士2022-10-04 11:39:541条回答
宽阔居士2022-10-04 11:39:541条回答
1mol水在100°C和101.325kPa向真空蒸发,变成100°C和101.325kPa的水蒸气,试计算此过程的体系的熵的差,环境的熵的差,并判断此过程是否自发.

已提交,审核后显示!提交回复
共1条回复
 寄生人11 共回答了23个问题
寄生人11 共回答了23个问题 |采纳率95.7%- 1、这个过程的始末态与大气环境中的水沸腾,液气相变一致,所以计算沸腾过程的相变熵就可以了.具体是相变焓/沸点.数据应该有的查,或者题目给.
2、这个过程的体系吉布斯函数变为0,因为始末态和大气中的相变一致,所以是两相平衡,为0.
3、真空膨胀,与沸点时的可逆相变相比,不做膨胀功,系统吸热少.环境放热与系统吸热一致,数值减小,环境熵变为负,但绝对值小,相比沸点时反抗大气膨胀,熵变数值(都是负数,但真空膨胀绝对直小,所以代数上说,数值就大)要大.计算结果应该是熵变大于0,也就是自发 - 1年前
相关推荐
- 在室温下,某盛氧气钢筒氧气压力为537.02kPa,若提用160立方厘米(在101.325KPa下占的体积)的氧气后,筒
在室温下,某盛氧气钢筒氧气压力为537.02kPa,若提用160立方厘米(在101.325KPa下占的体积)的氧气后,筒内压力降为131.72kPa,设温度不变,试用理想气体状态方程估计钢筒的体积?
 fukai3201年前3
fukai3201年前3 -
 艾乔儿 共回答了13个问题
艾乔儿 共回答了13个问题 |采纳率92.3%钢筒的体积为V
131.72*V+101.325*160=537.02*V
405.75V=16212
V=40(立方厘米)1年前查看全部
- 氢气被水蒸气饱和是什么意思那现在已知25℃、101.325KPa时水的饱和蒸汽压为23mmHg。则将2mol H2饱和需
氢气被水蒸气饱和是什么意思
那现在已知25℃、101.325KPa时水的饱和蒸汽压为23mmHg。则将2mol H2饱和需要多少mol 水蒸气呢?怎么计算? 夜梦孤星1年前2
夜梦孤星1年前2 -
 fkfn 共回答了19个问题
fkfn 共回答了19个问题 |采纳率89.5%氢气被水蒸气饱和也就是特定条件下,氢气在水蒸气中的溶解度达到了浓度平衡----氢气溶解在水蒸气的最大溶解度!1年前查看全部
- .25kpa反抗101.325kpa的外压恒温膨胀变化到101.325kpa,求体系做的体积功,
 黄牛是什么颜色滴1年前2
黄牛是什么颜色滴1年前2 -
 於菟YY 共回答了19个问题
於菟YY 共回答了19个问题 |采纳率94.7%体积功=恒外压乘以体积变化.
首先计算25Kpa某体积的气体碰撞到101.325KPA时,体积的变化,再乘以恒外压即可.1年前查看全部
- 1mol理想气体其始态为27度 1013.25kpa,经恒温可逆膨胀到101.325kpa,W,△U,△H,△S!
 zxqer1年前1
zxqer1年前1 -
 weijiabin 共回答了21个问题
weijiabin 共回答了21个问题 |采纳率90.5%这个公式可供参考,孩子,我只能帮你到这了
W=-nRTln(V2/V1)
Q=-W
△U=0
△H=0
△S=Q/T1年前查看全部
- 一道有关化学热力学初步的题求解在101.325kPa和353.25K条件下,苯的气化热为30.50 kJ·mol-1.在
一道有关化学热力学初步的题求解
在101.325kPa和353.25K条件下,苯的气化热为30.50 kJ·mol-1.在此条件下,若1mol的苯完全气化,此过程的W、△rUm、△rHm、△rSm、△rGm各为多少?
谢谢了~ richard_9111年前1
richard_9111年前1 -
 茶叶不跳舞 共回答了23个问题
茶叶不跳舞 共回答了23个问题 |采纳率91.3%在已知的温度和压强下,这个过程为可逆相变.
等温等压下,Q = △rHm = 1*30.50 = 30.50kJ·mol-1
可逆过程,所以 △rSm = Q/T = 30.50/353.25 = 86.34J/mol·K
等温等压无非体积功的可逆过程,所以 △rGm = 0
由理想气体状态方程,计算出气化后,苯的体积 = 0.029 m^3
如果忽略液体的体积,那么W = -P*V = -2936.9 J
则△rUm = Q + W = 27.56 kJ·mol-11年前查看全部
- 请老师们赐教!1molCO(g,理想气体)在25度、101.325kpa时,被506.63kPa的环境压力压缩到200度
请老师们赐教!
1molCO(g,理想气体)在25度、101.325kpa时,被506.63kPa的环境压力压缩到200度的最终状态,求此过程的Q、W、U、H、S.已知Co(g)的cp,m=3.5R
希望老师能说的详细点,我不太懂. 骘天子_cc1年前1
骘天子_cc1年前1 -
 艾力克斯 共回答了22个问题
艾力克斯 共回答了22个问题 |采纳率90.9%PV=NRT先算出25℃,101.325Kpa时的体积V1
然后再把等压升温到200℃时的体积V2
W=-P(V2-V1) (P=506.63Kpa)
从你给的条件看此压缩应该是等压压缩,由Cpm-Cvm=R可得Cvm=2.5R
∴Cvm*△T U=Q+W可以得到 Q,W,U. Cpm*△T可以得到H
这样代入数据就可已得到S1年前查看全部
- 水沸腾时的蒸气压为101.325kpa吗?
 冬天的芷桦1年前1
冬天的芷桦1年前1 -
 Tomaths 共回答了11个问题
Tomaths 共回答了11个问题 |采纳率100%回答这个问题时,还必须考虑温度的因素;如果没有条件,只能判它错了.1年前查看全部
- 在101.325kpa压力下,将2mol 90℃的H2O(L)与1mol 20℃的H2O(L)在一绝热容器中混合,
在101.325kpa压力下,将2mol 90℃的H2O(L)与1mol 20℃的H2O(L)在一绝热容器中混合,
A.△S>0 B.△S=0 C.△S frankcathy1年前1
frankcathy1年前1 -
 xiaobao008 共回答了21个问题
xiaobao008 共回答了21个问题 |采纳率95.2%选B水的状态不变,都是液态,所以混乱度不变.给个采纳呗,谢啦1年前查看全部
- 问一个关于沸腾的问题水在100℃时,其饱和蒸汽压为101.325kPa;乙醇在78.4℃时,其饱和蒸汽压为101.325
问一个关于沸腾的问题
水在100℃时,其饱和蒸汽压为101.325kPa;乙醇在78.4℃时,其饱和蒸汽压为101.325kPa;苯在80.1℃时,其饱和蒸汽压为101.325kPa.
也就是说饱和蒸汽压达到一定值时,液体便会沸腾
为什么恰恰好将温度提升到某种液体饱和蒸汽压达到这个定值的时候,这个液体的温度就不能继续升高呢? zhangxu241年前1
zhangxu241年前1 -
 夜静星语 共回答了18个问题
夜静星语 共回答了18个问题 |采纳率94.4%饱和蒸汽压就是汽化和液化的速度相同时的气体压强.通常要在一个封闭的容器中才能达到饱和状态.此时能够感受到的就是不蒸发了.
1、任何温度下都对应一个饱和蒸汽压.不是只有在沸腾的时候才会有饱和蒸汽压.
2、不是在那个气压下一定会沸腾,而是沸腾时对应一个饱和气压.
3、为什么恰恰好将温度提升到某种液体饱和蒸汽压达到这个定值的时候,这个液体的温度就不能继续升高呢?这个说法也不对,不是不能升高了,而是温度再升高,饱和蒸汽压也在升高.应该说要保持一定的饱和蒸汽压,这个温度是确定的.
你的问题是概念不清楚.这样回答你能不能明白了?
亲,请不要忘记及时采纳.有问题另行提问,1年前查看全部
- 在0℃及101.325kPa上,纯干空气密度为1.293*10的负三次方g?m的负三次,试求空气的表观摩尔质量;
在0℃及101.325kPa上,纯干空气密度为1.293*10的负三次方g?m的负三次,试求空气的表观摩尔质量;
在0℃及101.325kPa上,纯干空气密度为1.293*10的负三次方g·m的负三次,试求空气的表观摩尔质量; toomt1231年前1
toomt1231年前1 -
 hljgaochen 共回答了6个问题
hljgaochen 共回答了6个问题 |采纳率83.3%V(标)=22.4 L/molM(空气)=22.4(L/mol)X1.293X10^-3(g/m-3)=22.4(L/mol)X1.293(g/L)=28.96 g/mol1年前查看全部
- 水摩尔蒸发焓为42.37KJ/mol,373.15K时水饱和蒸汽压为101.325Kpa,则355.1K时水饱和蒸汽压
 zk198211年前3
zk198211年前3 -
 重复注册 共回答了16个问题
重复注册 共回答了16个问题 |采纳率100%dP/dT=焓变/T²克劳修斯克拉佩龙方程.定积分适用于有气相的两相平衡.手机码字不容易.1年前查看全部
- 1.在298K及101.325kPa下发生下列反应:(1).2H2(g)+O2(g)→H2O(l);(2).CaO(s)
1.在298K及101.325kPa下发生下列反应:(1).2H2(g)+O2(g)→H2O(l);(2).CaO(s)+CO2(g)→CaCO3(s),则下列情况中正确的是( ).
A.△S(1)>0,△S(2)>0.
B.△S(1) 印本1年前1
印本1年前1 -
 道明寺321 共回答了14个问题
道明寺321 共回答了14个问题 |采纳率85.7%两个都应该是小于0
因为都是从气态变到固态,熵是减少的1年前查看全部
- 原题如下:已知水(H2O,l)在100摄氏度的饱和蒸汽压为101.325KPa,在此温度、压力下的摩尔蒸发焓为40.66
原题如下:
已知水(H2O,l)在100摄氏度的饱和蒸汽压为101.325KPa,在此温度、压力下的摩尔蒸发焓为40.668KJ/mol.设水蒸气适用于理想气体状态方程.
(1)求在100摄氏度、101.325KPa下,使2mol液体水全部蒸发成水蒸气时的Q、W、ΔH,ΔU,ΔS.(2)若上述过程在真空容器中进行,始末状态与上述工程相同,计算过程的Q,W,ΔG.
真空膨胀的过程是不可逆过程,真空膨胀是否绝热,ΔG用那个公式,还请讲解. yxfeng1年前2
yxfeng1年前2 -
 然现 共回答了18个问题
然现 共回答了18个问题 |采纳率88.9%刚才我给你发信息了,你看看吧.只要记住一点,状态函数的改变值只与始末状态有关,与所经历的具体途径无关.所以两问的始末状态相同,则ΔH,ΔU,ΔS,ΔG就相同,而不管是什么样的具体过程,第一问中显然是可逆相变,所以ΔG=0,那么第二问的ΔG也为0.Q,W不是状态函数,所以与过程有关,但ΔU=Q+W,真空容器中外压P=0,所以做功W=0,因此Q=ΔU.1年前查看全部
- 将10℃、101.325kPa的1mol H2O(l)变为100℃、10.13kPa的H2O(g),求此过程的熵变ΔS.
将10℃、101.325kPa的1mol H2O(l)变为100℃、10.13kPa的H2O(g),求此过程的熵变ΔS.已知Cp,m(H2O,l
将10℃、101.325kPa的1mol H2O(l)变为100℃、10.13kPa的H2O(g),求此过程的熵变ΔS。已知Cp,m(H2O,l)=75.31 J.K-1.mol-1,100℃、101.325kPa下ΔvapHm(H2O)=40.63 kJ.mol-1。 小Qoo1年前1
小Qoo1年前1 -
 李蓝天 共回答了14个问题
李蓝天 共回答了14个问题 |采纳率92.9%这个文题你去看看物理化学课本上的例题就知道怎么做了!1年前查看全部
- 1mol,0℃,101.325kPa的单原子理想气体(Cp,m=5/2R)经一可逆过程,体积增加一倍,ΔH=2092J,
1mol,0℃,101.325kPa的单原子理想气体(Cp,m=5/2R)经一可逆过程,体积增加一倍,ΔH=2092J,Q=1674J.计算末态温度,压力及过程ΔU和W.
俺学艺不精,还请各位指教 zrs_01811年前1
zrs_01811年前1 -
 magic_cookies 共回答了19个问题
magic_cookies 共回答了19个问题 |采纳率78.9%1)求 T2
因为 ΔH=n×Cp,m×△T
所以 2092=1×(5/2)×8.3145×△T
求得 △T=100.64 K
即 T2=100.64+273.15=373.79 K
2)求压力 P2
根据 P1V1/T1=P2V2/T2
得 P2=(V1/V2)(T2/T1)P1=(1/2)(373.79/273.15)×101325=69328.71 Pa
3)求 △U 和 W
因为 Cp,m-Cv,m=R 得 Cv,m=5/2R-R=3/2R
所以 △U=nCv,m△T=1×(3/2)×8.3145×100.64=1255.16 J
又 Q=△U+W 得 W=1674-1255.16=418.84 J1年前查看全部
- 1mol理想气体在300.2 K时从1013.25kPa恒温可逆膨胀到101.325kPa,试求:(1)、 U、 H、
1mol理想气体在300.2 K时从1013.25kPa恒温可逆膨胀到101.325kPa,试求:(1)、 U、 H、 A、 G、 S、Q、W
 cchust-tj1年前1
cchust-tj1年前1 -
 冰儿是我 共回答了13个问题
冰儿是我 共回答了13个问题 |采纳率92.3%理想气体,恒温,则U变=H变=0
U=Q+W,所以Q=-W,W=-PdV=-nrt/v dv=-nrtln(v2/v1)=-nrtln(p1/p2)=nrtln(p2/p1)
S=Q/T=-W/T=-NRTLN(P2/P1)/T=NRLN(P1/P2)
A=U+TS
G=H+TS
把数据代进去,就可以求出来了1年前查看全部
- 氢气热值比甲烷低?为什么?101.325kpa,273.15k的状态下,甲烷的高热值是39829KJ/m3低热值是358
氢气热值比甲烷低?为什么?
101.325kpa,273.15k的状态下,甲烷的高热值是39829KJ/m3低热值是35807KJ/m3,氢气的高热值12789KJ/m3,低热值是10779KJ/m3. szzpf1年前3
szzpf1年前3 -
 qiulin520 共回答了20个问题
qiulin520 共回答了20个问题 |采纳率90%用碳和氢气合成甲烷的反应,通过标准摩尔生成焓的计算可以得出ΔH>0,即这个反应是个吸热反应,所以甲烷的热值比氢气高1年前查看全部
- 在压力为101.325KPA,温度为293.15K,氧浓度为21%,空气罐里,问氧气的质量怎么计算?往罐里通入氧气很少的
在压力为101.325KPA,温度为293.15K,氧浓度为21%,空气罐里,问氧气的质量怎么计算?往罐里通入氧气很少的氧气使压力为200kpa,温度为293.15kpa,氧浓度为42%,问通入氧气量怎样计算,使多少?
空气罐的体积为1立方米, Sanbin1年前1
Sanbin1年前1 -
 cqpengxun 共回答了20个问题
cqpengxun 共回答了20个问题 |采纳率95%压力为101.325KPA,温度为293.15K就是标准状况嘛 空气的相对分子质量是29
你空气的量都没讲怎么算氧气的质量啊
标准状况下氧气质量就是空气质量乘以21%
2.设原有空气质量为a ,通入氧气质量为b
则有(21%a+b)/a+b=42%
42(a+b)=21a+100b
21a=58b
b=21/58a1年前查看全部
- 298K,101.325kPa,1mol苯和1mol甲苯混合为理想溶液,求混合过程的焓变和熵变?
 鱼儿不xx1年前1
鱼儿不xx1年前1 -
 milo1111111 共回答了14个问题
milo1111111 共回答了14个问题 |采纳率71.4%根据理想液态混合过程中,系统的焓不发生变化,所以△H=0
x苯=x甲苯=0.5
△S=-R(n苯lnx苯+n甲岑lnx甲苯)=-8.314×(1×ln0.5+1×1×ln0.5)=11.47J/K1年前查看全部
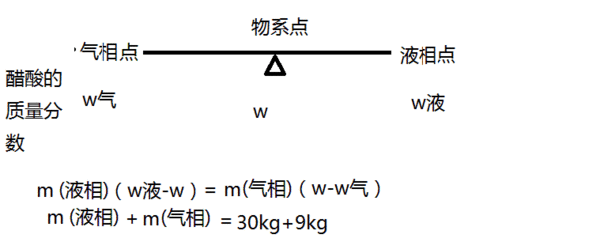
- 6.(10 分)在101.325kPa 下,9.0kg 的水和30.0kg 的醋酸形成的液态混合物加热到105°C,
6.(10 分)在101.325kPa 下,9.0kg 的水和30.0kg 的醋酸形成的液态混合物加热到105°C,
达到气液两相平衡,气相组成y(醋酸)=0.417,液相组成x(醋酸)=0.544.试求气液
两相的质量各为多少千克? 只说实话地偶1年前1
只说实话地偶1年前1 -
 猪仔大雄 共回答了19个问题
猪仔大雄 共回答了19个问题 |采纳率84.2%1年前查看全部
- 一道高中化学必修二的计算题有机物A在101.325KPA.227摄氏度时体积为2.6L,与同一状况下5.2L氧气混合后点
一道高中化学必修二的计算题
有机物A在101.325KPA.227摄氏度时体积为2.6L,与同一状况下5.2L氧气混合后点燃,恰好完全反应,生成二氧化碳和水蒸汽,燃烧后体积增大了2.6L,在使产物通过浓硫酸,气体体积减少一半(体积均在同一状况下测定),试确定A的分子式.
要有解题过程,不要只有答案
 郁兮1年前1
郁兮1年前1 -
 ggmm 共回答了16个问题
ggmm 共回答了16个问题 |采纳率100%体积均在同一状况下测定,所以不考虑体积与温度变化,只是水为气态,因此,气体体积减少一半,为水,即产物中CO2与H2O的物质的量比为1:1
因为2.6LA~5.2L氧气~5.2LCO2~5.2LH2O
所以1A~2O2~2CO2~2H2O
A=2CO2+2H2O-2O2=C2H4O21年前查看全部
- 一密闭刚性容器中充满了空气,并有少量水存在.当容器在300K条件下达到平衡时,容器内压力为101.325kPa.若把该容
一密闭刚性容器中充满了空气,并有少量水存在.当容器在300K条件下达到平衡时,容器内压力为101.325kPa.若把该容器移至373.15K的沸水中,试求容器达到新的平衡时应有的压力.设容器中始终有水存在,且可忽略水的体积的任何变化.已知300K时水的饱和蒸汽压为3.567kPa.希望详细一点,
 明天就回来1年前1
明天就回来1年前1 -
 gysfjzj 共回答了16个问题
gysfjzj 共回答了16个问题 |采纳率81.3%P1V1/T1=P2V2/T2, 式中V1=V2, P1=101.325kPa ,T1=300K T2= 373.15K, 求的,P2=126.314 kPa; P2-3.567=122.464 kPa; 答案应该是: 122.464 kPa;
说错了您别笑话我.谢谢!1年前查看全部
- 1摩尔理想气体于27摄氏度,101.325KPa状态下受某恒定外压力恒温压缩到平衡,再由该状态等容升温至97摄氏度,则压
1摩尔理想气体于27摄氏度,101.325KPa状态下受某恒定外压力恒温压缩到平衡,再由该状态等容升温至97摄氏度,则压力升到1013.25KPa求整个过程的Q.W,摩尔定压热容恒为20.92
 骆驼巷子1年前1
骆驼巷子1年前1 -
 沁梨 共回答了20个问题
沁梨 共回答了20个问题 |采纳率90%这不是属于高中化学,应属于大学物理内容1年前查看全部
- 普通化学求答案有450g水蒸气在101.325kPa和100摄氏度的条件下凝结成水.已知水的蒸发热为2.26kJ每克,试
普通化学求答案
有450g水蒸气在101.325kPa和100摄氏度的条件下凝结成水.已知水的蒸发热为2.26kJ每克,试计算此过程的(1)W和Q(2)H和U的差值 倭们都用妇炎洁1年前1
倭们都用妇炎洁1年前1 -
 夏威夷日光 共回答了24个问题
夏威夷日光 共回答了24个问题 |采纳率75%H2O(g) = H2O(l)
水蒸气凝结成水放出热量,Q < 0,
Q = -2.26×450 = -1017(kJ)
w = -△nRT = -(0 - 450/18)×8.314×373 = 77.5(kJ)
△ U = -1017 + (77.5) = -939.5(kJ)
△H = qP = -1017(kJ)
可以采纳我的了吧1年前查看全部
- 设在洁净的空气中N2,O2和Ar的质量分数分别为0.755,0.232,和0.130,若大气的压力是101.325KPa
设在洁净的空气中N2,O2和Ar的质量分数分别为0.755,0.232,和0.130,若大气的压力是101.325KPa,试计算各气
 tzpwyy1年前1
tzpwyy1年前1 -
 CTTC 共回答了22个问题
CTTC 共回答了22个问题 |采纳率81.8%N2,O2和Ar的压力分别是101.325*0.755=76.5 KPa、101.325*0.232=23.5KPa、101.325*0.130=13.2KPa1年前查看全部
大家在问
- 112(x-100)-10x=100
- 2一列火车速度为54km/h,列车穿过一座长640m的隧道,用时57秒,求列车车长
- 3长80m,宽40m,湖面占25%求湖面周围的绿地面积.我要列式
- 4如果这块地长80m,宽40m,那么种上西红柿的面积是多少平方米
- 5两个数相除,商3余10,被除数、除数、商与余数的和是163,求被除数和除数.
- 6两个数相除,商3余10,被除数、除数、商与余数的和是163,求被除数和除数.
- 7有11个人围成一圈,依次编号1-11号,从1号起轮流表演节目,方法是:隔一个人表演一个节目,隔两个人表演一个
- 8初三科学竞赛题在天平的两端,各放一只等质量的烧杯,烧杯中盛放等质量等浓度的稀硫酸.像两只烧杯中分别放入一块镁片和铝片(均
- 9河岸上由一人在C点拉船,5米每秒现在已知河岸于睡眠垂直,且绳索BC为20m,C点距水面的垂直距离AC为12m,问8秒后船
- 10三角形应用题等腰三角形ABC,AB=AC,一腰上的中线BD将这个等腰三角形的周长分成21和12两部分,则此三角形的周长为
- 11恶 组词
- 12easy1.常见的非晶体有:(举出三例)2.物态变化时总需要〔 〕或( ).( )的物体( )增加,( )的物体( )减
- 13小明家五六月两个月的上网费共72元,6月份比5月份多了x元,5月份的上网费是多少元,6月份的上网费是多少元
- 14书店“十一”搞促销,每本科技书30元,买5本送1本,买8本送2本.
- 15A是质数,A+40,A+80也是质数,A是多少?