补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
 ekare2022-10-04 11:39:541条回答
ekare2022-10-04 11:39:541条回答| 补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤: ①配制0.01mol•L -1 、0.008mol•L -1 等一系列浓度的[Fe(SCN) 6 ] 3- (红色)标准比色液 ②样品处理  ③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10mL ④比色,直到与选取的标准颜色一致或相近即可. 试回答下列问题: (1)配制25mL0.01mol•L -1 标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:______,若配制过程中定容时俯视刻度会使配制的浓度______(填偏大、偏小、不影响). (2)步骤②脱色过程包括加入:______(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→______(填操作). (3)比色法确定待测液的浓度的原理是______ (4)已知有关离子的还原性顺序为I - >Fe 2+ >SCN - >Br - >Cl - ,则步骤②中Ⅲ可选择的氧化剂有______a.碘水b.溴水c.氯水d.通入(SCN) 2 ;写出加入上述某一氧化剂时涉及到的离子反应方程式:______ (5)若其补铁剂是由乳酸  与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:______. |

已提交,审核后显示!提交回复
共1条回复
 同是TY人 共回答了25个问题
同是TY人 共回答了25个问题 |采纳率96%- (1)反应操作步骤有量取、溶解、移液、洗涤、定容、摇匀等操作,首先用量筒量量取一定体积的溶液在烧杯中溶解,冷却后转移到25ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加;定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏大,
故答案为:25mL容量瓶、胶头滴管;偏大;
(2)活性炭具有吸附性,可用来脱色,具有漂白性,脱色后,活性炭不溶于水,可用过滤的方法分离,故答案为:活性炭;过滤;
(3)溶液浓度越大,颜色越深,故答案为:溶液颜色与物质的量浓度成正比;
(4)由于离子的还原性顺序为I - >Fe 2+ >SCN - >Br - >Cl - ,所以溴水、氯水能将亚铁离子氧化为铁离子.加入氯水反应的离子方程式为Cl 2 +2Fe 2+ =2Fe 3+ +2Cl - ,
故答案为:bc;Cl 2 +2Fe 2+ =2Fe 3+ +2Cl - ;
(5)该补铁剂为乳酸亚铁[CH 3 CH(OH)COO] 2 Fe,乳酸具有弱酸性,利用强酸制弱酸.所以盐酸与乳酸亚铁[CH 3 CH(OH)COO] 2 Fe生成乳酸和氯化亚铁,反应方程式为[CH 3 CH(OH)COO] 2 Fe+2HCl→2CH 3 CH(OH)COOH+FeCl 2 ,故答案为:[CH 3 CH(OH)COO] 2 Fe+2HCl→2CH 3 CH(OH)COOH+FeCl 2 . - 1年前
相关推荐
- “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验: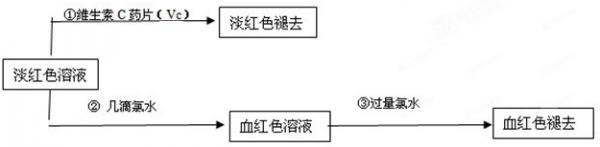
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是______,另一同学判断出错的原因是______.
(2)丙的实验①说明维生素C具有较强的______性(填“氧化”或“还原”).
(3)写出与丙的实验②中现象对应的离子反应方程式______;______
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe 3+ 结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN - 氧化了.请你设计一个实验方案以确认哪种假设更合理______
(5)针对实验目的,本次实验尚未完成的任务是______. wolsey51年前1
wolsey51年前1 -
 夺命小书生 共回答了20个问题
夺命小书生 共回答了20个问题 |采纳率90%(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理,故答案是:乙; 亚铁盐在空气中易被氧气氧化;(2)由于...1年前查看全部
- 初中化学题乳酸亚铁{化学式为(C3H5O3)2Fe,溶于水可电离出乳酸跟离子和亚铁离子}是常见补铁剂中的有效成分(其他成
初中化学题
乳酸亚铁{化学式为(C3H5O3)2Fe,溶于水可电离出乳酸跟离子和亚铁离子}是常见补铁剂中的有效成分(其他成分不含铁),某实验小组为测定补铁剂中铁的质量分数,采用了如下的实验步骤:
第一步:取10克补铁剂,在酸性条件下用双氧水把乳酸亚铁全部氧化成乳酸铁;
第二步:加入足量氨水和乳酸铁反应,观察到溶液中出现红褐色絮状沉淀,反应的化学方程式为:3NH3+3H2O+(C3H5O3)2Fe=====Fe(OH)3下箭头+3C3H5O3NH4
第三步:过滤、洗涤、干燥后得到纯净的沉淀,充分加热后未见明显的颜色变化,但称得质量减少了0.27克,则该补铁剂中铁的质量分数为
答案是5.6%,我一下子没想到好的方法,问一下大家如何计算?
请大家速度解答,明天要上交的 红树林重金属1年前1
红树林重金属1年前1 -
 yurong139 共回答了17个问题
yurong139 共回答了17个问题 |采纳率82.4%这个其实很简单的,加热沉淀的时候起的是分解反应,也就是2Fe(OH)3===加热===Fe2O3+3H2O。水在加热后被蒸发,因此减少的质量是水的质量。由方程式中各成分的比例可以求得分解后所剩余氧化铁的质量为0.8克,也就是含有的铁的质量为0.56克,因此质量分数为5.6%1年前查看全部
- (2008•鼓楼区二模)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上还是一种高效的补铁剂.长期以来民间流传着“菠菜根
(2008•鼓楼区二模)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上还是一种高效的补铁剂.长期以来民间流传着“菠菜根比菠菜茎叶更有营养”、“菠菜不能与豆腐同食”等说法.
某校化学兴趣小组的同学拟通过实验来探究以下问题:
(1)菠菜中是否含有丰富的铁.
(2)菠菜中是否含有某种酸类物质.
(3)菠菜根中铁的含量是否比菠菜茎和叶高.
(4)菠菜为什么与豆腐不能同食.
该小组同学通过上网查询,获得以下资料:
①菠菜中确实含有一种有机酸,其化学名称为乙二酸(化学式为C2H2O4),俗称草酸.②草酸的酸性比醋酸强.③豆腐中含有丰富的钙元素. ④草酸钙是一种无色晶体,不溶于水,是尿道结石的主要成分.⑤Fe2+遇氧化性物质能转化为Fe3+.⑥含Fe3+的溶液遇KSCN(硫氰化钾)溶液呈血红色,而含 Fe2+的溶液则不能.
该小组设计了如下实验方案:
实验Ⅰ: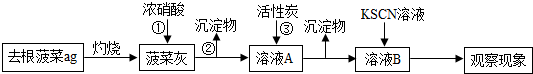
实验Ⅱ:
取有根菠菜ag使用相同仪器和试剂,重复实验Ⅰ的过程,观察现象时发现溶液B的红色比实验Ⅰ中得到的溶液红色深.
实验Ⅲ:
另将菠菜在少量开水中煮沸2~3分钟,滤去菠菜,得滤液C.向滤液C中加入足量的Ca(OH)2溶液,再加入足量的醋酸,观察现象.
请回答下列问题:
(1)操作①中加入的浓硝酸具有强氧化性.由此推知溶液A中含有Fe3+Fe3+(填“Fe2+”或“Fe3+”).操作②的名称为过滤过滤,操作过程中所需使用的玻璃仪器有烧杯烧杯、玻璃棒玻璃棒、漏斗漏斗.
(2)操作③中加入活性炭的作用吸附水中的可溶性杂质吸附水中的可溶性杂质.
(3)实验Ⅱ中得到的溶液B的红色比实验Ⅰ中溶液B的红色深,可以说明菠菜根中铁元素的含量与菠菜茎、叶相比高高(填“高”、“低”或“相同”).
(4)实验Ⅲ中向滤液C加入Ca(OH)2溶液后,再加入足量的醋酸,其目的是排除碳酸钙的干扰.若醋酸的化学式可用HAc表示,写出碳酸钙与醋酸发生反应的化学方程式CaCO3+2HAc═CaAc2+H2O+CO2↑CaCO3+2HAc═CaAc2+H2O+CO2↑.在加入醋酸后发现仍有不溶性物质存在,你认为该物质可能是草酸钙草酸钙,则菠菜中含有含有(选填“含有”、“不含有”或“无法证明”)草酸.
(5)试解释菠菜不能与豆腐同食的理由:与豆腐中含有丰富的钙反应产生草酸钙与豆腐中含有丰富的钙反应产生草酸钙. baojinhuei1年前1
baojinhuei1年前1 -
 蛮天飞 共回答了14个问题
蛮天飞 共回答了14个问题 |采纳率85.7%(1)菠菜中含有铁元素,浓硝酸具有强氧化性,可以将亚铁离子氧化为铁离子,通过操作②,得到了沉淀物和溶液,说明此步操作是过滤,在过滤操作中用到的玻璃仪器主要有烧杯、玻璃棒和漏斗,所以本题答案为:Fe3+,过滤,烧杯,玻璃棒,漏斗;
(2)活性炭具有吸附性,可以吸附水中的杂质,所以本题答案为:吸附水中的可溶性杂质;
(3)含Fe3+的溶液遇KSCN(硫氰化钾)溶液呈血红色,含量越高,则颜色越深,实验Ⅱ中得到的溶液B的红色比实验Ⅰ中溶液B的红色深,可以说明菠菜根中铁元素的含量与菠菜茎、叶相比要高,所以本题答案为:高;
(4)碳酸盐遇酸化气,故与醋酸反应后会生成二氧化碳,同时生成醋酸钠和水,由于草酸的酸性比醋酸强,所以草酸钙不会与醋酸反应,仍然会以沉淀的形式存在,所以本题答案为:CaCO3+2HAc═CaAc2+H2O+CO2↑,草酸钙,含有;
(5)通过题干提供的信息可以看出,菠菜中含有草酸,豆腐中含有丰富的钙元素,会结合生成不溶于水的草酸钙,所以本能同食,故本题答案为:与豆腐中含有丰富的钙反应产生草酸钙.1年前查看全部
- 富马酸铁是一种治疗贫血药物,能提高人体的抗应激能力和抗病能力,可用作补铁剂.
富马酸铁是一种治疗贫血药物,能提高人体的抗应激能力和抗病能力,可用作补铁剂.
(1)富马酸亚铁中的铁属于______(选填“常量”或“微量”)元素.
(2)富马酸亚铁(C4H2FeO4)中C、O元素的质量比为______.
(3)已知富马酸亚铁中铁元素的质量分数为33%,若每次服用1包该补铁剂(0.2g/包),摄入铁元素的质量为______mg. yz06161年前1
yz06161年前1 -
 swedrg2008 共回答了13个问题
swedrg2008 共回答了13个问题 |采纳率84.6%解题思路:(1)从人体中超过0.01%的元素称为常量元素,含量在0.01%以下的元素称为微量元素去分析解答;
(2)已知:碳元素的相对原子质量为:12,氧元素的相对原子质量为:16,富马酸亚铁(C4H2FeO4)中C、O元素的质量比为:(12×4):(16×4)=3:4去分析解答;
(3)由题意可知:1包该补铁剂中含有铁元素的质量为:0.2g×33%=0.066g=66mg;去分析解答;(1)人体中超过0.01%的元素称为常量元素,含量在0.01%以下的元素称为微量元素,铁属于微量元素;故答案为:微量;(2)已知:碳元素的相对原子质量为:12,氧元素的相对原子质量为:16,富马酸亚铁(C4H2FeO4)中C...
点评:
本题考点: 矿物质与微量元素;元素质量比的计算;混合物中某元素的质量计算.
考点点评: 学化学、用化学,学会用化学的眼光看社会,看生活.1年前查看全部
- (12分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(12分)“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色。
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色。学生甲由此断定“速力菲”的主要成分是三价铁盐。
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口。结果发现:溶液仅显示淡红色。乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐。
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验:
试完成下列问题:
(1)甲、乙两位同学的结论中比较正确的是________,另一同学的结论不合理的原因是
________________________。
(2)丙的实验①说明维生素C具有较强的________性(填“氧化”或“还原”)。
(3)写出与②中现象对应的离子反应方程式________________________________。
(4)关于③中的实验现象,丙同学提出了两种假设:一种是过量的双氧水与Fe 3 + 结合生成了某种稳定的新物质;另一种则是过量的双氧水将SCN - 氧化了。请你设计一个实验方案以确认哪种假设更合理________________________________。
(5)针对实验目的,本次实验尚未完成的任务是__________________。 mangder1年前1
mangder1年前1 -
 huanwen025 共回答了25个问题
huanwen025 共回答了25个问题 |采纳率96%(1)乙 亚铁盐在空气中易被氧气氧化
(2)还原
(3)2Fe 2 + +H 2 O 2 +2H + ===2Fe 3 + +2H 2 O Fe 3 + +3SCN - ===Fe(SCN) 3
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理
(5)未能测其成分
Fe 2 + 易被氧化成Fe 3 + ,H 2 O 2 具有较强的氧化性,维生素C药片具有较强的还原性,Fe 3 + 遇SCN - 显血红色。1年前查看全部
- 若每次服用1包该补铁剂,则摄入铁元素的质量为多少mg?知道的请马上回复,谢谢
若每次服用1包该补铁剂,则摄入铁元素的质量为多少mg?知道的请马上回复,谢谢
(计算结果取整数)问题补充:每包含富马酸亚铁0.2g,服用量:每次1-2包,成人) jinhong1年前2
jinhong1年前2 -
 以事实说话14 共回答了13个问题
以事实说话14 共回答了13个问题 |采纳率92.3%富马酸亚铁C4H2FeO4,每次服用1包该补铁剂,则摄入铁元素的质量为多少65.92mg1年前查看全部
- 为什么补铁剂一般都用亚铁盐如硫酸亚铁,而不用铁盐,如硫酸铁?
 yy栀子1年前4
yy栀子1年前4 -
 tongyi1969 共回答了22个问题
tongyi1969 共回答了22个问题 |采纳率90.9%铁是人体所必需的元素,为红细胞合成血红素必不可少的物质.吸收到骨髓的铁进入骨髓细胞,聚集到线粒体中与原卟啉结合形成血红素,血红素与球蛋白结合成为血红蛋白,进而发育为成熟的红细胞.缺铁时,血红素生成减少,红细胞中血红蛋白相应减少.
缺铁性贫血的最佳治疗方法就是补充铁剂.在众多的铁剂当中,硫酸亚铁由于其不良反应较少,且价格便宜,所以,目前为止它仍是治疗缺铁性贫血的基本药物.1年前查看全部
- 铁及其化合物在生活中应用广泛.(1)硫酸亚铁常作补铁剂,人体缺铁会造成
铁及其化合物在生活中应用广泛.
(1)硫酸亚铁常作补铁剂,人体缺铁会造成 (填字母序号).
A.骨质疏松 B.贫血 C.佝偻病 D.夜盲症
(2)铁制品长期使用容易生锈,铁生锈的条件是.在铁制品表面镀铬(Cr)可以防止铁生锈,工业上获取镀铬原料三氧化铬的化学反应方程式为:Na 2 Cr 2 O 7 +X=2CrO 3 +Na 2 SO 4 +H 2 O,其中X的化学式为 .
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验:
①小莉提出:上述实验中,省略某些实验也能达到目的.能被省略的实验是 (填字母序号).
②将反应后的废液倒入废液缸中,过滤,向所得滤液中加入铁粉,无气泡产生.则下列说法中,正确的是
(填字母序号).
A.一定含有硫酸锌 B.可能含有硫酸铜
C.滤渣中一定含有Fe、Cu D.滤渣中可能含有Zn、Fe、Cu. ii雄1年前1
ii雄1年前1 -
 ycq1127ycq 共回答了15个问题
ycq1127ycq 共回答了15个问题 |采纳率73.3%故答为:(1)B;(2)H 2 SO 4 ;(3)C;(4)①C;②AB.
1年前查看全部
- 菠菜是一种高效的补铁剂.长期以来民间流传有“菠菜不能与豆腐同食”、“菠菜
菠菜是一种高效的补铁剂.长期以来民间流传有“菠菜不能与豆腐同食”、“菠菜
根比菠菜茎叶更有营养”等说法.某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁?②菠菜是否含有草酸类物质?
③菠菜根中铁的含量是否比菠菜茎和叶的高?
该同学通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水.
他们设计的实验步骤如下:
Ⅰ.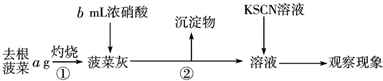
Ⅱ.取菠菜根a g使用相同仪器、试剂,重复Ⅰ中实验,观察实验现象.
Ⅲ.将菠菜在少量开水中煮沸2~3min,冷却后滤去菠菜,得滤液.向滤液中加入足量Ca(OH)2
溶液,然后再加入足量试剂X,观察现象.请回答以下问题:
(1)操作①中使用的仪器除三脚架、酒精灯、玻璃棒、坩埚钳、泥三角外还需要______,操作②的名称是______;
(2)可以说明菠菜中含Fe元素的现象是______;可以说明菠菜根中Fe元素含量要比菠菜茎叶中多的现象是______.
(3)菠菜中的Fe是+2价还是+3价?______;
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质.由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰.则X是______(写化学式),加入试剂X后观察到的现象是______.
(5)你认为“菠菜不能与豆腐同食”的原因是______. lazydayu1年前1
lazydayu1年前1 -
 leefengmin 共回答了15个问题
leefengmin 共回答了15个问题 |采纳率100%解题思路:(1)根据实验操作步骤①灼烧来分析选择用到的实验仪器,分离固液混合物用过滤;
(2)三价铁遇硫氰化钾显血红色;
(3)草酸有较强的还原性;
(4)草酸钙不与醋酸反应,也不溶于水;
(5)菠菜中含有草酸,豆腐中含有丰富的钙元素,会结合生成不溶于水的草酸钙.(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯;分离固液混合物用过滤,
故答案为:坩埚;过滤;
(2)三价铁遇硫氰化钾显血红色,浓度越大,红色越深,故答案为:步骤Ⅰ中得到溶液加KSCN后显的红色;步骤Ⅱ中得到溶液的红色比步骤Ⅰ中得到溶液的红色深;
(3)草酸有较强的还原性,能将三价铁还原,故菠菜中的铁为+2价,故答案为:+2价;
(4)碳酸盐遇酸化气,故与醋酸反应后会生成二氧化碳,同时生成醋酸钠和水,由于草酸的酸性比醋酸强,所以草酸钙不会与醋酸反应,仍然会以沉淀的形式存在,故答案为:CH3COOH;沉淀部分溶解;
(5)菠菜中含有草酸,豆腐中含有丰富的钙元素,会结合生成不溶于水的草酸钙,所以本能同食,故答案为:菠菜中的草酸与豆腐中的Ca2+反应生成草酸钙.点评:
本题考点: 生活中的有机化合物;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题通过实验的方式探究了菠菜中铁元素的含量以及菠菜不能与豆腐同食的原因,属于应用化学知识解决生活中的实际问题的考查方式,完成此类题目,要能够灵活的将知识迁移,难度不大.1年前查看全部
- 二价铁离子怎样体现氧化性二价铁剂能作氧化剂又能作还原剂,请分别举例说明,
 迷宗1年前1
迷宗1年前1 -
 tianya00110 共回答了20个问题
tianya00110 共回答了20个问题 |采纳率95%作氧化剂:把Zn投入Fe2+溶液,置换出Fe.Fe从2+变0价
作还原剂:用Cl2氯气等有强氧化性的东西来氧化Fe2+,产生Fe3+.Fe从2+变3+1年前查看全部
- “速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
“速力菲”是一种人工合成的补铁剂,某研究性学习小组为探究其主要成分,进行了如下实验:
(1)打开这种药片的密封膜,发现其外观为淡黄色;
(2)将“速力菲”投入小试管中,加入少量蒸馏水,充分振荡后发现溶液变浑浊;慢慢加入稀硫酸后溶液变得澄清透明并显黄色;滴加KSCN溶液,立即变为血红色.学生甲由此断定“速力菲”的主要成分是三价铁盐;
(3)学生乙的操作与甲大致相同,所不同的是他动作敏捷,且在振荡前用橡皮塞塞紧试管口.结果发现:溶液仅显示淡红色.乙同学认为“速力菲”的主要成分不是三价铁盐而是亚铁盐.
(4)为了确认甲、乙的结论是否正确,学生丙将乙所得的淡红色溶液分成两份继续进行实验: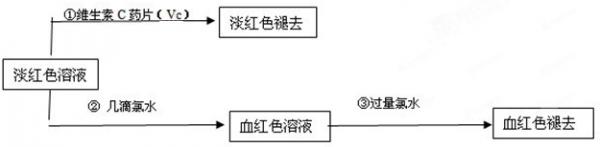
试回答下列问题:
(1)甲、乙两位同学的结论中比较合理的是______,另一同学判断出错的原因是______.
(2)丙的实验①说明维生素C具有较强的______性(填“氧化”或“还原”).
(3)写出与丙的实验②中现象对应的离子反应方程式______;______
(4)关于丙的实验③中的现象,丙同学提出了两种假设:一种是过量的氯水与Fe3+结合生成了某种稳定的新物质;另一种则是过量的氯水将SCN-氧化了.请你设计一个实验方案以确认哪种假设更合理______
(5)针对实验目的,本次实验尚未完成的任务是______. qinchuan731年前1
qinchuan731年前1 -
 紫羅蘭22 共回答了15个问题
紫羅蘭22 共回答了15个问题 |采纳率80%解题思路:(1)根据亚铁离子的化学性质及甲、乙同学的操作是否严密进行分析;
(2)根据三价铁离子具有氧化性及淡黄色褪去判断维生素具有的性质;
(3)加入氯水,亚铁离子被氧化成了三价铁离子;硫氰化钾与铁离子生成硫氰化铁;
(4)可以向反应后的溶液中重新加入硫氰化钾溶液,根据现象判断两种假设的合理性;
(5)根据题中信息找出本次实验尚未完成的任务.(1)由于亚铁离子容易被空气中的氧气氧化,乙同学动作敏捷,且在振荡前用橡皮塞塞紧试管口,而甲同学充分振荡后,慢慢加入稀硫酸,所以乙同学比较合理,
故答案是:乙; 亚铁盐在空气中易被氧气氧化;
(2)由于三价铁离子具有氧化性,加入维生素后淡红色褪去,铁离子被维生素还原成了亚铁离子,
故答案是:还原;
(3)②中现象对应的反应方是氯气和亚铁离子的反应及硫氰化钾与铁离子反应生成血红色的硫氰化铁,反应的离子方程式是:2Fe2++Cl2=2 Fe3++2Cl-,Fe3++3SCN-═Fe(SCN)3,
故答案是:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3;
(4)若是氯水将SCN-氧化了,可以重新加入硫氰化钾溶液,观察现象,如果变成血红色,第二种假设合理;如果不变色,说明第一种假设合理,
故答案是:再加过量KSCN溶液,如果变血红色,则第二种合理;如果不变色,则第一种合理;
(5)根据“某研究性学习小组为探究其主要成分,进行了如下实验”,本次实验尚未完成的任务是:未能测出“速力菲”成分,
故答案为:未能测其成分.点评:
本题考点: 探究物质的组成或测量物质的含量;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查了探究“速力菲”主要成分,充分考查了学生的分析、理解能力及对所学知识的掌握情况,本题难度中等.1年前查看全部
大家在问
- 1英语首字母填空:It is r____ heavily.Candy looks inside her school ba
- 2英语按要求完成下列句子.1.l hope to hear from Alice in a week(改为同义句)
- 3special offers and product promotions是什么意思
- 4英语句型转换!She likes koalas very much.(改为一般疑问句)_______she_______
- 5中秋随感 作文
- 6同学们用花盆摆出一个双环形(如图),每隔5分米摆一盆.两个交点处各摆一盆,每一环的周长都是10米,一共需要多少盆花?
- 7常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
- 8高分计划一卷通八年级语文(上)专项训练(八)课外文言文答案
- 9有一天,小羽同学打开收音机后,又去打开台灯,这时他听到收音机中传来“咔哒”一声.他为了进一步验证这个现象,将收音机旋至没
- 10一个长方体花坛面积是6平方米,如果长增加 1 3 ,宽增加 1 4 ,现在的面积比原来增加多少平方米?
- 11英语翻译北京市 西城区 西直门外大街 1号 西环广场 T3楼8层,麻烦帮我翻译一下,
- 12don't walk on the grass=?
- 13帮忙音译一个单词?注意音译不是翻译.soft音译是什么
- 141 without the air to hold some of the sun's heat ,the earth
- 15初中英语对话填空、追分的.能填多少天多少.
