二氧化锰一般在化学反应中做什么
 钟兴楚2022-10-04 11:39:5420条回答
钟兴楚2022-10-04 11:39:5420条回答
已提交,审核后显示!提交回复
共20条回复
 tianshicwb 共回答了13个问题
tianshicwb 共回答了13个问题 |采纳率84.6%- 催化剂,化学反应前后起质量,化学性质都不改变!
- 1年前
 姬然773 共回答了11个问题
姬然773 共回答了11个问题 |采纳率- 催化剂
- 1年前
 smalling 共回答了1个问题
smalling 共回答了1个问题 |采纳率- 氧化反应中作为催化剂使用
- 1年前
 bnfvy 共回答了4个问题
bnfvy 共回答了4个问题 |采纳率- 中性,面对氧化性强的物质做还原剂,面对还原性强的物质可做氧化剂,也可作催化剂
- 1年前
 buyaorangshi 共回答了4个问题
buyaorangshi 共回答了4个问题 |采纳率- 催化剂
- 1年前
 hl_315 共回答了6个问题
hl_315 共回答了6个问题 |采纳率- 催化剂
- 1年前
 cood1234 共回答了3个问题
cood1234 共回答了3个问题 |采纳率- 催化剂.用来反应一些本来不反应的物质
- 1年前
 yktx888 共回答了1个问题
yktx888 共回答了1个问题 |采纳率- 催化剂
- 1年前
 251822569 共回答了4个问题
251822569 共回答了4个问题 |采纳率- 氧化剂。催化剂。干燥剂。测定水泥中的硫化钠。http://baike.baidu.com/view/213848.htm
- 1年前
 qqggxl 共回答了1个问题
qqggxl 共回答了1个问题 |采纳率- 催化剂
- 1年前
 咖啡可乐猪 共回答了4个问题
咖啡可乐猪 共回答了4个问题 |采纳率- 催化剂
- 1年前
 安静的老虎 共回答了69个问题
安静的老虎 共回答了69个问题 |采纳率- 催化剂,反应物
- 1年前
 II123 共回答了3个问题
II123 共回答了3个问题 |采纳率- 催化
- 1年前
 龙之吟 共回答了1个问题
龙之吟 共回答了1个问题 |采纳率- 催化剂
- 1年前
 昙花一现1212 共回答了7个问题
昙花一现1212 共回答了7个问题 |采纳率- 制氧器的过程中做催化剂,还有一个反应中是氧化剂还是什么,具体忘了
- 1年前
 xmxlycx 共回答了1个问题
xmxlycx 共回答了1个问题 |采纳率- 是催化剂吧
- 1年前
 你是我的青春 共回答了2个问题
你是我的青春 共回答了2个问题 |采纳率- 强氧化剂
- 1年前
 香蕉papa 共回答了1个问题
香蕉papa 共回答了1个问题 |采纳率- 强氧化剂 催化剂 极化剂
- 1年前
 sa9f 共回答了3个问题
sa9f 共回答了3个问题 |采纳率- 催化剂,尤其是在制作氧气的时候,二氧化锰里面还含有两个氧分子
- 1年前
 sniffe 共回答了815个问题
sniffe 共回答了815个问题 |采纳率- 氧化剂
少数反应中做催化剂 - 1年前
相关推荐
- 实验室常用二氧化锰和浓盐酸共热制氯气,反应的化学方程式:MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H
实验室常用二氧化锰和浓盐酸共热制氯气,反应的化学方程式:MnO 2 +4HCl(浓)
 MnCl 2 +Cl 2 ↑+2H 2 O
MnCl 2 +Cl 2 ↑+2H 2 O
下列说法正确的是A.反应前后锰元素的化合价不变 B.可以用向上排空气法收集Cl 2 C.用浓盐酸配制稀盐酸时,必须用托盘天平、量筒、烧杯和玻璃棒 D.该反应是复分解反应  bixiaotian1年前1
bixiaotian1年前1 -
 pbrush2 共回答了20个问题
pbrush2 共回答了20个问题 |采纳率95%B
1年前查看全部
- 如何测知一定量的氯酸钾和二氧化锰的混合物反应后生成的氧气的量_______ 原理:________操作方法:______
如何测知一定量的氯酸钾和二氧化锰的混合物反应后生成的氧气的量_______ 原理:________操作方法:_______
我觉得因为在化学反应前后,反应物和生成物的总质量不变,那么生成氧气的质量是不是等于反应物二氧化锰和氯酸钾的混合物的质量呢?
望能尽快得到答复哦!好的一定立即采纳! aa都怕偶1年前1
aa都怕偶1年前1 -
 第三极刘诚 共回答了13个问题
第三极刘诚 共回答了13个问题 |采纳率92.3%氯酸钾和二氧化锰在加热条件下生成氯化钾和氧气.而二氧化锰在其中的作用只是起到催化剂的作用,加快反映的速率,可有可无.
测定氧气的量可用排水集气法,将一个量筒放入装有水的水槽中,灌满水,瓶口向下浸没于水中,将有氧气生成的导管通入瓶口内,当气体不在生成时,用玻璃盖盖住瓶口拿出水面,量出瓶中水的体积V1,用量筒总体积V-V1=氧气体积1年前查看全部
- 实验室用过氧化氢和二氧化锰制氧气,直到气体不再产生,试管内固体剩余物有______种,改用高锰酸钾制氧气,加热到没有气体
实验室用过氧化氢和二氧化锰制氧气,直到气体不再产生,试管内固体剩余物有______种,改用高锰酸钾制氧气,加热到没有气体产生时,试管内固体剩余物有______种.这两个反应的固体剩余物中都有______,但它在两个反应中的作用不一样,在过氧化氢分解中它是______,在高锰酸钾分解中它是一种______.
 create10291年前1
create10291年前1 -
 uu树下yaya 共回答了20个问题
uu树下yaya 共回答了20个问题 |采纳率85%解题思路:根据用过氧化氢和二氧化锰制取氧气时,固体二氧化锰是催化剂,在反应前后二氧化锰的质量不变;用高锰酸钾制取氧气时,固体产物是锰酸钾和二氧化锰分析.用过氧化氢和二氧化锰制取氧气时,其中二氧化锰是催化剂,在反应前后二氧化锰的质量不变,过氧化氢分解的产物是氧气和水,因此试管内固体剩余物只有二氧化锰一种物质;
用高锰酸钾制取氧气时,产物是锰酸钾、二氧化锰和氧气,固体产物是锰酸钾和二氧化锰两种,其中二氧化锰是生成物;
故答案为:一;两;二氧化锰;催化剂;生成物.点评:
本题考点: 实验室制取氧气的反应原理;催化剂的特点与催化作用.
考点点评: 本题考查了制取氧气的两种不同的原理,难度不大,关键是熟练掌握二者的反应并通过对比完成问题的解答即可.1年前查看全部
- (2008•松北区一模)实验室有下列仪器和氯酸钾、二氧化锰、稀硫酸、大理石、15%的过氧化氯溶液五种药品及蒸馏水、木块、
(2008•松北区一模)实验室有下列仪器和氯酸钾、二氧化锰、稀硫酸、大理石、15%的过氧化氯溶液五种药品及蒸馏水、木块、火柴等实验用品.

请回答下列问题:
(1)利用上述仪器和药品.可以制取的气体是______,用化学方程式表示制取该气体的化学反应原理2H2O2
2H2O+O2↑MnO2 .2H2O2制取该气体所选择的仪器是(填仪器序号)______,请画出制取该气体的装置图:
2H2O+O2↑MnO2 .
(2)在实验中,若用注射器代替长颈漏斗.其优点是______,换药品后,上述装置还可以制取的气体是______. 雪儿不回家1年前1
雪儿不回家1年前1 -
 zzos 共回答了21个问题
zzos 共回答了21个问题 |采纳率90.5%解题思路:(1)利用上述仪器和药品.可以制取的气体是氧气,如果制氧气只能是用双氧水制氧气,用氯酸钾制氧气需要铁架台,所给仪器中没有,制二氧化碳需用稀盐酸,所以只能制氧气;
(2)若用注射器代替长颈漏斗,可以控制反应的进行,如果换药品后还可以制取二氧化碳.(1)氯酸钾制氧气需要用到铁架台,而所给仪器中没有,制二氧化碳需要用到大理石和稀盐酸,所给药品中也没有,只能是用双氧水制氧气,先检查装置的气密性,再向锥形瓶中加入二氧化锰,从长颈漏斗口加入双氧水,待气泡连续均匀冒出再用向上排空气法收集.所以用到的仪器有:③④⑤⑥⑩.
(2)用注射器,可以控制反应速度,也可以控制反应的发生和停止,节约了药品.
故答案为(1)氧气,2H2O2
MnO2
.
2H2O+O2↑,③④⑤⑥⑩ ;
;
(2)控制反应速度,也可以控制反应的发生和停止,节约了药品;二氧化碳点评:
本题考点: 实验室制取气体的思路;制取气体的反应原理的探究;化学实验方案设计与评价;仪器的装配或连接;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用所给的仪器和药品来制取气体时,首先考虑制取某种气体用到什么药品,所给药品中是否有,如果有了再考虑用到什么仪器,所给的仪器中是否都有,按照这样的思路考虑.1年前查看全部
- 氯酸钾和二氧化锰混合制氧使用排水法收集的氧气中混有空气的原因是什么
 polaris_yang1年前1
polaris_yang1年前1 -
 kk做手术 共回答了15个问题
kk做手术 共回答了15个问题 |采纳率86.7%原因可能有2个
1是等气泡一冒出立刻开始收集,原试管内留有的空气进入
2是通过氯酸钾和二氧化锰混合制氧可以有两个化学式
(1)2KClO3===(MnO2加热)===2KCl+3O2上箭头
(2)2KClO3+2MnO2===加热===2KMnO4+Cl2上箭头+O2上箭头
还可以有氯气生成
有什么不明白可以继续问,随时在线等.1年前查看全部
- (2013•黄浦区一模)实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验
(2013•黄浦区一模)实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验

①写出操作Ⅰ的名称______;
②操作Ⅳ称量所得的固体为1.49g(不计每步操作损耗),请问该实验中氯酸钾和二氧化锰混合加热,产生了多少molO2?(根据化学方程式列式计算) lzhf19861年前1
lzhf19861年前1 -
 烧香的猪 共回答了19个问题
烧香的猪 共回答了19个问题 |采纳率84.2%解题思路:要将二氧化锰从混合物中分离出来,首先将固体溶解再进行过滤;根据操作过程可知:操作Ⅳ所得固体为氯化钾,根据氯化钾的质量并结合方程式可减少出生成氧气的物质的量.(1)要将二氧化锰从混合物中分离出来,首先将固体溶解再进行过滤;
故答案为:溶解;
(2)氯化钾的物质的量为:[1.49g/74.5g/mol]=0.02mol
设生成O2x mol.
2KClO3
MnO2
.
△3O2↑+2KCl
32
x0.02mol
[3/x]=[2/0.02mol]
x=0.03mol
答:生成O20.03mol.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了学生获取信息,及利用方程式规范答题的能力,要细心分析,仔细解答.1年前查看全部
- 两道化学计算题实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学取2g二氧化锰于锥形瓶中然后慢慢滴入34g过氧化氢溶液
两道化学计算题
实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学取2g二氧化锰于锥形瓶中然后慢慢滴入34g过氧化氢溶液,完全反应后,称得锥形瓶你剩余物质总质量是34.4g
求生成氧气的质量 过氧化氢溶液中溶质的质量分数
某练铁厂用含Fe2O3的矿石炼10t含杂质2%的铁,至少徐一氧化碳的质量是多少? 标准情况下,一氧化碳的体积是多少(CO密度:1.25kg/立方米)
要过程
 躺起看月亮1年前1
躺起看月亮1年前1 -
 阿杜在线 共回答了19个问题
阿杜在线 共回答了19个问题 |采纳率100%(1)根据质量守恒,生成氧气的质量=锥形瓶内物品减少的量=2+34-34.4=1.6g
2H2O2=2H2O+O2
68 32
x 1.6g
所以x=1.6*68/32=3.4g,所以过氧化氢溶液中溶质的质量分数=3.4/34=0.1=10%
(2)“炼10t含杂质2%的铁”即生成的铁有10*(1-2%)=9.8t=9800kg
Fe2O3+3CO=2Fe+3CO2
84 112
x 9800kg
所以x=9800*84/112=7350Kg,即至少需要一氧化碳的质量为7350Kg,其体积V=m/p=7350Kg/1.25Kg/立方米=5880立方米1年前查看全部
- 取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质...
取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质...
取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质量为25.5g 然后继续加热,至不再有气体放出为止第二次收集氧气为4.8g1共收集到氧气多少克2第一次加热后,有多少克氯酸钾分解了3第一次加热后剩余的25.2g固体中含有那些物质各多少克 baobaomimi1年前2
baobaomimi1年前2 -
 haike200 共回答了23个问题
haike200 共回答了23个问题 |采纳率78.3%1、根据质量守恒定律第一次收集到氧气质量=30g-25.5g=4.5g
一共收集到氧气的质量=4.8g+4.5g=9.3g
2、设第一次加热分解的氯酸钾质量为X,生成氯化钾的质量为Y
2KClO3 = MnO2 △=2KCl + 3O2 ↑
245 149 96
X Y 4.5g
X=11.5g
Y=7g
3、设第二次分解氯酸钾的质量为Z
2KClO3 = MnO2 △=2KCl + 3O2 ↑
245 96
Z 4.8g
Z=12.25g
二氧化锰的质量=25.5g-12.25g-7g=6.25g
第一次加热后剩余的25.2g固体中含有氯酸钾、氯化钾、二氧化锰,
质量分别是:12.25g、7g、6.25g
希望我回答能对你的学习有帮助!1年前查看全部
- 实验室有下列装置和过氧化氢溶液、稀盐酸、二氧化锰、高锰酸钾、石灰石等试剂以及胶管、火柴等用品.请回答下列问题:
实验室有下列装置和过氧化氢溶液、稀盐酸、二氧化锰、高锰酸钾、石灰石等试剂以及胶管、火柴等用品.请回答下列问题:

(1)写出仪器①的名称______;
(2)用A、C组装制取一瓶O2,应选择的试剂是______. shilei1983541年前1
shilei1983541年前1 -
 不见枯荣 共回答了16个问题
不见枯荣 共回答了16个问题 |采纳率87.5%解题思路:(1)从仪器的图形和用途去分析解答;
(2)由发生装置A可以看出:是加热固体制取气体,同时试管口有棉花团,所以用的药品是高锰酸钾去分析解答.(1)由仪器的图形和用途可知:①为酒精灯;故答案为:酒精灯;
(2)由发生装置A可以看出:是加热固体制取气体,同时试管口有棉花团,所以用的药品是高锰酸钾,由于氧气不易溶于水,所以可用排水法收集;故答案为:高锰酸钾.点评:
本题考点: 氧气的制取装置;氧气的收集方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 实验室制取气体时,发生装置的选择取决于反应物的状态和反应条件.1年前查看全部
- 某同学在做了“用双氧水和二氧化锰制取氧气”的实验后,展开了思考与探究:催化剂二氧化锰的用量对反应速率有没有影响呢?
某同学在做了“用双氧水和二氧化锰制取氧气”的实验后,展开了思考与探究:催化剂二氧化锰的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集到0.96克氧气时所用的时间,结果如下:(其他实验条件均相同)
实验次序 1 2 3 4 5 6 7 8 9 10
二氧化锰粉末用量/克
0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0
所用时间/秒
17 8 7 5 4 3 2 2 2 2
(1)从表中的数据看出:二氧化锰的用量对反应速率是有影响的,请描述二氧化锰的用量对反应速率的影响是______ .
(2)如果在实验中忘了加入二氧化锰.下列对实验结果的描述正确的是( )
A、不影响化学反应速度
B、反应速度慢,产生氧气比应有的量少
C、产生氧气总量不少,但反应速度慢
D、无法产生氧气
(3)实验中要产生0.96克氧气至少需要多少克H2O2?(通过化学方程式计算说明) leocw1年前1
leocw1年前1 -
 lcs9 共回答了23个问题
lcs9 共回答了23个问题 |采纳率87%(1)一定量的二氧化锰可以促进反应的进行
(2)C
(3)2h2o2=2h2o+o2
68 32
x 0.96
x=2.04g1年前查看全部
- 急吖一:书写下列化学方程式 1.碱式碳酸铜生成二氧化碳,水和氧化铜 2.高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气 3.
急吖
一:书写下列化学方程式
1.碱式碳酸铜生成二氧化碳,水和氧化铜
2.高锰酸钾受热分解生成锰酸钾,二氧化锰和氧气
3.铁和硫酸反映成硫酸亚铁和氢气
4.铝和盐酸反应生成氯化铝和氧气
5.氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠
6.碳酸钙呵盐酸反应生成氯化钙,二氧化碳和水
7.二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水
8.水在通电条件下生成氢气和氧气
9.二氧化碳呵硫酸反应生成硫酸铁和水 hongzhenfeng1年前1
hongzhenfeng1年前1 -
 pi1215 共回答了18个问题
pi1215 共回答了18个问题 |采纳率83.3%1.Cu2(OH)2CO3=加热=2CuO+CO2+H2O
2.2KMnO4=加热=K2MnO4+MnO2+O2
3.Fe+H2SO4=FeSO4+H2
4.2Al+6HCl=2AlCl3+3H2
5.2NaOH+CuSO4=Cu(OH)2+Na2SO4
6.CaCO3+2HCl=CaCl2+H2O+CO2
7.CO2+Ca(OH)2=CaCO3+H2O
8.2H2O=电解=2H2+O2
9.不反应1年前查看全部
- 把氯酸钾和二氧化锰混合物25克放在试管里加热,直到氯酸钾全部完全冷却后称得剩余固体物质的质量为15.4g.
把氯酸钾和二氧化锰混合物25克放在试管里加热,直到氯酸钾全部完全冷却后称得剩余固体物质的质量为15.4g.
1.反应后制得氧气多少克?
2.原混合物中氯酸钾有多少克?
3.原混合物中二氧化锰有多少克? 光头chen1年前2
光头chen1年前2 -
 xiaoye5577 共回答了15个问题
xiaoye5577 共回答了15个问题 |采纳率86.7%1,由于MnO2是催化剂所以不参加反应,KClO3在MnO2得催化下加热生成KCl与O2,所以氧气为9.6g.2,因为2KClO3=加热=2KCl+3O2所以M(KClO3)=225*9.6/96=24.5g.3.M(MnO2)=25-24.5=0.5.1年前查看全部
- CuO能作催化剂吗?比如像二氧化锰那样催化过氧化氢
 pairsouter1年前3
pairsouter1年前3 -
 毛毛的木马 共回答了19个问题
毛毛的木马 共回答了19个问题 |采纳率89.5%催化H2O2分解可以的,但不是什么反应都能催化1年前查看全部
- (2012•延庆县一模)实验室用过氧化氢溶液在二氧化锰催化下制取氧气,现已制得氧气64g,则消耗过氧化氢的质量为多少?
 xljzh1年前1
xljzh1年前1 -
 leileilesure 共回答了24个问题
leileilesure 共回答了24个问题 |采纳率91.7%解题思路:根据过氧化氢分解的反应原理写出反应的化学方程式,然后把生成的气体的质量代入化学方程式进行计算.设消耗过氧化氢的质量为x.
2H2O2
MnO2
.
2H2O+O2↑
6832
X64 g
[68/x=
32
64g]
解得x=136 g
答:过氧化氢质量为136 g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度不大,主要考查了根据化学方程式来计算相关物质的质量,要注意答题的规范性.1年前查看全部
- 关于高锰酸钾各种反应的生成物1、二氧化锰是否溶于碱?如何解释高锰酸钾与过量3%过氧化氢反应后溶液呈棕色?2、反应将循环进
关于高锰酸钾各种反应的生成物
1、二氧化锰是否溶于碱?如何解释高锰酸钾与过量3%过氧化氢反应后溶液呈棕色?
2、反应将循环进行如下:2KMnO4(加热)==K2Mn04+MnO2+O2;
2K2MnO4+ 2H2O====KMnO4+ MnO2↓+ 4KOH
锰酸钾能在强加环境下稳定?
那么数次后的产物应是什么?如果还有二氧化锰溶于碱后的产物,那么如何将其分离?
强加——强碱环境 followstudents1年前1
followstudents1年前1 -
 醉梦凝烟 共回答了16个问题
醉梦凝烟 共回答了16个问题 |采纳率87.5%1、MnO2不溶于碱.
KMnO4与H2O2反应,由于H2O2本身的酸性极弱,因此该反应是在一个近中性的环境中发生的,而中性环境中KMnO4的还原产物为MnO2.
2、K2MnO4在强碱环境中稳定,在强酸环境中则易发生歧化反应生成MnO4-和MnO2.
先说下,第二个反应为:3K2MnO4 + 2H2O = 2KMnO4 + MnO2↓ + 4KOH
将两个反应叠加,消掉中间产物K2MnO4:
4KMnO4 + 2H2O = 4MnO2↓ + 4KOH + 3O2↑
因此最后的产物是MnO2、KOH、O21年前查看全部
- 实验室常采用加热氯酸钾和二氧化锰的混合物制取氧气,怎样证明氧气是由氯酸钾而不是由二氧化锰分解生成的?
 风声雨起1年前5
风声雨起1年前5 -
 z38293 共回答了22个问题
z38293 共回答了22个问题 |采纳率86.4%在实验前称量二氧化锰的质量,实验之后把剩余固体放进足量水里,过滤,然后烘干,称量,后来的质量=原来二氧化锰的质量,就可以说明氧气不是二氧化锰分解产生的1年前查看全部
- (2011•道里区二模)实验室现有块状石灰石、高锰酸钾、稀硫酸、二氧化锰、棉花、木块及下列仪器:
(2011•道里区二模)实验室现有块状石灰石、高锰酸钾、稀硫酸、二氧化锰、棉花、木块及下列仪器:

请回答下列同题:
(1)仪器①的名称.______;
(2)制取二氧化碳整个过程中,需要的仪器有______(填序号),某同学选择仪器后,发现上述药品不适合制取二氧化碳,你认为还应填加药品______ (填名称)才可以制二氧化碳;发生反应的方程式为______
(3)画出制取该气体的装置图. asa4631年前1
asa4631年前1 -
 人云亦云11 共回答了18个问题
人云亦云11 共回答了18个问题 |采纳率88.9%解题思路:(1)根据仪器的形状、结构、用途回答.
(2)根据实验室制二氧化碳的原理、装置和过程回答.
(3)根据实验室制二氧化碳的原理和装置回答.(1)①呈锥形,为反应容器,名为锥形瓶.
(2)实验室制二氧化碳的药品为石灰石和稀盐酸;石灰石的主要成分是碳酸钙,它与盐酸反应生成氯化钙、水、二氧化碳,方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;根据药品的状态为固体和液体,反应条件不需加热,制取装置用到的仪器有①②⑤⑧,另外取固体药品时还用镊子⑨.
(3)根据药品的状态和反应条件,收集装置用①②⑧组装,二氧化碳的密度比空气大,用⑤收集;图如下: .
.
故答案为:
(1)锥形瓶;
(2)①②⑤⑧⑨;稀盐酸;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3) .
.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;制取二氧化碳的操作步骤和注意点;书写化学方程式、文字表达式、电离方程式.
考点点评: 气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.1年前查看全部
- 氯酸钾在二氧化锰的催化下能分解为氯化钾和氧气,现有氯酸钾m克和n克二氧化锰的混合物,完全反应可得到w克固体,则生成的氧气
氯酸钾在二氧化锰的催化下能分解为氯化钾和氧气,现有氯酸钾m克和n克二氧化锰的混合物,完全反应可得到w克固体,则生成的氧气的克数为( )
A.m+n
B.m+n-w
C.m+n+w
D.m-w 平平淡淡的1年前1
平平淡淡的1年前1 -
 chenhuishiling 共回答了18个问题
chenhuishiling 共回答了18个问题 |采纳率83.3%解题思路:固体质量减少是因为产生了氧气这种气态物质,它会逸出体系,使得固体质量减少,所以生成氧气的质量就是固体减少的质量,可以据此结合二氧化锰的作用即催化剂的概念来解答该题.参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气逸散到空气中,所以反应后减少的质量就是生成的氧气的质量;二氧化锰在反应中充当了催化剂,其质量在反应前后不发生改变,所以剩余固体的质量为wg中包含着二氧化锰,故在计算质量的减少量时,必须加上二氧化锰的质量,所以生成氧气的质量为:(m+n-w)g,分析所给选项可以知道选项B是正确的.
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查质量守恒定律的内容以及应用,很具有新颖性,同时也考查了学生的分析和应变能力.1年前查看全部
- 某兴趣小组取氯酸钾和二氧化锰的混合物共26.5g进行加热,产生的气体质量随时间的关系如表所示:
某兴趣小组取氯酸钾和二氧化锰的混合物共26.5g进行加热,产生的气体质量随时间的关系如表所示:
加热时间 一分钟 三分钟 五分钟 七分钟 九分钟
产生的气体量 26.5g 23.8g 18.2g 16.9g 16.9g
试求:(1)由此可知,该小组共制得气体的量为-------- (2)求原混合物中氯酸钾的质量 (3)反应后混合物中二氧化锰的质量分数 tangtangjian1年前1
tangtangjian1年前1 -
 zwjoebear 共回答了20个问题
zwjoebear 共回答了20个问题 |采纳率85%小组共制得气体的量为:26.5-16.9=9.6g
2KClO3===MnO2====2KCl + 3O2
245 96
X=24.5 9.6g
原混合物中氯酸钾的质量:24.5g
反应后混合物中二氧化锰的质量:26.5-24.5=2g
质量分数:2/16.9=11.8%1年前查看全部
- 将ag的氯酸钾和bg的二氧化锰混合加热一会后得到cg残余物生成氧气多少g
 补_丁1年前1
补_丁1年前1 -
 hbycsmile 共回答了19个问题
hbycsmile 共回答了19个问题 |采纳率94.7%2KCLO3+MNO2=2KCL+3O2+MNO2
氧气的质量=ag+bg-cg1年前查看全部
- 现有氯酸钾和二氧化锰的混合物30g,加热完全反应后,冷却称量剩余物体的质量为20.4g
现有氯酸钾和二氧化锰的混合物30g,加热完全反应后,冷却称量剩余物体的质量为20.4g
求:剩余固体中二氧化锰的质量. 风霜渐起1年前2
风霜渐起1年前2 -
 忘记等于想起 共回答了18个问题
忘记等于想起 共回答了18个问题 |采纳率94.4%设混合物中的质量为x克,MnO2是催化剂,质量不变.反应前KClO3的质量为30-x克,反应后KCl的质量为20.4-x克.
2KClO3 = 2KCl + 3O2 (g)
2*122.5 2*74.5
30 - x 20.4 -x
245 :149 = (30 - x) :(20.4 - x)
x = 5.51年前查看全部
- 将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g.求:(1)生成氧气多少克?
将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g.求:(1)生成氧气多少克?
为什么我怎么算氧气的质量都不等于9.6 g 会游泳的树袋熊1年前3
会游泳的树袋熊1年前3 -
 小呓 共回答了16个问题
小呓 共回答了16个问题 |采纳率100%残渣中二氧化锰0.5g,氯化钾14.9g,正好是0.2mol,生成0.3mol氧气,正好是9.6g.1年前查看全部
- 按下列要求正确书写化学方程式:(1)实验室用氯酸钾和二氧化锰共热制取氧气:2KClO3MnO2.△2KCl+3O2↑2K
按下列要求正确书写化学方程式:
(1)实验室用氯酸钾和二氧化锰共热制取氧气:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3
2KCl+3O2↑MnO2 .△
(2)用熟石灰处理工厂排放出的废水中硫酸______
(3)用主要成分是Al(OH)3的药物来治疗胃酸过多______
(4)赤铁矿冶炼成铁的反应原理3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 . sim959551年前1
sim959551年前1 -
 Iampigpig 共回答了24个问题
Iampigpig 共回答了24个问题 |采纳率91.7%解题思路:氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
稀硫酸和氢氧化钙反应生成硫酸钙和水;
氢氧化铝和稀盐酸反应生成氯化铝和水;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳.(1)氯酸钾在二氧化锰的催化作用下受热分解的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑;
(2)稀硫酸和氢氧化钙反应的化学方程式为:H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)稀盐酸和氢氧化铝反应的化学方程式为:3HCl+Al(OH)3=AlCl3+3H2O;
(4)高温条件下,氧化铁和一氧化碳反应的化学方程式为:3CO+Fe2O3
高温
.
2Fe+3CO2.
故填:2KClO3
MnO2
.
△2KCl+3O2↑;H2SO4+Ca(OH)2=CaSO4+2H2O;3HCl+Al(OH)3=AlCl3+3H2O;3CO+Fe2O3
高温
.
2Fe+3CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.1年前查看全部
- 将20g过氧化氢的溶液和3g二氧化锰混合反应,共收集8g干燥的氧气,问反应生成的另一种物质的质量为()
将20g过氧化氢的溶液和3g二氧化锰混合反应,共收集8g干燥的氧气,问反应生成的另一种物质的质量为()
A 6g.B 9g C 12g D20g 落寞的71年前2
落寞的71年前2 -
 qiiq1006 共回答了16个问题
qiiq1006 共回答了16个问题 |采纳率87.5%2H2O2===2H2O+O2
36 32
X 8
X=9
选B1年前查看全部
- 实验室用分解过氧化氢法制氧气时,加入的少量二氧化锰在化学反应前后( )
实验室用分解过氧化氢法制氧气时,加入的少量二氧化锰在化学反应前后( )
A. 质量减少
B. 质量增加
C. 化学性质改变
D. 化学性质不变 liuge1年前3
liuge1年前3 -
 么的撒 共回答了21个问题
么的撒 共回答了21个问题 |采纳率90.5%解题思路:实验室用分解过氧化氢法制氧气时,加入的少量二氧化锰在化学反应中做的是催化剂,根据催化剂的定义和特点考虑本题,真正理解其本质特点.催化剂是在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有变化的物质.这里的改变包括加快和减慢两种情况.催化剂在化学反应中所起的作用叫催化作用.过氧化氢发生分解可用二氧化锰做该反应的催化剂,所以加入的少量二氧化锰在化学反应前后化学性质不变.
故选D.点评:
本题考点: 催化剂的特点与催化作用;实验室制取氧气的反应原理.
考点点评: 解答该题关键要理解催化剂概念中的“一变、二不变”的涵义.一变是反应速度变,二不变是本身质量和化学性质.1年前查看全部
- 实验室用MnO2和HCl来制取氯气.当有0.2MOL二氧化锰别还原时,被氧化的氯化氢的质量为多少
 segat1年前1
segat1年前1 -
 jedinancy 共回答了21个问题
jedinancy 共回答了21个问题 |采纳率100%n(HCL)=0.4mol
m(HCL)=0.4mol*36.5g/mol=1.46g1年前查看全部
- 过氧化氢溶液和二氧化锰混合制取氧气——化学方程式怎么写吖?
 佳音kk1年前0
佳音kk1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于质量守恒定律的一道习题a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气___
关于质量守恒定律的一道习题
a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气_____克. yueminzhou1年前5
yueminzhou1年前5 -
 mousehj 共回答了27个问题
mousehj 共回答了27个问题 |采纳率96.3%a+b-c1年前查看全部
- 分别写出下列反应的化学方程式:(1)加热氯酸钾与二氧化锰制取氧气:2KClO3MnO2.△2KCl+3O2↑2KClO3
分别写出下列反应的化学方程式:
(1)加热氯酸钾与二氧化锰制取氧气:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△
(2)电解水:2H2O
2H2↑+O2↑通电 .2H2O.
2H2↑+O2↑通电 .
(3)铁在氧气中燃烧:3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 .
(4)二氧化碳通入澄清石灰水变浑浊:______
(5)红磷在氧气中燃烧:4P+5O2
2P2O5点燃 .4P+5O2;属于______反应.
2P2O5点燃 .
(6)3g H2在充足氧气中燃烧可以产生水的质量是______g.写出解题过程.
(7)16g甲在氧气中完全燃烧生成44CO2 和 36gH2O,求甲的化学式______. qianliang_g1年前1
qianliang_g1年前1 -
 嘎12 共回答了16个问题
嘎12 共回答了16个问题 |采纳率93.8%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
(2)水通电分解生成氢气和氧气,反应的化学方程式为:2H2O
通电
.
2H2↑+O2↑.
(3)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2
点燃
.
Fe3O4.
(4)石灰水中的溶质是氢氧化钙,能与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(5)生成五氧化二磷,反应的化学方程式为:4P+5O2
点燃
.
2P2O5,该反应符合“多变一”的特征,属于化合反应.
(6)设生成水的质量为x,
2H2+O2
点燃
.
2H2O
436
3g x
[4/36=
3g
x] x=27g.
(7)甲在氧气中充分燃烧生成二氧化碳和水,说明该物质中一定含有碳元素和氢元素,且反应前后碳元素和氢元素的质量不变,
则二氧化碳中碳元素质量为:44g×[12/44]=12g,水中氢元素质量为:36g×[1×2/18]=4g,碳和氢元素的质量和为:12g+4g=16g,故该物质不含有氧元素;
设其化学式为CxHy,则该分子中碳原子和氢原子的个数比为[12g/12]:[4g/1]=1:4,其化学式为CH4.
故答案为:(1)2KClO3
MnO2
.
△2KCl+3O2↑;
(2)2H2O
通电
.
2H2↑+O2↑;
(3)3Fe+2O2
点燃
.
Fe3O4;
(4)CO2+Ca(OH)2═CaCO3↓+H;
(5)4P+5O2
点燃点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- (2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
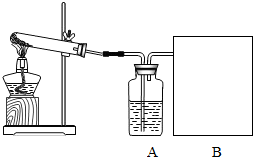 (2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
(2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
①检查装置的气密性,气密性良好;
②先在试管中放入MnO2,再放入略多于计算量的KClO3;
③连接好实验装置;
④加热;
⑤收集气体;
⑥适当的时间后,停止加热,拆卸装置.
回答下列问题:
(1)装置A中的试剂______.
(2)方框B中最好选用下列装置中的______(填字母序号).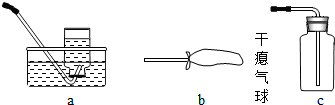
(3)实验中观察到何种现象时开始收集气体______.
(4)实验结束后,该同学发现收集到的气体比预计的少许多,百思不得其解.你认为可能的原因是______.
(5)欲从反应的残渣中回收二氧化锰(难溶于水),其操作步骤是:溶解、______、烘干. 小小香草1年前1
小小香草1年前1 -
 qulinshan 共回答了17个问题
qulinshan 共回答了17个问题 |采纳率88.2%解题思路:(1)依据图示及其作用,辨识常用药品,正确写出药品名称;
(2)根据实验要求,选择合适的实验装置;
(3)根据氧气的性质收集氧气时,掌握开始收集气体应注意的问题;
(4)在实验出现误差或失误时,会分析解决问题,找出原因.
(5)学会固体混合物的分离方法及操作步骤.(1)依据图示及其作用装置A中的试剂可用浓硫酸;因浓硫酸具吸水性,可做氧气的干燥剂.故答案为:浓硫酸
(2)根据实验要求分析方框B中最好选用的装置:a 装置是用排水法收集,得不到干燥的氧气.b装置可以收集到纯净而干燥的氧气,且能够观察收集气体的量;c 装置收集氧气时,无法排除集气瓶内空气.故答案为:b
(3)根据氧气不易溶于浓硫酸的性质收集氧气时,开始有气泡冒出因混有空气不纯,不要立即收集.看到有气泡从A中均匀冒出才能收集.故答案为:看到有气泡从A中均匀冒出
(4)实验结束后,该同学发现收集到的气体比预计的少许多,出现这样的现象可能是:装置A漏气、气球漏气、药品量少等.故答案为:装置A漏气(或气球漏气)等
(5)从反应的残渣中回收难溶于水的二氧化锰时,残渣中的氯化钾(或存在没反应完的氯酸钾)能溶于水,故其操作步骤为:溶解、过滤、烘干.故答案为:过滤
故答案为:
(1)浓硫酸
(2)b
(3)看到有气泡从A中均匀冒出
(4)装置A漏气(或气球漏气)
(5)过滤点评:
本题考点: 制取氧气的操作步骤和注意点;混合物的分离方法;过滤的原理、方法及其应用;氧气的制取装置;氧气的收集方法.
考点点评: 掌握常用气体的干燥剂、制取氧气的装置与收集方法及注意事项,学会固体混合物的分离方法及操作步骤1年前查看全部
- T——T将27.6克氯酸钾(KClO3)与2克二氧化锰(MnO2)加热制取一定量的氧气后,使反应停止,测得剩余固体中含二
T——T
将27.6克氯酸钾(KClO3)与2克二氧化锰(MnO2)加热制取一定量的氧气后,使反应停止,测得剩余固体中含二氧化锰的质量分数为10%.计算:
(可能用到的相对原子质量:O—16;Cl—35.5;Mn—55;K—39)
⑶反应停止时剩余固体的质量.⑷制得氧气的质量.
⑸有多少克氯酸钾没有分解.
具体的写明过程. 68809511年前1
68809511年前1 -
 weixi5924 共回答了17个问题
weixi5924 共回答了17个问题 |采纳率100%反应停止时剩余固体的质量:2g/10%=20g
制得氧气的质量:27.6g+2g-20g=9.6g
设分解的氯酸钾质量为x
2KClO3=2KCl+3O2
245 96
X 9.6g
列比例式
x=24.5g
没有分解的 氯酸钾的质量为27.6g-24.5g=3.1g1年前查看全部
- 实验室用氯酸钾制取氧气时,如果没有二氧化锰,也可以在氯酸钾中加入少量高锰酸钾,产生氧气的速度也会加快.用符号表达式表示其
实验室用氯酸钾制取氧气时,如果没有二氧化锰,也可以在氯酸钾中加入少量高锰酸钾,产生氧气的速度也会加快.用符号表达式表示其原因:
1.
2. foxren1年前4
foxren1年前4 -
 omarsharif 共回答了11个问题
omarsharif 共回答了11个问题 |采纳率90.9%1、2KMnO4=K2MnO4+MnO2+O2↑
2、2KClO3=2KCl+3O2(MnO2催化剂)1年前查看全部
- 有下列两组药品和如图所示的实验装置,请你进行实验室制取氧气的探究.①5%的过氧化氢溶液和二氧化锰;②高锰酸钾
有下列两组药品和如图所示的实验装置,请你进行实验室制取氧气的探究.①5%的过氧化氢溶液和二氧化锰;②高锰酸钾 
(1)写出B图中a仪器的名称:______.
(2)选择一组药品,写出其反应的化学方程式:______.
(3)根据所选药品,你选择的发生装置是______(填序号).选择此装置的依据是______.
(4)你选择的收集装置是______(填序号).选择此装置的依据______.
(5)用你选择的装置收集氧气,如何知道氧气已收集满?______. 莘晴1年前1
莘晴1年前1 -
 rosegirl_lin 共回答了12个问题
rosegirl_lin 共回答了12个问题 |采纳率83.3%(1)B图中a仪器的名称是长颈漏斗;
(2)5%的过氧化氢溶液和二氧化锰产生水和氧气,反应的方程式为:2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑;
用高锰酸钾制氧气时,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰、氧气,反应条件是加热,反应的方程式为:2KMnO 4
△
.
K 2 MnO 4 +MnO 2 +O 2 ↑;
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,二氧化锰是催化剂,发生装置属于固液常温型B装置;用高锰酸钾制氧气时,发生装置的特点属于固体加热型的A装置;
(4)因为氧气不易溶于水且密度大于空气,所以既可以用排水法收集,也可以用向上排空气法收集;
(5)用排空气法收集氧气,验满氧气的方法是:将带火星的木条放在集气瓶口,木条复燃;用排水法,验满氧气的方法是:集气瓶口有气泡冒出.
故答案为:(1)长颈漏斗; (2)2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑(或2KMnO 4
△
.
K 2 MnO 4 +MnO 2 +O 2 ↑)
(3)B(或A);反应物为固体和液体,不需要加热(或反应物为固体,需要加热)
(4)C(或E);氧气的密度比空气大(或氧不易溶于水)
(5)将带火星的木条放在集气瓶口,木条复燃(或集气瓶口有气泡冒出)1年前查看全部
- 将二氧化锰加入二氧化氢溶液中反应的化学方程式
 xt19581年前4
xt19581年前4 -
 xxyp 共回答了14个问题
xxyp 共回答了14个问题 |采纳率92.9%额 二氧化氢…………应该叫过氧化氢吧
H2O2=====(等号上写MnO2)2H2O+O2↑1年前查看全部
- 百分之5的过氧化氢溶液68克 加入二氧化锰完全反应后可生成氧气多少克
 maohuatao1年前2
maohuatao1年前2 -
 kee123123 共回答了19个问题
kee123123 共回答了19个问题 |采纳率89.5%2H2O2==MnO2==2H2O+O2
68 32
68g xg
x=3.2g
所以可以生成O23.2克1年前查看全部
- 实验室用过氧化氢溶液制取氧气的时候为什么用二氧化锰作催化剂而不直接加热过氧化氢溶液呢?
 土豆00451年前3
土豆00451年前3 -
 happy游柚 共回答了21个问题
happy游柚 共回答了21个问题 |采纳率95.2%只有加热很浓的过氧化氢才可以制取氧气.而用二氧化锰催化的双氧水浓度不必很高.用二氧化锰来催化制取也更方便1年前查看全部
- 将氯酸钾. 二氧化锰. 高锰酸钾的混合物装入试管并充分加热,反应完成后试管中残渣中物质有 [
将氯酸钾. 二氧化锰. 高锰酸钾的混合物装入试管并充分加热,反应完成后试管中残渣中物质有 [ ]A.1种
B.2种
C.3种
D.4种 族长001年前1
族长001年前1 -
 daisuki_why 共回答了20个问题
daisuki_why 共回答了20个问题 |采纳率95%C1年前查看全部
- 、从实验室用氯酸钾于二氧化锰制取氧气后的残渣中(假定反应充分)回收氯化钾和二氧化锰.
 zjx21cn1年前4
zjx21cn1年前4 -
 小鱼蛮儿 共回答了16个问题
小鱼蛮儿 共回答了16个问题 |采纳率93.8%加水后,用过滤纸过滤氯化钾和二氧化锰,把过滤纸上的水分蒸发掉,就可以得到干燥的氯化钾和二氧化锰.1年前查看全部
- 3.讲氯酸钾和二氧化锰的混合物14.5g,加热使之充分反应到不再产生气体为止,冷却后称得剩余的质量为9.7g,问:(1)
3.讲氯酸钾和二氧化锰的混合物14.5g,加热使之充分反应到不再产生气体为止,冷却后称得剩余的质量为9.7g,问:(1)产生氧气的质量 (2)剩余固体是什么物质?各为多少克?还有一题 4.用含有一定杂质的高锰酸钾样品8.78g,加热使之完全反应(杂质不参加反应)制得0.56L的氧气(标准状态下氧气的密度为1.429g/L)计算:(1)该样品中高锰酸钾的质量是多少?纯度为多少?(2)反应后试管中什么固体物质?各为多少克?
 我意乱天下11年前1
我意乱天下11年前1 -
 lnyyllj 共回答了20个问题
lnyyllj 共回答了20个问题 |采纳率85%1.设氧气为X ,2KCLO3=2KCL+3O2 245 149 96 X 14.5-9.7 X=4.8*149/96=7.45 9.7-7.45=2.25 剩余固体为二氧化锰和氯化钾的混合物 其中二氧化锰2.25克 氯化钾7.45克.2.其化学反应方程式为 2KMnO4(加热)=K2MnO4+MnO2+O2↑ 316 197 87 32 X Y Z 0.8 据题得,氧气的质量为0.56L×1.429g/L≈0.8克 将其代入方程式,设KMnO4的质量为X克,反应后的K2MnO4为Y克,MnO2为W克.解得X=7.9 Y=4.925 W=2.175 所以高锰酸钾样品的纯度为7.9克/8.78克≈90﹪ 反应后试管中剩余的物质为锰酸钾和二氧化锰,重量分别是4.925克和2.175克.希望我的回答能够帮到你哦.1年前查看全部
- 二氧化锰作催化剂时,用质量守恒定律计算,用反应物的质量减生成物的质量,放映物种算不算二氧化锰的质量
 snwvh19781年前1
snwvh19781年前1 -
 nobarking 共回答了25个问题
nobarking 共回答了25个问题 |采纳率92%不算1年前查看全部
- 已知R-Cl+H2O =R-OH+HCl(反应条件是NaOH).试以乙醇、浓硫酸、食盐和二氧化锰为主要原料合成二氧六醚
已知R-Cl+H2O =R-OH+HCl(反应条件是NaOH).试以乙醇、浓硫酸、食盐和二氧化锰为主要原料合成二氧六醚 .写出方程式
①______②_______③_______④______⑤____________ fj19687201年前1
fj19687201年前1 -
 绝非等闲 共回答了20个问题
绝非等闲 共回答了20个问题 |采纳率90%1. C2H5OH=C2H4(乙烯)+H2O(浓硫酸催化)
2. 4NaCl+4H2SO4+MnO2=4NaHSO4+MnCl2+2H2O+Cl2
3. C2H4+Cl2=C2H4Cl2
4. C2H4Cl2+2H2O=CH2OHCH2OH(使用已知条件,氢氧化钠催化)
5 CH2OHCH2OH+C2H4Cl2=2HCl+产物(强碱如氢氧化钠催化)
产物应为二氧六环,即含六个碳原子的正六边形(环己烷)1,4位(六边形的两个对角)的2个碳原子被氧原子取代的产物.1年前查看全部
- 什么东西与二氧化锰反应或将其作为催化剂,加热生成气体?
什么东西与二氧化锰反应或将其作为催化剂,加热生成气体?
生成的气体是什么?
(制氧气的反应就别说了……) nn小狗1年前2
nn小狗1年前2 -
 wangqi198321 共回答了17个问题
wangqi198321 共回答了17个问题 |采纳率88.2%制氯气的,MnO2+4HCl(浓)(加热)=Cl2+MnCl2+2H2O1年前查看全部
- 能否用其他物质代替二氧化锰分解过氧化氢溶液制氧气?(我在家里自己做,代替品要好找的)
 Hoffman1111年前2
Hoffman1111年前2 -
 雨-薇 共回答了25个问题
雨-薇 共回答了25个问题 |采纳率88%试试新鲜的土豆块,最好是土豆内部的部分.
或者碎瓷片,但如果双氧水浓度很小(比如市售3%双氧水消毒剂),现象不明显.
加热能促进反应,但不要煮沸1年前查看全部
- 2.某兴趣小组用氯酸钾和二氧化锰的化合物加热制取氧气,试管中固体的质量随时间变化的数据见下表.制取结束后,将剩余固体用适
2.某兴趣小组用氯酸钾和二氧化锰的化合物加热制取氧气,试管中固体的质量随时间变化的数据见下表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.

(1)共制得氧气 g.
(2)计算生成氯化钾的质量. 在镜中飞翔1年前1
在镜中飞翔1年前1 -
 晓曦cc 共回答了13个问题
晓曦cc 共回答了13个问题 |采纳率100%1) 28.0-18.4=9.6g
2KClO3 = 2KCl + 3O2
149 96
x 9.6
x=14.9g1年前查看全部
- 将21.8g氯酸钾和二氧化锰的混合物,装入大试管加热到不再有气体产生.剩余固体质量为12.2g.
将21.8g氯酸钾和二氧化锰的混合物,装入大试管加热到不再有气体产生.剩余固体质量为12.2g.
1.生成氧气多少克?2.氯化钾多少克?3.二氧化锰多少克? rieu1年前3
rieu1年前3 -
 hhb127 共回答了18个问题
hhb127 共回答了18个问题 |采纳率88.9%根据题意可知生成氧气的质量为:21.8g-12.2g=9.6g
设生成氯化钾质量为x
2KClO3==MnO2==2KCl+3O2↑
149 96
x 9.6g
149/x=96/9.6g
x=14.9g
说明你的数据有问题,因为生成氯化钾的质量比反应后混合物的总质量都多,1年前查看全部
- 氯酸钾和二氧化锰制氧气的化学方程式能改写成离子方程式吗
 睡mm101年前1
睡mm101年前1 -
 allenwhm 共回答了16个问题
allenwhm 共回答了16个问题 |采纳率81.3%不能.
因为离子方程式是需要离子参与的化学反应才能改写.氯酸钾加热生成氧气的化学反应过程中没有离子参与,故而不能写离子方程式.1年前查看全部
- 实验室用6.96g二氧化锰和50g36.5%的盐酸共热,问:
实验室用6.96g二氧化锰和50g36.5%的盐酸共热,问:
1.在标准状况下可产生氯气多少升?
2.如不考虑HCL挥发,将反应后溶液加水稀释到250毫升,取25毫升和足量硝酸银溶液反应,可得沉淀多少克?
第一小题做出来了.主要是第2小题不会.. 微色芽芽1年前2
微色芽芽1年前2 -
 洋洋泡泡 共回答了24个问题
洋洋泡泡 共回答了24个问题 |采纳率91.7%1.二氧化锰的物质的量为:6.96g÷87g/mol=0.08mol
HCl的物质的量为:50g×36.5%÷36.5g/mol=0.5mol
MnO2量不足,所以用MnO2来算.
Cl2的体积为:0.08mol×22.4L/mol=1.792L
2.Cl^-的物质的量为:0.5mol-0.08mol×2=0.34mol 沉淀的质量为:0.34mol×143.5g/mol×10%=4.879g1年前查看全部
- 122.5克氯酸钾在40克二氧化锰作摧化剂的条件下完全分解后,剩余产物中有二氧化锰多少克,有氯化钾多少克?
 yao妹儿1年前3
yao妹儿1年前3 -
 冰河雪莲 共回答了11个问题
冰河雪莲 共回答了11个问题 |采纳率100%1楼的说的对二氧化锰作为催化剂不会消耗,故反应前的质量==反应后的质量
即M二氧化锰==40g
2KClO3==2KCl+3O2↑(设有X克的氯化钾生成)
245 149
122.5 X
X===74.5克1年前查看全部
- .二氧化锰的作用.在用氯酸钾制氧气和用浓盐酸制氯气时都要用到二氧化锰.二氧化锰的作用是否相同?分别起什么作用?
 伊卜拉欣a1年前4
伊卜拉欣a1年前4 -
 johnsonfly 共回答了18个问题
johnsonfly 共回答了18个问题 |采纳率88.9%不一样
用氯酸钾制氧气时,MnO2作为催化剂,不参与反应.起催化作用.
制氯气时,MnO2作为反应物,是氧化剂.氧化Cl-变成Cl2.起氧化作用.1年前查看全部
大家在问
- 1为什么下雨天有负离子?今天我妈拉我出去散步,说什么下雨天负离子多?为什么雨天负离子多呢?雨天负离子是怎么产生的呢?不下雨
- 2一圆柱形玻璃容器,重为3N,内盛深度为20cm的硫酸,硫酸的总体积为500mL.现将容器置于面积为1000每平方厘米的水
- 3把逻辑函数F=ABC+AC +A +CD化简为最简与或式.
- 4Are Paul and Claire both busy with their jobs?怎样回答?
- 5翻页的英语怎么写?
- 6某工厂每天生产质量分数为0.49%的废硫酸溶液1000000克,若改用熟石灰处理,每天要用氢氧化钙的质量多少?
- 7这句话在语意和语法上对吗?人类的好奇心是无穷无尽的,有时仰望浩瀚无垠的宇宙,会情不自禁地发问:宇宙中真的有外星人吗?
- 8must 没有过去式,那能用于过去时的句子中吗
- 9在△ABC中,向量AB=〔2,3〕,向量AC=〔1,k〕,根据下列条件求k的值; ∠A=90°
- 10第一声喝彩“它们的花瓣红得像点燃的火焰”这句话用比喻修辞的表达效果.
- 11世博会给上海带来极好的发展机会 用英语翻译
- 12为什么每个电流表上都标注多少比5
- 13今年春晚被网友评为“娱乐又亲民”、“气氛温馨,让人放松”;“没有广告,不用换台,很清新,看得很爽”;是“最干净的一届春晚
- 14→→化学问题 关于钝化取出插在硫酸铜溶液中的铝条,铝条表面附有一层红色物质,现欲除去表面的红色物质,最好选用A.稀硫酸B
- 15已知a的平方减4a加1等于0,求a的四次加1分之a的平方
