化学平衡向正方向移动的意义是什么?是说生成物的物质的量增加吗,
 毛二柱2022-10-04 11:39:543条回答
毛二柱2022-10-04 11:39:543条回答增大压强指向气体变小的方向,这个气体变小的是说体积变小吗
可是比如两个液体生成气体(L+L1gas),增大压强,是逆反应的产物增加了,那应该指向逆方向,但是气体体积变小又应该指向正方向,到底怎么看

已提交,审核后显示!提交回复
共3条回复
 祝福是最好的礼物 共回答了23个问题
祝福是最好的礼物 共回答了23个问题 |采纳率95.7%- 在其他条件都不改变的情况下,可以理解为物质的量增加,但我们一般说平衡向正方向移动就是正反应速率大于逆反应速率,生成物浓度增大,反应物转化率增大(分很多情况的).然后,跟压强有关的,要看气体前的计量数,固体和液体都是不会影响压强的,如果增大压强,反应就会向气体的计量数少的一边移动
- 1年前
 jovi200 共回答了11个问题
jovi200 共回答了11个问题 |采纳率- 不会啊,你说的是缩小体积以增大压强么?那肯定是逆向移动啊
- 1年前
 伤了你的我 共回答了1个问题
伤了你的我 共回答了1个问题 |采纳率- 楼下的说的很对,我来补充一下,其他条件不变,增大压强平衡向气体变小的方向,可以解释为,化学反应方程式的两边的体积小的方向,比如你说的例子(L+L1<=>gas)左边全是液体可以视体积为0,右边是一倍的气体可视体积为1, 0<1, 左边<右边,所以增大压强平衡左移,也就是逆反应方向,而不是正方向...
- 1年前
相关推荐
- 关于压强压强增大,化学平衡向体积增大的方向移动.压强减小,化学平衡向体积减小的方向移动.压强增大,浓度应该是增大的,反应
关于压强
压强增大,化学平衡向体积增大的方向移动.压强减小,化学平衡向体积减小的方向移动.压强增大,浓度应该是增大的,反应速率增大.可是浓度增大到底是反应物还是生成物?还是一起增大?还有帮我解释下为什么压强增大和减小,化学平衡的转移?帮我用举例证明.如:浓度增大,V正》V逆,化学平衡向正方向移动. 无名小仔1年前1
无名小仔1年前1 -
 冰箱可乐 共回答了20个问题
冰箱可乐 共回答了20个问题 |采纳率95%首先你要记得克拉伯龙方程pv=nRT,再来具体分析问题 (p为压强),(v为体积),(n为物质的量),(r为常数,一般不改变),(T为温度) 再来具体分析问题 mA(g)+nB(g)=aC(g)+bD(g) 这种问题有两种,一种是m+n=a+b.在这种情况下,不管压强怎么改变 平衡都不移动.另一种情况就是m+n(大于或小于)a+b 在这种情况下如果增大压强,平衡就会从系数大的一方移向系数小的一方.反之,如果减小压强的话,就从系数小的一方移向系数大的一方.如果是体积变化的话,也可以用克拉伯龙方程解,在密闭容器中,体积增大,压强就减小了.体积减小,压强增大.然后再判断方程两边的系数大小,就可以判断出平衡移动的方向了 .你也可以这样想,化学平衡有三条,勒夏特列唱反调.什么是唱反调呢?很简单,就是增大什么,就减小什么 举个例子吧,比如说增大压强的话,这个时候平衡就被破坏了.为了重新达到平衡状态,就必须减小压强.在这个题目中,假设m+n(大于)a+b mA(g)+nB(g)=aC(g)+bD(g) 由于左边的气体系数比右边的多吧,所以当增大压强后,为了达到平衡,就要减小它,平衡往右进行.相当于一个天平,刚开始是平衡的,往其中一个加入东西的话,不就不平衡了吗?这个时候,就要把重的一边,提取些给轻的一边.自己联想下吧,能给你的帮助就这些了.练脑子不是练肌肉,多练不如多想、1年前查看全部
- 化学平衡一句话理解一定温度下在溶剂恒定的密闭容器中,进行反应A(s)+2B(g)——(可逆号)C(g)+D(g),因为A
化学平衡一句话理解
一定温度下在溶剂恒定的密闭容器中,进行反应A(s)+2B(g)——(可逆号)C(g)+D(g),因为A为固态,反应前后气体的体积不变,而气体的质量却变化
上面说的气体的质量发生变化我不理解,为什么质量会变化,一定变化吗? 多走一步就是天堂1年前1
多走一步就是天堂1年前1 -
 dhy139 共回答了18个问题
dhy139 共回答了18个问题 |采纳率94.4%是这样的
反应物中的气体只有B,而A是固体.生成物种C、D都是气体,根据质量守恒定律,C、D质量之和等于A和B的质量,所以很显然,反应后气体质量增加1年前查看全部
- 请您详解一下高中课本-化学平衡中的等效平衡
 147251年前2
147251年前2 -
 随便叫了 共回答了29个问题
随便叫了 共回答了29个问题 |采纳率82.8%“等效平衡”的问题已有较多的文章见诸报刊杂志,但在教学实践中教师和学生还是感到困难重重.如何突破这一难点,让学生不仅易于掌握,而且能灵活应用,就成为教学研究的一个重要课题.本文结合我们多年的教学实践进行一些探讨,力求有所突破. 一、难点分类 “等效平衡”的教学难点:一是“等效平衡”概念,在相同条件下的同一可逆反应里,建立的两个或多个化学平衡中,各同种物质的含量相同,这些化学平衡均属等效平衡(包括“等同平衡”).关键是“各同种物质的含量相同”;二是“等效平衡”在恒温恒容条件下的应用;三是在恒温恒压条件下的应用;四是在计算中的应用. 二、难点分散渗透 为了突破难点,我们在教学中将上述难点分散渗透在三节课中. 1.先渗透“等效平衡”概念,并举例让学生学会判断哪些属于等效平衡,哪些不属于等效平衡.再讨论第一类:在恒温恒容条件下的应用. 例1.恒温恒容:(1)A容器中加入1gSO2和1gO2反应达到平衡,SO2的转化率为a%,另一同温同容的B容器中加入2gSO2和2gO2反应达到平衡,SO2的转化率为b%,则a%____________b%. (2)2HI =(可逆)H2+I2(气)平衡,增大HI的物质的量,平衡____________移动,新平衡后HI的分解率____________,HI的体积分数____________. (3)N2O4 =(可逆)2NO2平衡,减少N2O4的物质的量,平衡____________移动,N2O4的转化率____________,N2O4的体积分数____________,NO2的体积分数____________. 分析:(1)同温:
①B和C是“等效的” ②A C A变为B也相当于加压. B容器相当于加压,平衡正向移动,更多的SO2和O2转化为SO3,a%<b%. (2)(a)判断平衡移动:增大反应物HI浓度,平衡正移(或反应物HI浓度增大,v正增大,v正>v逆,说明平衡正向移动).理加入HI原平衡被破坏,新加入的HI又分解为H2和I2,即正向移动(注意:不能得出HI分解率增大的结论). (b)判断含量变化和分解率变化:同温下,比如原起始时1molHI(VL),现起始时相当于2molHI(VL),相当于加压,分别达到平衡,两平衡中HI的分解率相同,同种物的含量相同,HI分解率不变,体积分数不变. (3)减小反应物N2O4浓度,平衡逆向移动(或反应物N2O4浓度减小,v正减小,v正<v逆,说明平衡逆向移动).理原平衡破坏,小部分NO2又化合生成N2O4(注意:不能得出N2O4的转化率如何变化的结论). 结论:(1)判断平衡移动:应用浓度改变对平衡的影响来判断. (2)判断含量变化和转化率变化:恒温恒容条件下,若反应物只有一种,增大(或减小)此物的量,相当于加压(或减压)来判断;若反应物不止一种,同倍数增大(或减小)各反应物的量,相当于加压(或减压)来判断. 2.先练习巩固上次的思路,再讨论第二类:在恒温恒压条件下的应用. 例2.恒温恒压: (1)加入1molN2和3molH2达到平衡,N2体积分数为a%,N2转化率为b%;若再加入1molN2和3molH2,平衡正向移动,新平衡后N2体积分数为a%,N2转化率为b%;若减少0.5molN2和1.5molH2,平衡逆向移动,新平衡后N2体积分数为a%,N2转化率为b%,平均摩尔质量不变. (2)H2+I2(气)=(可逆) 2HI,加入1molH2和2molI2(气)达到平衡,若H2减少0.5 mol,I2减少1mol,平衡逆向移动,各物质含量不变. 分析:(a)判断平衡移动(略). (b)恒温恒压,若1molN2和3molH2达到平衡时为VL,则又加1molN2和3molH2达到平衡时为2VL,各同种物的浓度相同,是等效的,转化率相同,各同种物的含量相同,平均摩尔质量相同. 结论:恒温恒压条件下,只要保持相当于两反应物的物质的量之比为定值(可以任意扩大或缩小),即各同种物的物质的量浓度相同,均是等效关系. 3.第三次渗透是在可逆反应计算学习以后,学生已学会应用极限法和三步计算模式,再讨论第三类:“等效平衡”在计算中的应用. 三、探求简便方法 如果求得简便易懂的方法,难点不攻自破.我们将三步计算模式(始、变、平)改变为“变形三步”模式(始、变、始′),用于“等效平衡”的计算非常简单易学.关键是理解其中“平”变为“始′”,所以“变形三步”中的“始”与“始′”是等效关系.例3.在一定温度下,把2molSO2和1 molO2通过一个一定容积的密闭容器里,发生如下反应:2SO2+O2=(可逆) 2SO3.当此反应进行到一定程度时,反应混合物就处于化学平衡状态.现在该容器中,维持温度不变,令a,b,c分别代表初始加入SO2,O2,SO3的物质的量.如果a,b,c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时的完全相同,请填写下列空白: (1)若a=0,b=0,则c=_____________; (2)若a=0.5,则b=_____________和c=_____________; (3)若a,b,c取值必须满足的一般条件是(请用两方程式表示,其中一个只含a和c,另一个只含b和c)_____________. 分析:均是等效平衡关系. (1)c=2 (2)2SO2+O2 2SO3 始 2 1 0 变 1.5 0.75 1.5 b=0.25 始′ 0.5 0.25 1.5 c=1.5 (3)2SO2 + O2 2SO3 始 2 1 0 变 2-a1-b c 始′ a b c (2-a)/c=2/2 a+c=2 (1-b)/c=1/2 2b+c=2 恒温恒压时,必须用物质的量浓度的值代入计算. 例4.某恒温恒容的密闭容器充入3molA和2molB,反应:3A(气)+2B(气)=(可逆) xC(气)+yD(气)达到平衡时C的体积分数为m%.若将0.6molA,0.4molB,4molC,0.8molD作为起始物充入,同温同容下达到平衡时C的体积分数仍为m%,则x=_____________,y=_____________. 3A+ 2B xC+yD 始 3 2 0 0 变3-0.6 2-0.4 4 0.8 始′0.6 0.4 40.8 (3-0.6)/4=(3/x) x=5 (4/0.8)=(x/y) y=1 应用上述方法教学后,绝大部分学生认为:思路清晰、方法易学、有钻研兴趣.学生作业和测试结果均是做题快,准确度高.1年前查看全部
- 化学平衡题,急 (4)相同温度下,有相同体积的恒容密闭容器A和恒压密闭容器B, A容器中充入1molN2和3molH2、
化学平衡题,急 (4)相同温度下,有相同体积的恒容密闭容器A和恒压密闭容器B, A容器中充入1molN2和3molH2、B容器中充入2molN2和6molH2,充分反应达到平衡状态,A中NH3的体积分数为a ,放出热量Q1kJ;B中NH3的体积分数为b ,放出热量Q2kJ .则: a___b(填“>、=或
 shan136355399371年前1
shan136355399371年前1 -
 454957472 共回答了17个问题
454957472 共回答了17个问题 |采纳率100%a、=或1年前查看全部
- 反应NH 4 HS(s) NH 3 (g)+H 2 S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生
反应NH 4 HS(s)
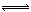 NH 3 (g)+H 2 S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是
NH 3 (g)+H 2 S(g),在某一温度下达到平衡。下列各种情况中,不能使化学平衡发生移动的是A.其他条件不变时通入SO 2 气体 B.移走一部分NH 4 HS固体 C.容器体积不变,充入N 2 D.压强不变时,充入N 2  最小人物1年前1
最小人物1年前1 -
 肖xiao晓 共回答了18个问题
肖xiao晓 共回答了18个问题 |采纳率88.9%BC
A能,通入SO 2 气体能与H 2 S反应使平衡向正反应方向移动;B不能移动;C不能移动;D能,保持压强不变,充入N 2 时容器体积必将增大,使各组分的浓度减小,平衡将向正反应方向移动;1年前查看全部
- 动态平衡和化学平衡的关系?
 小虫儿在飞1年前1
小虫儿在飞1年前1 -
 停滞陀螺 共回答了11个问题
停滞陀螺 共回答了11个问题 |采纳率90.9%可以说化学平衡是一个动态平衡从宏观上来说,反应是停止了.而从微观上,微观粒子仍然再不断的反应,只是正负反应速率相等,抵消了1年前查看全部
- 化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)=4mol/L.试确定B的起始浓度c(B)的取值范围是______;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是______.
①增加C的物质的量②加压③升温④使用催化剂
(2)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为c2(CO) c(CO2) ;c2(CO) c(CO2)
已知C(s)+H20(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌C0(g)+H20(g)的平衡常数为K2,则K与K1、K2二者的关系为______.
(3)已知某温度下,反应2SO2+02⇌2S03的平衡常数K=19.在该温度下的体积固定的密闭容器中,c0(SO2)=1mol•L-1c0(O2)=1mol•L-1,当反应在该温度下SO2转化率为80%时,该反应______ (填“是”或“否”)达到化学平衡状态,若未达到,向______ (填“正反应”或“逆反应”)方向进行.
(4)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=xkJ•mol-1;若a+b>c+d,增大压强平衡向______ (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则x______0(填“>”或“<”). 非礼勿看1年前1
非礼勿看1年前1 -
 戴维宁定理 共回答了14个问题
戴维宁定理 共回答了14个问题 |采纳率100%解题思路:(1)若A完全转化为C,B取最小值,若C完全转化为反应物,B取最大值;改变条件重新达到平衡后体系中C的体积分数增大,可使平衡正向移动或增加C;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比,已知的两个反应相加得到C(s)+CO2(g)⇌2CO(g),则K等于已知两个反应的平衡常数之积;
(3)2SO2+02⇌2S03
开始 1 1 0
转化0.8 0.4 0.8
转化80%后0.20.6 0.8
Qc=
=26.7>K;0.82 0.22×0.6
(4)增大压强,平衡向气体体积缩小的方向移动;升高温度,平衡向吸热的方向移动.(1)可逆反应A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)=4mol/L,
若A完全转化为C,消耗B为04mol/L,则B最小值为3mol/L,若C完全转化为反应物,生成2molB,则B的最大值为9mol/L,因反应为可逆反应,均不能完全转化,则B的浓度范围为3mol/L<c(B)<9mol/L;改变条件重新达到平衡后体系中C的体积分数增大,可使平衡正向移动或增加C,升高温度平衡正向移动,符合题意,而加压平衡逆向移动,使用催化剂平衡不移动,故选①③,
故答案为:3mol/L<c(B)<9mol/L;①③;
(2)K为生成物浓度幂之积与反应物浓度幂之积的比,反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为
c2(CO)
c(CO2),已知的两个反应相加得到C(s)+CO2(g)⇌2CO(g),则K等于已知两个反应的平衡常数之积,即K=K1×K2,故答案为:
c2(CO)
c(CO2);K=K1×K2;
(3)2SO2+02⇌2S03
开始 1 1 0
转化0.8 0.4 0.8
转化80%后0.20.6 0.8
Qc=
0.82
0.22×0.6=26.7>K,没有达到平衡,平衡向逆反应方向移动,故答案为:否;逆反应;
(4)增大压强,平衡向气体体积缩小的方向移动,a+b>c+d,增大压强平衡向正反应方向移动;升高温度,平衡向吸热的方向移动,由升高温度,平衡向逆反应方向移动,则x<0,故答案为:正反应;<.点评:
本题考点: 化学平衡的计算;化学平衡建立的过程;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查较综合,涉及化学平衡的影响因素、化学平衡的计算等,把握温度、压强对平衡的影响及可逆反应的特性、K的计算等为解答的关键,平衡常数K与反应的关系,题目难度不大.1年前查看全部
- 化学平衡中气体的体积分数和浓度还有密度,这三者算的时候体积怎么取得不一样啊
 高塔下的小镇1年前1
高塔下的小镇1年前1 -
 anonymities 共回答了12个问题
anonymities 共回答了12个问题 |采纳率83.3%谁知道,这要问当初设计这个的人,所以要注意变换单位1年前查看全部
- 化学平衡 化学反应速率浓度时间图像 斜率表示瞬时速率吗?
化学平衡 化学反应速率浓度时间图像 斜率表示瞬时速率吗?
浓度时间图像 斜率表示瞬时速率吗? 斜率等于0 速率等于0吗 平衡状态 斜率不是为零吗 爱淘一族1年前1
爱淘一族1年前1 -
 玛特 共回答了16个问题
玛特 共回答了16个问题 |采纳率93.8%斜率是表示瞬时速率.斜率为0,表示反应达到平衡状态,正逆反应速率相等.1年前查看全部
- 恒温恒压下,在一个可变容积的容器中充入与反应有关气体,化学平衡怎么移动?
 liusy011年前1
liusy011年前1 -
 男ss 共回答了21个问题
男ss 共回答了21个问题 |采纳率90.5%你充入什麼,那麼平衡就要减弱它的增多,那麼就朝消耗它的方向反应.1年前查看全部
- 化学平衡常数的由来我是一名高二的学生,我们刚刚学习了化学平衡,学习了平衡常数,我想知道平衡常数是怎么发现的,另外,为什么
化学平衡常数的由来
我是一名高二的学生,我们刚刚学习了化学平衡,学习了平衡常数,我想知道平衡常数是怎么发现的,另外,为什么各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数(也就是为什么K值是一定的),能不能解释一下?
请不要直接拷贝百度知道上的词条,因为我之所以问就是因为词条里没有 最爱的aa爱131年前1
最爱的aa爱131年前1 -
 yu04ren 共回答了18个问题
yu04ren 共回答了18个问题 |采纳率88.9%化学平衡常数 是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数。平衡常数一般有浓度平衡常数和压强平衡常数。
(1)平衡常数表达式及其意义
对于化学反应 mA+nB(可逆号)pC+qD
在一定温度下达到化学平衡时,其平衡常数表达式为:
k=[c(C)^p*c(D)^q]/[c(A)^m*c(B)^n],
在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
(2)平衡常数的测定
平衡常数可以用实验方法测定,也可以利用热力学数据计算而得。
实验方法通常有化学方法和物理方法。
化学方法是通过化学分析法测定反应达到平衡时各物质的浓度。但必须防止因测定过程中加入化学试剂而干扰了化学平衡。因此,在进行化学分析之前必须使化学平衡“冻结”在原来平衡的状态。通常采用的方法是采取骤冷、稀释或加入阻化剂使反应停止,然后进行分析。例如,要测定反应2H2+O2(可逆号)2H2O在2 000 ℃达到平衡时的平衡常数,可以将一定量的水置于耐高温的合金管中加热,在2 000 ℃时保持一段时间,使之达到化学平衡。然后,将管子骤然冷却,再分析其中H2O、H2、O2的含量,便可计算出在2 000 ℃时这个反应的平衡常数。
物理方法就是利用物质的物理性质的变化测定达到平衡时各物质浓度的变化,如通过测定体系的折光率、电导、颜色、压强或容积的改变来测定物质的浓度。物理方法的优点是在测定时不会干扰或破坏体系的平衡状态。
(3)平衡常数的单位
平衡常数有标准平衡常数和非标准平衡常数之分,前者的量纲为一,后者的量纲取决于平衡常数的表达式。
根据标准热力学函数算得的平衡常数是标准平衡常数,记作K?,又称之为热力学平衡常数;用平衡时生成物对反应物的压力商或浓度商表示的平衡常数是经验平衡常数(Kp或Kc),或称作非标准平衡常数。中学教材中涉及的平衡常数是经验平衡常数。
大家知道,一些重要的热力学函数,如U、H、F、G等的绝对值是无法确定的。为了计算它们的相对大小,需要统一规定一个状态作为比较的标准,这样才不致引起混乱。所谓标准状态是指在温度T和标准压力 (101 325 Pa)下物质的特定状态,简称标准态。热力学数据表中的标准态,国际上都已有明确规定。
对于反应物计量系数之和等于生成物计量系数之和的反应,其经验平衡常数是无量纲的纯数,与压力、浓度所用的单位无关,而且也等于标准平衡常数之值。
对于反应物计量系数之和不等于生成物计量系数之和的反应,则其经验平衡常数是有量纲的量,其数值就与压力、浓度所用的单位有关。也只有当压力、浓度的单位与热力学数据表中对应标准态的单位相同时,所计算的经验平衡常数数值才能与标准平衡常数数值相同。
催化剂对反应速率、化学平衡的影响
对于一个确定的可逆反应来说,由于反应前后催化剂的化学组成、质量不变,因此,无论是否使用催化剂,反应的始、终态都是一样的,则反应的标准吉布斯函数变化是相等的,催化剂对化学平衡无影响。
一个化学反应采用同一种催化剂,可以同等程度改变正、逆反应速率。1年前查看全部
- 化学平衡移动的含义化学平衡向某个方向移动的含义是什么?请赐教,
 wgz19621年前1
wgz19621年前1 -
 handapple 共回答了27个问题
handapple 共回答了27个问题 |采纳率81.5%这里涉及到了化学反应限度的问题.
绝大多数的化学反应是可逆反应,反应物消耗掉,产生生成物,而同时生成物也会逆向地生成反应物.化学反应限度是指一个化学反应达到动态平衡,即有多少反应物消耗,同时又有多少反应物生成,所以从表面看反应似乎停止了.
而LZ提到的化学平衡移动就是指这个平衡被打破,反应朝着一个方向进行(可以是正反应也可以是逆反应).如向反应器皿中加入更多的反应物,反应物物质的量增多,整个反应就会向正方向倾斜(反应物减少、生成物增多),而有生成物向反应物的反应受到抑制.
如果LZ还不懂,可以这样理一个反应就像一个天平,当达到反应限度时天平平衡了,而当外加的条件影响了其中一边,平衡被打破,反应就会倾向于一方.这就是通俗理解的化学平衡移动1年前查看全部
- 现向一密闭容器中充入1mol N2与3molH2 ,在一定条件下反应,达到化学平衡时,N2与H2物质的量浓度之比1:3,
现向一密闭容器中充入1mol N2与3molH2 ,在一定条件下反应,达到化学平衡时,N2与H2物质的量浓度之比1:3,
讲明白就好,量浓度不是等于物质的量除以体积吗,无质量之比还等于速率之比,我觉得是1:3,可答案不选这个. wangpeng2791年前1
wangpeng2791年前1 -
 jslxt 共回答了16个问题
jslxt 共回答了16个问题 |采纳率100%化学平衡?就是反应物和生成物共存,正反应速率等于逆反应速率从而达到化学平衡,并不是完全反应只有生成物而是反应物和生成物共存,所以是小于1:3.1年前查看全部
- 化学反映速率,化学平衡可逆反应进行过程中,若开始只有反应物,没有生成物,则V(正)最大,V(逆)为零.随着反应的进行,反
化学反映速率,化学平衡
可逆反应进行过程中,若开始只有反应物,没有生成物,则V(正)最大,V(逆)为零.随着反应的进行,反应物的浓度逐渐减小,正反应速率就逐渐减小;逆反应速率逐渐增大,最终达到平衡.
那么
问题一:有没有可能在反应刚刚开始的时候,同时向容器内加入生成物和反应物,那么此时V(逆)不为零,有没有可能使V(正)=V(逆),即达到化学平衡?如果可以各物质应该加入多少?(可举例)
问题二:在一个可逆反应达到平衡的时候,若必须要加入一定反应物(生成物,都可以),但又要保持化学平衡不变,各物质应加多少?为什么?
问题二分衡容和衡压两种情况来答,请从本质影响,即浓度上回答!谢谢! zcm94181年前3
zcm94181年前3 -
 oyming2006 共回答了18个问题
oyming2006 共回答了18个问题 |采纳率94.4%问题一:可以
例如:N2 + 3H2 2NH3,假设开始加10分子N2,30分子H2,不加入生成物,再假设平衡时状态为9分子N2,27分子H2,2分子NH3,那么如果想要一开始即达到反应平衡,只需开始时加入9分子N2,27分子H2,2分子NH3就行了(恒容,恒压都可以,)
问题二:若还是用上面的例子,恒容时不可能加入反应物或生成物后继续保持平衡
恒压时只需要按反应平衡时的比例同时添加反应物及生成物就可以了,或者按反应开始的比例加反应物,或者按反应进行完全的比例加生成物.
但是如果是如同N2+O22NO的例子(此例中反映前后压强不变),不管是恒容还是恒压,按比例添加就可以1年前查看全部
- 增大压强,会使化学平衡向着气体体积缩小的方向移动,减小压强向体积增大移动.不要用平衡定理解释
 dragonluo1年前1
dragonluo1年前1 -
 天平上的鸭子 共回答了27个问题
天平上的鸭子 共回答了27个问题 |采纳率88.9%增大压强实际上就是减小气体体积.所以一旦增压,气体体积就要减小,方程式左右哪一边化学计量数比较小,意味着体积比较小,于是就往气体体积缩小的方向移动了.减小压强同理.1年前查看全部
- 影响化学平衡的因素
影响化学平衡的因素

 roses11年前2
roses11年前2 -
 gjrichard 共回答了17个问题
gjrichard 共回答了17个问题 |采纳率88.2%化学平衡移动的首要条件是可逆反应,也就是反应物和生成物在相同条件下可以相互转化.知道这些,所谓化学平衡移动就 是正逆反应进行的程度.一般的影响条件是温度,压强,反应物或生成物多少等等1年前查看全部
- 化学平衡的转化率转化率与哪些因素有关?若转化率一定是否代表着各物的含量比值不变
 dd的妈1年前3
dd的妈1年前3 -
 yizo 共回答了21个问题
yizo 共回答了21个问题 |采纳率95.2%转化率与温度有关,
在反应中气体总量反应物与生成物不同情况下,与压强有关.
还与各组分浓度有关,当然固体就没有什么浓度概念了,所以即使增加固体反应物,平衡也不变,转化率不变
注意的是,江月说的催化剂并不影响转化率,催化剂只改变反应速率.
转化率相同,则相当于等效平衡,各组分笔直一定1年前查看全部
- 化学平衡习题XYZ三种气体,取X&Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y==2Z(可逆反应)
化学平衡习题
XYZ三种气体,取X&Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y==2Z(可逆反应),达到平衡状态,测得混合气体中反应物总物质的量与生成物的总物质的量之比为3:2则Y的转换率最接近于
A33% B40%C50%D65%
希望有详细解答过程...谢谢 lx_07231年前1
lx_07231年前1 -
 skywalker0626 共回答了11个问题
skywalker0626 共回答了11个问题 |采纳率81.8%因为恒容,所以设X,Y的起始浓度均为amol,X转化了bmol
由方程式 X + 2Y 2Z
起始:a a 0
转化:b 2b 2b
平衡:(a-b)(a-2b) 2b
所以(a-b+a-2b):(2b)=3:2所以可得b=a/3
故平衡时n(Y)=a-2b=a/3
所以Y的转化率=【(a-a/3)/a】×100%=66.67%
所以选D1年前查看全部
- 化学平衡中的增大压强是用什么办法?除了压缩体积还有什么方法?
 左岸对面1年前1
左岸对面1年前1 -
 woshibiaoge 共回答了17个问题
woshibiaoge 共回答了17个问题 |采纳率88.2%一般是压缩体积
另一种就是增大投入(体积固定)1年前查看全部
- 化学平衡与速率1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平
化学平衡与速率
1、两容器A和B,A恒压,B恒容,容积相等,起始时分别向AB通入体积比2:1的等量的SO2和O2,并达到平衡.问起始时两容器中的反应速率___较大;反应过程中的反应速率___较大.(说明原因)
2、某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)===2Q(g).平衡时,各物质的浓度比为A:B:C=1:1:2,保持温度不变,以1:1:2的体积比再充入A、B、Q,则下列说法正确的是:
A、刚充入的反应速率V正减少,V逆增大
B、达到新的平衡时,反应混合物中AB的物质的量分数增加
C、达到新的平衡时,ABQ浓度之比仍为1:1:2
D、达到新的平衡过程中,体系压强先增大,后逐渐减小
3、将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间的关系如图(可惜不能显示出来),在下列因素中:
1.盐酸的浓度 2.镁带的表面积 3.溶液的浓度 4.氢气的压强 5.氯离子浓度
影响反应速率的因素有_________
解释图中速率增大段AB形成的原因_________
解释图中速率到达最大值后速率逐渐减小段的原因_________
 Nancylu83161年前1
Nancylu83161年前1 -
 chenyigirl 共回答了20个问题
chenyigirl 共回答了20个问题 |采纳率95%1.起始时速率相等.因所有条件都一样,速率也一样.反应过程中恒压容器中速率快.因这是一个等体积气体反应,恒压时体积会减小,浓度相对恒容的要大,所以速率快.
2.D.
A.速率都增大
B.此操作相当于加压,平衡向正反应移动.Q体积分数增大.
C.因平衡发生移动,比值变化.若是恒压,平衡不移动,则不变.
D.刚充入时,压强增大,因平衡向右移动,分子数减少,压强减小.
3.影响因素:123
AB增大是因为该反应放热,温度上升,速率增大.
过B后是因为盐酸浓度减小太多,浓度的影响超过了温度的影响,所以速率减小.1年前查看全部
- 化学平衡问题 高手请进……体积相同的甲、乙两个容器中,分别都充入1mol的下列反应物, 在反应过程中,甲容器保持体积不变
化学平衡问题 高手请进……
体积相同的甲、乙两个容器中,分别都充入1mol的下列反应物, 在反应过程中,甲容器保持体积不变,乙容器保持压强不变. 下列说法正确的是 ( AB )
选项 反应物 反应 转化率
A SO3 2SO3 =2SO2 + O2 甲 风情-0071年前1
风情-0071年前1 -
 sammonkey 共回答了16个问题
sammonkey 共回答了16个问题 |采纳率87.5%A.反应前后气体体积增大,甲容器体积不变,则压强变大,平衡向左移动,反应物转化率降低,乙容器压强不变,则体积变大,等效为减压,平衡右移,反应物转化率增大.B同理
C.反应前后气体体积不变,因此无论恒压还是恒容都不影响平衡移动,即反应物转化率不变1年前查看全部
- 在化学平衡那章里,对于N2+3H2=2NH3这个反应,书上怎么就知道它是体积减小的反应呢?怎么就知道是1体积的N2和和3
在化学平衡那章里,对于N2+3H2=2NH3这个反应,书上怎么就知道它是体积减小的反应呢?怎么就知道是1体积的N2和和3体积的H2反应生成2体积的NH3呢?也许有人会说根据理想气体方程体积比等于物质的量之比从而得出的?但问题是得出这个结论要在同温同压下啊?这个反应难道一定是同温同压下吗?
 生活de平淡1年前5
生活de平淡1年前5 -
 eryeryrey 共回答了16个问题
eryeryrey 共回答了16个问题 |采纳率87.5%假设反应完全,4份体积的气体得到的是2份体积的空气.所以这个是体积减小的反应..至于为什么是2体积的氨气,根据化学方程式配平就可以得到.
化学平衡问题和其他的化学反应不同,化学平衡指的是动态平衡,它只是遵循了这样的规律.学习化学平衡只要记住规律,按照规律做题就可以了,至于其中的奥妙.恐怕你们化学老说都说不清楚
高中毕业快两年了,化学的东西也忘的差不多了,但学习化学平衡的时候还是不要钻牛角尖的好,不然只会越来越乱.只要记着规律,方法,一切问题都搞的定.
仅个人意见.说错了不承担责任.呃==!1年前查看全部
- 在一密闭容器内盛有溴化氢气体,在一定温度下建立如下化学平衡:2HBr=H2(g)+Br2(g)(正反应吸热),如果升高温
在一密闭容器内盛有溴化氢气体,在一定温度下建立如下化学平衡:2HBr=H2(g)+Br2(g)(正反应吸热),如果升高温度,正反应速率会增大,逆反应速率会增大.
那如果降低温度呢?正反应速率跟逆反应速率会怎么变化
为什么逆反应速率会增大? 70bacwui1年前3
70bacwui1年前3 -
 灯火滥觞夜贵人 共回答了25个问题
灯火滥觞夜贵人 共回答了25个问题 |采纳率88%应该是和加热相反吧1年前查看全部
- 化学平衡中,正反应到底是放热还是吸热?如果是放热或者吸热,升温后,平衡向哪里移动
 keramune1年前3
keramune1年前3 -
 树一棵 共回答了15个问题
树一棵 共回答了15个问题 |采纳率93.3%正反应可以放热也可以吸热,要看这个反应的性质.
若是放热,升温后,平衡逆向反应.你想啊,人家本来就放热了,不要热,你还要给他热,那他当然扛不住,要回去了.1年前查看全部
- 以体积比为1∶3的氮气、氢气混合气体,通入密闭固容容器中,在一定条件下发生反应,达到化学平衡时,混合气体中N2的体积分数
以体积比为1∶3的氮气、氢气混合气体,通入密闭固容容器中,在一定条件下发生反应,达到化学平衡时,混合气体中N2的体积分数是a%(a
 寂莫女人1年前1
寂莫女人1年前1 -
 ivyholly 共回答了20个问题
ivyholly 共回答了20个问题 |采纳率90%反应前氮气、氢气按1∶3通入,反应按1∶3进行,所以平衡时氮气、氢气仍为1∶3.取平衡时气体100mol,则其中氮气为a mol,氢气为3a mol,氨气为(100-4a)mol.由N2 + 3H2 = 2NH3可看出,生成氨气的物质的量即等于反应减少的物质的量,故反应前氮气、氢气混合气体的物质的量为100+(100-4a)=200-4a mol.
(1)混合气中NH3的体积分数是(100-4a)/100
(2)容器内的压强为反应前100/(200-4a )倍1年前查看全部
- 在某容积为2升的密闭容器中,充入5克N2O4气体,在1.01*100000Pa,45摄氏度下建立化学平衡,
在某容积为2升的密闭容器中,充入5克N2O4气体,在1.01*100000Pa,45摄氏度下建立化学平衡,
此时1mol混合气体占有体积为26.1升,求上述平衡气体中NO2质量分数. mz_han1年前1
mz_han1年前1 -
 小龙人1号 共回答了16个问题
小龙人1号 共回答了16个问题 |采纳率87.5%N2O4在该条件下,一部分 分解为 NO2
N2O4 = 2 * NO2
设 平衡气体中有 N2O4 x克,有NO2 y克
则根据质量守恒
x + y = 5
N2O4 分子量 = 2*14 + 4*16 = 92
NO2 分子量 = 14 + 2*16 = 46
N2O4 的mol量 = x/92
NO2 的mol量 = y/46
则
x/92 + y/46 = 2/26.1
联立两个方程
x/92 + y/46 = 2/26.1
x + y = 5
x+ 2y = 2*92/26.1
x+y + y = 2*92/26.1
5 + y = 2*92/26.1
y = (2*92 - 5*26.1)/26.1 = 2.05 克
平衡气体中NO2质量分数 = 2.05/5 = 41%1年前查看全部
- 升高温度,化学平衡会向着吸热反应的方向移动,此时放热反应的反应速率会减小吗?
 小香1591年前2
小香1591年前2 -
 欧阳淼 共回答了23个问题
欧阳淼 共回答了23个问题 |采纳率95.7%温度升到,化学反应速率增加 因此放热反应的反应速率也是增加的1年前查看全部
- 下列关于化学平衡常数的说法正确的是( ) A.化学平衡发生移动,平衡常数必发生变化 B.平衡常数发生变化,化学平衡必发
下列关于化学平衡常数的说法正确的是( )
A.化学平衡发生移动,平衡常数必发生变化 B.平衡常数发生变化,化学平衡必发生移动 C.改变浓度,平衡常数一定改变 D.催化剂改变达到平衡的时间,必引起平衡常数的改变  蝶舞飞儿1年前1
蝶舞飞儿1年前1 -
 almondroca 共回答了16个问题
almondroca 共回答了16个问题 |采纳率93.8%B
化学平衡常数只与温度有关,与浓度、压强、催化剂无关;平衡发生移动,是由于Q≠K,可能是Q发生了变化,平衡常数不一定发生变化,但平衡常数发生变化,化学平衡必发生移动。1年前查看全部
- 为什么升高(降低)体系温度,化学平衡朝吸(放)热方向移动是?其原理是什么?
 zhouming08011年前1
zhouming08011年前1 -
 kss394071335 共回答了24个问题
kss394071335 共回答了24个问题 |采纳率91.7%化学平衡的内涵是:所有的反应都可视作是可逆的,达到平衡时,正反应速率等于逆反应速率.而根据经典化学动力学的理论,也就是碰撞理论,要发生反应,必须满足以下几个条件:1、分子要碰撞.2、碰撞的分子能量需要比反应需...1年前查看全部
- 为什么说化学平衡反应中,前后体积相等的反应,压强和总物质的量一定时不能作为平衡标志?
 icesky1年前4
icesky1年前4 -
 ff小男孩 共回答了20个问题
ff小男孩 共回答了20个问题 |采纳率90%比如H2+I2=2HI,对这样的气体反应来说,反应过程中任何一个时间点的体积相等,则物质的量也相等.由PV=nRT可以知道,由于反应整个过程中V不变,n不变,T也不变,所以P也不变,因此压强和总物质的量一定时不能作为平衡标志1年前查看全部
- 对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使
对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),在一定条件下建立化学平衡后,下列各条件变化时,能使平衡正向移动的是( )
A.恒温恒容通入He
B.再通入少量CO2
C.温度升高
D.加压 降落凡间1年前1
降落凡间1年前1 -
 dayubird 共回答了24个问题
dayubird 共回答了24个问题 |采纳率95.8%解题思路:对于反应2CO(g)+O2(g)⇌2CO2(g)(正反应为放热反应),该反应中,气体的化学计量数减少,反应放热,改变下列条件,可以使平衡向着正反应方向移动的因素是降温,增大反应物浓度、加压等.A、恒温恒容通入He,总压增大,分压不变,平衡不动,故A错误;
B、再通入少量CO2 ,增大生成物浓度,平衡逆向进行,故B错误;
C、反应是放热反应,温度升高,平衡逆向进行,故C错误;
D、反应前后气体体积减小,加压平衡向气体体积减小的方向进行,平衡正向进行,故D正确;
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学平衡的影响因素,题目难度不大,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.1年前查看全部
- 压强增大,可逆反应的化学平衡怎样移动
 swgwg1年前1
swgwg1年前1 -
 liao_3701 共回答了17个问题
liao_3701 共回答了17个问题 |采纳率82.4%如反应:M(g)+N(g)=P(g)+Q(g)
如上反应,左右气体物质的系数之和相同,则化学平衡不移动.
如反应:M(g)+N(g)=P(g)+Q(l)
如上反应,压强增大,化学平衡向气体体积减小的方向移动,即向上面化学方程式中的正方向移动.
如反应:M(g)+N(s)=P(g)+Q(g)
如上反应,压强增大,化学平衡向气体体积减小的方向移动,即向上面化学方程式中的逆方向移动.1年前查看全部
- 为什么对反应前后气体总体积发生变化的化学反应,在其他条件不变的条件下,增大压强,会使化学平衡向气体体积减小的方向移动?增
为什么对反应前后气体总体积发生变化的化学反应,在其他条件不变的条件下,增大压强,会使化学平衡向气体体积减小的方向移动?增大压强,不一定会使化学平衡向气体体积减小的方向移动.所以大家只要告诉我上面提到的“在其他条件不变的条件下”的“其他条件”指的是什么?
比如充入不参加反应的N2,那么压强也变大了,但是平衡不会移动的吧!这个也应该属于“其他条件”? 单身的潜逃1年前4
单身的潜逃1年前4 -
 红桑牡丹 共回答了27个问题
红桑牡丹 共回答了27个问题 |采纳率100%其他条件指的是:反应物(生成物)浓度、温度、催化剂.
催化剂不改变平衡,只加速快减缓反应速度.
一般在研究平衡时,所考虑的因素主要为4个,即:反应物(生成物)浓度、压强(体积)、温度、催化剂.
之所以增大压强,不一定会使化学平衡向气体体积减小的方向移动是因为此处未考虑改变温度、增加或减少反应物(生成物)浓度对反应平衡的影响.
关于楼主补充的那个问题,通过改变压强来改变反应平衡的本质是使体系各组分的浓度发生变化,这样的压强变化在反应平衡中可以成为有效压强变化;而冲入N2使压强增大却并未改变各组分的浓度,所以这个压强的改变为无效变化.这只是题型中常见的一种考法,而不作为影响平衡的主要因素进行研究.关于平衡移动的研究我们只考虑主要因素,即上述中的四点,一般指的其它条件为这四种条件.当然也有特例,比如楼主所说的这种情况,就是“不一般”的情况下的条件需要特殊对待.
还有什么不明白的可以问我哦,很乐意为你解答.1年前查看全部
- 化学平衡,望详解将3molA和2.5molB混合与2L的密闭容器中,发生反映的化学方程式:3A(g)+B(g)===xC
化学平衡,望详解
将3molA和2.5molB混合与2L的密闭容器中,发生反映的化学方程式:3A(g)+B(g)===xC(g)+2D(g),5min后达到化学平衡,容器内的压强减小,已知D的平衡反应速率为0.1mol/L.min,填空
1.A的平均反应速率为
2.平衡时C的浓度
3.平衡时B的转化率
4.平衡时,容器内的压强与原容器内的压强之比
还有,我搞不懂压强为什么变化 sunhao15731年前1
sunhao15731年前1 -
 烧饼王 共回答了24个问题
烧饼王 共回答了24个问题 |采纳率87.5%达到化学平衡,容器内的压强减小,就说明3+1>x+2,x只能等于1
D的平衡反应速率为0.1mol/L.min提醒我们,
平衡时D物质的量为0.1×2×5=1mol
3A(g)+B(g)===C(g)+2D(g)
起始 3 2.5 0 0
转化 1.5 0.5 0.5 1
平衡 1.5 2 0.5 1
计算出上述数据后就可以计算了
1.A的平均反应速率为1.5÷2÷5=0.15
2.平衡时C的浓度0.5÷2=0.25
3.平衡时B的转化率0.5/2=25%
4.平衡时,容器内的压强与原容器内的压强之比(1.5+2+0.5+1)/(3+2.5)=10:11
至于压强变化,是因为方程式
设方程式为mA+nB=pC+qD(ABCD均为气体)
若m+n=p+q,压强不变
若m+n>p+q,压强变小
若m+n1年前查看全部
- 关于化学平衡的一个小小的疑惑.①.恒温恒压条件下,2SO2+O2=2SO3这个反应已经达到平衡以后,往体系中加入同温度的
关于化学平衡的一个小小的疑惑.
①.恒温恒压条件下,2SO2+O2=2SO3这个反应已经达到平衡以后,往体系中加入同温度的气态SO3,请问化学平衡如何移动,反应如何进行?
另外想问一下,存在反应一直逆向进行,但是结果最后平衡正移的吗? youbing9991年前1
youbing9991年前1 -
 我爱米妮 共回答了19个问题
我爱米妮 共回答了19个问题 |采纳率89.5%先回答你的一个问题:
加入SO3后,由于SO3量的增加,压强的增加,使得反应向相反的方向移动,也就是消耗SO3,即:逆反应方向
其实在化学平衡的题中,只要始终牢记:化学平衡的原则就是外因导致增加或减少,内因往相反的方向移动.1年前查看全部
- 高二化学 在高一基础上讲化学反应速率和化学平衡的 有关问题
高二化学 在高一基础上讲化学反应速率和化学平衡的 有关问题
我不懂压强对化学速率 和平衡的影响。
1、老师说压强的影响实质是对浓度的影响, 我认为 如果压强改变(假设都有气体参加反应)浓度不变。那反应速率和平衡都不变。 如果压强变 浓度变, 那速率一定 改变 ,升高或者降低。 然后再看化学反应系数 来判断平衡是否改变 。我这么想对吗? 或者还有什么需要注意的
2、浓度对速率和平衡的影响,增大 无论是反应物还是生成物 的浓度。 所有的速率都增大吗? 在这块 有个图像 增大浓度 图像之间有连接点 如下图。 其余的图像没有连接点吗? 求大神指导
 蟑螂1431年前4
蟑螂1431年前4 -
 maocyoee 共回答了16个问题
maocyoee 共回答了16个问题 |采纳率93.8%理解上有漏洞,原因是对化学平衡的理解没透彻.
1、压强的影响实质浓度的影响.要注意,题目中说,浓度怎么怎么变,那就等于压强怎么怎么变,反之依然.还可以看成,浓度变了,压强一定变,因为“浓度就是压强”(可以这样理解),不存在压强改变而浓度不变的情况.
2、要注意,只有在其它因素(压强、温度)不变的情况下,无论增大反应物还是生成物的浓度.,所有的速率都增大,这是对的.
3、突然急速减小温度、浓度的时候没有连接点(还有其他)1年前查看全部
- 平衡常数改变影响化学平衡的其它条件时,即使平衡发生移动,K值不变 但是平衡移动了的话为什么K值会不变呢
 joygod1年前2
joygod1年前2 -
 di7pnc 共回答了20个问题
di7pnc 共回答了20个问题 |采纳率95%K值只与温度有关,与其它因素无关.
正是因为与K值所处的状态比较,才能判断出平衡移动的方向;也就是说,K值就是参照点(类似于坐标的原点).1年前查看全部
- 化学平衡判断时,用速率判断是不是非要写:v正:v逆=几比几,不能省略
化学平衡判断时,用速率判断是不是非要写:v正:v逆=几比几,不能省略
如N2+3H2=2NH3 V(N2):V(NH3)=1:2错误,而 V(N2)正:V(NH3)逆=1:2对 将发行价格和规1年前2
将发行价格和规1年前2 -
 长飞丸 共回答了17个问题
长飞丸 共回答了17个问题 |采纳率70.6%是一定要写的,因为这是一个可逆反应.
N2、H2在生成NH3的同时(即正反应进行的同时)
NH3也在分解为N2、H2(逆反应也在进行)
且二者未必相同(反应未达到平衡时)
所以在用速率判断时要注明反应的方向.1年前查看全部
- 对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是( )
对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是( )
A.化学反应速率变化时,化学平衡一定发生移动
B.化学平衡发生移动时,化学反应速率一定变化
C.可逆反应进行得越彻底,化学反应速率就越大
D.只有在催化剂存在下,才会发生化学反应速率变化而化学平衡不移动的情况 ycbb3661年前1
ycbb3661年前1 -
 潜川男人 共回答了20个问题
潜川男人 共回答了20个问题 |采纳率90%解题思路:化学平衡是否发生变化,取决于正逆反应速率的关系,如正逆反应速率相等,则平衡不移动,如正反应速率大于逆反应速率,平衡向正反应方向移动,否则向逆反应方向移动.A.正逆反应速率都变化但仍相等,则平衡不移动,故A错误;
B.化学平衡发生移动时,正逆反应速率不等,一定发生变化,故B正确;
C.可逆反应进行的彻底是反应限度的内容,和化学反应速率之间没有必然联系,故C错误;
D.如反应前后气体的体积不变,增大压强,平衡也不移动,故D错误.
故选B.点评:
本题考点: 化学平衡的影响因素;化学反应速率的影响因素.
考点点评: 本题考查化学平衡与反应速率的关系,题目难度不大,注意反应是否处于平衡状态,取决于正逆反应速率的大小关系.1年前查看全部
- 化学中为什么说增加固体或纯液体的量,化学平衡不移动?
化学中为什么说增加固体或纯液体的量,化学平衡不移动?
增加后反应物的接触面积增加,所以正反应速率加快,导致平衡向正方向移动. xxl2991年前1
xxl2991年前1 -
 singlesv 共回答了17个问题
singlesv 共回答了17个问题 |采纳率88.2%化学平衡移动时(都是气体影响平衡的移动),
固体和纯液体既不能改变气体压强,也不能改变气体浓度!
所以对平衡移动没有影响,你这点增大接触面积增大反应速率简直就可以忽略不计了!因为影响太少了!1年前查看全部
- 一道化学平衡问题已知可逆反应2A=B+C,A状态不明,B为气态,C为固态,恒压下平衡时升高温度气体密度增大.问为什么平衡
一道化学平衡问题
已知可逆反应2A=B+C,A状态不明,B为气态,C为固态,恒压下平衡时升高温度气体密度增大.
问为什么平衡体系中加少量C,平衡会向逆反应方向移动?不是说增加固体的量,其固体浓度不变,不影响移动吗? 呵牛1年前2
呵牛1年前2 -
 catmiu 共回答了18个问题
catmiu 共回答了18个问题 |采纳率94.4%可以肯定A为气态,“恒压下平衡时升高温度气体密度增大”,若A为固态,则体系中只有B为气态,恒压下平衡时升高温度气体密度就会不变的.
但平衡体系中加少量C,平衡是不会移动的1年前查看全部
- 关于化学平衡的移动理解的问题:三个外界条件(P即压强 T即温度 C即浓度)中C改变的情况我懂了.但 见下
关于化学平衡的移动理解的问题:三个外界条件(P即压强 T即温度 C即浓度)中C改变的情况我懂了.但 见下
但P增大时,对于反应mA (g) +nB (g) = pC (g) +q D(g)(可逆符号打不出)若m + n >p + q.V(正)>V(逆) 为什么正反应速率会比逆反应速率快?
还有
△H<0(放热)
升温,平衡正方向移动.
我理解为:升温,于是要朝能减弱升温方向移动,即吸热方向,但是正逆哪个是吸热方向?
我现在是知道勒夏特列原理但是不知道怎么用 prince00001年前5
prince00001年前5 -
 _碎了 共回答了17个问题
_碎了 共回答了17个问题 |采纳率82.4%如果改变影响平衡的一个因素,平衡就向能够减弱这种改变的方向移动,以抗衡该改变.
这个的前提是ABCD是气体,正反应使得压强降低,逆反应使得压强增大,如果抗衡压强增大这一情况的话,就要降低压强,也就是正反应的速率大于逆反应.
△H<0是放热反应,也就是正反应进行时,放出热量,相对的逆反应就是吸收热量.所以升温的话,是想逆反应移动,吸收热量.1年前查看全部
- 化学平衡中2种气体反应,只改变其中一种气体浓度,v(正)图形曲线怎么变?
化学平衡中2种气体反应,只改变其中一种气体浓度,v(正)图形曲线怎么变?
比如说aX+bY=(可逆)=cW+dZ,都是气体,达到平衡后,我同时减小X的浓度和增大Y的浓度,也就是说不同时增加或减少所有反应物,而是一个增一个减.
我知道这应该由浓度商和K来判断是否移动,但是在v-t图像中,v(正)的图像怎么变呢?化学反应速率图像中的纵轴v到底能定量吗?这个时候一个增一个减,怎么定量分析总的正反应速率呢?
求解惑,谢谢了.
 Jing_riza1年前1
Jing_riza1年前1 -
 罗盛峰5168 共回答了23个问题
罗盛峰5168 共回答了23个问题 |采纳率82.6%对于aX+bY=(可逆)=产物,速率方程为:v=k·c(X)^x·c(Y)^y
其中k是速率常数,x、y是反应级数.对基元反应,x=a,y=b.
由以上,可以定量分析总的正反应速率.
这些是大学普通化学学习的内容.1年前查看全部
- 在含有弱电解质的溶液中,往往有多个化学平衡共存.
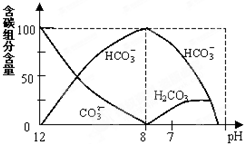 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是______
A.c(HA)<c(A-)B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-)D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示.
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”)______大量共存.
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:______.
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=
=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=______.c(H
)c(OH)CO −3c(
)CO 2−3 upbbq1年前1
upbbq1年前1 -
 绝对欠揍 共回答了21个问题
绝对欠揍 共回答了21个问题 |采纳率95.2%解题思路:(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,得到溶液溶质为NaA和HA,溶液pH大于7,说明A-离子水解程度大于HA电离程度;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,以此分析解答.(1)0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后,反应后得到等量的HA、NaA,溶液pH大于7,则盐类水解大于酸的电离,
A. 水解生成HA,则c(HA)>c(A-),故A错误;
B.因等体积混合,则反应后c(HA)一定小于0.1mol/L,故B错误;
C.反应后得到等量的HA、NaA,则2c(Na+)=c(HA)+c(A-),故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(A-),又2c(Na+)=c(HA)+c(A-),则c(OH-)=c(H+)+[1/2][c(HA)-c(A-)],故D正确;
故答案为:D;
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,
①由反应及图象可知,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,故答案为:不能;
②当pH=7时,溶液中溶质为碳酸氢钠、氯化钠,离子浓度大小为:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
故答案为:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-)>c(CO32-);
③水解常数Kh=
c(HCO3−)c(OH−)
c(CO32−)=2×10-4,当溶液中c(HCO3-):c(CO32-)=2:1时,c(OH-)=10-4mol/L,由Kw可知,c(H+)=10-10mol/L,所以pH=10,
故答案为:10.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子方程式的有关计算;pH的简单计算.
考点点评: 本题考查较综合,涉及溶液中离子浓度大小分析,化学平衡常数的计算及溶液中酸碱之间的反应,题目难度较大,综合考查学生分析问题、解决问题的能力,注重能力的考查.1年前查看全部
- 增加或减少化学平衡时的反应物或生成物浓度对反应有影响吗?如果有反应速率怎么变?麻烦讲得通俗点,谢谢
 844920351年前2
844920351年前2 -
 ss燃烧 共回答了25个问题
ss燃烧 共回答了25个问题 |采纳率88%这应该是高中化学反应速率的题,增加或减少化学平衡时的反应物或生成物浓度时可能有影响,也可能没有影响,要看反应物或生成物是固体还是气体,对于气体和固体来说,固体没有影响(对于高中来说),对于气体和气体来说,一定有影响,记住一个口诀对于气体来说无论是反应物还是生成物对反应速率,一定有影响,固体和液体不一定(很少有影响的),还得看具体的题1年前查看全部
- 化学平衡向正方应方向移动那么反应物的转化率一定变高吗
化学平衡向正方应方向移动那么反应物的转化率一定变高吗
不是 我是说反应物的转化率一起变高! 馅饼儿1年前3
馅饼儿1年前3 -
 mikazz 共回答了17个问题
mikazz 共回答了17个问题 |采纳率88.2%不是,转化率与转化量和反应物量都有关:反应向正反应进行,说明转化量变大,但如果这种改变是由于反应物物质的量增多,导致反应物浓度增大而导致反应向正反应方向移动的话,那么,由转化率=转化量/反应物量得:1个量增大,另1个量减小,无法判断其比值的大小关系.并且,由勒夏特列原理:反应向着能减小改变的方向进行得:反应物转化量1年前查看全部
- 化学平衡的移动(高手进)今天解决
化学平衡的移动(高手进)今天解决
N2+3H2===2NH3
充入2molN2和6mol的H2,反应平衡后加入1molN2和3mol的H2,
此时,反应是否移动,各物质浓度如何变化,反应速率如何变化
.
H2+I2=2HI
充入6molI2和6mol的H2,反应平衡后加入1molI2和1mol的H2,
此时,反应是否移动,各物质浓度如何变化,反应速率如何变化
.
H2+I2=2HI
充入6molI2和6mol的H2,反应平衡后加入1molHe ,
此时,反应是否移动,各物质浓度如何变化,反应速率如何变化
.
N2+3H2===2NH3
充入2molN2和6mol的H2,反应平衡后加入1molHe ,
此时,反应是否移动,各物质浓度如何变化,反应速率如何变化
. skdkjh2k3jhfaksj1年前4
skdkjh2k3jhfaksj1年前4 -
 人面桃花8 共回答了17个问题
人面桃花8 共回答了17个问题 |采纳率82.4%答案序号1~4为题号,按顺序来,A为假设体积不变,B为假设压力不变,AB均假设温度不变..第一题A压力增大,平衡右移,各物质浓度增大,速率增大B一直是按反应计量比加入反应物的,因此反应平衡不移动,但是各物质浓度都上升了,...1年前查看全部
- 在下列平衡体系3NO2+H2O⇌2HNO3+NO中加入O2,则化学平衡( )
在下列平衡体系3NO2+H2O⇌2HNO3+NO中加入O2,则化学平衡( )
A. 向左移
B. 向右移动
C. 不移动
D. 无法判断 浓浓苹果香1年前1
浓浓苹果香1年前1 -
 白色的雪1 共回答了13个问题
白色的雪1 共回答了13个问题 |采纳率84.6%解题思路:在下列平衡体系3NO2+H2O⇌2HNO3+NO中加入O2,氧气和一氧化氮反应生成二氧化氮,平衡正向进行;平衡体系3NO2+H2O⇌2HNO3+NO中加入O2,氧气和一氧化氮反应生成二氧化氮,生成物浓度减小,平衡正向进行;
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡移动原理的理解应用,掌握物质性质和移动 原理是解题关键,题目较简单.1年前查看全部
- 为什么化学平衡正向移动,反应物转化率升高
 zhiyong19711年前1
zhiyong19711年前1 -
 今日风采 共回答了11个问题
今日风采 共回答了11个问题 |采纳率100%转化率=(反应前反应物的物质的量-反应后反应物的物质的量)/反应前反应物的物质的量.化学平衡正向移动,就是反应物反应的更多了,反应后反应物的物质的量减少,所以转化率升高1年前查看全部
大家在问
- 1-1,-2,-3,-4,0,1,2,3,4九宫格解法
- 2清平乐.村居的诗意,求学霸指点,谢谢!
- 3I wish I had a bow.
- 4如图在三角形abc中ab大于acaf是角bac的平分线g一零ab上一点且ab等于acde平行BC
- 5(2013•河西区二模)已知A(-4,n),B(2,4)是一次函数y=kx+b的图象和反比例函数y=[m/x]的图象的两
- 6用下面词造句如题,最好能简单一点的1.concern oneself with2.was+adj/adv+as poss
- 7人教版语文八年级上册第6课《阿长与山海经》资料分析!会的朋友帮帮忙!
- 8我可以和你照张相吗?用英语怎么说?
- 9What is the theme of World AIDS Day this year?
- 10— Is the price of the backpack very______?
- 11把60℃的硝酸钾饱和溶液冷却到20℃,下列叙述错误的是 ( )
- 12—Is his name Tim?
- 13read the sentence and guess the meaning of ''over the moon''
- 14Three boys,Xiao Li ,Xiao Ji,and Xiao Ming,were friends.They
- 15麻烦老师解答:根据句意及首字母提示
