H2SeO4和 H2SO4的酸性强弱
 阿蒙是我的好朋友2022-10-04 11:39:541条回答
阿蒙是我的好朋友2022-10-04 11:39:541条回答怎么判断?
你说的是气态氢化物的吧.而最高价氧化物对应的水化物不是应该和元素的非金属性一致吗?为什么硒酸会比硫酸的酸性强?

已提交,审核后显示!提交回复
共1条回复
 boboshi 共回答了18个问题
boboshi 共回答了18个问题 |采纳率100%- 硒酸强
同族元素,越往下其酸性更强. - 1年前
相关推荐
- H2SeO4第一步电离程度大于第二步原因是什么,如何叙述清楚到位
 wyhczljp1年前3
wyhczljp1年前3 -
 coolwater2005 共回答了14个问题
coolwater2005 共回答了14个问题 |采纳率92.9%因为第一步电离后产生的H+ 会抑制第二步电离.1年前查看全部
- 1.写出相应的化学符号由8个硫原子构成的分子( )2.硒元素的化学性质与硫的化学性质相似,化学式为H2SEO4,用化学方
1.写出相应的化学符号
由8个硫原子构成的分子( )
2.硒元素的化学性质与硫的化学性质相似,化学式为H2SEO4,用化学方程式来说明硒酸的一条化学性质 drwf771年前4
drwf771年前4 -
 小庙住持 共回答了21个问题
小庙住持 共回答了21个问题 |采纳率90.5%1.写出相应的化学符号
由8个硫原子构成的分子( S8 )
2.硒元素的化学性质与硫的化学性质相似,化学式为H2SEO4,用化学方程式来说明硒酸的一条化学性质
H2SeO4+2NaOH=Na2SeO4+2H2O
硒酸具有酸性,可以和碱发生中和反应1年前查看全部
- 为什么氧化性HClO3>HClO4 h2seo4>h2seo3
 一腚道理1年前2
一腚道理1年前2 -
 暧暧14 共回答了14个问题
暧暧14 共回答了14个问题 |采纳率78.6%因为氯酸根中CL和O的键能较小.因为过渡元素的半径收缩导致硒的高氧化态下,氧化性和酸性均强于硫酸1年前查看全部
- H2SO4 H2SeO4 H2TeO4 酸性的强弱是怎样的?
 WOkk091年前1
WOkk091年前1 -
 liuliao883201 共回答了15个问题
liuliao883201 共回答了15个问题 |采纳率80%H2SO4的酸性最强,其次是H2SeO4、H2TeO4酸性依次减弱,为什么呢?就是因为它们所在元素周期的位置,对于非金属的酸越往周期表的上方和右方,化合物酸性就越强,S就不用说了,像Se相对就弱了,而Te就显出些金属的性质,比如导电性.1年前查看全部
- H2SeO4氧化性与Cl2相比那个强
H2SeO4氧化性与Cl2相比那个强
H2SeO4+2HCl==H2SeO3+H2O+Cl2↑根据此方程式分析
H2SeO4氧化性与H2SO4相比那个强
SeO2的还原性与SO2相比那个强 沐汀1年前2
沐汀1年前2 -
 qq3450110 共回答了18个问题
qq3450110 共回答了18个问题 |采纳率77.8%H2SeO4氧化性比Cl2强
H2SeO4+2HCl==H2SeO3+H2O+Cl2↑1年前查看全部
- Se的相对原子质量为79,当某病人需要Se质量为8g,则相当于( )g的H2SeO4中Se的质量.
 824939561年前1
824939561年前1 -
 fsdgfxcvxcv 共回答了22个问题
fsdgfxcvxcv 共回答了22个问题 |采纳率81.8%8g的Se的物质的量为8/79,则H2SeO4的物质的量也为8/79,质量为145×8/79=14.68g1年前查看全部
- (2006•自贡)硒元素具有抗衰老,抑制癌细胞的功能.它的化学性质与硫相似,对应的含氧酸的化学式为H2SeO4,在H2S
(2006•自贡)硒元素具有抗衰老,抑制癌细胞的功能.它的化学性质与硫相似,对应的含氧酸的化学式为H2SeO4,在H2SeO4中Se的化合价是( )
A.+4
B.+3
C.+6
D.+5 可可bb1年前1
可可bb1年前1 -
 oo做乐 共回答了23个问题
oo做乐 共回答了23个问题 |采纳率87%解题思路:利用硒酸中常见元素H、O的化合价分别为+1、-2,根据化合物中各元素的化合价代数和为零,可计算Se元素的化合价.设硒酸H2SeO4中Se元素的化合价为x
(+1)×2+x+(-2)×4=0
x=+6
故选C点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题侧重考查常见元素的化合价以及化合价的原则,这类题几乎是在所有类型化学试题中,都会出现.要想做好此类题,就必须要落实好“双基”(基础知识和基本技能).1年前查看全部
- 硒元素具有抗衰老,抑制癌细胞的功能.它的化学性质与硫相似,元素符号为Se,对应的含氧酸的化学式(分子式)为H2SeO4这
硒元素具有抗衰老,抑制癌细胞的功能.它的化学性质与硫相似,元素符号为Se,对应的含氧酸的化学式(分子式)为H2SeO4这种酸应读作______.
 芝道1571年前4
芝道1571年前4 -
 贤文5 共回答了16个问题
贤文5 共回答了16个问题 |采纳率93.8%解题思路:根据硒元素化学性质与硫相似,进行分析推断.含氧酸以除氢元素、氧元素外的第三种元素的名称命名为某酸.根据硒元素化学性质与硫相似,进行分析推断硒的含氧酸H2SeO4应读作:硒酸;
故答案为:硒酸.点评:
本题考点: 化学式的书写及意义.
考点点评: 本题难度不大,掌握含氧酸的命名方法等是正确解答本题的关键.1年前查看全部
- H2SO4(硫酸) H2SeO4(砷酸) 那个酸性大?
 我站在谎言的背后1年前1
我站在谎言的背后1年前1 -
 cqjyt2005 共回答了16个问题
cqjyt2005 共回答了16个问题 |采纳率81.3%硫酸的比砷酸的酸性大~`
元素周期表中,第六主族从上到下是:氧、硫、砷、锑、铋
根据元素周期律,从上到下,非金属性逐渐减弱,除氧外的其它元素最高价氧化物的水化物从上到下逐渐减弱,所以它们的酸性也逐渐减弱..1年前查看全部
- 硒元素(符号为Se),具有抗衰老、抑制癌细胞的功能,如图是硒原子的有关信息,其中硒酸H2SeO4与硫酸化学性质相似,请根
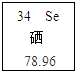 硒元素(符号为Se),具有抗衰老、抑制癌细胞的功能,如图是硒原子的有关信息,其中硒酸H2SeO4与硫酸化学性质相似,请根据相关知识填写下列空格:
硒元素(符号为Se),具有抗衰老、抑制癌细胞的功能,如图是硒原子的有关信息,其中硒酸H2SeO4与硫酸化学性质相似,请根据相关知识填写下列空格:
①硒酸Se的化合价______价;
②硒原子的原子核内的质子数为______;
③在含丰富硒的土壤上种植的白莲、甘薯、大米等,由于含丰富的硒被称为富硒产品,富硒产品中的“硒”指的是______(选填“元素”、“分子”或“原子”);
④这种硒酸与氢氧化钠的中和反应的化学方程式:______. 心情好一切都好1年前1
心情好一切都好1年前1 -
 mingfei606 共回答了21个问题
mingfei606 共回答了21个问题 |采纳率90.5%解题思路:①根据在化合物中正负化合价代数和为零,进行解答;
②根据图结合原子序数=核内质子数进行分析;
③由题意可知,富硒产品中的“硒”指的是元素,它存在于物质的化合物中;
④根据题中信息结合化学方程式的书写进行分析.①根据在化合物中正负化合价代数和为零,设H2SeO4中Se元素的化合价为x,则:(+1)×2+x+(-2)×4=0,解答x=+6;
②根据原子序数=核内质子数,硒原子的原子序数是34,因此硒原子的原子核内的质子数为34;
③由题意可知,富硒产品中的“硒”指的是元素;
④硒酸与氢氧化钠的中和反应的化学方程式2NaOH+H2SeO4=Na2SeO4+2H2O;
故答案为:①+6;②34;③元素;④H2SeO4+2NaOH═Na2SeO4+2H2O.点评:
本题考点: 元素周期表的特点及其应用;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生根据化学式计算元素的化合价、元素周期表的有关知识以及化学方程式的书写等,难度不大.1年前查看全部
- H2SeO4叫做什么,是一种酸的化学式,读作什么?
H2SeO4叫做什么,是一种酸的化学式,读作什么?
并且与NaOH溶液能反应生成什么?化学式怎么写.
到底是什么酸 朔漠游侠1年前5
朔漠游侠1年前5 -
 syjy12 共回答了18个问题
syjy12 共回答了18个问题 |采纳率88.9%硒酸
H2SeO4+2NaOH===Na2SeO4(硒酸钠)+2H2O1年前查看全部
- (2006•黄浦区一模)硒元素具有抗衰老、抑制癌细胞的功能,含氧酸的化学式为H2SeO4,在H2SeO4中Se的化合价是
(2006•黄浦区一模)硒元素具有抗衰老、抑制癌细胞的功能,含氧酸的化学式为H2SeO4,在H2SeO4中Se的化合价是( )
A.+3
B.+4
C.+5
D.+6 menglanllffll1年前1
menglanllffll1年前1 -
 南方有约 共回答了15个问题
南方有约 共回答了15个问题 |采纳率93.3%解题思路:利用硒酸中常见元素H、O的化合价分别为+1、-2,根据化合物中各元素的化合价代数和为零,可计算Se元素的化合价.设硒酸H2SeO4中Se元素的化合价为x
(+1)×2+x+(-2)×4=0
x=+6
故选D点评:
本题考点: 有关元素化合价的计算.
考点点评: 根据化合物中各元素的化合价代数和为0,利用化合物的化学式可计算出其中未知的元素化合价.1年前查看全部
- (2006•西城区一模)葡萄含有丰富的非金属元素硒(Se),人体如果缺硒可能会引起皮肤病变.在硒酸(化学式为H2SeO4
(2006•西城区一模)葡萄含有丰富的非金属元素硒(Se),人体如果缺硒可能会引起皮肤病变.在硒酸(化学式为H2SeO4)中,Se元素的化合价是( )
A.+2价
B.+3价
C.+4价
D.+6价 爱情渣子1年前1
爱情渣子1年前1 -
 3802926 共回答了21个问题
3802926 共回答了21个问题 |采纳率100%解题思路:根据化合物的化学式H2SeO4,利用化合物中各元素的化合价代数和为0的原则,由化合物中氢为+1价、氧为-2价,计算化合物中Se元素的化合价.化合物中氢为+1价、氧为-2价,设化合物H2SeO4中Se元素化合价为x,依化合物中各元素化合价代数和为零的原则,有(+1)×2+x+(-2)×4=0,解之得x=+6;
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 根据化合物中各元素的化合价代数和为0,利用化合物的化学式可计算其中未知的元素化合价.1年前查看全部
- 为什么H2SeO4的酸性比硫酸强?
为什么H2SeO4的酸性比硫酸强?
按照元素周期表中氧族元素的性质,应该是硫酸更强啊?
我是在(高1,华师大出的)中看到的!
次周期律 小dd守则1年前1
小dd守则1年前1 -
 丑女阿撒 共回答了22个问题
丑女阿撒 共回答了22个问题 |采纳率95.5%次周期律 简单的说,是第三,四,五周期的非金属元素的一系列性质呈现出锯齿形的状态.如最高氧化态的氧化物的氧化性强弱(SeO3>SO3),水化物的氧化性强弱(HBrO4>HClO4),水化物的酸性.
这是从试验中总结,并计算验证的.目前尚没听说有很可信服的定性说明.1年前查看全部
- H2SeO3第一步电离程度大于第二步电离的原因,且为什么H2SeO4酸性大于H2SeO3
 谷中佳人1年前1
谷中佳人1年前1 -
 子弹- 共回答了19个问题
子弹- 共回答了19个问题 |采纳率89.5%元素周期表的知识,含氧酸中中心原子的价态越高,其酸性越强1年前查看全部
大家在问
- 1两条互为反向延长线的射线可以组成一对平角,那么相交于同一点...
- 2求将圆周上2(n-1)个点用(n-1)条不相交的弦连接的方式数
- 3水的比热容最大,氢气的热值最大,而水又是由氢元素组成的,这之间是不是有什么联系呢?
- 4HClO3是一种具有强氧化性的强酸,预计Cu和HClO3溶液反应的生成物不可能是
- 5一碗饭的热量约等于几杯水
- 6(158+120除6)*5如何简便计算,
- 7都的多音字组词
- 8池中有一定量的硫酸怎么消除酸性
- 9八年级下数学评价手册第16页第5题怎么写?
- 10五年级简便计算练习题
- 11日加二笔是什么字
- 12看星星怎么能判断天气
- 13赤道和两极附近的年降雨量大约为多少毫米
- 14“浅草才能没马蹄”前一句是什么?
- 15去字加偏旁组成什么字
