将m g铁红和硫化亚铁的混合物溶解在足量的稀盐酸中,得到n g沉淀,则远混合物中硫化亚铁的质量为
 颖莹elinor2022-10-04 11:39:544条回答
颖莹elinor2022-10-04 11:39:544条回答A,5n g B(m-5n)g C(m-11n/4)g D,11n/4 g

已提交,审核后显示!提交回复
共4条回复
 测量组长 共回答了19个问题
测量组长 共回答了19个问题 |采纳率94.7%- 选D:
反应式为
Fe2O3+6HCL=3H2O+2FeCl3
FeS +2HCl= H2S+ FeCl2
2FeCl3+ H2S= S↓+2FeCl2+2HCl
根据原子守恒,硫化亚铁中的硫原子全部转化成了硫沉淀
所以n(FeS)=n(S)= n/32 mol
m(FeS)=n/32 mol * 88g/mol=11n/4 g 即D答案正确 - 1年前
 徽风犹记 共回答了1个问题
徽风犹记 共回答了1个问题 |采纳率- 应该是11N/4 g
反应式为
Fe2O3+6HCL=3H2O+2FeCl3
FeS +2HCl= H2S+ FeCl2
2FeCl3+ H2S= S+2FeCl2+2HCl
最后的沉淀是S单质
即m(S)=N g
根据式量计算
m(FeS)=[(56+32)/32]*N g
=11N/4 g - 1年前
 mm317 共回答了433个问题
mm317 共回答了433个问题 |采纳率- lxfeng007 - 江湖新秀 四级
的回答是对的.
计算过程要带单位. - 1年前
 飞天遁地2008 共回答了67个问题
飞天遁地2008 共回答了67个问题 |采纳率- D. 11n/4 g
(1)Fe2O3 + FeS + 6HCI == 3FeCI2 + S + 3H2O
------------88g---------------------------32g
------------88n/32g------------------------ng
(2)混合物中硫化亚铁的质量== 11n/4 g - 1年前
相关推荐
- 工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学利用草酸晶体(
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学利用草酸晶体(H2C2O4•3H2O)分解产生的气体产物进行了如下的实验,请你参与过程分析.
【资料】草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O
CO2↑+CO↑+4H2O浓硫酸 △
【问题探究】用下图所示装置进行实验:
(1)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是______(填字母编号).
a.浓硫酸b.澄清石灰水c.氢氧化钠溶液
(2)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:①加热前将装置中的空气排出,防止发生爆炸;停止加热后______.
(3)写出D装置中所发生反应的一个化学方程式3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.若实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是______.(计算结果保留一位小数)
【实验反思】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会______(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷______. ly2781年前1
ly2781年前1 -
 偷心WZ 共回答了23个问题
偷心WZ 共回答了23个问题 |采纳率95.7%解题思路:(1)二氧化碳用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥,先除二氧化碳再干燥;
(2)加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收;
(3)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,据此书写方程式;
(4)E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×[32/44]×100%=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=[10 g−2.4g/10g]×100%=76.0%;
反思1:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;
反思2:实验装置的一个明显缺陷:缺少尾气处理装置或检验水是否除尽.(1)二氧化碳先用氢氧化钠溶液吸收,用澄清的石灰水检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥,二者顺序不能颠倒,否则气体从溶液中会带入D装置,使E装置的质量增加,影响测量效果;
(2)加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收;
(3)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,方程式为:3CO+Fe2O3
高温
.
2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以);
(4)E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×[32/44]×100%=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=[10 g−2.4g/10g]×100%=76.0%;
实验反思:
反思1:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;
反思2:一氧化碳有毒,排放到空气中会污染大气,所以实验装置的一个明显缺陷:缺少尾气处理装置;
故答案为:(1)c;a;
(2)驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.(合理即可);
(3)3CO+Fe2O3
高温
.
2Fe+3CO2,(一氧化碳与FeO、Fe3O4反应也可以);
(4)76.0%;偏小;缺少尾气处理装置.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;气体的干燥(除水);书写化学方程式、文字表达式、电离方程式.
考点点评: 本题通过实验现象和分析,得出结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握,细心解答.1年前查看全部
- 问题是这样的.天安门城楼的红墙所用的红色颜料是铁红(主要成分为Fe2 O3),试计算1000Kg铁红中最多含铁的质量.问
问题是这样的.天安门城楼的红墙所用的红色颜料是铁红(主要成分为Fe2 O3),试计算1000Kg铁红中最多含铁的质量.问题就是这样的拉 做.公式什么的都帮我写出来.急缺吖.明天要交拉`
 jackhello1年前3
jackhello1年前3 -
 a309631917 共回答了12个问题
a309631917 共回答了12个问题 |采纳率100%假如该1000kg的铁红全部是Fe2O3,则此时含铁量最多.
Fe2O3的分子质量为:56*2+16*3=160 g/mol;
Fe占的质量分数为:56*2/160=0.7;
则1000kg铁红中最多含 Fe的质量为:1000*0.7=700kg;1年前查看全部
- (2014•凉山州三模)某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)
(2014•凉山州三模)某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3).其实验方案如下:

(1)滤渣B中发生反应的离子反应方程式为:______
(2)已知Fe(OH)3沉淀的pH是3-4,溶液C通过调节pH可以使Fe3+沉淀完全.下列物质中,可用作调整溶液C的pH的试剂是______(填序号).
A.铜粉 B.氨水 C.氢氧化铜 D.碱式碳酸铜
(3)向含Fe2+的酸性废水中加入K2Cr2O7溶液后发生反应的离子方程式______.
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,反应的离子方程式为______.
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol•L-1,c(H2SO4)=3mol•L-1.将0.3mol的铜与之加热充分反应后,被还原的HNO3的物质的量为______. 只爱陌生人3331年前1
只爱陌生人3331年前1 -
 非Faye 共回答了18个问题
非Faye 共回答了18个问题 |采纳率88.9%解题思路:合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,易铁离子易水解,可通过调节溶液pH的方法制得氢氧化铁沉淀,即E为氢氧化铁,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,以此解答该题.合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,易铁离子易水解,可通过调节溶液pH的方法制得氢氧化铁沉淀,即E为氢氧化铁,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,
(1)滤渣B为铁和铜,加入硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,故答案为:CD;
(3)K2Cr2O7具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,二者的物质的量之比为2:7,设物质的量分别为2mol、7mol,则反应生成氢氧化铝和偏铝酸钡以及硫酸钡沉淀,反应的离子方程式为2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O,
故答案为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O;
(5)n(HNO3)=0.2mol,n(H2SO4)=0.3mol,混合液中n(H+)=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO+4H2O,可知0.2molNO3-完全被还原,反应后溶液溶质为硫酸铜,故答案为:0.2mol.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题考查物质的制备,侧重于物质的分离和提纯的实验方案的设计,注重于学生实验能力、分析能力的考查,题目难度不大,注意根据反应的离子方程式计算(5).1年前查看全部
- 某工厂排放的废水中还有硫酸铜,将废水处理可得到铜和铁红(氧化铁),求方程式
 蒗鉴1年前1
蒗鉴1年前1 -
 jj5e6uhg 共回答了13个问题
jj5e6uhg 共回答了13个问题 |采纳率84.6%CUSO4+FE=FESO4+CU
FE+2HCL=FECL2+H2
2FECL2+CL2=2FECL3
FECL3+3NAOH=3NACL+FE(OH)3
2FE(OH)3加热=FE2O3+3H2O1年前查看全部
- (2012•梅州一模)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3
(2012•梅州一模)工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3 ),具体生产流程如下:

试回答下列问题:
(1)滤液X中含有的金属阳离子是______(填离子符号).
(2)步骤Ⅲ中可选用______试剂调节溶液的pH(填字母).
A.稀硝酸B.氨水 C.氢氧化钠溶液D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3 达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol•L-1.试判断所得FeCO3 中是否混有Fe(OH)2______(填“是”或“否”),请通过简单计算说明理由______ (已知:Ksp[Fe(OH)2]=4.9×10-17).
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______.
(5)在空气中煅烧FeCO3 生成产品氧化铁的化学方程式为4FeCO3+O2
2Fe2O3+4CO2高温 .4FeCO3+O2.
2Fe2O3+4CO2高温 . 糊塌子1年前1
糊塌子1年前1 -
 jy02536131 共回答了15个问题
jy02536131 共回答了15个问题 |采纳率93.3%解题思路:(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,依据酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应分析判断;
(2)依据步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液PH至5-6.5,试剂不能氧化亚铁离子,不能是碱性强的溶液;
(3)依据浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡;
(4)温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,原子守恒配平写出;(1)硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等,酸浸后铁的氧化物和酸反应溶解,二氧化硅不与酸反应,氧化铁溶解后生成铁离子,氧化亚铁溶解后生成亚铁离子,故答案为:Fe2+、Fe3+;
(2)由步骤Ⅱ加入过量铁粉滤液中阳离子为亚铁离子,步骤Ⅲ加入试剂调节溶液pH至5-6.5,试剂不能氧化亚铁离子,强碱性溶液会沉淀亚铁离子,
A.稀硝酸具有氢氧化性能氧化亚铁离子,故A不符合;
B.氨水是弱碱,可以调节溶液PH,故B符合;
C.氢氧化钠溶液 是强碱溶液,加入会沉淀亚铁离子,故C不符合;
D.高锰酸钾溶液具有氢氧化性,能氧化亚铁离子,故D不符合;
故选B;
(3)由浓度商和溶度积常数比较分析判断,Q<Ksp沉淀溶解,Q>Ksp沉淀溶解,Q=Ksp沉淀溶解达到平衡,溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成,
故答案为:否;溶液中c(Fe2+)•c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<Ksp[Fe(OH)2],故无Fe(OH)2沉淀生成;
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,温度过高碳酸氢铵会分解,温度升高促进亚铁离子的水解,故答案为:防止NH4HCO3分解,减少Fe2+的水解;
(5)空气中煅烧碳酸亚铁,是碳酸亚铁和氧气反应生成氧化铁和二氧化碳,由原子守恒配平后反应的化学方程式为4FeCO3+O2
高温
.
2Fe2O3+4CO2,
故答案为:4FeCO3+O2
高温
.
2Fe2O3+4CO2.点评:
本题考点: 铁的氧化物和氢氧化物;难溶电解质的溶解平衡及沉淀转化的本质;制备实验方案的设计.
考点点评: 本题考查了铁及其化合物性质的分析应用,主要是流程分析理解和反应过程的判断,题目难度中等.1年前查看全部
- 铁红是氧化铁吗rt,顺便告诉下铁红的性质和用途,
 鲨鱼大象1年前2
鲨鱼大象1年前2 -
 老三的大哥 共回答了16个问题
老三的大哥 共回答了16个问题 |采纳率100%铁红是氧化铁
氧化铁,别名磁性氧化铁红;高导磁率氧化铁;烧褐铁矿;烧赭上;铁丹;铁粉,红粉;威尼斯红(主要成分为氧化铁),三氧化二铁.化学式Fe2O3,溶于盐酸,为红棕色粉末.其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可做催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料.1年前查看全部
- 离子反应计算题铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160ml 5mol·L—1盐酸中,在加入一定量铁
离子反应计算题
铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160ml 5mol·L—1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为_________g
请回答问题并分析. lwjkkk1年前1
lwjkkk1年前1 -
 zzko 共回答了13个问题
zzko 共回答了13个问题 |采纳率92.3%收集到的气体为氢气0.1mol,可知与铁粉反应的盐酸有0.2mol,和参加反应的铁粉为0.1mol
所以与氧化铁反应的盐酸为0.6mol(160ml*5mol/l-0.2=0.6mol),这就求得溶液中三价铁离子的量为0.2mol,然后铁粉跟三价铁离子反应,可得参与反应的铁粉为0.1mol
最后两种反应所用的铁的质量为11.2g(0.2*56=11.2)1年前查看全部
- (2012•镇江)工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的
(2012•镇江)工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下的实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O
CO2↑+CO↑+4H2O浓硫酸 △
(1)下列可用作草酸分解制取气体的装置是dd(填字母编号)
【问题讨论】用下图所示装置进行实验: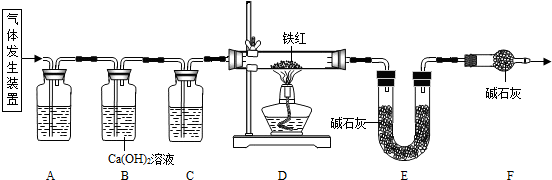
(2)实验前应先检查装置的气密性检查装置的气密性.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是cc、aa(填字母编号)
a.浓硫酸 b.澄清石灰水 c.氢氧化钠溶液
(4)B装置的作用是验证二氧化碳已除尽验证二氧化碳已除尽.
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:①加热前将装置中的空气排出,防止发生爆炸将装置中的空气排出,防止发生爆炸.停止加热后驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.
(6)写出D装置中所发生反应的一个化学方程式3CO+Fe2O3
2Fe+3CO23CO+Fe2O3高温 .
2Fe+3CO2.高温 .
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数:
(7)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.铁的氧化物 FeO Fe2O3 Fe3O4 铁的质量分数 77.8% 70.0% 72.4%
①D中充分反应后得到Fe粉的质量为mg,则7.07.0<m<7.787.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%76.0%.
【实验反思】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小偏小(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷缺少尾气处理装置缺少尾气处理装置. 兰舟少住1年前1
兰舟少住1年前1 -
 安根 共回答了20个问题
安根 共回答了20个问题 |采纳率85%(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置,故答案为:d
(2)实验前应先检查装置的气密性,故答案为:检查装置的气密性
(3)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;故答案为:c;a
(4)B装置还可以检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽
(5)加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.故答案为:①将装置中的空气排出,防止发生爆炸;②驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.(合理即可)
(6)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以)
(7)如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×
32
44=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=
10 g−2.4g
10g×100%=76.0%;故答案为:①7.0;7.78;②76.0%
实验反思:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置.故答案为:偏小;缺少尾气处理装置.1年前查看全部
- “朱门酒肉臭,路有冻死骨”,这朱色的大门通常是用铁红(Fe 2 O 3 )漆成的。Fe 2 O 3 也是铁锈的主要成分,
“朱门酒肉臭,路有冻死骨”,这朱色的大门通常是用铁红(Fe 2 O 3 )漆成的。Fe 2 O 3 也是铁锈的主要成分,其中Fe为+3价。缺铁性贫血是青少年生长发育过程中常见的一种贫血症状,因此青少年要注意“补铁(二价铁离子)”。请问以下哪种做法不可以起到对人体“补铁”的作用 [ ]A.服食氧化铁粉未
B.多用铁锅煮食
C.服食含硫酸亚铁的药物
D.多吃蛋黄、菠菜等含铁丰富的物质 rangrang1231年前1
rangrang1231年前1 -
 c1j2g3 共回答了19个问题
c1j2g3 共回答了19个问题 |采纳率89.5%A1年前查看全部
- 用化学符号填空:(1)2个铵根离子______;(2)红色颜料铁红的主要成分______;(3)造成温室效应的气体单质_
用化学符号填空:
(1)2个铵根离子______;
(2)红色颜料铁红的主要成分______;
(3)造成温室效应的气体单质______;
(4)厨房用的酸性调味品中的酸______. kfc8899001年前1
kfc8899001年前1 -
 一_粟 共回答了28个问题
一_粟 共回答了28个问题 |采纳率78.6%解题思路:离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法和步骤写出物质的化学式即可.(1)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字,故2个铵根离子可表示为:2NH4+.
(2)红色颜料铁红的主要成分是氧化铁,其化学式为:Fe2O3.
(3)臭氧是能造成温室效应的气体单质,其化学式为:O3.
(4)厨房用的酸性调味品中的酸是醋酸,其化学式为:CH3COOH.
故答案为:(1)2NH4+;(2)Fe2O3;(3)O3;(4)CH3COOH;点评:
本题考点: 化学式的书写及意义;化学符号及其周围数字的意义.
考点点评: 本题难度不大,主要考查同学们对常见化学用语(离子符号、化学式、化学方程式等)的书写和理解能力,解题时应注意只能从给出的元素中选择来组成物质.1年前查看全部
- 铁红与氧化铜在工业上的主要用途分别是什么?
 wo_kaokao1年前1
wo_kaokao1年前1 -
 一念之间tt 共回答了19个问题
一念之间tt 共回答了19个问题 |采纳率84.2%铁红制铁 氧化铜制铜盐1年前查看全部
- 某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品.过程如下图所示 呃呃,
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品.过程如下图所示 呃呃,
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品.过程如下图所示呃呃,每一步具体是什么麻烦讲一下,还有,第一步怎么会有两种溶液生成?

 天使掉牙1年前1
天使掉牙1年前1 -
 330603417 共回答了21个问题
330603417 共回答了21个问题 |采纳率90.5%第一步加过量铁粉1年前查看全部
- 下列有关铁及其化合物的说法中正确的是 A.Fe 3 O 4 是一种红棕色粉末,俗称铁红 B.Fe(OH) 2 为白色固体
下列有关铁及其化合物的说法中正确的是
A.Fe 3 O 4 是一种红棕色粉末,俗称铁红 B.Fe(OH) 2 为白色固体,不溶于水,能在空气中稳定存在 C.除去FeCl 2 中的FeCl 3 杂质,可以向溶液中加入过量铁粉,然后过滤 D.检验FeCl 2 溶液是否变质的方法是:加入KSCN溶液,观察是否有血红色沉淀产生  yywyyw1年前1
yywyyw1年前1 -
 liliting619 共回答了23个问题
liliting619 共回答了23个问题 |采纳率95.7%C
1年前查看全部
- 某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过程
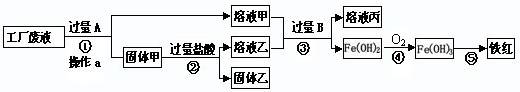
某工厂废液中含有氯化钠.氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过程不引入其他金属元素。设计实验方案如下图所示,
回答下列问题。
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 。
(2)工厂废液中加入过量A反应的化学方程式为 。
(3)溶液甲中的金属离子是 (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是 (填序号)。
(5)铁红是炼铁的主要原料,写出用CO和铁红炼铁的化学方程式 。 烂漫xiao仙1年前1
烂漫xiao仙1年前1 -
 游客2614 共回答了15个问题
游客2614 共回答了15个问题 |采纳率86.7%(5分)(1)引流 (2)Fe+CuCl 2 = FeCl 2 +Cu
(3)Na + 、Fe 2+ (4)①②
(5)3CO+Fe 2 O 3 2Fe+3CO 2
2Fe+3CO 2
分析:向废水中加入过量的铁,可以把铜还原出来,过滤得到铜、铁.再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;溶液甲中含有溶质氯化亚铁和氯化钠,溶液乙中含有氯化亚铁和盐酸向其加入过量的B,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀.
废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和生成的氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.故填:引流.
(2)加入过量的A是铁与氯化铜反应故填:Fe+CuCl 2 =FeCl 2 +Cu
(3)溶液甲中含有溶质氯化亚铁和不参加反应的氯化钠;故填Na + 、Fe 2+
(4)步骤①②③中①是铁和氯化铜反应;②是铁和盐酸反应;③中发生两个反应;氯化亚铁和氢氧化钠反应;盐酸和氢氧化钠反应这两个反应都属于复分解反应,①②中金属与酸、金属与盐的反应都是置换反应;故填①②
(5)铁红(主要成分Fe 2 O 3 ),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;故填3CO+Fe 2 O 3 2Fe+3CO 2
2Fe+3CO 2
<>1年前查看全部
- 在蒸发皿中灼烧氢氧化铁的铁红为什么不行?
 胖布欧1年前3
胖布欧1年前3 -
 爱游的小鱼 共回答了22个问题
爱游的小鱼 共回答了22个问题 |采纳率81.8%蒸发皿是用来加热蒸发液体的1年前查看全部
- 某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其
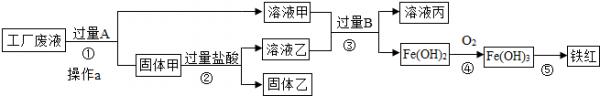
某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素.设计实验方案如图所示.
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是______.
(2)工厂废液中加入过量A反应的化学方程式为______.
(3)固体乙的主要成分是______.
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收集到0.2g氢气(杂质不参加反应).则该生铁样品中铁的质量分数为______.(列出
计算过程,保留一位小数.) 大飞0011年前1
大飞0011年前1 -
 wangkun128 共回答了25个问题
wangkun128 共回答了25个问题 |采纳率88%解题思路:向废水中加入过量的铁,可以把铜还原出来,过滤得到铜、铁.再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;溶液甲中含有溶质氯化亚铁和氯化钠,溶液乙中含有氯化亚铁和盐酸,向其加入过量的B,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀.废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和生成的氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.
(2)加入过量的A是铁与氯化铜反应化学方程式为,Fe+CuCl2=FeCl2+Cu
(3)由上述分析可知甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉.
(4)铁红(主要成分Fe2O3),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;化学方程式为3CO+Fe2O3
高温
.
2Fe+3CO2
(5)生铁的主要成分是铁,铁与硫酸反应生成硫酸亚铁和氢气,根据化学方程式中已知氢气的质量可求出铁的质量,从而求出生铁中铁的质量分数.
设参加反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
[56/x=
2
0.2g]
解得:x=5.6g
生铁中铁的质量分数=[5.6g/5.8g]×100%=96.6%
故答案为:(1)引流(2)Fe+CuCl2═FeCl2+Cu(3)铜(4)3CO+Fe2O3
高温
.
2Fe+3CO2
(5)96.6%点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;金属的化学性质;铁的冶炼;酸的化学性质;根据化学反应方程式的计算.
考点点评: 本题主要考查了玻璃棒的作用:(溶解中其加速溶解的作用、过滤中起引流的作用、蒸发中起使其受热均匀地作用);书写化学方程式的配平,判断某种物质是否过量等方面的内容.1年前查看全部
- 急!一道化学题,再线等,天安门城楼的红墙所用的红色颜料是铁红(成分Fe2 O3)试计算1000千克铁红中最多含铁的质量.
急!一道化学题,再线等,
天安门城楼的红墙所用的红色颜料是铁红(成分Fe2 O3)试计算1000千克铁红中最多含铁的质量.没悬赏,大不了积够再给!拜托当个好人! kittyhan韩1年前3
kittyhan韩1年前3 -
 5-5-5- 共回答了17个问题
5-5-5- 共回答了17个问题 |采纳率70.6%Fe2 O3中Fe的质量分数=56*2/(56*2+16*3)*100%=70%
那么100Kg中Fe的含量=1000*70%=700Kg
因此,1000Kg中含有铁的质量是700Kg1年前查看全部
- 【急】工业铁红的主要成分是Fe2O3,还有少量的FeO、Fe3O4.现称取铁红样品10g和足量的一氧化碳充分反应后
【急】工业铁红的主要成分是Fe2O3,还有少量的FeO、Fe3O4.现称取铁红样品10g和足量的一氧化碳充分反应后
生成的二氧化碳质量为6.6g,求工业铁红中贴的质量分数 drawei1年前0
drawei1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•镇江二模)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3)
(2014•镇江二模)兴趣小组分析了用硫铁矿烧渣(主要成份Fe203、Fe304、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验.
(一)铁红制备的流程图分析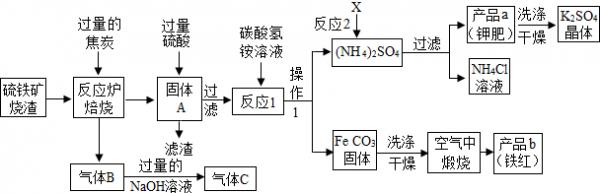
(1)写出焙烧中CO与Fe203反应的化学方程式Fe203+3C0
2Fe+3C02高温 .Fe203+3C0.
2Fe+3C02高温 .
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和______(填仪器名称)
(3)你认为对气体C最佳的处理方法是______.
A.冷却后排入空气B.燃烧后排放C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是______.
(5)反应2中相关物质的溶解度如表.你认为该反应在常温下能实现的原因是______.
洗涤干燥得到K2S04晶体时,可选用下列______(填字母)洗涤剂;物质 X K2SO4 NH4Cl (NH4)2SO4 溶解度g(25℃) 34.0 11.1 37.2 19.5
A.KCl的饱和溶液B.水C.K2S04的饱和溶液
为检验K2S04晶体是否洗涤干净,可取最后一次洗涤液,先加入______(选填序号,下同),振荡、静置,再向上层清液中滴加______,观察现象即可判断.
A.AgN03溶液B.过量的BaCl2溶液C.过量的Ba(N03)2溶液
(二)铁红的性质实验
【问题讨论】
【资料1】草酸晶体(H2C204•3H20)在浓H2S04作用下受热分解,化学方程式为:
H2C2O4•3H2O
C02↑+C0↑+4H20△ .
(6)实验前应先______.
(7)进入E中的气体是纯净、干燥的CO,则B、D中的试剂依次是______、______(填字母编号).
A.浓硫酸 B.澄清的石灰水C.氢氧化钠溶液
(8)C装置的作用是______.
【数据分析与计算】
用SDTQ600热分析仪对氧化铁(Fe2O3)和CO进行热反应分析,获得相关数据,绘制成管内剩余固体质量〜反应温度的关系如图2.
【资料2】已知铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁.
(9)800℃以上时,管内固体成分的化学式为______;
(10)写出管内固体质量由48g变为46.4g时反应的化学方程式3Fe203+C0
2Fe304+C02高温 .3Fe203+C0.
2Fe304+C02高温 .
【实验评价】
请指出【问题讨论】中实验装置的一个明显缺陷. 未语殇1年前1
未语殇1年前1 -
 lisongyf 共回答了16个问题
lisongyf 共回答了16个问题 |采纳率81.3%解题思路:(一)(1)根据方程式的写法进行回答;(2)根据过滤时用到的玻璃仪器考虑;(3)根据一氧化碳过量及一氧化碳的化学性质及用途分析;(4)根据碳酸氢铵受热易分解考虑;(5)根据生成物的溶解度大小分析反应能否发生;根据实验的目的分析可知,检验氯离子时需要排除硫酸根离子的干扰.(二)(6)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,实验前应先检查装置的气密性;(7)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥;(8)澄清石灰水是验证气体中是否含有二氧化碳的;(9)通过分析资料确定,800℃时氧化铁和一氧化碳进行反应的产物;(10)根据质量变化分析生成物,再写出化学方程式;【实验评价】没有参加反应的一氧化碳污染空气(一)(1)反应物是一氧化碳和氧化铁,生成物是铁和二氧化碳,反应条件是高温,用观察法配平即可,所以方程式是:Fe203+3C0
高温
.
2Fe+3C02;
(2)把不溶于液体的固体和液体分离方法是过滤,过滤用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)反应炉中一氧化碳还原氧化铁生成铁和二氧化碳,过量的一氧化碳会随二氧化碳逸出,因此气体B为一氧化碳和二氧化碳的混合气体,通过足量的氢氧化钠溶液后,二氧化碳与氢氧化钠反应生成碳酸钠和水,因此气体C主要成分是一氧化碳,一氧化碳可作为还原剂重复利用
(4)因为碳酸氢铵受热分解为氨气、水、二氧化碳,所以反应I的反应温度一般需控制在35℃以下,其目的是防止碳酸氢铵受热分解;
(5)根据复分解反应发生的条件,反应2中没有不溶物,但常温下硫酸钾的溶解度很小,在生成物中会以沉淀形式出现,所以反应可以发生,所以反应2在常温下能实现的原因是:常温下K2SO4的溶解度小,用硫酸钾饱和溶液清洗硫酸钾晶体,硫酸钾晶体不会减少,如果用水或其它溶液都会溶解一部分硫酸钾晶体;
因为硫酸根离子和银离子也会生成白色的硫酸银沉淀,所以需要先检验硫酸根离子,然后再检验氯离子,检验硫酸根离子可以加入硝酸钡溶液,加入氯化钡溶液,会引入氯离子,对氯离子的检验后造成干扰,所以为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入c,振荡、静置,再向上层清液中滴加a,观察现象即可判断.
(二)(6)实验前应先检查装置的气密性,否则会由于漏气使实验失败;
(7)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;所以A中盛放的是氢氧化钠溶液,吸收二氧化碳,氢氧化钙是验证二氧化碳是否被除净,C中盛放的是浓硫酸,吸收水分;
(8)C装置是检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽
(9)由铁的氧化物有:FeO、Fe304、Fe2O3,在一定的条件下,均能够逐步失去其中的氧,最终被还原为铁,可知在800℃以上时,管内固体质量不再减少,说明只有铁了;
(10)根据固体质量的减少量可知开始一氧化碳与氧化铁反应生成四氧化三铁,随着温度升高再生成氧化亚铁,最后生成铁,所以在管内固体质量由48g变为46.4g时反应物是一氧化碳和氧化铁,生成物是四氧化三铁和二氧化碳,用观察法配平即可,所以方程式是:3Fe203+C0
高温
.
2Fe304+C02.
【实验评价】没有参加反应的一氧化碳污染空气,所以缺点是缺少尾气处理装置.
故答案为:(1)Fe203+3C0
高温
.
2Fe+3C02
(2)漏斗
(3)C
(4)防止碳酸氢铵受热分解
(5)常温下K2S04的溶解度小(意思相近均给分)C、C、A
(6)检查装置气密性
(7)C、A
(8)检验二氧化碳是否被除尽(意思相近均给分)
(9)Fe
(10)3Fe203+C0
高温
.
2Fe304+C02
【实验评价】
缺少尾气处理装置(意思相近均给分).点评:
本题考点: 物质的相互转化和制备;过滤的原理、方法及其应用;结晶的原理、方法及其应用;常见气体的检验与除杂方法;证明硫酸和可溶性硫酸盐;铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道从题目中提取有用信息,熟悉化学方程式的书写步骤,锻炼了学生分析问题解决问题的能力.1年前查看全部
- 怎样从FeCl2和CuCl2的混合溶液中回收Cu和铁红
 小X泉1年前1
小X泉1年前1 -
 qingzhu007 共回答了24个问题
qingzhu007 共回答了24个问题 |采纳率83.3%先加入过量的铁粉,充分搅拌,静置,待反应完成后过滤,向滤渣上加入过量的盐酸,过滤后剩余的就是铜.
向第一次过滤后的滤液中通入过量的氯气,蒸发、结晶,就是氯化铁了.1年前查看全部
- 某工厂废液中含有氯化钠.氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其
某工厂废液中含有氯化钠.氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素.设计实验方案如图所示,回答下列问题.
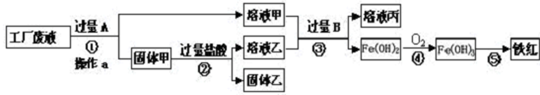
(1)②加入过量盐酸的目的是______.
(2)工厂废液中加入过量A反应的化学方程式为______.
(3)溶液甲中的金属离子是______(写离子符号). 欧派kk1年前1
欧派kk1年前1 -
 我是普通用户 共回答了19个问题
我是普通用户 共回答了19个问题 |采纳率89.5%解题思路:根据题目给出的信息:要从废液中回收铜并得到铁红,要求全过程不引入其他金属元素,因此向废液中加入过量的铁粉,铁和氯化铜反应生成氯化亚铁和铜,铁与氯化钠溶液不反应;过滤后,溶液甲是氯化钠和氯化亚铁的混合物,因此阳离子是钠离子和亚铁离子;固体甲是铜和过量的铁.(1)要从废液中回收铜并得到铁红,要求全过程不引入其他金属元素,因此向废液中加入过量的铁粉,从而得到金属铜,故答案为:把过量的金属A,即铁粉除去
(2)铁和氯化铜反应生成氯化亚铁和铜,故答案为:Fe+CuCl2=FeCl2+Cu
(3)过滤后,溶液甲是氯化钠和氯化亚铁的混合物,因此阳离子是钠离子和亚铁离子;故答案为:Na+、Fe2+点评:
本题考点: 物质的相互转化和制备;酸的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 考点考查了物质的制备,物质的制备有一下几种类型:一种是只能用题目给出的原料来制取;一种是自己选取原料来制备新物质;还有的是给你一部分药品,其它自选等.本题结合物质的性质,灵活应用,答案就会迎刃而解.1年前查看全部
- 硫酸亚铁在空气中煅烧生成铁红和三氧化硫的方程式,
 盖章呢你1年前3
盖章呢你1年前3 -
 西风秀色 共回答了21个问题
西风秀色 共回答了21个问题 |采纳率85.7%4FeSO4+O2=高温= 2Fe2O3 + 4SO31年前查看全部
- 铁红也就是三氧化二铁长期吸入对人体有哪些危害越详细越好
铁红也就是三氧化二铁长期吸入对人体有哪些危害越详细越好
我工作的再生机组有的地方很脏(由于设备密封不好,到处是铁红)那个再生机组空气中也会有铁红.主要是有一项作业任务是更换除尘器里的朔烧板,发生故障更换时粉尘量非常大,一个月最多一次更换了4次!作业现场温度高,体力消耗大,作业时间平均时间是4到5个小时.(带了防尘口罩,但是作业结束后还是会有铁红残留在鼻腔中)这个铁粉是从洗完钢板的盐酸中焙烧出来的.铁粉的颗粒特别小!肉眼无法分辨 我今年25岁就从事这个工作!对此想多了解一下.如果危害太大的话就调换别的岗位 十五今1年前1
十五今1年前1 -
 力大为王 共回答了20个问题
力大为王 共回答了20个问题 |采纳率90%当空气中的悬浮颗粒物中含有三氧化二铁时可以催化空气中的二氧化硫氧化成酸雾,吸附在微粒的表面,被代入呼吸道深部.硫酸雾的刺激作用比二氧化硫约强10倍,而二氧化硫对人体的危害是:1、刺激呼吸道.二氧化硫易溶于水,当其通过鼻腔、气管、支气管时,多被管腔内膜水分吸收阻留,变成亚硫酸、硫酸和硫酸盐,使刺激作用增强.2、二氧化硫和悬浮颗粒物的联合毒性作用.二氧化硫和悬浮颗粒物一起进入人体,气溶胶微粒能把二氧化硫带到肺深部,使毒性增加3-4倍.3、二氧化硫的促癌作用.动物实验证明10毫克/米3的二氧化硫可加强致癌物苯并(a)芘的致癌作用.在二氧化硫和苯并(a)芘的联合作用下,动物肺癌的发病率高于单个致癌因子的发病率.此外,二氧化硫进入人体时,血中的维生素便会与之结合,使体内维生素C的平衡失调,从而影响新陈代谢.二氧化硫还能抑制和破坏或激活某些酶的活性,使糖和蛋白质的代谢发生紊乱,从而影响机体生长发育.1年前查看全部
- 某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过程
某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过程不引入其他金属元素.设计实验方案如图所示: 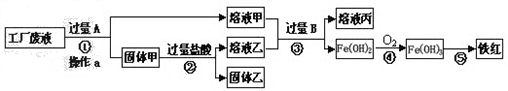
回答下列问题.
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 _________ .
(2)工厂废液中加入过量A反应的化学方程式为 _________ .
(3)溶液甲中的金属离子是 _________ (写离子符号).
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是 _________ (填序号).
(5)铁红是炼铁的主要原料,写出用CO和铁红炼铁的化学方程式 _________ . haiying03141年前1
haiying03141年前1 -
 xinhen1988 共回答了20个问题
xinhen1988 共回答了20个问题 |采纳率95%1年前查看全部
- 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),实验方案如
某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),实验方案如下所示。 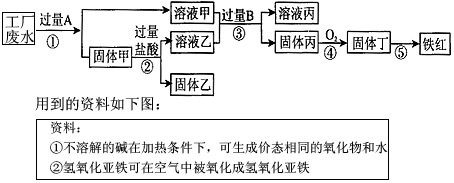
(1)推断物质B为______________;固体甲成分为__________________。
(2)工厂废液中加入过量A的化学方程式为_______________________________________。
(3)步骤③发生反应的化学方程式为___________________________________。
(4)检验A是否过量的方法为_______________________________。
(5)步骤⑤中的化学方程式为__________________________。 起个名累头汗1年前1
起个名累头汗1年前1 -
 shipengfei 共回答了20个问题
shipengfei 共回答了20个问题 |采纳率90%(1)氢氧化钠溶液(氢氧化钙溶液);铁和铜
(2)Fe+CuCl 2 ==Cu+FeCl 2
(3)FeCl 2 +2NaOH==2NaCl+Fe(OH) 2 ↓
(4)取少量溶液甲于试管中,放入光亮的铁钉,若铁钉上有红色物质析出,则证明A不过量,若铁钉上没有红色固体析出,则证明A过量
(5)2Fe(OH) 3 ==Fe 2 O 3 +3H 2 O1年前查看全部
- (某工厂废液中含有氯化钠.氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过
(某工厂废液中含有氯化钠.氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe 2 O 3 ),要求全过程不引入其他金属元素.设计实验方案如下图所示, 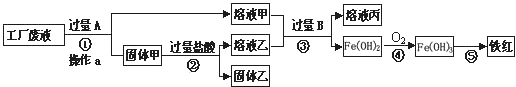
回答下列问题.
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是______.
(2)工厂废液中加入过量A反应的化学方程式为______.
(3)溶液甲中的金属离子是______(写离子符号).
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是______(填序号). 白袍骁将1年前1
白袍骁将1年前1 -
 爱的呼换 共回答了13个问题
爱的呼换 共回答了13个问题 |采纳率92.3%废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和生成的氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.故填:引流.
(2)加入过量的A是铁与氯化铜反应故填:Fe+CuCl 2 =FeCl 2 +Cu
(3)溶液甲中含有溶质氯化亚铁和不参加反应的氯化钠;故填Na + 、Fe 2+
(4)步骤①②③中①是铁和氯化铜反应;②是铁和盐酸反应;③中发生两个反应;氯化亚铁和氢氧化钠反应;盐酸和氢氧化钠反应这两个反应都属于复分解反应,①②中金属与酸、金属与盐的反应都是置换反应;
故答案为:(1)引流(2)Fe+CuCl 2 ═FeCl 2 +Cu(3)Na + 、Fe 2+ (4)①②1年前查看全部
- (2012•镇江)工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的
(2012•镇江)工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下的实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O
CO2↑+CO↑+4H2O浓硫酸 △
(1)下列可用作草酸分解制取气体的装置是______(填字母编号)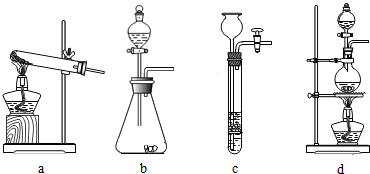
【问题讨论】用下图所示装置进行实验: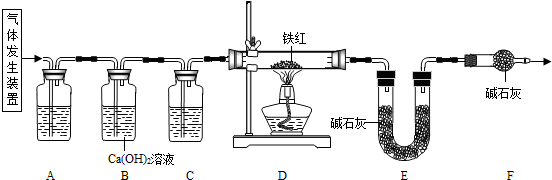
(2)实验前应先______.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是______、______(填字母编号)
a.浓硫酸 b.澄清石灰水 c.氢氧化钠溶液
(4)B装置的作用是______.
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:①加热前______.停止加热后______.
(6)写出D装置中所发生反应的一个化学方程式3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
【数据分析与计算】
【资料2】铁的常见氧化物中铁的质量分数:
(7)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.铁的氧化物 FeO Fe2O3 Fe3O4 铁的质量分数 77.8% 70.0% 72.4%
①D中充分反应后得到Fe粉的质量为mg,则______<m<______.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是______.
【实验反思】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会______(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷______. xiaobaosanmei1年前1
xiaobaosanmei1年前1 -
 zhushun 共回答了19个问题
zhushun 共回答了19个问题 |采纳率89.5%(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置,故答案为:d
(2)实验前应先检查装置的气密性,故答案为:检查装置的气密性
(3)二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,一氧化碳可以用浓硫酸干燥;故答案为:c;a
(4)B装置还可以检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽
(5)加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.故答案为:①将装置中的空气排出,防止发生爆炸;②驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.(合理即可)
(6)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;故答案为:3CO+Fe2O3
高温
.
2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以)
(7)如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×[32/44]=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=[10 g-2.4g/10g]×100%=76.0%;故答案为:①7.0;7.78;②76.0%
实验反思:本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置.故答案为:偏小;缺少尾气处理装置.1年前查看全部
- (2010•扬州模拟)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的
(2010•扬州模拟)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为______.
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于______晶体.
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是______.
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是______,原因是______.
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为______,分子的空间构型为______.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为______.
 隐行人alex1年前1
隐行人alex1年前1 -
 疯了的正长人 共回答了9个问题
疯了的正长人 共回答了9个问题 |采纳率77.8%解题思路:(1)Ti的原子序数为22,位于周期表第四周期ⅡB族;
(2)两种氯化物的熔沸点较低,应属于分子晶体;
(3)SO42-和 S2O82-中S元素的化合价分别为+6价和+7价,SO42-中含有σ键;S2O82-中含有S-S键;
(4)影响离子晶体熔沸点高低的因素有半径因素和电荷因素;
(5)根据价层电子对数计算杂化类型并判断空间构型;
(6)根据均摊法分别计算两种晶体的配位数,可计算出配位数之比.(1)Ti的原子序数为22,位于周期表第四周期ⅡB族,核外电子排布为[Ar]3d24s2,
故答案为:[Ar]3d24s2;
(2)两种氯化物的熔沸点较低,应属于分子晶体,故答案为:分子;
(3)A.SO42-中只存在σ键,故A错误;
B.S2O82-中含有S-S键,为非极性键,有强氧化性,故B正确;
C.SO42-和 S2O82-中S元素的化合价分别为+6价和+7价,两者的氧元素的化合价不同,故C错误,
故答案为:B;
(4)影响离子晶体熔沸点高低的因素有半径因素和电荷因素,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高,
故答案为:MgO;均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高;
(5)价层电子对数为[6+2/2]=4,孤电子对数为[6−2/2]=2,所以杂化类型为sp3杂化,分子为V形结构,
故答案为:sp3、V形(折线形);
(6)图1中Fe位于体心和顶点,铁的配位数为8,图2中Fe位于顶点和面心,距离最近的为顶点和面心的铁原子,有12个,所以配位数为12,二者比值为8:12=2:3,
故答案为:2:3.点评:
本题考点: 晶胞的计算;原子核外电子排布;配合物的成键情况;晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查较为综合,涉及多方面的知识,题目难度中等,易错点为(6),注意利用均摊法计算晶胞,学习中注意把握电子排布式、杂化类型、晶体的类型以及熔沸点的比较等方法.1年前查看全部
- (16分)以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜
(16分)以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。

(1)若F是由Na + 和SO 4 2- 组成的溶液,则甲的化学式是 ,列举A物质的一种用途 。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中的 ;在I溶液中加入氢氧化钠溶液,可以观察到的现象是 ,对应的离子方程式和化学方程式依次是 ,
;
(3)写出G A+C的化学方程式: 。
A+C的化学方程式: 。
(4)若A中混有杂质Al 2 O 3 ,除去杂质的方法是加入过量的 ,该反应的离子方程式为 。
(5)由E和A组成的混合物与稀H 2 SO 4 作用,固体恰好溶解,所得溶液中不含Fe 3 + ,且生成的Fe 2 + 与H 2 的物质的量之比为4:1。则反应物中Fe 2 O 3 、Fe、H 2 SO 4 的物质的量之比为____ ____。 juan08961年前1
juan08961年前1 -
 Juventus_1897 共回答了19个问题
Juventus_1897 共回答了19个问题 |采纳率89.5%1年前查看全部
- 关于铁及其化合物的性质和用途的叙述中,正确的是 A.用铝锅炒菜比用铁锅好 B.Fe 2 O 3 俗称铁红,常用作红色油漆
关于铁及其化合物的性质和用途的叙述中,正确的是
A.用铝锅炒菜比用铁锅好 B.Fe 2 O 3 俗称铁红,常用作红色油漆和涂料 C.黑色的FeO不溶于水,也不溶于盐酸 D.FeSO 4 溶液在空气中可长期存放,不会变质  lidan348761年前1
lidan348761年前1 -
 ps0256 共回答了24个问题
ps0256 共回答了24个问题 |采纳率95.8%B
1年前查看全部
- 氧化铁可用坐红色颜料,俗称铁红,试根据氧化铁的化学式计算:
氧化铁可用坐红色颜料,俗称铁红,试根据氧化铁的化学式计算:
(1)氧化铁的相对分子质量
(2)氧化铁中铁元素的质量分数
(3)1000t铁红最多含有铁的质量
(4)1000t杂质5%的铁红中最多含量的质量(假设杂质中不含有铁元素).
请写下计算过程,谢谢、 月光离1年前1
月光离1年前1 -
 nande 共回答了20个问题
nande 共回答了20个问题 |采纳率100%(1)Fe2O3的相对分子质量=56*2+16*3=160
(2)Fe%=(56*2)/160=70%
(3)1000t*70%=700t
(4)1000t*5%*70%=35t1年前查看全部
- 某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品.过程如下图所示
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品.过程如下图所示
(废水中的其他物质不参与反应)
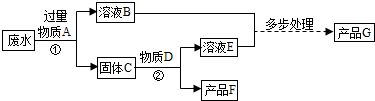
过程①中发生反应的化学方程式为.
A-G七种物质中含铁元素的有(填字母代号).
 stella07191年前1
stella07191年前1 -
 落语归尘 共回答了12个问题
落语归尘 共回答了12个问题 |采纳率75%反应①化学方程式:CuSO4+Fe=FeSO4+Cu
含铁元素的有ABCEG1年前查看全部
- 二氧化三铁又称铁红,是粉红色粉末.为什么实验室中的是黑色的?
 水精灵的水枪1年前2
水精灵的水枪1年前2 -
 再见了暑假 共回答了21个问题
再见了暑假 共回答了21个问题 |采纳率90.5%楼主说法有错误.首先是三氧化二铁,不是二氧化三铁.
三氧化二铁又称铁红,是红色粉末,绝对没错,绝不是黑色的.
黑色的有铁粉、四氧化三铁、氧化亚铁等.1年前查看全部
- 下列有关叙述正确的是( ) A.Fe 2 O 3 俗称铁红,用作红色油漆或涂料 B.“酸雨”是由大气中的碳、硫、氮的氧
下列有关叙述正确的是( )
A.Fe 2 O 3 俗称铁红,用作红色油漆或涂料 B.“酸雨”是由大气中的碳、硫、氮的氧化物溶于雨水造成 C.氯化钠、蔗糖、小苏打都是电解质 D.石油分馏、煤的气化、海水制食盐等过程都包含化学变化  quantity5031年前1
quantity5031年前1 -
 米花0511 共回答了21个问题
米花0511 共回答了21个问题 |采纳率85.7%A
酸雨的形成与大气中的碳的氧化物无关,B项错误;蔗糖为非电解质,C项错误;石油分馏、海水制盐没有发生化学变化,D项错误1年前查看全部
- 磁铁矿,铁红,苛性钠,烧碱,火碱,小苏打,苏打,纯碱,它们是纯净物还是混合物?
 gaoping20181年前1
gaoping20181年前1 -
 hanxl8 共回答了15个问题
hanxl8 共回答了15个问题 |采纳率93.3%苛性钠,烧碱,火碱,小苏打,苏打,纯碱,都是纯净物
铁红是铁的化合物:铁红 Fe2O3
磁铁矿,应该说所有的矿物质(金、银除外)都是混合物1年前查看全部
- 氧化铁的颜色铁黄 铁红等 成分都是氧化铁 那黄色是怎么来的?
 科科科1年前1
科科科1年前1 -
 yemajun 共回答了20个问题
yemajun 共回答了20个问题 |采纳率100%铁黄 是氧化铁的水合物 由空气中金属铁氧化而得 色光从柠檬黄到橙黄都有.着色力几乎与铅铬黄相等.耐光、耐大气影响、耐污浊气体以及耐碱性都非常强.耐酸性较差特别是能被浓热的强酸溶解.加热时脱水变色,逐渐形成氧化铁红.1年前查看全部
- 天安门城楼的红墙所用的红色颜料是铁红(主要成分为Fe2O3),试计算1 000 kg铁红中最多含铁的质量
 ii猴子1年前1
ii猴子1年前1 -
 悲伤翻篇 共回答了19个问题
悲伤翻篇 共回答了19个问题 |采纳率94.7%1000*(56*2/56*2+16*3)=700kg1年前查看全部
- 铁红的化学方程式是什么?铁红和氧化铜在工业上各有一种什么用途?
 skskgod1年前1
skskgod1年前1 -
 xalsf1020 共回答了14个问题
xalsf1020 共回答了14个问题 |采纳率100%化学式:Fe2O3,又叫氧化铁
氧化铜--制人造丝、陶瓷、釉及搪瓷、电池、石油脱硫剂、杀虫剂,也供制氢、催化剂、绿色玻璃等用. 氧化铁---1. 其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中 2. 可做催化剂 3. 玻璃、宝石、金属的抛光剂 4.用于和CO反应炼制生铁(H2也可) Fe2O3+3CO=2Fe+3CO2(高温) Fe2O3+3H2=2Fe+3H2O(高温) 2Fe2O3+3C=(高温)4Fe+3CO2↑ 3Fe3O4+8Al==(高温) 还有 氧化铁溶于酸制三价铁盐1年前查看全部
- 天安门城楼的红墙所用的红色颜料是铁红(主要成分Fe2O3),试计算1000Kg铁红中最多含铁的质量.
 暗香朵朵1年前1
暗香朵朵1年前1 -
 210076gyc 共回答了22个问题
210076gyc 共回答了22个问题 |采纳率90.9%Fe2O3中Fe质量分数=56*2/(56*2+16*3)=70%
所以1000Kg铁红中最多含铁的质量=1000*70%=700kg1年前查看全部
- 铁红的化学方程式是什么?铁红和氧化铜在工业上各有一种什么用途?
 朱颜幽梦1年前1
朱颜幽梦1年前1 -
 sczyf 共回答了15个问题
sczyf 共回答了15个问题 |采纳率93.3%铁红的化学方程式是Fe2O3 用途:红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中 ,可做催化剂 , 玻璃、宝石、金属的抛光剂 ,.用于和CO反应炼制生铁(H2也可)
氧化铜:用途:气体分析中测定碳.有机反应催化剂.制造人造丝和其他铜化合物.光学玻璃发光剂.作为色料用于人造宝石、有色玻璃、陶瓷釉彩1年前查看全部
- 由铁红制绿矾的化学方程式
 hhr1431年前1
hhr1431年前1 -
 826200 共回答了21个问题
826200 共回答了21个问题 |采纳率81%首先将铁红(Fe2O3)放到过量稀硫酸里方程式为:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O
再向其中加入过量的铁粉,方程式为:Fe+Fe2(SO4)3==3FeSO4,其中过量的铁粉和稀硫酸也会反应:Fe+H2SO4==H2+FeSO4,氢气后面记得打箭头.然后蒸发就好了.得到了绿矾.1年前查看全部
- 铁红与硫酸纳的反应化学方程式
 幽燕游霞1年前2
幽燕游霞1年前2 -
 mq200 共回答了22个问题
mq200 共回答了22个问题 |采纳率81.8%铁红就是Fe2O3,不和硫酸钠反应
但和NaHSO4反应,楼主是不是写错了?1年前查看全部
- 下列有关铁及其化合物的说法中,正确的是( ) A.Fe 3 O 4 是一种红棕色粉末,俗称铁红 B.Fe(OH) 2
下列有关铁及其化合物的说法中,正确的是( ) A.Fe 3 O 4 是一种红棕色粉末,俗称铁红 B.Fe(OH) 2 为白色固体,能在空气中稳定存在 C.除去FeCl 2 溶液中的FeCl 3 杂质,可以向溶液中加入过量的铁粉,然后过滤 D.Fe 2 (SO 4 ) 3 溶液遇到KSCN溶液产生血红色沉淀  YanZi_Carrie1年前1
YanZi_Carrie1年前1 -
 bp2mm 共回答了18个问题
bp2mm 共回答了18个问题 |采纳率83.3%A.氧化铁是红色粉末,俗称铁红,四氧化三铁是黑色固体,俗称磁性铁,故A错误;B.氢氧化亚铁为白色固体,不稳定,易被空气中氧气氧化生成红褐色氢氧化铁,所以在氯化亚铁和氢氧化钠溶液反应过程中固体颜色变化...1年前查看全部
- 工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学进行
工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学进行
进行了如下实验.
别的我会,可是这一条
的常见氧化物中铁的质量分数:
铁的氧化物 FeO Fe2O3 Fe3O4
铁的质量分数 77.8% 70.0% 72.4%
(7)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.①D中充分反应后得到Fe粉的质量为mg,则
.②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是.76%
我想问一下,为什么是76%呢?根据化学方程式,co2的质量是6.6,生成铁的质量是56,不应该是56%吗 caizhiyusart1年前1
caizhiyusart1年前1 -
 xx火石 共回答了25个问题
xx火石 共回答了25个问题 |采纳率84%你的方程式是什么
铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,无法写出方程式呀
CO----CO2---O 增加的一个O来源于铁红中
44 16
6.6g x
44/6.6g=16/x
x=2.4g
铁红中铁的质量分数是.(10g-2.4g)/10g*100%=76%1年前查看全部
- 请问:铁红的化学式要写结晶水吗?
 难得糊涂09151年前2
难得糊涂09151年前2 -
 南柯梦狼 共回答了15个问题
南柯梦狼 共回答了15个问题 |采纳率86.7%氧化铁通常指三氧化二铁,化学式Fe2O3,分子量159.69,棕红色粉末,俗称铁红.密度5.24g/cm3,熔点1565℃.不溶于水,不与水反应.跟酸反应,生成铁盐.在高温下可被氢气、一氧化碳等还原成铁.用作颜料、抛光剂、催化剂等.灼烧硫酸亚铁或氢氧化铁制得.1年前查看全部
大家在问
- 1根据句意及首字母提示完成单词 C____ to you!You have passed exam.
- 2this coat is too small for me to wear的同义句
- 3已知关于x的方程组2x+y=k+1①和x-3y=3②的解x,y
- 4下表是某生态系统能量流动情况的调查结果,表中甲、乙、丙、丁、戊分别代表构成各营养级的不同种群[表中数据单位:l02kJ/
- 5观沧海的练习题(有分加哦)从诗大的体裁看,这是一首( )体( )言,从表达方式看,它是一首( )写景的诗.回答时要把题目
- 6解方程:x+1分之1 + 2分之1 = 6分之5
- 7求一道数学题 已知椭圆x²/16+y²/4=1,过点(2.1)做一弦 使弦在这点被平分,求直线方程
- 8我现在初二,期末总分一共345分.算好还是坏啊
- 9英语改正下列句子中的错误问题在补充里
- 10《读书·养气·写作》语文阅读题答案
- 11词语杰作的意思
- 12光的反射的典型例子是平面镜成像吗?光的折射的典型例子是凸透镜成像吗?
- 13以地球为中心40拍米外有什么行星
- 14写出动词的 -ing 形式 what——you doihg.
- 15秋天比春天冷得多英语怎么说?2种说法


