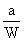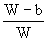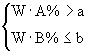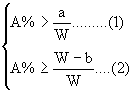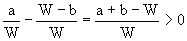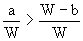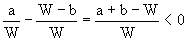结晶法分离混合物和熔点有关吗
 001ll02022-10-04 11:39:543条回答
001ll02022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 顶级鸟 共回答了21个问题
顶级鸟 共回答了21个问题 |采纳率90.5%- 结晶法分两种:
一种是蒸发结晶,适用于溶解度随温度变化比较小的物质,如NaCl.当温度变化时,如从100度降到20度,但溶解度变化不大,析出的NaCl很小,所以要析出晶体,必须蒸发掉水份.
一种是降温结晶,适用于溶解度随温度变化比较大的物质,如KNO3.当饱和溶液降温时,溶解度大大降低,所以KNO3因为溶解度变小了,结晶析出.
用结晶法分离:如NaCl溶液中的KNO3,就可以采用降温结晶的办法了.与熔点是无关的,只与溶解度有关. - 1年前
 lisasmile1983 共回答了11个问题
lisasmile1983 共回答了11个问题 |采纳率- 没有关系,只与溶解度有关系。
- 1年前
 华山81 共回答了5个问题
华山81 共回答了5个问题 |采纳率- 没有关系,结晶分离法只是利用两种或多种可溶性固体在同一种溶剂里溶解度的不同来达到分离的目的。(=^ ^=)还有什么不懂再问哈
- 1年前
相关推荐
- (2005•桂林)下列各组物质,只用结晶法就可分离的是( )
(2005•桂林)下列各组物质,只用结晶法就可分离的是( )
A.酒精和水
B.KNO3和NaCl
C.MnO2和KCl
D.CaCO3和河沙 恨娇不爱1年前1
恨娇不爱1年前1 -
 可靠人格 共回答了14个问题
可靠人格 共回答了14个问题 |采纳率71.4%解题思路:结晶的方法是分离两种溶解度随温度变化趋势差异较大的可溶性物质的方法,据此对选项进行分析判断即可.A、酒精与水能以任意体积比互溶,且一般不能出现晶体,因此结晶法不能对其进行分离;
B、KNO3和NaCl两种物质均溶于水且硝酸钾溶解度随温度变化明显,氯化钠溶解度随温度变化不明显,故可以采用结晶的方法进行分离;
C、MnO2和KCl中二氧化锰不溶于水,氯化钾溶于水,可采用过滤的方法分离;
D、CaCO3和河沙均不能溶于水,所以不可采用结晶的方法分离;
故选B.点评:
本题考点: 结晶的原理、方法及其应用.
考点点评: 此题是有关混合物分离的考查题,解题的关键是掌握采用结晶法分离混合物的原则,即结晶的方法是分离两种溶解度随温度变化趋势差异较大的可溶性物质的方法.1年前查看全部
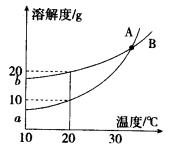
- A、B两种化合物溶解度曲线如右图,现要求用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响).取50g
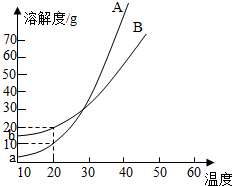 A、B两种化合物溶解度曲线如右图,现要求用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响).取50g混合物将其溶于100g热水中然后冷却至20℃,若要使A析出而B不析出,则混合物中B的质量分数最高不能超过( )
A、B两种化合物溶解度曲线如右图,现要求用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响).取50g混合物将其溶于100g热水中然后冷却至20℃,若要使A析出而B不析出,则混合物中B的质量分数最高不能超过( )
A.20%
B.30%
C.40%
D.50% 意大利vsvvl2比01年前1
意大利vsvvl2比01年前1 -
 小云17 共回答了13个问题
小云17 共回答了13个问题 |采纳率92.3%解题思路:根据题意,冷却至20℃,若要使A析出而B不析出,需满足此时B物质的为不饱和溶液最多恰好为饱和溶液;据此,由B物质20℃时的溶解度,计算混合物中B的质量分数最大值.为降温到20℃时A析出而B不析出,此时B物质的为不饱和溶液最多恰好为饱和溶液;
据溶解度曲线,20℃时B物质的溶解为20g,即100g水中最多可溶解B物质20g,因此,可判断原50g混合物中含B物质不超过20g;
此时混合物中B物质的质量分数=[20g/50g]×100%=40%,则混合物中B的质量分数最高不能超过40%
故选C.点评:
本题考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用.
考点点评: 根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小,可以判断某温度下物质的溶解度.1年前查看全部
- 下列混合物适宜用结晶法分离的是:( )A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)
下列混合物适宜用结晶法分离的是:( )A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)2 D.NaCl BaSO4
 龙V芳1年前1
龙V芳1年前1 -
 ywwf 共回答了26个问题
ywwf 共回答了26个问题 |采纳率92.3%B
因为,NaNO3的溶解度随温度的升高而增大,NaCl的溶解度随温度的升高而变化不大1年前查看全部
- (初四化学)海水淡化的方法①蒸馏法原理 ②结晶法原理 ③膜法原理
 whhlm1年前1
whhlm1年前1 -
 llren_1982 共回答了16个问题
llren_1982 共回答了16个问题 |采纳率87.5%①蒸馏法原理:根据海水里面各种物质不同沸点的原理,通过蒸汽的方法提取水.
②结晶法原理:根据海水里面各种物质不同结晶温度的原理,先将海水加热,然后通过降温,海水里面的nacl nabr等物质先结晶,剩下的不就是水了么.
③膜法原理:通过高分子膜来提取海水,因为高分子膜具有憎水性或亲水性,通过亲水性高分子膜可以使水从膜的一边渗透到另一边,但是海水中的盐分却不可以通过,以这样的方法进行海水淡化.
求给分,纯手打不易.1年前查看全部
- 氯化钠和硫酸钡能通过结晶法分离吗?
 莫邪52881年前1
莫邪52881年前1 -
 夏雪雨 共回答了22个问题
夏雪雨 共回答了22个问题 |采纳率100%不能
因为BaSO4难溶于水,如果用结晶法,NaCl析出后会与BaSO4混在一起.无法分离
正确的分离方法:直接过滤即可1年前查看全部
- 分离下列混合物不可行的是:A.用结晶法冲含有少量NaCl的KNO3溶液中分离KNO3.B.用过滤法除去氢氧化铁胶体中的氯
分离下列混合物不可行的是:A.用结晶法冲含有少量NaCl的KNO3溶液中分离KNO3.B.用过滤法除去氢氧化铁胶体中的氯化铁.C.用新制的生石灰通过加热蒸馏驱除乙醇中的少量水.
制取时二氧化碳为什么不能用硫酸?
a 和c为什么可以麻烦解释下被谢谢~ 我就是任因久1年前3
我就是任因久1年前3 -
 黔龙出山 共回答了13个问题
黔龙出山 共回答了13个问题 |采纳率92.3%A 中NaCl和KNO3的溶解度随温度的降低变化不一样,所以可以分离
B 中离子和胶体的分离只能用半透膜
C中 水和生石灰反应生成氢氧化钙 然后和乙醇的沸点就不一样了(有机物和无机物的沸点一般都有差别的)
硫酸和碳酸钙生成的硫酸钙微溶,不能持续反应.1年前查看全部
- 什么是 悬浊溶液,乳浊溶液,胶体溶液?什么是 晶体?什么是 结晶法?请简单而实际地说明!
 66750271年前2
66750271年前2 -
 不用添 共回答了17个问题
不用添 共回答了17个问题 |采纳率100%悬浊液是大于100nm固体小颗粒分散在液体中的液体,就是说溶质不溶解,只能以小颗粒悬浮形式在了液体中,比如说生活中的面汤
乳浊液是体液小液滴由于不溶于溶解液体而分散在溶剂液体中,比如生活中的牛奶豆浆等等
胶体溶液1-100nm固体小颗粒分散在溶质液体中的液体,比如说生活中的硅胶交替...胶体和悬浊液都是固体不溶解而以小颗粒形式分散在液体中,只不过小颗粒的直径大小不同而已.
晶体内部构成该物质的原子能够有规律排列的固体.比如说很多金属,内部的原子都是一层层规律排列的.
结晶法就是通过控制不同物质的在溶剂中的溶解度不同而洁净的方法.举个例子来说,A,B两种物质在水中溶解度不同,A物质远大于B物质,那么在加热溶解后降温,由于A物质的溶解度大,所以会在水中不析出.而B物质因为溶解度较小所以在降温时溶解更加降低会从水溶液中晶体析出.
希望能对你有所帮助...
答案纯属原创,此外悬浊溶液,乳浊溶液和胶体溶液的说法是欠妥的.悬浊液,乳浊液和胶体与溶液的概念是不一样的,不能混为一谈哦...1年前查看全部
- 什么是分馏法、结晶法(KNO3和NaCl)
 梦中的橡树1年前1
梦中的橡树1年前1 -
 zysandxl111 共回答了19个问题
zysandxl111 共回答了19个问题 |采纳率89.5%一、物质的分离和提纯基本原理
混合物的分离是指用物理、化学方法将混合物中各组分分开,并恢复到原状态,得到比较纯的物质.物质的提纯则只要将杂质除去即可.物质提纯的原则为:不增(不引入新的杂质)、不变、易分离.
实验操作要简便,不能繁杂.用化学方法除去溶液中的杂质时,要想把被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去.
二、常用的分离和提纯方法
1.过滤 过滤是除去溶液中混有不溶于溶剂的杂质的方法.
过滤时应注意:
(1)一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁.
(2)二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘.
(3)三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和漏斗中有三层滤纸处轻轻接触;漏斗颈的末端应与接受器的内壁相接触,例如用过滤法除去粗食盐中少量的泥沙.
2.蒸发和结晶 蒸发是将溶剂气化、使溶液浓缩从而使溶质析出的方法.结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物.加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅拌溶液,防止由于局部温度过高,造成液滴飞溅.当蒸发皿中出现较多的固体时,即停止加热.结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出.例如用结晶的方法将NaCl和KNO3分离.
3.蒸馏 蒸馏是提纯或分离沸点不同的液体混合物的方法.用蒸馏原理进行多种混合液体的分离,叫分馏.例如将石油蒸馏可以得到煤油、汽油、柴油等等.
4.分液和萃取 分液是把两种互不相溶、密度也不相同的液体分离开的方法.萃取是利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法.萃取和分液经常一起使用来分离物质.选择的萃取剂应符合下列要求:
(1)和原溶液中的溶剂互不相溶;
(2)对溶质的溶解度要远大于原溶剂;
(3)溶剂易挥发.
在萃取和分液过程中要注意:
(1)将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡.
(2)振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡.
(3)然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗下口放出,上层液体从上口倒出.
三、常见的分离方法选择
1.对于固体与固体的混合物:
(1)杂质易分解、易升华时,用加热法,如碳酸钠中混有NaHCO3;
(2)一种易溶,一种难溶,用过滤法,如NaCl中混有泥沙;
(3)二者均易溶,但其溶解度随温度的影响不同,用结晶法,如NaCl中混有KNO3.
2.液体与液体的混合物:
(1)沸点相差较大时,用蒸馏法,如酒精与水的分离;
(2)互不混溶时,用分液法,如四氯化碳与水的混合物的分离;
(3)在互不相溶溶剂中的溶解度不同时,用萃取法,如用CCl4萃取碘水中的碘.
3.气体与气体的混合物:洗气吸收法.
四、常见物质分离、提纯范例
1.物理方法的范例
(1)溶解、过滤法
MnO2与KCl的分离:采用溶解过滤法.除去炭粉中杂质氧化铜或铜粉中锌杂质,采用盐酸溶解、过滤法除杂.
(2)加热灼烧法
氧化铜中混有炭粉,二氧化锰中混有炭粉采用在空气中加热灼烧法除杂.
(3)溶解、结晶法
例如,分离氯化钠和硝酸钾可根据两种物质的含量不同分别采用蒸发结晶法或降温结晶法.
2.化学方法的范例
(1)生成气体法:如除去氯化钠中碳酸钠杂质,加适量盐酸.
(2)生成沉淀法:如除去氯化钠溶液中氯化钙杂质,加适量的碳酸钠溶液.
(3)还原法:如铜粉中有氧化铜杂质:在加热条件下通入足量氢气或一氧化碳.
(4)正盐酸式盐转化法:例如,碳酸钠溶液中含有碳酸氢钠杂质,向溶液中加入适量的氢氧化钠,NaHCO3+NaOH=Na2CO3+H2O;碳酸氢钠溶液中含有少量碳酸钠杂质:向溶液中通入过量二氧化碳,Na2CO3+CO2+H2O=2NaHCO3.
(5)洗气法:除去下列气体中的杂质,括号中为杂质:
CO(CO2):碱溶液;H2(HCl):水或碱溶液;CO2(HCl):饱和碳酸氢钠溶液;SO2(HCl):饱和亚硫酸氢钠溶液.
(6)加热法:除去氮气中氧气:通过炽热铜网;除去二氧化碳中CO,通过炽热氧化铜粉末.
(7)干燥法:常见干燥剂有氯化钙、碱石灰、生石灰和浓硫酸.一般最后一步除去水蒸气.
在实际应用中往往分离或提纯一种物质要用到多种方法:例如,粗盐中含有Ca2+ 、 Mg2+ 、SO42-等杂质,提纯方法:溶解、依次加入过量氯化钡溶液、过量氢氧化钠溶液、过量碳酸钠溶液、过量盐酸溶液,蒸发得到氯化钠纯净物.再如,空气中含有二氧化碳、氧气依次通过氢氧化钠、炽热铜网最后得到氮气和稀有气体等.1年前查看全部
- 现有下列实验方法,1,用盐析法分离油脂皂化反应的产物 2,用结晶法分离硝酸钾与氯化钠的混合物
现有下列实验方法,1,用盐析法分离油脂皂化反应的产物 2,用结晶法分离硝酸钾与氯化钠的混合物
3,用分液法分离水和溴乙烷的混合物 4,用蒸馏的方法分离酒精和苯酚
正确的有? bsrr471年前1
bsrr471年前1 -
 kiddying 共回答了21个问题
kiddying 共回答了21个问题 |采纳率100%①正确;油脂皂化反应后的产物加食盐可析出高级脂肪酸钠,
②正确;NaCl的溶解度受温度变化影响很小,而KNO3的溶解度受温度变化影响较大,故可通过重结晶法分离KNO3和NaCl的混合物,
③正确;水和溴乙烷互不相溶,可用分液法分离,
④正确;酒精和苯酚的沸点(分别为78.5 ℃和182 ℃)差别较大,可用蒸馏法分离,1年前查看全部
- 下列说法中不正确的是( )A.目前已采用的海水淡化方法有多级蒸馏法、结晶法、膜法等B.绿色化学能够从源头上阻止污染,有
下列说法中不正确的是( )
A.目前已采用的海水淡化方法有多级蒸馏法、结晶法、膜法等
B.绿色化学能够从源头上阻止污染,有助于实现人类与自然的和谐相处
C.“白色污染”不是指白色的垃圾
D.地球上的淡水资源相当丰富,因为地球称为“水球” kf881年前1
kf881年前1 -
 绫波迷A 共回答了21个问题
绫波迷A 共回答了21个问题 |采纳率90.5%解题思路:A、根据海水淡化的原理及方法进行分析.B、从绿色化学的理念出发分析.C、从“白色污染”的污染物来源进行分析.D、从水资源的分类及分布分析.A、目前淡化海水的方法有多种,如:蒸馏法、结晶法、淡化膜法、多级闪急蒸馏法等,其中最常用的是蒸馏法,目前多采用多级闪急蒸馏法.正确.
B、绿色化学是指原子利用率为100%的化学,即实现零排放,所以可以从源头阻止污染,正确.
C、“白色污染”是指有废弃塑料引起的污染,并不是指白色物质理解,正确.
D、地球上的水资源很丰富,但是淡水资源还不到水资源的1%,所以要保护水资源,错误.
故选D点评:
本题考点: 绿色化学;水资源状况;白色污染与防治.
考点点评: 绿色化学实质是反应物全部反应生成所需的产物,实现原子利用率100%,不造成浪费、污染,从源头上做起.1年前查看全部
- 求详解) A,B两种化合物的溶解曲线如图所示.现要用结晶法从A,B混合物中提取
求详解) A,B两种化合物的溶解曲线如图所示.现要用结晶法从A,B混合物中提取
如图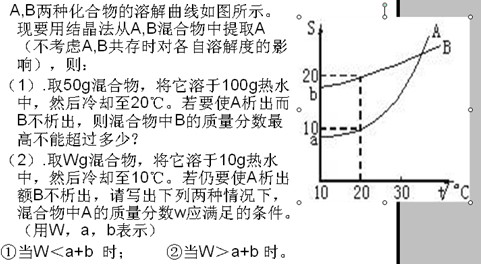
 顺子19801年前3
顺子19801年前3 -
 张某某 共回答了18个问题
张某某 共回答了18个问题 |采纳率88.9%20度时100g水中B最多可溶20g,降温到20度时,没有B析出,所以原混合物中B的质量最多为20g,所以原混合物中B的质量分数最多不超过 20g/50g*100%=40%
第二题看不清呀
有问题Hi我1年前查看全部
- 结晶法的步骤它与降温结晶,蒸发结晶有什么区别?
 穿裤子的他1年前1
穿裤子的他1年前1 -
 不再的小懒 共回答了16个问题
不再的小懒 共回答了16个问题 |采纳率93.8%加热浓缩,冷却结晶,过滤~就OK了
结晶的方法一般有2种:一种是蒸发溶剂法,它适用于温度对溶解度影响不大的物质.沿海地区“晒盐”就是利用的这种方法.另一种是冷却热饱和溶液法(即降温结晶).此法适用于温度升高,溶解度也增加的物质.如北方地区的盐湖,夏天温度高,湖面上无晶体出现;每到冬季,气温降低,纯碱(Na2CO3·10H2O)、芒硝(Na2SO4·10H2O)等物质就从盐湖里析出来.在实验室里为获得较大的完整晶体,常使用缓慢降低温度,减慢结晶速率的方法.1年前查看全部
- 可以用结晶法分离的是哪个1酒精和水2硝酸钾和水
 xiaomifeng19761年前1
xiaomifeng19761年前1 -
 想游泳的小鱼 共回答了23个问题
想游泳的小鱼 共回答了23个问题 |采纳率82.6%第二个.因为第一个酒精与水任意比互溶,不可能用结晶法分离.硝酸钾的溶解度随温度变化较大,所以可以用结晶法分离.1年前查看全部
- 物质结晶法主要有两种,分别是什么?海水晒盐是哪一种?
 as8830701年前1
as8830701年前1 -
 cs3rffdsfd 共回答了12个问题
cs3rffdsfd 共回答了12个问题 |采纳率83.3%降温结晶法
蒸发结晶法
海水晒盐是蒸发结晶法1年前查看全部
- 用结晶法分离物质的条件拜托不要从别的地方抄一堆听不懂的话!
 free66881年前1
free66881年前1 -
 边走边爱j 共回答了13个问题
边走边爱j 共回答了13个问题 |采纳率84.6%两种物质在不同的温度下溶解度的变化不同可以分离
例如:100度时 氯化钾可以溶解150g(假设不一定正确)20度时可以溶解10g
100度时 氯化钠可以溶解37g 20度时可以溶解36g 先把水加热到100度把氯化钠氯化钾的混合物150g加入到水中 如果是氯化钾那么全部溶解 剩下的就是氯化钠 分离出来氯化钠之后,把溶液降温至20度 氯化钾出来140g 氯化钠出来1g纯度很高了 这样就算把两种物质分开了
结晶法主要看溶解度的变化1年前查看全部
- A、B两种化合物的溶解度曲线如图所示,现要用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响)。
A、B两种化合物的溶解度曲线如图所示,现要用结晶法从A、B混合物中提取A(不考虑A、B共存时对各自溶解度的影响)。
小题1:取50g混合物,溶于100g热水,然后冷却至20℃。若要使A析出而B不析出。则混合物中B的质量分数(B%)最高不能超过多少?(写出推理及计算过程)
小题2:取Wg混合物。溶于100 g的热水,然后冷却至10℃若仍要使A析出而B不析出。请写出下列两种情况下,混合物中A的质量分数(A%)应满足什么关系式。(以W、a、b表示)
当W 当W>a+b时, A%______________ 两个一次性杯1年前1
两个一次性杯1年前1 -
 南方人2006 共回答了22个问题
南方人2006 共回答了22个问题 |采纳率81.8%1年前查看全部
- 蒸馏法、过滤法、结晶法这三种哪个是海水淡化常用的方法
 飘荡的海1年前1
飘荡的海1年前1 -
 qi291ying 共回答了20个问题
qi291ying 共回答了20个问题 |采纳率90%蒸馏法、1年前查看全部
- 混合物用结晶法和过滤法分离的区别
混合物用结晶法和过滤法分离的区别
哪种混合物分离用的是结晶法..
哪种分离用的是过滤法... ruioy1年前1
ruioy1年前1 -
 清风519 共回答了22个问题
清风519 共回答了22个问题 |采纳率95.5%结晶的话是两种易溶的溶液,随着温度的变化变化不大的.
过滤的话是一种可溶,一种不可溶1年前查看全部
- 有一KNO3和NaCI的混合物,其中KNO3的质量分数占92%,NaCI的质量分数占8%,现在采用结晶法分离该混合物.(
有一KNO3和NaCI的混合物,其中KNO3的质量分数占92%,NaCI的质量分数占8%,现在采用结晶法分离该混合物.(已知100摄氏度时溶解度KNO3 246g,NaCI 40g,20摄氏度时溶解度KNO3 331.6g,NaCI 36g)1,取500g混合物,在100摄氏度时把它们全部溶解,至少要加水多少克?2,把上述溶液降温至20摄氏度,析出的晶体是什么?其质量是多少克?
 鸽子满天飞1年前1
鸽子满天飞1年前1 -
 feiguolantian 共回答了12个问题
feiguolantian 共回答了12个问题 |采纳率91.7%是指100度时可以溶解硝酸钾246克氯化钠40克需要200克水.500/286*200=348g水1年前查看全部
- 用结晶法分离2种盐的混合溶液(如K NO3和NaCl),为什么不考虑离子两两组合结果(KCl和Na NO3)
 冰雪聪明的米米1年前5
冰雪聪明的米米1年前5 -
 幻彩琉璃a_a 共回答了21个问题
幻彩琉璃a_a 共回答了21个问题 |采纳率90.5%从溶液中离子存在形式来看,是以K+、Na+、Cl-、NO3-存在,所以析出四种物质的可能性,而通过控制降温结晶,就会让溶液中随温度变化大的溶质先析出来,这里有一个竞争的过程,因为KNO3随温度变化最大,所以可以通过控制温度结晶得到KNO3.(你需要去查一下这四种 物质在不同温度下的溶解度,对比之后更容易理解)1年前查看全部
- 氯化钠中混有少量的硝酸钾时,应如何用结晶法提纯
氯化钠中混有少量的硝酸钾时,应如何用结晶法提纯
这里提纯后要得到的是被提纯物质的晶体吗? 先锋骨头1年前2
先锋骨头1年前2 -
 悔浪 共回答了22个问题
悔浪 共回答了22个问题 |采纳率95.5%蒸发浓缩,冷却结晶1年前查看全部
- 物质分离的各种方法的条件萃取分液法,加热分解,结晶,分液,蒸馏,过滤 结晶法是分液的一种吗?我分不清结晶蒸馏和萃取,请各
物质分离的各种方法的条件
萃取分液法,加热分解,结晶,分液,蒸馏,过滤
结晶法是分液的一种吗?我分不清结晶蒸馏和萃取,请各位学长学姐帮帮忙,解释一下,谢谢.
 fish02751年前1
fish02751年前1 -
 benyao1 共回答了10个问题
benyao1 共回答了10个问题 |采纳率90%萃取分液的要求是分离的东西都是液体,并且相互溶解度极低,因为牵涉到萃取,所以两种液体对于溶质的溶解度要有明显差异.加热分解法分解要求需要保留的物质有热稳定性,在其他物质分解的温度点仍然能稳定存在.结晶法要求不同物质之间在溶解度变化程度不同,例如通过改变温度来结晶分离时,有的物质随温度变化溶解度变化快,会析出,有的则并不变化.分液的话参照萃取分液法,不牵涉到萃取即可.蒸馏法要求物质均为液体,一般具有良好的互溶性,但是沸点差距较大.过滤法比较简单,就是简单的固液分离罢了.
结晶法并不是分液法,分液针对的都是液体,结晶法虽说也是液体,但是收集的结晶是固体.
蒸馏和萃取是两种完全不同的化学操作,蒸馏是一种分离过程,而萃取是一种提纯的过程.蒸馏也是针对液体的,就像上面说的,是靠沸点不同把不同的物质慢慢蒸发出来,按照沸点不同收集,比如很多混在一起的液体,沸点是70度,130度,180度各种,那么比如在75度,135度,185度时各稳定一段时间,就可以把三中液体的蒸汽分别收集起来,在冷凝即可.而萃取的话,就是使用分液漏斗,一般是两种并不互溶的液体放在里面,然后一种从另一种中把溶剂溶解过来.纯手打,1年前查看全部
- 1.下列混合物中,既不可用结晶法,用不可用过滤法分离的是()
1.下列混合物中,既不可用结晶法,用不可用过滤法分离的是()
A.铁粉和铜粉
B.酒精和水
C.Cu(OH)2和CuSO4
D.食盐和水
2.粗盐提纯的主要操作步骤有————、————、————.这三部操作中都必须用到的仪器是————,该仪器在这三步操作中的作用分别是①————————②————————③———————— welby0051年前1
welby0051年前1 -
 老师辛苦了 共回答了10个问题
老师辛苦了 共回答了10个问题 |采纳率90%1 A B
2 溶解 过滤 结晶 ; 玻璃棒 ;搅拌,使充分溶解 ; 引流 ;搅拌 防止溶液局部受热飞溅.1年前查看全部
- 如何用结晶法分离乙醇和水?
 ningxiangren1年前1
ningxiangren1年前1 -
 zmpn321 共回答了25个问题
zmpn321 共回答了25个问题 |采纳率80%结晶法是将溶液中溶质通过浓缩降温使得晶体从饱和溶液析出从而分离的.降低的温度本身要比0度高才有可操作性.乙醇的能与水以任意比例互溶,就是说得不到饱和的乙醇溶液,也就不能结晶析出,况且乙醇的固液相变温度是零下100多.通常的方法是利用蒸馏,常压下,乙醇的沸点比水低,蒸馏使得乙醇蒸发,再冷却得到浓度较高的乙醇.反复蒸馏 可得到高浓度乙醇.理论上可以得到100%的乙醇,但实上,最高浓度的乙醇有99.9999%.1年前查看全部
- 碘水提纯碘可以用结晶法吗?
 tt燃烧的瓦特1年前1
tt燃烧的瓦特1年前1 -
 cara4693 共回答了14个问题
cara4693 共回答了14个问题 |采纳率92.9%不可以,碘会升华.1年前查看全部
- 下列属于物质化学变化的是A.结晶法除去NaCl中少量的KNO3 B气球冲入过量的空气,爆炸C金属钠有强还原性,能与水反应
下列属于物质化学变化的是
A.结晶法除去NaCl中少量的KNO3 B气球冲入过量的空气,爆炸
C金属钠有强还原性,能与水反应 D氯化钠溶于水生成盐酸 2004060321631年前2
2004060321631年前2 -
 欲烦 共回答了18个问题
欲烦 共回答了18个问题 |采纳率77.8%答案D
分液适用于互不相溶的液体之间的一种分离方法,蒸馏是依据混合物中个组分沸点不同而分离的一种法,适用于除去易挥发、难挥发或不挥发杂质,过滤适用于不溶性固体和液体之间的一种分离方法,因此它们都是物理变化,所以只有洗气从有可能发生化学反应,答案选D.1年前查看全部
- 什么时候用蒸馏,什么时候用萃取什么时候用蒸馏法,什么时候用萃取法,什么时候用分液法,什么是时候用结晶法?回答最好通俗易懂
什么时候用蒸馏,什么时候用萃取
什么时候用蒸馏法,什么时候用萃取法,什么时候用分液法,什么是时候用结晶法?回答最好通俗易懂. cwq3331年前1
cwq3331年前1 -
 yoppies 共回答了18个问题
yoppies 共回答了18个问题 |采纳率100%当各液体沸点不同时用蒸馏,当各物质在某溶剂中的溶解度不同时用萃取,当两液体互不相溶时用分液,当某物质可溶液蒸发出用结晶.1年前查看全部
- 化学实验时,什么时候用结晶法,什么时候用萃取分液法,什么时候用蒸馏法
 krin61001年前3
krin61001年前3 -
 把我掘哭了 共回答了19个问题
把我掘哭了 共回答了19个问题 |采纳率78.9%结晶法:看溶解的东西对于温度变化,如果变化较大,可以使用这种方法
萃取分液法:用于不互溶的两种液体
蒸馏法:用于溶质溶解在溶液中,且沸点不同1年前查看全部
- 获取纯的氯化钠书上说结晶法比蒸发法得到的氯化钠更纯,但是我不明白为什么.蒸发法没错是速度比结晶法快,但我觉得这只会导致得
获取纯的氯化钠
书上说结晶法比蒸发法得到的氯化钠更纯,但是我不明白为什么.
蒸发法没错是速度比结晶法快,但我觉得这只会导致得到的晶体比较小(或者说是粉末),但是为什么会没那么纯呢?别的分子可以与氯化钠分子组在一起,然后结为一体么?不太可能吧?
那是不是就是说,即使是蒸发法,也是氯化钠与氯化钠分子结合,氯化镁和氯化镁分子结合,所以混在一起以后不纯?还是说氯化钠分子会和氯化镁分子结合? 别城孤雁1年前6
别城孤雁1年前6 -
 bpboybpboy 共回答了16个问题
bpboybpboy 共回答了16个问题 |采纳率81.3%因为蒸发法氯化钠的杂质大部分留在氯化钠中,而结晶法杂质就能溶解在溶剂中而除去,多次结晶即重结晶就能出去大部分杂质,从而获得更纯净的氯化钠
蒸发法是两种物质混合在一起1年前查看全部
- 碳酸钠能用结晶法提取码?在碳酸钠,碳酸钾和碳酸氢钾的混合物中,碳酸钠能否用结晶法提取?具体怎样做?
 池花落无声1年前1
池花落无声1年前1 -
 ivycch 共回答了27个问题
ivycch 共回答了27个问题 |采纳率88.9%碳酸钠能用结晶法提取.具体操作如下:把碳酸钠,碳酸钾和碳酸氢钾的混合物溶于水制成较高温度的饱和溶液,然后冷却热饱和溶液到10 ℃,在10 ℃碳酸钠的溶解度为12.2克、碳酸氢钠的溶解度为8.15克、碳酸钾的溶解度为109...1年前查看全部
大家在问
- 1质量和熔点有什么关系熔点越高质量越大吗
- 2世界上熔点最高,硬度最大的物质是什么?怎么制造?开发?
- 3已知sinα+cosα=(1-根号3)/2,且0
- 4马路的两边相隔7米有一棵白杨树,小华乘无轨电车3分钟内看到马路的一边有白杨树151棵.
- 5Instead of pilling them together ,it pushes them apart.中文翻译
- 6已知 a ∈( 1/2π,π )sin a=3/5 ,则tan(π + 1/4π) 具体做题思路是什么
- 7活动小组在某山山脚测得的温度为22度,山顶为16度,请说出该山的相对高度.A1000米 B3666米 C2000 D60
- 8找规律填数:-5;-2;1;4,.第n个数是
- 9he thought nobody was around,but he was in fact seen __into
- 10一台压路机,前轮直径是1m,轮宽1.2m,每分钟滚动15周.一分钟前进了多少米?1分钟前轮压过的面积是多少
- 11过一点画已知直线的平行线文字叙述.过程.
- 12为什么托里拆利用汞所产生的压强作为标准大气压,为什么不用水?
- 13诞换偏旁组词将言字旁换成别的偏旁
- 14初中地理与高中地理有什么不同
- 15求初一(上)数学运算题20道有理数的 我说....