与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
 herry黄2022-10-04 11:39:543条回答
herry黄2022-10-04 11:39:543条回答A. 10mL 1mol/L (NH4)2SO4溶液
B. 50mL 0.2mol/L NH4Cl溶液
C. 10mL 0.1mol/L(NH4)2SO4溶液
D. 200mL 0.1mol/L NH4NO3溶液

已提交,审核后显示!提交回复
共3条回复
 为了vv来vv 共回答了21个问题
为了vv来vv 共回答了21个问题 |采纳率81%- 解题思路:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.
100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为:c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol•L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol•L-1;
C、10mL0.1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.2mol•L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol•L-1;
故选:BC.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,题目难度不大,注重了基础知识的考查,注意溶液中所含微粒的物质的量浓度与所取溶液的体积大小无关. - 1年前
 yuhai26 共回答了1个问题
yuhai26 共回答了1个问题 |采纳率- 题干中NH4+的浓度是0.1*2=0.2
A中为1
B中为0.2
C中为0.2
D中为0.1
所以选BC
这题不会是单选吧,时间久了,有点模糊了 - 1年前
 蓓蕾gg 共回答了4个问题
蓓蕾gg 共回答了4个问题 |采纳率- 呵呵,看氮元素的个数可解!
- 1年前
相关推荐
- 在100mL0.1mol/L的醋酸溶液中,欲使醋酸的电离程度增大,氢离子浓度减小,可采用的方法是( )
在100mL0.1mol/L的醋酸溶液中,欲使醋酸的电离程度增大,氢离子浓度减小,可采用的方法是( )
A. 加热
B. 加入lmol/L的醋酸溶液l00mL
C. 加入少量的0.5mol/L的硫酸
D. 加入少量的lmol/L的NaOH溶液 北部湾的日出1年前1
北部湾的日出1年前1 -
 miaozhangxin 共回答了19个问题
miaozhangxin 共回答了19个问题 |采纳率78.9%解题思路:醋酸是弱电解质,弱电解质的电离是吸热反应,升高温度促进其电离,向醋酸中加入和氢离子反应或醋酸根离子反应的物质或者是加水稀释都能促进醋酸电离,但氢离子浓度减小,说明改变的条件能和氢离子反应.A.醋酸是弱电解质,醋酸的电离是吸热反应,升高温度促进醋酸电离,氢离子浓度增大,所以不符合条件,故A错误;
B.向溶液中加入浓醋酸溶液,氢离子浓度增大,所以不符合条件,故B错误;
C.向溶液中加入少量硫酸,氢离子浓度增大,抑制醋酸电离,所以不符合条件,故C错误;
D.向溶液中加入少量氢氧化钠溶液,氢氧根离子和氢离子反应,所以促进醋酸电离,且氢离子浓度降低,故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离,既要考虑促进醋酸电离又要考虑氢离子浓度降低,根据外界条件对其影响分析解答即可,难度不大.1年前查看全部
- 下列反应的离子方程式正确的是( ) A.向100mL0.1mol/LFeBr 2 溶液中通入0.025mol的Cl 2
下列反应的离子方程式正确的是( ) A.向100mL0.1mol/LFeBr 2 溶液中通入0.025mol的Cl 2 ,充分反应2Fe 2+ +4Br - +3Cl 2 ═2Fe 3+ +2Br 2 +6Cl - B.向Fe(NO 3 ) 3 溶液中加入过量的HI溶液2NO 3 - +8H + +6I - ═3I 2 +2NO↑+4H 2 O C.将碳与足量的浓硫酸共热反应后的气体混合物,通入过量氢氧化钠溶液中CO 2 +SO 2 +4OH - ═SO 3 2- +CO 3 2- +2H 2 O D.将等体积等物质的量浓度的NaHCO 3 溶液与Ba(OH) 2 溶液混合HCO - 3 +Ba 2+ +OH - ═BaCO 3 ↓+H 2 O  fangyang09161年前1
fangyang09161年前1 -
 小牧山 共回答了25个问题
小牧山 共回答了25个问题 |采纳率92%A、FeBr 2 的物质的量为0.01mol,Cl 2 为0.025mol,根据发生的反应:2Fe 2+ Cl 2 ═2Fe 3+ +2Cl - ,2Br - +Cl 2 ═2Cl - +2Br 2 ,可知氯气过量,故反应的离子方程式为:2Fe 2+ +4Br - +3Cl 2 ═2Fe 3+ +2Br 2 +6Cl - ,故A正确;
B、Fe 3+ 离子具有强氧化性,加入过量HI溶液,Fe 3+ 与HI发生氧化还原反应被还原为离子Fe 2+ ,本题不符合反应实际,故B错误;
C、将碳与浓硫酸共热反应方程式为:C+2H 2 SO 4
△
.
CO 2 ↑+2SO 2 ↑+2H 2 O,生成CO 2 和SO 2 气体的物质的量之比为1:2,正确的离子方程式应为CO 2 +2SO 2 +6OH - =2SO 2- 3 +CO 3 2- +3H 2 O,故C错误;
D、等体积等物质的量浓度的NaHCO 3 溶液与Ba(OH) 2 溶液中,NaHCO 3 和Ba(OH) 2 物质的量相等,涉及反应有:
HCO - 3 +OH - =CO 3 2- ↓+H 2 O;CO 3 2- +Ba 2+ =BaCO 3 ↓,总反应为:HCO - 3 +Ba 2+ +OH - =BaCO 3 ↓+H 2 O,故D正确.
故选AD.1年前查看全部
- 有100mL0.1mol/L的FeCl3溶液与50mL0.1mol/L的AgNO3溶液混合后,混合液各离子浓度由大到小的
有100mL0.1mol/L的FeCl3溶液与50mL0.1mol/L的AgNO3溶液混合后,混合液各离子浓度由大到小的顺序是( )
A.[Cl-]>[Fe3+]>[Ag+]>[NO3-]
B.[Cl-]>[Fe3+]>[NO3-]>[Ag+]
C.[Fe3+]>[NO3-]>[Cl-]>[Ag+]
D.[NO3-]>[Fe3+]>[Cl-]>[Ag+] linx54001年前2
linx54001年前2 -
 88林夕凡88 共回答了14个问题
88林夕凡88 共回答了14个问题 |采纳率100%1.FeCl3的物质的量是AgNO3的一倍!
所以无论铁离子如何水解,
浓度都大于银离子,硝酸根离子
2.在AgNO3溶液中,银离子易水解
Ag+ +H2O>=C[Ag+]
3.在 FeCl3溶液中,
由于Fe3+易水解,
所以n(CL-)比N(Fe3+)大三倍以上
故答案为:B.[Cl-]>[Fe3+]>[NO3-]>[Ag+]1年前查看全部
- 中和100mL0.1mol/L 的盐酸与醋酸需0.1mol/L 的NaOH溶液体积分别为多少?
中和100mL0.1mol/L 的盐酸与醋酸需0.1mol/L 的NaOH溶液体积分别为多少?
溶液要中性 在飞萤火1年前4
在飞萤火1年前4 -
 ejwmjgzb 共回答了14个问题
ejwmjgzb 共回答了14个问题 |采纳率92.9%完全反应的话需要100ml.如果要求最终溶液呈中性那就另当别论了1年前查看全部
- 与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A.10mL 1mol/L (NH4)2SO4溶液
B.50mL 0.2mol/L NH4Cl溶液
C.10mL 0.1mol/L(NH4)2SO4溶液
D.200mL 0.1mol/L NH4NO3溶液 李军88881年前1
李军88881年前1 -
 sandy_de 共回答了16个问题
sandy_de 共回答了16个问题 |采纳率93.8%解题思路:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为:c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol•L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol•L-1;
C、10mL0.1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.2mol•L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol•L-1;
故选:BC.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,题目难度不大,注重了基础知识的考查,注意溶液中所含微粒的物质的量浓度与所取溶液的体积大小无关.1年前查看全部
- 在100mL0.1mol/L的NH 4 Cl溶液中,离子浓度大小顺序正确的是: A.c(Cl — )>c(NH 4 +
在100mL0.1mol/L的NH 4 Cl溶液中,离子浓度大小顺序正确的是:
A.c(Cl — )>c(NH 4 + )>c(H + )> c(OH - ) B.c(Cl — )>c(NH 4 + )>c(OH - )>c(H + ) C.c(NH 4 + )>c(Cl — )>c(OH - )>c(H + ) D.c(Cl — )= c(NH 4 + )>c(H + )= c(OH - )  竹缘1年前1
竹缘1年前1 -
 br1002 共回答了17个问题
br1002 共回答了17个问题 |采纳率76.5%A
1年前查看全部
- 标况下,将aL二氧化琉和氯气组成的混合气体通入100mL0.1mol/L的三价的硫酸铁溶液中,充分反应后溶液的棕黄色变浅
标况下,将aL二氧化琉和氯气组成的混合气体通入100mL0.1mol/L的三价的硫酸铁溶液中,充分反应后溶液的棕黄色变浅.向反应后的溶液加入足量的氯化钡溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11、65g.则下列不正确的是()
A.所得沉淀为0、05mol硫酸钡
B.混合气体中二氧化硫体积为0、448L
C.aL混合气体的物质的量为0、04mol
D.a的取值范围是0、672L~0.896L 总是擦肩1年前1
总是擦肩1年前1 -
 jackydfeng 共回答了18个问题
jackydfeng 共回答了18个问题 |采纳率94.4%解题要点:电子得失守恒,考虑反应后元素价态的变化,谁得电子,谁失去电子
注意这句话:充分反应后溶液的棕黄色变浅
说明:
1、硫酸铁被消耗,消耗数值大于0但小于0.01mol.
2、所通入的氯气会最终变为氯离子CL-,所得的电子是从SO2而来
3、SO2会全变为硫酸根,所失去的电子可以从沉淀硫酸钡来计算出
计算步骤:
1、所得沉淀是硫酸钡,注意不是亚硫酸钡,因为硫酸铁没有消耗完,不会存在亚硫酸根.
硫酸钡物质的量=11.65/223=0.05(mol),则硫元素为0.05mol
2、100mL0.1mol/L的三价的硫酸铁溶液含Fe2(SO4)3为0.01mol
则所含硫元素为0.03mol,根据物量守恒可知二氧化硫为0.05-0.03=0.02(mol)
那么二氧化硫体积为0.02*22.4=0.448(L)
3、0.02mol的SO2变硫酸根后所失去电子为0.02*2=0.04(mol)
因为消耗到了硫酸铁,所以混合气体中的氯气(CL2)变成CL-所得到的电子应小于0.04mol,即氯气应该小于0.04/2=0.02mol
那么混合气体应小于0.04mol
4、若0.01mol的Fe2(SO4)3全部反应完,即三价铁都被还原为二价铁,所得到电子为0.02mol.因反应中0.02mol的SO2变硫酸根后所失去电子为0.02*2=0.04(mol),则氯气变成CL-所得到的电子为0.04-0.02=0.02(mol),故氯气为0.02/2=0.01(mol),但实际上Fe2(SO4)3未全部反应完,故0.01mol1年前查看全部
- 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着B
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V
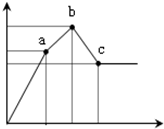 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解NaOH+Al(OH)3=NaAlO2+2H2O,请回答下列问题
(1)写出b-c发生反应的离子方程式:______
(2)下列说法正确的是______
A.a点的溶质为(NH4)2SO4
B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-)
C.b点沉淀为Al(OH)3和BaSO4
D.C点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+)
(3)写出a-b发生反应的离子方程式:______
(4)滴加到c点共加入Ba(OH)2溶液的体积为______mL,b、a两点沉淀的质量差为______g(精确到0.001).(注:要求在答题卡最下面方框内仅列出计算比例式)
 maxxy1年前1
maxxy1年前1 -
 hbycsmile 共回答了19个问题
hbycsmile 共回答了19个问题 |采纳率94.7%100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c).
(1)b-c发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点的溶质为(NH4)2SO4,故A正确;
B、由分析可知,溶液中NH4+完全反应,此时溶液为氨水溶液又电荷守恒可知,b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-),故B正确;
C、由分析可知,b点沉淀为Al(OH)3和BaSO4,故C正确;
D、C点为氨水与偏铝酸钡溶液,0.01molAl(OH)3完全溶解生成0.01molAlO2-,需再加入0.005molBa(OH)2,一水合氨电离很弱,则点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+),故D正确,
故答案为:ABCD;
(3)由上述分析可知,a-b发生离子反应为SO42-+Ba2++NH4++OH-=BaSO4↓+NH3?H2O,
故答案为:SO42-+Ba2++NH4++OH-=BaSO4↓+NH3?H2O;
(4)当SO42-完全沉淀时,共需加入0.02molBa(OH)2,要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,则滴加到c点共加入Ba(OH)2溶液的体积为[0.025mol/0.1mol/L]=0.25L=250mL;
a点到b点,发生沉淀反应为SO42-+Ba2+=BaSO4↓,需要0.005molBa(OH)2,即b、a两点沉淀的质量差为0.005mol×233g/mol=1.165g,
故答案为:250;1.165.1年前查看全部
- 向100mL0.1mol/L的Al3l3溶液8滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应
向100mL0.1mol/L的Al3l3溶液8滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度.
 小菲菲糖1年前1
小菲菲糖1年前1 -
 howe426 共回答了14个问题
howe426 共回答了14个问题 |采纳率92.9%解题思路:根据恰好完全反应得到澄清的溶液,发生AlCl3+4NaOH═NaAlO2+3NaCl+H2O,然后利用n=cV来计算即可.AlCl3的物质的量为个.1L×个.1mol/L=个.个1mol,
由恰好完全反应z到澄清的溶液,设NaOH溶液的物质的量浓度为x,则
AlCl3+vNaOH═NaAlO2+3NaCl+H2O
1 v
个.个1mol 个.8x
[1/v=
个.个1mol
个.8x],解zx=个.个ymol/L,
答:NaOH溶液的物质的量浓度为个.个ymol/L.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查物质的量浓度的计算,明确恰好完全反应发生的化学反应是解答本题的关键,然后将物质的物质的量代入化学反应方程式计算即可解答,难度不大.1年前查看全部
- 2010四川高考化学试题第十题有关①100mL0.1mol/LNaHCO3、②100mL0.1mol/LNa2CO3两种
2010四川高考化学试题第十题
有关①100mL0.1mol/LNaHCO3、②100mL0.1mol/LNa2CO3两种溶液的叙述不正确的是
A.溶液中水电离出的H+个数:②>① B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO32-)>c(H¬2CO3) D.②溶液中:c(HCO3-)>c(H¬2CO3)
A选项如何理解?
谢!
水中电离出的氢离子的确是后者多,水中氢存在于两部分
一部分在水中一部分在碳酸氢根或碳酸中.所以
溶液中水电离的氢离子应该是后者少啊 A200106581年前1
A200106581年前1 -
 ljj5846693 共回答了16个问题
ljj5846693 共回答了16个问题 |采纳率93.8%CO32-是弱电解质,在水中会水解生成碳酸,导致水的电离平衡向右移,即促进水的电离,而①中HCO3-在水中的水解程度小于CO32-,对水的电离平衡影响也较①小,A正确1年前查看全部
- 向100mL0.1mol/L的氢氧化钠溶液中缓慢通入一定量的CO2气体,下列有关反应后的溶液说法错误的是( )
向100mL0.1mol/L的氢氧化钠溶液中缓慢通入一定量的CO2气体,下列有关反应后的溶液说法错误的是( )
A.该溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.该溶液中可能存在:c(H+)+c(H2CO3)=c(OH-)+c(CO32-)
C.向该溶液中滴入少量稀盐酸,一定会产生气泡
D.向该溶液中滴入少量Ca(OH)2溶液,一定会有白色沉淀产生 帕特龙1年前1
帕特龙1年前1 -
 tinn 共回答了15个问题
tinn 共回答了15个问题 |采纳率100%解题思路:A.无论是碳酸钠溶液还是碳酸氢钠,溶液中一定满足电荷守恒,根据电荷守恒进行判断;
B.当氢氧化钠与二氧化碳按照物质的量1:1反应,反应后的溶液为碳酸氢钠溶液,根据碳酸氢钠溶液中电荷守恒和物料守恒进行判断;
C.若二氧化碳不足,反应后的溶液组成为碳酸钠溶液或碳酸钠、氢氧化钠的混合物,则加入盐酸后不会生成气体;
D.碳酸钠、碳酸氢钠都能够与氢氧化钙反应生成碳酸钙沉淀.A.溶液中一定遵循电荷守恒,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A正确;B.氢氧化钠与二氧化碳可以反应生成碳酸氢钠溶液,碳酸氢钠溶液中,根据物料守恒可得:①c(Na+)=c(C...
点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查离子浓度的大小比较,为高考常见题型,侧重于学生分析能力的考查,题目难度中等,注意从电荷守恒和物料守恒的角度分析该题,选项C为易错点,注意分析反应后溶液中溶质的组成情况.1年前查看全部
- 与100mL0.1mol/L(NH4)2SO4溶液中的NH4+浓度相同的溶液是( ).A.0
与100mL0.1mol/L(NH4)2SO4溶液中的NH4+浓度相同的溶液是( ).A.0
与100mL0.1mol/L(NH4)2SO4溶液中的NH4+浓度相同的溶液是( ).A.0.2mol/L的氨水100mL B.0.1mol/L (NH4)3Cl溶液200mL C.0.2mol/L NH4NO3溶液50mL D.0.2mol/L (NH4)3PO4溶液50mL 为什么? dd区1年前2
dd区1年前2 -
 adas16 共回答了18个问题
adas16 共回答了18个问题 |采纳率94.4%计算其中NH4+浓度即可;
原溶液中溶质0.1mol/L,一个溶质分子有2个铵离子,所以铵离子浓度0.2mol/L;
A中为0,不考虑水解的话;
B中NH4Cl只有1个铵离子,是0.1mol/L;
C是1个,但是溶质0.2mol/L,所以是0.2mol/L;
D是0.2*3=0.6mol/L;1年前查看全部
- 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶
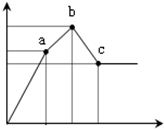 向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
向100mL0.1mol/L硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol/L Ba(OH)2溶液.随着Ba(OH)2溶液体积V(横坐标)的变化,沉淀总物质的量n的变化如图所示,
已知铝盐中滴加过量氨水能产生Al(OH)3沉淀,该沉淀遇强碱如NaOH溶液又可溶解NaOH+Al(OH)3=NaAlO2+2H2O,请回答下列问题
(1)写出b-c发生反应的离子方程式:______
(2)下列说法正确的是______
A.a点的溶质为(NH4)2SO4
B.b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-)
C.b点沉淀为Al(OH)3和BaSO4
D.C点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+)
(3)写出a-b发生反应的离子方程式:______
(4)滴加到c点共加入Ba(OH)2溶液的体积为______mL,b、a两点沉淀的质量差为______g(精确到0.001).(注:要求在答题卡最下面方框内仅列出计算比例式) 一切随凤1年前1
一切随凤1年前1 -
 sz_oct 共回答了11个问题
sz_oct 共回答了11个问题 |采纳率90.9%解题思路:100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3・H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c),以此来解答.100mL 0.1mol•L-1硫酸铝铵[NH4Al(SO4)2],NH4Al(SO4)2物质的量为0.01mol.溶液含有NH4+0.01mol,Al3+0.01mol,SO42-0.02mol.
关键弄清楚反应顺序,开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵(开始到a);
再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3・H2O,所以沉淀质量继续增加;当SO42-完全沉淀时,共需加入0.02molBa(OH)2,加入0.04molOH-,Al3+反应掉0.03molOH-,生成Al(OH)30.01mol,剩余0.01molOH-恰好与NH4+完全反应,此时溶液中NH4+完全反应,此时溶液为氨水溶液(a到b);
继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,此时溶液为氨水与偏铝酸钡溶液(b到c).
(1)b-c发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)A、由分析可知,从开始到a点,发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,a点的溶质为(NH4)2SO4,故A正确;
B、由分析可知,溶液中NH4+完全反应,此时溶液为氨水溶液又电荷守恒可知,b点溶液中一定存在:c(NH4+)+c(H+)=c(OH-),故B正确;
C、由分析可知,b点沉淀为Al(OH)3和BaSO4,故C正确;
D、C点为氨水与偏铝酸钡溶液,0.01molAl(OH)3完全溶解生成0.01molAlO2-,需再加入0.005molBa(OH)2,一水合氨电离很弱,则点溶液中一定存在:c(AlO2-)>c(Ba2+)>c(NH4+),故D正确,
故答案为:ABCD;
(3)由上述分析可知,a-b发生离子反应为SO42-+Ba2++NH4++OH-=BaSO4↓+NH3・H2O,
故答案为:SO42-+Ba2++NH4++OH-=BaSO4↓+NH3・H2O;
(4)当SO42-完全沉淀时,共需加入0.02molBa(OH)2,要使0.01molAl(OH)3完全溶解,需再加入0.005molBa(OH)2,则滴加到c点共加入Ba(OH)2溶液的体积为[0.025mol/0.1mol/L]=0.25L=250mL;
a点到b点,发生沉淀反应为SO42-+Ba2+=BaSO4↓,需要0.005molBa(OH)2,即b、a两点沉淀的质量差为0.005mol×233g/mol=1.165g,
故答案为:250;1.165.点评:
本题考点: 化学方程式的有关计算;离子方程式的有关计算.
考点点评: 本题考查了物质间的反应,明确物质的性质及离子反应先后顺序是解本题关键,明确各个拐点溶液中存在的溶质,注意:NH4+与Al3+同时存在,OH-首先与Al3+反应,而NH4+与Al(OH)3同时存在,OH-首先与NH4+反应,为易错点,题目难度较大.1年前查看全部
- 从100mL0.1mol/L的AICL3溶液中取出50mL,则此时AICL3溶液中CL-的物质的量浓度是
从100mL0.1mol/L的AICL3溶液中取出50mL,则此时AICL3溶液中CL-的物质的量浓度是
A;0.1mol/L B;0.05mol/L C;0.3mol/L D;0.15mol/L
我算出来怎么是0.6mol/L 浪子香城1年前1
浪子香城1年前1 -
 fabe48 共回答了21个问题
fabe48 共回答了21个问题 |采纳率95.2%依旧是0.3mol/L,因为这只是溶液的体积变为原来的一半,它的溶度并没有改变,原来的溶度是0.3,现在依旧是0.3,要想改变它的溶度,可以加入其它溶度的AICL3溶液或蒸发溶液等等方法.
化学重在理解,理解了就很容易.希望能帮到你...1年前查看全部
- 常温下100mL0.1mol/LCH3COOH溶液,pH值为3.向其中加入amL0.1mol/LKOH溶液,回答下列问题
常温下100mL0.1mol/LCH3COOH溶液,pH值为3.向其中加入amL0.1mol/LKOH溶液,回答下列问题:
(1)若实验室用pH值为2的CH3COOH溶液来配制100mL0.1mol/LCH3COOH溶液.则所用CH3COOH溶液的浓度______1mol/L(填“大于”、“等于”或“小于”).所用CH3COOH溶液的体积______10mL(填“大于”、“等于”或“小于”).
(2)混合后充分反应,测得各离子浓度大小顺序为c(K+)>c(CH3COO-)>c(OH-)>c(H+).则所加入1mol/LKOH溶液的体积a为______(填“大于100mL”、“等于100mL”、“小于100mL”或“均可能”).
(3)当混合后溶液pH=7时,溶液中各离子浓度的关系是______.此时,a______100mL(填“大于”、“等于”或“小于”). itopia1年前1
itopia1年前1 -
 没有明天会怎样 共回答了20个问题
没有明天会怎样 共回答了20个问题 |采纳率90%解题思路:(1)CH3COOH是弱电解质,c(CH3COOH)大于其溶液中c(H+);
CH3COOH在稀释过程中c(CH3COOH)减小、n(CH3COOH)不变,据此计算CH3COOH体积;
(2)混合后充分反应,测得各离子浓度大小顺序为:[K+]>[CH3COO-]>[OH-]>[H+],溶液呈碱性,溶液中的溶质可能是CH3COOK、CH3COOK和少量KOH;
(3)当混合后溶液pH=7时,溶液呈中性,再结合电荷守恒判断离子浓度大小; CH3COOK溶液呈碱性,要使 CH3COOH和KOH混合溶液呈中性,则 CH3COOH应该稍微过量.(1)CH3COOH是弱电解质,c(CH3COOH)大于其溶液中c(H+),所以pH=0的醋酸溶液中醋酸浓度大于1mol/L;
CH3COOH在稀释过程中c(CH3COOH)减小、n(CH3COOH)不变,浓醋酸浓度大于1mol/L,则所用CH3COOH溶液的体积小于10mL,
故答案为:大于;小于;
(2)混合后充分反应,测得各离子浓度大小顺序为:[K+]>[CH3COO-]>[OH-]>[H+],溶液呈碱性,溶液中的溶质可能是CH3COOK、CH3COOK和少量KOH或CH3COOK和极少量的CH3COOH,则体积a均有可能,故答案为:均可能;
(3)当混合后溶液pH=7时,溶液呈中性,则[OH-]=[H+],再结合电荷守恒得:[K+]=[CH3COO-],水的电离程度很小,则溶液中离子浓度大小顺序是:[K+]=[CH3COO-]>[OH-]=[H+]; CH3COOK溶液呈碱性,要使 CH3COOH和KOH混合溶液呈中性,则 CH3COOH应该稍微过量,则a小于100mL,
故答案为:[K+]=[CH3COO-]>[OH-]=[H+];小于.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了离子浓度大小比较、pH计算等知识点,根据溶液中酸碱性再结合守恒思想解答,难点是(4)题pH计算,知道Kh、Ka、Kw之间的关系,会使用粗略的计算方法,题目难度中等.1年前查看全部
- 一道关于钠的化学题~将2.3gNa放入100mL0.1mol/L的盐酸中充分反应后共生成标况下氢气的体积为?
 晟民1年前2
晟民1年前2 -
 yunsi123 共回答了19个问题
yunsi123 共回答了19个问题 |采纳率89.5%2Na + 2H2O = 2NaOH + H2↑ 2.3g Xg 2×23 2 46X=4.6 X=0.1g =0.05mol 0.05mol×22.4L/mol=1.12L1年前查看全部
- 有关①100mL0.1mol/LNaHCO3、②100mL0.1mol/LNa2CO3两种溶液
有关①100mL0.1mol/LNaHCO3、②100mL0.1mol/LNa2CO3两种溶液
为什么溶液中阴离子的物质的量浓度之和:②>① xiafq_xj1年前1
xiafq_xj1年前1 -
 空谷足音爱素素 共回答了13个问题
空谷足音爱素素 共回答了13个问题 |采纳率84.6%①中碳酸氢根水解生成碳酸和氢氧根,离子数目不变.②中碳酸根水解生成碳酸氢根和氢氧根,离子数目增加1年前查看全部
- 下列溶液中与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
下列溶液中与100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度相同的是( )
A.10mL1mol/L(NH4)2SO4溶液
B.50mL0.2mol/LNH4Cl溶液
C.10mL0.2mol/L(NH4)2SO4溶液
D.200mL0.1mol/LNH4NO3溶液 sophia17843471年前1
sophia17843471年前1 -
 sying111 共回答了19个问题
sying111 共回答了19个问题 |采纳率94.7%解题思路:根据物质的化学式及物质的物质的量浓度来计算NH4+的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.100mL0.1mol/L(NH4)2SO4溶液中NH4+离子浓度为c(NH4+)=0.2mol/L.
A、10mL1mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=2mol•L-1;
B、50mL0.2mol/LNH4Cl溶液,c(NH4+)=c(NH4Cl)=0.2mol•L-1;
C、10mL0.2mol/L(NH4)2SO4溶液,c(NH4+)=2c[(NH4)2SO4)]=0.4mol•L-1;
D、200mL0.1mol/LNH4NO3溶液,c(NH4+)=c(NH4NO3)=0.1mol•L-1;
故选:B.点评:
本题考点: 物质的量浓度.
考点点评: 本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,所含微粒的物质的量浓度与所取溶液的体积大小无关.1年前查看全部
- 配置100mL0.1mol/L的NaCl溶液 由于天平会多称量0.05g 氯化钠 那会改变其浓度,这怎么办呢?
 雪里蕻20081年前1
雪里蕻20081年前1 -
 52154sg 共回答了16个问题
52154sg 共回答了16个问题 |采纳率93.8%使用分析天平称量NaCl,分析天平精确到0.0001g.1年前查看全部
大家在问
- 1物理 密度推导题有甲乙两种密度分别为P1,P2的两种金属合成一块密度为P,边长为a的正方体 求合金中两金属的质量要过程
- 24分之3×5+4分之3×2+4分之3×3 递等式 还有(11+11分之9)×11 递等式 可以简便计算
- 3化合物C(C6H12)能使溴水褪色能溶于浓H2SO4,催化加氢生成2-甲基戊烷,被KMnO4氧化后生成两种羧酸.C结够
- 4含有比喻的词语就像 快如闪电这样的成语如字要在第二个
- 5有一列数,第一个数X1=1,第二个数X2=4,从第二个数开始,每个数是它相邻两个数和的一半,求X2010
- 6一个底面半径是10米的蓄水池,能蓄水785立方米,如果再挖深3米,这个蓄水池共能蓄水多少立方米?
- 7英语现在完成时for和since的区别,要初中使用最广泛的!
- 8Jim的房间看起来真乱啊!(完成译句)
- 9陌上花开缓缓归 作文
- 10在干燥的空气中用塑料梳子梳理干燥的头发,头发跟着飘动,有时还能听到“啪啪”的响声,解释原因
- 11从A组的备选词语中至少选用两个词语,从B组中至少选用一组关联词,写一段关于建筑物或艺术品的话.A
- 12你所在的考场里空气的质量大约是( )(已知空气的密度是1.29kg/m3)
- 13甲桶油比乙桶油多2千克,从甲桶中取出36千克加入到乙桶这时乙桶油的重量是甲的3倍,原来甲重多少千克
- 14求一道概率题的解法三人独立地去破译一份密码,已知各人能译出的概率分别为1/15、1/3、1/4,问三人中至少有一人能译的
- 15Thank you very much的回答,是OK更恰当,还是Fine更恰当,还是That's all right更恰
