同温,同压下某瓶充满O2 时重116g,充满CO2 时重122g,充满某气体时重114g.A:28 B:60 C:32
 等待萤火虫2022-10-04 11:39:541条回答
等待萤火虫2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 jomyone 共回答了14个问题
jomyone 共回答了14个问题 |采纳率92.9%- D
首先三个相同的瓶子,体积一定是相同的,而又在同温同压下,所以摩尔数相同(貌似是阿弗加德罗定律...)
然后设摩尔数是X
由题意:瓶质量+O2=116
瓶质量+CO2=122
两式相减,可得CO2-O2=6=44X-32X=6
解得X=0.5
再然后就是:瓶质量+O2=116
瓶质量+A=114
同上列式可求得A式量=28 - 1年前
相关推荐
- (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为_____
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为______.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为______.
(2)相同条件下,某Cl2与O2混合气体100mL恰好与150mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为______,混合气体的平均相对分子质量为______. 一身ee1年前1
一身ee1年前1 -
 nanmu1229 共回答了17个问题
nanmu1229 共回答了17个问题 |采纳率100%解题思路:(1)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的物质的量为xmol、O2的物质的量为ymol,根据平均相对分子质量确定x、y关系,据此计算解答;
(2)由于氯气能与氢气化合生成了氯化氢,氧气与氢气化合生成了水,设与氯气的气体为X,则氧气的体积为(100mL-x),根据方程式表示出各自消耗氢气的体积,结合消耗氢气总体积列方程计算,相同条件下体积之比等于物质的量之比,根据
=[m/n]计算平均摩尔质量,进而确定平均相对分子质量..M (1)混合气体的密度是H2的14.5倍,则混合气体平均相对分子质量为14.5×2=29,CO、N2的相对分子质量都是28,可以看作CO、O2的混合气体,令CO、N2的总物质的量为xmol、O2的物质的量为ymol,则28x+32y=29(x+y),整理得x:y=3:1,故氧气的质量分数=[1mol×32g/mol/1mol×32g/mol+3mol×28g/mol]×100%=27.6%;
其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为[1mol×32g/mol+1.5mol×16g/mol/1mol×32g/mol+3mol×28g/mol]×100%=48.3%,
故答案为:27.6%;48.3%;
(2)设氯气的气体为x,氧气的体积为(100mL-x),则:
Cl2+H2
点燃
.
2HCl 2H2 +O2
点燃
.
2H2O
x x 2(100mL-x)(100mL-x)
所以,x+2(100mL-x)=150mL 解得:x=50mL,氧气的体积为100mL-50mL=50mL,所以,混合气体中Cl2和O2的体积之比为50mL:50mL=1:1.假设氯气和氧气各1摩尔,则混合气体的平均摩尔质量为:[71g+32g/2mol]=51.5g/mol,即平均相对分子质量为51.5,
故答案为:1:1;51.5.点评:
本题考点: 元素质量分数的计算;物质的量的相关计算.
考点点评: 本题考查混合物计算,难度不大,注意对基础知识的理解掌握.1年前查看全部
- 两个体积相同的容器,一个盛有NH3,另一个盛有N2和H2,在同温,同压下,两容器内的气体一定具有相同的 ( )
两个体积相同的容器,一个盛有NH3,另一个盛有N2和H2,在同温,同压下,两容器内的气体一定具有相同的 ( )
A、原子总数 B、质子总数 C、分子总数 D、质量 jvhmr1年前5
jvhmr1年前5 -
 hgs1220 共回答了21个问题
hgs1220 共回答了21个问题 |采纳率100%C
同温同压下,气体的体积之比等于气体的摩尔的量之比(因为粒子间的距离近似相等),所以两容器内气体的粒子总数相等,V1/V2=n1/n2
又因为它们是以分子的形式存在的,故选C .
但愿我的答案能对你的解答有所帮助1年前查看全部
- 两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的( )
两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温、同压下,两容器内的气体一定具有相同的( )
A. 电子总数
B. 质子总数
C. 分子总数
D. 质量 airice1年前3
airice1年前3 -
 chexiong1969 共回答了22个问题
chexiong1969 共回答了22个问题 |采纳率100%解题思路:相同条件下,体积相同的两种容器内气体的物质的量相等,分子数相等,根据气体的原子组成作进一步判断.相同条件下,体积相同的两种容器内气体的物质的量相等.
A、N原子核外电子数为7,O原子的核外电子数为8,另一容器中不能确定N2和O2的物质的量的关系,故电子数无法确定,两种容器中的电子数不一定相等,故A错误;
B、N原子质子数为7,O原子的这种时候为8,另一容器中不能确定N2和O2的物质的量的关系,故质子数无法确定,两种容器中的质子数不一定相等,故B错误;
C、相同条件下,体积相同的两种容器内气体的物质的量相等,分子数相等,故C正确;
D、NO的摩尔质量为30g/mol,N2的摩尔质量为28g/mol,O2的摩尔质量为32g/mol,另一容器中不能确定N2和O2的物质的量的关系,无法确定两种容器内气体的质量关系,故D错误.
故选:C.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查阿伏伽德罗定律及其推论,题目难度不大,本题着重于原子结构的考查,注意把握原子的组成.1年前查看全部
- 如图是某同学利用日常用品注射器设计简易实验装置.甲管中注入10mL CH4,同温、同压下乙管中注入50mL
如图是某同学利用日常用品注射器设计简易实验装置.甲管中注入10mL CH4,同温、同压下乙管中注入50mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间.
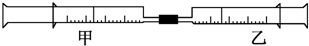
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花.
其中正确的是______.
(2)甲管中发生的化学反应类型为______.
(3)反应后,甲管中剩余气体能用下列试剂吸收的是______.
A.水 B.氢氧化钠溶液C.硝酸银溶液D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到______,若再向其中滴入几滴石蕊试液,又观察到______. beijingdachong1年前1
beijingdachong1年前1 -
 birdym 共回答了21个问题
birdym 共回答了21个问题 |采纳率90.5%解题思路:(1)甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,氯气逐渐减少,但不消失,因为氯气过量,所以氯气的颜色逐渐变浅;反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)出现;反应过程中气体的体积减小,导致试管内的压强低于外界大气压,体积减少;
(2)甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,
(3)根据反应后,甲管中剩余气体为氯气、氯化氢和CH3Cl,可以用碱溶液吸收;
(4)甲管中的氯气、氯化氢溶于水,氯气与水反应生成盐酸和次氯酸,溶液呈酸性,溶液变黄,氯离子能与AgNO3溶液产生氯化银白色沉淀;其余有机物不溶于水,溶液分层.(1)甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,氯气逐渐减少,但不消失,因为氯气过量,所以氯气的颜色逐渐变浅,不会变成无色;反应后有油状液滴(二氯甲烷、三氯甲烷与四氯甲烷)出现;反应过程中气体的体积减小,导致试管内的压强低于外界大气压,体积减少,甲管活塞向内移动,故选:②③;
(2)甲烷与氯气在光照条件下发生取代反应生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,
故答案为:取代反应;
(3)反应后,甲管中剩余气体为氯气、氯化氢和CH3Cl,三者都能与碱反应,可以用氢氧化钠溶液溶液吸收,故选B;
(4)甲管中的氯气、氯化氢溶于水,氯气与水反应生成盐酸和次氯酸,溶液呈酸性,氯离子能与AgNO3溶液产生氯化银白色沉淀;其余有机物不溶于水,溶液分层,所以将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到液体分为两层,产生白色沉淀,溶液变黄;若再向其中滴入几滴石蕊试液,又观察溶液先变红后褪色,
故答案为:液体分为两层,产生白色沉淀,溶液变黄;先变红后褪色.点评:
本题考点: 甲烷的取代反应.
考点点评: 本题考查了甲烷的取代反应,题目难度不大,解答本题要掌握各种物质的性质,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 有同温,同质量的A,B两物体,先将B物体投入一锅热水中,待B与热水同温后,水温降低5摄氏度.立即将B取出,把A投入此锅热
有同温,同质量的A,B两物体,先将B物体投入一锅热水中,待B与热水同温后,水温降低5摄氏度.立即将B取出,把A投入此锅热水中,待A与热水同温时,水温又降低5摄氏度.若不计热量损失,则他们的比热大小是哪个大?
 渐渐变老1年前3
渐渐变老1年前3 -
 vfrmju123 共回答了13个问题
vfrmju123 共回答了13个问题 |采纳率92.3%设初始温度为80,物体温度为20.
B投入水中后,温度变为75,则m水×C水×5=mB×CB×55,得:CB=m水×C水×5/(mB×55)
同样的:m水×C水×5=mA×CA×50,得:CA=m水×C水×5/(mA×50)
可见B的比热小于A的比热.1年前查看全部
- 由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为( )
A.29:8:13
B.22:1:14
C.13:8:29
D.26:16:57 爱上水瓶的双鱼1年前1
爱上水瓶的双鱼1年前1 -
 江津阿剑 共回答了15个问题
江津阿剑 共回答了15个问题 |采纳率80%二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同,
可知混合气体的平均相对分子质量等于氮气的相对分子质量,为28,
而一氧化碳的相对分子质量也为28,则二氧化碳与氢气的平均相对分子质量为28,
设二氧化碳的物质的量为x,氢气的物质的量为y,
则
44x+2y
x+y=28
x:y=13:8,
同温同压下,气体的体积之比等于物质的量之比,
所以,只要满足二氧化碳与氢气的体积之比等于13:8,一氧化碳为任意值都可,
故选CD.1年前查看全部
- 同温.同压下,某瓶充满O2(氧气)时质量为116g,充满CO2时质量为112g,充满A时为114g,则A的相对分子质量为
 数码缘份1年前1
数码缘份1年前1 -
 wusagi22 共回答了20个问题
wusagi22 共回答了20个问题 |采纳率90%因为相同温度相同压强时,同体积的任何气体具有相同的分子数.即物质的量相同.
设空瓶的质量为m则
(116一m)/32==(112一m)/44,
m=算不出,是你的题目错了,应该CO2的质量是122,则m=100g,
设A的相对分子质量为M,
(116一100)/32=(114一100)/M
M=28.
A的相对分子质量是281年前查看全部
- 同温、同压下,相同体积的气体具有相同的分子数.今有氢气和一氧化碳的混合气体VL,当其完全燃烧时,需要同温同压下的氧气0.
同温、同压下,相同体积的气体具有相同的分子数.今有氢气和一氧化碳的混合气体VL,当其完全燃烧时,需要同温同压下的氧气0.5VL,则混合气体中H 2 和CO的体积比是( ) A.1:1 B.1:2 C.1:3 D.不能确定  quily_yang1年前1
quily_yang1年前1 -
 balrog007 共回答了18个问题
balrog007 共回答了18个问题 |采纳率100%根据反应的化学方程式,2CO+O 2
点燃
.
2CO 2 、2H 2 +O 2
点燃
.
2H 2 O,每2个CO分子反应消耗1个氧气分子、每2个H 2 分子反应也消耗1个氧气分子,由同温、同压下,相同体积的气体具有相同的分子数,可知相同体积的氢气与一氧化碳反应消耗氧气的体积相同,即每体积CO或H 2 完全反应都需要消耗0.5体积的氧气,因此混合气体中H 2 和CO的体积比为任意比.
故选D.1年前查看全部
- 同温、同压、同质量下,两种气体的体积之比与其摩尔质量成反比:V1/V2=M2/M1为什么
 woshiyx1年前3
woshiyx1年前3 -
 贝恩堡的5415 共回答了24个问题
贝恩堡的5415 共回答了24个问题 |采纳率95.8%气体的关系式:pV=nRT=mPT/M;p,T,m三者相同,则VM就是常数,即互为反比.1年前查看全部
- 由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同.则该混合气体中二氧化碳、氢气、一氧化碳的体积比为( )
A. 29:8:13
B. 22:1:14
C. 13:8:29
D. 26:16:57 rrrq101年前1
rrrq101年前1 -
 shaoyu797 共回答了21个问题
shaoyu797 共回答了21个问题 |采纳率95.2%解题思路:根据二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同,可知混合气体的平均相对分子质量等于氮气的相对分子质量,为28,而一氧化碳的相对分子质量也为28,则二氧化碳与氢气的平均相对分子质量为28,以此解答该题.二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同,
可知混合气体的平均相对分子质量等于氮气的相对分子质量,为28,
而一氧化碳的相对分子质量也为28,则二氧化碳与氢气的平均相对分子质量为28,
设二氧化碳的物质的量为x,氢气的物质的量为y,
则
44x+2y
x+y=28
x:y=13:8,
同温同压下,气体的体积之比等于物质的量之比,
所以,只要满足二氧化碳与氢气的体积之比等于13:8,一氧化碳为任意值都可,
故选CD.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查混合气体的计算,题目难度不大,本题注意相同条件下,气体的密度之比等于相对分子质量之比.1年前查看全部
- 32.两份铝片,第一份与足量的盐酸反应,第二份与足量的氢氧化钠溶液反应,同温、
 拟态虫子1年前3
拟态虫子1年前3 -
 梦里走tt 共回答了18个问题
梦里走tt 共回答了18个问题 |采纳率66.7%在这两个过程中,关键要看的是电子转移的量,同样是由零价的铝转变为三价的铝,相同质量的铝,转移的电子数目相同,转移的电子全部用于氢离子的还原,都是由相同的正一价的氢转变为零价的氢,所需要的电子数相同,因此,相同的铝片不管与酸反应还是与碱反应,生成的氢气的量都是一样的1年前查看全部
- 同温,同压下,C02,C0,H2混合气体的平均摩尔质量为28g/m0|,求V(C02):V(C0):V(H2)=
 zhuyucheng1年前1
zhuyucheng1年前1 -
 阿岛1 共回答了21个问题
阿岛1 共回答了21个问题 |采纳率95.2%42:任意:161年前查看全部
- 已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应
已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收.同温、同压下NO2与NO的体积比如下,其中不能被NaOH溶液完全吸收的是( )
A.1:1
B.1:3
C.2:l
D.3:1 cherryfoxliying1年前1
cherryfoxliying1年前1 -
 A20011733 共回答了21个问题
A20011733 共回答了21个问题 |采纳率71.4%A、根据NO+NO2+2NaOH=2NaNO2+H2O方程式可知NO2与NO的体积比为1:1,正好被吸收,故A能完全被吸收,故A错;
B、NO2与NO的体积比为1:3,一氧化氮多了,因为NO2与NO的体积比为1:1,正好被吸收,所以多了的一氧化氮又不能被氢氧化钠溶液吸收,所以一氧化氮不能被NaOH溶液完全吸收,故B正确;
C、NO2与NO的体积比为2:1,反应完后二氧化氮有剩余,通过2NO2+2NaOH=NaNO2+NaNO3+H2O反应可知剩余的二氧化氮可以直接被氢氧化钠溶液吸收,故C错;
D、NO2与NO的体积比为3:1,反应完后二氧化氮有剩余,通过2NO2+2NaOH=NaNO2+NaNO3+H2O反应可知剩余的二氧化氮可以直接被氢氧化钠溶液吸收,故D错;
故选B.1年前查看全部
- 为什么"三种气体同温,同密度,气体摩尔质量越大,气体压强越小"呢
为什么"三种气体同温,同密度,气体摩尔质量越大,气体压强越小"呢
与阿伏加德罗定律的推论有关么? 猪猪与亲亲1年前3
猪猪与亲亲1年前3 -
 chris_cxy 共回答了13个问题
chris_cxy 共回答了13个问题 |采纳率100%气体摩尔质量越大.分子的相对分子质量就越大.也就是说.该分子的原子序数越靠后.也就代表着分子体积更大.这点老师上课都有讲到.高中课本也有的.说原子半径那一章.
明白的话就可以明白我下面的话了.假设这些气体都放在密封的瓶子内.单位面积上.分子体积越大的气体.撞击容器壁的数量就越少.所以气体压强就越小.
气体压强是跟单位面积上气体分子撞击数量有关的.物理课上应该会扩展的1年前查看全部
- 已知同温、同压下体积相同的任何气体中含有相同的分子数.工业制HNO3的尾气含NO2和NO,通常用NaOH吸收,能够发生的
已知同温、同压下体积相同的任何气体中含有相同的分子数.工业制HNO3的尾气含NO2和NO,通常用NaOH吸收,能够发生的所有反应方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O.当NO2与NO的体积比为下列值时,不能被完全吸收的是( )
A. 2:1
B. 1:1
C. 1:2
D. 4:1 77368461年前1
77368461年前1 -
 我很PL哦 共回答了15个问题
我很PL哦 共回答了15个问题 |采纳率93.3%解题思路:根据这两个方程式:NO+NO2+2NaOH═2NaNO2+H2O,2NO2+2NaOH═NaNO2+NaNO3+H2O可知NO和NO2的体积比为1:1正好被吸收,再根据第二个方程式可知二氧化氮能直接被氢氧化钠溶液吸收,再进行具体分析.A、NO2与NO的体积比为2:1,反应完后二氧化氮有剩余,通过2NO2+2NaOH═NaNO2+NaNO3+H2O反应可知剩余的二氧化氮可以直接被氢氧化钠溶液吸收,故A错;
B、根据NO+NO2+2NaOH═2NaNO2+H2O方程式可知NO2与NO的体积比为1:1,正好被吸收,故B错;
C、若NO2与NO的体积比为1:2,则一氧化氮过量,而导致一氧化氮不能被完全吸收,故C正确;
D、若NO2和NO的体积比为4:1,反应完后二氧化氮有剩余,通过2NO2+2NaOH═NaNO2+NaNO3+H2O反应可知剩余的二氧化氮可以直接被氢氧化钠溶液吸收,故D错;
故选C.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题关键是要通过分析所给的方程式可知二氧化氮过量可被吸收,一氧化氮过量不能被吸收.1年前查看全部
- 已知2A (g)+B (g)⇌2C(g)△H<0.向同温、同体积的三个密闭容器中分别充入气体(甲)&
已知2A (g)+B (g)⇌2C(g)△H<0.向同温、同体积的三个密闭容器中分别充入气体(甲) 2mol A和1mol B;(乙) 1mol A和0.5molB;(丙) 2mol C:恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A.C的质量 m:m甲=m丙>2m乙
B.容器内压强P:P甲=P丙>2P乙
C.c(A)与c(B)之比k:k甲=k丙>k乙
D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 lctel1年前1
lctel1年前1 -
 移动101 共回答了13个问题
移动101 共回答了13个问题 |采纳率100%解题思路:可逆反应2A(g)+B (g)⇌2C(g)△H<0在恒温恒容条件下,充入气体(甲)2mol A和1mol 达到平衡状态,与加入(丙)2mol C达到平衡状态为等效平衡,各组分的含量、浓度相等;若将乙容器的容积缩小一半,达到平衡时乙与甲、丙为等效平衡,然后将乙的容积恢复到现在的体积,则相当于减小了压强,平衡向着逆向移动,反应物的转化率减小,据此进行分析.在恒温恒容条件下,充入气体(甲)2mol A和1mol 达到平衡状态,与加入(丙)2mol C达到平衡状态为等效平衡,各组分的含量、浓度相等;若将乙容器的容积缩小一半,达到平衡时乙与甲、丙为等效平衡,然后将乙的容积恢复到现在的体积,则相当于减小了压强,平衡向着逆向移动,反应物的转化率减小,
A、由于甲和丙为等效平衡,所以二者中C的质量相等,若C的质量为m;而乙中平衡向着逆向移动,C的质量减小,一定小于2m,即m甲=m丙>2m乙,故正确;
B、甲和丙为等效平衡,反应后总的气体的物质的量相等,所以二者的压强相等;而乙中平衡向着逆向移动,反应后气体的物质的量大于甲和丙的一半,所以压强大于2P,即P甲=P丙<2P乙,故B错误;
C、甲、乙、丙中加入的A、B的物质的量之比为2:1,反应过程中消耗的A、B的物质的量之比为2:1,所以达到平衡时三个容器中c(A)与c(B)之比k:k甲=k丙=k乙,故C错误;
D、由于甲和丙的反应过程不同,反应过程中放出的热量不一定相等,故D错误;
故选A.点评:
本题考点: 等效平衡;化学平衡的影响因素.
考点点评: 考查等效平衡的有关判断,题目难度较大,该题综合性强,对学生的思维能力要求高,不易得分,该题的关键是明确等效平衡的含义以及判断依据,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力.1年前查看全部
- 写出下列各烷烃的分子式.(1)烷烃A在同温、同压下蒸气密度是氢气的36倍______;(2)烷烃B的分子中含有200个氢
写出下列各烷烃的分子式.
(1)烷烃A在同温、同压下蒸气密度是氢气的36倍______;
(2)烷烃B的分子中含有200个氢原子______;
(3)烷烃C的分子中含有210个电子______;
(4)1L烷烃D的蒸气完全燃烧时,生成同温、同压下15L水蒸气______;
(5)1g烷烃E完全燃烧时,消耗标准状况下的O2 2.464L______. rock_13141年前1
rock_13141年前1 -
 泥巴铺子 共回答了16个问题
泥巴铺子 共回答了16个问题 |采纳率87.5%解题思路:(1)根据密度之比等于摩尔质量之比进行计算;
(2)根据烷烃的通式CnH(2n+2)和B的分子中含有200个氢原子计算;
(3)根据烷烃的通式列式计算出含有的电子数,根据烷烃C的分子中含有210个电子计算出通式中的n;
(4)根据同温同压下,体积比等于物质的量之比,再根据氢原子守恒计算出n;
(5)根据写出烷烃燃烧的通式,根据烷烃质量和氧气的物质的量计算出n.烷烃的通式为:CnH(2n+2),烷烃的相对分子量为:14n+2,
(1)密度之比等于摩尔质量之比,就等于相等分子量之比,A的相对分子质量为:36×2=72=14n+2,解得n=5,所以A的分子式为C5H12,
故答案为:C5H12;
(2)烷烃B的分子中含有200个氢原子,即2n+2=200,解得:n=99,所以B的分子式为C99H200,
故答案为:C99H200;
(3)烷烃C的分子中含有210个电子,烷烃的通式为CnH(2n+2),含有的电子数为:6n+2n+2=210,解得:n=26,所以C的分子式为C26H54,
故答案为:C26H54;
(4)1L烷烃D的蒸气完全燃烧时,生成同温、同压下15L水蒸气,根据氢原子守恒,所以烷烃D分子中含30个氢原子,即2n+2=30,n=14,所以D的分子式为C14H30,
故答案为:C14H30;
(5)标准状况下的O2 2.464L物质的量为:[2.464L/22.4L/mol]=0.11mol,
根据反应 CnH2n+2 +[3n+1/2] O2→nCO2+(n+1)H2O,
(12n+2n+2)g [3n+1/2]mol
1 g 0.11 mol
列式为:
3n+1
2mol×1g=(12n+2n+2)×0.11mol,解得n=7,E的分子式为C7H16,
故答案为:C7H16.点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查了有机物烷烃分子式的确定,题目难度中等,要求学生掌握物质的量与摩尔质量转化关系、同温同压下气体的摩尔质量与密度关系,并且能够学会用通式表示烷烃的燃烧反应.1年前查看全部
- 阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
阿伏加德罗曾经总结出一条定律:同温、同压下,同体积的任何气体都含有相同的分子数.右图是电解水的简易装置图.
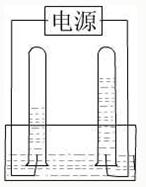
(1)在图的括号中标出电源的正极和负极(用“+”、“-”表示)
(2)与正极相连的试管里产生的是______气;与负极相连的试管中产生的是______气;这两种气体的分子个数比是______.
(3)怎样用实验的方法证明这两种气体.
(4)通过以上实验可说明水由______组成. xueyuzhui1年前1
xueyuzhui1年前1 -
 yuyinghai 共回答了13个问题
yuyinghai 共回答了13个问题 |采纳率69.2%解题思路:熟记电解水的实验现象和结论,气体的验证方法.(1)由正氧负氢,氢二氧一,可知左边为负极,右边为正极;
(2)正极产生的气体体积少为氧气,负极产生的气体体积多为氢气,氧气和氢气分子的个数比为1:2;
(3)证明氧气用带火星的木条,能够复燃即可,证明氢气用燃着的木条,能够燃烧,产生淡蓝色火焰即可;
(4)电解水生成了氢气和氧气,所以说明水是由氢元素和氧元素组成的.
故答案为:(1)左边为负极,右边为正极;
(2)氧气,氢气,1:2;
(3)用带火星的木条,能够复燃是氧气,用燃着的木条,能够燃烧,产生淡蓝色火焰是氢气;
(4)氢元素和氧元素.点评:
本题考点: 电解水实验;水的组成.
考点点评: 熟记正氧负氢,氢二氧一,电解水能够获得的结论.1年前查看全部
- 1L烷烃A的蒸汽完全燃烧时,生成同温、同压下15L水蒸气,求该烷烃的分子式.
 蓝色的鱼缸1年前4
蓝色的鱼缸1年前4 -
 旭曜翌阳 共回答了13个问题
旭曜翌阳 共回答了13个问题 |采纳率100%设烷烃的分子式为CnH(2n+2)
CnH(2n+2)+XO2=nCO2+(n+1)H2O
n+1=15,n=14
所以为C14H301年前查看全部
- 已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO 3 的尾气中含有的NO 2 和NO常用NaOH溶液吸
已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO 3 的尾气中含有的NO 2 和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO 2 +2NaOH=2NaNO 2 +H 2 O,2NO 2 +2NaOH=NaNO 2 +NaNO 3 +H 2 O,NO不能被NaOH溶液吸收.相同条件下NO 2 与NO的体积比如下,其中能被完全吸收的是( ) A.1:2 B.2:1 C.1:3 D.3:1  朝花夕拾791年前1
朝花夕拾791年前1 -
 anruky 共回答了11个问题
anruky 共回答了11个问题 |采纳率100%解析:由题给化学方程式可知,NO 2 和NO同时存在时可与氢氧化钠反应,且反应中两气体分子个数比为1:1,即两气体体积比为1:1;而只有NO时,NO不能被NaOH溶液吸收;又NO 2 可以单独与氢氧化钠溶液反应;所以,只要混合气体中NO 2 的体积大于或等于NO的体积,即可完全吸收;
故选BD.1年前查看全部
- 烷烃结构烃A于含氢量高的烃B属于同系物.在光照的条件下,1体积A最多可于6体积氯气完全反应(同温、同压),烃A的结构简式
烷烃结构
烃A于含氢量高的烃B属于同系物.在光照的条件下,1体积A最多可于6体积氯气完全反应(同温、同压),烃A的结构简式是_______ 为什么? 通途莲花1年前1
通途莲花1年前1 -
 风雨中的眼泪 共回答了22个问题
风雨中的眼泪 共回答了22个问题 |采纳率90.9%高氢含量的烃烃B属于同系物. ---甲烷在光照条件下,在体积为6卷一个完整的氯气反应(相同温度下,在相同的压力下),A是一个简化的____ CH3-CH3___每一个氢原子取代的,需要的烃结构消耗,不能被理解,一个分子中的氯,苯,甲烷是不是由于同系物1年前查看全部
- 在同温、同压条件下,相同体积的氧气和氢气的质量之比为____,密度之比为____,氧气对氢气的相对密度为___
在同温、同压条件下,相同体积的氧气和氢气的质量之比为____,密度之比为____,氧气对氢气的相对密度为___
我算出质量比了 是16:1么 然后密度之比都怎么算啊
那氧气对氢气的相对密度为多少啊 hxc18281年前3
hxc18281年前3 -
 寻找布列松 共回答了18个问题
寻找布列松 共回答了18个问题 |采纳率83.3%也是16:1!
密度为质量除以体积,质量之比为16:1,除以相同体积(16/v :1/v = 16:1),还是16:1.
相对密度为16:1,即16.1年前查看全部
- 在同温 同压时 相同质量的O2 H2 N2三种气体的体积大小 物质的量大小 分子个数多少
 4151216641年前2
4151216641年前2 -
 lf_xiaobailong 共回答了23个问题
lf_xiaobailong 共回答了23个问题 |采纳率95.7%质量相同,相对分子质量越小,物质的量就越大(n=m/M),所以物质的量H2>N2>O2 ,同温同压下,气体体积和分子个数都与物质的量成正比,所以都是 H2>N2>O21年前查看全部
- 在同温、同压、同体积的两个容器,一个装有CH 4 ,另一个装有NH 3 ,两者相同的是( ) A.原子的总数 B.氢原
在同温、同压、同体积的两个容器,一个装有CH 4 ,另一个装有NH 3 ,两者相同的是( ) A.原子的总数 B.氢原子的个数 C.分子个数 D.质量  shuiyuwenjianbin1年前1
shuiyuwenjianbin1年前1 -
 nyjessica 共回答了20个问题
nyjessica 共回答了20个问题 |采纳率95%同温、同压、同体积的两个容器,一个装有CH 4 ,另一个装有NH 3 ,二者的分子数目相同,物质的量相同,
A、CH 4 是5原子分子,分子含有4个H原子,当二者分子数相等时,含有原子总数一定不相等,二者含有原子总数之比为5:4,故A错误;
B、CH 4 分子含有4个H原子,NH 3 是分子含有3个H原子,当二者分子数相等时,H原子数一定不相等,二者H原子数目之比为4:3,故B错误;
C、在同温同压下,相同体积的任何气体含有相同的分子数,故CH 4 与NH 3 分子数相同,故C正确;
D、CH 4 与NH 3 的物质的量相同,二者摩尔质量不同,质量一定不相等,二者之比等于摩尔质量之比为16:17,故D错误;
故选C.1年前查看全部
- 高一化学《物质的量》单元测试题1、同温、同压下决定气体体积的主要因素是 ( )A、气体分子的直径 B、气体物质的量的多少
高一化学《物质的量》单元测试题
1、同温、同压下决定气体体积的主要因素是 ( )
A、气体分子的直径 B、气体物质的量的多少
C、气体分子间的平均距离 D、气体分子的式量.
2、在相同条件下,A容器中的H2和B容器中的NH3所含氢原子数相等,则两个容器的体
( )
A、1:2 B、1:3 C、2:3 D、3:2
3、下列说法正确的是 ( )
A、摩尔是含有6.02×1023个微粒的集体
B、0.012kg12C所含的原子数精确值是6.02×1023
C、1mol H2的体积为22.4L
D、1molH2SO4的质量是98g
4、下列物质中,在标准状况下体积最大的是 ( )
A、28gN2 B、71gCl2 C、48gO2 D、1000gH2O
5、同温同压下,1molHe和1molCl2具有相同的 ( )
A、原子数 B、质子数 C、质量 D、体积
6、下列说法正确的是 ( )
A、2mol的盐酸 B、0.1mol氢 C、0.3molHCl D、4mol的氧元素
7、所含分子数相同的一组物质是 ( )
A、1gH2和1gN2 B、1molH2O和1gH2O
C、3.2gO2和4.8gO3 D、44gCO2和16gO2
8、下列说法正确的是 ( )
A、摩尔表示物质的质量的单位 B、10gHF含有0.5molHF分子
C、2gH2的体积约为22.4L D、物质的摩尔质量等于其式量 210788391年前2
210788391年前2 -
 icelyw 共回答了29个问题
icelyw 共回答了29个问题 |采纳率79.3%(BC),D,D,C,D,C,(CD),B
这是化学…………1年前查看全部
- 5.8g有机物完全燃烧,只生成二氧化碳和水其体积比为一比一【同压同温】
 草阮三少他玛1年前2
草阮三少他玛1年前2 -
 红色奇异果 共回答了17个问题
红色奇异果 共回答了17个问题 |采纳率88.2%最简式:CH21年前查看全部
- 同温,同压下,两种气体的压强比等于物质的量之比,是怎么得出的?
 天街小雾1年前1
天街小雾1年前1 -
 IT靓仔 共回答了14个问题
IT靓仔 共回答了14个问题 |采纳率92.9%1.
描述气体的四个物理量:
----T,P,V,n
2.
气体状态方程
----PV=nRT.(R是常数)
----据上面公式,同T同V时,P1/P2=n1/n2
----据上面公式,同T同P时,V1/V2=n1/n2
----你上面说的关系没有.
3.
据日常生活经验
----同T同P,气体越多(物质的量越多),体积越大.V1/V2=n1/n2
----如吹气球.
----同T同V,气体越多(物质的量越多),压强越大.P1/P2=n1/n2
----如给自行车打气.1年前查看全部
- 已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应
已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收.相同条件下NO2与NO的体积比如下,其中能被完全吸收的是( )
A. 1:2
B. 2:1
C. 1:3
D. 3:1 ljhwww1年前1
ljhwww1年前1 -
 凤凰天天舞 共回答了26个问题
凤凰天天舞 共回答了26个问题 |采纳率84.6%解题思路:根据题中所提供的反应信息,分析一氧化氮与二氧化氮气体被完全吸收所需要满足的条件.解析:由题给化学方程式可知,NO2和NO同时存在时可与氢氧化钠反应,且反应中两气体分子个数比为1:1,即两气体体积比为1:1;而只有NO时,NO不能被NaOH溶液吸收;又NO2可以单独与氢氧化钠溶液反应;所以,只要混合气体中NO2的体积大于或等于NO的体积,即可完全吸收;
故选BD.点评:
本题考点: 常见化学反应中的质量关系.
考点点评: 运用题目所提供的信息分析问题、解决问题,体现了较强的学习能力与知识迁移的能力.1年前查看全部
- 气体判定6、同温、同压下,某瓶充满O2时重116g,充满CO2时重122g,充满某气体时重114g,则某气体可能是 (
气体判定
6、同温、同压下,某瓶充满O2时重116g,充满CO2时重122g,充满某气体
时重114g,则某气体可能是 ( )
A、H2S B、N2 C、HCl D、SO2
21、下图为实验室某浓硫酸酸试剂瓶标签上的有关数据,
试根据标签上的有关数据回答下列问题:
硫酸 化学纯(CP)
(500mL)
分子式:H2SO4
相对分子量:98
密度1.84g/ml
HCl质量分数:98%
(1)该浓硫酸的物质的量浓度为 mol/L.
(2)某学生欲用上述浓硫酸和蒸馏水配制500 ml 物质的量
浓度为1.0 mol•L-1稀硫酸.
①该学生需要量取 ml 上述浓硫酸进行配制.
②容量瓶上需标有以下五项中的
A温度 B浓度 C容量 D压强 E刻度线
③在配制过程中,下列实验操作对所配制的稀硫酸的物质的量浓度有何影响?
(在后面横线上“偏高”、“偏低”、“无影响”).
I、用量筒量取浓硫酸时俯视凹液面
II、定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ、定容时仰视视刻度线 Ⅳ、转移时容量瓶中有少量蒸馏水
14、用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫质量物质的量浓度,其单位为mol/Kg,若5mol/Kg的硫酸溶液的密度为1.3g/mL,则其物质的量浓度为 ( )
A、3.56mol/L B、4.36 mol/L C、5.00 mol/L D、5.25 mol/L
11、 同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3 :2 :1,则三溶液中氯离子的物质的量浓度之比为 ( )
A、3 :4 :3 B、1 :2 :3 C、1 :1 :1 D、6 :3 :2
我要的是过程
我会追加分数的哦
还有一问噢
标准状况下 67.2L NH3溶于32.8L水中则溶液的物质的量浓度为0.03MOLL 错哪了? 排骨年糕11年前1
排骨年糕11年前1 -
 ff之神 共回答了15个问题
ff之神 共回答了15个问题 |采纳率86.7%67.2L NH3溶于32.8L水中则溶液的物质的量浓度为0.03MOLL、都不知道密度、怎么求溶液的体积?溶液的体积可不是溶质的体积加溶剂的体积噢、先算出溶液的质量再除以密度才是溶液的体积、、、
这么多、我慢慢做、等着、会补充答案的、
第一题:要考虑瓶子的重量m、设其中可装n mol气体
m+32n=116
m+44n=122
那么n=0.5
x(某气体式量)* n=14
x=28,是N2
二、应该是硫酸质量分数:98%
c=(1.84g/ml*1000*98%)/(98g/mol)=18.4mol/L
这问不懂就HI我、我来解释物理量的关系
v=[(500 ml /1000)*0.1mol/L] / 18.4mol/l
容量瓶是精密量器、有刻度(容积)和使用温度、选A、C、E
I、俯视凹液面读数变大、量取的硫酸就少了、浓度降低、
II、定容后经振荡、摇匀、静置,发现液面下降是正常的、一些液体粘在塞子、瓶壁上、所以定容后不能加水、加水后浓度降低(溶剂变多)、
Ⅲ、仰视视刻度线读数变小、水加多了、浓度降低
Ⅳ、转移时容量瓶中有少量蒸馏水 没关系、最后加水的总量不变、浓度不变、
14、 1kg水里溶解了5mol硫酸、溶液的体积为(1kg+5mol*98g/mol)/(1.3g/mL)
然后c=5mol / [(1kg+5mol*98g/mol)/(1.3g/mL)]就是物质的量浓度了
11、这道题问的是浓度、就和体积比没关系了(这条件纯属耍人么)、
同物质的量浓度的NaCl、MgCl2、AlCl3、氯离子的物质的量浓度之比就是每种物质带的Cl离子数之比为1:2:3
终于做完了、好了好了、
不明白就Hi我、
最佳答案选我好不好、在做任务、谢谢谢谢、、、1年前查看全部
- 10mL某种气态烃,在50mL O2中充分燃烧,得到液态水和体积为35mL的混合气体(所有气体都是同温、同压下测定),则
10mL某种气态烃,在50mL O2中充分燃烧,得到液态水和体积为35mL的混合气体(所有气体都是同温、同压下测定),则该气态烃可能是?
CH4 C2H6 C3H8 C3H6 lazio19001年前1
lazio19001年前1 -
 mirainana 共回答了18个问题
mirainana 共回答了18个问题 |采纳率77.8%每一ML的CH4充分燃烧 消耗2ML的O2 体积会减少1ML 因为都是生成CO2和H2O 每一个C消耗一个O2 每H4消耗1个O2
每一ML的C2H6消耗 3.5ML的02 体积减少2.5ML
1ML C3H8 消耗5ML的O2 减少3ML
1ML C3H6 消耗4.5ML的O2 减少2.5ML
总共是10ML 减少了 25ML 根据上面的算法
所以应该是 C2H6和C3H61年前查看全部
- 将两份足量铝片分别与等体积的盐酸和氢氧化钠溶液反应,反应完全后生成同温、同压下体积相等的氢气,则盐酸
将两份足量铝片分别与等体积的盐酸和氢氧化钠溶液反应,反应完全后生成同温、同压下体积相等的氢气,则盐酸
和氢氧化钠溶液的物质的量浓度之比为()(可选1个或2个)A.1:1 B.1:3 C.2:3 D3:1 尘儿的老张1年前1
尘儿的老张1年前1 -
 枫叶落在我心上 共回答了18个问题
枫叶落在我心上 共回答了18个问题 |采纳率100%2Al+6HCl=2AlCl3+3H2
2Al+2NaOH+2H2O=2NaAlO2+3H2
由方程式可知,生成同温、同压下体积相等的氢气需氯化氢物质的量是氢氧化钠物质的量的3倍.所以选D3:11年前查看全部
- TIMU ZUOYE在同温,同压下A容器中的氧气和B中的氮气所含的原子个数相同,则a b的气体之比为 A 1;2 B 2
TIMU ZUOYE
在同温,同压下A容器中的氧气和B中的氮气所含的原子个数相同,则a b的气体之比为
A 1;2 B 2;1 C 2;3 D3;2 okpi1年前2
okpi1年前2 -
 bely_bely 共回答了16个问题
bely_bely 共回答了16个问题 |采纳率68.8%要么题目错了,要么答案错了
PV=nRT
同温同压下
V(A):V(B)=n(A):n(B)=1:11年前查看全部
- 黑色牛奶和白色牛奶在同一外界温度下 他们的最高温度都会和外界同温 也就是不存在温度差 为什么黑色温度高
 甩甩甩掉肉1年前1
甩甩甩掉肉1年前1 -
 小_阿呆 共回答了25个问题
小_阿呆 共回答了25个问题 |采纳率96%要你这么说太阳能热水器在外面里面的水是这么热的1年前查看全部
- 已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应
已知同温、同压下相同体积的任何气体都含有相同的分子数.工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,NO不能被NaOH溶液吸收.相同条件下NO2与NO的体积比如下,其中能被完全吸收的是( )
A. 1:2
B. 2:1
C. 1:3
D. 3:1 lpy9981年前1
lpy9981年前1 -
 孤单芭蕾922 共回答了19个问题
孤单芭蕾922 共回答了19个问题 |采纳率89.5%解题思路:根据题中所提供的反应信息,分析一氧化氮与二氧化氮气体被完全吸收所需要满足的条件.解析:由题给化学方程式可知,NO2和NO同时存在时可与氢氧化钠反应,且反应中两气体分子个数比为1:1,即两气体体积比为1:1;而只有NO时,NO不能被NaOH溶液吸收;又NO2可以单独与氢氧化钠溶液反应;所以,只要混合气体中NO2的体积大于或等于NO的体积,即可完全吸收;
故选BD.点评:
本题考点: 常见化学反应中的质量关系.
考点点评: 运用题目所提供的信息分析问题、解决问题,体现了较强的学习能力与知识迁移的能力.1年前查看全部
- 16、有机物A含C、H、O三种元素.为了测定其分子组成,进行如下实验:①在一定温度和压强下将A汽化,其气体质量是同温、同
16、有机物A含C、H、O三种元素.为了测定其分子组成,进行如下实验:①在一定温度和压强下将A汽化,其气体质量是同温、同压下等体积He(He相对原子质量为4)气体质量的38倍;②称取7.6gA,在11.2L氧气中完全燃烧,其产物只有CO2和水蒸气,将反应后的混合气通过浓硫酸后体积为10.64L,浓硫酸质量增加3.6g,再将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减小至6.16 L(气体体积均在标准状况下测定).试回答:
 江城飞雪1年前1
江城飞雪1年前1 -
 tt80 共回答了21个问题
tt80 共回答了21个问题 |采纳率90.5%设此有机物的分子式含 x个碳 y个氢 z个氧
则:
由:
1、“在一定温度和压强下将A汽化,其气体质量是同温、同压下等体积He(He相对原子质量为4)气体质量的38倍”
可以得出此分子的相对原子量为38*4=152
即 12x+y+16z=152
2、“称取7.6gA,”
已经知道此分子的相对原子量 则称取7.6g 换算成摩尔数是:7.6/152=0.05mol
3、“在11.2L氧气中完全燃烧,其产物只有CO2和水蒸气”
说明反应完全
4、“混合气通过浓硫酸,浓硫酸质量增加3.6g”
浓硫酸具有吸水性,则增加的3.6g为反应后产生水的质量 换算为摩尔质量为 3.6/18=0.2mol 但因为水中含有两个氢 则可推出 0.05mol的A中含有0.4mol的氢 即1molA含有0.4/0.05=8个氢 即 y=8
5、“将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减小至6.16 L(气体体积均在标准状况下测定)”
此处又考到一个知识点 因为水被浓硫酸吸附走了 只剩二氧化碳与过氧化钠的反应
2CO2+2Na2O2=2Na2CO3+O2
因为所给的条件都是体积上面的变化 则从上面反应式可以看出 2体积的二氧化碳 产生1体积的O2 体积差是1
“混合气通过浓硫酸后体积为10.64L,再将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减小至6.16 L”
即通过过氧化钠前后的体积差是 10.64-6.16=4.48L
换算成摩尔数则为:4.48/22.4=0.2mol(22.4为体积摩尔换算系数)
则可得出原来CO2的摩尔数为0.2*2=0.4mol(2为反应体积差的二倍,解释见反应式下)则0.05molA含碳0.4mol 则 x=8
6、有上已经得出x=8 y=8
从相对原子量关系式12x+y+16z=152 中可以求出 16z=48 z=3
7、所以A的分子式为 C8H8O3 甲氧基苯甲酸1年前查看全部
- 与二氧化碳密度相同(同温、同压)的烷烃的分子式为?为什么是丙烷.
 dion531年前3
dion531年前3 -
 我想mm察好多年 共回答了26个问题
我想mm察好多年 共回答了26个问题 |采纳率88.5%C3H8;与二氧化碳密度相同(同温、同压)的烷烃的分子式为?即与CO2相对分子质量相同的烷烃的分子式为?CO2相对分子质量为44,C3H8相对分子质量也是44.1年前查看全部
- 同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11 ②密度比为11:16 ③
同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11 ②密度比为11:16 ③体积比为16:11 ④体积比为11:16( )
A.①③
B.①④
C.②③
D.②④ 诚实河南人1年前1
诚实河南人1年前1 -
 里膨 共回答了17个问题
里膨 共回答了17个问题 |采纳率88.2%解题思路:根据质量相同计算出两种物质的物质的量之比,结合阿伏加德罗定律及其推论计算并比较体积、密度关系.同温同压下,气体摩尔体积相同,设两种物质的质量都为1g,则SO2和CO2的物质的量之比=[1/64mol:
1
44mol=11:16,
根据ρ=
M
Vm]知,两种气体的密度之比等于其摩尔质量之比=64g/mol:44g/mol=16:11,根据V=
m
MVm知,相同质量的两种气体,其体积之比等于摩尔质量的反比=44g/mol:64g/mol=11:16,所以①④正确,故选B.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查物质的量的相关计算以及阿伏加德罗定律及其推论的有关知识,题目难度不大,注意有关公式的利用.1年前查看全部
- 已知同温、同压下,相同体积的任何气体,都含有相同数目的分子.在一个密闭容器中盛有H2、O2、Cl2组成的混合气体.通过电
已知同温、同压下,相同体积的任何气体,都含有相同数目的分子.在一个密闭容器中盛有H2、O2、Cl2组成的混合气体.通过电火花引爆后,三种气体恰好完全反应.经充分冷却后,所得溶液中溶质的质量分数为33.4%,则原混合气体中H2、O2、Cl2分子数目简单整数比是(( )
A. 1:1:1
B. 3:2:1
C. 1:2:3
D. 9:4:1 xia00jun1年前1
xia00jun1年前1 -
 星心遐想 共回答了21个问题
星心遐想 共回答了21个问题 |采纳率81%解题思路:由题意可知:氢气在氯气中燃烧生成氯化氢,氢气在氧气中燃烧生成水,所以冷却后得溶液为氯化氢溶液;并根据反应的化学方程式表示的意义,通过各物质的分子数之比和质量比的关系进行解答:而后利用分子个数比=[物质的质量/相对分子质量]之比进行计算.溶液为盐酸,溶质是氯化氢.设取100克溶液,其中含HCl33.4克,则含水66.6克,则氯化氢和水的分子个数比为:33.4g36.5g=14所以液体中HCl分子和水的分子个数比为1:42H2+O2 点燃 . 2H2OH2+Cl2 点...
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题难度比较大,主要考查学生对化学方程式表示的意义的理解,明确分子个数比=[物质的质量/相对分子质量]之比,才能正确解答1年前查看全部
- 由CO2、N2组成的混合气体的密度在同温、同压下是氢气密度的17倍,则该混合气体中二
由CO2、N2组成的混合气体的密度在同温、同压下是氢气密度的17倍,则该混合气体中二
氧化碳、氮气的体积比为
[ ]
A.3∶5
B.3∶7
C.5∶3
D.13∶8 zx56298211年前1
zx56298211年前1 -
 秋天的香椿芽 共回答了14个问题
秋天的香椿芽 共回答了14个问题 |采纳率100%设CO2所占比例为x,则有44x+28(1-x)=34
x=3/8,1-x=5/8.CO2:N2=3:51年前查看全部
- 已知2SO2(g)+O2(g)⇌2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气
已知2SO2(g)+O2(g)⇌2SO3(g);△H=-197kJ•mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲)2mol SO2和1mol O2;(乙)1mol SO2和0.5mol O2;(丙)2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. 平衡常数:K甲=K丙=K乙
D. 反应放出或吸收热量的数值Q:Q甲+Q丙>197kJ 五岭逶迤1年前1
五岭逶迤1年前1 -
 成都男侍应生 共回答了16个问题
成都男侍应生 共回答了16个问题 |采纳率93.8%解题思路:丙容器中2mol SO3折算成反应物为2mol SO2和1mol O2与甲容器相同,所以达到平衡时与甲为等效平衡,乙容器起始量为甲的一半,平衡时压强小于甲,由于该反应的正反应为体积减小的反应,所以乙容器中反应正向进行的程度小于甲,所以乙容器中压强大于甲容器压强的一半,SO3的质量小于甲的一半,平衡常数只受温度影响,与反应起始量无关,由于甲和丙是从相反方向到达的等效平衡,所以它们热量的数值之和应等于反应的反应热,据此答题;丙容器中2mol SO3折算成反应物为2mol SO2和1mol O2与甲容器相同,所以达到平衡时与甲为等效平衡,乙容器起始量为甲的一半,平衡时压强小于甲,由于该反应的正反应为体积减小的反应,所以乙容器中反应正向进行的程度小于甲,所以乙容器中压强大于甲容器压强的一半,SO3的质量小于甲的一半,平衡常数只受温度影响,与反应起始量无关,由于甲和丙是从相反方向到达的等效平衡,所以它们热量的数值之和应等于反应的反应热,所以有:
A、容器内压强P:P甲=P丙<2P乙,故A错误;
B、SO3的质量m:m甲=m丙>2m乙,故B正确;
C、三个容器温度相同,所以对于同一个方程式,平衡常数:K甲=K丙=K乙,故C正确;
D、由于甲和丙是从相反方向到达的等效平衡,所以反应放出或吸收热量的数值Q:Q甲+Q丙=197kJ,故D错误;
故选BC.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题主要考查了等效平衡的思想在平衡体系中的应用,中等难度,解题时要注意运用折算的方法比较三个容器中的起始量.1年前查看全部
- 同温,同压下,将aLCO2气体通过足量的Na2O2后,再将所得气体与bLNO混合得到CL气体.以下分析及其对应的结论中,
同温,同压下,将aLCO2气体通过足量的Na2O2后,再将所得气体与bLNO混合得到CL气体.以下分析及其对应的结论中,错误的是
A,若a〈b,则C〉1/2(a+b) B,若a〈b,则C〈1/2(a+b)
C,若a〉b,则C=1/2(a+b) D,若a=b,则C=1/2(a+b) 我是tufei1年前1
我是tufei1年前1 -
 一盘没有下完的棋 共回答了24个问题
一盘没有下完的棋 共回答了24个问题 |采纳率95.8%方程式:
1.CO2+NA2O2+NO=NA2CO3+NO2
2.2CO2+2NA2O2=2NA2CO3+O2
NO2的量=1/2(CO2+NO) 即C=1/2(A+B)
O2的量=1/2(CO2) C=1/2A
如果A1/2(A+B)
其余就可以解释了.1年前查看全部
- 同温 同压下 ag氢气和bg氦气的体积比为2a:b
同温 同压下 ag氢气和bg氦气的体积比为2a:b
为什么对? lantao_98551年前2
lantao_98551年前2 -
 gbxcnh 共回答了13个问题
gbxcnh 共回答了13个问题 |采纳率92.3%氢气的相对分子质量是2,氦气的相对分子质量是4,那么ag氢气就是a/2摩尔,bg氦气就是b/4摩尔,摩尔比等于体积比,a/2:b/4,所以是2a:1年前查看全部
- 依照“同温、同压、同体积的任何气体所含分子数相同”,下列叙述正确的是( )
依照“同温、同压、同体积的任何气体所含分子数相同”,下列叙述正确的是( )
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的物质的量之比等于密度之比
C.同温同压下两种气体的质量之比等于密度之比
D.同温同体积下两种气体的物质的量之比等于压强之比
为什么呢?
在标准状况下,10gCO和CO2的混合气体的体积为6.72L。
混合气体中CO和CO2的物质的量之比是( )
2:1 B.1:2 C.1:1 3;4
为什么呢?
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比为( )
A.29:8:13 B.22:1:14 C.13:8:29 D.26:16:57
答案给出是C和D,为什么呢? 冷鎽1年前2
冷鎽1年前2 -
 红豆的红 共回答了17个问题
红豆的红 共回答了17个问题 |采纳率94.1%第一道题是根据克拉白龙方程PV=nRT倒出来的,P是压强,V是体积,n是物质的量,T是温度,R是常数=8.314.
当方程中确定了三个变量,第四个变量当然也是确定的了.
补充的第一题,已知标准状态下气体的摩尔体积是22.4mol/L,根据上述的方程,可以知道当P,T确定时,体积与物质的量成正比.则混合气体物质的量满足
(X1+X2)/6.72=1/22.4 整理得 X1+X2=0.3mol
同时,根据两者不同的摩尔质量和总质量,得到另外一个方程
28*X1+44*X2=10
两个方程联立,解方程组 算出X1=0.2 X2=0.1 所以选择A
补充的第二题 根据克拉白龙方程,同温同压下n/V是一个定值,也就是说,当温度压力固定的时候,单位体积所含有的分子数目是固定的.n1/V1=n2/V2
混合气体在该条件下具有与氮气相同的密度,根据密度=质量/体积,m1/V1=m2/V2(可以理解成密度相同时,单位体积气体的质量是相同的)
两个结论综合一下,得出:m1/n1=m2/n2 (说明两种气体具有相同的平均分子量)
设混合气体中各组分物质的量为X1,X2,X3.则其混合后m1=44*X1+2*X2+28*X3
氮气的m2=28*n2
故得到(44*X1+2*X2+28*X3)/(X1+X2+X3)=28 整理得X1/X2=13/8
也就是说混合气体中CO2与H2的物质的量只比为13:8
又由克拉白龙方程,同温同压下体积与物质的量成正比 故C02与H2的体积比也应满足13:8
所以此题选C,D1年前查看全部
- 冷冻能分离盐水中的盐和水吗?另外,为什么盐水的饱和蒸汽压比同温下的水的低就导致了其冰点比水低?“另一个海水淡化的方法是冷
冷冻能分离盐水中的盐和水吗?
另外,为什么盐水的饱和蒸汽压比同温下的水的低就导致了其冰点比水低?
“另一个海水淡化的方法是冷冻法,冷冻海水,使之结冰,在液态淡水变成固态的冰的同时,盐被分离了出去”,为什么会盐不留在冰块里呢? sj9611521年前1
sj9611521年前1 -
 蛙子 共回答了17个问题
蛙子 共回答了17个问题 |采纳率100%另一个海水淡化的方法是冷冻法,冷冻海水,使之结冰,在液态淡水变成固态的冰的同时,盐被分离了出去.1年前查看全部
- 相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下
相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是( )
A. 1:1:2
B. 2:1:3
C. 6:3:2
D. 3:2:1 龚成章1年前1
龚成章1年前1 -
 315640203 共回答了15个问题
315640203 共回答了15个问题 |采纳率93.3%解题思路:首先,写出相关化学方程式2KI+Cl2═2KCl+I2 Na2S+Cl2═2NaCl+S↓ 2FeBr2+3Cl2═2FeCl3+2Br2,求出在相同在Cl2相等的情况下,KI、Na2S、FeBr2的物质的量之比,而三种溶液体积有相等,物质的量浓度之比就等于物质的量之比.首先,写出相关化学方程式2KI+Cl2═2KCl+I2 Na2S+Cl2═2NaCl+S↓ 2FeBr2+3Cl2═2FeCl3+2Br2
2nn n n[2/3]nn
可知在Cl2相等的情况下,KI、Na2S、FeBr2的物质的量之比为2n:n:[2/3]n=6:3:2,在三种溶液体积相等的前提下,物质的量浓度之比就等于物质的量之比.
故选:C.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;化学方程式的有关计算.
考点点评: 本题主要考查有关化学方程式的计算和物质的量的计算,难度较小.1年前查看全部
- 向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0
向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2
 beehmnant1年前2
beehmnant1年前2 -
 lashoot 共回答了20个问题
lashoot 共回答了20个问题 |采纳率90%两个都达到平衡状态时转化率是一样的,
甲的物质的量浓度是乙的二倍1年前查看全部
- (2012•河北模拟)由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关
(2012•河北模拟)由C16O和C18O组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列关系正确的是( )
A.混合气体中C16O和C18O的分子数之比为14:15
B.混合气体中C16O和C18O的物质的量之比为1:1
C.混合气体中C16O和C18O的质量之比为15:14
D.混合气体中C16O和C18O的密度之比为1:1 57个realtree1年前0
57个realtree1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 相同质量、初温的高温的铜和铁,放入水中..等到与水同温(水的温度会上升).哪个放出的热量多
 心宁孤独1年前1
心宁孤独1年前1 -
 devinw 共回答了20个问题
devinw 共回答了20个问题 |采纳率65%比热容的公式Q=cm△t
m,t都相同
铜的比热容是0.39×103J/(kg·℃), 铁的比热容是0.46×103J/(kg·℃)
铁多一点1年前查看全部
- 有H2和O2的混合气体aL,经点火反应后,其体积减小为bL,(反应前后气体体积是在同温,同压下测定,且在100℃以下).
有H2和O2的混合气体aL,经点火反应后,其体积减小为bL,(反应前后气体体积是在同温,同压下测定,且在100℃以下).计算混合气体中H2和O2各多少升?
 曾凡新dd1年前3
曾凡新dd1年前3 -
 cxf66766 共回答了19个问题
cxf66766 共回答了19个问题 |采纳率89.5%两种情况
1:氧气过量,则剩余为氧气
参加反应的气体体积比为2:1
所以H2体积为2(a-b)/3,氧气体积为b+(a-b)/3=(a+2b)/3
2:H2过量,则剩余为H2
因为参加反应的气体体积比为2:1
所以O2体积为(a-b)/3,H2体积为b+2(a-b)/3=(2a+b)/31年前查看全部
大家在问
- 1【(x+4分之1y)的二次方-(x-4分之一y)的二次方】乘以(3x-3分之1y)(3分之1y+3x)(9分之1+9x的
- 2用三菱PLC编写一个四层电梯的梯形图或LD指令:1) 开始时电梯处于任意一层(1,2,3,4),数码管显示楼层号。2)
- 3求函数f(x)=1+3x-x³的极值,
- 4刘翔在09年全运会上的表现,急要,
- 5坏人有坏报的英文怎么写
- 6小华买3千克苹果共用了10.5元钱,买苹果的总价与数量的比值是______,这个比值表示______.
- 7(talk when food is in your mouth)改为否定祈使句
- 8(x^2减2x)减2(X^2减2X)减3 因式分解
- 9Is this a photo of your family?怎么读
- 10下面哪种说法是错误的( ) A.等边三角形一定是锐角三角形 B.等腰三角形一定不是直角三角形 C.钝角三角形中只有一个
- 11定语从句which, that它们所代替的先行词是事物的名词或代词,在从句中可作主语、宾语等,作宾语时可以省略他们作宾语
- 12请问H2和CO在不同催化剂的作用下可以生成草酸吗?急=回答,顺便给下解释
- 13用纸盒烧水,水被烧开而纸不会烧焦,这是为什么?
- 14如何正确的面对挫折和困难或方法?
- 15下列关于光现象的说法中,正确的是( )
