某二元酸H2A的电离方程式是H2A=H+ +HA-,HA-可逆号A2- +H+.Na2A溶液显碱性,理由是
 俺乡就俺上ss2022-10-04 11:39:546条回答
俺乡就俺上ss2022-10-04 11:39:546条回答为什么显碱性?
理由是什么?

已提交,审核后显示!提交回复
共6条回复
 苍凌 共回答了12个问题
苍凌 共回答了12个问题 |采纳率100%- 因为第二步是可逆的电离,所以A2-会发生水A2- +H2O=可逆=HA- +OH-
如果是NaHA,溶液是酸性的,因为HA-会发生电离.HA-=H+ +A2- - 1年前
 okeva 共回答了290个问题
okeva 共回答了290个问题 |采纳率- 第二步电离是可逆的,说明A2-能发生水A2- + H2O =可逆=HA- + OH -,所以显碱性。
- 1年前
 烨兰 共回答了407个问题
烨兰 共回答了407个问题 |采纳率- 根据H2A=H+ +HA-,HA-可逆号A2- +H+判断Na2A是强碱弱酸盐.
强碱弱酸盐水解,溶液呈碱性。 - 1年前
 weng0716 共回答了2个问题
weng0716 共回答了2个问题 |采纳率- 这个很好解释呀,一般这类盐是呈强碱性,此理解方程式可写成H2A+Na2A=2NaHA,一般NaHA是弱碱性的,具体的不太清楚了,高中的化学,时间长了忘的差不多了
- 1年前
 花开的声音_小草 共回答了184个问题
花开的声音_小草 共回答了184个问题 |采纳率- Na2A中A2-会水解,使溶液呈碱性。
A2- + H2O = HA- + OH-(可逆) - 1年前
 gzzqs 共回答了4个问题
gzzqs 共回答了4个问题 |采纳率- 因为电离出的HA-结合了H离子,使得水的电离向生成OH的方向发展
- 1年前
相关推荐
- 一元酸、二元酸、三元酸是怎样划分的?
 lj96121年前3
lj96121年前3 -
 流影无声 共回答了14个问题
流影无声 共回答了14个问题 |采纳率92.9%根据酸分子电离时所能生成的氢离子的个数,可以把酸分为一元酸、二元酸、三元酸等.例如硝酸是一元酸,硫酸是二元酸.1年前查看全部
- 一二元酸是不是有几个H就叫几个元酸
 铁拳王1年前5
铁拳王1年前5 -
 若愚2008 共回答了16个问题
若愚2008 共回答了16个问题 |采纳率93.8%对,如硫酸就是二元酸,盐酸就是一元酸1年前查看全部
- 常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示
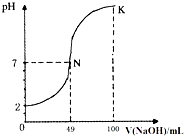 常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol•L-1H2A(二元酸)溶液中逐滴加入0.2mol•L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
A.H2A为二元强酸
B.K点时加水稀释溶液,c(H+)增大
C.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
D.K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) libo104191年前1
libo104191年前1 -
 wfs90 共回答了22个问题
wfs90 共回答了22个问题 |采纳率86.4%解题思路:A、图象分析向100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明H2A为弱酸;
B、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;
C、依据溶液中电荷守恒分析判断离子浓度大小;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较.A、图象分析,100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明氢离子未全部电离,H2A为弱酸,故A错误;
B、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故B正确;
C、依据溶液中电荷,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故C错误;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选B.点评:
本题考点: 中和滴定.
考点点评: 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,图象分析是关键,题目难度中等.1年前查看全部
- 二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-⇌H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-⇌H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
A. NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+)
B. NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
C. Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+)
D. H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-) 下床后分手1年前5
下床后分手1年前5 -
 wenghuochao 共回答了19个问题
wenghuochao 共回答了19个问题 |采纳率100%解题思路:该二元酸第一步完全电离,第二步部分电离,所以溶液中A2-能水解,HA-只能电离不能水解,结合盐类水解来分析解答.A.NaHA溶液中:HA-电离程度大于水解程度,所以溶液呈酸性,则c(H+)>c(OH-),故A错误;
B.NaHA溶液中HA-只能电离不能水解,所以溶液中不存在H2A,故B错误;
C.Na2A溶液中A2-能水解而使溶液中c(OH-)>c(H+),盐溶液中A2-的水解程度较小,所以c(A2-)>c(OH-),钠离子不水解,其浓度最大,所以离子浓度大小顺序是c(Na+)>c(A2-)>c(OH-)>c(H+),故C正确;
D.根据电荷守恒得c(H+)=c(HA-)+2 c(A2-)+c(OH-),故D正确;
故选AB.点评:
本题考点: 离子浓度大小的比较.
考点点评: 本题考查了离子浓度大小的比较,明确该二元酸的电离方式是解本题关键,注意第一步是完全电离,第二步是部分电离,导致HA-只能电离不能水解,为易错点.1年前查看全部
- 单烯和二烯是同系物吗?还有一元酸和二元酸呢?
单烯和二烯是同系物吗?还有一元酸和二元酸呢?
如题,比如丙烯和丙二烯是不是同系物?还有,一元酸和二元酸是不是同系物?
还有,要说明原因 jackyren1年前1
jackyren1年前1 -
 骑御猫逛街的老鼠 共回答了16个问题
骑御猫逛街的老鼠 共回答了16个问题 |采纳率75%单烯和二烯不是同系物,一元酸和二元酸也不是同系物
同系物要求官能团种类相同且个数也相等.1年前查看全部
- 1.一元酸能形成酸式盐吗二元酸能形成几种酸式盐n元酸能形成多少种酸式盐
1.一元酸能形成酸式盐吗二元酸能形成几种酸式盐n元酸能形成多少种酸式盐 2.既然酸式盐可看成酸碱中和时碱不足的产物那么向酸式盐溶液中加碱能发生反应吗 c.碱式盐 .碱式碳酸铜 碱式氯化镁 C.其它类型盐 a.含氧酸盐和无氧酸盐 (填分类依据下同) b.金属盐和铵盐 c.硫酸盐、硝酸盐、磷酸盐.d.钠盐、铜盐、铁盐.e.铁盐和亚铁盐 f.强酸盐和弱酸盐
 宝贝培培1年前2
宝贝培培1年前2 -
 我的名字叫后羿 共回答了16个问题
我的名字叫后羿 共回答了16个问题 |采纳率81.3%一元酸不能形成酸式盐
二元酸能形成一种酸式盐
n元酸能形成n-1种酸式盐
酸式盐溶液中加碱能发生反应
Cu2(OH)2CO3 Mg(OH)Cl
含氧酸盐和无氧酸盐:酸根离子是否含有氧元素
金属盐和铵盐:按阳离子分类
硫酸盐、硝酸盐、磷酸盐.按酸根阴离子分类
钠盐、铜盐、铁盐.按金属阳离子所属元素分类
铁盐和亚铁盐 铁盐(含有铁离子+3价的盐) 亚铁盐(含有亚铁离子+2价的盐)
强酸盐和弱酸盐 按酸根阴离子对应酸的强弱分类1年前查看全部
- 怎样判定酸碱滴定突越点个数?例如,顺丁烯二酸和乙二酸同是二元酸,但在滴定过程中分别有一个和两个突越点.最后,确定突越点个
怎样判定酸碱滴定突越点个数?
例如,顺丁烯二酸和乙二酸同是二元酸,但在滴定过程中分别有一个和两个突越点.最后,确定突越点个数时,与滴定液浓度是否有关? 缘分虫子1年前2
缘分虫子1年前2 -
 amethystime 共回答了17个问题
amethystime 共回答了17个问题 |采纳率94.1%能被滴定产生突越的条件是:cKa>=10^-8
两级电离能被分开滴定的条件是:Ka1/Ka2>10^51年前查看全部
- (2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 N
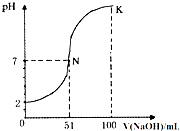 (2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
(2013•安庆三模)常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
A.H2A为二元强酸
B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
C.K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+)
D.K点时加水稀释溶液,c(H+)增大 1983528xmf1年前1
1983528xmf1年前1 -
 positionww 共回答了18个问题
positionww 共回答了18个问题 |采纳率94.4%解题思路:A、图象分析向100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明H2A为弱酸;
B、常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液50ml,恰好反应生成NaHA,溶液呈酸性,所以加入51ml氢氧化钠溶液溶液呈中性,依据溶液中电荷守恒分析判断离子浓度大小;
C、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;A、图象分析,100mL 0.1mol•L-1 H2A(二元酸)溶液PH=2,说明氢离子未全部电离,H2A为弱酸,故A错误;
B、常温下,向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液50ml,恰好反应生成NaHA,溶液呈酸性,所以加入51ml氢氧化钠溶液溶液呈中性,依据溶液中电荷守恒分析判断离子浓度大小,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故B错误;
C、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故C错误;
D、K点对应溶液中向100mL 0.1mol•L-1 H2A(二元酸)溶液中逐滴加入0.2mol•L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,图象分析是关键,题目难度中等.1年前查看全部
- 某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-H++B2
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-H++B2-.
为什么在0.1mol/l的NA2B溶液里只存在一步电离而没有H2B生成. king0342131年前1
king0342131年前1 -
 shaohui_jiao 共回答了15个问题
shaohui_jiao 共回答了15个问题 |采纳率100%因为H2B==H++HB-是全部电离的,HB-离子不能和H+结合生成弱电解质,所以,Na2B只存在B2-水解.HB-离子不能水解,就像Na+、Cl-不能结合氢氧根,氢离子一样.所以在0.1mol/l的NA2B溶液里只存在一步电离而没有H2B生成.1年前查看全部
- 化学中的一元酸 二元酸 含氧酸 无氧酸是什么?
 laoshu60821年前5
laoshu60821年前5 -
 clmk911 共回答了18个问题
clmk911 共回答了18个问题 |采纳率94.4%元 指的是 酸中可电离的H个数
如:HCL是一元 H2CO3是二元 H3PO4是三元
注意 醋酸 CH3COOH 是一元
含氧无氧就是酸中的O原子个数
如HCL是无氧酸 HNO3 H2CO3 H3PO4 是含氧酸1年前查看全部
- 某二元酸(H 2 A)按下式发生电离:H 2 A=H + +HA - ;HA - H + +A 2- 。现有下列四种溶液
某二元酸(H 2 A)按下式发生电离:H 2 A=H + +HA - ;HA -  H + +A 2- 。现有下列四种溶液
H + +A 2- 。现有下列四种溶液
①0.01mol/L的H 2 A溶液
②0.01mol/L的NaHA溶液
③0.02mol/L的HCl溶液与0.04mol/L的NaHA溶液等体积混合
④0.02mol/L的NaOH溶液与0.02mol/L的NaHA溶液等体积混合
下列关于上述四种溶液的说法正确的是[ ]A.溶液②中存在水解平衡:HA - +H 2 O 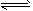 H 2 A+OH -
H 2 A+OH -
B.溶液③中有:c(HA - )+c(A 2- )=c(Na + )
C.溶液④中有:c(OH - )=c(H + ) +c(HA - ) +2c(H 2 A)
D.四种溶液中c(HA - )浓度大小:③>②>①>④ 肉肉和球球1年前1
肉肉和球球1年前1 -
 的老城区显 共回答了20个问题
的老城区显 共回答了20个问题 |采纳率90%B1年前查看全部
- (2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与
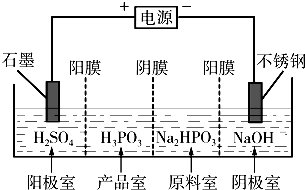 (2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(2013•济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3⇌H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式______.
②某温度下,0.1000mol•L-1的H3PO3溶液pH的读数为1.6,即此时溶液中c (H+)=2.5×10-2mol•L-1,除OH-之外其他离子的浓度由小到大的顺序是______,该温度下H3PO3电离平衡的平衡常数K=______.(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中c(Na+)______ c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”).
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式______.
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图:说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过
①阴极的电极反应式为______.
②产品室中反应的离子方程式为______. 李盛楠1年前1
李盛楠1年前1 -
 zzyzlo2004 共回答了17个问题
zzyzlo2004 共回答了17个问题 |采纳率94.1%解题思路:(1)①亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O;
②根据亚磷酸的浓度和pH知,亚磷酸是二元弱酸,在水溶液里分步电离,且电离程度逐渐减小,据此确定离子浓度大小;
K=
;c(H+).C(H2PO3−) C(H3PO3)
③根据电荷守恒分析;
(2)碘具有强氧化性,亚磷酸具有强还原性,所以碘和亚磷酸发生氧化还原反应生成氢碘酸和磷酸;
(3)①阴极上得电子发生还原反应;
②产品室中HPO32-和氢离子结合 生成亚磷酸.(1)①亚磷酸是二元酸,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O,故答案为:H3PO3+OH-=H2PO3-+H2O;
②0.1000mol•L-1的H3PO3溶液pH的读数为1.6,氢离子浓度小于亚磷酸浓度,所以亚磷酸是二元弱酸,在水中分步电离,且第一步电离程度大于第二步,两步电离中都有氢离子生成,所以氢离子浓度最大,离子浓度大小顺序是c(HPO32-)<c(H2PO3-)<c(H+),
H3PO3 ⇌H++H2PO3-
起始时各物质浓度(mol•L-1)0.1000
反应的各物质的浓度(mol•L-1)2.5×10-2 2.5×10-22.5×10-2
平衡时各物质的浓度(mol•L-1)0.10-2.5×10-2 2.5×10-22.5×10-2K=
c(H+)•c(H2PO3−)
c(H3PO3)=
2.5×10−2×2.5×10−2
0.10−2.5×10−2=8.3×1
0−3 mol•L-1
故答案为:c(HPO32-)<c(H2PO3-)<c(H+),8.3×10-3mol/L;
③溶液呈中性,则C(H+)=C(OH-),溶液呈电中性,则c(Na+)+C(H+)=C(OH-)+c(H2PO3-)+2c(HPO32-),因为C(H+)=C(OH-),所以c(Na+)=c(H2PO3-)+2c(HPO32-),故答案为:=;
(2)碘具有强氧化性,亚磷酸具有强还原性,所以亚磷酸和碘能发生氧化还原反应生成氢碘酸和磷酸,反应方程式为:
H3PO3+I2+H2O=2HI+H3PO4,故答案为:H3PO3+I2+H2O=2HI+H3PO4;
(3)①阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②产品室中HPO32-和氢离子结合生成亚磷酸,反应离子方程式为:HPO32-+2H+=H3PO3,故答案为:HPO32-+2H+=H3PO3.点评:
本题考点: 弱电解质在水溶液中的电离平衡;电解原理.
考点点评: 本题考查弱电解质的电离,知识点较综合,电极反应式的书写、有关平衡常数的计算是高考热点,应重点掌握.1年前查看全部
- 某二元酸(简写为H2A)溶液,按下式发生一级和二级电离:
某二元酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A H++HA- HA- H+ + A2-
已知相同浓度时的电离程度H2A大于 HA-.设有下列四种溶液:
(A)0.01mol/L的H2A溶液 (B)0.01mol/L的NaHA溶液
(C)0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合溶液
(D)0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合溶液
据此,填写下列空白(填代号):
(1)c(H+)最大的是_______,最小的是_________.
(2)c(H2A)最大的是_______,最小的是_________.
(3)c(A2-)最大的是_______,最小的是_________.
请问该怎么判断
希望详细点. love19885271年前3
love19885271年前3 -
 水墨年华LQ 共回答了19个问题
水墨年华LQ 共回答了19个问题 |采纳率94.7%据此,填空(填入代号)
⑴ c(H+)最大的是(A),最小的是(D).
⑵ c(H2A) 最大的是(C),最小的是(D).
⑶ c〔A^(2-)〕最大的是(D),最小的是(A).
先逐项分析,然后比较
1.A中的H+浓度大约在0.01-0.02之间,没有完全电离
B中的H+浓度小于0.01的,原因同A
C中HCl提供的H+浓度是0.01,同时还抑制了NaHA的电离,所以总体的H+浓度是小于0.01的
D中因为发生了中和反应,H+几乎不存在,所以最小
2.解释与(1)一样,
3.D中因为有中和反应,生成的几乎是A^2-,而A中的基本上是H2A分子1年前查看全部
- 草酸是一个二元酸,用它做基准物质标定氢氧化钠溶液的浓度 时,为什么只出现一个突跃?
草酸是一个二元酸,用它做基准物质标定氢氧化钠溶液的浓度 时,为什么只出现一个突跃?
分析化学实验 磷硫混酸的电位滴定 wangping04111年前1
wangping04111年前1 -
 kendall_0479 共回答了21个问题
kendall_0479 共回答了21个问题 |采纳率85.7%额,因为滴定过程中碱过量,草酸的俩氢离子完全反应.
如果你反过来就会有两个突越,用氢氧化钠作基准物质滴定草酸.1年前查看全部
- 三:怎么理解什么是一元酸,二元酸,酸式盐,一元醇(P25)?
三:怎么理解什么是一元酸,二元酸,酸式盐,一元醇(P25)?
P25大家当作它不存在~ 阿弥陀佛561311年前2
阿弥陀佛561311年前2 -
 ww521 共回答了19个问题
ww521 共回答了19个问题 |采纳率100%一元酸:HCl,HF 反正简单看就是有一个H的
二元酸:H2SO4 就是有两个H的,类推三元酸四元酸……
酸式盐,NaHCO3 ,可以理解为就是含有H的盐
一元醇:含有一个-OH 的醇,比如C2H5OH,依此类推二元醇……多元醇1年前查看全部
- 根据酸分子中含有的氢原子数将酸分为一元酸 二元酸.这么说为什么不对?
 千秋万世长乐未央1年前3
千秋万世长乐未央1年前3 -
 min馨 共回答了22个问题
min馨 共回答了22个问题 |采纳率81.8%恩 这是不对的
应该是根据一个酸分子最多可以电离出H+的个数来判断...
比如H3BO3 就是一元酸
H3PO3 就是二元酸1年前查看全部
- 已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA- H++A2-.试回答下列问题:
已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA- H++A2-.试回答下列问题:
⑴NaHA溶液呈________(填"酸"、"碱"或"中")性,理由是___________________. 为什么HA-只电离不水解.?
 834y1年前1
834y1年前1 -
 blueeyes1999 共回答了14个问题
blueeyes1999 共回答了14个问题 |采纳率92.9%显碱性对于盐来说,有“强酸弱碱盐显酸性,强碱弱酸盐显碱性”.
NaHA为弱酸氢式盐,显碱性1年前查看全部
- 将下列性质的番号,填入个小题后面对应的括号中:A.脱水性 B.强酸性 C.二元酸 D.氧化性 E.吸水性
将下列性质的番号,填入个小题后面对应的括号中:A.脱水性 B.强酸性 C.二元酸 D.氧化性 E.吸水性
(1)将胆矾放入装有浓硫酸的干燥器中,过一段时间胆矾变成白色.()
(2)NaOH与H2SO4(硫酸)反应,可生成硫酸钠和硫酸氢钠这两种盐.() 幻影在线1年前3
幻影在线1年前3 -
 yzqy1314 共回答了18个问题
yzqy1314 共回答了18个问题 |采纳率94.4%1.E,浓硫酸从结晶水合物中得到的结晶水是吸水性.
2.BC,与NaOH反应说明具有酸性,生成NaHSO4说明是二元酸.1年前查看全部
- 硫酸的二元酸的性质怎么体现
 aichuanqi1041年前1
aichuanqi1041年前1 -
 青莎 共回答了20个问题
青莎 共回答了20个问题 |采纳率95%与NaOH中和反应,消耗的H2SO4的物质的量为NaOH的一半.而NaOH是一元碱,所以盐酸为二元酸1年前查看全部
- 怎么判断一种酸是几元酸啊,为什么亚磷酸(H3PO3)二元酸?
 香氏雪海1年前8
香氏雪海1年前8 -
 sh7301 共回答了12个问题
sh7301 共回答了12个问题 |采纳率91.7%判断酸是几元酸,不能只看他的化学式
主要看一个这种分子进入水中会电离几个氢离子
如果你在高中阶段,一般的都是有几个H就是几元酸,有几个特殊的,老师会强调,这个硬记住就行
至于有机,主要看官能团 ,主要是酚,羧基.有几个就是几元1年前查看全部
- 是什么决定一元酸\二元酸\三元酸的分类的?
 liyanjin1年前1
liyanjin1年前1 -
 飘过星空的泪 共回答了19个问题
飘过星空的泪 共回答了19个问题 |采纳率78.9%1 常规上是指最多能电离出的氢离子数(看有几个氢离子)
如一元强酸:盐酸,二元强酸:硫酸,三元弱酸:磷酸(可电离出一到三个氢离子,视环境而定)
2 例外的:硼酸(H3BO3)结合一个水电离出的氢氧根,即水解出一个氢离子.所以是一元酸1年前查看全部
- 一元酸 一元碱 二元碱 二元酸 三元酸是什麽呀
 猪喊鸣1年前1
猪喊鸣1年前1 -
 culimuch 共回答了26个问题
culimuch 共回答了26个问题 |采纳率96.2%1元碱就是1mol该碱含有1molOH-,酸也是一样,以此类推.1年前查看全部
- 可能是我2.坐等X、Y、Z是短周期元素的三种常见氧化物.X跟水反应后可生成一种具有还原性的不稳定的二元酸.该酸的化学式是
可能是我2.坐等
X、Y、Z是短周期元素的三种常见氧化物.X跟水反应后可生成一种具有还原性的不稳定的二元酸.该酸的化学式是_____;Y和X的组成元素相同,Y的化学式是____;1molZ在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是____,其中和产物的化学式是____.在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是____________________________. 妖来妖网1年前1
妖来妖网1年前1 -
 万点愁红 共回答了25个问题
万点愁红 共回答了25个问题 |采纳率84%1)H2SO3,
2)SO3,
3)P2O5,
4)Na3PO4,
5)2P+5SO3=5SO2+P2O51年前查看全部
- 某芳烃其分子式为C9H12,以K2Cr2O7和浓H2SO4氧化后可得一种二元酸.将原来的芳烃进行硝化,所得的一元硝基
某芳烃其分子式为C9H12,以K2Cr2O7和浓H2SO4氧化后可得一种二元酸.将原来的芳烃进行硝化,所得的一元硝基
化合物有三种.试推出该芳烃的结构式. 艾露恩的祝福1年前2
艾露恩的祝福1年前2 -
 睛天mm 共回答了18个问题
睛天mm 共回答了18个问题 |采纳率83.3%是间位二甲苯1年前查看全部
- 哪些二元酸第一步完全电离而第二步不完全,
 ourshangrila1年前1
ourshangrila1年前1 -
 蹲墙头侯红杏 共回答了20个问题
蹲墙头侯红杏 共回答了20个问题 |采纳率95%硫酸(最典型),k2=0.01
硒酸
其他都很不常见1年前查看全部
- 高一化学,请问这句话怎么错了? 根据酸电离产生H离子的个数将酸分为一元酸、二元酸等
 我来说一句吧1年前1
我来说一句吧1年前1 -
 我爱胡炯 共回答了14个问题
我爱胡炯 共回答了14个问题 |采纳率85.7%不是电离出的个数1年前查看全部
- 根据酸电离产生H离子的个数将酸分为一元酸、二元酸等 .这句话怎么错了?
 疏影-青儿1年前1
疏影-青儿1年前1 -
 summermemetea 共回答了22个问题
summermemetea 共回答了22个问题 |采纳率86.4%应该说是根据每个分子在水中电离产生氢离子的个数1年前查看全部
- 如果一个溶液中有一种二元酸电离,第一步是完全电离,第二步是部分,已知部分电离平衡常数,那么我在求解这道题时我想列出电离平
如果一个溶液中有一种二元酸电离,第一步是完全电离,第二步是部分,已知部分电离平衡常数,那么我在求解这道题时我想列出电离平衡常数表达式,这时我应该用溶液中的氢离子溶度还是部分电离出的氢离子溶度?
 musicmysoul1年前1
musicmysoul1年前1 -
 心随凝动 共回答了12个问题
心随凝动 共回答了12个问题 |采纳率91.7%当然是溶液中总得电离氢离子浓度1年前查看全部
- 这句话错哪了?根据酸电离产生H离子的个数将酸分为一元酸、二元酸等
 灰色心情lh1年前1
灰色心情lh1年前1 -
 海风细碎 共回答了15个问题
海风细碎 共回答了15个问题 |采纳率93.3%还少了一个条件,是在一个酸分子中1年前查看全部
- 电解质,酸氯气不是电解质也不是非电解质?这句话对吗?为什么?碳酸是一元酸还是二元酸?醋酸是一元酸还是四元酸?为什么
 黑羽竹秋1年前1
黑羽竹秋1年前1 -
 xuyuan324 共回答了15个问题
xuyuan324 共回答了15个问题 |采纳率86.7%你好
呵呵
电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等.凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等.
氯气不是电解质也不是非电解质这句话对的
碳酸主要是根据其一个分子可以电离出的最大氢离子数目来判断 碳酸是二元酸 因为存在盐 碳酸钠
醋酸 是一元羧酸
对于有机物中酸的元是根据-COOH的个数来判断 无机物中的 有氧酸是几元酸的问题是 根据其-OH 结构来判断1年前查看全部
- 二元羧酸是什么是有两个-cooh还是有两个-oh?与二元酸有什么区别吗?
 yaojing5181年前5
yaojing5181年前5 -
 sdtjedna 共回答了18个问题
sdtjedna 共回答了18个问题 |采纳率94.4%含有两个-COOH
二元羧酸 属于二元酸,二元酸 范围更广 ,
二元酸:
无机二元酸:每个分子在水中能够且只能电离出两个氢离子的酸[包括含氧酸和无氧酸,如硫酸 (H2SO4)、亚硫酸(H2SO3)氢硫酸(H2S)、碳酸(H2C03)、偏硅酸(H2Si03)等]
有机二元酸:含有两个羧基的酸[如乙二酸,即草酸(H2C2O4)]1年前查看全部
- 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+ +HA-
某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=H+ +HA-
HA- = H+ +A2-
则在0.1mol/L的Na2A溶液中,下列微粒浓度关系式不合理的是_
A选项是C(A2-)+C(HA-)+C(H2A)=0.1mol/L答案说是不合理的,但我觉得合理的 mantiand1年前1
mantiand1年前1 -
 shirley_0913 共回答了20个问题
shirley_0913 共回答了20个问题 |采纳率80%我个人认为是不合理的.从粒子的守恒原理角度.能有A出现的所有物质的浓度为0.1mol/L
这里它忘了一个Na2A.因为不一定全部电离啊.没人说钠盐一定都可完全电离.
当然我必须补充下高中期间学习确实钠盐没有不全电离的.我想如果按照这个样子的话,这道题你的想法就是正确的了.1年前查看全部
- 化学(离子浓度)二元酸(化学式用H2A表示)在水中的电离方程式是:H2A=等号=H+ + HA- (完全电离)HA-=可
化学(离子浓度)
二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=等号=H+ + HA- (完全电离)
HA-=可逆号=H+ +A2- (不完全电离)
盐溶液Na2A中各离子浓度从大到小的顺序为(并说出理由): 怀念TBL1年前1
怀念TBL1年前1 -
 zhaoyi514 共回答了20个问题
zhaoyi514 共回答了20个问题 |采纳率90%c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
如果不水解,(Na+)=2c(A2-),所以c(Na+)>c(A2-).
现发生水解反应A2- + H2O =可逆= OH- + HA-,而水解过程是微量的,所以c(A2-)>c(OH-).
每生成一个HA-就生成一个OH-,水解前溶液中有少量OH-,所以c(OH-)>c(HA-)
最后一个是不能判断的,一般认为水解产生的HA-多于H+1年前查看全部
- 二元酸和乙二醇,硬酯酸反应后的产物的颜色和色度由什么条件决定
 飞行鱼041年前1
飞行鱼041年前1 -
 菥叶 共回答了23个问题
菥叶 共回答了23个问题 |采纳率91.3%根据时间和温度.具体情况要看是什么二元酸,种类不同时间和温度也不同.给分吧.哈哈.1年前查看全部
- X,Y,Z是短周期的三种常见氧化物,X跟水反应后可生成一种具有还原性的不稳定二元酸,该酸化学式是______.Y和X组成
X,Y,Z是短周期的三种常见氧化物,X跟水反应后可生成一种具有还原性的不稳定二元酸,该酸化学式是______.Y和X组成元素相同,Y的化学式是_____,1molZ在加热时跟水反应的产物需要用6mol的氢氧化物才能完全中和,在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是_____.
麻烦把过程和思路写下,
高二氮族元素部分的题. nihao6361年前4
nihao6361年前4 -
 明珠3122 共回答了15个问题
明珠3122 共回答了15个问题 |采纳率86.7%做元素推断题,最有效的方法:先把短周期的元素全部写出来.然后在看题,读取信息.“X跟水反应后可生成一种具有还原性的不稳定二元酸”推断出 x 是非金属元素.缩小范围,在非金属元素里面验证.结合后面的 y 与x 组成元素相同,很容易得出 x 是 SO3,y 是SO2.“1molZ在加热时跟水反应”和“6mol的氢氧化物” 都是信息点:这个和平时学习习惯很有关了,关键是细致.很容易得出 z 就是P .这种叙述形式的推断 应该是不难的,你要把握住每个信息点,题目不会说废话的,每句话仔细想想,题目做多了会有窍门的.这题不完全是氮族的,应该是一个小小的综合题.而且考试中不太可能单单出某个族的推断,一般是综合的,要把平时的小知识点牢牢记住的,往往突破口就是这些小知识点.
不知道我说了这么多对你有没有帮助.1年前查看全部
- “根据酸分子中含有的H原子个数将酸分为一元酸,二元酸等”这句话难道不对吗,
 yjdream1年前1
yjdream1年前1 -
 鲍三介 共回答了23个问题
鲍三介 共回答了23个问题 |采纳率95.7%不对
如:醋酸CH3COOH是一元酸,但它的一个分子中有4个氢原子
改为:根据酸的每个分子在水溶液中电离出的氢离子的个数将酸分为一元酸,二元酸等1年前查看全部
- 不饱和聚酯树脂配方中二元酸与二元醇摩尔比对分子量有何影响
 13的无片眼镜1年前1
13的无片眼镜1年前1 -
 这年头注册真难 共回答了15个问题
这年头注册真难 共回答了15个问题 |采纳率86.7%理论上1mol二元醇和1mol二元酸反应,二元醇超出二元酸的量越多,分子量越少!但还要看反应的时间,和终点的判断1年前查看全部
- 什么是一元酸,二元酸和多元酸啊?它到底是按原子数量来分还是离子啊?
什么是一元酸,二元酸和多元酸啊?它到底是按原子数量来分还是离子啊?
我怎么区分一种盐到底是正盐还是碱式盐还是酸式盐?中盐就是正盐吗? 玫瑰宁宁1年前6
玫瑰宁宁1年前6 -
 万亩田 共回答了15个问题
万亩田 共回答了15个问题 |采纳率93.3%能提供一个H+的是一元酸,如HNO3,HCl.
有金属阳离子和酸根组呀的化合物是盐,同时有H+或OH-在里面,分别就是酸式盐或碱式盐.1年前查看全部
- 什么叫一元酸?什么叫二元酸?怎么区分?
 栎m1年前2
栎m1年前2 -
 ajie103 共回答了20个问题
ajie103 共回答了20个问题 |采纳率90%并不是几个氢就是几元酸 如原硅酸 H4SiO4是二元酸 硼酸不是电离产生氢离子,而是结合氢氧根使溶液中氢离子浓度大于氢氧根浓度,而使溶液显酸性,类似于盐的水解,硼酸分子只能结合一个氢氧根,所以是一元酸 根据一个酸分子电离的氢离子个数来判断1年前查看全部
- 一元酸和二元酸(强酸)的酸碱中和滴定曲线有区别吗?区别在哪里?
 hsjwar21年前4
hsjwar21年前4 -
 飞树99 共回答了19个问题
飞树99 共回答了19个问题 |采纳率89.5%如果是二元弱酸就有区别,会有两个滴定突跃,强酸两个H离子几乎是一起滴定的,没区别1年前查看全部
- 已知某二元酸H2A溶于水发生如下电离”H2A=H++HA-,HA-可逆号A2-+H+,则酸式盐NaHA溶于水,电离出的离
已知某二元酸H2A溶于水发生如下电离”H2A=H++HA-,HA-可逆号A2-+H+,则酸式盐NaHA溶于水,电离出的离子中,一定不能发生水解的是HA-还是A2-?(答案是HA-,为什么)
 conglongqi1年前1
conglongqi1年前1 -
 此涨彼消 共回答了16个问题
此涨彼消 共回答了16个问题 |采纳率81.3%H2A溶于水发生如下电离H2A=H++HA-,HA-可HA-逆号A2-+H+,由该电离方程式看出此酸是分步电离,为弱酸,因此该酸的酸式盐HA-不能发生水解1年前查看全部
- 二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-⇌H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系正
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-⇌H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系正确的是( )
A. NaHA:c(Na+)>c(HA-)>c(H2A)>c(OH-)>c(H+)
B. NaHA:c(Na+)=c(A2-)+c(HA-)
C. Na2A:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. H2A:c(H+)=c(HA-)+c(A2-)+c(OH-) 妖精薇笑1年前1
妖精薇笑1年前1 -
 满脑子想着离婚 共回答了16个问题
满脑子想着离婚 共回答了16个问题 |采纳率93.8%解题思路:A、依据电离过程可知二元酸是弱酸,HA-离子水解显碱性,电离显酸性;
B、依据溶液中电荷守恒计算分析;
C、依据电离过程可知二元酸是弱酸,A2-水解显碱性;
D、溶液中存在电荷守恒;A、二元酸H2A在水溶液中发生电离:H2A=H++HA-,HA-⇌H++A2-.说明是第二步存在电离平衡,HA-离子存在两种趋势,电离和水解,电离大于水解溶液显酸性,水解大于电离溶液显碱性,故A错误;
B、在NaHA溶液中存在阳离子是Na+、H+,阴离子HA-、A2-、OH-,溶液中存在物料守恒,c(Na+)=c(A2-)+c(HA-)故B正确;
C、在Na2A溶液中A2-离子水解溶液显碱性,A2-+H2O⇌HA-+OH-;HA-+H2O⇌H2A+OH-;溶液中离子浓度一定是:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故C错误;
D、在H2A溶液中阳离子H+,阴离子HA-、A2-、OH-,溶液中存在电荷守恒一定是:c(H+)=c(HA-)+2c(A2-)+c(OH-),故D错误;
故选B.点评:
本题考点: 离子浓度大小的比较;弱电解质在水溶液中的电离平衡;盐类水解的应用.
考点点评: 本题考查了盐类水解的应用,离子浓度大小的比较,溶液中的电荷守恒应用,关键是酸式盐存在的电离和水解程度大小的确定.1年前查看全部
- 某二元酸(化学式用H 2 A表示)在水中的电离方程式是:H 2 A H + +HA - ,HA - H + +A 2-
某二元酸(化学式用H 2 A表示)在水中的电离方程式是:H 2 A  H + +HA - ,HA -
H + +HA - ,HA -  H + +A 2- ,
H + +A 2- ,
回答下列问题:
(1)Na 2 A溶液呈________(填“酸性”、“中性”或“碱性”),理由是:_______________________
(用离子方程式说明) NaHA溶液呈________(填“酸性”、“中性”或“碱性”),理由是:________________________。
(2)已知0.1mol/LNaHA溶液的pH=2,则0.1mol/L的H 2 A溶液中氢离子的物质的量浓度________0.11mol/L(填“<”、“>”或“==”)理由是:______________________________。
(3)0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是:________________________ 32byk1年前1
32byk1年前1 -
 mi258721877 共回答了10个问题
mi258721877 共回答了10个问题 |采纳率90%1年前查看全部
- 化学选修4水溶液某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A=H++HA- HA- =H++A2-已知0
化学选修4水溶液
某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A=H++HA- HA- =H++A2-
已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是 ____ 0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是:
0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是
答案我知道,我只需要详细的解答过程,谢谢~
 爱吃草莓的狸狸1年前1
爱吃草莓的狸狸1年前1 -
 云云aa 共回答了17个问题
云云aa 共回答了17个问题 |采纳率82.4%小于,理由是,已知0.1mol·L-1NaHA溶液的pH=2,0.1mol·LHA-电离约为0.01mol/L-的氢离子,假设一级完全电离,2级电离肯定受抑制,应该是小于。
Na+>HA->H+>A2-,Na+完全电离,浓度就是溶液浓度,HA-存在电离,所以他第二,H+有H2O电离,稍微大于A2-。1年前查看全部
- 问一道高中化学题目3.某二元酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A = H++HA- HA- =(可
问一道高中化学题目
3.某二元酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A = H++HA- HA- =(可逆)H+ + A2- (注意区分氢离子和加号)
测得25℃时0.1 mol·L-1的H2A溶液中c(H+)=0.11 mol·L-1,则该条件下,HA-离子的电离度是( )。
(A)1% (B)9.1% (C)10% (D)20%
 尚vv的巧克力1年前1
尚vv的巧克力1年前1 -
 boxxod 共回答了19个问题
boxxod 共回答了19个问题 |采纳率89.5%电离度——弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。
(C)10%1年前查看全部
- 根据分子中含有的氢原子个数将酸分为一元酸,二元酸等,这句话对吗?为何?
 coolseav1年前3
coolseav1年前3 -
 完蛋了完蛋了 共回答了16个问题
完蛋了完蛋了 共回答了16个问题 |采纳率81.3%不对.如乙酸,有4个氢,但它是一元酸.再如硼酸H3BO3,有3个氢,但它是一元弱酸,它不是电离出氢离子,而是结合OH-,使水中的H+增加.
H3BO3+H2OB(OH)4- + H+1年前查看全部
- 某二元酸H2A的电离方程式是H2A=H+ +HA-,HA-可逆号A2- +H+.Na2A溶液显碱性,理由是
某二元酸H2A的电离方程式是H2A=H+ +HA-,HA-可逆号A2- +H+.Na2A溶液显碱性,理由是
为什么显碱性?
理由是什么? xu6f1年前6
xu6f1年前6 -
 小瘪三闯xx 共回答了18个问题
小瘪三闯xx 共回答了18个问题 |采纳率88.9%因为第二步是可逆的电离,所以A2-会发生水A2- +H2O=可逆=HA- +OH-
如果是NaHA,溶液是酸性的,因为HA-会发生电离.HA-=H+ +A2-1年前查看全部
- 是不是含有两个H原子的酸就是二元酸
是不是含有两个H原子的酸就是二元酸
可不可以举出一个含有两个H原子但又不是二元酸的酸? cc完了1年前4
cc完了1年前4 -
 chenzhang_wang 共回答了19个问题
chenzhang_wang 共回答了19个问题 |采纳率89.5%对于无机酸可以这样认为.但对于有机酸是不可以的.
有机酸称为羧酸(RCOOH),官能团:-COOH,又称为羧基,只有羧基中的氢可以电离出来,成为为氢离子.所以根据羧基的数目分为一元酸、二元酸与多元酸.
所有的有机酸中的氢原子的数目都大于2个,不一一例举.1年前查看全部
- 强酸 弱酸 一元酸 二元酸 等导电能力由强到弱顺序是怎样的?
 wtt2011年前1
wtt2011年前1 -
 阳光无风 共回答了17个问题
阳光无风 共回答了17个问题 |采纳率94.1%其导电能力由电离电子决定,电离粒子越多,导电性越好,所以强酸大于弱酸,二元酸大于一元酸1年前查看全部
大家在问
- 1汉译英:当我回家的时候,你正在干什么?(过去进行时)
- 2课时优化答案谁有
- 3This is my brother.把句子变成复数形式
- 4英语翻译是论文的摘要,请帮我翻译成英语.不一定100%符合原话,能达到大意,语法没什么错误就行.其中余额宝的英语是Yu'
- 5(x+5y)²-(2x+10y)(3x-y)+(3x-y)²
- 6英语怎么变句型英语怎么 疑问句 否定句 反问句 对画线部分提问 还有那些单词变复数特殊(四年级下) 单三形式 原形 否定
- 7与集合二次不等式有关A={x|-2
- 8下面是某研究性学习小组对氢氧化钠有关性质进行探究的过程,请回答下列问题.
- 9打开汽水瓶盖为什么有气泡冒出有关溶解度
- 10人体通过神经系统对刺激做出有规律的反应叫?
- 11树上有鸽若干,如果地上鸽子飞上树4只,则树上鸽子树是地上鸽子数的3倍;如果树上鸽子下地4只,则树上鸽子数是地上鸽子数的2
- 12什么物质没有中心体什么样的物质 或细胞结构中没有中心体、细胞壁、叶绿体、线粒体?(不是说都没有)哪些植物是高等植物,哪些
- 131到4这四个数字如果4个数字为一组可以排列多少组
- 14小苏从家中骑自行车到火车站接朋友,如果每小时骑行12千米,那么可以比火车到站时间提前10分钟到达,如果每小时骑行9千米,
- 15请问 三角形 和 角 的符号怎么打?

