水处理剂-硫酸铝是危险品吗
 feng_bo2022-10-04 11:39:541条回答
feng_bo2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 mmm808 共回答了14个问题
mmm808 共回答了14个问题 |采纳率100%- 不属于危险品.
但:对眼睛、粘膜有一定的刺激作用.误服大量硫酸铝对口腔和胃产生刺激作用.本品不燃,只具刺激性. - 1年前
相关推荐
- 高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其
高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其生产工艺如下: 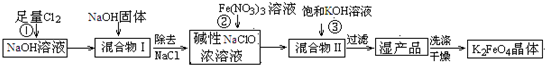
主要反应为:3NaClO+2Fe(NO 3 ) 3 +10NaOH=2Na 2 FeO 4 ↓+3NaCl+6NaNO 3 +5H 2 ONa 2 FeO 4 +2KOH=K 2 FeO 4 +2NaOH.
(1)写出反应①的离子方程式: .
(2)从“混合物II”中分离出K 2 FeO 4 后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 .
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO 3 ) 3 不同质量浓度对K 2 FeO 4 生成率的影响;图Ⅱ为一定温度下,Fe(NO 3 ) 3 质量浓度最佳时,NaClO浓度对K 2 FeO 4 生成率的影响.
根据图分析:工业生产中最佳温度为 ℃,此时Fe(NO 3 ) 3 与NaClO两种溶液最佳质量浓度之比为 .
(4)K 2 FeO 4 在水溶液中易水4FeO 4 2- +10H 2 O
4Fe(OH) 3 +8OH - +3O 2 ↑.在提纯K 2 FeO 4 时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号).
A.H 2 OB.CH 3 COONa、异丙醇C.NH 4 Cl、异丙醇D.Fe(NO 3 ) 3 、异丙醇
(5)将适量K 2 FeO 4 溶解于pH=4.74的溶液中,配制成c(FeO 4 2- )=1.0mmol?L -1 的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO 4 2- )的变化,结果见图Ⅲ.该实验的目的是 .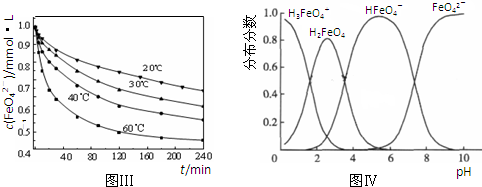
(6)FeO 4 2- 在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是 (填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO 4 - 的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO 4 - +OH - =FeO 4 2- +H 2 O. yeahlum1年前1
yeahlum1年前1 -
 科幻世界 共回答了19个问题
科幻世界 共回答了19个问题 |采纳率100%/1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种新型、高效的多功能水处理剂.干燥
高铁酸钾(K 2 FeO 4 )是紫色光泽的微细结晶粉末,它的氧化性超过高锰酸钾,是一种新型、高效的多功能水处理剂.干燥的高铁酸钾在198摄氏度以下是稳定的,受热易分解为金属氧化物和氧气.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是;______
(2)高铁酸钾的化学性质是;______
(3)高铁酸钾中铁元素的化合价______;保存高铁酸钾时应注意______
(4)完成高铁酸钾与水反应的化学方程式:
4K 2 FeO 4 +10H 2 O═4Fe(OH) 3 +8KOH+3______↑. ericmarco1年前1
ericmarco1年前1 -
 catbb 共回答了10个问题
catbb 共回答了10个问题 |采纳率90%(1)高铁酸钾是紫色光泽的微细结晶粉末,不需要通过化学变化表现出来,属于物理性质;
(2)高铁酸钾受热易分解为金属氧化物和氧气,有新物质生成,属于化学性质.
(3)在K 2 FeO 4 中,由于钾显+1价、氧显-2价,所以,高铁酸钾中铁元素的化合价+6.由于干燥的高铁酸钾在198摄氏度以下是稳定的,受热易分解为金属氧化物和氧气.所以,在保存高铁酸钾时应注意干燥、低温;
(4)由反应的化学方程式可以知道,反应前有8个钾原子,4个铁原子,20个氢原子,26个氧原子,反应后有8个钾原子,4个铁原子,20个氢原子,30个氧原子,由质量守恒定律可知,生成的气体为氧气,且分子个数为3,所以空白处应填:O 2 ;
故答为:(1)紫色结晶粉末;(2)受热易分解为金属氧化物和氧气;(3)+6,干燥、低温;(4)O 2 .1年前查看全部
- (2009•徐州模拟)我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如下图所示.下列说法正确的是( )
(2009•徐州模拟)我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如下图所示.下列说法正确的是( )
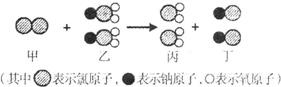
A.乙中氯元素的化合价为+3价
B.丙物质中的微粒是不运动的
C.该反应不符合质量守恒定律
D.该反应的化学方程式为2Cl+NaClO2═2ClO2+2NaCl PZQ1261年前1
PZQ1261年前1 -
 tianditian 共回答了19个问题
tianditian 共回答了19个问题 |采纳率84.2%解题思路:A、根据物质的分子构成,判断物质的化学式;利用化合物中元素的化合价的代数和为零,计算出要求元素的化合价;
B、构成物质的粒子都在不断运动;
C、反应前后,原子的种类和个数不变是物质符合质量守恒定律的原因;根据反应的微观示意图,判断反应前后原子的变化情况;
D、根据反应中各种物质的分子构成及参加反应的分数个数,完成反应的化学方程式的书写.A、物质乙的分子由1个钠原子、1个氯原子和2个氧原子构成,则乙物质的化学式为NaClO2;设其中氯元素的化合价为x,则有(+1)+x+(-2)×2=0,解得x=+3;故A正确;B、任何构成物质的粒子都在不断运动;故B不正确;C、...
点评:
本题考点: 微粒观点及模型图的应用;质量守恒定律及其应用.
考点点评: 分子结构模型可以反映出物质的分子的构成,利用分子的构成可判断物质的类别及化学式;不同种原子构成的物质为化合物分子,同种原子构成的分子为单质分子.1年前查看全部
- (2007•包头)高铁酸钾(K2Fe04)是一种高效的多功能水处理剂.它与水反应的化学方程式为:4K2Fe04+10H2
(2007•包头)高铁酸钾(K2Fe04)是一种高效的多功能水处理剂.它与水反应的化学方程式为:4K2Fe04+10H20═4Fe(OH)3↓+8X+302↑,则X的化学式为( )
A.K20
B.Fe203
C.KOH
D.Fe(OH)2 为畅1年前1
为畅1年前1 -
 唐少爷的剑 共回答了10个问题
唐少爷的剑 共回答了10个问题 |采纳率100%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.根据反应的化学方程式4K2Fe04+10H20═4Fe(OH)3↓+8X+302↑,反应物中钾、铁、氧、氢原子个数分别为8、4、26、20,反应后的生成物中钾、铁、氧、氢原子个数分别为0、4、18、12,根据反应前后原子种类、数目不变,则8X中含有8个钾原子、8个氧原子、8个氢原子,则每个X分子由1个钾原子、1个氧原子、1个氢原子构成,则物质X的化学式为KOH.
故选C.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 二氧化氯(ClO 2 )是一种安全高效的水处理剂,与Cl 2 相比,ClO 2 具有更显著的杀菌能力,且不会产生对人体有
二氧化氯(ClO 2 )是一种安全高效的水处理剂,与Cl 2 相比,ClO 2 具有更显著的杀菌能力,且不会产生对人体有害的有机氯代物。工业上常用Cl 2 与物质x制取ClO 2 ,化学反应如下:
Cl 2 +2X ="=" 2 NaCl + 2ClO 2 。有关说法正确的是()A.物质X的化学式为NaClO 2 B.物质X中氯元素显+1价 C.物质X的化学式为NaClO 3 D.物质X属于氧化物  zh456661年前1
zh456661年前1 -
 KERENYIN 共回答了20个问题
KERENYIN 共回答了20个问题 |采纳率95%A
1年前查看全部
- (2009•茂名一模)顺丁烯二酸二甲酯是一种重要的有机化工原料,广泛应用于涂料,油漆,杀虫剂尤其是在水处理剂等方面.下面
(2009•茂名一模)顺丁烯二酸二甲酯是一种重要的有机化工原料,广泛应用于涂料,油漆,杀虫剂尤其是在水处理剂等方面.下面是利用石油产品M合成顺丁烯二酸二甲酯的部分过程

(1)已知烃M的相对分子质量为78,分子内含碳量为92.3%,所有C-H键和碳碳键类型相同,化合物M的化学式为______.
(2)中间产物A含有的官能团为______(填名称)
(3)在上述生产的产品中得到是顺丁烯二酸二甲酯粗品(纯度≤90%),检验纯净的顺丁烯二酸二甲酯和粗产品的方法.______
(4)写出由中间产物A合成顺丁烯二酸二甲酯的方程式______.
(5)顺丁烯二酸二甲酯在一定条件下可形成一种高分子化合物.写出反应的化学方程式:______. 登录难难于上青天1年前1
登录难难于上青天1年前1 -
 井Mickey 共回答了23个问题
井Mickey 共回答了23个问题 |采纳率87%解题思路:(1)分子内含碳量为92.3%,含H为7.7%,则C、H原子个数比为[92.3%/12]:[7.7%/1]=1:1,烃M的相对分子质量为78,则设烃为(CH)x,13x=78,则x=6,烃为C6H6;
(2)A含C=C、-COOH、-COOC-;
(3)顺丁烯二酸二甲酯含碳碳双键和酯基,粗产品混有A,A含-COOH,利用羧酸的性质检验;
(4)中间产物A合成顺丁烯二酸二甲酯,与甲醇发生酯化反应;
(5)顺丁烯二酸二甲酯在一定条件下可形成一种高分子化合物,发生碳碳双键的加聚反应.(1)(1)分子内含碳量为92.3%,含H为7.7%,则C、H原子个数比为[92.3%/12]:[7.7%/1]=1:1,烃M的相对分子质量为78,则设烃为(CH)x,13x=78,则x=6,烃为C6H6,所有C-H键和碳碳键类型相同,该物质为苯,故答案为:C6H6;
(2)A含C=C、-COOH、-COOC,名称分别为碳碳双键、羧基、酯基,故答案为:碳碳双键、羧基、酯基;
(3)顺丁烯二酸二甲酯含碳碳双键和酯基,粗产品混有A,A含-COOH,检验方法为分别取少量粗品和纯品于试管,分别加入碳酸氢钠溶液,若试管中有气泡产生,则原试
剂为粗品,故答案为:取少量粗品和纯品于试管,分别加入碳酸氢钠溶液,若试管中有气泡产生,则原试剂为粗品;
(4)中间产物A合成顺丁烯二酸二甲酯,与甲醇发生酯化反应,该反应为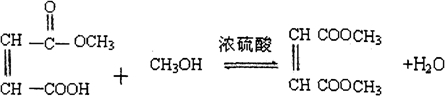 ,
,
故答案为: ;
;
(5)顺丁烯二酸二甲酯在一定条件下可形成一种高分子化合物,发生碳碳双键的加聚反应,该反应为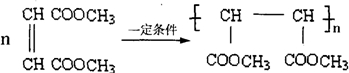 ,
,
故答案为: .
.点评:
本题考点: 有机物的合成;有机物的结构和性质;有机化学反应的综合应用.
考点点评: 本题考查有机物的合成,为高考常见题型,把握有机物的官能团及性质为解答的关键,注意合成路线中物质的结构及发生的有机化学反应,题目难度中等.1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2氧化性更强,且没有二次污染.高铁酸钾与
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2氧化性更强,且没有二次污染.高铁酸钾与水反应的化学方程式是:4K2FeO4+10H2O=4X↓+8KOH+3O2↑.以下有关高铁酸钾的说法正确的是( )
A.高铁酸钾属于氧化物
B.高铁酸钾应密封、防水保存
C.高铁酸钾中铁显+3价
D.X的化学式是Fe(OH)2 arrowfisher1年前1
arrowfisher1年前1 -
 zyx9988 共回答了22个问题
zyx9988 共回答了22个问题 |采纳率95.5%解题思路:根据高铁酸钾的组成和性质来分析物质的类别及物质的保存,利用高铁酸钾的化学式及化学方程式来分析元素的化合价及物质的化学式.A、高铁酸钾是K、Fe、O三种元素组成的,而氧化物中只有两种元素组成,则高铁酸钾不属于氧化物,故A错误;
B、因高铁酸钾与水反应,则高铁酸钾应密封、防水保存,故B正确;
C、高铁酸钾中K元素的化合价为+1价,O元素的化合价为-2价,根据化合物中正负化合价的代数和为零,则铁元素的化合价为+6价,故C错误;
D、由化学方程式4K2FeO4+10H2O=4X↓+8KOH+3O2↑,根据质量守恒定律可知X的化学式为Fe(OH)3,故D错误;
故选B.点评:
本题考点: 有关化学式的计算和推断;空气中常见酸碱盐的质量或性质变化及贮存法;从组成上识别氧化物;有关元素化合价的计算;质量守恒定律及其应用.
考点点评: 本题考查的知识点较多,学生应能利用化学式判断物质的类别、保存及物质中元素的化合价,能根据化学方程式和质量守恒定律来推断物质的化学式.1年前查看全部
- X是一种消毒杀菌效率高、污染小的水处理剂.制备原理为:2KClO 3 +4HCl(浓)=2KCl+2X+Cl 2 ↑+2
X是一种消毒杀菌效率高、污染小的水处理剂.制备原理为:2KClO 3 +4HCl(浓)=2KCl+2X+Cl 2 ↑+2H 2 O
试根据质量守恒定律推断X的化学式为( )
A.HClO 3
B.HClO
C.Cl 2 O 5
D.ClO 2 ll7478161年前1
ll7478161年前1 -
 忧郁好2 共回答了19个问题
忧郁好2 共回答了19个问题 |采纳率84.2%根据质量守恒定律和化学方程式可知,X的化学式中应含有K的个数为:(2-2)÷2=0,含有Cl的个数为:(2+4-2-2)÷2=1,含有O的个数为:(2×3-2)÷2=2,含有H的个数为:(4-2×2)÷2=0;故可推断X的化学式为:ClO 2 .
故选D.1年前查看全部
- (2006•太原)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( )
(2006•太原)高铁酸钾(K2FeO4)是一种高效多功能水处理剂,它与水反应不可能生成( )
A.氧气
B.碳酸钾
C.氢氧化钾
D.氢氧化铁 咖菲-猫1年前1
咖菲-猫1年前1 -
 zetaplusc1 共回答了23个问题
zetaplusc1 共回答了23个问题 |采纳率87%解题思路:由题意:高铁酸钾(K2FeO4)与水反应,反应物中的元素种类为:钾元素、铁元素、氧元素、氢元素;根据质量守恒定律的“元素守恒”可知,生成物中也应为这四种元素,不能多也不能少.故可知答案.氧气含有氧元素,可能生成;碳酸钾含有碳元素,反应物中无碳元素,根据质量守恒定律的“元素守恒”不可能生成;氢氧化钾含有的元素,反应物中含有,可能生成;氢氧化铁含有的元素,反应物中含有,可能生成.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过有关化学方程式有效地寻找出解题方法,从而培养了学生的创新思维能力.1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A. 高铁酸钠是氧化物
B. 高铁酸钠中铁元素的化合价为+6价
C. 高铁酸钠是一种新型的有机化合物
D. 高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 天使ww_58581年前1
天使ww_58581年前1 -
 骆驼ci 共回答了13个问题
骆驼ci 共回答了13个问题 |采纳率100%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负...
点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- (2012•泉港区质检)已知某物质X是一种消毒杀菌效率高、二次污染小的水处理剂,又知该物质的制备原理为:
(2012•泉港区质检)已知某物质X是一种消毒杀菌效率高、二次污染小的水处理剂,又知该物质的制备原理为:
2KClO3+4HCl(浓)=2KCl+2X+Cl2↑+2H2O.则X的化学式为( )
A. ClO2
B. HClO
C. Cl2O5
D. HClO3 太Q1年前1
太Q1年前1 -
 guanqingyu 共回答了22个问题
guanqingyu 共回答了22个问题 |采纳率95.5%解题思路:根据质量守恒定律的进行化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学方程式中反应物或生成物的化学式.根据质量守恒定律和化学方程式可知,反应前钾的个数为2,氯的个数为6,氧的个数为6,氢的个数为4;反应后钾的个数为2,氯的个数为4,氧的个数为2,氢的个数为4,可推断X的化学式为:ClO2,故A正确,B、C、D错误.
故选A.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
(2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
A.氧气
B.碳酸钠
C.氢氧化钠
D.氢氧化铁 wolaikankan51881年前1
wolaikankan51881年前1 -
 luankk 共回答了13个问题
luankk 共回答了13个问题 |采纳率76.9%解题思路:本题考查的是质量守恒定律,反应前后元素的种类和质量不变.本题中高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠;反应前有氧元素,因此反应后可能生成氧气;反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠;反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁.A、反应前有钠、铁、氧、氢四种元素,因此反应后可能生成氧气,故选项错误;
B、高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠,故选项正确;
C、反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠,故选项错误;
D、反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁,故选项错误;
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点是有关质量守恒定律的实验探究,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂.
(1)FeO42-与水反应的方程式为:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是______和______.
(2)将适量K2FeO4配制成c(FeO42-)=1.0×10-3mol•L-1(1.0mmol•L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ.题(1)中的反应为FeO42-变化的主反应,该反应的△H______0.
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示.下列说法正确的是______(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-⇌H++FeO42-的电离平衡常数表达式为K=c(H+).c(FeO42−) c(HFeO4−) ,其数值接近______(填字母).c(H+).c(FeO42−) c(HFeO4−)
A.10-2.5;B.10-6;C.10-7;D.10-10
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL,1.0×10-3mol•L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为______mol,[完全沉淀后溶液中残留的c(FeO42- )为______.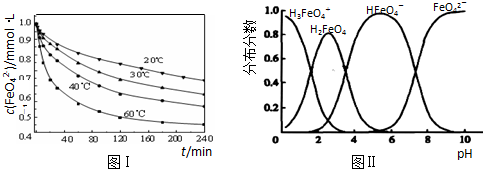
 一个和两个1年前1
一个和两个1年前1 -
 shirex 共回答了17个问题
shirex 共回答了17个问题 |采纳率88.2%解题思路:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
(2)温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小;温度越高FeO42-浓度越小,正向反应是吸热反应;
(3)根据图象的内容来分析图象所描述的意义;
(4)平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(5)根据溶度积常数计算.(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应;
故答案为:>;
(3)A、不同PH值时,溶液中铁元素的存在形态及种数不相同,比如在PH值等于6时,就只有两种形态,故A错误;
B.根据图片知,改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小,故正确;
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O,故错误;
D.根据图片知pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当,故正确;
故选BD;
(4)HFeO4-⇌H++FeO42-的电离平衡常数表达式为K=
c(H+).c(FeO42−)
c(HFeO4−),根据图象知,等HFeO4-和FeO42-
浓度相等时,溶液中氢离子浓度接近中性,所以K接近10-7,
故答案为:
c(H+).c(FeO42−)
c(HFeO4−),C;
(5)25℃时,CaFeO4的Ksp=4.536×10-9,若要使100mL1.0×10-3mol•L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量=
KSP
c(FeO42−)×0.1L=
4.536×10−9
1.0×10−5mol/L×0.1L=4.536×10-5,[完全沉淀后溶液中残留的c(FeO42- )为 1×10-5mol/L,
故答案为:4.536×10-5,1×10-5mol/L.点评:
本题考点: 体积百分含量随温度、压强变化曲线;化学平衡常数的含义;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了溶度积常数、电离平衡等知识点,难度中等,难点是溶度积常数的有关计算,当溶液中离子浓度为1×10-5mol/L时认为离子完全沉淀,为易错点.1年前查看全部
- 高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔
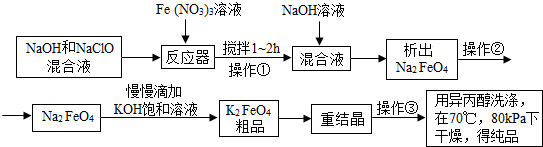
高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景.其制备路线如下:
试回答下列问题
(1)操作①搅拌的目的是______.
(2)操作②与操作③相同,该操作的名称是______
(3)慢慢滴加KOH饱和溶液发生的复分解反应的化学方程式为______.
(4)高铁酸钾作为净水剂对人的身体还有一个的好处是补铁,K2FeO4中铁元素的化合价为______价
(5)操作③后剩余的母液中,可循环使用的物质的化学式是______. bnliner1年前1
bnliner1年前1 -
 miraclecai 共回答了23个问题
miraclecai 共回答了23个问题 |采纳率91.3%解题思路:(1)根据玻璃棒搅拌的作用分析
(2)根据分离混合物的方法分析
(3)根据复分解反应的特点及化学方程式的书写原则书写方程式
(4)根据化合物中正负化合价的代数和为0分析
(5)根据重结晶后母液中的溶质分析(1)氢氧化钠和NaClO的混合液中加入硝酸亚换溶液发生化学反应,为使其充分反应可用玻璃棒搅拌.
(2)操作②与操作③都是将固体从液体中分离出来,因此可采用过滤
(3)慢慢滴加KOH饱和溶液后,氢氧化钾和高铁酸钠发生复分解反应生成高铁酸钾和氢氧化钠,化学方程式为 2KOH+Na2FeO4=K2FeO4+2NaOH.
(4)K2FeO4中钾元素+1价,氧元素-2价,根据正负化合价的代数和为0可知铁元素的化合价为+6价
(5)操作③后剩余的母液中还含有氢氧化钠溶液可循环使用.
故答案为:(1)使其充分反应.
(2)过滤
(3)2KOH+Na2FeO4=K2FeO4+2NaOH.
(4)+6
(5)NaOH点评:
本题考点: 物质的相互转化和制备.
考点点评: 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,培养了学生运用知识的能力.1年前查看全部
- NDJ-1型旋转粘度计测水处理剂粘度选哪个转子?
NDJ-1型旋转粘度计测水处理剂粘度选哪个转子?
1、用NDJ-1型旋转粘度计测聚合型水处理剂粘度应该选用图中四个中哪个转子,(绝对粘度范围大概0—30mpa.S)?
2、还有麻烦讲讲具体怎么操作跟读数,
 felixkuok1年前1
felixkuok1年前1 -
 sypmk 共回答了21个问题
sypmk 共回答了21个问题 |采纳率85.7%1、NDJ-1型旋转粘度计1#转子测量范围为(20-900)mPa·s.如果想测量更低的动力粘度,可以选择0#转子.
2、具体方法是:将清洗过的保护架和转子先后安装到旋转粘度计上,将旋转粘度计浸入未知液中,液面大约在转子“瓶颈”处的1/2.接通电源,打开电源开关,把转速旋钮旋到12转转速档,待指针稳定后按下制动杆以钳住指针,同时关闭电源.使指针停止在观察窗内,从刻度盘上读取指针偏转角α1.按以上步骤,测量6转转速档下的偏转角α2.
根据检定证书给出的旋转粘度计1#转子12转和6转的K值,计算出粘度值.
粘度值η=K·α1年前查看全部
- 我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如图所示.下列说法正确的是( )
我国最近已研究出新型水处理剂ClO2的新制法,其反应的微观过程如图所示.下列说法正确的是( )
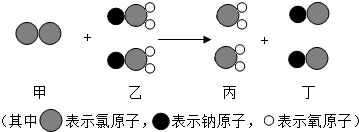
A.该反应中甲和乙分子个数比为1:2
B.该反应属于复分解反应
C.乙中氯元素的化合价为+5价
D.该反应的化学方程式为2Cl+2NaClO2=2ClO2+2NaCl aa和地角1年前1
aa和地角1年前1 -
 小子真丑 共回答了21个问题
小子真丑 共回答了21个问题 |采纳率81%解题思路:根据物质的微观构成,写出反应物、生成物的化学式,再根据反应的微观过程,写出反应的方程式;由方程式即可进行有关问题的分析解答.由物质的微观构成可知,甲物质的分子由两个氯原子构成,物质甲的化学式应写为Cl2;物质乙、丙、丁的化学式分别为NaClO2、ClO2、NaCl.因此,该反应的微观过程的化学式应为:Cl2+2NaClO2═2ClO2+2NaCl;
A、由上述反应的方程式可知,该反应中甲和乙分子个数比为1:2.故A正确;
B、由上述反应的方程式可知,该反应的反应物是两种,不属于分解反应.故B不正确;
C、乙物质的化学式为NaClO2;设其中氯元素的化合价为x,则有(+1)+x+(-2)×2=0,解得x=+3;故C不正确;
D、该反应的化学方程式为:Cl2+2NaClO2═2ClO2+2NaCl;故D不正确.
故选A.点评:
本题考点: 微粒观点及模型图的应用;有关元素化合价的计算;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
考点点评: 分子结构模型可以反映出物质的分子的构成,利用分子的构成可判断物质的类别及化学式;不同种原子构成的物质为化合物分子,同种原子构成的分子为单质分子.1年前查看全部
- (2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4
(2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是( )
A.高铁酸钾中铁显+6价
B.湿法中FeO42-是还原产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 bluemen1年前1
bluemen1年前1 -
 dudubear1 共回答了17个问题
dudubear1 共回答了17个问题 |采纳率94.1%解题思路:A、根据化合物中正负化合价的代数和为0进行解答;
B、还原产物是氧化剂被还原得到的产物;
C、化合价升高数=化合价降低数=转移电子数;
D、依据高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂分析.A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、湿法中FeO42-是氧化产物,故B错误;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,铁元素化合价升高,每生成2molNa2FeO4,转移电子总数=化合价升高总数=化合价降低总数=8mol,所以每生成1molNa2FeO4共转移4mol电子,同时1molNa2O2变化生成1molO2,化合价升高,转移电子物质的量为2mol,所以共转移电子10mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,H2S、NH3具有还原性被氧化,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确;
故选AD.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;氧化还原反应的计算.
考点点评: 本题考查了氧化还原反应的化合价变化判断,概念分析和电子转移数计算,熟练掌握氧化还原反应的特征是化合价变化是关键.1年前查看全部
- 高铁酸钾(K 2 Fe0 4 )是具有紫色光泽的粉末,它是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂
高铁酸钾(K 2 Fe0 4 )是具有紫色光泽的粉末,它是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂.干燥的高铁酸钾在198℃以下是稳定的,受热易分解、变质.根据上述信息,请回答下列问题:
(1)高铁酸钾的物理性质是______;
(2)高铁酸钾中铁元素的化合价为______;
(3)为防止高铁酸钾变质,保存时应注意______. carpediewm1年前1
carpediewm1年前1 -
 千年和万年 共回答了22个问题
千年和万年 共回答了22个问题 |采纳率81.8%(1)根据叙述可知,高铁酸钾是一种具有紫色光泽的粉末.故填:具有紫色光泽的粉末.
(2)高铁酸钾中钾元素的化合价是+1价,氧元素的化合价是-2价,根据化合物中元素化合价代数和为零的原则可以求出铁元素的化合价为+6价.故填:+6.
(3)因为高铁酸钾受热易分解、变质,所以应该在阴凉干燥处密封保存.故填:应该在阴凉干燥处密封保存.1年前查看全部
- 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
(1)已知:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有______.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=______的溶液.
(2)高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为______.干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 电解法 制备中间产物Na2FeO4,再与KOH溶液反应
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为______.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH放电时负极材料为______,正极反应为:______.放电 充电
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为______mol. ghm8007181年前1
ghm8007181年前1 -
 jun6249397 共回答了17个问题
jun6249397 共回答了17个问题 |采纳率82.4%解题思路:(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;依高铁酸根离子水解平衡移动的影响因素解答;
(2)①Fe2O3、KNO3、KOH混合加热发生氧化还原反应,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+3价,依据氧化还原反应得失电子守恒规律计算;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数,根据电荷守恒确定OH-系数,根据氢元素守恒确定H2O系数,检查氧元素守恒,据此写出氧化还原反应方程式;
③电解时阳极Fe失电子发生氧化反应,被氧化生成高铁酸根离子;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁;放电 充电
(4)依据溶度积规则,当Qc=Ksp达到沉淀溶解平衡,要产生沉淀则Qc>Ksp,据此解答.(1)K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42- 被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质;4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑,增大溶液中的氢氧根离子浓度,能够使平衡逆向移动,抑制高铁酸根离子的水解,所以同浓度的高铁酸钾在pH为11.50的水溶液中最稳定;
故答案为:杀菌消毒、吸附悬浮物;11.50;
(2)①Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,Fe2O3做还原剂;N元素化合价由+5价降低到+3价,
KNO3做氧化剂,设氧化剂物质的量为xmol,还原剂物质的量为ymol,要使氧化剂得到电子总数等于还原剂失去电子总数,x×(5-3)=y×2×(6-3),解得x:y=3:1;
故答案为:3:1;
②由信息可知,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,根据元素守恒还应生成H2O,反应中FeO42-→FeO43-,铁元素化合价由+6价降低为+5价,总共降低1价,Fe3+→FeO43-,铁元素化合价由+3价升高为+5价,总共升高2价,化合价升降最小公倍数为2,所以FeO42-系数为2,Fe3+系数为1,根据铁元素守恒确定FeO43-系数为3,根据电荷守恒确定OH-系数8,根据氢元素守恒确定H2O系数为4,反应离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
故答案为:2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
③电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(3)放电时,为原电池,依据3Zn+2K2FeO4+8H2O
放电
充电3Zn(OH)2+2Fe(OH)3+4KOH,锌化合价升高,发生氧化反应,做负极,高铁酸根离子在正极得到电子,发生还原反应生成氢氧化铁,电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
故答案为:Zn;FeO42-+4H2O+3e-═Fe(OH)3+5OH-;
(4)设加入Ca(OH)2的物质的量为xmol,则溶液中钙离子浓度为x×10-3mol/L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)=2.0×l0-4 mol•L-l,
Qc=x×10-3mol/L×2.0×l0-4 mol•L-l=Ksp=4.54×l0-9;
解得:x=2.27×10-2;
故答案为:2.27×10-2.点评:
本题考点: 铁盐和亚铁盐的相互转变;氧化还原反应;化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题为综合题,考查了氧化还原反应方程式的书写及配平、电极反应式的书写、溶度积规则的应用,题目难度较大,明确物质的性质及题给信息、熟悉化合物中各元素化合价、沉淀溶解平衡规律是解本题关键,氧化还原方程式的书写是难点.1年前查看全部
- (2008•江苏模拟)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3
(2008•江苏模拟)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )△ .
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1mol KClO3参加反应有2 mol电子转移 蘼粉粉1年前1
蘼粉粉1年前1 -
 李ww的师弟 共回答了15个问题
李ww的师弟 共回答了15个问题 |采纳率93.3%解题思路:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.△ .A.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故A正确;
B.Cl元素的化合价由+5价降低为+4价,所以氯酸钾对应的产物ClO2是还原产物,故B错误;
C.H2C2O4为还原剂,在反应中被氧化,故C错误;
D.1molKClO3参加反应有1mol×(5-4)=1mol,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂中元素的变化来解答,难度不大.1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂。下列反应可制取K 2 FeO 4 :
高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂。下列反应可制取K 2 FeO 4 :
2Fe(OH) 3 +3Cl 2 +10KOH 2 K 2 FeO 4 +KCl+8H 2 O
K 2 FeO 4 +KCl+8H 2 O
对于该反应,下列说法正确的是A.该反应是置换反应 B.钾元素化合价降低 C.Fe(OH) 3 发生还原反应 D.Cl 2 是氧化剂  我是北斗我怕谁1年前1
我是北斗我怕谁1年前1 -
 不懂乱猜 共回答了17个问题
不懂乱猜 共回答了17个问题 |采纳率88.2%
1年前查看全部
- 高铁酸钾是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺如下:
 yy561年前1
yy561年前1 -
 badoudou 共回答了10个问题
badoudou 共回答了10个问题 |采纳率80%(1)温度较低 2分
(2)2,3,10;2,6,3,5 3分
(3)AC 2分
(4)5.6m/33 L 3分
(5)在pH=11.50的溶液中,OH-浓度大,使FeO42-+10H2O 4Fe(OH)3+
8OH-+3O2↑平衡向左移动(合理答案也给分). 2分1年前查看全部
- Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=
Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移 new_tenant1年前1
new_tenant1年前1 -
 winyjm 共回答了21个问题
winyjm 共回答了21个问题 |采纳率85.7%2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低.
A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;
B、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故B正确;
C、Na2O2→O2,O元素化合价升高,O2是氧化产物,故C正确;
D、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D正确.
故选A.1年前查看全部
- 高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:Fe(OH)3+ClO-+OH-一FeO42-+Cl-+H2
高铁酸钾是一种理想的绿色水处理剂,工业上可通过如下反应制得:Fe(OH)3+ClO-+OH-一FeO42-+Cl-+H2O(未配平),在上述反应中( )
A. FeO4 2-是还原产物
B. ClO-是还原剂
C. 1molFe(OH)3得到3mol电子
D. 配平后OH-的化学计量数为4 ryan9231年前1
ryan9231年前1 -
 星夜一人 共回答了18个问题
星夜一人 共回答了18个问题 |采纳率88.9%解题思路:氧化还原反应中,得电子化合价降低的反应物是氧化剂,氧化剂对应的产物是还原产物,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;氧化还原反应中得失电子相等,据此分析解答.A、该反应中,反应前后氯元素的化合价由+1价→-1价,氯元素得电子化合价降低,所以ClO-作氧化剂,还原产物是
Cl-,FeO42-是氧化产物,故A错误.
B、该反应中,反应前后氯元素的化合价由+1价→-1价,氯元素得电子化合价降低,所以ClO-作氧化剂,故B错误.
C、该反应中,一个Fe(OH)3生成FeO42-,铁元素失去3个电子,所以1molFe(OH)3失去3mol电子,故C错误.
D、该反应中,一个Fe(OH)3生成FeO42-,铁元素失去3个电子,一个ClO-生成Cl-得到2个电子,根据得失电子相等,该反应方程式为 2Fe(OH)3+3 ClO-+4OH-=2FeO42-+3Cl-+5H2O,故D正确.
故选D.点评:
本题考点: 氧化还原反应方程式的配平;氧化还原反应的电子转移数目计算.
考点点评: 本题考查了氧化还原反应中还原剂和氧化剂、氧化产物和还原产物的判断等知识点,难度不大,注意氧化还原反应方程式的配平依据是得失电子相等.1年前查看全部
- (2010•平谷区一模)高铁酸钾(K2FeO4)是一种新型高效水处理剂.下列关于该物质的叙述,正确的是( )
(2010•平谷区一模)高铁酸钾(K2FeO4)是一种新型高效水处理剂.下列关于该物质的叙述,正确的是( )
A.它是一种氧化物
B.组成中含有两种非金属元素
C.它是一种混合物
D.K2FeO4中铁元素的化合价为+6 embraceor1年前1
embraceor1年前1 -
 昨天的风0609 共回答了15个问题
昨天的风0609 共回答了15个问题 |采纳率80%解题思路:A、根据氧化物的组成特点,由高铁酸钾的化学式K2FeO4,判断该物质是否属于氧化物;
B、由高铁酸钾的化学式K2FeO4,判断组成元素中属于非金属元素的种类;
C、根据高铁酸钾的化学式K2FeO4,由物质组成的组成,判断物质分类;
D、利用化合物中各元素化合价代数和为0,由K、O元素的化合价,可计算其中铁元素的化合价.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成,该物质不属于氧化物;故A不正确;
B、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成,其中只有O元素一种非金属元素;故B不正确;
C、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成的化合物,而非混合物;故C不正确;
D、设化合物K2FeO4中铁元素的化合价为x,依据化合物中各元素化合价代数和为0,有(+1×2)+x+(-2×4)=0,解得x=+6;故D正确;
故选D.点评:
本题考点: 有关元素化合价的计算;从组成上识别氧化物;纯净物和混合物的判别;元素的简单分类.
考点点评: 根据化合物中各元素化合价代数和为0,利用化合物的化学式可计算其中未知的元素化合价.1年前查看全部
- (2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(
(2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(OH)3+3ClO-+4OH-→2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4.有关分析错误的是( )
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1mol Na2FeO4转移3mol电子
D.高铁酸钠的氧化性大于次氯酸钠 欢喜虫虫1年前1
欢喜虫虫1年前1 -
 等待你的猫 共回答了21个问题
等待你的猫 共回答了21个问题 |采纳率90.5%解题思路:A.根据等物质的量的氧化剂得电子数目判断;
B.湿法中铁元素化合价升高;
C.铁元素化合价由+2价升高到+6价;
D.根据氧化剂氧化性大于氧化产物的氧化性判断.A.用作净水剂时,1molNa2FeO4可到3mol电子,被还原生成Fe(OH)3,1molNaClO得2mol电子,被还原生成Cl-,则等物质的量Na2FeO4氧化能力优于次氯酸钠,故A正确;
B.湿法中铁元素化合价升高,被氧化,故B正确;
C.干法制备中铁元素化合价由+2价升高到+6价,则每生成1mol Na2FeO4转移4mol电子,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,可知次氯酸钠的氧化性较强,故D错误.
故选CD.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=
Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移 conananiu1年前1
conananiu1年前1 -
 我是流浪者 共回答了20个问题
我是流浪者 共回答了20个问题 |采纳率95%2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低.
A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;
B、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故B正确;
C、Na2O2→O2,O元素化合价升高,O2是氧化产物,故C正确;
D、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D正确.
故选A.1年前查看全部
- (2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是(
(2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是( )
A.+2价
B.十3价
C.+4价
D.+6价 hulihula20001年前1
hulihula20001年前1 -
 wzh_bird 共回答了19个问题
wzh_bird 共回答了19个问题 |采纳率84.2%解题思路:根据在化合物中正负化合价代数和为零,结合高铁酸钠(Na2FeO4)的化学式进行解答本题.根据在化合物中正负化合价代数和为零,钠元素显+1,氧元素显-2,设铁元素的化合价是x,可知高铁酸钠(Na2FeO4)中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 杀菌灭藻剂的定义是有关于水处理剂方面的
 moon聂小倩1年前1
moon聂小倩1年前1 -
 hh女cuer 共回答了16个问题
hh女cuer 共回答了16个问题 |采纳率93.8%杀菌灭藻剂
性 能:
属非氧化性灭菌剂,粘泥剥离剂,是一种阳离子表面活性剂,
能有效地挖去藻类繁殖和粘泥增长,在不同的PH值范围内均有很好的杀菌
灭藻能力,并有分散和渗透作用,能渗透并除去粘泥和剥离附着的藻类,
此外,还有去油能力.
用 途:
广泛适用于循环冷却水系统,油田注水系统,冷冻水系统中,
作为非氧化性杀菌灭藻剂,粘泥剥离剂使用,也可用作晴纶纤维染色的均
染剂及其纺织加工前的柔滑和抗静电处理.
质量指标:(符合HG/T2230-91)
指标名称
指标
外观 无色或淡黄色粘稠液体
活性组合含量% 44-46
密度(20°C)g/cm³ 1.3-1.4
胺盐含量% ≤4.0
PH值 6.0-8.0
使 用 方 法:
作非氧化性杀菌灭藻剂时,一般投放量为50-100g/m³.作为粘泥剥离
剂时,用量为200-300g/m3同时投加适量消泡剂.如与戊二醛、二硫氰基甲
烷等杀菌剂配合作用,可增加效力,但不能与氯酚类药剂同用,投入本品
后循环水中因剥离出污物应及时滤除或排污,以免泡沫消失后沉积.
包装及贮存:
采用塑料桶装,贮存于室内通风阴凉处,避免
阳光直射,贮存期二年.1年前查看全部
- (2011•江苏一模)高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产,原理为:3NaClO+2F
(2011•江苏一模)高铁酸钾是一种高效的多功能的水处理剂.工业上常采用NaClO氧化法生产,原理为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,Na2FeO4+2KOH=K2FeO4+2NaOH,主要的生产流程如下:

(1)写出反应①的离子方程式______.
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4)______Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.
图1为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
图2为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响.
①工业生产中最佳温度为______℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为______.
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:______.
③若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______.
(4)K2FeO4 在水溶液中易水解:4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用______溶液(填序号).
A.H2OB.CH3COONa、异丙醇C.NH4Cl、异丙醇D.Fe(NO3)3、异丙醇. 飘的水1年前1
飘的水1年前1 -
 尚笑酷房 共回答了14个问题
尚笑酷房 共回答了14个问题 |采纳率92.9%解题思路:(1)氯气是酸性气体,能和烧碱溶液反应生成NaCl和NaClO;
(2)从难溶电解质的沉淀转化的角度分析;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面;
②从盐类的水解角度分析;
③根据反应物和生成物书写反应的离子方程式;
(4)选择的洗涤剂应能抑制K2FeO4的水解,并注意减少K2FeO4的溶解.(1)氯气是酸性气体,能和烧碱溶液反应,反应实质为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;(2)根据反应Na2FeO4+2KOH=K2FeO4+2NaOH可知,反应生成溶解度更小的物质,说明此温度下Ksp(K2FeO4...
点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查物质的制备方案的设计,题目难度中等,解答本题时注意把握题给信息,学习中注重知识迁移能力的培养.1年前查看全部
- ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取ClO2:2NaClO3
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.欧洲一些国家用NaClO3和浓盐酸反应来制取ClO2:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.下列判断不正确的是( )
A.NaClO3在反应中得到电子
B.NaClO3在反应中只作氧化剂
C.被氧化和被还原的元素都是Cl
D.ClO2是氧化产物 amanda_lu03231年前1
amanda_lu03231年前1 -
 lz5u 共回答了21个问题
lz5u 共回答了21个问题 |采纳率95.2%解题思路:反应2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5降低为+4价,Cl元素的化合价由-1升高到0价,以此来解答.A、因反应中Cl元素的化合价由+5降低为+4价,则NaClO3在反应中得到电子,故A正确;
B、因反应中Cl元素的化合价由+5降低为+4价,则NaClO3在反应中得到电子,作氧化剂,盐酸中Cl元素的化合价由-1升高到0价,盐酸为还原剂,故B正确;
C、该反应中Cl元素的化合价由+5降低为+4价,也是Cl元素的化合价由-1升高到0价,被氧化和被还原的元素都是Cl,故C正确;
D、二氧化氯是化合价降低的氯元素所在的生成物,是还原产物,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应中的基本概念,明确反应中元素的化合价变化是解答本题的关键.1年前查看全部
- 高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂.
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂.

(1)高铁酸钾具有强氧化性的原因是______.
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为______,______.
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法.
①干式氧化的初始反应是2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2mol Na2FeO4时转移电子______mol.
②湿式氧化法的流程如图:
上述流程中制备Na2FeO4的化学方程式是______.
(4)高铁电池是正在研制中的可充电电池,图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有______、______.
(5)探究高铁酸钾的某种性质.
【实验1】将适量K2FeO4固体分别溶解于pH为 4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmol•L-1(1mmol•L-1=10-3mol•L-1)的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,结果见图2(注:800min后,三种溶液中高铁酸钾的浓度不再改变).
【实验2】将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为0mmol•L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2.则
①实验1的目的是______;
②实验2可得出的结论是______;
③高铁酸钾在水中的反应为4FeO42-+10H2O⇌4Fe(OH)3+8OH-+3O2↑.由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是______. 8227love1年前1
8227love1年前1 -
 majcos 共回答了19个问题
majcos 共回答了19个问题 |采纳率84.2%解题思路:(1)高铁酸钾中的铁是正6价,处于高价态,具有强氧性;
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,吸附杂质的作用;
(3)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol;
②Fe(NO3)3被NaClO氧化成Na2FeO4;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点;
(5)①在其它条件相同的情况下研究在FeO42-不同PH溶液中的稳定性;
②研究温度改变,FeO42-的稳定性;
③用平衡移动的原理解释.(1)高铁酸钾中的铁是正6价,处于高价态,具有强氧性,故答案为:其中的铁元素为+6价,易得电子;
(2)高铁酸钾是具有强氧性,还原产物铁离子水解生成氢氧化铁胶体,吸附杂质的作用,故答案为:高铁酸钾有强氧化性,能杀菌消毒;产生的Fe(OH)3有吸附性,有絮凝作用;
(3)①2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,6molNa2O2中12mol的负一价氧,2mol的有变成0价,还有10mol变成-2价,而铁是正2价变为正6价,所以每生成2mol Na2FeO4时转移电子10mol,故答案为:10;
②Fe(NO3)3被NaClO氧化成Na2FeO4,故答案为:2Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(4)高铁电池由图2为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有放电时间长,工作电压稳定等优点,
故答案为:放电时间长;工作电压稳定;
(5)①在其它条件相同的情况下研究在FeO42-不同PH溶液中的稳定性,故答案为:研究在FeO42-不同PH溶液中的稳定性(或反应的速率);
②研究温度改变,FeO42-的稳定性,故答案为:温度越高,FeO42-越不稳定(或与水反应的速率越快);
③用平衡移动的原理解释,pH=11.50的溶液中OH-离子浓度大,使平衡向左移动,故答案为:pH=11.50的溶液中OH-离子浓度大,使平衡向左移动.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学电源新型电池.
考点点评: 本题考查元素化合物知识结合化学反应的速率以及平衡的移动等知识的综合考查,难度大,学生不容易接受.1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、去浊、脱色、除臭为一体的新型高效水处理剂.下列关于该物质的叙述正
高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、去浊、脱色、除臭为一体的新型高效水处理剂.下列关于该物质的叙述正确的是( )
A. 它是一种氧化物
B. K2FeO4中铁元素的化合价为+6价
C. 它是一种混合物
D. 该物质含有两种非金属元素 WSL5301年前4
WSL5301年前4 -
 叮铃鱼 共回答了20个问题
叮铃鱼 共回答了20个问题 |采纳率95%解题思路:可以根据高铁酸钾的化学式进行相关的判断,氧化物是指含有两种元素且其中一种是氧元素的化合物,根据化合价规则即可求得高铁酸钾中铁元素的化合价.A、高铁酸钾含有钾、铁、氧三种元素,不是氧化物,故A错误;
B、根据化合物中各元素正负化合价的代数和为零,设铁元素的化合价为x,则有(+1)×2+x+(-2)×4=0,解得x=+6,故B正确;
C、高铁酸钾是纯净物不是混合物,故C错误;
D、高铁酸钾含有氧这一种非金属元素,故D错误;
故选B.点评:
本题考点: 物质的简单分类;从组成上识别氧化物;纯净物和混合物的判别;物质的元素组成;有关元素化合价的计算.
考点点评: 本题主要考查了氧化物的概念以及化合价规则,完成此题,可以依据已有的知识进行.1年前查看全部
- 我国最近已研究出新型水处理剂ClO 2 的新制法,其反应的微观过程如下图所示。下列说法正确的是 [
我国最近已研究出新型水处理剂ClO 2 的新制法,其反应的微观过程如下图所示。下列说法正确的是 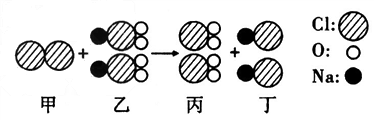 [ ]
[ ]A. 乙中氯元素的化合价为+5
B. 该反应符合质量守恒定律
C. 反应前后元素的种类发生变化
D. 该反应化学方程式为Cl 2 + NaClO 2 ==2ClO 2 + 2NaCl 2 憨人A1年前1
憨人A1年前1 -
 yun2536147 共回答了15个问题
yun2536147 共回答了15个问题 |采纳率86.7%B1年前查看全部
- 在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
A.铁酸钠属于氧化物
B.河水用铁酸钠处理后变为纯水
C.铁酸钠中铁元素的化合价为+6价
D.铁酸钠中铁元素的化合价为+3价 兰若寺的高小胖1年前1
兰若寺的高小胖1年前1 -
 8美丽8 共回答了26个问题
8美丽8 共回答了26个问题 |采纳率92.3%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断;
B、根据纯净物与混合物的区分方法进行分析判断;
C、根据化合价的计算方法判断;
D、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据铁酸钠(Na2Fe04),铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故A错;
B、用铁酸钠处理后的河水中含有可溶性的钙镁化合物等,属于混合物;故B错;
C、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,故C正确;
D、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6;故D错.
故选C.点评:
本题考点: 从组成上识别氧化物;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、纯净物与混合物的区分方法、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂.下列反应可制取K 2 FeO 4 :2Fe(OH) 3
高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂.下列反应可制取K 2 FeO 4 :2Fe(OH) 3 +3Cl 2 +10KOH
2K 2 FeO 4 +6KCl+8H 2 O对于该反应,下列说法正确的是( )0-30℃ . A.该反应是置换反应 B.钾元素化合价降低 C.Fe(OH) 3 发生还原反应 D.Cl 2 是氧化剂  xiesuan1年前1
xiesuan1年前1 -
 没有果实 共回答了17个问题
没有果实 共回答了17个问题 |采纳率94.1%A、反应物、生成物的种类、种数不符合置换反应概念,不是置换反应,故A错误;
B、钾元素化合价反应前后都为+1价,故B错误;
C、铁元素化合价由+3价升高为+6价,Fe(OH) 3 发生氧化反应,故C错误;
D、氯元素的化合价由0将为-1价,发生还原反应,氯气是氧化剂,故D正确.
故选:D.1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
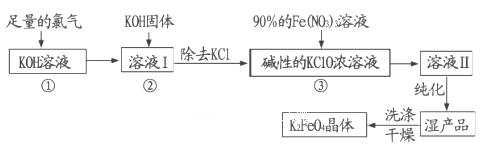
请同答下列问题:
(l)写出向KOH溶液中通入足量Cl 2 发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
(3)从溶液Ⅱ中分离出K 2 FeO 4 后,还会有副产品KNO 3 ,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K 2 FeO 4 ,理论上消耗氧化剂的物质的量为____ mol。A.为下一步反应提供碱性的环境 B.使KClO 3 转化为KClO C.与溶液I中过量的Cl 2 继续反应,生成更多的KClO D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(4)高铁酸钾(K 2 FeO 4 )作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO 4 2 - +_______ H 2 O="_______" Fe(OH) 3 (胶体)+_______O 2 ↑+_______OH - 。
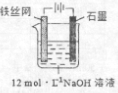
(5)从环境保护的角度看,制备K 2 FeO 4 较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。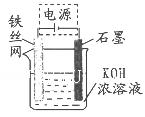
(6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH) 2 +2Fe(OH) 3 +4KOH-----3Zn+2K 2 FeO 4 +8H 2 O,放电时电池的负极反应式为________ 。 lvchaohahaha1年前1
lvchaohahaha1年前1 -
 huang123tao 共回答了11个问题
huang123tao 共回答了11个问题 |采纳率81.8%1年前查看全部
- 在KOH溶液中 用次氯酸钾氧化三氧化铁制备新一代水处理剂高铁酸盐化学方程式
 inbf1年前2
inbf1年前2 -
 太白金星2006 共回答了15个问题
太白金星2006 共回答了15个问题 |采纳率80%3 KClO+ 4 KOH+2 Fe(OH)3=2 K2FeO4 + 3 KCl + 5 H2O1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下 (1)反应①应在温度
高铁酸钾(K 2 FeO 4 )是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下 
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl 2 反应生成的是KClO 3 。写出在温度较高时KOH 与Cl 2 反应的化学方程式______________________,当反应中转移5mol电子时,消耗的氯气是
___________mol。
(2)在反应液I中加入KOH固体的目的是___________(填编号)。
A.与反应液I中过量的Cl 2 继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO 3 转化为KClO
(3)从溶液II中分离出K 2 FeO 4 后,还会有副产品KNO 3 、KCl,则反应③中发生的离子反应方程式为
___________________________。
(4)如何判断K 2 FeO 4 晶体已经洗涤干净______________________。
(5)高铁酸钾(K 2 FeO 4 )作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
____FeO 4 2- +____H 2 O→_____Fe(OH) 3 (胶体)+_____O 2 ↑+______完成并配平方程式将完整的离子方程式写在下方:______________________。 追求真理吧1年前1
追求真理吧1年前1 -
 venus88 共回答了23个问题
venus88 共回答了23个问题 |采纳率91.3%(1)6KOH+3Cl 2 ==KClO 3 +5KCl+3H 2 O;3
(2)AC
(3)2Fe 3+ +3ClO - +10OH - ==2FeO 4 2- +3Cl - +5H 2 O
(4)取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净
(5)4FeO 4 2- +10H 2 O=4Fe(OH) 3 (胶体)+3O 2 ↑+8OH -1年前查看全部
- X是一种消毒杀菌效率高、污染小的水处理剂。制备原理为:
X是一种消毒杀菌效率高、污染小的水处理剂。制备原理为:
2KClO 3 +4HCl(浓)==2KCl+2X+Cl 2 ↑+2H 2 O
试根据质量守恒定律推断X的化学式为[ ]A.HClO 3
B.HClO
C.Cl 2 O 5
D.ClO 2 最近好郁闷1年前1
最近好郁闷1年前1 -
 love0913 共回答了15个问题
love0913 共回答了15个问题 |采纳率93.3%D1年前查看全部
- 铁酸钾(K2FeO4)做水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式为
 拉拉拉拉1年前2
拉拉拉拉1年前2 -
 什么时候了都 共回答了16个问题
什么时候了都 共回答了16个问题 |采纳率68.8%高铁酸钾(K2FeO4)是一种集氧化.吸附.杀菌.灭藻.去浊.脱色.除臭为一体选B A:它是一种氧化物 错,它由三种元素组成,不可能是氧化物.B:K21年前查看全部
- (2005•荆州)高铁酸钾是一种亲型、高效、多功能的“绿色”水处理剂,其化学式为K2FeO4,已知其中K元素为+1价,O
(2005•荆州)高铁酸钾是一种亲型、高效、多功能的“绿色”水处理剂,其化学式为K2FeO4,已知其中K元素为+1价,O元素为-2价,则Fe元素的化合价为( )
A.+2
B.+4
C.+5
D.+6 tom51681年前1
tom51681年前1 -
 q68040967 共回答了16个问题
q68040967 共回答了16个问题 |采纳率87.5%解题思路:已知K元素为+1价,O元素为-2价,根据在化合物中,各元素的化合价代数和为零即可求得Fe元素的化合价.在K2FeO4中K元素为+1价,O元素为-2价;
则设铁元素化合价为x,
则(+1)×2+x+(-2)×4=0;
解得:x=+6;
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳
高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳定的,在受潮或受热时都易发生分解.根据上述信息,请回答下列问题.
(1)高铁酸钾的物理性质是有紫色光泽的粉末有紫色光泽的粉末.
(2)高铁酸钾在保存时应注意避免受潮,受热受潮,受热.
(3)高铁酸钾与水反应的化学方程式如下,请在方框内填入化学计量数,在横线上填写化学式.
4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+3O23O2↑. yu6275272951年前1
yu6275272951年前1 -
 liaodl1975 共回答了20个问题
liaodl1975 共回答了20个问题 |采纳率90%(1)物质的颜色、光泽、状态等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:有紫色光泽的粉末.
(2)高铁酸钾在受潮或受热时都易发生分解,所以高铁酸钾在保存时应注意避免受潮,受热.故填:受潮,受热.
(3)根据质量守恒定律可知,高铁酸钾和水反应生成氢氧化铁、氢氧化钾和氧气.故填:3O2.1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂。下列反应可制取K 2 FeO 4 ;
高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂。下列反应可制取K 2 FeO 4 ;
2Fe(OH) 3 +3Cl 2 +10KOH 2K 2 FeO 4 +6KCl+8H 2 O 对于该反应,下列说法正确的是 [ ]
2K 2 FeO 4 +6KCl+8H 2 O 对于该反应,下列说法正确的是 [ ]A.该反应是置换反应
B.钾元素化合价降低
C.Fe(OH) 3 发生还原反应
D.Cl 2 是氧化剂 maryzz1年前1
maryzz1年前1 -
 124356 共回答了13个问题
124356 共回答了13个问题 |采纳率84.6%D1年前查看全部
- 在GB/T16632-2008国标,水处理剂阻垢性能的测定(碳酸钙沉淀积法)中 为什么要加入硼砂缓冲溶液?
在GB/T16632-2008国标,水处理剂阻垢性能的测定(碳酸钙沉淀积法)中 为什么要加入硼砂缓冲溶液?
为什么不是加其他缓冲溶液?
 给了钱就不捣1年前1
给了钱就不捣1年前1 -
 jokan 共回答了22个问题
jokan 共回答了22个问题 |采纳率90.9%加缓冲液是为了调节ph值 但也有加按氯化铵缓冲液的 呀 只是测定水质的试剂而已1年前查看全部
- 高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳
高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾是具有紫色光泽的粉末;干燥的高铁酸钾在198℃以下是稳定的,在受潮或受热时都易发生分解.根据上述信息,请回答下列问题.
(1)高铁酸钾的物理性质是有紫色光泽的粉末有紫色光泽的粉末.
(2)高铁酸钾在保存时应注意避免受潮,受热受潮,受热.
(3)高铁酸钾与水反应的化学方程式如下,请在方框内填入化学计量数,在横线上填写化学式.
4K2FeO4+10H2O═4Fe(OH)3↓+8KOH+3O23O2↑. 宁静之声1年前1
宁静之声1年前1 -
 同在A组的 共回答了9个问题
同在A组的 共回答了9个问题 |采纳率88.9%解题思路:(1)物质的物理性质是指不需要通过化学变化表现出来的性质.
(2)高铁酸钾的热稳定性差,遇水容易发生化学反应.
(3)根据质量守恒定律可以确定物质的化学式.(1)物质的颜色、光泽、状态等方面的性质不需要通过化学变化表现出来,属于物理性质.故填:有紫色光泽的粉末.
(2)高铁酸钾在受潮或受热时都易发生分解,所以高铁酸钾在保存时应注意避免受潮,受热.故填:受潮,受热.
(3)根据质量守恒定律可知,高铁酸钾和水反应生成氢氧化铁、氢氧化钾和氧气.故填:3O2.点评:
本题考点: 化学性质与物理性质的差别及应用;空气中常见酸碱盐的质量或性质变化及贮存法;有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 本题主要考查高铁酸钾的性质和化学方程式的书写等方面的知识,物质之间发生化学变化时都遵循质量守恒定律.1年前查看全部
- 高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、脱色、除臭等为一的新型高效水处理剂.下列关于该物质的说法正确的是
高铁酸钾(K2FeO4)是一种集氧化、吸附、杀菌、灭藻、脱色、除臭等为一的新型高效水处理剂.下列关于该物质的说法正确的是( )
A.高铁酸钾是由2个钾原子、一个铁原子和4个氧原子构成的
B.高铁酸钾是一种混合物
C.高铁酸钾中含有两种金属元素
D.高铁酸钾分子是由6个原子构成的 qq521425q1年前1
qq521425q1年前1 -
 一定是猪 共回答了16个问题
一定是猪 共回答了16个问题 |采纳率87.5%解题思路:A、根据物质的构成进行分析;
B、根据混合物的概念进行分析;
C、由高铁酸钾的化学式K2FeO4,判断组成元素的种类;
D、根据分子的构成分析.A、宏观物质不能说是由几个原子构成的,应说一个高铁酸钾分子是由2个钾原子、一个铁原子和4个氧原子构成的,故A不正确;
B、根据高铁酸钾是由一种物质组成的,是一种纯净物;故B不正确;
C、根据高铁酸钾的化学式K2FeO4,高铁酸钾由K、Fe、O三种元素组成的化合物,含有两种金属元素;故C正确;
D、一个高铁酸钾分子是由7个原子构成的;故D不正确.
故选:C.点评:
本题考点: 化学式的书写及意义;纯净物和混合物的判别;元素的简单分类.
考点点评: 本题主要考查了物质的分类和化学式的意义,完成此题,可以依据已有的知识进行.1年前查看全部
- 高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂.下列反应可制取K 2 FeO 4 :2Fe(OH) 3
高铁酸钾(K 2 FeO 4 )是一种新型、高效、多功能水处理剂.下列反应可制取K 2 FeO 4 :2Fe(OH) 3 +3Cl 2 +10KOH=2K 2 FeO 4 +6KCl+8H 2 O,对于该反应,下列说法正确的是( ) A.该反应是复分解反应 B.钾元素化合价降低 C.Cl 2 是还原剂 D.Fe(OH) 3 发生氧化反应  正茂ii1年前1
正茂ii1年前1 -
 沙茶牛肉片 共回答了17个问题
沙茶牛肉片 共回答了17个问题 |采纳率94.1%A.Fe和Cl的化合价发生变化,属于氧化还原反应,故A错误;
B.K元素的化合价没有发生变化,故B错误;
C.Cl元素的化合价降低,被还原,Cl 2 是氧化剂,故C错误;
D.Fe元素的化合价升高,被氧化,Fe(OH) 3 发生氧化反应,故D正确.
故选D.1年前查看全部
- (2012•郑州一模)Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程
(2012•郑州一模)na2feo4是一种高效多功能水处理剂,应用前景十分看好.一种制备na2feo4的方法可用化学方程式表示如下:2feso4+6na2o2═2na2feo4+2na2o+2( )+o2↑.下列对此反应的说法中,不正确的是( )
a.方框中的物质na2so4
b.na2o2既是氧化剂,又是还原剂
c.na2feo4既是氧化产物,又是还原产物
d.2 mol feso4发生反应时,反应***有8 mol电子转移 cony_xue1年前1
cony_xue1年前1 -
 胖毛 共回答了21个问题
胖毛 共回答了21个问题 |采纳率90.5%解题思路:由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,Fe元素化合价升高,被氧化,结合元素化合价的变化解答该题.A.由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,则方框中的物质Na2SO4,故A正确;
B.反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,故B正确;
C.反应中Na2O2为氧化剂,FeSO4在反应中作还原剂,则Na2FeO4既是氧化产物又是还原产物,故C正确;
D.2molFeSO4发生反应时,化合价升高的有Fe和O,其中Fe化合价升高2×(6-2)=8,需要4molNa2O2为氧化剂,另2molNa2O2自身发生氧化还原反应,生成1molO2,转移电子2mol电子,共转移10mol电子,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,易错选项是D,注意该反应中不仅硫酸亚铁失电子,部分过氧化钠还失电子,为易错点.1年前查看全部
大家在问
- 1下列有关工业生产的叙述中,不正确的是高温( ) A.硫酸工业中,在接触室安装热交换器是为了循环利用反应放出的热量 B.
- 2﹣﹙﹣1﹚的4次方-﹙1-2分之1﹚÷﹙3﹚×[2-﹙﹣3﹚的平方]
- 3如图所示,同一水平桌面上放有体积相同的实心长方体木块和铁块各一个.现想探究木块和铁块的下表面谁更粗糙,小明同学设计了如下
- 4模拟城市4污水厂水管能接到抽水厂水管上吗?
- 5形容在一个地方住惯了不肯轻易迁移的词语
- 6顺便加一点例子。
- 7凹岸侵蚀,凸岸堆积,关于惯性离心力和非惯性系,怎么去和学生解释?
- 8把一根铁棒锯成8厘米的短铁棒,如果锯一段需要4分钟,锯完这根铁棒需要多少分钟?
- 9对别人的尊称有哪些词比如,大驾就是
- 10荷花生长在泥土中的部分是荷花的茎还是根
- 11下列关于重力和重心的说法中正确的是( ) A.物体本身就有重力,所以重力没有施力物体 B.形状规则的物体的重心
- 12Last Saturday Candy 1.____(take) her puppy Sweetie for a wal
- 13蜂蜜这个英语单词前面的H发不发音?
- 14肉包子打狗,
- 15Mike and I ______in the library now.

