Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=
 conananiu2022-10-04 11:39:541条回答
conananiu2022-10-04 11:39:541条回答A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移

已提交,审核后显示!提交回复
共1条回复
 我是流浪者 共回答了20个问题
我是流浪者 共回答了20个问题 |采纳率95%- 2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低.
A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;
B、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故B正确;
C、Na2O2→O2,O元素化合价升高,O2是氧化产物,故C正确;
D、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D正确.
故选A. - 1年前
相关推荐
- Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=
Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移 爱喝奶昔的笨笨1年前1
爱喝奶昔的笨笨1年前1 -
 cxstx 共回答了13个问题
cxstx 共回答了13个问题 |采纳率92.3%解题思路:从化合价变化的角度分析氧化还原反应中的有关概念的判断,根据化合价升降的数目计算反应中的电子转移数目.2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低.
A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;
B、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故B正确;
C、Na2O2→O2,O元素化合价升高,O2是氧化产物,故C正确;
D、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D正确.
故选A.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,题目难度不大,注意从化合价变化的角度分析有关概念和电子转移数目的计算.1年前查看全部
- (2012•惠州模拟)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2
(2012•惠州模拟)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术,制取Na2FeO4的反应为:Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法不正确的是( )
A.Fe2O3是反应的还原剂
B.Na2O2既是氧化剂又是还原剂
C.Na2FeO4反应的氧化产物
D.Na2FeO4能消毒杀菌是因其具有强氧化性 pucca_huxianng1年前1
pucca_huxianng1年前1 -
 落叶de飘零 共回答了19个问题
落叶de飘零 共回答了19个问题 |采纳率89.5%解题思路:Fe2O3+3Na2O2═2Na2FeO4+Na2O中,Fe元素的化合价由+3价升高为+6价,过氧化钠中O元素的化合价由-1价降低为-2价,以此来解答.A.因Fe元素的化合价升高,则Fe2O3是反应的还原剂,故A正确;
B.过氧化钠中O元素的化合价降低,则Na2O2是氧化剂,故B错误;
C.Fe元素的化合价升高,则被氧化,所以Na2FeO4反应的氧化产物,故C正确;
D.Na2FeO4具有强氧化性,所以能消毒杀菌,故D正确;
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,注意化合价与元素的性质关系,选项D为解答的难点,题目难度不大.1年前查看全部
- (2003•三水区)铁酸钠(Na2FeO4)是一种新型净水剂,铁酸钠中铁元素的化合价是( )
(2003•三水区)铁酸钠(Na2FeO4)是一种新型净水剂,铁酸钠中铁元素的化合价是( )
A.+2
B.+3
C.+5
D.+6 jiangdh1年前1
jiangdh1年前1 -
 cyuo12 共回答了21个问题
cyuo12 共回答了21个问题 |采纳率95.2%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,钠元素的化合价为+1,氧元素的化合价为-2,可得铁酸钠(Na2FeO4)中铁元素的化合价为:(+1)×2+x+(-2)×4=0,则x=+6,
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生对在化合物中正负化合价代数和为零计算指定元素化合价,在解题中应用的能力.1年前查看全部
- Na2FeO4(铁酸钠)中加入稀硫酸,溶液变黄,有无色气体生成的离子方程式
 彩色苹果5201年前2
彩色苹果5201年前2 -
 23066 共回答了19个问题
23066 共回答了19个问题 |采纳率89.5%离子方程式是:
4FeO42-+20H+==4Fe3++10H2O+3O2↑
无色气体是O2,溶液变黄是铁离子导致的.
希望对你有所帮助!1年前查看全部
- FeSO4 +Na2O2 = Na2FeO4 +Na2O +Na2SO4 +O2↑ 要具体点的方法
 泠泠111年前1
泠泠111年前1 -
 flyzhu 共回答了19个问题
flyzhu 共回答了19个问题 |采纳率89.5%化合价升高的有Fe2+、O22-
化合价降低的有O22-
所以把过氧化钠分开,一个专门负责升,一个专门负责降
FeSO4 + Na2O2 + Na2O2 → Na2FeO4 + Na2O + Na2SO4 + O2
Fe2+→FeO42-升高4
O22-→O2,升高2
O22-→2O2-,降低2
所以升高6,降低的×3
FeSO4 + Na2O2 + 3Na2O2 → Na2FeO4 + Na2O + Na2SO4 + O2
再看看Na,Na2O配系数2,即可
FeSO4 + 4Na2O2 == Na2FeO4 + 2Na2O + Na2SO4 + O2
哦,对了,是有好多种配法.
因为有反应:
2Na2O2 == 2Na2O + O2
随便乘一个系数跟上面一合并都是一个新的方程
FeSO4 + 6Na2O2 == Na2FeO4 + 4Na2O + Na2SO4 + 2O2
FeSO4 + 8Na2O2 == Na2FeO4 + 6Na2O + Na2SO4 + 3O2
.1年前查看全部
- (2009•深圳一模)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.某研究小组设计了用工业废铁屑(含铜、碳、硅等)制
(2009•深圳一模)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂.某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物.
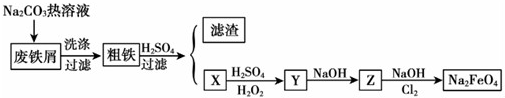
(1)废铁屑中加入碳酸钠热溶液的目的是______.
(2)试写出上述过程中X转化为Y的离子方程式______.
(3)写出Cl2将Z氧化为Na2FeO4的化学方程式______.
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理______.
(5)高铁酸钠还可以用电解法:Fe+2NaOH+2H2O=Na2FeO4+2H2↑,写出电解时阳极的电极反应式______. guochangjiong1年前1
guochangjiong1年前1 -
 liyulei 共回答了23个问题
liyulei 共回答了23个问题 |采纳率87%解题思路:依据流程图和实验目的分析判断,用工业废铁屑(含铜、碳、硅等)制取高铁酸钠,其中X、Y、Z是含铁化合物,碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,滤液为硫酸亚铁,加入硫酸和过氧化氢氧化亚铁离子为铁离子,加入氢氧化钠用生成氢氧化铁沉淀,在氢氧化钠溶液中通入氯气生成高铁酸钠;
(1)碳酸钠溶液水解显碱性清除废铁屑表面的油污;
(2)X为硫酸亚铁,Y为硫酸铁,硫酸亚铁加入过氧化氢和硫酸发生氧化还原反应;
(3)Z为氢氧化铁,在氢氧化钠溶液中氯气氧化氢氧化铁为高铁酸钠,依据原子守恒和氧化还原反应电子守恒配平书写化学方程式;
(4)高铁酸钠具有强氧化性能杀菌消毒,在反应过程中被还原为铁离子在水溶液中水解生成氢氧化铁胶体,胶体具有吸附悬浮杂质的作用起到净水作用;
(5)电解时阳极发生氧化反应,铁失电子生成高铁酸根离子,依据电解质溶液配平电荷守恒写出电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;依据流程图和实验目的分析判断,用工业废铁屑(含铜、碳、硅等)制取高铁酸钠,其中X、Y、Z是含铁化合物,碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质得到粗铁,加入硫酸,铁和硫酸反应生成硫酸亚铁,过滤得到滤渣为铜和硅,滤液为硫酸亚铁,加入硫酸和过氧化氢氧化亚铁离子为铁离子,加入氢氧化钠用生成氢氧化铁沉淀,在氢氧化钠溶液中通入氯气生成高铁酸钠;
(1)碳酸钠溶液水解显碱性,洗涤废铁屑表面油污,油脂在碱性溶液中水解生成溶于水的物质被洗去;
故答案为:清洗废铁屑表面的油污;
(2)X为硫酸亚铁,Y为硫酸铁,硫酸亚铁中加入过氧化氢在硫酸酸性溶液中发生氧化还原反应,反应生成铁离子和水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)Z为氢氧化铁,在氢氧化钠溶液中氯气氧化氢氧化铁为高铁酸钠,Cl2将Z为氢氧化铁氧化为Na2FeO4的化学方程式为:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
故答案为:10NaOH+3Cl2+2Fe(OH)3═2Na2FeO4+6NaCl+8H2O;
(4)Na2FeO4能消毒、净水的原因是高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用;
故答案为:高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3,具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用;
(5)电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了物质制备的实验过程分析和铁及其化合物性质的分析应用,电解池原理的分析判断,综合性强,难度中等,主要考查学生分析问题的能力,是高考的热点习题.1年前查看全部
- fe2o3+3na2o2=2na2feo4+na2o中为什么na2feo4既是氧化产物又是还原产
 shrek308ok1年前1
shrek308ok1年前1 -
 limzhu 共回答了15个问题
limzhu 共回答了15个问题 |采纳率100%fe从正三价变成正四价,O从负一价变成负二价.1年前查看全部
- 强碱下次氯酸钠与Fe(OH)3反应生成Na2FeO4,离子方程式:4OH- + 3ClO-
强碱下次氯酸钠与Fe(OH)3反应生成Na2FeO4,离子方程式:4OH- + 3ClO-
强碱下次氯酸钠与Fe(OH)3反应生成Na2FeO4,离子方程式:4OH-+3ClO-+2Fe(OH)2=2FeO4 2-+3Cl-+5H2O.求化学方程式(图中D项)
 tony_go1年前1
tony_go1年前1 -
 linaqwerttt 共回答了16个问题
linaqwerttt 共回答了16个问题 |采纳率93.8%4NaOH + 3NaClO +2Fe(OH)3 = 2Na2FeO4 + 3NaCl + 5H2O
其中NaOH是根据题意(强碱性环境)补的1年前查看全部
- 用铁酸钠(Na2FeO4)处理来自河流湖泊的水,以作为人们生活饮用水,是一项较新的技术,与此有关的以下叙述正确的是:①N
用铁酸钠(Na2FeO4)处理来自河流湖泊的水,以作为人们生活饮用水,是一项较新的技术,与此有关的以下叙述正确的是:①Na2FeO4溶液有强酸性 ②Na2FeO4溶液有强氧化性 ③Na2FeO4可使水软化 ④该过程中水被消毒和净化( )
A. ①③
B. ③④
C. ①②
D. ②④ frzhen1年前1
frzhen1年前1 -
 阗鬻髡 共回答了16个问题
阗鬻髡 共回答了16个问题 |采纳率81.3%解题思路:Na2FeO4为强碱弱酸盐,水解呈碱性,Fe元素化合价为+6价,具有强氧化性,可用于杀菌消毒,被还原生成Fe3+,水解和生成具有吸附性的氢氧化铁胶体,可用于净水.Na2FeO4为强碱弱酸盐,水解呈碱性,Fe元素化合价为+6价,具有强氧化性,则①错误,②、④正确;
不能除去溶液中的钙、镁等离子,不能使水软化,则③错误.
故选:D.点评:
本题考点: 盐类水解的应用;氧化还原反应.
考点点评: 本题考查氧化还原反应和盐类的水解,侧重于化学与生活的考查,注意把握物质的性质,难度不大.1年前查看全部
- Na2FeO4是一种高效多功能水处理剂,应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示如下2FeSO4+6
Na2FeO4是一种高效多功能水处理剂,应用前景广阔.一种制备Na2FeO4的方法可用化学方程式表示如下2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑.对此反应下列说法中正确的是x05( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是还原产物
D.2mol FeSO4发生反应时,共有8mol电子转移 哭泣海豚1年前1
哭泣海豚1年前1 -
 kintom 共回答了12个问题
kintom 共回答了12个问题 |采纳率100%2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,方程式没写错.
Fe从+2价到了+6价,共失去了4*2=8个电子.D正确.
Na2O2在反应中O从-1价升高到O2的0价,又降低为Na2O中的-2价.所以既是还原剂又是氧化剂.A错.
Na2FeO4中只有Fe由+2价升到+6价,属于氧化产物.B错.
O2是Na2O2中的-1价的O变来的,化合价升高是氧化产物.C错.
纯手打!1年前查看全部
- Fe(OH)3 +NaOH+Cl2===Na2FeO4 +NaCl +H2O怎么配
 qiusizu1年前2
qiusizu1年前2 -
 李宇春就是GAY 共回答了20个问题
李宇春就是GAY 共回答了20个问题 |采纳率100%Fe(+3)→Fe(+6),升3价
Cl2(0)→Cl(-1),降1*2=2价
按照Fe:Cl2 = 2:3配
按照Fe与Cl→Na→H→O的顺序依次配平各元素:
2Fe(OH)3 + 10NaOH + 3Cl2 == 2Na2FeO4 + 6NaCl + 8H2O1年前查看全部
- 新型净水剂高铁酸钠Na2FeO4中铁元素化合价是多少...
 87cissy411年前2
87cissy411年前2 -
 koala_kele 共回答了7个问题
koala_kele 共回答了7个问题 |采纳率85.7%Fe:+6
Na:+1
O:-21年前查看全部
- 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
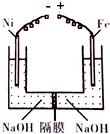 工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
工业上可用如图原理来制备高铁酸钠(Na2FeO4),下列说法正确的是( )
A.该装置实现了主要的能量转化:化学能→电能
B.Ni电极反应:4OH--4e-=2H2O+O2↑
C.装置右侧的OH-通过隔膜移向左侧
D.一段时间后,充分混合两端液体,溶液pH值会增小 耿寒1年前1
耿寒1年前1 -
 112286588 共回答了13个问题
112286588 共回答了13个问题 |采纳率92.3%解题思路:用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠,则铁作阳极,镍作阴极,阳极上铁失电子发生氧化反应,电极方程式为Fe-6e-+8OH-═FeO42-+4H2O,阴极发生还原反应,电极方程式为2H2O+2e-=H2↑+2OH-,据此分析解答.A.该装置是将电能转化为化学能的装置,为电解池,故A错误;
B.镍电极上电极反应式为2H2O+2e-=H2↑+2OH-,故B错误;
C.装置左侧的OH-通过隔膜移向右,故C错误;
D.阳极电极反应式为Fe-6e-+8OH-═FeO42-+4H2O,阴极电极方程式为2H2O+2e-=H2↑+2OH-,当得失电子相等时,消耗氢氧根离子的物质的量大于生成氢氧根离子的物质的量,二者混合时,所以溶液的pH减小,故D正确;
故选D.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了电解原理,明确阴阳极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.1年前查看全部
- Na2FeO4中铁的化合价Na2FeO4中铁元素的+6价是如何形成的?能不能从原子结构角度解释一下?
 wanglt10261年前2
wanglt10261年前2 -
 KOKL 共回答了17个问题
KOKL 共回答了17个问题 |采纳率94.1%Na2FeO4中.因为Na的化合价为+1价,因为有两个钠原子,所以2Na就有+2价,又因为氧元素的化合价为-2价,有4个氧原子所以就是4O,-8.正负化合价代数和为零,所以Fe的化合价为+6价.1年前查看全部
- 用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO
用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术.已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O.下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4对河水,湖水消毒的同时,还能起到净水的作用
C.3molNa2O2发生反应,有12mol电子转移
D.Na2FeO4具有较强的还原性,因而能对河水、湖水进行消毒杀菌
求解释B中的“起到净水的作用 ”
解析说FeO42-被还原成Fe3+,水解产生Fe(OH)3胶体可以使水中悬浮物凝聚沉降
讲一下是FeO42-与水反应生成Fe3+的吗?否则是怎样的? haoqq551年前1
haoqq551年前1 -
 傻笨熊 共回答了21个问题
傻笨熊 共回答了21个问题 |采纳率95.2%是FeO42-具有强氧化性,与水中的细菌病毒体反应(消毒过程:氧化细菌病毒体)被还原生成Fe3+,Fe3+水解产生Fe(OH)3胶体可以使水中悬浮物凝聚沉降1年前查看全部
- KIO3 I的化合价 Na2FeO4 Fe的化合价 KIO3 I的化合价 H2SO4 S的
KIO3 I的化合价 Na2FeO4 Fe的化合价 KIO3 I的化合价 H2SO4 S的
KIO3 I的化合价 Na2FeO4 Fe的化合价 KIO3 I的化合价 H2SO4 S的化合价 四圈1年前1
四圈1年前1 -
 195728042 共回答了9个问题
195728042 共回答了9个问题 |采纳率88.9%Na2FeO4 分子式有错吧,KIO3 I的化合价是+5价!H2SO4 S的化合价是+6价!1年前查看全部
- (2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH
(2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O.
(1)物质X的化学式为______.
(2)若某化工厂需要生产332t高铁酸钠,则需要氢氧化钠的质量为多少? sz_vincent1年前1
sz_vincent1年前1 -
 yongjun72 共回答了20个问题
yongjun72 共回答了20个问题 |采纳率100%解题思路:(1)根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式;
(2)根据化学方程式进行计算,根据已知的高铁酸钠的质量计算未知的氢氧化钠的质量.(1)因为反应前后各元素原子个数相等,X的化学式为NaCl
(2)根据化学方程式,通过物质间的比例关系,可用高铁酸钠的质量计算氢氧化钠的质量:答案为:
设:需要NaOH的质量为x.
2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O
160 332
x 332t
[160/x=
332
332t]
x=160t
答:需要NaOH的质量为160t.点评:
本题考点: 根据化学反应方程式的计算;有关化学式的计算和推断.
考点点评: 根据化学方程式进行计算时,物质的质量比要找准确,数据的计算要准确,步骤要完整.1年前查看全部
- 如何制备高铁酸(H2FeO4)高铁酸钠(Na2FeO4)是高效净水剂,但是高铁酸钠不可避免地要向自来水中引入钠离子,如何
如何制备高铁酸(H2FeO4)
高铁酸钠(Na2FeO4)是高效净水剂,但是高铁酸钠不可避免地要向自来水中引入钠离子,如何才能制得不含金属阳离子的高铁酸,百度百科上虽然有高铁酸,但是没有说怎么制取的 乌龟壳壳1年前1
乌龟壳壳1年前1 -
 yulin22 共回答了17个问题
yulin22 共回答了17个问题 |采纳率94.1%高铁酸在水溶液中是无法存在的,因此谁体系制备不现实.
因为高铁酸根离子酸性条件下的标准电极电势φ(FeO4 2-/Fe3+)=2.20V ,
此值大于水在酸性介质中氧化为O2的实际标准电极电势φ(H2O/O2)=2.1V(理论值更小,为1.229V,但大于实际值才能与水反应),可以与水反应
而高铁酸又在水中几乎完全电离,溶液强酸性,因此高铁酸在水中一生成就会氧化水而分解变为Fe3+或Fe(OH)3,无法稳定存在.
故高铁酸水溶液是无法制备的.
但是非水体系中可能可以进行制备.
比如在惰性质子溶剂、纯的强酸中进行反应.
这里没有找到相关制备的文献.但我猜想在发烟硫酸中可能可以进行制备(硫酸中S为最高氧化态,非常稳定,不会被高铁酸根离子氧化).
将高铁酸钠溶于发烟硫酸,由于发烟硫酸自偶电离很强,其酸性接近高氯酸,较之高铁酸要强,应该可以得到高铁酸的发烟硫酸溶液,同时生成硫酸钠(溶解在发烟硫酸中)减压蒸发浓缩,迅速降温使高铁酸晶体析出而硫酸钠留在发烟硫酸中(利用好硫酸钠的溶解度曲线,注意控温区间不使硫酸钠伴随析出),最终在严格干燥的环境下过滤,可能可以得到高铁酸.但此法的产率应该比较低,因为要考虑高铁酸的自发分解等其他因素,以及各种不可预见的干扰.
个人思考,仅供参考.1年前查看全部
- 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型水剂,它的氧化性比高酸锰钾更强,
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型水剂,它的氧化性比高酸锰钾更强,
本身在反应中被还原为Fe+离子.制取铁酸钠的化学方程式如下:
2Fe(NO3)3+16NaOH+3Cl2=2Fa2FeO4+6NaNO3+6NaCl+8H2O
(1).在上述反应中( )元素被氧化,当3molCl2参与反应时,转移电子的总数为( )
(2).铁酸钠之所以能净水,除了能消毒外,另一个原因是( ) 不可思议的鸭子1年前1
不可思议的鸭子1年前1 -
 zk138 共回答了18个问题
zk138 共回答了18个问题 |采纳率83.3%(1).在上述反应中( Fe )元素被氧化,---------------因为Fe元素的化合价升高,从Fe(NO3)3中的+3价,升高到Na2FeO4中的+6价
当3molCl2参与反应时,转移电子的总数为( 6mol )-----------因为每个Cl得到1个电子,3molCl2即得到6mol电子,或者每个Fe失去3个电子,2molFe(NO3)3即失去6mol电子
(2).铁酸钠之所以能净水,除了能消毒外,另一个原因是( 在消毒反应中,Na2FeO4会生成Fe3+,水解生成Fe(OH)3胶体,具有较强的吸附作用,吸附水中的杂质而沉降,起到净水的作用 )1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A.高铁酸钠是氧化物
B.高铁酸钠中铁元素的化合价为+6价
C.高铁酸钠是一种新型的有机化合物
D.高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 注定要孤独1年前1
注定要孤独1年前1 -
 nvhai11nvhai 共回答了16个问题
nvhai11nvhai 共回答了16个问题 |采纳率93.8%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.
B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知高铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,故此答案正确.
C、高铁酸钠(Na2Fe04)不含碳元素,不属于有机物,故此答案错误.
D、元素不能用个数进行计数,故此答案错误.
故选:B.点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 高中化学 次氯酸钠与氢氧化铁反应生成Na2FeO4 写它的离子方程式
高中化学 次氯酸钠与氢氧化铁反应生成Na2FeO4 写它的离子方程式
为什么是生成氯离子和水而不是其他的? 是在碱性环境下 belle08091年前3
belle08091年前3 -
 edwoodedwood 共回答了22个问题
edwoodedwood 共回答了22个问题 |采纳率86.4%写离子方程式,为了确保得分,通常先写化学反应方程式,再改写成离子方程式.
此反应的化学反应方程式为:三摩尔次氯酸钠和两摩尔氢氧化铁和四摩尔氢氧化钠反应生成两摩尔高铁酸钠和三摩尔氯化钠和五摩尔水.
所以离子方程式为:3Clo-+2Fe(OH)3+4OH﹣==2FeO4²﹣+3Cl﹣+5H2O
"为什么是生成氯离子和水而不是其他的? "
次氯酸钠中的氯显正一价,有强氧化性,通常被还原至负一价,即氯离子.
在写离子方程式时,有一句非常好用的口诀:一电子,二电荷. 所谓一电子就是说先通过氧化还原得失电子守恒将发生氧化还原反应的各反应物系数配好;二电荷是指通过电荷守恒将方程式左右两端的电荷配平,通常是要往上加带电荷的粒子.而这些粒子在中学阶段只有氢氧根、氢离子和水.(注:在反应物或生成物一侧加氢离子或氢氧根,在另一端一定加水.)而加什么通常要看题意,题中说在碱性条件下,所以在反应物一侧加氢氧根,则生成物一侧就加水.
所以反应为3Clo-+2Fe(OH)3+4OH﹣==2FeO4²﹣+3Cl﹣+5H2O1年前查看全部
- 高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已
高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+.已知制取高铁酸钠的化学方程式为:
2Fe(NO3)3+16NaOH+3Cl2===2Na2FeO4+6NaNO3+6NaCl+8H2O,回答下列问题:
(1)该反应中________得到电子,表现____________(填“氧化性”或“还原性”),Na2FeO4为________(填“氧化剂”、“还原剂”、“氧化产物”或“还原产物”).
(2)若有1 mol Cl2参加反应,则反应中转移电子的物质的量为________.
(3)Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的
Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案 (1)Cl2 氧化性 氧化产物 (2)2 mol (3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的
第2题的计算过程要详细点 pipi79781年前2
pipi79781年前2 -
 zhtlc 共回答了15个问题
zhtlc 共回答了15个问题 |采纳率86.7%解析
反应物Fe(NO3)3中铁显+3价,生成物Na2FeO4中铁显+6价,Fe(NO3)3中的Fe3+失去电子,表现还原性,而反应物Cl2中氯显0价,生成物NaCl中氯显-1价,Cl2得到电子,表现氧化性,因铁的化合价反应后升高,故Na2FeO4为氧化产物.
答案
(1)Cl2 氧化性 氧化产物 、
(2)2 mol
(3)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的1年前查看全部
- 在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于高铁酸钠的说法正确的是( )
A. 高铁酸钠是氧化物
B. 高铁酸钠中铁元素的化合价为+6价
C. 高铁酸钠是一种新型的有机化合物
D. 高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质 天使ww_58581年前1
天使ww_58581年前1 -
 骆驼ci 共回答了13个问题
骆驼ci 共回答了13个问题 |采纳率100%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断.
B、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.
C、根据含有碳元素的化合物叫有机化合物,简称有机物,据此进行分析判断.
D、利用元素不能用个数进行计数解决此题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据高铁酸钠(Na2Fe04),高铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故此答案错误.B、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负...
点评:
本题考点: 化学式的书写及意义;从组成上识别氧化物;有机物与无机物的区别;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- (2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
(2007•定西)高铁酸钠(Na2FeO4)是一种高效多功能的水处理剂.它和水反应不可能生成( )
A.氧气
B.碳酸钠
C.氢氧化钠
D.氢氧化铁 wolaikankan51881年前1
wolaikankan51881年前1 -
 luankk 共回答了13个问题
luankk 共回答了13个问题 |采纳率76.9%解题思路:本题考查的是质量守恒定律,反应前后元素的种类和质量不变.本题中高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠;反应前有氧元素,因此反应后可能生成氧气;反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠;反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁.A、反应前有钠、铁、氧、氢四种元素,因此反应后可能生成氧气,故选项错误;
B、高铁酸钠(Na2FeO4)与水反应时,反应前有钠、铁、氧、氢四种元素,因此反应后也是钠、铁、氧、氢四种元素,而碳酸钠中有碳元素,因此不可能生成碳酸钠,故选项正确;
C、反应前有钠、氧、氢元素,因此反应后可能生成氢氧化钠,故选项错误;
D、反应前有铁、氧、氢元素,因此反应后可能生成氢氧化铁,故选项错误;
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本考点是有关质量守恒定律的实验探究,有关质量守恒定律的考题在中考中经常出现,要抓住要点:五个一定不变,一个一定变.本考点经常出现在选择题、填空题和实验题中.1年前查看全部
- Na2FeO4中铁元素的化合价是什么?
 mayanlong1471年前0
mayanlong1471年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4
(2009•肇庆二模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
干法制备的主要反应方程为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法正确的是( )
A.高铁酸钾中铁显+6价
B.湿法中FeO42-是还原产物
C.干法中每生成1mol Na2FeO4 转移4mol电子
D.K2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 bluemen1年前1
bluemen1年前1 -
 dudubear1 共回答了17个问题
dudubear1 共回答了17个问题 |采纳率94.1%解题思路:A、根据化合物中正负化合价的代数和为0进行解答;
B、还原产物是氧化剂被还原得到的产物;
C、化合价升高数=化合价降低数=转移电子数;
D、依据高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂分析.A、根据高铁酸钾的化学式(K2FeO4)可知,设铁元素的化合价为x,则+1×2+x+(-2)×4=0,解得x=+6,故A正确;
B、湿法中FeO42-是氧化产物,故B错误;
C、反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,铁元素化合价升高,每生成2molNa2FeO4,转移电子总数=化合价升高总数=化合价降低总数=8mol,所以每生成1molNa2FeO4共转移4mol电子,同时1molNa2O2变化生成1molO2,化合价升高,转移电子物质的量为2mol,所以共转移电子10mol,故C错误;
D、K2FeO4具有氧化性所以能杀菌,H2S、NH3具有还原性被氧化,高铁酸钾与水反应时生成的Fe(OH)3(胶体)具有净水作用,故D正确;
故选AD.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算;氧化还原反应的计算.
考点点评: 本题考查了氧化还原反应的化合价变化判断,概念分析和电子转移数计算,熟练掌握氧化还原反应的特征是化合价变化是关键.1年前查看全部
- (2012•石家庄一模)目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(2012•石家庄一模)目前高铁酸钠(Na2FeO4)被广泛应用于水处理,具有高效、无毒的优点.
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式
______Fe(OH)3+______ClO-+______=______FeO42-+______Cl-+______
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和0H-未列出):
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2•7H20,过程如下:离子 SO42- Mg2+ Fe3+ Na+ Cl- 浓度(mol/L) a 0.05 0.10 0.50 0.58 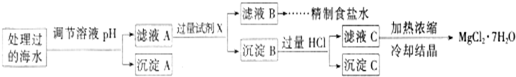
注:离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38 Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积变化忽略不计.
①表格中的a______0.16 (填“<”、“>”或“=”).
②沉淀A的组成为______ (填化学式)
③加入的过量试剂X为______ (填化学式)
④加入过量HCl的作用为______. 玉猪儿1年前1
玉猪儿1年前1 -
 gao7331195 共回答了21个问题
gao7331195 共回答了21个问题 |采纳率95.2%解题思路:(1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物还有OH-,OH-系数为4,根据H元素、O元素守恒可知,生成物含有H2O,其系数为5.
(2)①由表中Mg2+、Fe3+的浓度及Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,该溶液呈酸性,再利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),据此判断.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,据此判断X.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,抑制Mg2+水解.(1)反应中Fe(OH)3→FeO42-,Fe元素化合价由+3升高为+6价,总共升高3价,ClO-→Cl-,Cl元素化合价由+1价降低为-1价,总共降低2价,化合价升降最小公倍数为6,故Fe(OH)3系数为2,故ClO-系数为3,由元素守恒可知,FeO42-系数为2,Cl-系数为3,根据电荷守恒可知,反应物还有OH-,OH-系数为4,根据H元素、O元素守恒可知,生成物含有H2O,其系数为5,配平后的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
故答案为:2、3、4OH-,2、3、5H2O.
(2)①由Ksp[Fe(OH)3、Ksp[Mg(OH)2]可知,Mg2+完全沉淀时c(OH-)=10-7mol/L,Fe3+完全沉淀时c(OH-)=10-11mol/L,由表中Mg2+、Fe3+的浓度可知,该溶液呈酸性,c(H+)>c(OH-),利用电荷守恒可知,2c(SO42-)+c(Cl-)+c(OH-)=2c(Mg2+)+3c(Fe3+)+c(Na+)+c(H+),即2a+0.58+c(OH-)=2×0.05+3×0.1+0.5+c(H+),整理2a=0.32+c(H+)-c(OH-),由于c(H+)>c(OH-),所以a>0.16.
故答案为:>.
②由工艺流程图可知,处理的海水调节PH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3.
故答案为:Fe(OH)3.
③由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2.
故答案为:Ba(OH)2.
④由工艺流程图可知,盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,可以抑制Mg2+水解.
故答案为:使Mg(OH)2全部溶解转化为MgCl2;在加热浓缩滤液C时抑制Mg2+水解.点评:
本题考点: 氧化还原反应方程式的配平;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 考查氧化还原反应、溶度积计算、沉淀转化、溶液的有关计算、对化学工艺流程的理解、物质的分离提纯等,难度中等,(2)①为易错点、难点,根据电荷守恒判断原理、判断溶液的酸碱性是关键.1年前查看全部
- (2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH
(2009•西城区二模)高铁酸钠是一种新型净水剂,它的化学式为Na2FeO4,高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O.
(1)物质X的化学式为NaClNaCl.
(2)若某化工厂需要生产332t高铁酸钠,则需要氢氧化钠的质量为多少? ly73771年前1
ly73771年前1 -
 mophyc 共回答了19个问题
mophyc 共回答了19个问题 |采纳率94.7%(1)因为反应前后各元素原子个数相等,X的化学式为NaCl
(2)根据化学方程式,通过物质间的比例关系,可用高铁酸钠的质量计算氢氧化钠的质量:答案为:
设:需要NaOH的质量为x.
2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O
160 332
x 332t
160
x=
332
332t
x=160t
答:需要NaOH的质量为160t.1年前查看全部
- na2feo4在硫酸存在的条件下,将Mn^2+氧化为MnO4^-,而自身被还原Fe^3+的离子方程式
 tandy88581年前1
tandy88581年前1 -
 松林ss 共回答了16个问题
松林ss 共回答了16个问题 |采纳率93.8%离子方程式:
5FeO4^2- + 3Mn2+ + 16H+ == 5Fe3+ + 3MnO4- + 8H2O1年前查看全部
- (2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧
 (2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012•朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: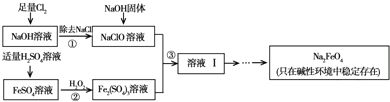
回答下列问题:
(1)氢氧化钠的电子式是______.
(2)经过步骤①后,加入NaOH固体的原因是______.
(3)步骤②反应的离子方程式是______.
(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为______.
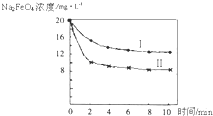
(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH______(填“高”或“低”).
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的______(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是______(答出两点即可). gou7891年前1
gou7891年前1 -
 daocaoren_home 共回答了23个问题
daocaoren_home 共回答了23个问题 |采纳率78.3%解题思路:(1)依据氢氧化钠的化学键的形成过程和电子式书写方法写出电子式;
(2)加入氢氧化钠可以调节溶液显碱性,易生成高铁酸钠;
(3)依据流程分析判断,步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,依据电子守恒、电荷守恒和原子守恒反应的离子方程式;
(4)碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式依据氧化还原反应电子守恒和原子守恒配平得到;
(5)依据高铁酸根离子发生的还原反应分析判断;
(6)依据高铁酸钠和氯气得到电子转化关系计算分析,根据高铁酸钠是强氧化剂,得到电子生成氢氧化铁胶体分析判断;(1)氢氧化钠是两种化合物,由钠离子和氢氧根离子构成,氢氧根中氧原子和氢原子形成共价键,电子式为:
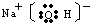 ;
;
故答案为: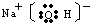
(2)步骤①是制备次氯酸钠的过程,加入氢氧化钠目的是调节溶液显碱性,因为Na2FeO4只在碱性环境中稳定存在;
故答案为:Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性;
(3)步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)反应③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)依据高铁酸钠在碱性溶液中稳定存在,发生的反应为:FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-,污水的PH越高平衡逆向进行,PH越小平衡正向进行,依据图象分析Ⅱ先达到平衡需要的时间短,反应速率快,说明污水PH小,曲线I比曲线II对应的污水的PH高;
故答案为:高;
(6)FeO42-+3e-+4H2O⇌Fe(OH)3+5OH-,单位质量得到电子[3/166]=0.018
Cl2+2e-=2Cl-,单位质量得到电子[2/71]=0.028,所以Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用;
故答案为:低,既能消毒杀菌又能净水(或无毒或方便保存等);点评:
本题考点: 制备实验方案的设计;铁盐和亚铁盐的相互转变.
考点点评: 本题考查了物质制备实验流程的分析判断,主要是物质性质,题干信息的应用,离子方程式 的书写是解题关键,题目难度中等.1年前查看全部
- 高铁酸钠(NA2FEO4)是一种高效的饮用水处理剂,工业上可由下列方法制得
高铁酸钠(NA2FEO4)是一种高效的饮用水处理剂,工业上可由下列方法制得
Fe2o3+3Na2O2=2Na2FeO4+Na2O 生成一mol Na2FeO4,有6mol电子转移.这个应该怎么判断,铅球详解
 炭烧虾1年前1
炭烧虾1年前1 -
 我们三儿 共回答了24个问题
我们三儿 共回答了24个问题 |采纳率100%错了,应该是 每生成1 mol Na2FeO4转移 3 mol e-
Fe的化合价升高 +3→+6,Fe2O3中有2个Fe,所以Fe2O3失去6 e-,
O的化合价降低 -1→-2,3 Na2O2中有6个Na,所以Na2O2得到6 e-,
即反应转移电子数为 6e-,
每生成2 mol Na2FeO4转移 6 mol e-,所以 每生成1 mol Na2FeO4转移 3 mol e-1年前查看全部
- 高铁酸钠(Na2FeO4)中铁元素的化合价为?
 njsn1年前2
njsn1年前2 -
 春风风人夏雨雨人 共回答了16个问题
春风风人夏雨雨人 共回答了16个问题 |采纳率75%NA2FEO4
2NA+
4O2-
2-8=-6
FE6+铁的化合价是正六价.1年前查看全部
- 铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高猛酸钾还强,本身在反应中被还原为Fe?﹢.问:
铁酸钠(na2feo4)是水处理过程中使用的一种新型净水剂,它的氧化性比高猛酸钾还强,本身在反应中被还原为fe?﹢.问:配平制取铁酸钠的化学方程式 fe(no3)3+ naoh+ cl2 = na2feo4+ nano3+ nacl+ h2o.一定要交方法呀,这种题没方法想好久的,简直***的···
 xjfk初一4班1年前1
xjfk初一4班1年前1 -
 心力衰竭1 共回答了16个问题
心力衰竭1 共回答了16个问题 |采纳率93.8%用电子得失法硝酸铁中铁为+3价,到铁酸钠中铁为+6价,失去3个电子.氯气中氯0价,得到一个电子.又因为有两个氯,乘2,所以,得到2个电子.2和3乘以他们的最小公倍数.所以,硝酸铁的系数为2,氯气为3,再观察法来配平.配完之后,计算左右两边的氧原子个数来检查是否正确最后答案是2 16 3 2 6 6 8 面对氧化还原题,教叫你一句口诀 失(失去电子)升(化合价升高)氧(氧化反应)还(还原剂)这是对一种物质而言1年前查看全部
- Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=
Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移 new_tenant1年前1
new_tenant1年前1 -
 winyjm 共回答了21个问题
winyjm 共回答了21个问题 |采纳率85.7%2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑反应中,Fe元素的化合价升高,由+2价升高到+6价,Na2O2中O元素的化合价既升高又降低.
A、Na2O2中O元素的化合价既升高又降低,反应中既是氧化剂又是还原剂,故A错误;
B、FeSO4→Na2FeO4,Fe的化合价升高,Na2FeO4是氧化产物,Na2O2→Na2FeO4,O元素化合价降低,Na2FeO4是还原产物,故B正确;
C、Na2O2→O2,O元素化合价升高,O2是氧化产物,故C正确;
D、反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D正确.
故选A.1年前查看全部
- 用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2
用高铁酸钠(Na2FeO4)是一种新型净水剂,主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═nNa2FeO4+3X+5H2O.下列说法中正确的是( )
A.该反应中,铁元素的化合价没有改变
B.该反应中X的化学式为NaCl
C.该反应中化学计量数n=4
D.该反应属于置换反应 wyf9812211年前1
wyf9812211年前1 -
 一只鞋走世界 共回答了21个问题
一只鞋走世界 共回答了21个问题 |采纳率85.7%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行解答;B、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式;C、根据质量守恒定律的实质,反应前后各元素的原子个数相等推断n的值;D、根据置换反应的概念分析.A、该反应中,反应物Fe(OH)3中铁元素的化合价为+3价,生成物Na2FeO4中铁元素的化合价为+6价,故A说法错误;
B、因为反应前后各元素原子个数相等,X的化学式为NaCl,故B说法正确;
C、根据反应前Fe原子的数目为2,可得n=2,故C说法错误;
D、一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应叫做置换反应.可见该反应不是置换反应,故D说法错误;
故选:B.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;反应类型的判定;质量守恒定律及其应用.
考点点评: 本题考查化合价原则、置换反应的定义以及质量守恒定律的内容,考查注重基础.1年前查看全部
- (2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(
(2014•松江区一模)高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂.湿法制备的离子反应方程式:2Fe(OH)3+3ClO-+4OH-→2FeO42-+3Cl-+5H2O;干法制备化学反应方程式:2FeSO4+4Na2O2→2Na2FeO4+2Na2SO4.有关分析错误的是( )
A.等物质的量Na2FeO4氧化能力优于次氯酸钠
B.湿法中氢氧化铁被氧化
C.干法中每生成1mol Na2FeO4转移3mol电子
D.高铁酸钠的氧化性大于次氯酸钠 欢喜虫虫1年前1
欢喜虫虫1年前1 -
 等待你的猫 共回答了21个问题
等待你的猫 共回答了21个问题 |采纳率90.5%解题思路:A.根据等物质的量的氧化剂得电子数目判断;
B.湿法中铁元素化合价升高;
C.铁元素化合价由+2价升高到+6价;
D.根据氧化剂氧化性大于氧化产物的氧化性判断.A.用作净水剂时,1molNa2FeO4可到3mol电子,被还原生成Fe(OH)3,1molNaClO得2mol电子,被还原生成Cl-,则等物质的量Na2FeO4氧化能力优于次氯酸钠,故A正确;
B.湿法中铁元素化合价升高,被氧化,故B正确;
C.干法制备中铁元素化合价由+2价升高到+6价,则每生成1mol Na2FeO4转移4mol电子,故C错误;
D.氧化还原反应中,氧化剂氧化性大于氧化产物的氧化性,可知次氯酸钠的氧化性较强,故D错误.
故选CD.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,为高考高频考点,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该类题目,难度不大.1年前查看全部
- (2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→
(2005•乐山一模)铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2→FeO
+Cl-+H2O,该反应的离子方程式中H2O的化学计量数是( )2−4
A.4
B.6
C.10
D.8 lemon01091年前1
lemon01091年前1 -
 紫风傲剑狂刀 共回答了21个问题
紫风傲剑狂刀 共回答了21个问题 |采纳率90.5%解题思路:先分析化合价变化,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,化合价降低了1价,根据化合价升高降低相等计算出铁离子和氯离子的化学计量数,再根据电荷守恒计算出氢氧根离子的计量数,最后根据氢原子守恒计算出水的化学计量数.反应Fe3++OH-+Cl2→FeO42-+Cl-+H2O中,铁元素化合价:+3价→+6,化合价升高了3价;氯元素化合价:0→-1,Cl2参加反应,化合价降低了1×2价,化合价变化的最小公倍数为6,所以Fe3+的化学计量数为2、Cl2的化学计量数为3,根据氯原子守恒,Cl-的计量数为6,即2Fe3++OH-+3Cl2→2FeO42-+6Cl-+H2O,根据电荷守恒,OH-的计量数为16,根据氢原子守恒,水的化学计量数为为:[16/2]=8,
故选D.点评:
本题考点: 离子方程式的书写;氧化还原反应.
考点点评: 本题考查了氧化还原反应的配平,题目难度中等,注意配平氧化还原反应中电子守恒、电荷守恒的应用,该题是高考中的高频题,侧重对学生能力的培养和训练;该题有助于培养学生分析问题、解决问题的能力及灵活应用所学知识能力.1年前查看全部
- (2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是(
(2006•广安)高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其中铁元素的化合价是( )
A.+2价
B.十3价
C.+4价
D.+6价 hulihula20001年前1
hulihula20001年前1 -
 wzh_bird 共回答了19个问题
wzh_bird 共回答了19个问题 |采纳率84.2%解题思路:根据在化合物中正负化合价代数和为零,结合高铁酸钠(Na2FeO4)的化学式进行解答本题.根据在化合物中正负化合价代数和为零,钠元素显+1,氧元素显-2,设铁元素的化合价是x,可知高铁酸钠(Na2FeO4)中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6.
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题难度不大,考查学生利用化合价的原则计算指定元素的化合价的能力.1年前查看全部
- 在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
在水的净化处理中,铁酸钠(Na2FeO4)是一种新型高效的水处理剂.下列关于铁酸钠说法正确的是( )
A.铁酸钠属于氧化物
B.河水用铁酸钠处理后变为纯水
C.铁酸钠中铁元素的化合价为+6价
D.铁酸钠中铁元素的化合价为+3价 兰若寺的高小胖1年前1
兰若寺的高小胖1年前1 -
 8美丽8 共回答了26个问题
8美丽8 共回答了26个问题 |采纳率92.3%解题思路:A、氧化物是指含有两种元素且其中一种是氧元素的化合物,由铁酸钠的化学式进行分析判断;
B、根据纯净物与混合物的区分方法进行分析判断;
C、根据化合价的计算方法判断;
D、根据在化合物中正负化合价代数和为零,结合铁酸钠的化学式进行解答本题.A、氧化物是由两种元素组成且含有氧元素的化合物,根据铁酸钠(Na2Fe04),铁酸钠由钠、铁、氧三种元素组成,不属于氧化物;故A错;
B、用铁酸钠处理后的河水中含有可溶性的钙镁化合物等,属于混合物;故B错;
C、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,故C正确;
D、钠元素显+1,氧元素显-2,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可知铁酸钠中铁元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6;故D错.
故选C.点评:
本题考点: 从组成上识别氧化物;有关元素化合价的计算.
考点点评: 本题难度不大,掌握氧化物的特征、纯净物与混合物的区分方法、有机物的特征、利用化合价的原则计算指定元素的化合价的方法是正确解答本题的关键.1年前查看全部
- 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4的离子方程式
 urephjfi1年前1
urephjfi1年前1 -
 xw2kmx 共回答了15个问题
xw2kmx 共回答了15个问题 |采纳率86.7%3ClO- +2Fe(OH)3 + 4OH- ==2FeO4 2- +5H2O +3Cl-1年前查看全部
- (2013•永春县模拟)高铁酸钠(Na2FeO4)是一种饮用水的高效消毒剂,可由下列方法制得:Fe2O3+3Na2O2&
(2013•永春县模拟)高铁酸钠(Na2FeO4)是一种饮用水的高效消毒剂,可由下列方法制得:Fe2O3+3Na2O2
2Na2FeO4+Na2O,关于该反应说法正确的是( )高温 .
A.Na2FeO4属于共价化合物
B.反应中Na2O2是氧化剂
C.生成1mol Na2FeO4,有6mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性 真是麻烦啊啊啊啊1年前1
真是麻烦啊啊啊啊1年前1 -
 GRILL 共回答了16个问题
GRILL 共回答了16个问题 |采纳率87.5%解题思路:首先判断元素的化合价,从化合价变化的角度分析氧化还原反应,根据化合价的变化判断电子转移的数目并判断物质的性质.A.Na2FeO4属于离子化合物,故A错误;
B、Na2O2中O元素的化合价由-1价变为-2价,被还原,Na2O2为氧化剂,故B正确;
C、反应中Fe元素的化合价由+3价升高到+6价,Na2FeO4被氧化,生成1mol Na2FeO4,有3mol电子转移,故C错误;
D、在Na2FeO4中Fe为+6价,具有强氧化性,故D错误.
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析.1年前查看全部
- 4Na2FeO4+10H2O=4Fe(OH)3+3O2↑+8NaOH 的反应机理?
 lsy887yy11年前2
lsy887yy11年前2 -
 tt脸爱tt 共回答了20个问题
tt脸爱tt 共回答了20个问题 |采纳率95%Na2FeO4中的铁是+6价,有较强的氧化性,可以将-2价的氧原子氧化成氧气.1年前查看全部
- Na2FeO4 怎么求每个元素符号的化合价?
 神州行不行1年前4
神州行不行1年前4 -
 dazzlingman 共回答了21个问题
dazzlingman 共回答了21个问题 |采纳率95.2%Na,O一般来说都不变价,所以分别是+1,-2
这样推得Fe是+6价1年前查看全部
- Na2FeO4中铁元素的化合价
 woneyane1年前1
woneyane1年前1 -
 Darling1981 共回答了13个问题
Darling1981 共回答了13个问题 |采纳率84.6%+6价1年前查看全部
- 高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2
高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________.
我想知道的是 仅凭题目给的条件 我怎么知道要选NAOH? 电子翅膀1年前1
电子翅膀1年前1 -
 浓仪 共回答了12个问题
浓仪 共回答了12个问题 |采纳率91.7%肯定要选含Na的,不选硫酸钠是因为这样得不到纯净的高铁酸钠,选氢氧化钠,当OH-放电完毕之后,溶液中就没有其他杂质了.1年前查看全部
- (2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O
(2013•盐城一模)用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知获得高铁酸钠的反应为:Fe2O3+mNa2O2=nNa2FeO4+Na2O,下列说法中正确的是( )
A.Na2FeO4中,铁元素的化合价+6价
B.消毒的作用是除去水中可溶性杂质
C.化学计量数m=n
D.高铁酸钠中铁元素质量分数最大 清波11年前1
清波11年前1 -
 uwanna 共回答了17个问题
uwanna 共回答了17个问题 |采纳率88.2%解题思路:A、根据在化合物中元素化合价的代数和为零的原则进行分析判断.
B、根据消毒的作用进行分析判断.
C、根据质量守恒定律:反应前后原子种类和数目均不变,进行分析判断.
D、根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.A、钠元素显+1价,氧元素显-2价,设Na2FeO4中铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故选项说法正确.
B、消毒的作用是除去有害细菌,不是除去水中可溶性杂质,故选项说法错误.
C、根据质量守恒定律,反应前有2个铁原子,2n=2,则n=2;钠的原子个数为2×2+2=6个,2m=6,m=3;m与n不相等,故选项说法错误.
D、高铁酸钠中钠原子的相对原子质量之和为23×2=46,铁原子的相对原子质量之和为56,氧原子的相对原子质量之和为16×4=64,氧元素的相对原子质量之和最大,则氧元素的质量分数最大,故选项说法错误.
故选A.点评:
本题考点: 化学方程式的配平;有关元素化合价的计算;元素的质量分数计算.
考点点评: 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、质量守恒定律、有关化学式的计算等是正确解答本题的关键.1年前查看全部
- 高铁酸钠(Na2FeO4)是一种绿色环保高效的饮水消毒剂.高铁酸钠中铁元素的化合价为
 scyber1年前1
scyber1年前1 -
 rainxing 共回答了18个问题
rainxing 共回答了18个问题 |采纳率88.9%+61年前查看全部
- 如何配平?麻烦写下离子方程式Fe(OH)3+Br2+NaOH=Na2FeO4+NaBr+H2OH2O2+KMnO4+H2
如何配平?麻烦写下离子方程式
Fe(OH)3+Br2+NaOH=Na2FeO4+NaBr+H2O
H2O2+KMnO4+H2SO4=H2O+K2SO4+MnSO4+O2
请举其中任意一个说明是如何配平和写离子方程式的! 猪猪爱苗条1年前2
猪猪爱苗条1年前2 -
 金顺顺 共回答了12个问题
金顺顺 共回答了12个问题 |采纳率91.7%你看仔细啦.以这个为例H2O2+KMnO4+H2SO4=H2O+K2SO4+MnSO4+O2 首先我们找到化学价变化的元素.左边的H2O2中的O-到右边的02升到0价.左边的KMnO4中的Mn7+到右边的Mn6+降了1价.硫酸只充当反应环境不参与变化所以不用...1年前查看全部
- (2012•郑州一模)Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程
(2012•郑州一模)na2feo4是一种高效多功能水处理剂,应用前景十分看好.一种制备na2feo4的方法可用化学方程式表示如下:2feso4+6na2o2═2na2feo4+2na2o+2( )+o2↑.下列对此反应的说法中,不正确的是( )
a.方框中的物质na2so4
b.na2o2既是氧化剂,又是还原剂
c.na2feo4既是氧化产物,又是还原产物
d.2 mol feso4发生反应时,反应***有8 mol电子转移 cony_xue1年前1
cony_xue1年前1 -
 胖毛 共回答了21个问题
胖毛 共回答了21个问题 |采纳率90.5%解题思路:由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,Fe元素化合价升高,被氧化,结合元素化合价的变化解答该题.A.由质量守恒可知反应的方程式为2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,则方框中的物质Na2SO4,故A正确;
B.反应中O元素化合价既升高又降低,则Na2O2既是氧化剂,又是还原剂,故B正确;
C.反应中Na2O2为氧化剂,FeSO4在反应中作还原剂,则Na2FeO4既是氧化产物又是还原产物,故C正确;
D.2molFeSO4发生反应时,化合价升高的有Fe和O,其中Fe化合价升高2×(6-2)=8,需要4molNa2O2为氧化剂,另2molNa2O2自身发生氧化还原反应,生成1molO2,转移电子2mol电子,共转移10mol电子,故D错误.
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,易错选项是D,注意该反应中不仅硫酸亚铁失电子,部分过氧化钠还失电子,为易错点.1年前查看全部
大家在问
- 1我和父亲抬担子 文中描写父亲背影的句子,你从中体会到了什么
- 2一篇100字左右的英语信假设你是李华,有一位澳大利亚朋友rose 托你在北京找一份工作.你在21世纪(21St cent
- 3在下列二次根式中,与根号ab(a>0,b>0)是同类二次根式的是() A.√4分之a²b² B.√a
- 4教室里只接有220V 40W的电灯8盏,平均每天用电4小时.若在4月1日查电能表,表上数字显示是0743.3
- 5在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系
- 6连词成句 :actiave active is she is not no very she
- 7i为虚数单位,则z=1+i+i2+…+i10的共轭复数.z等于( )
- 81.第二段中的"样子很凶",是和上文________,________相呼应,是和下文"还是用昨天那样的温柔而柔和的腔调
- 9浮云掩月是什么意思
- 102.5+5.55-1.59+4.45怎么简便计算
- 11无怀氏之民欤?葛天氏之民欤?有何作用?
- 12天上的繁星数得清,自己脸上的煤烟却看不见.
- 13Li Ming made great progress ________ of his parents. [
- 14细胞分裂间期的结果呈染色质还是染色体形态,数目相同吗?什么不同?
- 15硫酸氨糖和盐酸氨糖哪个好
