原子中电子的排列规则
 理想的寻求者2022-10-04 11:39:544条回答
理想的寻求者2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 挑灯看戏 共回答了16个问题
挑灯看戏 共回答了16个问题 |采纳率87.5%- 楼主请看答案:不懂问我
好好努力学习啊
6点:你还在睡觉,但你的机体已经醒来,内分泌功能活跃.如果这时起床,不要匆忙,动作还是舒缓些为好.
8点:心脑血管病易发作时段,练瑜伽功最好推迟到11点前.此时可吃早餐,但不适合顺势疗法药物.
9点:后2个小时期间疼痛和恐怖感最小,是看牙医的最好时间.
10点:适合参加公务谈判,完成各种教学任务和通过考试.
11点:如果极想吃奶油蛋糕,最好在现在而不是午饭后,因为这时,脂肪会转化为能量,而不是贮存在腹部和大腿.
13点:在办公室里,工作人员打哈欠:在学校里,孩子们脑子不好使.午休的最佳时间.
14点:身体的静电荷最小,适宜梳理头发.
16点:身体需要运动,跑、跳、游泳等.如果不得不坐着工作,也要站起来走一走,做做下蹲,这有利于保持工作精力.
17点:放松时间,可以玩玩乐器,这时双手最灵活.
18点:晚饭的最佳时间,但要适量.这时,多余的热量会转化为脂肪,而不是能量.
19点:护理皮肤,营养面膜会带来好处.服用药物吸收也最好.
20点:对美的追求最强烈,内心世界最丰富.看看画册,读读书,还可以试试新衣服.
21点:体温下降,新陈代谢减慢,这时不要吃东西.此时,你也会特别难忍孤独.
22点:你的肝脏不希望你喝酒.酒还影响睡眠,乃至次日的心情.这时候吸烟也最有害健康.
23点:幻想——美好的前景,远大的理想和崭新的观念.通常,这些东西在现实生活中很难通过.
24点:直到早晨——反应慢慢,没有坚定的目的性.如果还不睡觉,最易感到恐惧和抑郁.所以,最好睡觉!
1.入睡的最佳时间:晚上22:00-23:00
2.起床的最佳时间:早上5:00-6:00
3.用脑的最佳时间:上午8:00 思维严谨周密
10:00精力充沛
下午2:00 反应敏捷
晚上8:00 记忆力最差
4.饮水的最佳时间:早上起床后或每餐前1小时各饮一杯水
5.散步的最佳时间:饭后45分钟
6.锻炼身体的最佳时间:上午10:00
下午15:00
7.洗澡的最佳时间:晚上临睡前一次温水浴
8.美容的最佳时间:晚上临睡前用护肤品
9.饮茶的最佳时间:餐后1小时
10.吃水果的最佳时间:饭前1小时
一、原子核
1.质子数:指原子核内质子个数,决定元素的种类.
质子数=核电荷数=原子序数
2.中子数:指原子核内中子个数,与质子数一起决定某元素同位素的种类.
3.质量数:如果忽略电子的质量,将原子核内所有的质子和中子的相对质量(相对于 原子真实质量的1/12,即 )取近似整数值(两者均为1)加起来,所得的数值叫做质量数.
质量数(A)=质子数(Z)+中子数(N)
4.原子的组成
二、原子核外电子运动的特征
1.电子运动的特点
(1)质量很小( ),带负电荷;
(2)运动的空间范围小(直径约为 );
(3)运动的速率很快(约为 ).
2.电子云:电子在核外空间一定范围内出现,好像带负电荷的云雾笼罩在原子核周围,我们形象地称之为电子云.电子云中的每一个小黑点并不代表一个电子,只是表示电子曾经在此处出现过,而且小黑点的密疏可以表示电子出现的机率的大小.
三、原子核外电子的排布
1.在含有多个电子的原子里,核外电子是分层排布的.
2.电子层:根据电子具有的能量的高低,即离核远近,把电子在核外的排布分成不同的电子层.
3.核外电子排布规律
(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐渐升高的电子层里(K→L→M层),即能量最低原理.
(2)各电子层最多容纳的电子数目是 个.
(3)最外层电子数目不超过8个(K层为最外层时不超过两个),次外层电子数目不超过18个,倒数第三层电子数目不超过32个.
以上规律相互联系,相互牵制,不能孤立,片面理解.
4.原子结构示意图和离子结构示意图
(1)原子结构示意图:核电荷数=核外电子数.如, 原子结构示意图:
(2)阳离子结构示意图:核电荷数=核外电子数+阳离子所带电荷数.如, 离子结构示意图:
(3)阴离子结构示意图:核电荷数=核外电子数-阴离子所带电荷数.如, 离子结构示意图:
5.元素的性质与元素的原子核外电子排布的关系
(1)稀有气体的活泼性:稀有气体元素的原子最外层有8个电子(氦是2个电子),处于稳定结构,因此化学性质稳定,一般不跟其他物质发生化学反应.
(2)非金属性与金属性(一般规律):
最外层电子数 得失电子趋势 元素的性质
金属元素 <4 易失 金属性
非金属元素 >4 易得 非金属性
四、1~20号元素微粒结构的特点
1.稀有气体原子的电子层结构与周期的非金属元素形成的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同.
(1)与 原子电子层结构相同的离子有: .
(2)与 原子电子层结构相同的离子有: .
(3)与 原子电子层结构相同的离子有: .
2.核外有10个电子的微粒:
(1)分子: .
(2)阳离子: .
(3)阴离子: .
3.元素的原子结构的特殊性:
(1)原子核中无中子的原子: .(2)最外层有1个电子的元素:H、Li、Na.(3)最外层有2个电子的元素:Be、Mg、He.(4)最外层电子数等于次外层电子数的元素:Be、Ar.(5)最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne.(6)电子层数与最外层电子数相等的元素:H、Be、Al.(7)电子总数为最外层电子数2倍的元素:Be.(8)次外层电子数是最外层电子数2倍的元素:Si.(9)内层电子数是最外层电子数2倍的元素:Li、P.
掌握了上述一些结构特点及规律可以迅速推断元素及其原子序数等.
五、离子半径
1.离子半径的大小
金属离子的半径比其原子半径小,因多数为达稳定结构而失去最外层电子,即失去最外层,比原子少了一层电子.另外金属阳离子的正电荷数大时比其小时的半径更小,这只适用于同种元素的金属离子.如半径 ,* .
非金属阴离子的半径比其原子半径大得多.最低价态的非金属阴离子具有稀有气体的电子层结构.
具有相同电子层结构的离子,如均具2、8或2、8、8电子层结构时,其规律性是:离子的核电荷越大,半径越小.如:
①具2、8电子层结构的离子:
②具有2、8、8电子层结构的离子:
比较原子、简单阳离子、阴离子的半径可以总结出如下的规律:一看电子层数,二看核电荷数,三看电子数.解释为:先看电子层数,电子层数多的,一般半径就大;电子层数相同时看核电荷数,核电荷数多的半径反而小;如果电子层数与核电荷数都相同,就要比较核外电子数了,核外电子数多的半径就大.如:半径大小顺序为: .
2.离子的氧化性和还原性 以常见元素为例:
①阳离子的氧化性 一般与金属活动性顺序表中的活动性相反.
其中要注意 它易转化为 而有明显还原性.又有 未排入,因为其氧化性显著,比 等的氧化性还强.
②阴离子的还原性 多数为非金属单质的氧化性越弱,则最低价阴离子的还原性越强.如:
3.易出误区的离子
①阳离子的电子层数一般比对应的原子少一层,但有例外.如锡和铅的阳离子. 与 的电子层数相同,但半径却小. 才比 少一层电子. 离子与 具相同电子层数,但半径却小.
②非金属阴离子在达最低价时只有还原性而无氧化性.但未达最低价时则不一定.如过氧根离子中的 ,易失电子转化为 ,而具有强氧化性.但它是氧的中间价态,在一定条件下可失电子转化为 ,所以也有还原性.如遇到 与水或 反应时 的自身氧化还原反应等.
原子结构学案及习题
http://www.***.cn 发布时间:2008-03-21 郑州市74中
考纲要求:
1、 了解原子的结构及同位素的概念.理解原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与质子数、中子数之间的相互关系.
2、 以第1、2、3周期的元素为例,了解原子核外电子排布规律.
考情分析:
1、 同位素、同素异形体、同系物、同分异构体等概念的辨析.
2、 以重大科技成果为背景,考查原子结构、微粒之间的关系及原子组成的表示方法.
3、 1~18号元素原子的结构特征,运用核外电子排布规律推断元素的性质.
基础回顾:
:
四、元素、同位素、核素的比较
元素 同位素 核素
概念 具有 的同一类原子的总称 相同而 不同的同一元素的不同原子互称为同位素 具的一定数目的质子和一定数目的中子的一种原子
对象 宏观概念,对同类原子而言 微观概念,对某种元素的原子而言 微观概念,指元素的具体的某个原子
特征 既有游离态,又有化合态,性质通过形成单质或化合物来体现 同位素化学性质几乎相同,物理性质不同.天然存在的各种同位素所占的原子百分数一般不变 具有真实的质量,不同核素的质量不相同
一、原子核外电子排布的原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生.
1.最低能量原理
电子在原子核外排布时,要尽可能使电子的能量最低.怎样才能使电子的能量最低呢?比方说,我们站在地面上,不会觉得有什么危险;如果我们站在20层楼的顶上,再往下看时我们心理感到害怕.这是因为物体在越高处具有的势能越高,物体总有从高处往低处的一种趋势,就像自由落体一样,我们从来没有见过物体会自动从地面上升到空中,物体要从地面到空中,必须要有外加力的作用.电子本身就是一种物质,也具有同样的性质,即它在一般情况下总想处于一种较为安全(或稳定)的一种状态(基态),也就是能量最低时的状态.当有外加作用时,电子也是可以吸收能量到能量较高的状态(激发态),但是它总有时时刻刻想回到基态的趋势.一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的.这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……
2.保里不相容原理
我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向.在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的.根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反.也就是说,每一个轨道中只能容纳两个自旋方向相反的电子.这一点好像我们坐电梯,每个人相当于一个电子,每一个电梯相当于一个轨道,假设电梯足够小,每一个电梯最多只能同时供两个人乘坐,而且乘坐时必须一个人头朝上,另一个人倒立着(为了充分利用空间).根据保里不相容原理,我们得知:s亚层只有1个轨道,可以容纳两个自旋相反的电子;p亚层有3个轨道,总共可以容纳6个电子;f亚层有5个轨道,总共可以容纳10个电子.我们还得知:第一电子层(K层)中只有1s亚层,最多容纳两个电子;第二电子层(L层)中包括2s和2p两个亚层,总共可以容纳8个电子;第3电子层(M层)中包括3s、3p、3d三个亚层,总共可以容纳18个电子……第n层总共可以容纳2n2个电子.
3.洪特规则
从光谱实验结果总结出来的洪特规则有两方面的含义:一是电子在原子核外排布时,将尽可能分占不同的轨道,且自旋平行;洪特规则的第二个含义是对于同一个电子亚层,当电子排布处于
全满(s2、p6、d10、f14)
半满(s1、p3、d5、f7)
全空(s0、p0、d0、f0)时比较稳定.这类似于我们坐电梯的情况中,要么电梯是空的,要么电梯里都有一个人,要么电梯里都挤满了两个人,大家都觉得比较均等,谁也不抱怨谁;如果有的电梯里挤满了两个人,而有的电梯里只有一个人,或有的电梯里有一个人,而有的电梯里没有人,则必然有人产生抱怨情绪,我们称之为不稳定状态.
二、核外电子排布的方法
对于某元素原子的核外电子排布情况,先确定该原子的核外电子数(即原子序数、质子数、核电荷数),如24号元素铬,其原子核外总共有24个电子,然后将这24个电子从能量最低的1s亚层依次往能量较高的亚层上排布,只有前面的亚层填满后,才去填充后面的亚层,每一个亚层上最多能够排布的电子数为:s亚层2个,p亚层6个,d亚层10个,f亚层14个.最外层电子到底怎样排布,还要参考洪特规则,如24号元素铬的24个核外电子依次排列为
1s22s22p63s23p64s23d4
根据洪特规则,d亚层处于半充满时较为稳定,故其排布式应为:
1s22s22p63s23p64s13d5
最后,按照人们的习惯“每一个电子层不分隔开来”,改写成
1s22s22p63s23p63d54s1
即可.
三、核外电子排布在中学化学中的应用
1.原子的核外电子排布与轨道表示式、原子结构示意图的关系:原子的核外电子排布式与轨道表示式描述的内容是完全相同的,相对而言,轨道表示式要更加详细一些,它既能明确表示出原子的核外电子排布在哪些电子层、电子亚层上, 还能表示出这些电子是处于自旋相同还是自旋相反的状态,而核外电子排布式不具备后一项功能.原子结构示意图中可以看出电子在原子核外分层排布的情况,但它并没有指明电子分布在哪些亚层上,也没有指明每个电子的自旋情况,其优点在于可以直接看出原子的核电荷数(或核外电子总数).
2.原子的核外电子排布与元素周期律的关系
在原子里,原子核位于整个原子的中心,电子在核外绕核作高速运动,因为电子在离核不同的区域中运动,我们可以看作电子是在核外分层排布的.按核外电子排布的3条原则将所有原子的核外电子排布在该原子核的周围,发现核外电子排布遵守下列规律:原子核外的电子尽可能分布在能量较低的电子层上(离核较近);若电子层数是n,这层的电子数目最多是2n2个;无论是第几层,如果作为最外电子层时,那么这层的电子数不能超过8个,如果作为倒数第二层(次外层),那么这层的电子数便不能超过18个.这一结果决定了元素原子核外电子排布的周期性变化规律,按最外层电子排布相同进行归类,将周期表中同一列的元素划分为一族;按核外电子排布的周期性变化来进行划分周期
如第一周期中含有的元素种类数为2,是由1s1~2决定的
第二周期中含有的元素种类数为8,是由2s1~22p0~6决定的
第三周期中含有的元素种类数为8,是由3s1~23p0~6决定的
第四周期中元素的种类数为18,是由4s1~23d0~104p0~6决定的.
由此可见,元素原子核外电子排布的规律是元素周期表划分的主要依据,是元素性质周期性变化的根本所在.对于同族元素而言,从上至下,随着电子层数增加,原子半径越来越大,原子核对最外层电子的吸引力越来越小,最外层电子越来越容易失去,即金属性越来越强;对于同周期元素而言,随着核电荷数的增加,原子核对外层电子的吸引力越来越强,使原子半径逐渐减小,金属性越来越差,非金属性越来越强. - 1年前
 ljade 共回答了14个问题
ljade 共回答了14个问题 |采纳率- 能量最低原则,先内层后外层,有k,m,l,n,o,p,q七层,每层排的数目是2*n*n,n为第几层,例如K就是n=1,则排列数目为2.一次类推
- 1年前
 夏之守候者 共回答了6个问题
夏之守候者 共回答了6个问题 |采纳率- 一、原子核外电子排布的原理
处于稳定状态的原子,核外电子将尽可能地按能量最低原理排布,另外,由于电子不可能都挤在一起,它们还要遵守保里不相容原理和洪特规则,一般而言,在这三条规则的指导下,可以推导出元素原子的核外电子排布情况,在中学阶段要求的前36号元素里,没有例外的情况发生。
1.最低能量原理
电子在原子核外排布时,要尽可能使电子的能量最低。怎样才能使电子的能量最低... - 1年前
 dd安 共回答了5个问题
dd安 共回答了5个问题 |采纳率- 我推荐你去看《无机化学》,自己琢磨吧
- 1年前
相关推荐
- 这个说法是否与"原子是化学变化中的最小微粒"相矛盾?
这个说法是否与"原子是化学变化中的最小微粒"相矛盾?
仁爱版九年级化学课本:"在化学变化中原址可以得到或失去电子转换成离子,离子也可以通过失去或得到电子转换成原子",这种说法是否与"原子是化学变化中的最小微粒"相矛盾?请高手解释谢谢!
希望高手说明详细原因,非诚勿扰,谢谢! yingxinfaye1年前6
yingxinfaye1年前6 -
 我爱海布里 共回答了16个问题
我爱海布里 共回答了16个问题 |采纳率81.3%刚才打错了,望见谅;我完全同意上面二楼的回答:只要原子的核电荷数(或原子核)不发生变化,就还是原来的原子,只是在化学变化中原子得失电子而变成离子而已,况且离子是带电的原子(或原子团),它本质上还是同种元素的原子嘛!1年前查看全部
- 在原子里,核电荷数等于A、核外电子总数B、中子数C、质子数D、相对原子质量
 哈哈kgl哈1年前2
哈哈kgl哈1年前2 -
 听风雨轩 共回答了12个问题
听风雨轩 共回答了12个问题 |采纳率100%相对原子质量是=质子数+中子数=B+C1年前查看全部
- 原子与分子的区别原子构成分子这个我知道.那在发生化学变化时本质是分子还是原子发生了变化?还有,分子都是由原子构成的吗?分
原子与分子的区别
原子构成分子这个我知道.那在发生化学变化时本质是分子还是原子发生了变化?还有,分子都是由原子构成的吗?分子多了可以构成物质,原子多了可不可以直接构成物质?(本人初二党,看到化学是一塌糊涂) 赵vv周的zz1年前5
赵vv周的zz1年前5 -
 ww灵 共回答了17个问题
ww灵 共回答了17个问题 |采纳率88.2%原子和分子都是构成物质的粒子,
化学变化时是分子发生改变,分子是保持某种物质化学性质的粒子,
原子是化学变化时最小粒子,所以原子在化学变化时是不发生改变的.
初中化学不难,只要有心学没有什么做不到的!1年前查看全部
- 原子与分子的区别和联系
 tapir1年前1
tapir1年前1 -
 雨中的蛇 共回答了20个问题
雨中的蛇 共回答了20个问题 |采纳率100%组成于被组成的关系1年前查看全部
- 短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最
短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最高价氧化物的电子式是?
在一定条件下,上述四种元素的单质均能与氧气反应,其中Z的氧化物既能溶于稀硫酸,又能溶于NaOH溶液,②Z元素在元素周期表中位于第几周期,第几主族.
Y固体单质与盐酸反应,再向反应后的溶液中加入过量烧碱溶液,最终溶液中有白色沉淀生成,③写出生成白色沉淀的反应方程式
向上述四种元素的单质的混合物中加入足量烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀,④产生白色沉淀的离子方程式
X,Y,Z,W四种元素的原子半径由大到小顺序为(用元素符号表示) wenwen19811年前2
wenwen19811年前2 -
 yanggao198118 共回答了19个问题
yanggao198118 共回答了19个问题 |采纳率94.7%X、Y、Z、W分别为碳、镁、铝、硅1年前查看全部
- 汤姆生发现原子中存在带负电的粒子,该粒子称为( )
汤姆生发现原子中存在带负电的粒子,该粒子称为( )
A. 电子
B. 质子
C. 中子
D. 核子 茉美眉1年前1
茉美眉1年前1 -
 如风走过 共回答了20个问题
如风走过 共回答了20个问题 |采纳率85%解题思路:原子由位于中心的原子核和核外电子组成.其中,原子核带正电,电子带负电.汤姆生发现了原子中存在一种带负电荷的粒子,这种粒子就是电子.
故选A.点评:
本题考点: 原子结构、元电荷与带电情况.
考点点评: 本题考查了发现电子的历史,是一道基础题.1年前查看全部
- 已知汞的摩尔质量为200.5×10-3 kg/mol,密度为13.6×103 kg/m3,则一个汞原子的体积为多少?体积
已知汞的摩尔质量为200.5×10-3 kg/mol,密度为13.6×103 kg/m3,则一个汞原子的体积为多少?体积为1cm3的汞中有多少汞原子?
 这是一场暗战1年前2
这是一场暗战1年前2 -
 西湖阳光 共回答了20个问题
西湖阳光 共回答了20个问题 |采纳率95%解题思路:由摩尔质量和密度可求出1mol汞原子所点据的空间,则可求得单个原子的体积;
由摩尔质量可求得摩尔体积,则可求出1cm3汞中含有的原子数.由题意可知,汞的摩尔体积为:
V=[M/ρ]
所以汞原子的体积为:
V0=
V
NA=
M
ρNA=
200.5×10−3
6.02×1023×13.6×103=2.4×10-29m3
每立方厘米汞中所含分子数为:
n=
1cm3
V0=
10−6
2.4×10−29=4.1×1022.
答:一个汞原子的体积为2.4×10-29m3;体积为1cm3的汞中有4.1×1022个汞原子.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题为阿伏加德罗常中的计算题,计算过程注意单位的换算,并且要学会科学记数法的计算方法.1年前查看全部
- 怎么写原子结构示意图分别代表什么
 牡车别1年前0
牡车别1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 核外电子数=质子数的条件是在同一原子内吗?(22 20:13:33)
 riddlel1年前5
riddlel1年前5 -
 cytlc 共回答了19个问题
cytlc 共回答了19个问题 |采纳率94.7%对于一个原子来说,核外电子数=质子数
对于离子就不是这样的了.1年前查看全部
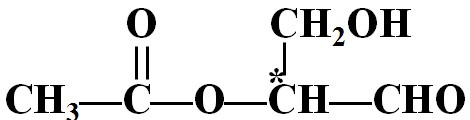
- 下列有机物X含有一个手性碳原子,具有光学活当发生下列化学反应时,生成新的有机物无光学活性的是
下列有机物X含有一个手性碳原子,具有光学活当发生下列化学反应时,生成新的有机物无光学活性的是
A.与银氨溶液反应
B.与甲酸在一定条件下发生酯化反应
C.与金属钠发生反应
D.与H2发生加成反应
 3069991年前3
3069991年前3 -
 glk_13 共回答了17个问题
glk_13 共回答了17个问题 |采纳率88.2%选D.手性碳原子是指与该碳原子相连的四个基团完全不相同!只有D选项可以使原物质没有手性碳!使物质没有旋光性的方法,一是没有手性碳,二是有,但是成为内消旋体!A与醛基反应生成羧基,对手性碳没影响,B与羟基反应生成酯基,手性碳没变化,C与羟基反应生成醇盐,手性碳没变,D里氢气与羰基加成使得与手性碳连接的醛基变为—CH2OH,碳上连接了两个相同的基团,使得原来的手性碳不再是手性碳!1年前查看全部
- 试说明分子原子原子核质子中子电子正离子负离子
试说明分子原子原子核质子中子电子正离子负离子
其中哪几种带电粒子能参与导电形成电流?它们的运动方向和规定的电流方向有什么关系? F12TT1年前2
F12TT1年前2 -
 杨敏君 共回答了18个问题
杨敏君 共回答了18个问题 |采纳率94.4%1、通常所说的导线中的电流是由电子参与形成的.其方向与电子运动方向相反.
2、阴阳离子也可以形成电流,不过这主要发生在电池中.在电池中阴阳离子在正负极之间发生对流,电流方向为阳离子的流向,也是阴离子流动方向的相反方向.
3、若用电解液导电,则电流流向同2中情况.1年前查看全部
- 已知一个C12 原子的质量是1.99x10^-23g,元素R的某种原子每个质量为2.67x1O^-23g,元素R的相对原
已知一个C12 原子的质量是1.99x10^-23g,元素R的某种原子每个质量为2.67x1O^-23g,元素R的相对原子质量的计算式和计算结果为____(写出过程)
 甜甜魅立人生1年前1
甜甜魅立人生1年前1 -
 雨梦爱洁 共回答了21个问题
雨梦爱洁 共回答了21个问题 |采纳率90.5%元素R的相对原子质量的计算式=(元素R的实际质量)/(C12 原子的质量*1/12)
一个C12 原子的质量1/12等于1/12*1.99x10^-23g=1.66x10^-24g
元素R的相对原子质量为2.67x1O^-23g/1.66x10^-24g=16.116.081年前查看全部
- 原子序数为9和20的两种元素他们相互化合时形成什么类型的化学键
 ClareX1年前2
ClareX1年前2 -
 哪有那么多重名的 共回答了22个问题
哪有那么多重名的 共回答了22个问题 |采纳率100%原子序数为9和20的两种元素是F、Ca,这是典型的活泼非金属与活泼金属,它们相互化合时形成典型的离子键1年前查看全部
- 某化合物有2种元素组成其中原子个数比为2比1,式量为160求化学式
 alexguan1431年前1
alexguan1431年前1 -
 大沙粒 共回答了15个问题
大沙粒 共回答了15个问题 |采纳率73.3%Cu2S1年前查看全部
- 0.1molH2SO4中含有____个H2SO4分子,公约含有______个原子,在水溶液中可以电离出___个H离子
0.1molH2SO4中含有____个H2SO4分子,公约含有______个原子,在水溶液中可以电离出___个H离子
摆脱给步骤,过程加分 请神赐我双全法1年前1
请神赐我双全法1年前1 -
 lihongde 共回答了13个问题
lihongde 共回答了13个问题 |采纳率100%H2SO4由H2SO4分子构成,1个H2SO4分子中含7个原子;H2SO4=2H+ + SO42-
(1)0.1molX6.02X10^23/mol=6.02X10^22
(2)6.02X10^22X7=4.214X10^23
(3)6.02X10^22X2=1.204X10^231年前查看全部
- 一秒的定义是啥?,是地球公转周期的31556736分之一.还是铯原子震动若干下的时间.还是什么别的.
 592871881年前1
592871881年前1 -
 柚子365 共回答了22个问题
柚子365 共回答了22个问题 |采纳率95.5%一秒
最早,人们是利用地球自转运动来计量时间的,基本单位是平太阳日.19世纪末,将一个平太阳日的1/86400作为一秒,称作世界时秒.
由于地球的自转运动存在着不规则变化,并有长期减慢的趋势,使得世界时秒逐年变化,不能保持恒定.因此,按此定义复现秒的准确度只能达到一亿分之一秒.
1960年国际计量大会决定采用以地球公转的运动为基础的历书时秒作为时间单位,即将1900年初附近,太阳的几何平黄经为279°41'48".04的瞬间作为1900年1月O日12时整,从该时刻起算的回归年的1/31556925.9747作为一秒.按此定义复现秒的准确度提高到十亿分之一秒.
1967年,国际计量大会决定采用原子秒定义取代历书时秒定义.即将铯-133原子基态的两个超精细能级之间跃迁相对应辐射的9192631770个周期所持续的时间定义为一秒.按此定义复现秒的准确度已优于十万亿分之一秒.
1960年以前,CIPM(国际计量大会)以地球自转为基础,定义以平均太阳日之86400分之一作为秒定义.即1 Second = 1/86400 Mean Solar day其稳定度在10-8左右.
1960~1967年CIPM改以地球公转为基础,定义西元1900年为平均太阳年.秒定义更改为:一秒为平均太阳年之31556925.9747分之一.1 Sec = 1/31556925.9747 Solar Year at 1900稳定度约为10-9.1年前查看全部
- 35个电子以上的原子结构分布示意图怎么排
 猪头上的小酒窝1年前2
猪头上的小酒窝1年前2 -
 hyzhaoting 共回答了16个问题
hyzhaoting 共回答了16个问题 |采纳率93.8%2,8,18,18-N,或者2,8,18,321年前查看全部
- 原子质量定义为质子数加上中子数岂不是更容易理解,为什么非要用碳来作为标准?
 含笑幽灵1年前1
含笑幽灵1年前1 -
 30岁东北女不怕烂 共回答了23个问题
30岁东北女不怕烂 共回答了23个问题 |采纳率78.3%质子和中子质量是不一定的,会有点小小的差别,这就是核反应(聚变和裂变)会放出能量的原因.距离来说,氘核1中子1质子,2个氘核聚变成一个氦核,2中子2质子,但质量会有微小损失,变成巨大能量放出了.1年前查看全部
- 化学(如下题)在物质如图(金刚石)的结构中,每个碳原子最多连有——个碳原子. 为什么?
化学(如下题)
在物质如图(金刚石)的结构中,每个碳原子最多连有——个碳原子.
为什么?
 cara41961年前1
cara41961年前1 -
 sitg1969 共回答了14个问题
sitg1969 共回答了14个问题 |采纳率85.7%每个碳原子最多连有4个碳原子.
因为碳原子最外电子层有4个未成对的电子,所以能和另外4个碳原子最外电子层未成对的电子形成共用电子对,达到稳定的结构.1年前查看全部
- 铜原子失去一个电子是失去哪个能极上的,硫酸四氨合铜的配位数为什么是4?
 花花pgy1年前3
花花pgy1年前3 -
 bbsplayer1 共回答了17个问题
bbsplayer1 共回答了17个问题 |采纳率88.2%铜原子失去一个电子是失去4s1上的电子,形成3d10稳定状态.
Cu+电子排布[Ar] 3d10
铜离子为dsp2杂化,整个络离子呈平面正方形构型.或者说铜离子电子构型为3d9,采取dsp2杂化可以得到比较大的晶体场稳定化能.1年前查看全部
- A,B,C三种金属的相对原子质量之比为3:5:7,若以4:2:1的物质的量之比形成三种金属的混合物4.64g,溶于足量的
A,B,C三种金属的相对原子质量之比为3:5:7,若以4:2:1的物质的量之比形成三种金属的混合物4.64g,溶于足量的盐酸后,放出的氢气在标准状况下的体积是3.136L.若三种金属均为+2价,求三种金属的相对原子质量
 TCL52011年前1
TCL52011年前1 -
 softli 共回答了19个问题
softli 共回答了19个问题 |采纳率100%3.136/22.4=0.14摩
则A,B,C三种金属的物质的量依次为:0.08摩、0.04摩、0.02摩.
设A,B,C三种金属的相对原子质量依次为3X、5X、7X,
3X*0.08+5X*0.04+7X*0,02=4.64
X=8
则三种金属相对原子质量依次为24、40、56.1年前查看全部
- 物质分几种?我是这样分的,一共两种.一是由原子,分子组成的物体.另一种是电磁波系列的物质,包
物质分几种?我是这样分的,一共两种.一是由原子,分子组成的物体.另一种是电磁波系列的物质,包
物质分几种?
我是这样分的,一共两种.一是由原子,分子组成的物体.另一种是电磁波系列的物质,包括光,热量,能量等等.这样分可以吗? 泥金小字蛮笺句1年前1
泥金小字蛮笺句1年前1 -
 leeqingwen 共回答了18个问题
leeqingwen 共回答了18个问题 |采纳率94.4%要看你的分类标准呢.如混合物与纯净物,宏观与微观1年前查看全部
- 同位素就是质子数相同中子数不同的原子 这话哪错了?
 chenyuanchi1101年前3
chenyuanchi1101年前3 -
 若是偶然 共回答了19个问题
若是偶然 共回答了19个问题 |采纳率89.5%科技名词定义
中文名称:同位素 英文名称:isotope 定义1:具有相同原子序数(即质子数相同,因而在元素周期表中的位置相同),但质量数不同,亦即中子数不同的一组核素.所属学科:电力(一级学科);核电(二级学科) 定义2:中子数不同的同一种元素的一种原子形式,包括稳定同位素和放射性同位素.所属学科:生态学(一级学科);全球生态学(二级学科)1年前查看全部
- 同温同压下,含相同原子数的下列气体,密度最大的是( )
同温同压下,含相同原子数的下列气体,密度最大的是( )
A. SO2
B. CO2
C. HCl
D. CH4 jade土拨鼠1年前1
jade土拨鼠1年前1 -
 沃野榆梅 共回答了15个问题
沃野榆梅 共回答了15个问题 |采纳率86.7%解题思路:同温同压下,气体摩尔体积相等,根据ρ=
知,气体的摩尔质量越大,其密度越大,据此分析解答.M Vm 二氧化硫的摩尔质量是64g/mol、二氧化碳的摩尔质量是44g/mol、氯化氢的摩尔质量是36.5g/mol、甲烷的摩尔质量是16g/mol,同温同压下,气体摩尔体积相等,根据ρ=
M
Vm知,气体的摩尔质量越大,其密度越大,与气体的分子数无关,摩尔质量最大的是二氧化硫,则其密度最大的是二氧化硫,
故选A.点评:
本题考点: 阿伏加德罗定律及推论.
考点点评: 本题考查了阿伏伽德罗定律及其推论,明确密度与摩尔质量的关系是解本题关键,相同条件下,气体密度只与摩尔质量有关,与其质量、分子数、体积都无关,题目难度不大.1年前查看全部
- 物理书上说一切物质由分子组成,可化学书上说一切物质由分子和原子构成.怎么回事?
 魔狼转世791年前3
魔狼转世791年前3 -
 qzoaj 共回答了20个问题
qzoaj 共回答了20个问题 |采纳率90%物理学把能组成物质的微粒统称分子(注意,是统称,这里的分子并不是化学中所说的分子),分子由原子构成!只要记住,物理和化学像这种概念只要分清哪句话在哪门学科中出现就行了,考试不会混考这种概念 !1年前查看全部
- 什么是原子在一个平面内比如甲烷一个C,两个H,在同一个平面内,是因为如果再加上第三个H,两个键角加起来大于180度吗?如
什么是原子在一个平面内
比如甲烷一个C,两个H,在同一个平面内,是因为如果再加上第三个H,两个键角加起来大于180度吗?如果不是,是怎么用键角判断的? we12327091年前1
we12327091年前1 -
 bigalex88 共回答了22个问题
bigalex88 共回答了22个问题 |采纳率86.4%回到数学问题:三点成一平面.
以一个原子为一点.有三个以上原子组成的分子,如果都在一个平面内就是了.水分子有三个原子必在同一平面内,与键角无关.
但甲烷有五个原子,它们不在同一平面内.
乙烯分子有六个原子,若以所有原子的核为中心质点,则这些质点正好在同一平面内.平面形有机分子的碳原子都取sp2杂化,键角是120度.相同例还有苯.1年前查看全部
- 原子得到电子后为什么带负电荷?
 ling5461年前3
ling5461年前3 -
 皇甫玉龙 共回答了18个问题
皇甫玉龙 共回答了18个问题 |采纳率94.4%原子得到电子后,电子数比质子数多,电子带负电荷,所以原子得到电子后带负电荷1年前查看全部
- 在下列空格中,选择填上“原子”或“分子”,
在下列空格中,选择填上“原子”或“分子”,
纯净的水都是由水_____构成的.水分子是由氢_____和氧______构成的.当水通电时,生成氢气和氧气,发生的是______变化.其实质是,水_______在电流的作用下,分解出氢____和氧______,氢______和氧______不能独立存在.每两个氢______结合成一个氢______,每两个氧________结合成一个氧_____.在_______变化中,_________本身没有变化.在________变化中,______发生了变化,构成原物质______里的______重新组合,生产其他物质的_______. jonesjack1年前1
jonesjack1年前1 -
 恋之风景蝴蝶 共回答了21个问题
恋之风景蝴蝶 共回答了21个问题 |采纳率90.5%分子 原子 原子 化学 分子 原子 原子 原子 原子 原子 分子 原子 分子 物理 化学性质 化学 化学性质 分子 原子 分子 ~~~
唔.亲一个一个对着去蛤 .正好我也是初三的.加油1年前查看全部
- 碳元素原子最外层4个电子,易得还是失电子
 jenny1801年前3
jenny1801年前3 -
 玫瑰的王子 共回答了22个问题
玫瑰的王子 共回答了22个问题 |采纳率90.9%既不易得电子,也不易失电子,所以碳的单质很稳定1年前查看全部
- 已知短周期的离子.原子序数为a的A显正二价,原子序数为b的B显正一价,原子序数为c的C显负三价,原子序数为d的D显负一价
已知短周期的离子.原子序数为a的A显正二价,原子序数为b的B显正一价,原子序数为c的C显负三价,原子序数为d的D显负一价.都具有相同的电子结构,则下列叙述正确的是
原子半径A>B>D>C
原子序数d>c>b>a
离子半径C>D>B>A
单质的还原性A>B>D>C Ellenie1年前1
Ellenie1年前1 -
 北极狐888 共回答了13个问题
北极狐888 共回答了13个问题 |采纳率92.3%他们的离子具有相同的电子结构(这一点很重要),不妨设该电子结构有x个电子.
A显+2价,所以是失去两个电子,所以a=x+2,
B显+1价,所以是失去一个电子,所以b=x+1,
C显-3价,所以是得到三个电子,所以c=x-3,
D显-1价,所以是得到一个电子,所以d=x-1,
原子序数为:a>b>d>c.
另外,还可以推出,AB比CD的周期数大1.
所以,原子半径:B>A>C>D.
还原性:B>A>C>D
离子半径:由于核外电子排列相同,所以,原子序数越大(核电荷数越多),则半径越小,所以:C>D>B>A1年前查看全部
- 人是不是也是由一个个分子原子构成的
人是不是也是由一个个分子原子构成的
原子是构成物体的最小单位,可是人真的也是原子构成的么 se5011年前1
se5011年前1 -
 爱母80 共回答了23个问题
爱母80 共回答了23个问题 |采纳率78.3%是,人体内主要是蛋白质,水,糖类等有机物和无机物,有机物和无机物都是由分子和原子构成的1年前查看全部
- 氯只有(35)Cl和(37)Cl两种稳定同位素,它们在氯气中的原子数之比为(35)Cl:(37)Cl=3:1.则相对分子
氯只有(35)Cl和(37)Cl两种稳定同位素,它们在氯气中的原子数之比为(35)Cl:(37)Cl=3:1.则相对分子质量为70,72,74的氯分子数之比为
A.5:2:1 B.5:2:2 C.4:1:1 D.9:3:2
因为Cl-35:Cl-37=3:1
所以设Cl2-70=X,Cl2-72=Y,Cl2-74=Z
则(2X+Y):(Y+2Z)=3:1
我想知道为什么这么设,还有为什么都要+上Y 柚子一个1年前1
柚子一个1年前1 -
 gy030122 共回答了21个问题
gy030122 共回答了21个问题 |采纳率85.7%氯只有35Cl和37Cl两种稳定同位素,他们在氯气中的原子个数比是3:1,则相对分子质量为70,72,74的氯气分子之比可能是()
A 5:2:1 B 5:2:2 C 9:3:2
答案:AC
氯的平均原子量为
(35*3+37*1)/4=35.5
氯气的平均分子量为
35.5*2=71
分别代入
A:(5*70+2*72+1*74)/8=71 正确
B:(5*70+2*72+2*74)/9=71.9 错误
C:(9*70+3*72+2*74)/14=71 正确1年前查看全部
- 下列哪个分子中所有原子都满足8电子结构的是( )
下列哪个分子中所有原子都满足8电子结构的是( )
A NH3 B Hcl C Pcl3 D ccl4 东北四丫1年前2
东北四丫1年前2 -
 zs-0431 共回答了17个问题
zs-0431 共回答了17个问题 |采纳率88.2%C、D
首先,若是有H元素的化合物就要去除,因为H就算是核外电子排布达到稳定结构也只有两个,永远不可能到8个.
所以排除A、B,另,首先判断物质是离子化合物还是共价化合物,若是离子化合物,我觉得一般都已经达到了8电子稳定结构,但若是共价化合物,以PCl3为例,P的价电子数为5,则须有三根共价键才能达到8电子稳定结构,而PCl3恰好有满足,若化合物是PCl5就不对了..CCl4是同样的道理.1年前查看全部
- 烃C6H12分子中,一定在同一平面内的碳原子数为多少?为什么?
 飞碟止境1年前1
飞碟止境1年前1 -
 刀粉团老太 共回答了21个问题
刀粉团老太 共回答了21个问题 |采纳率90.5%如果是环烷就是一个,烯烃就是4个,祝你学习愉快1年前查看全部
- 分子晶体熔沸点一定低于原子晶体?不同类的!
 虹之美1年前2
虹之美1年前2 -
 没有钱的鱼 共回答了24个问题
没有钱的鱼 共回答了24个问题 |采纳率91.7%不同类的就没准了 例如:
分子晶体 水 熔点零度
原子晶体 汞 熔点零下38.8度1年前查看全部
- 有那些化学式既可表是化学元素,也可表示一种单质和表示一个原子?
 lex41年前3
lex41年前3 -
 双木辉 共回答了21个问题
双木辉 共回答了21个问题 |采纳率95.2%稀有气体元素,金属元素,少素非金属,如S P C 等1年前查看全部
- 720克的某单质X(60个原子个数,即60为X的右下角的数字)中含有60NA个X原子,则X的相对原子质量为( )
720克的某单质X(60个原子个数,即60为X的右下角的数字)中含有60NA个X原子,则X的相对原子质量为( )
A.2
B.120
C.12
D.60 wwh2271年前1
wwh2271年前1 -
 guzhengty 共回答了13个问题
guzhengty 共回答了13个问题 |采纳率100%C
60NANA=60
72060=12
不知道对不对……
^______^1年前查看全部
- 有机化学次序规则怎么用?次序规则基本明白,但是实际运用中出现一些情况不懂了,具体如下1:单原子和多原子集团之间怎么比较优
有机化学次序规则怎么用?
次序规则基本明白,但是实际运用中出现一些情况不懂了,具体如下
1:单原子和多原子集团之间怎么比较优先顺序,比如溴基,苯基,异丙基之间等等类似情况.
2:多原子间,如果把与第一个原子相连的其他原子比较后,仍然一样,怎么办?例如:-CH2NH2与-CH2NHCH3之间的比较,它们都是N,H,H.
急盼知道的朋友帮帮忙, 恋尘乐苦1年前1
恋尘乐苦1年前1 -
 junelina 共回答了21个问题
junelina 共回答了21个问题 |采纳率85.7%1.不必考虑多原子,只考虑你选择的那个碳原子直接相连的那个原子的次序.
2.如果第一个原子的次序相同,比较下一个原子的次序.1年前查看全部
- 【高一化学】关于容易和难得电子的原子比较》》
【高一化学】关于容易和难得电子的原子比较》》
同主族的原子(周期表右边那一块,如VIA)半径大的原子容易得电子还是半径小的容易得电子,为什么?从微观角度分析,我觉得电荷数越大对离子的吸引力越大,所以就有同周期从左往右半径越来越小.可这解释是错误的.为什么? j2328420541年前2
j2328420541年前2 -
 3333663 共回答了13个问题
3333663 共回答了13个问题 |采纳率84.6%原子半径越大,相应的电子离原子核的距离就越大.在原子中质子与电子是一一对应的.所以,由于距离的原因,半径越大原子核对电子的约束力就越小.所以金属性越强.1年前查看全部
- 某一元有机酸分子中的C、H、O的原子个数比为1:2:1,某钠盐含有一定质量的结晶水.当此钠盐加热到一定温度时,因失去结晶
某一元有机酸分子中的C、H、O的原子个数比为1:2:1,某钠盐含有一定质量的结晶水.当此钠盐加热到一定温度时,因失去结晶水,质量减少39.7%,将此含结晶水的钠盐0.57g与适量的硫酸在加热条件下反应,得0.298g Na2SO4.
(1)求此钠盐的式量及其含结晶水的数目.
(2)求此一元有机酸的式量并写出结构简式.答案是(1)136,3(2)60,CH3COOH求解题过程【最好解题过程能规范些= = winson_yu1年前2
winson_yu1年前2 -
 litnew 共回答了16个问题
litnew 共回答了16个问题 |采纳率87.5%设有机酸为CxH2xOx,则钠盐为NaCxH(2x-1)Ox.yH2O.
18y/(18y+22+30x)*100%=39.7%
化简得到:5.427y=5.955x+4.367
试算得到:y=3,x=2
NaC2H3O2.3H2O
C2H3O2H
CH3COOH
根据“此含结晶水的钠盐0.57g与适量的硫酸在加热条件下反应,得0.298g Na2SO4”该条件,可以知道含结晶水的钠盐的相对分子质量为:0.57/(0.298/142*2)=136.1年前查看全部
- 当分裂能小于电子成对能时,中心原子与配体形成高自旋配合物这句话错在哪
 Tianl2801年前1
Tianl2801年前1 -
 bazi6634 共回答了17个问题
bazi6634 共回答了17个问题 |采纳率100%当分离能小于电子成对能时,形成低自旋配合物;当分离能大于电子成对能时形成高自旋配合物!1年前查看全部
- 某元素原子的摩尔质量为Qg/mol 则该元素一个原子的质量为多少克?
 大庆我帅狂1年前2
大庆我帅狂1年前2 -
 881008 共回答了15个问题
881008 共回答了15个问题 |采纳率100%1mol这种原子的质量是Q,1mol共是6.02*23也就是NA个.所以一个是Q/NA1年前查看全部
- 在一本书中提到一种碱性催化剂:氯原子链接至少为十二个碳原子的季铵碱@小弟很是迷惑,
 蝴蝶梦与飞1年前2
蝴蝶梦与飞1年前2 -
 兰心如梦 共回答了16个问题
兰心如梦 共回答了16个问题 |采纳率87.5%这是一种有亲水基(铵基)和疏水基(烷基)的相转移催化剂(也叫表面活性剂);在聚合反应中用来从水相向油滴中运送单体的.1年前查看全部
- 物理问题第三周期的非金属原子最高配位数能达到7个,而硅只有4个(键角比其他非金属的大),能不能用压力使硅原子间的键角减小
物理问题
第三周期的非金属原子最高配位数能达到7个,而硅只有4个(键角比其他非金属的大),
能不能用压力使硅原子间的键角减小?如果能,需要的压力大吗?
谢谢 虫子飞吧1年前1
虫子飞吧1年前1 -
 灰灰猫儿 共回答了12个问题
灰灰猫儿 共回答了12个问题 |采纳率75%这种事情从理论上来讲当然可以了,如果你有能耐控制一个分子的话,我想压力不大.1年前查看全部
- 1.某元素的各种同位素原子的近似相对原子质量怎么求?2.某元素的近似相对原子质量怎么求?
1.某元素的各种同位素原子的近似相对原子质量怎么求?2.某元素的近似相对原子质量怎么求?
3.元素的种类取决于 a微粒电子书 b微粒质子数 c原子质量数 d原子核电荷数
4.相对原子表中H喂1.00794这是 a一种氢原子的相对原子质量
b所有氢原子质量的平均值
c三种氢原子的平均相对原子质量
d氢元素的平均相对原子质量
写好编号,要直观易懂.谢 blindunicorn1年前2
blindunicorn1年前2 -
 ss上机l 共回答了27个问题
ss上机l 共回答了27个问题 |采纳率92.6%就是质量数
如有质量数为a(含量x%)和b(含量y%)及c(含量z%)的原子组成:M=x%a+y%b+z%c
d
d1年前查看全部
- .标准状况下,33.6L CH4气体中原子的数目是多少?
 LINYAJING9007131年前1
LINYAJING9007131年前1 -
 大象撼蚂蚁 共回答了22个问题
大象撼蚂蚁 共回答了22个问题 |采纳率90.9%标准状况下,气体的摩尔体积为22.4L,所以33.6L甲烷气体为33.6/22.4=1.5mol,共含有的分子数目是1.5*6.02*10^23个,每个分子中含有4个原子,所以原子个数为:4*1.5*6.02*10^23=3.612*10^24个1年前查看全部
- 晶体(包括离子,原子,分子,金属)发生物理变化(比如固体液化)是不是只克服分子间作用力?
 liaops-1021年前1
liaops-1021年前1 -
 guoting501 共回答了13个问题
guoting501 共回答了13个问题 |采纳率100%只有共价晶体分子才要克服分子间作用力
其他不存在分子结构,离子晶体克服离子键,金属克服金属键,原子晶体克服共价键1年前查看全部
- 无机化学问题(与轨道有关)在形成分子轨道时,原子轨道应达到最大重叠,这才能使体系的能量下降最大,使体系更稳定,这是为什么
无机化学问题(与轨道有关)
在形成分子轨道时,原子轨道应达到最大重叠,这才能使体系的能量下降最大,使体系更稳定,这是为什么?重叠大,能量下降快的原因?
波函数正负代表什么? 还是分手吧1年前1
还是分手吧1年前1 -
 缎带舞鞋 共回答了9个问题
缎带舞鞋 共回答了9个问题 |采纳率100%原子轨道达到最大重叠时,成键最稳定,分子键 电极电势小
也可以用波函数解释 +与+叠加-与-叠加 使波函数振幅增大
-与+叠加 会使波函数振幅减小 而且 重叠部分越大 波函数幅度减小越多
所以分子很稳定
如果在 波函数图像中(Y 角度分布函数)
+区内 Y函数 取正值
-区内 Y函数 取负值1年前查看全部
- 某固体仅有一种元素组成,其密度为5g/cm3.该固体结构为:在棱长为1*10^-7cm的立方体中有20个原子,则此元素的
某固体仅有一种元素组成,其密度为5g/cm3.该固体结构为:在棱长为1*10^-7cm的立方体中有20个原子,则此元素的相对原子质量约为_____?
 xingfu3331年前2
xingfu3331年前2 -
 假名士2008 共回答了17个问题
假名士2008 共回答了17个问题 |采纳率88.2%首先你要求出cm3有多少原子数 1/1*10^-7cm 再乘以20 城出来在除以阿伏伽德罗常数 是摩尔数 再用5除以摩尔数就可以 估计不用考虑原子公共的问题 我没计算器 不算了1年前查看全部
大家在问
- 1已知函数f(x)=㏒2x+1/1-x,若x1∈(1,2)
- 2那个,我对数学很感兴趣所以想试着学一下但是现在才是初中生也知道高数跟初中数学差的很远啦,不过我需要怎么一步一步的学才能学
- 3文科生数学不好的人可不可以学高数
- 4紧急!求函数定义域 f:(1/2,∞) f(x)=2㏒e(2x+1)!
- 5陋室铭中陋室不陋的原因是什么
- 6如果给周长24米的矩形宽增加2米就恰好是一个正方形,原来矩形面积多少?
- 7一个圆柱的体积是108πcm的三次方,且底面积的直径是圆柱高的一半,求这个圆柱的底面半径.
- 8在通风不畅的室内使用煤炉时,会产生有毒气体.(写出化学方程式).
- 9已知等差数列{an}满足a5+a6=28,则其前10项之和为______.
- 10百人百砖,丁每八,妇每四,幼童八人搬一块,丁妇幼童各几何?
- 11为什么水分子是有2个氢原子和1个氧原子构成而不是离子
- 12es sind bestimmt noch welche da怎么翻译?
- 13已知等差数列【an】满足a5+a6=28,则a10
- 14请教一个公式(a+b)^3=?
- 15You must be confident and proud in this kind of T shirt.[翻译成
