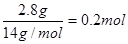.标准状况下,33.6L CH4气体中原子的数目是多少?
 LINYAJING9007132022-10-04 11:39:541条回答
LINYAJING9007132022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 大象撼蚂蚁 共回答了22个问题
大象撼蚂蚁 共回答了22个问题 |采纳率90.9%- 标准状况下,气体的摩尔体积为22.4L,所以33.6L甲烷气体为33.6/22.4=1.5mol,共含有的分子数目是1.5*6.02*10^23个,每个分子中含有4个原子,所以原子个数为:4*1.5*6.02*10^23=3.612*10^24个
- 1年前
相关推荐
- 已知2Fe2++Br2=2Fe3++2Br-.向100 mL的FeBr2溶液中通入标准状况下Cl22.24L,充分反应后
已知2Fe2++Br2=2Fe3++2Br-.向100 mL的FeBr2溶液中通入标准状况下Cl22.24L,充分反应后,溶液中有1/3的Br-被氧化成溴单质.求原FeBr2溶液的物质的量浓度
 天悯631年前1
天悯631年前1 -
 既然留念 共回答了16个问题
既然留念 共回答了16个问题 |采纳率100%通过氯气2.24L,即为0.1mol的氯气
由于二价铁离子(Fe2+)的还原性比Br-的要强,所以,Cl2先氧化Fe(2+)
设,该溴化亚铁溶液的量浓度为c mol/L,则亚铁离子的量为0.1c mol.
2Fe(2+)+Cl2=2Fe(3+)+2Cl(-),氧化全部的亚铁离子需要0.05c mol的氯气
而,溴离子的量为0.2c mol,1/3的Br(-)被氧化,就是0.2c/3 molBr(-)被氧化
2Br(-)+Cl2=2Cl(-)+Br2
所以,消耗0.1c/3 mol的氯气.
0.05c+0.1c/3=0.1
解得c=1.2 mol/L1年前查看全部
- 按要求回答下列问题.(1)SO 2 是形成酸雨的罪魁祸首.64gSO 2 的物质的量为______,在标准状况下的体积约
按要求回答下列问题.
(1)SO 2 是形成酸雨的罪魁祸首.64gSO 2 的物质的量为______,在标准状况下的体积约为______,所含原子数为______.
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na 2 CO 3 固体(NaHCO 3 )______
②FeCl 3 溶液(FeCl 2 )______
③Mg粉(Al)______
④CO 2 (SO 2 )______. 梨花阵阵1年前1
梨花阵阵1年前1 -
 watch_star 共回答了19个问题
watch_star 共回答了19个问题 |采纳率84.2%(1)64SO 2 的物质的量=
64g
64g/mol =1mol,标况下SO 2 的体积=1mol×22.4L/mol=22.4L,SO 2 分子含有3个原子,含有原子数目=1mol×3×N A mol -1 =3N A ,
故答案为:1mol;22.4L;3N A ;
(2)①由于碳酸氢钠加热分解生成碳酸钠,故可以加热方法除去混有的碳酸氢钠;
②氯气氧化氯化亚铁生成氯化铁,用氯气除去氯化铁溶液中混有的氯化亚铁;
③Al与NaOH溶液(或KOH溶液)反应反应,而Mg不能反应,再进行过滤分离,可以除去混有的Al;
④二氧化硫有还原性,能与酸性高锰酸钾反应生成硫酸;二氧化硫能与饱和的碳酸氢钠反应反应生成二氧化碳,可以用KMnO 4 (H + )溶液(或饱和NaHCO 3 溶液)除去二氧化碳中混有的二氧化硫,
故答案为:①加热;②Cl 2 ;③NaOH溶液(或KOH溶液);④KMnO 4 (H + )溶液(或饱和NaHCO 3 溶液).1年前查看全部
- 使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为( )
使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为( )
A. 6.4g
B. 11g
C. 8.2g
D. 1.6g mmickeyy1年前3
mmickeyy1年前3 -
 xp78150815 共回答了19个问题
xp78150815 共回答了19个问题 |采纳率84.2%解题思路:根据气体的体积差,通过差量法计算参加反应的二氧化碳体积、生成的氧气的体积,判断4.48L气体的组成及各成分的体积,再根据n=
计算各组分气体的物质的量,利用m=nM计算质量.V Vm 令参加反应的CO2气体的体积为a,生成的O2的体积为b,则:
2CO2+2Na2O2=2Na2CO3+O2,气体体积减小△V
2 1 1
ab5.6L-4.48L=1.12L
解得a=2.24L,b=1.12L.
所以4.48L气体中CO2体积为5.6L-2.24L=3.36L,O2的体积为1.12L.
所以4.48L气体的质量为[3.36L/22.4L/mol]×44g/mol+[1.12L/22.4L/mol]×32g/mol=8.2g.
故选C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查根据方程式的计算,难度中等,本题采取差量法计算,可以不用讨论或计算判断最后气体的组成,注意差量法的理解与运用.1年前查看全部
- N A 为阿伏加德罗常数,下列说法正确的是 ( ) A.标准状况下,11.2
N A 为阿伏加德罗常数,下列说法正确的是 ()
A.标准状况下,11.2 L的己烷所含的分子数为0.5 N A B.28 g乙烯所含共用电子对数目为4 N A C.0.1molC n H 2n+2 中含有的C-C键数为0.1n N A D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 N A  兰香默默1年前1
兰香默默1年前1 -
 小贝丢丢 共回答了11个问题
小贝丢丢 共回答了11个问题 |采纳率90.9%1年前查看全部
- 利用化学方程式计算题1.制取标准状况下的氢气(密度为0.0899g/L)11.2L,需要多少克锌粒跟盐酸反应?(Zn+H
利用化学方程式计算题
1.制取标准状况下的氢气(密度为0.0899g/L)11.2L,需要多少克锌粒跟盐酸反应?(Zn+H2SO4=ZnSO4+H2)
2.若充分燃烧8g氢气,在标准状况下,最少需要氧气多少升(标准状况下氧气的密度约为1.43g/L)? fenglin12151年前1
fenglin12151年前1 -
 romanticgc4 共回答了28个问题
romanticgc4 共回答了28个问题 |采纳率89.3%1第一个32.5g
算出氢气质量1g
2 8g氢气需要64g氧气转化以下1年前查看全部
- 用水吸收标准状况下的5.6L的氯化氢气体,制成200ML溶液,在所得的溶液中加入6.5g锌粒,充分反应后,计算溶液中Zn
用水吸收标准状况下的5.6L的氯化氢气体,制成200ML溶液,在所得的溶液中加入6.5g锌粒,充分反应后,计算溶液中Zn2+ H+ Cl-的物质的量浓度分别为多少?(溶液的体积变化忽略不计)
 懒懒梦1年前6
懒懒梦1年前6 -
 请叫我王丽娟 共回答了14个问题
请叫我王丽娟 共回答了14个问题 |采纳率100%5.6LHCl的物质的量是5.6÷22.4=0.25mol,6.5gZn是0.1mol,所以盐酸过量
Zn+ 2HCl= ZnCl2+H2↑
1mol 2mol 1mol
0.1mol n m n=0.2mol m=0.1mol
所以c(Zn2+)=0.1÷0.2=0.5mol/L
(cH+)=(0.25-0.2)÷0.2=0.25mol/L
c(Cl-)=0.25÷0.2=1.25mol/L1年前查看全部
- 1.在标准状况下,8g SO2 所占体积相同的氧气的质量是( )
1.在标准状况下,8g SO2 所占体积相同的氧气的质量是( )
A.8g B.16g C.4g D.2g
2.在标准状况下,跟11.2 L氨气( NH3 )中所含氢原子数目相同的下列物质是( )
A.8.4 L CH4
B.0.3 mol HCl
C.49 g H2SO4
D.18 g H2O
3.配制一定物质的量浓度的溶液时,下列操作会使所配的溶液物质的量浓度偏高的是( )
忽略了洗涤烧杯的步骤
定容时液体凹面最低点高于刻度线
定容时液体凹面最低点低于刻度线
定容、摇匀、静置后发现液体凹面低于刻度线又加水至刻度线 florawen831年前2
florawen831年前2 -
 shinezd 共回答了10个问题
shinezd 共回答了10个问题 |采纳率90%1.C,易得二氧化硫物质的量为1/8mol,标况下均为气体,且体积与物质的量成正比,所以氧气物质的量也为1/8mol,乘以摩尔质量,得4g
2.A,标况下氨气物质的量为0.5mol,所以氢原子数目为1.5mol,计算可得,8.4L(3/8mol)甲烷符合条件;B为0.3mol,C为1mol,D为2mol
3.选第三个,相当于水加少了,浓度就偏高1年前查看全部
- 熟悉化学的朋友,把含CaCO3质量分数为0.9的大理石100g与足量的盐酸反应(杂质在反应),在标准状况下,能生成CO2
熟悉化学的朋友,
把含CaCO3质量分数为0.9的大理石100g与足量的盐酸反应(杂质在反应),在标准状况下,能生成CO2多少毫升? t1f56881年前1
t1f56881年前1 -
 babyjyy 共回答了20个问题
babyjyy 共回答了20个问题 |采纳率90%CaCO3+2HCl=CaCl2+CO2+H2O杂质不反应情况下100gCaCO3生成44gCO2,因为CaCO3含量为0.9,因此CO2产量0.9mol为44*0.9=39.6g,体积=22.4L*0.9=20.16L=20160mL1年前查看全部
- 将标准状况下的aL升氯化氢溶于100毫升水中,得到盐酸密度为bg/ml,则该盐酸的物质的
 wzzzsz1年前2
wzzzsz1年前2 -
 qqzhu8423 共回答了12个问题
qqzhu8423 共回答了12个问题 |采纳率100%氯化氢的摩尔数是:aL/22.4L ;
氯化氢的质量是:36.5g*aL/22.4L ;
形成的溶液的质量是:36.5a/22.4+100 ;
形成的溶液的体积是:(36.5a/22.4+100)/b ;
所以1000毫升溶液的氯化氢的量浓度mol/L是:
(1000a/22.4)/[(36.5a/22.4+100)/b]
=(1000ab/22.4)/(36.5a/22.4+100)
=1000ab/(36.5a+100*22.4) .1年前查看全部
- 0.54g某金属投入足量稀盐酸中,充分反应后,收集到标准状况下672mlH2.(1)所得H2的质量是多少克?
0.54g某金属投入足量稀盐酸中,充分反应后,收集到标准状况下672mlH2.(1)所得H2的质量是多少克?
(2)反应消耗多少摩尔HCL?
(3)若反应后金属在其氯化物中显+3价,则该金属的摩尔质量是多少? 梦儿03591年前4
梦儿03591年前4 -
 luochunyi99 共回答了16个问题
luochunyi99 共回答了16个问题 |采纳率100%1.672mlH2的物质的量是0.672/22.4=0.03mol所以H2的质量是0.03*2=0.06g2.H2中的氢元素全部来自盐酸,所以盐酸的物质的量是0.03*2=0.06mol3.设金属为M.若反应后金属在其氯化物中显+3价,则反应方程式为:2M+6HCl=2MCl3+3...1年前查看全部
- (1)标准状况下,含有相同氧原子数的CO和CO2,其物质的量之比为______;质量之比为______;碳原子数之比为_
(1)标准状况下,含有相同氧原子数的CO和CO2,其物质的量之比为______;质量之比为______;碳原子数之比为______;体积之比为______.
(2)硫酸铵[(NH4)2SO4]是常见的氮肥,写出它在水中的电离方程式______;
(3)写出与Cu2++2OH-═Cu(OH)2↓离子方程式相对应的化学方程式______;
(4)NaHSO4在水溶液中的电离方程式______.
(5)写出用稀硫酸清洗铁锈(Fe2O3)的离子方程式:______. 崔书君1年前1
崔书君1年前1 -
 公主恋王子 共回答了21个问题
公主恋王子 共回答了21个问题 |采纳率81%解题思路:(1)根据物质分子含有氧原子数目确定CO和CO2的物质的量之比,根据m=nM确定二者质量之比,二者都含有相同的碳原子数目,故碳原子数之比二者物质的量之比,相同条件下体积之比等于物质的量之比;
(2)在水溶液中的电离的程度分析判断在水溶液中是否完全电离,强电解质完全电离,弱电解质部分电离,离子团不能再拆;
(3)可溶性铜盐与强碱反应生成氢氧化铜沉淀和可溶性盐的离子反应为Cu2++2OH-═Cu(OH)2↓;
(4)硫酸氢钠是强电解质,水溶液正完全电离生成钠离子、氢离子、硫酸根离子;
(5)反应生成硫酸铁和水,氧化铁在离子反应中应保留化学式.(1)CO分子含有1个氧原子,CO2分子含有2个氧原子,氧原子数目相同,则:n(CO)=2n(CO2),故n(CO):n(CO2)=2:1,所以m(CO):m(CO2)=2×28:1×44=14:11,二者都含有相同的碳原子数目,故碳原子数之比二...
点评:
本题考点: 电离方程式的书写;离子方程式的书写.
考点点评: 本题考查电离方程式、离子方程式的书写,明确电解质的强弱、发生的化学反应是解答本题的关键,题目难度不大.1年前查看全部
- 某金属粉末由铁、锌、铝、组成与足量的稀硫酸反应生成氢气在标准状况下为3.36L,则该金属混合物的物质的量可能是( ).A
某金属粉末由铁、锌、铝、组成
与足量的稀硫酸反应生成氢气在标准状况下为3.36L,则该金属混合物的物质的量可能是( ).
A.0.15mol B.0.1mol C.0.12mol D.0.14mol 玫瑰香水rose1年前1
玫瑰香水rose1年前1 -
 RLinux 共回答了17个问题
RLinux 共回答了17个问题 |采纳率100%1 mol Fe 和1mol Zn 都是 产生 1 mol H2
而1 mol Al 产生 1.5 mol H2
3.36 L 氢气是 3.36/22.4==0.15 mol
若全部是Al ,则金属物质的量最小,是 0.15/1.5==0.1 mol
若没有Al,则金属物质的量最大,是 0.15/1==0.15 mol
则 0.1< 金属物质的量1年前查看全部
- 2.22g某醇与足量的金属钠反应收集到标准状况下的气体336mL,则该醇分子式
 xuanzhe7771年前1
xuanzhe7771年前1 -
 ah_sba 共回答了13个问题
ah_sba 共回答了13个问题 |采纳率76.9%醇与钠反应生成醇钠与氢气2ROH+2Na====2RONa+H2生成氢气物质的量n(H2)=0.336/22.4=0.015mol2.22g该醇中醇羟基的物质的量n(-OH)=0.015*2=0.03mol于是含有1mol醇羟基的该醇,质量为2.22/0.03=74g假定该醇是饱和一元醇,...1年前查看全部
- 把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
把12.1克铁屑与锌粒的混合物投入足量的稀硫酸中,充分反应后,金属全部溶解,在标准状况下
共收集到气体4.48升,求混合物中铁的质量分数 wwm4311年前1
wwm4311年前1 -
 1986120212 共回答了19个问题
1986120212 共回答了19个问题 |采纳率78.9%设混合物中含锌的物质的量为x、含铁的物质的量为y
则有:65g/mol × x + 56g/mol × y =12.1g ----(1)
Zn + H2SO4=ZnSO4 + H2 ↑
1 1
x x
Fe+ H2SO4=FeSO4 + H2 ↑
1 1
y y
x + y = 4.48L ÷ 22.4L/mol=0.2mol --------(2)
联立(1)(2)解得
X=0.1mol Y=0.1mol
则混合物中铁的质量=0.1mol × 56g/mol=5.6g
混合物中铁的质量分数=5.6g ÷ 12.1g × 100%=46.3%
答:混合物中铁的质量分数为46.3%1年前查看全部
- 按体积比1比2比3所组成的氮气氧气二氧化碳混合物100克在标准状况下的体积为?
按体积比1比2比3所组成的氮气氧气二氧化碳混合物100克在标准状况下的体积为?
咋子我等于60.48安?难道算错了啊? 01ablage1年前2
01ablage1年前2 -
 水木雅美 共回答了22个问题
水木雅美 共回答了22个问题 |采纳率90.9%我算下来是60L
设N2=n mol,则O2=2n mol,CO2=3n mol
28n+32*2n+44*3n=100
n=100/224 mol
6n=600/224 mol
标准状况下体积V=60L1年前查看全部
- 将标准状况下2.24HCL气体全部溶于水中,配置得到250ml溶液,计算该盐酸的物质的量的溶度.若该盐酸密度为1.2g/
将标准状况下2.24HCL气体全部溶于水中,配置得到250ml溶液,计算该盐酸的物质的量的溶度.若该盐酸密度为1.2g/cm3,求词演算的质量分数,求详解,尤其是最后一问!
 duan3331年前1
duan3331年前1 -
 hf04037237 共回答了14个问题
hf04037237 共回答了14个问题 |采纳率100%将标准状况下2.24L HCl的物质的量=2.24/22.4=0.1mol
该盐酸的物质的量的浓度=0.1/0.25=0.4mol/L
溶液的质量=250*1.2=300克
0.1摩尔氯化氢的质量=0.1*36.5=3.65克
溶液 的质量=300+3.65=303.65克
盐酸溶液的质量分数=3.65/303.65=12.02%
稀盐酸的密度比1.2g/ml要小.1年前查看全部
- 燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某烃后,测得生成CO2的体积为8.96L(标准状况),生
燃烧法是测定有机化合物化学式的一种重要方法.完全燃烧0.1mol某烃后,测得生成CO2的体积为8.96L(标准状况),生成H2O的质量为9.0克.
(1)求该烃的分子式
(2)写出该烃可能有的结构简式. 淘气天08涯1年前1
淘气天08涯1年前1 -
 紫沁嫣然 共回答了13个问题
紫沁嫣然 共回答了13个问题 |采纳率100%解题思路:(1)根据有机物燃烧时,有机物中的碳全部转化为二氧化碳,由二氧化碳的质量,可求得烃中C原子个数,有机物中的氢全部转化为水,由水的其质量可以可求得烃中H原子个数,以此可求得烃的分子式;
(2)根据碳链异构来书写同分异构体;(1)二氧化碳为体积为8.96L(标准状况),n(CO2)=[8.96L/22.4L/mol]=0.4mol,n(C)=n(CO2)=0.4mol;水的质量为9.0g,n(H2O)=[9.0g/18g/mol]=0.5mol,n(H)=2n(H2O)=2×0.5mol=1mol,即0.1mol烃中含有0.4molC原子,1molH原子,所以该烃分子中C原子个数为4,H原子个数为10,所以该烃的分子式为C4H10,
答:该烃的分子式为C4H10;
(2)由碳链异构可知,C4H10的可能的结构简式为:CH3CH2CH2CH3或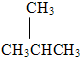 ;
;
答:该烃可能有的结构简式.CH3CH2CH2CH3或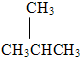 ;
;点评:
本题考点: 有机物实验式和分子式的确定.
考点点评: 本题考查学生燃烧法确定有机物分子组成和同分异构体的确定,根据原子守恒法来解答,难度不大.1年前查看全部
- 在Mg+2HCl=MgCl+H2→中,元素被氧化,若消耗2molMg,则在标准状况下生成H2的体积是 ,转移的电子数是
在Mg+2HCl=MgCl+H2→中,元素被氧化,若消耗2molMg,则在标准状况下生成H2的体积是 ,转移的电子数是 .
 633380651年前1
633380651年前1 -
 gdmx9136 共回答了25个问题
gdmx9136 共回答了25个问题 |采纳率88%44.8L;4mol.1年前查看全部
- 关于气体摩尔体积的某气体的摩尔质量为M g/mol,分子数为x,在标准状况下所占的体积是V L,质量是m g.某元素原子
关于气体摩尔体积的
某气体的摩尔质量为M g/mol,分子数为x,在标准状况下所占的体积是V L,质量是m g.某元素原子的摩尔质量为A g/mol,原子个数是y,NA为阿伏加德罗常数,试说明下列各式表示的意义.M/NA x/NA A/NA y/NA m/V m/M fang11261年前1
fang11261年前1 -
 LY-陈清源 共回答了22个问题
LY-陈清源 共回答了22个问题 |采纳率95.5%M/NA ------1个气体分子的质量
x/NA ------气体的物质的量
A/NA ----------1个原子的质量
y/NA ------------原子的物质的量
m/V --------------气体的密度
m/M----------------气体的物质的量1年前查看全部
- 3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
3.84克铜投入盛定量浓度HNO3中标准状况下收集到1.68L气体时铜恰全消耗写化学方程式求反应中耗硝酸物质量
能具体点吗
方程式帮我写清楚点好吗
我会非常感谢 moonfetch1年前1
moonfetch1年前1 -
 hst168 共回答了19个问题
hst168 共回答了19个问题 |采纳率89.5%n(Cu)=0.06mol
n气体=0.075mol
所以反应就是8Cu+24HNO3=8Cu(NO3)2+3NO(气体)+5NO2(气体)+12H2O
消耗硝酸物质的量为0.18mol1年前查看全部
- 某气体是引起温室效应的主要气体之一,0.01mol该气体的质量为0.44g.该气体的摩尔质量为______,在标准状况下
某气体是引起温室效应的主要气体之一,0.01mol该气体的质量为0.44g.该气体的摩尔质量为______,在标准状况下该气体的密度是______.
 4703340141年前1
4703340141年前1 -
 本ID只上古典 共回答了28个问题
本ID只上古典 共回答了28个问题 |采纳率89.3%解题思路:依据摩尔质量M=[m/n],标准状况下气体密度=[M/Vm]来计算.该气体的摩尔质量M=[m/n]=[0.44g/0.01mol]=44g/mol,标准状况下气体密度ρ=[M/Vm]=[44g/mol/22.4L/mol]=1.96g/L.
故答案为:44g/mol;1.96g/L.点评:
本题考点: 物质的量的相关计算.
考点点评: 本题考查了物质的量和质量、摩尔质量以及密度和M、Vm之间关系的计算,掌握概念和换算定量关系是解题关键,题目较简单.1年前查看全部
- 实验室用含4 mol HCl的浓盐酸与足量MnO 2 共热制取氯气,若生成的气体全部逸出,在标准状况下可收集气体的体积是
实验室用含4 mol HCl的浓盐酸与足量MnO 2 共热制取氯气,若生成的气体全部逸出,在标准状况下可收集气体的体积是 [ ]A.44.8 L
B.22.4 L
C.小于22.4 L
D.介于22.4 L于44.8 L之间 celavie8191年前1
celavie8191年前1 -
 316728495 共回答了19个问题
316728495 共回答了19个问题 |采纳率100%C1年前查看全部
- 已知3cu+8HNO3======3CU(NO3)2+2NO↑+4H2O现反应生成4.48升(标准状况下)
已知3cu+8HNO3======3CU(NO3)2+2NO↑+4H2O现反应生成4.48升(标准状况下)
NO 1 消耗cu的质量是多少?若反应后的溶液的体积为150ml则生成的CU(NO3)2的物质的量溶度是多少? huaishui871年前1
huaishui871年前1 -
 power_211 共回答了22个问题
power_211 共回答了22个问题 |采纳率90.9%3cu+8HNO3=3CU(NO3)2+2NO↑+4H2O
0.3mol 4.48L=0.2mol
0.3X64=19.2g
生成的CU(NO3)2油关系式知道是0.3mol,浓度就是0.3mol/150ml=2mol/L1年前查看全部
- 将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
将1.2MOL 金属钠与下列物质反应在标准状况下能生成11.2L氢气的是
(A)1MOL乙醇
(B)1MOL乙二醇
(C)含1MOL甲醇的水溶液
(D)1MOL丙二醇
我做出来怎么每个选项都是生成0.6mol的氢气啊 uway1年前1
uway1年前1 -
 nqwi 共回答了20个问题
nqwi 共回答了20个问题 |采纳率85%2NA+2H2O=2NaOH+H2
2CH3CH2OH+2NA=2CH3CH2ONA+H2
选A的.1MOL乙醇反应完了就完了,NA是过量的.没有水的.1年前查看全部
- A和B两种有机物,各取0.1mol 充分燃烧,都生成4.48L CO2(标准状况)和3.6g H2O.已知A对氢气的相对
A和B两种有机物,各取0.1mol 充分燃烧,都生成4.48L CO2(标准状况)和3.6g H2O.已知A对氢气的相对密度为14,B中碳元素的质量分数为40%,且B的水溶液具有导电性.试求A和B的分子式,并写出它们的结构简式.
 Google测试员55511年前1
Google测试员55511年前1 -
 龙回ff 共回答了20个问题
龙回ff 共回答了20个问题 |采纳率100%解题思路:根据二氧化碳的体积和水的质量分别计算物质的量,可知A、B分子中C、H原子个数,A对氢气的相对密度为14,则A的相对分子质量为28,B的水溶液具有导电性,则B中含有-COOH官能团,结合B中碳元素的质量分数,计算B的相对分子质量,进而推断分子式和可能的结构简式.4.48L CO2的物质的量为[4.48L/22.4L/mol]=0.2mol,3.6g H2O的物质的量为[3.6g/18g/mol]=0.2mol,
则A和B两种有机物中含有C原子个数为:[0.2mol/0.1mol]=2,
含有H原子个数为:
0.2mol
0.1mol×2=4,
A对氢气的相对密度为14,则A的相对分子质量为2×14=28,
而2×12+4=28,
所以A的分子式为C2H4,应为乙烯,结构简式为CH2=CH2,
B的水溶液具有导电性,则B中含有O元素,设B的分子式为C2H4Ox,
由B中碳元素的质量分数为40%可知
2×12
2×12+16x=0.4,解之得:x=2,
故B的分子式为C2H4O2,应为乙酸,结构简式为CH3COOH,
答:A和B的分子式分别为C2H4、C2H4O2,结构简式分别为CH2=CH2、CH3COOH.点评:
本题考点: 有关有机物分子式确定的计算.
考点点评: 本题考查有机物分子式的计算,题目难度不大,注意相对密度与相对分子质量的关系,注重题中信息的把握.1年前查看全部
- 1L标准状况下的HCL气体溶于水形成2L溶液,球该溶液的物质的量浓度.
 cnxmpr1年前3
cnxmpr1年前3 -
 水蓝雅 共回答了19个问题
水蓝雅 共回答了19个问题 |采纳率78.9%标况1L=1/22.4mol
∴浓度c=(1/22.4)/2=1/44.8=0.022mol/L1年前查看全部
- 化学中标准状况与非标准状况的转换公式
 davyhuang1年前1
davyhuang1年前1 -
 superloverkiki 共回答了16个问题
superloverkiki 共回答了16个问题 |采纳率87.5%克拉珀龙方程式PV=nRT
P表示压强,单位Pa;
V表示气体体积,单位立方米;
n表示物质的量,单位mol;
T表示热力学温度,单位K(开尔文);
R表示气体常数,R=8.314帕米3/摩尔·K.
将物质的各项性质转换为上述标准单位即可
推论:
1)同温同压时:①V1:V2=n1:n2=N1:N2
②ρ1:ρ2=M1:M2
③ 同质量时:V1:V2=M2:M1
(2)同温同体积时:④ p1:p2=n1:n2=N1:N2
⑤ 同质量时:p1:p2=M2:M1
(3)同温同压同体积时:⑥ ρ1:ρ2=M1:M2=m1:m2
如果你是学习高中化学,常用的是下面的推论
如果你学物理或者物化,上面的克拉伯龙方程比较实用,当然条件简单的话也可以用下面的推论1年前查看全部
- 将mg铝铁合金分成两等份一份与足量盐酸充分反应收集到标准状况下氢气体积为17.92L另一份与足量的氢氧化钠充分反应收到1
将mg铝铁合金分成两等份一份与足量盐酸充分反应收集到标准状况下氢气体积为17.92L另一份与足量的氢氧化钠充分反应收到1.2g氢气球M值.
 脆弱的鱼儿1年前5
脆弱的鱼儿1年前5 -
 科学163 共回答了17个问题
科学163 共回答了17个问题 |采纳率82.4%铁与NaOH不反应
这两种金属反应产物化合价分别是+2、+3
对应的,置换出的氢原子对应的系数就是2和3
设n(Fe) = xmol n(Al) = y mol
56x + 27y = m
2x + 3y = 17.92 * 2 / 22.4
3y = 1.2 * 2 / 2
(2、3式氢物质的量乘2的原因是1个氢气分子占2个氢原子)
解出以上3个方程得:
x = 0.2 mol
y = 0.4 mol
m = 22 g1年前查看全部
- 将标准状况下22.4L氨气溶于1L水中所得溶液的物质量浓度为1MOL/L,这句话对不,为什么
 qjw戚少1年前1
qjw戚少1年前1 -
 伊莲娜 共回答了17个问题
伊莲娜 共回答了17个问题 |采纳率94.1%不对.氨气是1摩.但溶液不是一升.要用氨气的质量加1升水的质量和后除以所得的氨水的密度,已不是1升.1年前查看全部
- 将标准状况下5.6L氯化氢气体溶于蒸馏水制成100ml溶液 密度为1.1g /ml 向其中加入足量的锌来制取氢气.
将标准状况下5.6L氯化氢气体溶于蒸馏水制成100ml溶液 密度为1.1g /ml 向其中加入足量的锌来制取氢气.
试回答1.盐酸的物质的量浓度时多少?
2.标准状况下能制的氢气多少L?
3.盐酸的质量分数是多少? xiaojin2001年前1
xiaojin2001年前1 -
 qingxingleleng06 共回答了18个问题
qingxingleleng06 共回答了18个问题 |采纳率83.3%1.氯化氢物质的量0.25mol,溶液体积0.1L,所以物质的量浓度为2.5mol/L
2.两分子氯化氢对应一分子氢气,所以氢气体积为氯化氢的一半2.8L
3.溶质质量0.25×36.5=9.125g 溶液质量=体积×密度=110g
质量分数约为8.30%1年前查看全部
- 标准状况下,在四个干燥的烧瓶中分别充入标准状况下,在四个干燥的烧瓶中分别充入
标准状况下,在四个干燥的烧瓶中分别充入标准状况下,在四个干燥的烧瓶中分别充入
标准状况下,在四个干燥的烧瓶中分别充入:①纯净的氨气 ②混有1/3体积空气的氯化氢气体 ③纯净的NO2气体 ④混有少量O2的NO2气体,然后各做喷泉实验.实验后,四个烧瓶中溶液的物质的量浓度大小关系是?(假设溶质不扩散) 请说明计算过程
请务必分析每个烧瓶内的变化以及最终结果!
答案是1=2=3>4,无法理解 九月的常春藤1年前3
九月的常春藤1年前3 -
 bluetu 共回答了11个问题
bluetu 共回答了11个问题 |采纳率72.7%① = ② = ③ > ④
①②③都是消耗的气体体积与形成溶液的体积相同;浓度相同.
④消耗的气体体积中只有部分得到溶质(O2 + 4NO2 + 2H2O = 4HNO3)1年前查看全部
- 有一种气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是( )
有一种气体的质量是14.2g,体积是4.48L(标准状况),该气体的摩尔质量是( )
A. 28.4
B. 28.4 g•mol-1
C. 71
D. 71 g•mol-1 筱也1年前0
筱也1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- MnO2+4HCl(浓)===(加热)MnCl+Cl2+2H2O 反应中,产生的氯气在标准状况下的体积为11.2L.
MnO2+4HCl(浓)===(加热)MnCl+Cl2+2H2O 反应中,产生的氯气在标准状况下的体积为11.2L.
计算参加反应的HCl的物质的量,一级反应中被氧化的HCl的物质的量 authenauthen1年前2
authenauthen1年前2 -
 wjj6260 共回答了26个问题
wjj6260 共回答了26个问题 |采纳率96.2%MnO2+4HCl(浓)=△=MnCl2+Cl2↑+2H2O该反应中,4mol HCl参与反应,2mol被氧化为Cl2,2mol参与形成MnCl2,1/2的HCl被氧化.n(Cl2)=V/Vm=11.2/22.4=0.5molMnO2+4HCl(浓)=△=MnCl2+Cl2↑+2H2O4 1n(HCl) 0.5moln(HCl)=2mol被氧...1年前查看全部
- 将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H
将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H2S04恰好反应完全.
(1)该原电池的负极反应式为______
(2)原稀硫酸的物质的量浓度是______mol•L-1
(3)列式计算锌片减少的质量. ttQWERss1年前1
ttQWERss1年前1 -
 轩辕行素311 共回答了12个问题
轩辕行素311 共回答了12个问题 |采纳率100%解题思路:(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,写出相应的电极反应式.
(2)锌和稀硫酸反应生成氢气,根据氢气体积和硫酸的关系式计算硫酸的物质的量浓度.
(3)根据锌和氢气之间的关系式计算锌减少的质量.(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以负极上的电极反应式为:Zn-2e-=Zn2+,电池反应式为:Zn+2H+=Zn2++H2↑.
故答案为:Zn-2e-=Zn2+.
(2)设硫酸的物质的量浓度是C.
Zn+H2SO4=ZnSO4+H2↑
1mol22.4L
0.25Cmol 6.72L
C=1.2mol/L.
故答案为:1.2.
(3)设锌减少的质量为m.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m6.72L
m=19.5g
故答案为:19.5g.点评:
本题考点: 原电池和电解池的工作原理;氧化还原反应的计算.
考点点评: 本题考查了电极反应式的书写及物质的量的有关计算,难度不大,根据物质的物质的量之间的关系式来解答即可.1年前查看全部
- 0.05 mol X 能与足量的NaHCO3溶液反应放出22.4L CO2 (标准状况),则X的分子式为( ).A.c2
0.05 mol X 能与足量的NaHCO3溶液反应放出22.4L CO2 (标准状况),则X的分子式为( ).A.c2H2O4 B.C3H6O4 C.C4H8O4 D.C5H10O4
不好意思打错了,是0.5mol x 仲园老大1年前1
仲园老大1年前1 -
 黑点斑斑 共回答了16个问题
黑点斑斑 共回答了16个问题 |采纳率93.8%题目不对吧
因为n(CO2)=22.4/22.4=1mol,所以与NaHCO3反应生成CO2的羧基的量为
n(-COOH)=n(CO2)=1mol,又因为X的量为0.05 mol,
所以1mol/0.05mol=20,即1molX中含有20mol的羧基?
如果X的量为0.5mol,或者CO2为2.24L,1molX中含有2mol的羧基,那么答案为A
X为HOOCCOOH1年前查看全部
- 按体积比为1:2:3所组成的N2、O2、CO2的混合气体150g.该混合气体在标准状况下的体积为?
 burgerqueen1年前4
burgerqueen1年前4 -
 lfoliii 共回答了24个问题
lfoliii 共回答了24个问题 |采纳率91.7%90L.详细过程如下:
由PV=nRT,压强、温度一定时,体积比就等于物质的量之比.我们设氮气物质的量是x mol,那么氧气、二氧化碳物质的量就分别是 2x 和 3x.我们可以根据总质量列方程如下:
28 * x + 32 * 2x + 44 * 3x = 150;整理得
224x = 150,所以 x=150/224mol
混合气体的总物质的量 n = x + 2x + 3x = 6x = 900/224 mol
最后根据总物质的量来计算体积,在标准状况下,摩尔体积为22.4L/mol,V=900/224*22.4=90L
希望这个答案对你有所帮助!1年前查看全部
- 化学 氯气(3)含有杂质10%的MnO2 9.67g跟过量的12mol/L浓盐酸80mL充分反应,在标准状况下,能收集到
化学 氯气(3)
含有杂质10%的MnO2 9.67g跟过量的12mol/L浓盐酸80mL充分反应,在标准状况下,能收集到Cl2多少升?将剩余物加水稀释到100mL,则氯离子的物质的量浓度为多少?(假设反应中没有HCl损失) a1s21年前1
a1s21年前1 -
 zaizhaojop 共回答了13个问题
zaizhaojop 共回答了13个问题 |采纳率92.3%n(Mno2)=9.67g*90%/87g/mol=0.1mol n(HCL)=12mol/l*0.08L=0.96mol Mno2+4HCL==MnCL2+CL2↑ 0.1 0.4 0.1 V(CL2)=0.1MOL*22.4L/MOL=2.24L N(CL-)=0.96mol-0.1mol*2=0.76mol 100ml=0.1L c=n/v=0.76mol/0.1L=7.6mol/L1年前查看全部
- 某烃含氢14.3%,在标准状况下密度为2.5g/L 求分子式
 海无颜1231年前1
海无颜1231年前1 -
 00ya 共回答了13个问题
00ya 共回答了13个问题 |采纳率76.9%M=2.5×22.4=56
H=56×14.3%=8
C=(56-8)/12=4
分子式为C4H81年前查看全部
- 电解饱和食盐水50mL,某时刻测得H2体积为16.8mL(标准状况),此时溶液pH约为____.(lg2=0.3,lg3
电解饱和食盐水50mL,某时刻测得H2体积为16.8mL(标准状况),此时溶液pH约为____.(lg2=0.3,lg3=0.5,lg5=0.7)
麻烦写出详细过程及原因, 瘦月断肠人1年前2
瘦月断肠人1年前2 -
 Hicc_p 共回答了24个问题
Hicc_p 共回答了24个问题 |采纳率91.7%2H20+2NaCl=2NaOH+H2↑+Cl↑
2mol 22.4L
Xmol 16.8ml
X=1.5×10*-3mol
水的消耗应该是忽略不记的吧·要的话你再加上吧·
C=n/V=1.5×10*-3mol÷0.05L=0.03mol/L
pOH=-lg0.03=2-lg3=1.5
pH=14-pOH=12.51年前查看全部
- 标准状况下游H2和O2的混合气体44.8升,点燃完全反应后恢复至原状况余气体11.2升
标准状况下游H2和O2的混合气体44.8升,点燃完全反应后恢复至原状况余气体11.2升
求原混气中H2和O2各占多少升? 下相男人1年前2
下相男人1年前2 -
 zp2zp 共回答了15个问题
zp2zp 共回答了15个问题 |采纳率100%余气体11.2升是过量的H2或O2
1.如果H2过量:
H2与O2反应的体积比是2:1
那么参加反应的H2有(44.8-11.2)*2/3=22.4L
O2有11.2L
原来有H2:33.6L ; O2 11.2L
2.如果O2过量
那么原来有H2 22.4L; O2 22.4L1年前查看全部
- 在未说明标准状况时可否使用阿伏伽德罗常数
 顺子19801年前3
顺子19801年前3 -
 wxxxl 共回答了23个问题
wxxxl 共回答了23个问题 |采纳率91.3%可以的
阿伏伽德罗常量(符号:NA)是物理学和化学中的一个重要常量.它的数值为:
一般计算时取6.02×10^23或6.022×10^23.它的正式的定义是0.012千克碳12中包含的碳12的原子的数量.历史上,将碳12选为参考物质是因为它的原子量可以测量的相当精确.
阿伏伽德罗常量因意大利化学家阿伏伽德罗(Avogadro A)得名.现在此常量与物质的量紧密相关,摩尔作为物质的量的国际单位制基本单位,被定义为所含的基本单元数为阿伏伽德罗常量(NA).其中基本单元可以是任何一种物质(如分子、原子或离子).1年前查看全部
- 现含有CaCO3质量分数为90%的石灰石100克,高温煅烧至完全反应,计算标准状况下产生二氧化碳多少升?(二氧化碳的密度
现含有CaCO3质量分数为90%的石灰石100克,高温煅烧至完全反应,计算标准状况下产生二氧化碳多少升?(二氧化碳的密度是 1.98克/升)
 1周间1年前1
1周间1年前1 -
 zxc_vbn 共回答了21个问题
zxc_vbn 共回答了21个问题 |采纳率95.2%CaCO3=CaO十CO2
100 44
100*90% x
100/90=44/x
x=39.6g
v=39.6/1.98=20升1年前查看全部
- 把5.85g NaCl 晶体和10g 98%的浓硫酸(H2SO4)混合,强热,问可产生多少升HCl气体.(标准状况)
 忆蓝鸟1年前2
忆蓝鸟1年前2 -
 panlu01 共回答了14个问题
panlu01 共回答了14个问题 |采纳率100%NaCl +H2SO4= NaHSO4+HCl
58.5g 98g 22.4L
5.85g x y x=9.8g y=2.24L1年前查看全部
- 实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与
实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与盐酸反应,问至少需要含碳酸钙90%的石灰石多少克?
 170355411年前4
170355411年前4 -
 装靓宝宝 共回答了18个问题
装靓宝宝 共回答了18个问题 |采纳率94.4%11.2 L 0.5 mol
CaCO3 + 2 H+ = Ca2+ + H2O + CO2(气体)
0.5 mol 0.5 mol
0.5 mol / 90% * 100 g/mol = 55.6 g
答案:55.6g1年前查看全部
- 3.2克Cu与足量的1摩尔每升稀硝酸完全反应,计算生成NO多少升(标准状况).反应消耗稀硝酸多少毫升
 步舞凌乱1年前3
步舞凌乱1年前3 -
 榴岛书生 共回答了16个问题
榴岛书生 共回答了16个问题 |采纳率87.5%设反应消耗的硝酸 x mol,生成NO y mol.
3.2克Cu的物质的量是0.05mol.
3Cu + 8HNO3 === 3Cu(NO3)2 + 2NO↑ + 4H2O
3 8 2
0.05mol x mol y mol
则可列出比例式为0.05mol / 3 = x mol /8 =y mol / 2
解得x =0.4/3 y=0.1/3
所以,生成NO的体积是V(NO)=0.1/3 mol × 22.4L/mol = 0.75 L
反应消耗稀硝酸的体积是V(稀硝酸)=[(0.4mol / 3)/ (1mol/L)] ×1000ml / L = 133.33 ml
所以,生成NO 0.75 L 升(标准状况).反应消耗稀硝酸133.33 ml.1年前查看全部
- 将一定质量的铜溶于80ml 13.5mol/l 的浓HNO3中,待完全溶解后收集到气体6.72L(标准状况),并得到溶液
将一定质量的铜溶于80ml 13.5mol/l 的浓HNO3中,待完全溶解后收集到气体6.72L(标准状况),并得到溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为80ml,试计算:
a 被还原的硝酸的物质的量
b 铜的质量最多是多少 一万个理由我爱你1年前1
一万个理由我爱你1年前1 -
 hbhzzh 共回答了18个问题
hbhzzh 共回答了18个问题 |采纳率88.9%a.气体(NO,NO2)的物质的量为0.3mol,利用氮守恒可知被还原的硝酸的物质 的量为0.3mol
当然,如果你不喜欢这么做你也可以选择列方程
消耗了1mol的H+,产生0.3mol气体 根据离子方程式(设与浓硝酸反应的Cu为x,与稀硝酸反应的Cu为y)
Cu+4H(+)+2NO3(-)=Cu(2+)+2NO2↑+ 2H2O
3Cu + 8H+ + 2NO3- ====3Cu2+ + 2NO↑+ 4H2O
列出4x+8/3y=1,2x+2/3y=0.31年前查看全部
- 向200ml18mol/L浓硫酸中加入3.84克的铜,生成的气体在标准状况下的体积为多少毫升
 swangen1年前3
swangen1年前3 -
 tigerwoods16 共回答了15个问题
tigerwoods16 共回答了15个问题 |采纳率93.3%Cu + 2 H2SO4 == CuSO4 + SO2 + 2H2O
1 2 1 2
0.06 mol 3.6 mol 0.06 mol
所以硫酸过量,假设铜是完全反应,消耗0.12 mol硫酸后,
硫酸浓度大约还有17 mol/L,所以还是浓硫酸,故可以认为铜是完全反应
(如果浓硫酸变为稀硫酸,就不能再溶解Cu了,所以这一步是必须的)
所以生成SO2是 0.06 mol ,体积1.344 L1年前查看全部
- 取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况
取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况下CO2的密度为1.977g/L)
 吧啦咕噜嗒1年前2
吧啦咕噜嗒1年前2 -
 吮指鸡块 共回答了19个问题
吮指鸡块 共回答了19个问题 |采纳率73.7%解题思路:碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,由于200g碳酸钙完全反应,可利用碳酸钙的质量根据反应的化学方程式,计算生成气体二氧化碳的质量;
利用V=[m/ρ],根据二氧化碳质量计算出标准状况下气体的体积.设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
80g x
[100/80g=
44
x]
x=35.2g
标准状况下CO2的体积V=[35.2g/1.977g/L]=17.8L
答:可生成二氧化碳气体35.2g;在标准状况下体积为17.8L.
故答案为:35.2g;17.8L.点评:
本题考点: ["根据化学反应方程式的计算"]
考点点评: 本题是根据反应的化学方程式进行的基础计算,需要注意正确的书写格式及完整的步骤,特别是还需要使用质量与体积的关系式计算出气体的体积.1年前查看全部
- 将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
将一定质量的锌,氧化铁,氧化铜的混合粉末放入含有0.22molHCl中,充分反应后生成448mlH2(标准状况),残留
固体0.64g.过滤,滤液中无Cu2+.滤液中还有0.04molHCl.那么原混合物中Zn的质量为多少克? jlzh1年前2
jlzh1年前2 -
 卖精来上网 共回答了26个问题
卖精来上网 共回答了26个问题 |采纳率96.2%解;固体0.64g为铜,物质的量为0.01mol,氧化铜的物质的量为0.01mol.耗HCl 0.02mol
448mlH2(标准状况),物质的量为0.02mol,耗HCl 0.04mol.滤液中还有0.04molHCl.
所以氧化铁耗HCl 为0.22-0.02-0.04-0.04=0.12mol.发生反应如下:
Fe2O3+6HCl=2FeCl3+3H2O 2FeCl3+Zn=2FeCl2+ZnCl2
6mol 2mol 2mol 1mol
0.12mol 0.04mol 0.04mol 0.02mol
CuO +2HCl = CuCl2+H2O CuCl2 + Zn= ZnCl2+Cu
0.01mol 0.01mol 0.01mol 0.01mol
Zn+2HCl = ZnCl2+ H2
0.02mol 0.02mol
所以共消耗锌的物质的量为0.02mol+0.01mol+0.02mol =0.05mol
原混合物中Zn的质量为;0.05mol乘以65=3.25克1年前查看全部
大家在问
- 1巧拼对联【所给的词不一定全用】1、灿烂 锦绣 红梅 绿树 红花2、鸟语花香 山清水秀 瑞雪兆丰年3、春 冬 来 去 日
- 2、2008年11月17日《光明日报》载文指出:几千年来,汉字负载着中华
- 3嗜极端PH微生物如何抵抗强酸强碱对细胞壁的损伤作用?
- 4你留我在家里歇,莫不是半夜三更某我钱财,害我性命,却把大虫吓唬我?改成陈述句.
- 52011初中海淀二模数学18题肿么做额
- 6马克思主义中国化的历史进程和理论成果分别解决了什么问题?
- 7只有人人都献出爱,世界才会变得如此美好这句话中有无语病
- 8已知:cd平分∠acb,ac∥de,cd∥ef,试证明ef平分教deb
- 9解锐角三角形函数已知直线L1//L2//L3//L4,相邻两条平行直线间的距离都是1如果正方形ABCD的四个顶点分别在四
- 10能否有一件简便的方法,把word文档中的汉字词语按字母表的顺序排列
- 11应用题;妈妈今年25岁,儿子今年5岁,过多少年妈妈的年龄是儿子的2倍?
- 12今年妈妈和儿子的年龄和是46岁,5年后,妈妈的年龄是儿的3倍,今年妈妈和儿子各多少岁
- 1366个笔记本90个文具盒分给6个年纪11个班,每个年纪能分到多少个文具?
- 14英语 远离1号楼,怎么说
- 15初一语文上册同步精炼第4课答案阅读理解的就行 快快