将铜片、锌片和250mL稀硫酸组成的原电池,假设锌片只发生电化学腐蚀.当在铜片上放出6.72L(标准状况下)的气体时,H
 ttQWERss2022-10-04 11:39:541条回答
ttQWERss2022-10-04 11:39:541条回答(1)该原电池的负极反应式为______
(2)原稀硫酸的物质的量浓度是______mol•L-1
(3)列式计算锌片减少的质量.

已提交,审核后显示!提交回复
共1条回复
 轩辕行素311 共回答了12个问题
轩辕行素311 共回答了12个问题 |采纳率100%- 解题思路:(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,写出相应的电极反应式.
(2)锌和稀硫酸反应生成氢气,根据氢气体积和硫酸的关系式计算硫酸的物质的量浓度.
(3)根据锌和氢气之间的关系式计算锌减少的质量.(1)该原电池中较活泼的金属锌作负极,负极上锌失电子发生氧化反应生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以负极上的电极反应式为:Zn-2e-=Zn2+,电池反应式为:Zn+2H+=Zn2++H2↑.
故答案为:Zn-2e-=Zn2+.
(2)设硫酸的物质的量浓度是C.
Zn+H2SO4=ZnSO4+H2↑
1mol22.4L
0.25Cmol 6.72L
C=1.2mol/L.
故答案为:1.2.
(3)设锌减少的质量为m.
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
m6.72L
m=19.5g
故答案为:19.5g.点评:
本题考点: 原电池和电解池的工作原理;氧化还原反应的计算.
考点点评: 本题考查了电极反应式的书写及物质的量的有关计算,难度不大,根据物质的物质的量之间的关系式来解答即可. - 1年前
相关推荐
- 在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中,(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
在铜锌电解池中(电解质溶液为硫酸铜溶液,阳极为锌片,阴极为铜片),
1.为什么锌片会自己自动失去电子,然后锌原子变成锌离子?硫酸铜溶液为什么不和锌片直接发生氧化还原反应,即锌原子直接把电子转移给铜离子?
2.锌离子出来后为什么不会趋向阴极(铜片),然后又得到电子变成锌原子,形成单质锌?
打错了 是原电池 不是电解池 青帮小老大1年前3
青帮小老大1年前3 -
 凤翅镏金 共回答了12个问题
凤翅镏金 共回答了12个问题 |采纳率100%电解池问题 (请耐心看完)
1电解池由阴极 阳极 电解液体构成 已经形成了闭合的回路 所以回有电子的流动 通常是活泼的金属失电子
因为锌是做负极 负极失电子 阳极得电子(怎样判断阴阳级?通常 相对活泼的金属是做阴极的 锌比铜活泼所以 锌是负)
硫酸铜可以和锌片反应的 因为锌比铜活泼 可以置换铜 不知道你为什么说不能反应
2 这就要看溶液里有什么离子了上述溶液里正离子有氢离子与锌离子 这也涉及了离子的放电顺序 氢离子 》锌离子
也就是说 氢离子的氧化性强于锌离子 氢离子比锌离子先得到电子 所以不会析出单质锌 只会析出氢气
够详细了吧1年前查看全部
- 供选择的仪器装置如下图所示(图中A-G为装置代号,①-⑧为仪器的接口符号).供选择的药品有:金属钠、铜片、锌粒、炭粉、硝
供选择的仪器装置如下图所示(图中A-G为装置代号,①-⑧为仪器的接口符号).供选择的药品有:金属钠、铜片、锌粒、炭粉、硝酸、稀硫酸.
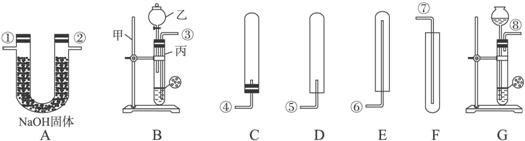
完成下列问题:
(1)写出B装置中的仪器名称:甲______,乙______,丙______.
(2)实验室制取氢气时,常选用的药品是______和______;发生反应的化学方程式为______.
(3)若一个学生选用盐酸为原料之一,则制得的氢气中会含有少量盐酸的酸,如让氢气通过装置(写装置代号)______,酸雾即可除去,化学反应方程式为______;制取和收集的装置是(写装置代号)______和______.
(4)请正确连接氢气的制取、除酸雾和收集氢气的装置(写接口符号)______接______,______接______. hotdog_w1年前1
hotdog_w1年前1 -
 x18h6c 共回答了14个问题
x18h6c 共回答了14个问题 |采纳率92.9%解题思路:(1)根据仪器图示和其作用,辨识常见仪器,写出仪器名称;
(2)实验室制取氢气选用药品的反应化学方程式的考查;
(3)选用稀盐酸制取氢气时,产生的氢气混有稀盐酸挥发出的HCl气体,混合气体通过氢氧化钠可净化氢气;
根据发生装置的装置图示,分析装置图中的正确装置,选取正确装置制取氢气;
(4)氢气的制取、除酸雾和收集氢气的装置的连接顺序:发生装置→净化→干燥→收集装置.净化后进行干燥以保证所收集的气体为干燥的气体,若净化与干燥顺序颠倒,则净化后的氢气因没通过再次干燥而不能得到干燥的气体.(1)仪器甲为固体装置的铁架台,乙为添加反应溶液带活塞的分液漏斗,丙为少量药品反应的容器试管.
故答:铁架台,分液漏斗,试管;
(2)实验室常用与不挥发的稀硫酸反应速度适中的锌粒制取氢气,锌与硫酸发生置换反应放出氢气.
故答:锌粒,稀硫酸,Zn+H2SO4═ZnSO4+H2↑;
(3)装置A中装有氢氧化钠,可与混在氢气中的HCl气体发生中和反应而除去,所以把混合气体通过装置A除去酸雾;
故选A,NaOH+HCl═NaCl+H2O;
使用固体锌粒和液体稀硫酸反应制取氢气,选择“固液不加热”型发生装置,由于装置B的导管伸入过长是错误装置,所以发生装置选G;
密度小于空气,应选择向下排空气收集气体的方法,图中装置C试管口被密封不能用来收集气体,装置D内导管没伸入试管底,收集气体不纯,所以收集氢气应选装置E.
故答:G,E;
(4)根据正确的连接顺序:发生装置→净化→干燥→收集装置,装置连接的接口顺序为:⑧→①→②→⑥,接口①②不分先后,所以连接顺序也可以为:⑧→②→①→⑥.
故答:⑧,①(或②),②(或①),⑥.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;实验室制取气体的思路;常用气体的收集方法;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
考点点评: 要掌握H2的实验室制法的原理装置、收集方法等,对装置的连接要了解一般的原则,发生装置→净化→干燥→收集装置.1年前查看全部
- 在一个电路中,有电源\电压表\导线和小灯泡.现在用铜片和锌片测小灯泡的电压,请问铜片是正极还是锌片是正极
 一剑7101年前1
一剑7101年前1 -
 牛股889 共回答了15个问题
牛股889 共回答了15个问题 |采纳率100%灯泡电压?一般来说铜是正极,但题有问题吧,不顺眼.1年前查看全部
- 原电池导电的电量如何算如将锌片和铜片浸入稀盐酸中组成原电池,总质量为60g,一段时间后总质量为47g问:通过导线的导电量
 hongqi3751年前1
hongqi3751年前1 -
 日光下的月光 共回答了13个问题
日光下的月光 共回答了13个问题 |采纳率92.3%电量Q=n*NA*q
n 为电子的物质的量
NA 阿伏加德罗常数
q 每个电子的电量1.60*10^-19C (库伦)1年前查看全部
- 一铜片在酒精灯上加热后,分别插入下列液体中放置片刻,铜片的质量不变的
一铜片在酒精灯上加热后,分别插入下列液体中放置片刻,铜片的质量不变的
为什么是无水乙醇?苯为什么不可以? pasha1年前3
pasha1年前3 -
 sd_匆匆 共回答了20个问题
sd_匆匆 共回答了20个问题 |采纳率85%题目所说的铜片质量不变是指:在加热前测一次质量,然后加热,再插入液体片刻后取出,干燥并称量.
铜片在酒精灯上加热后就成了氧化铜,即质量增大2Cu+O2==2CuO
而灼热的氧化铜可以将无水乙醇氧化成乙醛,氧化铜在此过程中被还原为铜单质.所以前后质量不变.
而苯是一种很稳定的烃,一般来说不能被直接氧化(苯不能被酸性高锰酸钾氧化就证明了这一点).
而氧化铜的氧化性远弱于酸性高锰酸钾,因此氧化铜就不与苯反应,称量结果是质量变大.1年前查看全部
- 等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置一段时间,最终铜片质量增加的是( )
等质量的铜片,在酒精灯上加热后,分别插入下列溶液中,放置一段时间,最终铜片质量增加的是( )
A. 硝酸
B. 乙醇
C. 少量硝酸和硝酸银混合溶液
D. 盐酸 hemionon1年前3
hemionon1年前3 -
 我是贝贝11 共回答了22个问题
我是贝贝11 共回答了22个问题 |采纳率100%解题思路:先根据铜片在酒精灯上加热生成CuO,质量增加,然后考虑表面的氧化铜与选项中的物质是否反应,确定铜片质量如何变化.A、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入硝酸中,发生反应:CuO+2HNO3═Cu(NO3)2+H2O,Cu2+进入溶液,铜片的质量会减小,故A错误;
B、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入无水乙醇中,发生反应:CH3CH2OH+CuO→CH3CHO+H2O+Cu,又恢复为铜,铜片的质量不变,故B错误;
C、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入少量硝酸中,发生反应:CuO+2HNO3═Cu(NO3)2+H2O,Cu2+进入溶液,然后是金属铜和硝酸银之间的置换反应,金属铜表面析出银的质量多余消耗的铜的质量,所以铜片质量增加,故C正确;
D、因铜片在酒精灯上加热后生成CuO,质量增加,将它投入盐酸中,反应生成氯化铜和水,Cu2+进入溶液,铜片的质量会减小,故D错误;
故选:C.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生金属铜的化学性质,注意在乙醇的催化氧化中,铜的作用是催化剂,质量不变,难度不大.1年前查看全部
- 在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()
在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是()
A 正极附近的硫酸根离子浓度逐渐增大
B电子通过导线由铜片流向锌片
C正极有氧气逸出
D铜片上又氢气逸出
为什么A错呢,正极附近氢离子得电子生成氢气,那么硫酸根离子不增多吗 ed4j7gei1年前5
ed4j7gei1年前5 -
 读个本科有aa 共回答了23个问题
读个本科有aa 共回答了23个问题 |采纳率95.7%选D
正极附近的硫酸根浓度应该减少.你可以这样考虑负极失电子.生成了锌离子在负极周围的负电荷就少了,需要硫酸根去补充,保持电中性.而正极得到电子生成氢气,正电荷减少,硫酸根也就减少了.你的理解错误在在硫酸根稀溶液中硫酸不是以H2SO4的形式存在,而是以硫酸根和氢离子的形式存在.希望我的回答对你有帮助1年前查看全部
- 分别向盛有等量铜片的四支试管中加入等体积的1浓硫酸2稀硫酸3浓硝酸4稀硝酸.
分别向盛有等量铜片的四支试管中加入等体积的1浓硫酸2稀硫酸3浓硝酸4稀硝酸.
网上可以搜到,我这没法上网,帮下忙 zcgfgh1年前3
zcgfgh1年前3 -
 风情万种888 共回答了20个问题
风情万种888 共回答了20个问题 |采纳率90%Cu+4HNO3(浓)==Cu(NO3)2+2NO2(气体)+2H2O 浓硫酸也是这样 稀的不能反应1年前查看全部
- 在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极有O2逸出
B.铜片上有H2逸出
C.正极附近的SO42-离子浓度逐渐增大
D.电子通过导线由铜片流向锌片 樱冢昴流1年前1
樱冢昴流1年前1 -
 学着做vv 共回答了17个问题
学着做vv 共回答了17个问题 |采纳率100%解题思路:该原电池中,较活泼的金属锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应生成氢气;电子从负极沿导线流向正极;溶液中阴离子向负极移动,阳离子向正极移动,据此分析.A、正极上氢离子得电子生成氢气,有H2逸出故A错误;
B、铜片作正极,正极上氢离子得电子生成氢气,故B正确;
C、原电池放电时,溶液中阴离子向负极移动,所以阴极附近的SO42-浓度逐渐增大,故C错误;
D、原电池放电时,电子从负极沿导线流向正极,即电子通过导线由锌片流向铜片,故D错误.
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,难点是判断溶液中阴阳离子的移动方向,很多学生认为阴离子向正极移动,阳离子向负极移动.1年前查看全部
- 12.8g铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为4.48L.铜和硝酸反应的化学方程式为:
12.8g铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为4.48L.铜和硝酸反应的化学方程式为:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
试计算:
(1)被还原的硝酸的物质的量
(2)4.48L气体中各成分的物质的量. 傷痕累累1年前2
傷痕累累1年前2 -
 nokia20999 共回答了23个问题
nokia20999 共回答了23个问题 |采纳率100%解题思路:(1)铜与硝酸反应生成的气体无论是NO还是NO2,一个气体分子中含有一个N原子,一个硝酸分子中含有一个N原子,根据原子守恒,气体的物质的量与被还原的硝酸的物质的量相等.
(2)铜与硝酸反应中,铜失电子作还原剂,硝酸得电子作氧化剂,在氧化还原反应中得失电子数相等,利用电子守恒,列方程组,得出NO、NO2的物质的量.(1)设气体的平均分子式为NOx,被还原的硝酸的物质的量为y,
标准状况下生成气体的物质的量为[4.48L/22.4L/mol]=0.2mol,气体分子与被还原的硝酸的关系式为
HNO3--NOx
1 1
ymol 0.2mol
y=0.2mol,
答:被还原的硝酸的物质的量为0.2mol;
(2)铜与硝酸反应中,铜失电子作还原剂,硝酸得电子作氧化剂,在氧化还原反应中得失电子数相等,利用电子守恒,列方程组,得出NO、NO2的物质的量.
铜的物质的量为[12.8g/64g/mol]=0.2mol,则0.2molCu变成Cu2+失去的电子为0.2mol×2=0.4mol,
设生成NO的物质的量为mmol,NO2的物质的量为nmol,混合气体的物质的量为0.2mol,即
m+n=0.2
由氧化还原反应中得失电子数相等得;
3m+n=0.4
列方程组
m+n=0.2
3m+n=0.4,解得m=0.1mol,n=0.1mol,
答:4.48L气体中NO为0.1mol,NO2的物质的量为0.1mol.点评:
本题考点: 硝酸的化学性质;化学方程式的有关计算.
考点点评: 本题考查的是硝酸的性质及结合方程式的计算,巧妙利用守恒法、关系式进行计算,有事半功倍之效.估算法、差量法、平均值法等都是做题时常用的方法.1年前查看全部
- 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
 某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑
(1)请在右边方框中画出能够实现这一反应的装置图______.
(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的
①实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色.
请你分析其原因______.
②假设按照该方案进行实验,且收集到碳棒上产生气体体积为11.2L(标准状况下).则该过程中铜片上发生的反应式为______.
③此时要使溶液恢复到实验前的状态,需加入______(写出该物质的化学式),其质量为______. 天zz涯1年前1
天zz涯1年前1 -
 穿越夜的思念 共回答了13个问题
穿越夜的思念 共回答了13个问题 |采纳率76.9%解题思路:(1)实现该反应,选择Cu为阳极,电解质为硫酸;
(2)碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色,其电解实质为电解水,C棒为阳极生成氧气,Cu棒上生成氢气,若一段时间恢复原状态,应加入等量的水.(1)若发生Cu+H2SO4(稀)=CuSO4+H2↑,利用电解来实现,则Cu为阳极,C为阴极,电解质为硫酸,装置如图
 ,故答案为:
,故答案为: ;
;
(2)①碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色,其电解实质为电解水,即两极与电源的正负极接反了,故答案为:两极与电源的正负极接反了;
②Cu棒上生成氢气,发生的电极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
③碳棒上产生气体体积为11.2L为氧气,其物质的量为[11.2L/22.4L/mol]=0.5mol,由2H2O
电解
.
O2↑+2H2↑,则要恢复原样加入H2O的质量为0.5mol×2×18g/mol=18g,
故答案为:H2O;18g.点评:
本题考点: 电解原理.
考点点评: 本题考查电解原理,明确电极材料的选择与发生的电极反应是解答本题的关键,注意电解后使溶液恢复原样,应从元素及质量守恒的角度来分析,题目难度不大.1年前查看全部
- ,如图所示,甲是铜片,乙是小磁铁.当开关闭合的时候
,如图所示,甲是铜片,乙是小磁铁.当开关闭合的时候
如图所示,甲是铜片,乙是小磁铁.当开关闭合后 A.甲将受到向左的排斥力 B.甲将受到向右的吸引力 C.乙

螺线管右端不是N极么,根据安培定则,为什么是S级,
 诺贝尔051年前1
诺贝尔051年前1 -
 hxjyugu 共回答了23个问题
hxjyugu 共回答了23个问题 |采纳率91.3%甲中没有磁通量,也就没有磁通量的改变,没有感应电流,不会受到磁场力的作用,所以不动.
A错.
B错
小磁铁要受到吸引力.
由右手螺旋定则也就是安培定则判断出螺线管的左端为N极,是正确的.不可能是S极.
很高兴能够帮助你.并请你能及时采纳.如果还有疑问疑问欢迎追问.有其它问题随请另行提问,我会及时给予回答.1年前查看全部
- 1.在空气中加热铜片,铜片表面有黑色固体生成,请问这句话是否符合客观事实?
1.在空气中加热铜片,铜片表面有黑色固体生成,请问这句话是否符合客观事实?
2.品名:硝酸铵
NH4NO3(数字右下角)
净重:50kg
含氮量:34%
请你计算,一袋硝酸铵产品中含纯硝酸铵的质量?
就是不知道那个50kg乘34%乘35%是什么意思吗!
还有纯硝酸铵的质量简单点说就是求什么的质量? 东-去-春-来1年前5
东-去-春-来1年前5 -
 巴山摩托车 共回答了16个问题
巴山摩托车 共回答了16个问题 |采纳率87.5%1.符合客观事实.因为铜和空气中氧气反应生成氧化铜(氧化铜是黑色的)
2.计算出纯硝酸铵的含氮量,为35%(用氮的相对
原子质量乘以2,再除以硝酸铵的相对分子质量)
34%:35%=( ):50
未知数得48.571年前查看全部
- 将小铜片假如稀硫酸中没有反应,再加入硝酸钾晶体,铜片逐渐溶解,并放出无色气体.其离子方程式是
将小铜片假如稀硫酸中没有反应,再加入硝酸钾晶体,铜片逐渐溶解,并放出无色气体.其离子方程式是
是离子方程式! dengfangying1年前2
dengfangying1年前2 -
 郁芙 共回答了14个问题
郁芙 共回答了14个问题 |采纳率92.9%实质是铜跟稀硝酸的反应生成一氧化氮,3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O1年前查看全部
- 将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是( )
A. 溶液的PH增大
B. 溶液中的Zn2+浓度增大
C. 溶液中的SO42-浓度增大
D. 溶液的密度增大 流浪天空下1年前6
流浪天空下1年前6 -
 季飞 共回答了24个问题
季飞 共回答了24个问题 |采纳率91.7%解题思路:锌片-铜片-稀硫酸溶液组成的原电池中,较活泼的金属锌作负极,铜作正极;负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应.A、原电池放电时,正极上氢离子得电子生成氢气析出,导致溶液中氢离子浓度降低,PH值增大,故A正确;
B、原电池放电时,负极上锌失电子生成锌离子进入溶液,导致溶液中锌离子浓度增大,故B正确;
C、原电池放电时,负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气,所以该反应中硫酸根离子浓度基本不变,故C错误;
D、原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,故D正确.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,难度不大,明确正负极上发生的电极反应是解本题的关键.1年前查看全部
- 小新用西红柿制作了一个水果电池,他用一片铜片和一片锌片制作了它的两个电极,做好该西红柿电池后,小新用电压表测量了它的电压
小新用西红柿制作了一个水果电池,他用一片铜片和一片锌片制作了它的两个电极,做好该西红柿电池后,小新用电压表测量了它的电压,你觉得它的电压有多高?( )
A. 3V
B. 220V
C. 1.5V
D. 0.2V jnbelieve1年前1
jnbelieve1年前1 -
 edmond828 共回答了21个问题
edmond828 共回答了21个问题 |采纳率100%解题思路:西红柿电池的电压应该小于干电池电压,已知一节干电池电压为1.5V,根据选项中所给电压的大小进行估测.西红柿电池提供的电压较小,应该小于一节干电池电压;而一节干电池电压为1.5V,因此西红柿电池提供的电压约0.2V.
故选D.点评:
本题考点: 电压.
考点点评: 此题考查的是水果电池提供电压的大小,水果电池提供的电压比我们常见电源提供的电压都要小,约0.2V左右.可以通过比较思想进行分析.1年前查看全部
- 将铝片和铜片插入氢氧化钠溶液里,形成原电池,正极为铜片还是铝片?为什么?
 占戈示申_20051年前1
占戈示申_20051年前1 -
 zy_lf 共回答了19个问题
zy_lf 共回答了19个问题 |采纳率94.7%因为Al和NaOH反应,Al失去电子,所以铝是负极,当然铜就是正极啦.1年前查看全部
- (2012•南宁三模)如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )
 (2012•南宁三模)如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )
(2012•南宁三模)如图所示,用导线连接a、b后,观察到铜片表面产生大量气泡.下列叙述正确的是( )
A.铜的金属性比铬强
B.总反应为Cu+H2SO4═CuSO4+H2↑
C.溶液中SO42-向铬极移动
D.若将a接电源负极、b接电源正极,铜极反应为2H2O-4e-═O2↑+4H+ dangguansh1年前1
dangguansh1年前1 -
 知识很重要 共回答了21个问题
知识很重要 共回答了21个问题 |采纳率90.5%解题思路:A、依据原电池中金属电极活泼的做负极,铬和铜连接插入稀硫酸溶液中,铜片表面有气体生成,证明铜在原电池中做正极,铬做负极;
B、图中原电池是负极铬失电子发生氧化反应,溶液中氢离子得到电子发生还原反应;
C、原电池中阴离子移向负极;
D、若将a接电源负极做电解池阴极、b接电源正极做电解池阳极,铜失电子生成铜离子.A、依据原电池中金属电极活泼的做负极,铬和铜连接插入稀硫酸溶液中,铜片表面有气体生成,证明铜在原电池中做正极,铬做负极,铬比铜活泼,故A错误;
B、图中原电池是负极铬失电子发生氧化反应,溶液中氢离子得到电子发生还原反应,总反应为2Cr+3H2SO4=Cr2(SO4)3+2H2↑,故B错误;
C、原电池中阴离子移向负极,溶液中SO42-向铬极移动,故C正确;
D、若将a接电源负极做电解池阴极、b接电源正极做电解池阳极,本身被氧化,铜失电子生成铜离子,电极反应为:Cu-2e-=Cu2+,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理的分析应用,主要是电极名称和电极反应的判断,溶液中的离子移动方向的分析,掌握基础是关键,题目难度中等.1年前查看全部
- 向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充
向一定量铜片中加入115mL某浓度的硫酸,在加热条件下反应,待铜片全部溶解后,将溶液稀释到500mL,再加入足量锌粉,充分反应后,收集到2.24L(标准状况)气体,过滤残留固体,干燥后称量,质量比加入的锌粉减轻了7.5g.试求:
(1)加入铜片的质量
(2)原硫酸的物质的量浓度. **in1年前2
**in1年前2 -
 燕子焚 共回答了15个问题
燕子焚 共回答了15个问题 |采纳率73.3%解题思路:根据反应方程式,判断反应的类型,根据气体的体积和固体质量的变化计算参加反应的铜和锌以及硫酸的物质的量,注意利用质量守恒定律.设加入Cu片的量为xmol,n(H2)=
2.24L
22.4L/mol=0.1mol,
Cu+2H2SO4(浓)
加热
.
CuSO4+SO2↑+2H2O,
xmol 2xmolxmol
CuSO4+Zn═ZnSO4+Cu
xmol xmolxmol
Zn+H2SO4═ZnSO4+H2↑
0.1mol 0.1mol 0.1mol
由Zn溶解,产生Cu质量减轻7.5g可得:65g/mol×(xmol+0.1mol)-64g/mol×xmol=7.5g
∴x=1,
∴加入铜片的质量为m(Cu)=1mol×64g/mol=64g,
原 H2SO4的物质的量浓度 c(H2SO4)=
n
V=
2×1mol+0.1mol
0.115L=18.3mol/L,
答:(1)加入铜片的质量为64g,
(2)原硫酸的物质的量浓度为18.3mol/L.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查化学方程式的计算,题目难度中等,注意有关反应方程式的书写,以及题中数据的处理.1年前查看全部
- 两种不同的金属片放在酸、碱、盐的溶液中就能成为一个电池.把铜片和铁片分别插在菠萝上,则正极是()片
 纤离之马1年前2
纤离之马1年前2 -
 呢喃囡囡 共回答了16个问题
呢喃囡囡 共回答了16个问题 |采纳率93.8%Cu、
因为菠萝是酸性的
所以只要Fe能和氢离子反应 失去电子
失去电子的是负极
之后电子通过外电路,从Cu出来,即Cu极得到电子,Cu附近的氢离子得到电子成氢气.
因此Cu是正极1年前查看全部
- 一道化学推断题把铁片和铜片同时放入盛有硝酸银溶液的试管中,充分反应后过滤,在滤纸上留下少量金属,并得到滤液.(1)在滤液
一道化学推断题
把铁片和铜片同时放入盛有硝酸银溶液的试管中,充分反应后过滤,在滤纸上留下少量金属,并得到滤液.
(1)在滤液里滴加盐酸:
①若有白色沉淀产生,则滤纸上一定含有的金属是( ),滤液中一定含有的金属离子是( )
②若无白色沉淀产生,则滤纸上一定含有的金属是( ),可能含有的金属是( );滤液中一定含有的金属离子是( ),可能含有的金属离子是( ).
(2)向从滤纸上得到的金属中滴加稀盐酸:
①若有气体产生,则滤纸上一定含有的金属是( ),滤液中一定含有的金属离子是( ).
②若无气体产生,则滤纸上一定含有的金属是( ),可能含有的金属是( );滤液中一定含有的金属离子是( ),可能含有的金属离子是( ). 天狼Lin1年前2
天狼Lin1年前2 -
 btgxd 共回答了16个问题
btgxd 共回答了16个问题 |采纳率87.5%(1)一定有银,因为有沉淀,所以有银离子,说明铜、铁的量不足以置换出全部的银,所以只有一部分置换出来的银成为了滤渣中一定有的金属!
溶液中一定有银离子,因为有白色沉淀,一定有铁、铜离子因为,铁、铜置换了银.
若无沉淀,说明银离子全部置换出来,一定有银.可能有铜和铁,因为铜和铁可能都过量.也可能恰好完全反应!溶液中一定有铁离子,因为铁的活动性比铜强,所以铁和溶液先反应,如果铁不够用,铜才会开始反应.所以不管怎么说,铁离子一定有.可能有铜离子啦.因为铁可能真的不够用.一定没银离子,因为没沉淀.
(2)一定有铁、铜、银,因为有气体,而铜、银活动性在氢后,所以一定有铁.上一问以说明了铁有剩余,铜一定等于没反应,银全部置换出的原因,所以,也一定有铜和银.
一定有银,因为铜铁可能恰好完全反应,或铜铁不足,可能有铜,因为可能铜过量.一定有的离子是铁,理由同第一问.可能有铜、银两种离子,因为铜银不足时,就会有银离子未被置换出来.1年前查看全部
- 下列离子方程式中,正确的是( ) A.稀硫酸滴在铜片上:Cu + 2H + = Cu 2+ + H 2 ↑ B.氧化
下列离子方程式中,正确的是()
A.稀硫酸滴在铜片上:Cu + 2H + = Cu 2+ + H 2 ↑ B.氧化镁和稀盐酸混合:MgO +2H + = Mg 2+ + H 2 O C.铜片插入硝酸银溶液中:Cu + Ag + = Cu 2+ + Ag D.稀盐酸滴在石灰石上:CO 3 2- + 2H + = H 2 O + CO 2 ↑  探心xl1年前1
探心xl1年前1 -
 baby_2004722 共回答了14个问题
baby_2004722 共回答了14个问题 |采纳率85.7%B1年前查看全部
- (2008•吉林)如图所示,小星的爸爸把电饭锅的三线插头中间的铜片拆除,以便能在墙壁上的两孔插座上使用.这种使用方法是否
 (2008•吉林)如图所示,小星的爸爸把电饭锅的三线插头中间的铜片拆除,以便能在墙壁上的两孔插座上使用.这种使用方法是否安全?为什么?
(2008•吉林)如图所示,小星的爸爸把电饭锅的三线插头中间的铜片拆除,以便能在墙壁上的两孔插座上使用.这种使用方法是否安全?为什么?  上海市长不说爱你1年前1
上海市长不说爱你1年前1 -
 ross7610 共回答了19个问题
ross7610 共回答了19个问题 |采纳率94.7%解题思路:三孔插座中多出的一个孔是用来接地线的;目的就是为了防止触电.电饭锅等家用电器都使用三孔插座,若将三线插头中间的铜片拆除,在墙壁上的两孔插座上使用,电饭锅的外壳不能与大地相连;这样当用电器漏电时,由于电饭锅的外壳是金属,会使外壳带电,电流也就不能通过地线,流入大...
点评:
本题考点: 插座的构造与工作方式;安全用电原则.
考点点评: 本题从另一角度考查三线插头中地线的作用,从而加强安全用电的意识.1年前查看全部
- 锌片与铜片连接插入硫酸铜中是不是原电池?
 23gsa1年前1
23gsa1年前1 -
 songtuannian 共回答了25个问题
songtuannian 共回答了25个问题 |采纳率96%是的,锌片作负极,铜片作正极,电子通过导线从锌片流向铜片,铜离子在铜片表面被还原.1年前查看全部
- 一道有难度的初中化学题一份因严重锈蚀而部分变成碱式碳酸铜的铜片,将其磨成粉末在空气中灼烧成氧化铜,完全反应后剩余固体质量
一道有难度的初中化学题
一份因严重锈蚀而部分变成碱式碳酸铜的铜片,将其磨成粉末在空气中灼烧成氧化铜,完全反应后剩余固体质量的变化情况( )
A.减少30% B.增加30% C不变 D无法判断 鱼不语1年前1
鱼不语1年前1 -
 bivhc 共回答了22个问题
bivhc 共回答了22个问题 |采纳率90.9%这题是要算出范围的.
Cu2(OH)2CO3===2CuO+H20+CO2
222 160
a x
x=160/222 a
2Cu+O2===2CuO
128 160
b y
y=160/128 b
所以生成物质量x+y约等于0.72a+1.25b
当a=0的时候 x+y的值是a+b的值的1.25倍,也就是增重25%
当b=0的时候 x+y的值是a+b的值的0.72倍,也就是减少28%
结论就是剩余固体的质量比反应之前的减少28%~增重25%
所以AB选项就都不对了.
在这个范围的选项之后不变.
这种竞赛题就是算范围的.1年前查看全部
- 铜片,石墨棒,稀硫酸,导线,烧杯为什么不能形成简单原电池?
 yanling2211年前1
yanling2211年前1 -
 2047991 共回答了19个问题
2047991 共回答了19个问题 |采纳率94.7%因为形成原电池的前提条件是:能自发地进行氧化还原反应,这儿的铜片,石墨棒,稀硫酸之间均不能发生氧化还原反应.1年前查看全部
- 在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:__
在铜-锌原电池中,理论上应观察到的现象是:铜片上:______锌片上:______.此时原电池的电极反应式是:正极:______负极:______.但在实际实验中,锌片上也有______、表面变黑等现象,其原因是______.
在相同温度下,同样大小的混有碳粒等杂质的锌比纯锌与同浓度同体积的稀硫酸反应的速率______(选填“要快”、“要慢”、“相等”、“无法确定”),其微观解释是______. 最后一个大佬1年前1
最后一个大佬1年前1 -
 nnbestgame 共回答了15个问题
nnbestgame 共回答了15个问题 |采纳率86.7%解题思路:根据得失电子判断电极反应现象并写出电极反应式;
根据实验现象分析形成此现象的原因;
在相同条件下,通过对比实验,判断含杂质的锌与纯锌哪个反应快,根据同性电荷、异性电荷的关系分析.该原电池中,铜片上,氢离子得电子生成氢气,所以看到的现象是:表面产生大量气泡;锌片上,锌失去电子生成锌离子进入溶液,锌片逐渐溶解,所以看到的现象是:表面无气泡,但锌片逐渐溶解;铜片作正极,锌片作负极,正极上的电极反应式为:2H++2e-=H2↑;负极上的电极反应式为:Zn-2e-=Zn2+;
但在实际实验中,由于锌不纯,混有碳等杂质,锌、碳、稀硫酸构成微小的原电池,且锌、碳混在一起,所以看到锌片上有气泡、表面变黑等现象;
在相同条件下,粗锌比纯锌反应速率快,氢离子在锌片上得电子生成氢气,首先要克服锌离子对它的排斥力,在在铜片上得电子生成氢气,而是通过静电引力,相对叫容易些,所以在相同条件下纯锌比纯锌反应速率快.
故答案为:表面产生大量气泡;表面无气泡,但锌片逐渐溶解;2H++2e-=H2↑;Zn-2e-=Zn2+;气泡;锌不纯,混有碳等杂质,本身在稀硫酸中形成许多微电池;要快;氢离子不需要克服锌离子对它的排斥力到锌片上得电子,而是通过静电引力到铜片上得电子.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池的正负极的判断及电极反应式的书写等知识点,写电极反应式时要注意电解质溶液的成分,电解质溶液不同,电极反应式可能不同,如氢氧燃料电池中电解质为酸或碱时,电极反应式就不同.1年前查看全部
- 物理课后,小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄想探究“西红柿电池的电压大小与哪
物理课后,小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄想探究“西红柿电池的电压大小与哪些因素有关”,小雄说:“可能与两金属片之间的距离有关”,小南想了想说:“也可能与两金属片插入西红柿的深度有关”. 为了验证猜想是否正确,他们找来了电压表,连成了如图所示的电路.
(1)请你选择其中一个猜想,并提出验证的方法.
(2)目前人们乱扔废旧电池的现象非常普遍,请你针对这种现象,给有关部门提出一条合理建议: ___ .
 nhslhm1年前1
nhslhm1年前1 -
 拉开早 共回答了15个问题
拉开早 共回答了15个问题 |采纳率80%解题思路:(1)利用控制变量法进行研究.控制金属片的深度一定,改变金属片间的距离.
控制金属片间的距离一定,改变金属片插入深度.利用电压表测量电压.
(2)电池会对环境造成污染,应回收.①猜想:“西红柿电池的电压大小可能与两金属片之间的距离有关”
步骤:
a.将一块铜片和一块锌片插入西红柿一定的深度,待电压表示数稳定后记下电压表的读数;
b.持插入西红柿的深度不变,改变铜片和锌片之间的距离,待电压表示数稳定后记下电压表的读数,重复几次;
c.比较几次电压表的读数,得出结论.
②猜想:“西红柿电池的电压大小可能与金属片插入西红柿的深度有关”
步骤:
a.将一块铜片和一块锌片插入西红柿一定的深度,待电压表示数稳定后记下电压表的读数;
b.保持铜片和锌片之间的距离不变,改变插入西红柿的深度,待电压表示数稳定后记下电压表的读数,重复几次;
c.比较几次电压表的读数,得出结论.
(2)由于电池中有电解质、重金属,乱扔废旧电池会对环境造成污染,故应分类回收.点评:
本题考点: 电压;控制变量法与探究性实验方案;能源的利用和对环境的危害.
考点点评: 本题考查了设计实验研究水果电池的电压的影响因素及对旧电池的处理,关心环境是我们每个人应有的职责.1年前查看全部
- 如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D
如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D.一段时间后,溶液中氢离子的物质的量减小 
 36634991年前1
36634991年前1 -
 余强 共回答了24个问题
余强 共回答了24个问题 |采纳率87.5%A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.1年前查看全部
- 自制物理实验,关于电的声音我将一坏了的麦克风改造,将电线剪短,中间放上一铜片,再把线接上.把改造好的麦克风插到电脑上,此
自制物理实验,关于电的声音
我将一坏了的麦克风改造,将电线剪短,中间放上一铜片,再把线接上.把改造好的麦克风插到电脑上,此时电线上通电了,我打开电脑的录音软件,开始录音,发现我手不与铜片接触时,没有声音,我手一与铜片接触,立刻会听见很大的“兹兹”声.(我是初中生,偶然发现做了这个实验,物理还没有学过电,不太了解.)
请问:1.这种声音如何产生的?
2.这个实验是不是类似与触电,与触电产生的巨大声响类似? yvonne12081年前1
yvonne12081年前1 -
 baotin 共回答了20个问题
baotin 共回答了20个问题 |采纳率100%人体本身就有微电流的.至于你的兹兹声,那是接触不良导致耳机或者音响反复通电造成的. 不要一个人在家做电方面的实验.虽然不是220V. 还是得注意安全1年前查看全部
- 11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子________
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________m
11、铜片、锌片连接后浸入稀H2SO4中构成原电池,当导线上通过电子3.01×1022个时,则锌失去电子_________mol,锌片质量减少_________g。铜片表面析出氢气_________L。 楚辛1年前1
楚辛1年前1 -
 诺木 共回答了22个问题
诺木 共回答了22个问题 |采纳率81.8%导线上通过电子3.01*1022个,为0.05mol,即转移电子0.05mol,锌失去0.05mol电子,Zn-2e=Zn2+,1molZn转移2mol电子,锌片质量减少65gmol-1*0.05mol/2=1.625g,电池反应为Zn+2H+=Zn2++H2(转移2e),生成H2为:22.4Lmol-1*0.05mol/2=0.56L1年前查看全部
- 将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )

A.两烧杯中铜片表面均无气泡产生
B.甲中正极的电极反应式为Zn-2e-=Zn2+
C.两烧杯中氢离子浓度均减少
D.产生气泡的速度甲比乙慢 1985yy1年前1
1985yy1年前1 -
 3882533 共回答了16个问题
3882533 共回答了16个问题 |采纳率87.5%解题思路:甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.A、甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、甲中铜为正极,铜片上氢离子得电子生成氢气,正极的反应为:2H++2e-=H2↑,故B错误;
C、甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,故C正确;
D、甲中形成铜锌原电池加快了反应速率,所以产生气泡的速度甲比乙快,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.1年前查看全部
- 能否用铜片,锌片和氢氧化钠溶液自制电池?
能否用铜片,锌片和氢氧化钠溶液自制电池?
效果会比氯化钠溶液好吗?还有什么好用的电解质?手头还有硫酸铜,碳酸钠和盐酸 geyinpeng1年前1
geyinpeng1年前1 -
 g1194yy3 共回答了16个问题
g1194yy3 共回答了16个问题 |采纳率75%不行,原电池必须要以自发的化学反应为基础,Zn和Cu都不能与NaOH反应,但是如果用CuSO4,HCl都可以,因为:Zn + Cu2+=== Zn2+ + Cu;Zn + 2H+===Zn2+ + H2
Na2CO3同理与Zn,Cu都不反应,所以也不行.
怎么样,有帮助吗?1年前查看全部
- 电学 为什么不能把三线插头的铜片拆除,当两孔插座用?
 众的略1年前2
众的略1年前2 -
 jeasyzhao 共回答了16个问题
jeasyzhao 共回答了16个问题 |采纳率93.8%第三的口为地线的口,可以起到保护作用,当线路没有布置好的时候,甚至可能用电器表层带电,若有地线则可以保证这点1年前查看全部
- 相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是( )
相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是( )
A. 稀硫酸
B. 浓硫酸
C. 稀硝酸
D. 浓硝酸 lilychin1年前1
lilychin1年前1 -
 lhq8289 共回答了19个问题
lhq8289 共回答了19个问题 |采纳率94.7%解题思路:在常温下,金属铜和稀硫酸不反应,在加热时,可以和浓硫酸反应:Cu+2H2SO4(浓
CuSO4+SO2↑+2H2O,根据金属铜与浓硝酸以及稀硝酸反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、△ .
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O进行计算.根据铜在金属活动性顺序表中的位置可知,铜不可以和非氧化性酸反应产生H2,但根据铜的性质可知,铜可以和氧化性酸反应,反应情况如下:Cu+2H2SO4(浓
△
.
CuSO4+SO2↑+2H2O,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,由上述方程可以很容易地判断出当铜的量相同时(假设为64g即1mol),与足量的酸反应产生气体最多的酸是浓硝酸(另外也可根据电子守恒作出推断,铜的质量相同,失电子数相同,因此产生1 mol 气体所需电子数最少的,也就是产生气体最多的).
故选D.点评:
本题考点: 铜金属及其重要化合物的主要性质;硝酸的化学性质;浓硫酸的性质.
考点点评: 此题考查的是铜与酸反应中的性质及其中相关的量的关系,要熟记发生的反应并进向相应的计算.1年前查看全部
- 实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个
实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个步骤:①
实验室常用铜片、稀硫酸和浓硝酸来制备五水硫酸铜:Cu+2HNO3+H2SO4=CuSO4+2NO2↑+2H2O分以下几个步骤:
①将盛有4.5g铜屑的蒸发皿置于酒精灯火焰上,灼烧至表面呈现黑色,冷却;
②加16mL3mol?L-1硫酸,再缓慢、分批加入7mL12mol?L-1硝酸(在通风橱进行);
③待反应缓和后,盖上表面皿,用水浴加热至铜屑全溶;
④倾析法趁热将溶液转移到另一蒸发皿中,并在水浴上浓缩到溶液出现晶膜,冷却,过滤;
…
请回答下列问题:
(1)将铜屑灼烧的目的是______,表面的黑色物质是______.
(2)加入硝酸时,必须缓慢、分批加入的目的是______.
(3)控制硝酸总量尽可能小除了环保和节约原料外,还可能的原因是______.
(4)下图是硫酸铜和硝酸铜的溶解度表(单位:g),请根据表回答:
①步骤④溶液冷却时析出的晶体主要是______.温度/℃ 0 20 40 60 80 100 CuSO4?5H2O 23.1 32.0 44.6 61.8 83.8 114.0 Cu(NO3)2?xH2O 83.5 125.0 163.0 182.0 208.0 247.0
②将五水硫酸铜粗产品提纯,要采取的实验方法是______.
(5)实验中取用蒸发皿的仪器是______,使用蒸发皿时的注意事项是______.(只需写出一项)
(6)如不用水浴加热蒸发,五水硫酸铜晶体可能会因温度高转变为白色的硫酸铜,此过程属于______变化.(填“物理”或“化学”)
 泽曼我心1年前1
泽曼我心1年前1 -
 maimailisa 共回答了20个问题
maimailisa 共回答了20个问题 |采纳率85%(1)因金属表面沾有油污,用加热可除去,同时生成黑色的氧化铜,故答案:除去表面的油污,氧化铜;
(2)硝酸是氧化剂,加快了会有大量气体放出,会夹带溶液,使溶液溢出容器;分批加是为充分利用硝酸,避免未反应的酸在加热时分解.故答案:防止反应剧烈,有液体溅出;避免硝酸分解;
(3)反应时,硝酸加多了,会导致粗产品中含有较多的硝酸铜,致使粗产品呈绿色.故答案:避免引入过多NO3-,影响后面的实验;
(4)①因CuSO4?5H2O的溶解度随温度变化较大,所以先析出,故答案:五水硫酸铜;
②因CuSO4?5H2O含有杂质Cu(NO3)2?xH2O,但Cu(NO3)2?xH2O溶解度随温度变化不大,故可用重结晶法提纯,故答案:重结晶;
(5)蒸发皿在实验中有一定的温度,应用坩埚钳取用,同时蒸发皿蒸发溶液时蒸发皿中溶液的体积不超过它体积的2/3、蒸发溶液时不能蒸干,有大部分晶体析出时停止加热、避免骤冷导致蒸发皿破裂等,故答案:避免骤冷导致蒸发皿破裂或蒸发溶液时蒸发皿中溶液的体积不超过它体积的2/3或蒸发溶液时不能蒸干等;
(6)由于固体由CuSO4?5H2O变成CuSO4,这是两种不同的物质,故答案:化学.1年前查看全部
- (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“
 (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
(2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
A.导线上的电流方向为A→B
B.A中SO42-浓度有所减小
C.盐桥中Cl-向A中移动
D.B中铜片质量有所增加 cc帮女八路1年前1
cc帮女八路1年前1 -
 南极北熊 共回答了33个问题
南极北熊 共回答了33个问题 |采纳率87.9%解题思路:将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.A.Zn为负极,Cu为正极,则导线上的电流方向为B→A,故A错误;B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;D.Cu为...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.1年前查看全部
- 将一铜片在酒精灯上加热分别插入1醋酸2乙醇3石灰水溶液中,反应完毕,取出铜片洗涤,干燥,称量.为什么醋酸变使铜片质量变轻
将一铜片在酒精灯上加热
分别插入1醋酸2乙醇3石灰水溶液中,反应完毕,取出铜片洗涤,干燥,称量.为什么醋酸变使铜片质量变轻,乙醇使其不变,石灰水溶液使其变重?
卷子的答案就是这样的 海之锋1年前1
海之锋1年前1 -
 gsnacdt 共回答了24个问题
gsnacdt 共回答了24个问题 |采纳率91.7%铜经过加热后表面部分铜会变成氧化铜,放入醋酸中氧化铜会被酸碱反映掉,所以质量会变轻
乙醇把氧化铜还原了,所以质量不变
和石灰水中的水会生成氢氧化铜附着在同表面,所以质量会变重1年前查看全部
- (1)小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄在探究过程中,找来了电压表,连成如图
(1)小南和小雄将一块铜片和一块锌片插入西红柿,做成了一个“西红柿电池”.小南和小雄在探究过程中,找来了电压表,连成如图所示的电路.发现电压表示数为0.5V,因此他们探究出第一个结果是:________片是西红柿电池的正极.
(2)上题中为了探究西红柿电池的电压大小与哪些因素有关,小雄猜想说:“可能与两金属片之间的距离有关”;请你也提出一个合理的猜想:西红柿电池的电压大小还可能与_____________________________________________有关。
 zqq8ii1年前1
zqq8ii1年前1 -
 tianjiuliangle 共回答了19个问题
tianjiuliangle 共回答了19个问题 |采纳率84.2%(1)铜;(2)金属片插入西红柿中的深度、西红柿的成熟程度、金属片在西红柿中的面积等任一条即得分---每空2分。
:(1)由于电压表此时正向偏转,说明与正接线柱相连的铜片是电源的正极.
(2)该题为开放答案合理即可,如酸度、甜度、成熟度、形状.但不能写水果种类,因为题中限定了西红柿.1年前查看全部
- 将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液
将1.92 g 纯铜片投入足量的某硝酸溶液中,铜片完全溶解.放出气体有导管通过盛有蒸馏水的洗气瓶充分反应,测得洗气瓶中液体增重W g.排水后理论上从洗气瓶出气口收集到气体(S.T.P)__________mL.
答案是448,怎么会没有W的=.= 胡aa1年前1
胡aa1年前1 -
 王府井前门 共回答了21个问题
王府井前门 共回答了21个问题 |采纳率90.5%这个题目.有点意思,你看好
铜是在不加热的情况不和稀硝酸反应
所以那个一定是浓硝酸
产生的气体是NO2
依据电子守恒 1.92克铜是0.03摩尔
转移了0.06摩尔电子 即有0.06摩尔NO2产生
0.06摩尔的NO2会与水反应生成NO
3摩尔NO2产生1摩尔NO
所以产生气体体积是0.02摩尔×22.4升每摩尔
就是448ML
那个W是骗人用的.
祝你新年快乐 学习进步!1年前查看全部
- 在烧杯中加入盐水,然后将连在电压表上的铜片和铝片放在盐水中如图所示,试着用电压表测量这个自制电池的电压.通过测量能否得知
在烧杯中加入盐水,然后将连在电压表上的铜片和铝片放在盐水中如图所示,试着用电压表测量这个自制电池的电压.通过测量能否得知哪个金属片是电池的正极?说出你的办法来.

 moonlightlady1年前2
moonlightlady1年前2 -
 蕃茄的命运 共回答了14个问题
蕃茄的命运 共回答了14个问题 |采纳率92.9%解题思路:根据电压表的正确使用方法进行分析.答:当电压表在电路中的正负极接反时,电压表指针向相反方向偏.当铜片接在电压表正极时,电压表指针向右偏,说明铜片是正极.
点评:
本题考点: 电源及其能量转化;电压表的使用.
考点点评: 本题利用了电压表的使用方法来判断电源的正负极,属于基础知识的考查.1年前查看全部
- 初三化学金属一共有四支试管,探究铁,铜,锌,银的金属活动顺序.第一支里放了铁片和稀盐酸.第二支里放了铜片和硝酸银溶液.第
初三化学金属
一共有四支试管,探究铁,铜,锌,银的金属活动顺序.
第一支里放了铁片和稀盐酸.
第二支里放了铜片和硝酸银溶液.
第三支里放了锌片和稀盐酸.
第四支里放了铁片和硫酸铜溶液.
我现在知道由第二支试管中看出Cu比Ag活泼,
第四支试管中看出Fe比Cu活泼.
我的问题是,那Zn的活动性怎么从上述实验看出来啊!?
如果看剧烈程度的话,Zn和Fe的活动性顺序排的很近啊,分得出谁更剧烈啊? zhangjinghang1年前6
zhangjinghang1年前6 -
 bbq1328 共回答了16个问题
bbq1328 共回答了16个问题 |采纳率81.3%第一支里放了铁片和稀盐酸.
第三支里放了锌片和稀盐酸.
由这两支,可以看出来反映的剧烈程度不一样.
锌的反应速度,比铁的反应速度要快.
所以得出Zn比Fe活泼
最后得出Zn>Fe>Cu>Ag1年前查看全部
- 小明和小丽将一块铜片和一块锌片插入西红柿内,做成了一个“西红柿电池”.小明和小丽想探究“西红柿电池的电压大小与哪些因素有
小明和小丽将一块铜片和一块锌片插入西红柿内,做成了一个“西红柿电池”.小明和小丽想探究“西红柿电池的电压大小与哪些因素有关”,小丽说:“可能与两金属片之间的距离有关”,
如何判断正负极
设计记录表格 Kyou_baby1年前1
Kyou_baby1年前1 -
 jiangshuhua2 共回答了17个问题
jiangshuhua2 共回答了17个问题 |采纳率88.2%果酸电池的正负极就可以在化学课学到啦
电池的负极会失去电子 正极得到电子
也就是说 电子从负极出来 进入到正极
而谁失去电子谁得到电子就看金属的活泼性了
因为锌比铜活泼 所以锌容易失去电子 所以锌是负极
铜容易得到电子 铜是正极1年前查看全部
- 将相同质量的铜片分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
将相同质量的铜片分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A. 反应速率,两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少 mira1年前1
mira1年前1 -
 hxz650714 共回答了19个问题
hxz650714 共回答了19个问题 |采纳率84.2%解题思路:A、反应速率与溶液的浓度有关,浓度越高,反应速率越快.
B、根据反应方程式判断消耗酸的物质的量多少.
C、二氧化氮是红棕色气体,一氧化氮是无色气体,根据生成气体的颜色判断.
D、根据反应方程式中铜与转移电子的关系判断.A、因为溶液浓度影响化学反应速率,浓度越大,反应速率越快,所以浓硝酸比稀硝酸反应速率快,故A错误.
B、铜与浓硝酸、稀硝酸反应方程式如下:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O
Cu+[8/3]HNO3=Cu(NO3)2+[2/3]NO↑+[4/3]H2O
根据方程式可知,浓硝酸消耗的物质的量多,故B正确.
C、根据B知,铜与浓硝酸反应生成二氧化氮,与稀硝酸反应生成一氧化氮,二氧化氮是红棕色气体,一氧化氮是无色气体,故C错误.
D、根据铜与转移电子的关系知,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑+2H2O 转移电子
1mol 2mol
Cu+[8/3]HNO3=Cu(NO3)2+[2/3]NO↑+[4/3]H2O 转移电子
1mol 2mol
根据方程式知,相同质量的铜与过量浓、稀硝酸反应转移电子数相等,故D错误.
故选B.点评:
本题考点: 硝酸的化学性质.
考点点评: 本题考查了铜与浓、稀硝酸的反应,难度不大,能正确书写铜与浓、稀硝酸反应的方程式是解本题的关键.1年前查看全部
- 铜片与浓硝酸反应,试管下端产生无色气体,气体上升逐渐变成红棕色的反应机理是什么
铜片与浓硝酸反应,试管下端产生无色气体,气体上升逐渐变成红棕色的反应机理是什么
为什么先生无色气体 疯花噱月1年前1
疯花噱月1年前1 -
 zi_58 共回答了23个问题
zi_58 共回答了23个问题 |采纳率100%我的理解是生成的是NO2,但NO2又与水反应后生成了NO,气泡上升,接触空气后又与氧气反应,变成红棕色1年前查看全部
- 铜片在酒精灯上加热后,与盐酸反应么为什么
 MJMJ200720071年前1
MJMJ200720071年前1 -
 安静一分钟 共回答了20个问题
安静一分钟 共回答了20个问题 |采纳率100%2Cu + O2 =加热= 2CuO
2CuO + 2HCl = CuCl2 + H2O1年前查看全部
- “把光亮的铜片放入盐酸中,表面出现气泡”这句话为什么不对
 mailmaxtoo1年前3
mailmaxtoo1年前3 -
 111122220 共回答了16个问题
111122220 共回答了16个问题 |采纳率87.5%Cu的金属活动性在H之后,所以不与稀盐酸和稀硫酸反应,所以没有气泡.
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au1年前查看全部
- 关于铜片和稀硫酸的反应铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?氯化钠
关于铜片和稀硫酸的反应
铜粉和稀硫酸加热不反应,但加入化合物X后,溶液逐渐变色.且质量增加,还放出气体,则X可能是?
氯化钠 硝酸钾 硫酸钠 碳酸钠? 长青131年前2
长青131年前2 -
 korla31g 共回答了21个问题
korla31g 共回答了21个问题 |采纳率81%硝酸钾
NO3-在酸性环境下具有硝酸性质,具有强氧化性
故加入硝酸钾后,会发生氧化还原反应
3Cu+8H+ +3NO3-=2Cu2+ +2NO+4H2O1年前查看全部
- 水银和铝,长白毛用铜置换硝酸汞,再把有一层汞的铜片在铝片上画一道线,会长出白毛,不停的涨,很快,这是为什么
 felic881年前5
felic881年前5 -
 sungsi 共回答了14个问题
sungsi 共回答了14个问题 |采纳率92.9%我试了一下,是氧化铝不错.你试试把一毛钱扔到汞液中,超级壮观.小心汞的毒性.1年前查看全部
大家在问
- 1观察下面的一列数:—1,—3,+1,—1,3.按规律在横线上在写出两个数:____.______.)
- 2成语搜索:日雕月琢
- 3按要求写成语:日雕月啄“日”和“月”带点
- 4如图,将△AOB绕点O逆时针旋转90°,得到△A′OB′.若点A的坐标为(a,b),则点A′的坐标为______.
- 5问三道关于二次函数的填空题1.a,b是正数,并且抛物线y=x^+ax+2b和x^+2bx+a都与x轴有交点,则a^+b^
- 6请教二次函数.我不会做二次函数题.有没简单的说法.那图像呢?
- 7关于二次函数的2小题··1.某校组织篮球比赛,参赛的每两队之间都要比赛一场,现全校共有x支球队参赛,设比赛的总场数为y,
- 8计算器怎么计算方差?(CASIO fx-82ES PLUS) 各种求~
- 9用一根绳子去测量树的周长 围两圈后绳子余下4米;如果三折后围一圈的话,绳子还剩下2/3米.
- 10(2005•海南)人体形成尿液的器官是( )
- 11Let's _____ on Saturday morning.横线上填climb、go climb还是going cl
- 12fatique fatigue 两者做形容词的区别【机械方面】
- 13已知a,b都是非零向量,且|a|=|b|=|a+b|,求a与a-b的夹角
- 14下列名言名句体现量变 下列名言名句体现量变和质变关系原理的是 [ ] ① 千里之堤,溃于蚁穴 ②牵牛要牵牛鼻子
- 15关于线性代数中特征值的问题已知三阶矩阵A的特征值为1、2、3,请问[4E-A]该如何求?
