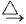过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等.现向50mL浓度为0.100mol
 忧郁的洋2022-10-04 11:39:546条回答
忧郁的洋2022-10-04 11:39:546条回答A. K2MnO4
B. MnO2
C. MnCl2
D. Mn

已提交,审核后显示!提交回复
共6条回复
 atjbk 共回答了21个问题
atjbk 共回答了21个问题 |采纳率100%- 解题思路:n(FeCl2)=0.05L×0.1mol/L=0.005mol,反应后被氧化生成Fe3+,Fe元素化合价升高1价,
n(KMnO4)=0.025L×0.04mol/L=0.001mol,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算.n(FeCl2)=0.05L×0.1mol/L=0.005mol,反应后被氧化生成Fe3+,Fe元素化合价升高1价,
n(KMnO4)=0.025L×0.04mol/L=0.001mol,设被还原后Mn元素的化合价为+x,
则0.005mol×(3-2)=0.001mol×(7-x),
x=2,
故选C.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,明确氧化还原反应中元素的化合价升降及电子守恒是解答本题的关键,题目难度不大. - 1年前
 flyer800 共回答了3个问题
flyer800 共回答了3个问题 |采纳率- 电子守恒,高锰酸钾将二价铁离子氧化为三价,又恰好完全反应,则设锰元素被还原后的价态为A,则0.0400乘以25再乘以7减A的差,与0.100乘以50相等,解出A为2
- 1年前
 COCOONLIU 共回答了21个问题
COCOONLIU 共回答了21个问题 |采纳率81%- 根据化学方程式,元素的升降价判断
- 1年前
 冰兰色的紫 共回答了2个问题
冰兰色的紫 共回答了2个问题 |采纳率- 首先你要搞清楚这个反应的产物是什么,你才能作答,
- 1年前
 woyaodanaizi 共回答了19个问题
woyaodanaizi 共回答了19个问题 |采纳率- Fe只能升到+3价,故Fe失电子数0.1*0.05
故Mn得电子为0.1*0.05
则每个Mn得电子0.005/(0.04*0.025)=5则Mn为+2价
) - 1年前
 jane8280 共回答了5个问题
jane8280 共回答了5个问题 |采纳率- 。
- 1年前
相关推荐
- 元素周期表里的过渡元素是什么意思?
 无辰rr1年前2
无辰rr1年前2 -
 菲宫小主 共回答了27个问题
菲宫小主 共回答了27个问题 |采纳率92.6%过渡元素(transition elements)是元素周期表中从ⅢB族到VⅢ族的化学元素 .这些元素在原子结构上的共同特点是价电子依次充填在次外层的 d 轨道上 ,因此,有时人们也把镧系元素和锕系元素包括在过渡元素之中 .另外,ⅠB族元素(铜、银、金)在形成+2和 +3 价化合物时也使用了d电子;ⅡB族元素(锌、镉、汞)在形成稳定配位化合物的能力上与传统的过渡元素相似,因此,也常把ⅠB和ⅡB族元素列入过渡元素之中.
具体知识参照百度文库:1年前查看全部
- 什么叫过渡元素啊?还有,铁为什么是过渡元素,我觉得应该是金属元素啊?
 qbpo1年前3
qbpo1年前3 -
 seabed 共回答了13个问题
seabed 共回答了13个问题 |采纳率100%过渡元素是从元素在化学元素周期表的位置来定义的,其最大的特点是从最内层到次外层的电子并不完全排布满,不像主族元素的电子从最内层依次排起直至最外层.像铁可以表现出正2和正3价就是这个原因.至于金属元素与非金属元素是从其价态表现来划分的.两者不是一回事,更不矛盾.1年前查看全部
- (2010•江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
 (2010•江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010•江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个
数比为______.
(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是______.(填序号)
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
(3)铬的配合物在药物应用、设计合成新磁材料领域和聚乙烯催化剂方面都有重要应用.现有铬(Ⅲ)与甲基丙烯酸根的配合为:元素 Mn Fe 电离能
(kJ・mol-1)I1 717 759 I2 1509 1561 I3 3248 2957 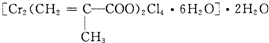
①该化合物中存在的化学键类型有______.
②该化合物中一个Cr的配位数为______.
③甲基丙烯酸分子中C原子的杂化方式有______.
④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是______.(填一种即可)
⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是______.(填元素符号) Franz·Kafka1年前1
Franz·Kafka1年前1 -
 知心ll结 共回答了24个问题
知心ll结 共回答了24个问题 |采纳率91.7%解题思路:(1)利用均摊法计算;
(2)A.根据正负化合价的代数和为0计算铁元素的化合价;
B.根据构造原理写出其价层电子排布式;
C.根据物质化合价、状态判断;
D.电离能越大,其失电子越难;
(3)①阴阳离子间存在离子键,非金属元素之间易形成共价键,含有空轨道的原子和含有孤电子对的原子间易形成配位键;
②配离子有甲基丙烯酸根、氯原子和水分子;
③根据含有的价层电子对判断杂化方式;
④根据等电子体的含义确定水分子的等电子体;
⑤铬元素最外层电子数是1,且铬属于第四周期,写出第四周期且最外层电子数是1的元素.(1)每个铁原子被2个N原子共用,每个N原子被4个Fe原子共用,所以氮原子与铁原子的个数比为1:2,故答案为:1:2;
(2)A.[Fe2(OH)n(SO4)3-n/2]m中n小于5,且[n/2]为正整数,且化合物中各元素的化合价代数和为0,铁的化合价为正整数,所以n=2,铁元素的化合价为+3,故A正确;
B.铁元素的价电子数8,且4s轨道排2个电子,3d轨道排6个电子,所以铁原子的价电子排布式是3d64s2,故B正确;
C.硫酸亚铁中铁元素的化合价是+2价,[Fe2(OH)n(SO4)3-n/2]m中铁元素的化合价是+3价,铁离子水解生成氢氧化铁,所以由FeSO4溶液制PFS需经过氧化、水解和聚合的过程,故C正确;
D.电离能越大,其失电子越难,所以气态Fe2+再失去一个电子比气态Mn2+再失去一个电子容易,故D错误;
故选D;
(3)①根据铬的配合物结构知,该配合物中含有离子键、共价键和配位键,故答案为:离子键、共价键和配位键;
②2个铬离子占有2个甲基丙烯酸根、4个氯原子和6个水分子,所以一个Cr的配位数是6,故答案为:6;
③甲基上的碳原子含有4个σ键,所以采取sp3杂化,碳碳双键上的碳原子含有3个σ键,所以采取sp2杂化,
故答案为:sp3、sp2;
④H2O分子含有3个原子8个价电子,与H2O分子互为等电子体的微粒是H2S、NH2-,故答案为:H2S、NH2-;
⑤铬元素最外层电子数是1,且铬属于第四周期,属于第四周期且最外层电子数是1的元素有K、Cu,
故答案为:K、Cu.点评:
本题考点: 元素电离能、电负性的含义及应用;原子核外电子排布;配合物的成键情况;“等电子原理”的应用;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查杂化方式的判断、配合物、等电子体等知识点,难点是配位数的判断,注意基础知识的积累和运用,难度不大.1年前查看全部
- 过渡元素 Cr原子的价电子构型为什么是3d5 4s1,而不是3d4 4s2
过渡元素 Cr原子的价电子构型为什么是3d5 4s1,而不是3d4 4s2
照这么说,23号应是3d4 4s1了,这样s半满了 llxsir1年前1
llxsir1年前1 -
 xnlizan 共回答了11个问题
xnlizan 共回答了11个问题 |采纳率90.9%电子排列按照三个原则:能量最低原则(一定要遵循这个原则),其次,就是以所说的,电子的排列首先要排满自旋方向相同的,再排自旋方向相反的.最后一个是洪特规则,就是电子全充满,半充满,空电子,能量是最低的(这个原则几本符合不完全正确)
你所问的,就是因为第三个原因,半充满状态能量最低,3d54s1都是半充满状态,而不取采3d44s2这种排法.
另外,现代的理论还不能很好的解释原子电子的排布,有的原子的电子排布到现今还不能有很好的解释1年前查看全部
- (13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性
(13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
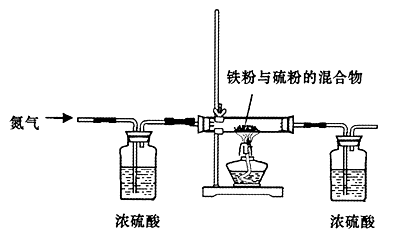
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe 3 S 4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO 2 )饱和溶液混合加热反应得氮气。请写出该反应的离子方程式: 。
(2)实验中通入氮气的作用 。
(3)若猜想一正确,则步骤三应该观察到试管内有 出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论 。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是 。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是 。 独行者19711年前1
独行者19711年前1 -
 忘记爱你 共回答了23个问题
忘记爱你 共回答了23个问题 |采纳率95.7%(1)NH 4 + + NO 2 - N 2 ↑+2H 2 O (2分)
N 2 ↑+2H 2 O (2分)
(2)赶走装置中的空气 (2分)
(3)有白色浑浊出现 (2分)
(4)取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe 2+ ,则黑色固体中铁的化合价为+2价。(3分)
(5)防止未反应的铁与稀硫酸反应生成Fe 2+ 干扰实验 (2分)
(6)除去未反应的硫 (2分)
(1)氮元素发生了归中反应:NH 4 + + NO 2 - N 2 ↑+2H 2 O
N 2 ↑+2H 2 O
(2)防止铁粉或硫粉被氧气氧化
(3)固体溶液产生的铁离子与硫化氢生成硫单质:2Fe 3 + +H 2 S=2Fe 2 + +S↓+2H + ,有淡黄色或乳白色浑浊出现
(4)也就是亚铁离子的检验(FeS+2H + =Fe 2 + +H 2 S↑):
取步骤三所得溶液少许,滴加KSCN溶液,若溶液不显红色,再向溶液中滴加少量氯水,溶液显红色,证明原溶液中只含有Fe 2+ ,则黑色固体中铁的化合价为+2价
(5)在步骤三中固体中加酸,需要通过对Fe 2+ 的检验来判定FeS,而铁可以与酸产生Fe 2+ ,所以必须使硫粉过量
(6)过量的硫可溶于碱液:3S+6OH - =S 2 - +SO 3 2 - +3H 2 O1年前查看全部
- (2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
 (2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009•海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
回答下列问题:元素 Mn Fe 电离能/kJ•mol-1 I1 717 759 I2 1509 1561 I3 3248 2957
(1)Mn元素价电子层的电子排布式为______,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是______.
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是______.
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为______晶体.
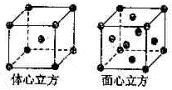
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为______,其中体心立方晶胞空间利用率为______. 半空烟火1年前1
半空烟火1年前1 -
 308783365 共回答了17个问题
308783365 共回答了17个问题 |采纳率88.2%解题思路:(1)根据核外电子排布规律书写;原子轨道处于半满、全满、全空时能量更低稳定;
(2)①根据配位键形成条件分析,由Fe原子或离子的核外电子排布图可知,Fe原子或离子含有空轨道,配位体中的中心原子含有孤对电子;
(3)根据信息可知三氯化铁的晶体为分子晶体;
(4)利用均摊法计算.(1)Mn元素为25号元素,核外电子排布式为[Ar]3d54s2,所以价层电子排布式为3d54s2,
由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(2)Fe原子或离子含有空轨道.所以,与Fe原子或离子形成配合物的分子或离子应具有孤对电子,故答案为:具有孤对电子;
(3)三氯化铁,其熔点:282℃,沸点315℃,在300℃以上升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.符号分子晶体的特征,故为三氯化铁分子晶体,
故答案为:分子;
(4)面心立方结构晶胞中铁原子数为1+6×[1/2]=4;体心立方结构晶胞中铁原子数为1+8×[1/8]=2,属于两种结构的铁原子数之比为4:2=2:1,体心立方晶胞空间利用率为68%,
故答案为:2:1;68%.点评:
本题考点: 晶体的类型与物质熔点、硬度、导电性等的关系;配合物的成键情况;晶胞的计算.
考点点评: 本题考查电子排布式、电离能、晶体性质、晶胞等,难度较大,是对知识与能力综合考查,(4)是学生解答的难点.1年前查看全部
- (2008•肇庆一模)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受
(2008•肇庆一模)学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究.请你根据要求完成下列部分实验报告.
Ⅰ课题名称:______.
Ⅱ实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、______、______、______等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ实验步骤:略
Ⅳ实验数据:
Ⅴ实验讨论:实验
编号KClO3(g) 氧化物 产生气体(mL) 耗时(s) 化学式 质量(g) 回收 (已折算到标况) 1 0.60 - - - 10 480 2 0.60 MnO2 0.20 90% 67.2 36.5 3 0.60 CuO 0.20 90% 67.2 79.5 4 0.60 Fe2O3 0.20 90% 67.2 34.7 5 0.60 Cr2O3 0.20 异常 67.2 188.3
(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、______、______.
(2)实验编号3的实验中KClO3的分解率为______%(保留一位小数).
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气体是______(填分子式),可用______试纸检验.上述异常现象产生的原因是______.
Ⅵ实验结论:______. mingyueyiyi1年前1
mingyueyiyi1年前1 -
 198773826 共回答了19个问题
198773826 共回答了19个问题 |采纳率84.2%解题思路:I 课题名称:根据提供的试剂分析其催化作用来解答;
II 根据实验操作分析所用仪器;
V 实验讨论:
(1)根据过滤的操作分析;
(2)根据氧气的体积来计算分解的氯酸钾,再计算其分解率;
(3)根据元素及氧化还原反应来推测产物,再根据物质的性质进行检验;
VI 实验结论:根据 实验的情况及实验的耗时来得出催化剂效果较好的物质.I 课题名称:因二氧化锰能催化氯酸钾受热分解,根据提供的试剂有氧化铁、氧化铜、氧化铬等,则含该实验来探究二氧化锰、氧化铁、氧化铜、氧化铬的氧化能力的比较,
故答案为:探究氧化铁、氧化铜、氧化铬对氯酸钾受热分解反应的催化作用;
II 除了题目中给出的仪器以外还需要反应容器,加热仪器,计时仪器,所以还需要大试管、酒精灯、计时器,故答案为:大试管;酒精灯;计时器;
V 实验讨论:
(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、普通漏斗、烧杯,故答案为:普通漏斗;烧杯;
(2)实验编号3中生成氧气为
67.2×10-3L
22.4L/mol=0.003mol,由2KClO3
催化剂
.
△2KCl+3O2↑可知,分解的氯酸钾为0.002mol×122.5g/mol=0.245g,则其分解率为[0.245g/0.60g]×100%=40.8%,故答案为:40.8;
(3)用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
VI 实验结论:因氧化铁和二氧化锰作催化剂时,时间少,相比较来说,其催化能力好,
故答案为:氧化铁的催化能力和二氧化锰的催化能力较好.点评:
本题考点: 探究化学规律.
考点点评: 本题考查化学反应速率影响的因素,探究催化剂对化学反应速率的影响及催化效果,注意实验过程及实验现象、结论,能够较好的考查学生综合应用知识的能力.1年前查看全部
- 学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜
学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣.是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究.请你根据要求完成下列部分实验报告.
Ⅰ课题名称:______
Ⅱ实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、大试管、酒精灯、计时器等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ实验步骤:略
Ⅳ实验数据:
Ⅴ实验讨论:实验
编号KClO3(g) 氧化物 产生气体(mL)
(已折算到标况)耗时(s) 化学式 质量(g) 回收 1 0.60 - - - 10 480 2 0.60 MnO2 0.20 90% 67.2 36.5 3 0.60 CuO 0.20 90% 67.2 79.5 4 0.60 Fe2O3 0.20 90% 67.2 34.7 5 0.60 Cr2O3 0.20 异常 67.2 188.3
(1)实验编号1的实验作用是______.
(2)实验编号3的实验中KClO3的分解率为______%(保留一位小数)
(3)在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气体可能是______(填分子式),可用______试纸检验.上述异常现象产生的原因是______.
Ⅵ实验结论:______. yangsuchen11281年前1
yangsuchen11281年前1 -
 ypgg 共回答了18个问题
ypgg 共回答了18个问题 |采纳率83.3%解题思路:I 课题名称:根据提供的试剂分析其催化作用来解答;
V 实验讨论:
(1)不使用催化剂和使用催化剂进行比较;
(2)根据氧气的体积来计算分解的氯酸钾,再计算其分解率;
(3)根据元素及氧化还原反应来推测产物,再根据物质的性质进行检验;
VI 实验结论:根据 实验的情况及实验的耗时来得出催化剂效果较好的物质.I 课题名称:因二氧化锰能催化氯酸钾受热分解,根据提供的试剂有氧化铁、氧化铜、氧化铬等,则含该实验来探究二氧化锰、氧化铁、氧化铜、氧化铬的氧化能力的比较,
故答案为:探究二氧化锰、氧化铁、氧化铜、氧化铬的氧化能力的比较;
V 实验讨论:
(1)因只有实验编号1不使用催化剂,则可以与使用催化剂的其它实验对照,故答案为:对照作用;
(2)实验编号3中生成氧气为
67.2×10−3L
22.4L/mol=0.003mol,由2KClO3
催化剂
.
△2KCl+3O2↑可知,分解的氯酸钾为
0.002mol×122.5g/mol=0.245g,
则其分解率为[0.245g/0.60g]×100%=40.8%,
故答案为:40.8;
(3)用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,
Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
VI 实验结论:因氧化铁和二氧化锰作催化剂时,时间少,相比较来说,其催化能力好,
故答案为:氧化铁和二氧化锰的催化能力较好.点评:
本题考点: 化学反应速率的影响因素;催化剂的作用.
考点点评: 本题考查化学反应速率影响的因素,探究催化剂对化学反应速率的影响及催化效果,注意实验过程及实验现象、结论,能够较好的考查学生综合应用知识的能力.1年前查看全部
- 关于过渡元素为什么除钪分族外,d区同族元素的活泼性都是自上往下逐渐降低?
 vivi_lok1年前1
vivi_lok1年前1 -
 yt-llj 共回答了11个问题
yt-llj 共回答了11个问题 |采纳率100%造成这种现象是由于同族元素从上往下原子半径增加不多,而有效核电荷数量增加较多,使电离能和升华焓增加显著,金属活泼性减弱1年前查看全部
- (2008•枣庄一模)学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化
(2008•枣庄一模)学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究.
请根据要求完成下列部分实验报告:
(1)课题名称:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用.
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、试管、酒精灯、秒表试管、酒精灯、秒表等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
(5)实验讨论:实验
编号KClO3/g 氧化物 产生气体/mL
(已折算到标况)耗时/s 化学式 质量/g 回收 1 0.60 - - - 10 480 2 0.60 MnO2 0.20 90% 67.2 36.5 3 0.60 CuO 0.20 90% 67.2 79.5 4 0.60 Fe2O3 0.20 90% 67.2 34.7 5 0.60 Cr2O3 0.20 90% 67.2 188.3
①在氧化物的回放过程中,要进行的操作是溶解、过滤过滤、洗涤、干燥干燥、称量.
②实验编号3的实验中KClO3的分解率为40.840.8(保留一位小数).
③在和Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气味的气体是C12C12,可用湿润的KI淀粉湿润的KI淀粉试纸检验.上述异常现象产生的原因是Cr2O3与KC1O3发生氧化还原反应Cr2O3与KC1O3发生氧化还原反应.
(6)实验结论Fe2O3、CuO能对KC1O(3分)解起催化作用Fe2O3、CuO能对KC1O(3分)解起催化作用. 装得不像1年前1
装得不像1年前1 -
 0201shuai 共回答了21个问题
0201shuai 共回答了21个问题 |采纳率85.7%(1)本实验的目的是探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用,所以其课题名称为探究CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解反应的催化作用.
故答案为:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器,故答案为:试管、酒精灯、秒表;
(5)①CuO、Fe2O3、Cr2O3都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量,
故答案为:过滤、干燥;
②生成氧气的物质的量为n=
V
Vm=
0.0672L
22.4L/mol=0.003mol,
2KCl3
CuO
.
△2KCl+3O2↑
2mol 3mol
0.002mol 0.003mol
所以反应的氯酸钾的物质的量为 0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为
0.245g
0.6g×100%=40.8%,
故答案为:40.8%;
③用Cr2O3做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl2,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl2;湿润的淀粉碘化钾;KClO3与Cr2O3发生了氧化还原反应;
(6)根据图表中回收的氧化物及耗时分析,CuO、Cr2O3 与二氧化锰比较,耗时较长且Cr2O3 的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:Fe2O3、CuO能对KC1O分解起催化作用.1年前查看全部
- 为什么通常选用过渡元素作为催化剂?
 jamessos1年前1
jamessos1年前1 -
 36c5i 共回答了22个问题
36c5i 共回答了22个问题 |采纳率100%结构决定性质,性质决定用途.
过渡元素的结构决定了其本身有降低反应活化能的能力从而促进反应的进行.于是也就使得人们利用它作为反应的催化剂.1年前查看全部
- 除了碱金属和碱土金属的在过渡元素右边的金属元素有统称吗,叫什么
除了碱金属和碱土金属的在过渡元素右边的金属元素有统称吗,叫什么
它们有什么性质 yangk05211年前1
yangk05211年前1 -
 xd9zf 共回答了12个问题
xd9zf 共回答了12个问题 |采纳率100%没有明确的定义,但是可以归纳为p区金属,如果不懂什么是p区,请参阅元素的分区1年前查看全部
- 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
(l)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为Fe3C+3O2
Fe3O4+CO2高温 .Fe3C+3O2.上述反应生成的磁性固体能溶于过量稀硝酸,该反应的离子方程式为______.
Fe3O4+CO2高温 .
(2)11.2g Fe与一定量的HNO3充分反应后,Fe全部溶解,生成Fe2+、Fe3+的物质的量之比为l:4,将生成的气体与一定量的O2混合后通入水槽中,气体恰好被完全吸收,氧气的物质的量是______.
A.0.12molB.0.14molC.0.2molD.0.13mol
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为______.
(4)利用电解实验可以制得纯净的Fe(OH)2,装置如图所示,两电极分别是石墨和铁,电解质溶液为NaCl溶液.
①植物油的作用是______,在加入植物油之前,要对NaCl溶液作何处理:______.
②阳极反应式为:______.
③若将该装置改为防止Fe发生电化学腐蚀的装置,Fe电极与电源______
极相连,当电路中通过2mol电子时,两极共收集到气体______L(标准状况). 一夜彼岸花1年前1
一夜彼岸花1年前1 -
 dengfeng920 共回答了13个问题
dengfeng920 共回答了13个问题 |采纳率92.3%解题思路:(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水;
(2)反应前后HNO3的物质的量不变,而化合价变化的只有Fe和氧气,则Fe失去电子数目等于O2得到电子的数目,以此进行计算;
(3)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化,由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O即可;
(4)①植物油的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气;
②阳极上Fe失去电子;
③该装置改为防止Fe发生电化学腐蚀的装置,则Fe为阴极,结合2NaCl+2H2O
2NaOH+Cl2↑+H2↑计算.电解 .(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+3O2
高温
.
Fe3O4+CO2;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水,离子反应为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:Fe3C+3O2
高温
.
Fe3O4+CO2;3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(2)11.2g Fe的物质的量为[11.2g/56g/mol]=0.2mol,由电子守恒可知,需要氧气为
0.2mol×
1
5×(2−0)+0.2mol×
4
5×(3−0)
2×(2−0)=0.14mol,故答案为:B;
(3)由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O可得到离子反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(4)①植物油的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入植物油之前,对d溶液进行加热处理的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;
②Fe为阳极,发生的电极反应为Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;
③该装置改为防止Fe发生电化学腐蚀的装置,则Fe为阴极,与电源负极相连,由2NaCl+2H2O
电解
.
2NaOH+Cl2↑+H2↑可知,通过2mol电子时生成2mol气体,气体体积为0.2mol×22.4L/mol=44.8L,故答案为:负;44.8.点评:
本题考点: 氧化还原反应的计算;化学方程式的有关计算;电解原理;铁的化学性质;铁盐和亚铁盐的相互转变.
考点点评: 本题考查较综合,涉及氧化还原反应的计算、电解计算、离子反应和化学反应方程式的书写等,综合性较强,侧重分析能力与计算能力的综合考查,题目难度中等.1年前查看全部
- 铁是一种过渡元素,金属铁是最常用的金属之一.请回答下列问题:(1)生铁中含有一种铁碳化合物(Fe3C)
铁是一种过渡元素,金属铁是最常用的金属之一.请回答下列问题:(1)生铁中含有一种铁碳化合物(Fe3C)
铁是一种过渡元素,金属铁是最常用的金属之一.请回答下列问题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为Fe3C+3O2
Fe3O4+CO2高温 .Fe3C+3O2,上述反应生成的磁性固体与过量浓硝酸反应后的溶液中含有的盐的化学式为______.
Fe3O4+CO2高温 .
(2)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.利用烧渣制绿矾的过程如下:
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出)______.
②向溶液X中加入足量铁屑的目的是______.
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时向FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全)______(提示:当某离子浓度小于10-5 mol?L-1时可以认为该离子沉淀完全了).
 溯雪流光1年前1
溯雪流光1年前1 -
 wendyl 共回答了11个问题
wendyl 共回答了11个问题 |采纳率90.9%(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+3O2
高温
.
Fe3O4+CO2;磁性固体能溶于过量浓硝酸发生氧化还原反应生成硝酸铁、NO2和水,
故答案为:Fe3C+3O2
高温
.
Fe3O4+CO2;Fe(NO3)3;
(2)①Fe2O3可以和稀硫酸之间反应生成硫酸铁,FeS可以和稀硫酸之间反应生成硫化氢,铁离子具有氧化性,硫化氢具有还原性,二者之间会发生化学反应:2Fe3++H2S=2Fe2++S↓+2H+,会产生硫单质,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
②向溶液硫酸铁中加入足量铁屑,金属铁可以和铁离子之间反应生成亚铁离子,以制备纯净的绿矾晶体,
故答案为:使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体;
(3)溶液pH为3时,溶液中c(H+)=10-3,则c(OH-)=10-11,Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+),c(Fe3+)=
1.1×10-36
10-33=1.1×10-3(mol/L)>10-5 mol?L-1,
故答案为:c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全.1年前查看全部
- 学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化锰对氯酸钾催化分解知识
学习元素周期律后,某研究性学习小组的同学们对第四周期过渡元素的氧化物产生了浓厚的兴趣.在已知二氧化锰对氯酸钾催化分解知识的基础上,联想到氧化铁、氧化铜、氧化铬等对氯酸钾的分解是否有催化作用,对此他们进行了实验研究.
请根据要求完成下列部分实验报告:
(1)课题名称:______.
(2)实验仪器及试剂:
实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、______等.
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
(3)实验步骤:略
(4)实验数据:
(5)实验讨论:实验
编号KClO 3 /g 氧化物 产生气体/mL
(已折算到标况)耗时/s 化学式 质量/g 回收 1 0.60 - - - 10 480 2 0.60 MnO 2 0.20 90% 67.2 36.5 3 0.60 CuO 0.20 90% 67.2 79.5 4 0.60 Fe 2 O 3 0.20 90% 67.2 34.7 5 0.60 Cr 2 O 3 0.20 90% 67.2 188.3
①在氧化物的回放过程中,要进行的操作是溶解、______、洗涤、______、称量.
②实验编号3的实验中KClO 3 的分解率为______(保留一位小数).
③在和Cr 2 O 3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色.该刺激性气味的气体是______,可用______试纸检验.上述异常现象产生的原因是______.
(6)实验结论______. onceared1年前1
onceared1年前1 -
 cy_hzx 共回答了11个问题
cy_hzx 共回答了11个问题 |采纳率100%(1)本实验的目的是探究CuO、Fe 2 O 3 、Cr 2 O 3 等对氯酸钾的受热分解有没有催化作用,所以其课题名称为探究CuO、Fe 2 O 3 、Cr 2 O 3 等对氯酸钾的受热分解反应的催化作用.
故答案为:探究氧化铁、氧化铜、氧化铬等对氯酸钾分配是否有催化作用;
(2)试根据实验要测定时间,所以应有秒表,还有反应容器和加热仪器,故答案为:试管、酒精灯、秒表;
(5)①CuO、Fe 2 O 3 、Cr 2 O 3 都难溶于水,所以回收是要溶解、洗涤、过滤、干燥、称量,
故答案为:过滤、干燥;
②生成氧气的物质的量为n=
V
Vm =
0.0672L
22.4L/mol =0.003mol,
2KCl 3
CuO
.
△ 2KCl+3O 2 ↑
2mol 3mol
0.002mol 0.003mol
所以反应的氯酸钾的物质的量为 0.002mol,质量为m=nM=0.002mol×122.5g/mol=0.245g,
所以其分解率为
0.245g
0.6g ×100%=40.8%,
故答案为:40.8%;
③用Cr 2 O 3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,则Cr元素的化合价升高,Cl元素的化合价降低,氯酸钾与氧化铬发生了氧化还原反应,生成氯气,其化学式为Cl 2 ,氯气能使湿润的淀粉碘化钾试纸变蓝,则可以使用湿润的淀粉碘化钾试纸检验氯气,
故答案为:Cl 2 ;湿润的淀粉碘化钾;KClO 3 与Cr 2 O 3 发生了氧化还原反应;
(6)根据图表中回收的氧化物及耗时分析,CuO、Cr 2 O 3 与二氧化锰比较,耗时较长且Cr 2 O 3 的回收物有异常,氯化铁和二氧化锰的催化能力相近.
故答案为:Fe 2 O 3 、CuO能对KC1O分解起催化作用.1年前查看全部
- (14分)A~T十多种物质存在下图所示关系(其中有 机反应的部分产物已省略)。已知A为过渡元素,B在常温下为液体,E、G
(14分)A~T十多种物质存在下图所示关系(其中有
 机反应的部分产物已省略)。已知A为过渡元素,B在常温下为液体,E、G为可燃性气体,R为黄绿色
机反应的部分产物已省略)。已知A为过渡元素,B在常温下为液体,E、G为可燃性气体,R为黄绿色 气体,K遇单质碘变蓝色,L、P能与银氨溶液发生银镜反应。其中S的分子式为C 4 H 4 O 4 ,其分子中有一个六元环,T为高分子化合物。
气体,K遇单质碘变蓝色,L、P能与银氨溶液发生银镜反应。其中S的分子式为C 4 H 4 O 4 ,其分子中有一个六元环,T为高分子化合物。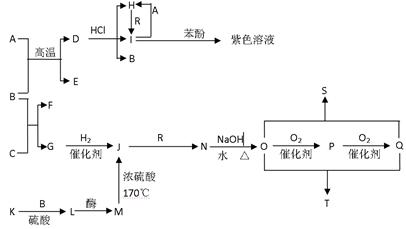
试回答下列问题:
(1)下列有关K的说法正确的是 。
A.K与纤维素是同分异构体
B.K与L是同系物
C.K是一种无臭、有甜味的粉末状物质
D.K是重要的食品工业原料,用于制备葡萄糖、酿制食醋、酿酒,也是药片中的黏合剂
(2)R与B溶液反应后的溶液具有 。
A .漂白性 B.氧化性C.还原性 D.酸性
.漂白性 B.氧化性C.还原性 D.酸性
(3)M与Q完全反应生成的有机产品是 (填名称)
(4)写出下列反应的离子方程式:
① D+HCl→H+I+B 。
② P与银氨溶液反应 。
(5)写出下列反应的化学方程式:
① B+C→F+G 。
② O+Q→S 。 JTPOLARIS1年前1
JTPOLARIS1年前1 -
 老街103号 共回答了21个问题
老街103号 共回答了21个问题 |采纳率95.2%1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 宝宝爱饭饭1年前1
宝宝爱饭饭1年前1 -
 wongyei 共回答了20个问题
wongyei 共回答了20个问题 |采纳率95%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 如何判断元素最高价和最低价?(过渡元素不考虑)
 scaudance1年前4
scaudance1年前4 -
 tommy121 共回答了18个问题
tommy121 共回答了18个问题 |采纳率83.3%金属的最高价就是最外层电子的个数.最低价是0价,金属没有负价.
非金属的最高价也是最外层电子数,最低价是负价,由最外层电子数-8
比如Cl的最外层是7个电子,那么最高价是+7价,最低价是7-8=-1价1年前查看全部
- 元素周期表可分为周期和族.其中,0族元素又称作( ) A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素
 qinqin84101年前1
qinqin84101年前1 -
 tonyscau 共回答了16个问题
tonyscau 共回答了16个问题 |采纳率100%A、稀有气体包含氦、氖、氩、氪、氙、氡,元素处于0族,故A正确;
B、卤族元素包含F、Cl、Br、I、At,故B错误;
C、碱金属包含Li、Na、K、Rb、Cs、Fr,故C错误;
D、过渡元素包含副族元素与第Ⅷ元素,故D错误;
故选A.1年前查看全部
- 关于铜的化合价铜的最外层只有一个电子,为什么会显示+2价比较多呢?是说过渡元素的次外层17个电子就满了吗?
 shf0011年前3
shf0011年前3 -
 悉悉梭梭 共回答了17个问题
悉悉梭梭 共回答了17个问题 |采纳率82.4%其实他的最外层是有两个电子,铜是过渡金属,次外层电子数不满18,只有17个,没有达到饱和状态
过渡金属,就是次外层不满18的,像铁的次外层是14个,具体的,高一好像不需要了解的,我们高二也只学了铁这一个1年前查看全部
- 铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
铁是一种过渡元素,金属铁是最常用的金属.请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为Fe3C+3O2
Fe3O4+CO2高温 .Fe3C+3O2.上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为______.
Fe3O4+CO2高温 .
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为______.
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾.利用烧渣制绿矾的过程如下:
①烧渣溶于稀H2SO4过程中,有单质硫生成,写出该反应的离子方程式(只写生成S的反应式,其他反应无需写出)______.
②向溶液X中加入足量铁屑的目的是______.
③可用硫酸酸化的 KMnO4溶液通过滴定法测定绿矾产品中FeSO4含量,滴定时发生反应的离子方程式为______.
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全______.
(提示:当某离子浓度小于1.0×10-5 mol•L-1时可以认为该离子沉淀完全了) changyan123456781年前1
changyan123456781年前1 -
 8300909 共回答了20个问题
8300909 共回答了20个问题 |采纳率85%解题思路:(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水;
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化,由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O即可;
(3)①Fe2O3和FeS均可以和稀硫酸之间反应分别生成硫酸铁、硫化氢,二者之间会发生化学反应;
②金属铁可以和铁离子之间反应生成亚铁离子;
③高锰酸根离子具有氧化性,能将亚铁离子氧化为铁离子.
(4)溶液中c(H+)=10-3,c(OH-)=10-11 ,代入Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+)求算.(1)Fe3C在足量的空气中高温煅烧生成四氧化三铁和二氧化碳,反应为Fe3C+3O2
高温
.
Fe3O4+CO2;磁性固体能溶于过量稀硝酸发生氧化还原反应生成硝酸铁、NO和水,离子反应为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:Fe3C+3O2
高温
.
Fe3O4+CO2;3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(2)由总反应(2SO2+O2+2H2O=2H2SO4)减去4Fe2++O2+4H+=4Fe3++2H2O可得到离子反应为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①Fe2O3可以和稀硫酸之间反应生成硫酸铁,FeS可以和稀硫酸之间反应生成硫化氢,铁离子具有氧化性,硫化氢具有还原性,二者之间会发生化学反应:2Fe3++H2S=2Fe2++S↓+2H+,会产生硫单质,故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
②向溶液硫酸铁中加入足量铁屑,金属铁可以和铁离子之间反应生成亚铁离子,以制备纯净的绿矾晶体,故答案为:使Fe3+完全转化为Fe2+,以制备纯净的绿矾晶体;
③高锰酸根离子具有氧化性,能将亚铁离子氧化为铁离子,实质是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)溶液pH为3时,溶液中c(H+)=10-3,则c(OH-)=10-11 ,Ksp=1.1×10-36=[c(OH-)]3×c(Fe3+),c(Fe3+)=1.1×10-36/10-33=1.1×10-3(mol/L)>10-5 mol•L-1,故答案为:c(Fe3+)=1.1×10-3(mol/L)>10-5 mol•L-1故Fe3+没有沉淀完全.点评:
本题考点: 铁盐和亚铁盐的相互转变.
考点点评: 本题考查较综合,涉及氧化还原反应的计算、离子反应和化学反应方程式的书写等,综合性较强,侧重分析能力与计算能力的综合考查,题目难度中等.1年前查看全部
- 过渡元素核外电子排布为什么那么奇怪
过渡元素核外电子排布为什么那么奇怪
有什么规律么? ¤-灵¤-月¤1年前3
¤-灵¤-月¤1年前3 -
 milkbutterfly 共回答了23个问题
milkbutterfly 共回答了23个问题 |采纳率78.3%当然有规律
保利不相容原理,能量最低原理,洪特规则
第一个就是同一电子亚层只能有两个自旋相反的电子
第二个就是先充满能级低的电子
第三个就是电子层出在全充满,半充满或者全空是稳定的,例如铬铜等
就这三个,高中阶段不用管1年前查看全部
- 为何过渡元素的最外层电子数除了1就是2?
 bellxie1年前1
bellxie1年前1 -
 擦洒的复活过海 共回答了22个问题
擦洒的复活过海 共回答了22个问题 |采纳率90.9%这是因为次外层最多能够容纳18个电子那第四周期的元素来讲第二主族元素钙的电子排布是2 8 8 2但是第三电子层分为3s 3p 3d,第三电子层的实际排布是3s上排了2个电子3p上排了6个3d上排了0个电子,然后第三副族就开始不在最外层上排了,在第三层上排而且最外层的两个电子中有一个排到次外层,之所以开始在最外层排后在次外层排是因为随着原子序数的增加,最外层上电子的能量渐渐高于次外层的3d轨道,而3d轨道最多能容10个电子,而且3d轨道上有5个电子时比较稳定,所以先把3d轨道排到5个在重新再排最外层,所以最外层有1个的有两个的.这个比较复杂,如果你是高中的了解一下就好,大学如果学化学的话,在无机化学理会学.1年前查看全部
- 过渡元素就是放射性金属元素? 倘若不是,那它们是什么关系?
 evaeyes1年前3
evaeyes1年前3 -
 孤独跋涉者 共回答了21个问题
孤独跋涉者 共回答了21个问题 |采纳率100%不是放射性元素就非得是过渡元素,主族元素里也有放射性同位素.
放射性有否是相对的,就拿我们身体所含的C、N来说,就有约1%是同位素,有放射性.然而它们的放射性弱得很,非特殊仪器很纯的样品都无法检测.碳14断年你听说过吧,用的就是放射性同位素的原理.
好好看看有关同位素的章节吧,掌握了正确的知识就不会疑神疑鬼.1年前查看全部
- 在人类已知的化合物中,种类最多的是过渡元素吗
 lsqsp1年前1
lsqsp1年前1 -
 panxin19 共回答了17个问题
panxin19 共回答了17个问题 |采纳率94.1%如果就某一个元素的话,应该是碳1年前查看全部
- 硅是不是过渡元素?铜是不是过渡元素?过渡元素和过渡金属有什么区别?
 暮之箫声1年前2
暮之箫声1年前2 -
 Geovanni 共回答了15个问题
Geovanni 共回答了15个问题 |采纳率80%硅不是过渡元素,铜是过渡元素.过渡元素和过渡金属没有区别,过渡元素基本上全部是金属,所以又成为过渡金属!
过渡元素(transition elements)是元素周期表中从ⅢB族到VⅢ族的化学元素 .又称过渡金属.这些元素在原子结构上的共同特点是价电子依次充填在次外层的 d 轨道上 ,因此,有时人们也把镧系元素和锕系元素包括在过渡元素之中 .另外,ⅠB族元素(铜、银、金)在形成+2和 +3 价化合物时也使用了d电子;ⅡB族元素(锌、镉、汞)在形成稳定配位化合物的能力上与传统的过渡元素相似,因此,也常把ⅠB和ⅡB族元素列入过渡元素之中.1年前查看全部
- 铁是一种典型的过渡元素,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算:(1)28g铁粉与足量
铁是一种典型的过渡元素,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算:(1)28g铁粉与足量
铁是一种典型的过渡元素,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算:
(1)28g铁粉与足量稀硫酸完全反应,生成氢气______mol.
(2)将5.72g钢样粉末(只含铁和碳)高温下置于足量的纯氧中完全反应,生成二氧化碳224mL(标准状况),则钢样中铁的质量分数为______.
(3)若将28.12g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2 224mL;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752L,计算FexC的化学式.
 星愿yhy1年前1
星愿yhy1年前1 -
 幸福017 共回答了18个问题
幸福017 共回答了18个问题 |采纳率83.3%(1)Fe~~H2
56g1mol
28g 0.5mol
故答案为:0.5mol;
(2)m(C)=[224mL/22400mL/mol×12g/mol=0.12g,所以则钢样中铁的质量分数为
5.72g?0.12g
5.72g×100%=97.9%,故答案为:97.9%;
(3)若将28.12g还原铁粉(含少量FexC)在氧气流中加热,得到标准状况下的CO2224mL,物质的量为0.01mol,则FexC物质的量为0.01mol;将相同质量的还原铁粉与足量硫酸反应,得到标准状况下的H2 10.752L,物质的量为0.48mol,消耗铁物质的量依据反应方程式计算:Fe+H2SO4=FeSO4+H2↑;铁的质量=0.48mol×56g/mol=26.88g;依据元素守恒可知FexC中 碳元素物质的量为0.01mol,FexC的质量=28.12g-26.88g=1.24g;物质的量为0.01mol,则摩尔质量=
1.24g
0.01mol]=124g/mol,依据化学式FexC计算得到x=2,所以化学式为Fe2C,答:FexC的化学式为Fe2C.1年前查看全部
- A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离
 A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图如图,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A______B______C______D______.
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是______,碱性最强的是______.
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是______,电负性最大的元素是______.
(4)E元素原子的核电荷数是______,E元素在周期表的第______周期,第______族,已知元素周期表可按电子排布分为s区、p区等,则E元素在______区.
(5)用电子式表示B的硫化物的形成过程:______. lovedaivy1年前1
lovedaivy1年前1 -
 asd123f 共回答了18个问题
asd123f 共回答了18个问题 |采纳率77.8%解题思路:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si元素、B为Na元素、C为P元素、D为N元素.
故答案为:Si、Na、P、N.
(2)非金属越强最高价氧化物对应水化物酸性越强,非金属性N>P>Si,酸性最强的是HNO3;金属性越强最高价氧化物对应水化物碱性越强,金属性Na最强,碱性最强的是NaOH.
故答案为:HNO3、NaOH.
(3)同周期自左而右,第一电离能增大(个别除外),所以第一电离能最大的元素是F,周期自左而右,电负性增大
,故电负性最大的元素是F.
故答案为:F、F.
(4)E为Fe元素,E的核外电子排布式为1s22s22p63s23p63d64s2,故核电荷数是26,Fe在周期表中处于第四周期第Ⅷ族,在周期表中处于d 区.
故答案为:26、四、Ⅷ、d.
(5)硫化钠是离子化合物,由钠离子与硫离子构成,用电子式表示Na2S的形成过程: .
.
故答案为: .
.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 考查元素推断、元素周期律、核外电子排布规律、常用化学用语等,难度不大,推断元素是解题的关键,注意熟练掌握元素周期律与物质性质的递变规律.1年前查看全部
- 有阳离子的金属有哪些?(1)为什么Cu ,Fe可以有阳离子?金属性很强吗?(2)是不是过渡元素都可以?(3)铝不可以,那
有阳离子的金属有哪些?
(1)为什么Cu ,Fe可以有阳离子?金属性很强吗?
(2)是不是过渡元素都可以?
(3)铝不可以,那么3~7主族的那些可以有阳离子? yudun19751年前1
yudun19751年前1 -
 566587 共回答了20个问题
566587 共回答了20个问题 |采纳率100%1.金属只能形成阳离子,没有阴离子!因为金属没有负价态!
2.同上
3.铝可以形成阳离子:Al3+1年前查看全部
- 最外层电子数相同的过渡元素
 yhg80111年前2
yhg80111年前2 -
 guiyuzihua 共回答了18个问题
guiyuzihua 共回答了18个问题 |采纳率88.9%肯定不是啊,两种元素化学性质“相同”,这个基本上不现实,过渡金属的最外层电子一般都是1-2个
铁、锌、锰等等都是2个,明显连相似都算不上1年前查看全部
- 请教各位网友,为什么在元素周期表上在过渡元素的右边,非金属元素的左边还会有一部分金属呢?
 xzj0021年前3
xzj0021年前3 -
 momowb 共回答了30个问题
momowb 共回答了30个问题 |采纳率86.7%门捷列夫知道.1年前查看全部
- 过渡元素的价电子排布式是【Ar】外的轨道还是最外层轨道?为什么?
 ellen55781年前1
ellen55781年前1 -
 gotogoto 共回答了16个问题
gotogoto 共回答了16个问题 |采纳率87.5%是指【Ar】外的轨道
比如.Fe的电子排布式是【Ar】3d6 4s2,那么它的价电子式就是3d6 4s21年前查看全部
- 求过渡元素的离子的溶解度规律
 沐雨清枫1年前1
沐雨清枫1年前1 -
 tanshanyong 共回答了21个问题
tanshanyong 共回答了21个问题 |采纳率95.2%过渡元素的化合价变化非常大,你得具体的说明是哪种化合价的比较才行.1年前查看全部
- 谁能给我讲讲元素周期表怎么看?比如”过渡元素”是什么?表上的表示电子层的f d s 是指什么?
 4205178811年前3
4205178811年前3 -
 jenice 共回答了24个问题
jenice 共回答了24个问题 |采纳率95.8%横看竖看都有意义的
横看是同一周期
竖看是同一主族
过渡元素就在金属元素和非金属元素中间,是过渡的
f,d,s是外围电子层排布的代号1年前查看全部
- 元素周期表中过渡元素有哪些?
 liki011年前1
liki011年前1 -
 daw0 共回答了18个问题
daw0 共回答了18个问题 |采纳率88.9%太多了 所有的副族 还有下面的f 区
简单来说就是 d ds f都是过渡元素1年前查看全部
- 为什么副族元素又称过渡元素
 风雨静姝1年前1
风雨静姝1年前1 -
 彤馨 共回答了17个问题
彤馨 共回答了17个问题 |采纳率88.2%因为随着核电荷数增大的顺序,原子增加的电子填充入次外层或倒数第三层中,而不是填入最外层.由于最外层电子通常为1~2个,且随着核电荷数增加内层电子数增多,半径变化不如主族元素明显,过渡元素均为中等活泼或不活泼金属,是主族典型金属元素向主族典型非金属元素过渡的元素,所以叫过渡元素.1年前查看全部
- 过渡元素最外层电子数如何判断,还有副族元素的族数是根据什么来排的.
过渡元素最外层电子数如何判断,还有副族元素的族数是根据什么来排的.
还有副族元素的族数是根据什么来排的.就像铁钴镍都是VIII族的可最外层我以正常的算法怎么算也不相等,也不等于8啊.其他副族的我也不知如何算最外层电子数啊. liuyyan1年前2
liuyyan1年前2 -
 jingshen2006 共回答了23个问题
jingshen2006 共回答了23个问题 |采纳率82.6%副族和VIII族的最外层电子数只可能是1个或两个,但是价电子数可能有很多个,像锰有七价,铬有 六价,铁有六价,锇有8价一样.它们是先把S电子排完再折回去排d电子和f电子.
排布先后顺序(非空间顺序):1S 2S 2P 3S 3P 4S 3D 4P 5S 4D 5P 6S 4F 5D 6P 7S 5F 6D 7P 5G 6F 7P 6G 7F…………………………1年前查看全部
- 最外层电子数是8的原子都是稀有气体原子吗?注意是原子,有没有可能是过渡元素
 o0西告0o1年前1
o0西告0o1年前1 -
 wkathykong 共回答了18个问题
wkathykong 共回答了18个问题 |采纳率88.9%是的,过渡金属的最外层电子数是1~2个1年前查看全部
- 过渡元素的电子亚层排布规律是什么
过渡元素的电子亚层排布规律是什么
同上,尽量详细,谢谢 faguangti1年前2
faguangti1年前2 -
 JECKYLIN 共回答了16个问题
JECKYLIN 共回答了16个问题 |采纳率100%你是大学还是高中?高中不用管这个,因为从薛定谔方程开始你都没学过.
大学的基础无机化学会简单介绍原子外层电子排布规律,要满足Hund规则,Pauli原理和能量最低规则.如果你想充分理解这几条规则,那么你还需要学习结构化学,量子力学基础中会介绍通过解薛定谔方程得到的四个量子数,这四个量子数表征了电子的运动状态.当满足那几条规则之后,能保证电子的能量最低.
简单来说,需要用到的是n+0.7l规则首先判断应该排哪一层电子,因为从第六周期开始又出现了内过渡元素,还要考虑倒数第三层的排列.然后在满足自旋相同的情况下开始排...要注意充满和半充满的时候能量会非常低,此时最外层的电子排布又会受到影响...
非常复杂.1年前查看全部
- 化学元素记忆想问下过渡金属的记忆方法看清了,是过渡元素,主族的我记住了要记忆符号(或名称) 周期 族数 如有好的口诀,望
化学元素记忆
想问下过渡金属的记忆方法
看清了,是过渡元素,主族的我记住了
要记忆符号(或名称) 周期 族数
如有好的口诀,望分享.
万分感激 心随梦想1年前1
心随梦想1年前1 -
 5201314宝贝 共回答了23个问题
5201314宝贝 共回答了23个问题 |采纳率95.7%这里的族和周期好记一些,就是元素的名称排列不好记.前20号都很熟,但后面不好记忆.你只记忆副族元素不是很好记,最好按周期记忆,这样同时元素序数也好记忆以及推理.
以前看到有这样一个小故事,应该有所帮助
可以编一个小故事来记忆:(但有的人不习惯)
侵 害 (氢氦)
从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命.刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了.
这下不得了,娘家要上告了.铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方.
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅 ,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊.
在来把这个故事浓缩一下(这样好记一些,):
第一周期:氢 氦 ---- 侵害
第二周期:锂 铍 硼 碳 氮 氧 氟 氖 ---- 鲤皮捧碳 蛋养福奶
第三周期:钠 镁 铝 硅 磷 硫 氯 氩 ---- 那美女桂林留绿牙(那美女鬼 流露绿牙)(那美女归你)
第四周期:钾 钙 钪 钛 钒 铬 锰 ---- 嫁改康太反革命
铁 钴 镍 铜 锌 镓 锗 ---- 铁姑捏痛新嫁者
砷 硒 溴 氪 ---- 生气 休克
第五周期:铷 锶 钇 锆 铌 ---- 如此一告你
钼 锝 钌 ---- 不得了
铑 钯 银 镉 铟 锡 锑 ---- 老把银哥印西堤
碲 碘 氙 ---- 地点仙
第六周期:铯 钡 镧 铪 ----(彩)色贝(壳)蓝(色)河
钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅
铱 铂 金 汞 砣 铅 ---- 一白巾 供它牵
铋 钋 砹 氡 ---- 必不爱冬(天)
第七周期:钫 镭 锕 ---- 防雷啊!
其他的方法没有,我就是这样记忆的.1年前查看全部
- (1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个...
(1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个...
(1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子.请写出B元素在周期表中的 纯属意外5411年前1
纯属意外5411年前1 -
 肖鲁嘉 共回答了20个问题
肖鲁嘉 共回答了20个问题 |采纳率85%A是铁,B是钴
B元素在周期表中的第四周期,第八族.1年前查看全部
- (1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个...
(1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个...
(1/2)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子.请写出正2价A离子在基态 大头rong32081年前2
大头rong32081年前2 -
 千里走单犄 共回答了21个问题
千里走单犄 共回答了21个问题 |采纳率90.5%原子序数小于36的过渡元素A和B,在周期表中位于同一族——只能是第四周期,第Ⅷ族中的铁、钴、镍三个元素.
基态B原子中含有三个未成对电子——钴.A是铁.
Fe2+的电子排布:1s2 2s2 2p6 3s2 3p6 3d61年前查看全部
- 碱金属,碱土金属,过渡元素,类金属,非金属,卤素,稀有气体分别是什么概念?
碱金属,碱土金属,过渡元素,类金属,非金属,卤素,稀有气体分别是什么概念?
碱金属,碱土金属,过渡元素,类金属,非金属,卤素,稀有气体分别有什么共性? waterman20041年前1
waterman20041年前1 -
 wangzhen01100 共回答了24个问题
wangzhen01100 共回答了24个问题 |采纳率95.8%碱金属:因为它们的氢氧化物碱性很强,因此而命名,包括IA中的所有金属;
碱土金属:因为它们的氢氧化物既具有较强的碱性,又具有象氧化铝这样的土性(水溶性小),故而命名,包括IIA族元素;
过渡元素:因为在元素周期表中处于s主族区和p区主族区之间而得名;
类金属:指单质导电性价于金属与非金属之间的元素;元素单质一般都是半导体;
卤素:因它们很易与金属形成化合物且具有盐的性质,即成盐元素,包括VIIA族元素;
稀有气体:原名惰性气体(难以形成化合物),现理解为稀少的气体,包括VIIIA(也称0族)元素.
共性:都是元素周期表大家庭中的一元素,就象梁山好汉一样,周期表中有它的交椅.1年前查看全部
- 外层电子数9~17之间的都是过渡元素吗
外层电子数9~17之间的都是过渡元素吗
是都是过渡元素(副族元素)的离子吗 石楠烟斗1年前2
石楠烟斗1年前2 -
 海幻儿 共回答了24个问题
海幻儿 共回答了24个问题 |采纳率79.2%是的.
简单离子(单原子离子)的最外层电子只有以下情况:
2电子:H-、Li+、Be2+、长周期IIIA~VA族低价离子(Tl+、Sn2+、Pb2+等)
8电子:IA~IIA族正离子(Li、Be除外)、IIIA~VIIA族负离子(N3-、O2-、S2-、卤素负离子等)、Al3+、少量第四周期过渡金属离子(Sc3+、Ti4+)
18电子:长周期IIIA~VIIA族高价正离子(Tl3+、Sn4+等)、IB~IIB族等于族号的正离子(Ag+、Zn2+等)、IIIB~IVB族等于族号的正离子(镧系金属离子、Zr4+等)
17电子:一般过渡金属离子
对照可知结论正确1年前查看全部
- 哪些过渡元素的氧化物是离子化合物,哪些是共价化合物
哪些过渡元素的氧化物是离子化合物,哪些是共价化合物

给一幅元素周期表作参考
 bmcc_co1年前2
bmcc_co1年前2 -
 kaomushupian 共回答了22个问题
kaomushupian 共回答了22个问题 |采纳率81.8%一般来说,低价是离子化合物,高价是共价化合物.Sc和Y只有3价,电子结构与铝相似,都是离子化合物.Ti有4价氧化物,介于离子与共价之间.V有5价氧化物,也是介于两者之间,酸性强于碱性,偏向与共价键.Cr有3价与6价两种氧化物,3价的为离子化合物,6价偏向共价化合物.Mn有2,3,4,7价氧化物,2,3价为离子化合物,4价为过渡氧化物,7价的是绿色油状液体,显然是共价化合物.Fe,Co,Ni只有低价氧化物,都偏向离子化合物,Cu,Zn两族的氧化物都是离子化合物.1年前查看全部
- 镧系收缩对原子半径的影响第六周期的不是比第五周期的多一个电子层吗其实我要问的是:镧系元素之后的过渡元素的原子和同族的第五
镧系收缩对原子半径的影响
第六周期的不是比第五周期的多一个电子层吗
其实我要问的是:镧系元素之后的过渡元素的原子和同族的第五周期的原子有效核电荷相等嘛,可是第六周期的原子比第五周期的原子多一个电子层,这么说的话,第六周期的原子半径不是应该比第五周期的原子半径大吗?
答得好我再加100分 cp我是一条鱼1年前4
cp我是一条鱼1年前4 -
 kejeter 共回答了18个问题
kejeter 共回答了18个问题 |采纳率77.8%镧系收缩对原子半径的影响:由于镧系收缩,同组的第二、第三过渡系金属的院子半径、离子半径很接近,因而性质相似.同时也使得钇成为稀土元素的成员,并与中稀土元素共存于矿物中.使得第四副族中的Zr何Hf,第五副族的Nb和Ta,第六副族中的Mo何W在原子半径和离子半径上较结晶,化学性质也相似,造成这三队元素在分离上的困难.
主要原因在于增加的f轨道上的电子对核电荷的屏蔽作用太小,致使核电荷对核外电子的吸引作用增加.这种增加导致同一副族第五第六过渡金属元素决定原子半径的两个因素(电子层数增加和核电荷吸引力)中核电荷吸引力占主导地位.这同具有完整次外壳层结构的主族元素的影响正好相反.
也许对你有用.1年前查看全部
- 主族金属单质与酸溶液反应置换氢气的能力一定比过渡元素强吗.
 书圣贝贝1年前1
书圣贝贝1年前1 -
 雁蓝天天 共回答了22个问题
雁蓝天天 共回答了22个问题 |采纳率95.5%不一定的,过渡元素Zn、Fe就比主族元素Sn、Pb强1年前查看全部
- 元素周期表中过渡元素包括几列 全是什么元素 其单质具有良好的什么性
 Misszhutou1年前1
Misszhutou1年前1 -
 电刑湿冷 共回答了11个问题
电刑湿冷 共回答了11个问题 |采纳率90.9%元素周期表中过渡元素包括10列,即副族(7列)和第VII族(3列),全是金属元素,单质具有良好的导电性导热性延展性等.1年前查看全部
大家在问
- 1一个正方体的高增加2厘米后,表面积增加了48平方厘米,原来正方体的表面积是多少平方厘米?
- 2下列氧化还原反应中,氧化剂与还原剂的质量比为2:1的是
- 3如图是量筒的测量情形,图中弹簧测力计的示数为______N.
- 4妈妈带着孩子在公园.孩子摔倒了喊着:“妈妈,抱!”妈妈却说“孩子,你一定能自己站起来!”我是反方
- 5化学 燃烧热以知CH4(g) +2O2(g)=CO2(g)+2H2O(l) ΔH=-Q1 KJ/mol H2(g)+1/
- 6人间四月芳菲尽 山寺桃花始盛开.长恨春归无觅处 不知转入此中来中尽的意思
- 7人们在那里能做运动用英语怎么说
- 8联词成句1、用下列词语中的二个写一段赞美老师的话,要求运用排比的修辞手法惬意 宽恕 馈赠 格尽职守 中流砥柱 (格不是这
- 9parent ______ (go) to Beijing last week.They ________(not co
- 10We ask that you do(click for more)...含义
- 11高中化学有关烷烃所有化学方程式.
- 12设3阶矩阵A的行列式定于2,求|-5A|
- 13七分之五除以a=七分之五x()
- 14翻译为英语:运动会已经持续了一个小时二十五分钟.
- 15提出科学原子论的科学家是?